n
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM SAÚDE COLETIVA
ANGÉLICA OLIVEIRA DE ASSIS
AVALIAÇÃO CLÍNICA DA RESPOSTA DO TRATAMENTO
PERIODONTAL NÃO-CIRÚRGICO (
Full mouthdesinfection) DE
PACIENTES DIABÉTICOS E NÃO DIABÉTICOS
ANGÉLICA OLIVEIRA DE ASSIS
AVALIAÇÃO CLÍNICA DA RESPOSTA DO TRATAMENTO
PERIODONTAL NÃO-CIRÚRGICO (
Full mouthScalling and Root Planing) DE
PACIENTES DIABÉTICOS E NÃO DIABÉTICOS
Dissertação apresentada ao programa de Pós-graduação em Saúde Coletiva, da área Odontologia da Faculdade de Odontologia UFRN, como requisito parcial para obtenção do título de mestre.
Orientador: Prof. Dr. Bruno César de Vasconcelos Gurgel
ANGÉLICA OLIVEIRA DE ASSIS
AVALIAÇÃO CLÍNICA DA RESPOSTA DO TRATAMENTO
PERIODONTAL NÃO-CIRÚRGICO (
Full mouthScalling and Root Planing) DE
PACIENTES DIABÉTICOS E NÃO DIABÉTICOS
Dissertação apresentada ao programa de Pós-graduação em Saúde Coletiva, da Faculdade de Odontologia UFRN, como requisito parcial para obtenção do título de mestre.
Aprovada em:____/____/_______
_________________________________________________________________ Prof. Dr. Renato de Vasconcelos Alves
Faculdade de Odontologia de Pernambuco – UPE (1º examinador)
_________________________________________________________________ Prof. Dra. Delane Maria Rêgo
Universidade Federal do Rio Grande do Norte (2º Examinadora)
_________________________________________________________________ Prof. Dr. Bruno César de Vasconcelos Gurgel
AGRADECIMENTOS
A Deus, pelo dom da vida, por me iluminar e me guiar em todos os momentos;
Aos meus pais, minha base, exemplo de vida e de luta, amor incondicional, confiança e estímulo, minha eterna gratidão;
A minha irmã Lívia, pelo apoio, carinho e força;
Ao meu orientador Bruno César de Vasconcelos Gurgel, cuja sabedoria me
proporcionou grande aprendizado, muito obrigada por despertar em mim a ânsia do saber e por me instruir a ter disciplina;
Aos pós-doutores Eduardo e Janaina, que foram anjos que surgiram na minha vida, obrigada pela paciência, apoio e por instigar ainda mais o encanto pela pesquisa científica;
As minhas amigas que também estão seguindo ou seguiram o mesmo percuso, o
mestrado, Sheyla, Isabelle, Karyna, Ivana e Poliana por vivenciarmos a mesma etapa da vida e por compartilharmos as angústias, os medos e os momentos de alegrias;
A minha amiga de infância Cassandra pelo carinho e amizade;
A good cell, Camila, Isabelle, Carol, Erico, Ivana, Palmira, Larissa, amigos dentistas pelo apoio;
As funcionárias do Departamento de Odontologia da UFRN, em especial a Andréia, Érica, Angela e Clécia que sempre ajudavam;
A minha família agradeço a compreensão pela ausência em alguns momentos; A médica Lidiane por apoiar a pesquisa encaminhando os pacientes diabéticos do Centro Clínico da Ribeira;
Aos professores do Programa de Pós Graduação em Saúde Coletiva pelo aprendizado; Ao coordenador da pós-graduação, Kênio Costa de Lima, por sempre nos ajudar desde da estatística a abertura de portas para realização da pesquisa;
RESUMO
Tem sido demonstrado que o diabetes influencia no desenvolvimento e progressão da doença periodontal. Acredita-se ainda que há uma relação bi-direcional entre o Diabetes Mellito e a Doença Periodontal. Por isso, o tratamento periodontal pode responder de forma diferente em pacientes com e sem o quadro de diabetes. O objetivo desse estudo foi avaliar clinicamente o efeito da terapia periodontal não cirúrgica em pacientes com periodontite e diabetes mellito (grupo teste) e sem o quadro de diabetes (grupo controle). Para isso, realizou-se o tratamento periodontal não-cirúrgico FMSRP (Full mouth desinfection) e verificou-se os parâmetros
clínicos periodontais (profundidade de sondagem, nível clínico de inserção, mobilidade, índice gengival e índice de placa) no início do estudo e após 3 meses. Na análise estatística, o paciente foi considerado como unidade de análise (p<0,05). Para as variáveis categóricas
utilizou-se o teste de Fisher. Nas comparações inter-grupo, foi utilizado o Mann-Whitney Test e para comparações intra-grupo (baseline e três meses), utilizou-se o Teste de Wilcoxon.
Participaram 26 pacientes no grupo controle e 14 no grupo teste. O índice de placa era 71,20% no início do estudo para o grupo teste e passou para 47,12% no fim; já no controle, os valores eram um pouco menores (48,52% passando para 37,50%). E o índice gengival no grupo teste no baseline era 42,67% diminuindo para 26,81% e no grupo controle diminuiu de
41,36% para 30,62%. A profundidade de sondagem foi no grupo teste 2,71mm passando para 2,40mm; já no controle, os valores foram de 2,84mm diminuindo para 2,55mm. O grupo controle ganhou 0,34 mm de inserção e o grupo teste perdeu 0,44mm de inserção. A recessão gengival aumentou 0,33mm no grupo teste e 0,04mm no grupo controle após os 3 meses. Houve diferença significativa inter-grupo para o índice de placa e gengival no baseline,
ABSTRACT
LISTA DE ILUSTRAÇÕES
Gráfico 1 - Porcentagem de sítios com profundidade de sondagem até 3 mm, maior que três e menor que 6 e maior que 6 mm.* Diferença significativa do mediana das porcentagens no baseline em relação aos
3 meses (P<0,05, Wilcoxon teste)... 38
Quadro 1 - Descrição dos estudos com objetivo de verificar o efeito da terapia periodontal relatadas na literatura científica... 23
Figura 1 - Desenho da coleta de dados... 33
Figura 2 - Visão frontal da arcada antes do tratamento... 33
Figura 3 - Visão lateral da arcada antes do tratamento... 33
Figura 4 - Visão frontal da arcada após o uso do ultrassom... 34
Figura 5 - Visão lateral da arcada após o uso do ultrassom... 34
Figura 6 - Visão frontal da arcada 15 dias após o FMSRP... 34
LISTA DE TABELA
Tabela 1 - Descrição das variáveis dependentes associadas à condição
periodontal... 30 Tabela 2 - Lista das variáveis independentes gerais que foram observadas... 31 Tabela 3 - Classificação de obesidade segundo o Índice de massa corpórea... 32 Tabela 4 - Descrição das variáveis independentes associadas à dieta e medicamento 32 Tabela 5 - Descrição das variáveis dependentes associadas ao exame sanguíneo... 33 Tabela 6 - Índice de placa e Índice Gengival (%) (mediana/p25 e p75) no baseline e
após 3 meses do FMSRP, nos pacientes diabéticos e não diabéticos... 37 Tabela 7 - Parâmetros clínicos periodontais (mm) (mediana/p25 e p75) no baseline e
após 3 meses do FMSRP, nos pacientes diabéticos e não diabéticos... 37 Tabela 8 - Porcentagem de sítios com mobilidade grau 0, grau 1, grau 2 e grau 3
(%) (mediana/p25 e p75) no baseline e após 3 meses do FMSRP, nos
LISTA DE ABREVIATURAS E SIGLAS
TNF- : Fator de Necrose Tumoral . IL-1ß: Interleucina 1ß.
HbA1c: Hemoglobina glicada ou glicolisada. AGES: Produtos finais da glicolisação enzimática.
RAGE: Receptor dos produtos finais da glicolisação enzimática. MMP´S: Metaloproteínases da matriz.
IL-6: Interleucina 6.
G-CSF: Fator estimulador de colônias de granulócitos. FMSRP: Full mouth scaling and root planing.
PS: Profundidade de sondagem.
PMSRP: Partial mouth scaling and root planing. HUOL: Hospital Onofre Lopes.
PIC: Perda de inserção clínica. IMC: Índice de massa corpórea. OMS: Organização Mundial de Saúde. IP: Índice de placa.
IG: Índice gengival.
SUMÁRIO
1 INTRODUÇÃO... 12
2 REVISTA DE LITERATURA... 14
2.1 DOENÇA PERIODONTAL... 14
2.2 DIABETES MELLITO... 15
2.3 DOENÇA PERIODONTAL E DIABETES MELLITO... 18
2.4 TRATAMENTO DA DOENÇA PERIODONTAL EM PACIENTE COM DIABETES MELLITO E SEM DIABETES MELLITO... 20
3 OBJETIVOS... 27
3.1 OBJETIVO GERAL... 27
3.2 OBJETIVOS ESPECÍFICOS... 27
4 METODOLOGIA... 28
4.1 CARACTERIZAÇÃO DO ESTUDO... 28
4.2 CONSIDERAÇÕES ÉTICAS... 28
4.3 UNIVERSO E AMOSTRA... 28
4.4 COLETA DE DADOS... 30
4.4.1 Exame clínico... 30
4.4.2 Calibração da Examinadora... 31
4.4.3 Ficha de registro de dieta, medicamento e determinação do IMC... 32
4.5 CRONOGRAMA DE COLETA DE DADOS... 33
4.6 CASO CLÍNICO DA PESQUISA... 34
4.7 ANÁLISE ESTATÍSTICA... 34
5 RESULTADOS... 36
5.1 CARACTERIZAÇÃO GERAL DA AMOSTRA... 36
5.2 PARÂMETROS CLÍNICOS... 36
6 DISCUSSÃO... 40
7 CONCLUSÃO... 45
REFERÊNCIAS... 46
1 INTRODUÇÃO
A periodontite é uma doença inflamatória associada a microrganismos anaeróbios que resulta de um desequilíbrio na interação entre a microbiota periodontal e a resposta imune do hospedeiro e provoca a destruição dos tecidos periodontais de suporte (EBERSOLE e CAPPELLI, 2000; PETERSEN e OGAWA, 2005). Muitos distúrbios sistêmicos foram implicados como fatores ou indicadores de risco para doença periodontal (TAYLOR, 2001; NUNN, 2003). Dentre esses, o Diabetes Mellito é uma doença complexa caracterizada por hiperglicemia, alterações metabólicas e vasculares (NISHIMURA et al., 1998) e que tem sido considerada um fator de risco para doença periodontal (PAPANOU, 1997). Por outro lado, autores têm sugerido que a periodontite também pode exacerbar essa doença sistêmica (KIRAN et al., 2005; MEALEY e OATES, 2006).
A doença periodontal leva a uma alteração endócrino-metabólica relacionada à dificuldade de controlar a glicemia, uma vez que a infecção gera uma resistência ou uma diminuição da função da insulina, devido à citocinas pró-inflamatórias, principalmente o TNF- (Fator de Necrose Tumoral ) e a IL-1ß (interleucina 1ß), causando um inadequado controle metabólico (RAYFELD et al., 1982; LANG, 1992; LING et al., 1994). Além disso, as bactérias gram-negativas presentes na periodontite também estão relacionadas a esse processo (TAYLOR, G. et al., 1996).
Independente da relação sistêmica entre as duas doenças, a doença periodontal deve ser tratada para restabelecer a saúde dos tecidos periodontais. O tratamento da doença periodontal inclui a abordagem preventiva por meio das instruções de higiene oral, remoção dos fatores retentivos e do biofilme dental por meio da raspagem e alisamento corono-radicular. Esse procedimento tem sido empregado há muito tempo como o padrão-ouro (MARTORELLI et al., 2004; LLAMBES et al., 2005).
periodontais em curto prazo (3 meses) (WESTFEH et al., 1996; WESTFELT et al., 1996; SANCHEZ et al., 2007; DA CRUZ et al., 2008; SANTOS et al., 2009).
O efeito do tratamento periodontal nos pacientes saudáveis e diabéticos ainda é alvo de intensa investigação. Somado a isso, não se sabe se os pacientes diabéticos tem maior recorrência da doença periodontal em um determinado período de tempo. Mesmo assim, estudos que avaliaram o prognóstico desse tratamento verificaram uma melhora nos parâmetros clínicos periodontais em ambos os grupos, mas sem diferenças entre eles tanto em estudos com acompanhamento de até seis meses como naqueles com duração de cinco anos (WESTFEH et al., 1996; ALMEIDA et al.; SANCHEZ et al., 2007; DA CRUZ et al., 2008).
2 REVISTA DE LITERATURA
2.1 DOENÇA PERIODONTAL
As doenças periodontais incluem a gengivite e periodontite, são consideradas doenças inflamatórias de origem infecciosa que afetam os tecidos de sustentação e proteção dos dentes, tendo o biofilme como o fator etiológico primário da doença periodontal. Essa enfermidade pode levar a perda do periodonto de maneira irreversível e, em estágios mais avançados, levar a perda do elemento dentário (SOCRANSKY e HAFFAJEE, 1992). Esse dano aos tecidos bucais tem repercussão negativa na qualidade de vida do paciente, uma vez que pode alterar a mastigação, a deglutição, a fala, a estética do sorriso e a autoestima (ARAUJO e SUKEKAVA, 2007).
Alguns estudos que avaliam a gengivite através da presença de sangramento à sondagem ao redor dos dentes verificaram que a prevalência é extremamente alta (CUNHA e CHAMBRONE, 1998; KATO SEGUNDO et al., 2004). Uma avaliação epidemiológica que contou com 811 adolescentes, sendo 320 de nível socioeconômico médio a alto e 491 eram de baixa condição socioeconômica, verificou que 98% dos adolescentes de 7 a 14 anos, com padrão econômico elevado apresentavam sangramento gengival e 100% do grupo de condição sócio-ecônimica inferior também apresentavam (CUNHA e CHAMBRONE, 1998). Mais recentemente, o Sb Brasil 2010 verificou que 11,7% da população de 12 anos apresentava apenas sangramento gengival, sem a presença de cálculo ou de bolsas periodontais (SBBRASIL, 2012).
Nas doenças periodontais, gengivite e periodontite, há uma alteração da microbiota em relação aos microorganismos presentes no indivíduo saudável. Havendo uma colonização mais gram-negativa, com bastonetes, móveis e anaeróbios (RITZ, 1967; SOCRANSKY et al., 1977; THEILADE e BUDTZ-JORGENSEN, 1988). O Aggregatibacter actinomycetemcomitans, Tannerella forsythia e Porphyromonas gingivalis são consideradas
os principais periodontopatógenos; além desses, também estão relacionados à destruição periodontal a Prevotella intermedia, Campylobacter rectus, Pepto-streptococcus micros, Fusobacterium nucleatum, Eubacterium nodatum, Streptococcus intermedius (SLOTS e
RAMS, 1991; SOCRANSKY e HAFFAJEE, 1992; WOLFF et al., 1994).
uma bacteremia devido a grande superfície epitelial ulcerada das bolsas periodontais (EBERSOLE e CAPPELLI, 2000).
Para a periodontite, os estudos utilizam como método de avaliação a profundidade de sondagem e/ou nível clínico de inserção ao redor dos dentes. Susin et al. (2004) realizaram um estudo epidemiológico na população metropolitana de Porto Alegre, Rio Grande do Sul. Este trabalho envolveu 11 áreas geográficas que incluía indivíduos com variável faixa de condição socioeconômica. A amostra foi de 853 indivíduos dentados, com idade entre 30 e 103 anos e observaram que 50% dos indivíduos apresentaram ≥ 30% dos dentes com perda de inserção ≥ 5mm. Em 65% da população analisada havia profundidade de bolsa ≥ 5mm e 25% a profundidade era ≥ 7mm (SUSIN et al., 2004). Já no SbBrasil 2010 que avaliou a presença de bolsas periodontais através do CPI (Índice Periodontal Comunitário), proposto pela OMS e complementado pelo exame da Perda de Inserção Periodontal (PIP) na população adulta e idosa. O CPI verifica a ocorrência de sangramento, cálculo e presença de bolsa periodontal (rasa e profunda) tendo como referência o exame por sextante (grupos de 6 dentes entre os 32 da arcada dentária). Foi observado que no grupo de 19 a 15 anos havia 9% dos adolescentes apresentando bolsas rasas e 0,7%, bolsas profundas; no grupo de 35 a 44 anos 19,4% tinham bolsas periodontais, sendo 15,2% rasas e 4,2%, profundas e o de 65 a 74 anos tinha 21,7% com bolsas, sendo 16,7% rasas (SBBRASIL, 2012).
Embora o desenvolvimento e progressão da doença periodontal dependam do hospedeiro para acontecer, nem todos os pacientes apresentam susceptibilidade semelhante para desenvolver a periodontite (SOCRANSKY et al., 1998). Fatores locais e sistêmicos estão implicados na modulação da resposta do hospedeiro (PAGE, 1998). Dos fatores sistêmicos, acredita-se que o paciente diabético tem duas vezes mais complicações periodontais que o paciente saudável (TERVONEN e KNUUTTILA, 1986; TAYLOR, G. et al., 1996; SOSKOLNE e KLINGER, 2001).
2.2 DIABETES MELLITO
Estima-se que a prevalência dessa patologia deva alcançar 333 milhões de pessoas em 2025. Embora os países desenvolvidos apresentem uma maior prevalência da doença, a incidência tende a ser maior nos países em desenvolvimento, como consequência do envelhecimento da população somado a alterações nos padrões nutricionais (KING et al., 1998). A VIGITEL, que mede a prevalência de fatores de risco e de proteção para doenças não transmissíveis na população brasileira, monitorando através de ligações telefônicas a população acima de 18 anos residentes em domicílios com telefone fixo nas capitais brasileiras e no DF, verificou que 5,6% da população brasileira possui Diabetes (VIGITEL 2011).
Há dois tipos principais de diabetes mellito e vários tipos secundários de menor frequência. O diabetes melito tipo 1, insulino-dependente, é causado por uma destruição nas células auto-imune das células beta produtoras de insulina das ilhotas de Langerhans no pâncreas, resultando numa deficiência de insulina. O tipo 2, não insulino-dependente, é causado por uma resistência periférica à ação da insulina, secreção prejudicada de insulina e produção aumentada de glicose no fígado. Além desses, há o diabetes gestacional e outros tipos secundários associados a doenças que envolvem o pâncreas (MEALEY, 2006).
O efeito em longo prazo da ausência de um controle metabólico de pacientes com diabetes mellito são alterações patológicas como mudanças microvasculares e neurológicas, comprometimento da síntese do colágeno e diminuição da função de leucócitos polimorfonucleares (PMN) (OLIVER e TERVONEN, 1994; YALDA et al., 1994). Esses comprometimentos levam a doenças microvasculares (retinopatia, nefropatia, neuropatia), doenças macrovasculares (cardiovascular), susceptibilidade a infecções e má cicatrização das feridas, além de poliúria, polidpsia, polifagia e perda de peso (ASSOCIATION, 2006). Já os sinais e sintomas da doença periodontal são reconhecidos como a sexta complicação da diabetes (LOE, 1993).
A função das células imunes, incluindo neutrófilos e macrófagos estão alteradas no paciente diabético. A quimiotaxia, a aderência e a fagocitose estão com a função prejudicada, dessa forma, inibindo o potencial de resposta do hospedeiro frente a agressões bacterianas levando a aumento significativo na destruição periodontal. Baseado nisso que os indivíduos podem exibir uma resposta inflamatória exagerada, um processo de cicatrização deficiente e uma diminuição da resistência. Tudo isso explica o aumento da severidade da doença periodontal e da destruição tecidual (LALLA E et al., 2000; GROSSI, 2001; LALLA E et al., 2001; MEALEY, 2006).
Uma ferramenta de avaliação do controle glicêmico que se deve lançar mão é o teste da hemoglobina glicada ou glicolisada (HbA1c). O mesmo não é utilizado como único critério para diagnóstico. O diagnóstico do diabetes é feito de acordo com quatro critérios e a positividade de qualquer um dos parâmetros confirma o diagnóstico de diabetes: Níveis de HbA1c ≥ 6,5%; Glicemia de jejum ≥ 126mg/dL; glicemia duas horas após sobrecarga com 75g de glicose ≥ 200mg/dL ou glicemia ao acaso ≥ 200 mg/dL (ADM AMERICAN DIABETES ASSOCIATION, 2011). A glicohemoglobina é formada continuamente em eritrócitos como um produto da reação não enzimática entre a glicose e a proteína hemoglobina que transporta oxigênio. A ligação da glicose à proteína é altamente estável, por isso, permanece durante a vida do eritrócito, aproximadamente 120 dias. O teste da HbA1c é usado para medir os níveis da glicohemoglobina e fornece uma estimativa média da glicose dos últimos 30 a 90 dias anterior ao teste (ROHLFING et al., 2002; VIRTUE et al., 2004).
A manutenção do nível de HBA1c abaixo de 7% é considerada como uma das principais metas no controle do diabetes. As complicações crônicas começam a se desenvolver quando os níveis estão situados permanentemente acima de 7% (UK, 1998). A Sociedade Brasileira de Diabetes adota, inclusive, metas terapêuticas mais rígidas de 6,5% para os valores de hemoglobina glicada (DCCT RESEARCH GROUP, 1993; UK PROSPECTIVE DIABETES STUDY GROUP, 1998).
Outro fator que deve ser observado no paciente diabético é a obesidade. O tecido adiposo pode representar um reservatório de mediadores inflamatórios aumentando a resposta inflamatória tanto na doença periodontal como no diabetes mellito (GREENBURG e OBIN, 2006; RITCHIE, 2007). Por isso, estudos que se proponham a avaliar a doença periodontal e a diabetes tem que minimizar a interferência dessa condição.
O diabetes mellito é um agravo de grande importância em relação a sua influência na aceleração ou no aumento da progressão da doença periodontal. O interesse no estudo da associação dessa doença oral com doenças sistêmicas tem crescido nos últimos anos (BECK et al., 1996; OFFENBACHER et al., 1996; GROSSI e GENCO, 1998; SCANNAPIECO e GENCO, 1999; KOROMANTZOS et al., 2011; KOROMANTZOS et al., 2012). Vários estudos tem demonstrado que o Diabetes Mellito é um fator de risco para o desenvolvimento da doença periodontal (CIANCIOLA et al., 1982; RYLANDER et al., 1986; HUGOSON et al., 1989; EMRICH et al., 1991; YALDA et al., 1994).
Além disso, quando se divide o grupo de pacientes diabéticos em bem controlados, moderadamente controlados e pobremente controlados verifica-se diferenças na melhora do nível clínico de inserção entre o mal controlado e o bem controlado após o tratamento periodontal em pacientes com periodontite, sugerindo que o diabetes influencia na evolução da doença periodontal (NOVAES et al., 1991; NOVAES et al., 1997; SANTOS et al., 2009). Resultados de estudos clínicos e epidemiológicos indicam que adultos diabéticos insulino-dependentes apresentam pior condição dos tecidos periodontais que não diabéticos ou bem controlados na mesma faixa etária (BELTING et al., 1964; GLAVIND et al., 1968; COHEN et al., 1970; TERVONEN e KNUUTTILA, 1986; SEPPALA e AINAMO, 1994; TSAI et al., 2002; LIM et al., 2007).
A relação entre o diabetes mellito e a doença periodontal é um exemplo de uma doença sistêmica predispondo uma infecção oral; por outro lado, uma vez a periodontite estabelecida, ela pode exacerbar esta doença sistêmica (KIRAN et al., 2005). Tem sido discutido que a presença da doença periodontal em pacientes diabéticos pode influenciar no controle da sua glicemia (TAYLOR, G. W. et al., 1996). Há evidências que sugerem que a resolução da inflamação periodontal pode melhorar o controle glicêmico, reduzindo os índices glicêmicos, estabelecendo assim, uma via de mão dupla entre a doença periodontal e o diabetes mellito (GROSSI e GENCO, 1998; KIRAN et al., 2005; LIM et al., 2007; KOROMANTZOS et al., 2011). Um estudo que realizou uma análise de risco multivariada verificou que a diabetes é um fator de risco para a doença periodontal e indivíduos diabéticos têm de 2,8 a 3,4 mais chances de ter doença periodontal, após o ajuste das variáveis de confusão como idade, gênero e medidas de higiene oral (NELSON et al., 1990).
formam através da glicosilação e oxidação de proteínas e lipídeos e tem a capacidade de se ligar aos receptores da membrana (RAGE- receptor de produtos finais glicosilados) de células endoteliais, monócitos ou macrófagos, células do sistema nervoso e musculares. A interação AGE-RAGE em células endoteliais leva a um aumento da permeabilidade vascular e tem um efeito positivo na formação de trombos. Já nos monócitos ou macrófagos, esta interação aumenta o estresse oxidativo celular, o que resulta em maior produção do fator de necrose tumoral (TNF-) e da interleucina 1ß (IL-1ß), associadas à diferenciação e atividade de osteoclastos, responsáveis pela destruição óssea, e também à produção de metaloproteinases da matriz (MMPs), cuja função primordial é a destruição do colágeno, atuando, dessa forma, na patogênese da doença periodontal (GARLET et al., 2006; MEALEY, 2006).
Por outro lado, a presença da doença periodontal pode resultar no aumento sistêmico dos níveis de citocinas inflamatórias (TNF- e TNF- ß), interleucina 6 (IL-6), proteína C reativa e fibrinogênio. Pacientes diabéticos apresentam altos níveis dessas substâncias no sangue, que estão relacionadas à resistência a insulina (PAGE, 1998; MEALEY, 2006).
Existe a possibilidade de que o TNF- (Fator de Necrose Tumoral ) circulante, um mediador inflamatório bastante presente na doença periodontal, proveniente do processo inflamatório exacerbado, possa estar relacionado ao mecanismo de resistência à insulina, bloqueando seu receptor e influenciando órgãos como fígado, músculos, tecido adiposo e, indiretamente, favorecendo a liberação de moléculas, como ácido graxo, que também resultam em resistência a insulina (NISHIMURA et al., 2003). Há estudos que indicam que bactérias patogênicas e ou seus produtos podem estimular células, tais como, fibroblastos, ceratinócitos e macrófagos que estão presentes no tecido periodontal a liberar uma grande quantidade de citocinas inflamatórias como o fator de necrose tumoral (TNF-), prostaglandinas E2, interleucinas (IL1ß, 6 e 12), fator estimulador de colônias de granulócitos (G-CSF) e quimiocinas que são relevantes nos processos inflamatórios da doença periodontal (KABASHIMA et al., 2002; FOKKEMA et al., 2003; GARLET et al., 2005). A elevação da expressão de citocinas e quimiocinas por células do tecido conjuntivo na doença periodontal crônica pode resultar no aumento do nível dos mediadores na circulação sanguínea que pode induzir ou perpetuar um efeito sistêmico (GRAVES et al., 2006).
desenvolvimento das doenças decorrentes da obesidade, como diabetes tipo II. Além disso, a interleucina IL2 e IL6 também foram indicadas como antagonistas à ação da insulina (TAYLOR, G. W. et al., 1996; ABBATECOLA et al., 2004; D'AIUTO et al., 2005). Foi mostrado que o diabetes regula a produção de citocinas pró-inflamatórias e quimiocinas levando a um aumento da inflamação, destruição dos tecidos e apoptose em pacientes que tenham periodontite (GAMONAL et al., 2001; GRAVES et al., 2006; MEALEY, 2006).
O diabetes prejudica a síntese de colágeno e glicosaminoglicanos, aumenta o fluido crevicular, podendo levar a perda do ligamento periodontal, progredindo com a reabsorção do osso alveolar, mobilidade e finalmente a esfoliação do dente, quando na presença do biofime bacteriano e da doença periodontal (IACONO et al., 1985; COLLIN et al., 1998).
Os pacientes diabéticos normalmente realizam o controle do seu estado glicêmico através da dieta, hipoglicêmicos orais e, em alguns casos, administrando doses de insulina. Tendo em vista isto, esses fatores também devem ser levados em consideração nos estudos que relacionam esse agravo à doença periodontal (JUNIOR et al., 2007; O'CONNELL et al., 2008). Somado a isso a mudança no estilo de vida tem se mostrado eficaz como prevenção para o desenvolvimento do Diabetes Mellito tipo II (LYRA et al., 2006). O relatório da Organização Mundial da Saúde (OMS, 2003) sobre dieta, nutrição e prevenção de doenças crônicas não transmissíveis, o consumo alimentar habitual constitui um dos principais fatores determinantes passíveis de modificação para doenças crônicas não transmissíveis.
2.4 TRATAMENTO PERIODONTAL DE INDIVÍDUOS DIABÉTICOS E NÃO-DIABÉTICOS
sondagem maior que 4 inicialmente no grupo de pacientes diabéticos passaram para 11,1% após cinco anos; já no grupo controle os valores iniciais foram de 23,4% passando para 13,5% com diferença significativa (p< 0,001) (WESTFELT et al., 1996).
O estudo de Christgau et al. (1998) teve como objetivo avaliar clinica, microbiologicamente e imunologicamente o efeito da terapia não cirúrgica em pacientes diabéticos e saudáveis sistemicamente. Houve a participação de 20 indivíduos por grupo e eles eram submetidos a duas fases de tratamento que consistiam: na adequação bucal e na raspagem e alisamento corono-radicular, sendo realizada uma sessão por quadrante. Não foi encontrada diferença significativa em nenhuma das variáveis clínicas avaliadas (índice gengival, índice de placa, sangramento a sondagem, profundidade de sondagem e perda do nível clínico de inserção) entre os grupos. Entretanto quando se categorizou os sítios com relação à profundidade de sondagem, verificou-se no grupo controle um aumento significativo (p≤ 0,05) nos sítios com profundidade até 3mm ( 54,2% para 67,9%) após 4 meses e uma redução significativa (p≤ 0,05) das bolsas com profundidade maior que 6 mm (14,0% para 4,3%) (CHRISTGAU et al., 1998).
Resultados semelhantes foram relatados no estudo de Navarro-Sanches, Faria-Almeida e Bascones-Martinez (2007) que comparou a eficácia da terapia periodontal não-cirúrgica em diabéticos e saudáveis sistemicamente, tendo uma amostra mais reduzida que o estudo anterior, que foi de 10 pacientes por grupo. Realizaram instrução de higiene oral e a raspagem e alisamento em até 4 sessões, com um acompanhamento de três e seis meses. Encontraram diferença significativa (p≤ 0,016) entre todas as variáveis clínicas (índice de placa, sangramento á sondagem, profundidade de sondagem, recessão e nível clínico de inserção) no mesmo grupo em relação ao tempo de acompanhamento final e o baseline. Todavia, não
houve diferença significativa dessas variáveis entre os grupos (SANCHEZ et al., 2007). Faria-Almeida, Navarro e Bascones (2006) buscaram comparar a resposta clínica e microbiológica da terapia não cirúrgica em pacientes diabéticos e saudáveis sistemicamente. Participaram 10 pacientes no grupo teste e a mesma quantidade no grupo controle, tendo um acompanhamento de 3 e 6 meses. Encontrou-se diferença significativa entre os grupos com relação à profundidade de sondagem no baseline e 3 meses (P<0.0001), entre 3 e 6 meses
(P<0.004) e entre baseline e 6 meses (P<0.0001) (ALMEIDA et al., 2006).
O tratamento da doença periodontal é realizado através da eliminação dos fatores etiológicos e contribuintes, ou seja, remoção do cálculo dental, correção de restaurações mal adaptadas, restauração de lesões cariosas (CATON et al., 2001) associado a um efetivo
é a única forma de evitar a formação do biofilme e impedir a reinfecção dos sítios. Inicialmente, realiza-se a raspagem e alisamento corono-radicular nas bolsas periodontais rasas e profundas com curetas e instrumentos ultrassônicos, que geralmente é dividida em sessões de tratamento, depois é realizado a reavaliação e verifica-se a necessidade de um procedimento cirúrgico (MARTORELLI et al., 2004; LLAMBES et al., 2005; DARRE et al., 2008).
Uma estratégia viável no tratamento periodontal não cirúrgico é o Full mouth Desinfection (FMSRP), que está baseada na metodologia descrita por Quiryen e
colaboradores (QUIRYNEN et al., 1995). Essa abordagem é realizada em até 24 horas, realizando a raspagem ultrassônica com pontas ultrassônicas associadas à raspagem e alisamento com instrumentos manuais, com o tempo aproximado de 1 hora por quadrante. Imediatamente após a instrumentação, a desinfecção é realizada seguindo a ordem: escovação da língua por 1 minuto com gel de clorexidina a 1%; irrigação subgengival dos sítios periodontalmente comprometidos com profundidade de sondagem maior que 3 mm (PS>3mm) com gel de clorexidina a 1%; bochecho com solução de clorexidina a 0,12% por 1 minuto (sendo 10 segundos de gargarejo, numa tentativa de alcançar as tonsilas) e, adicionalmente, os pacientes são instruídos a fazer dois bochechos ao dia com solução de clorexidina a 0,12% por 1 minuto (sendo também 10 segundos de gargarejo), durante 14 dias.
Esse protocolo tem mostrado reduzir a infecção periodontal em curto prazo e melhorar os parâmetros clínicos periodontais (RODRIGUES et al., 2003; SANTOS et al., 2009). Além disso, a utilização do FMSRP em pacientes diabéticos com alto risco de infecção, alterações vasculares e resposta inflamatória deficiente é benéfica porque ajuda a minimizar o risco de reinfecção dos sítios tratados (RODRIGUES et al., 2003). O estudo de Rodrigues et al. (2003) comparou o uso da amoxicilina com ácido clavulânico (850mg) somado ao Full mouth Scalling and Root Planing (FMSRP) ou apenas a raspagem e alisamento radicular em
indivíduos com diabetes tipo II e concluíram que a utilização do antibiótico não revelou uma melhora do controle glicêmico. Os autores encontraram uma redução estatisticamente significativa para o grupo que não recebeu o antibiótico (RODRIGUES et al., 2003).
nível clínico de inserção). Mas houve redução na profundidade de sondagem, aumento da recessão gengival e o redução do nível clínico de inserção tiveram alterações significativas (p=0.0706; ANOVA) (CRUZ et al., 2008).
Mais recentemente, Cirano et al. (2012) realizaram um estudo a fim de avaliar o potencial do FMUD, um estágio de boca completa com uso do ultrasson, para pacientes diabéticos descompensados e com periodontite severa e generalizada. O grupo diabético teve 16 participantes e no grupo não-diabético houve 15 pacientes. Não foi encontrada diferença significativa em nenhum dos parâmetros clínicos analisados (índice de placa, sangramento a sondagem, profundidade de sondagem, recessão e nível clínico de inserção) nos períodos de
baseline, três e seis meses (ANOVA e Tukey teste, p>0,05).
O quadro 01 mostra a síntese dos estudos que tem como objetivo verificar o efeito do tratamento periodontal nos pacientes diabéticos:
Quadro 1 - Descrição dos estudos com objetivo de verificar o efeito da terapia periodontal relatas na literatura científica.
Autor Objetivo Amostra Métodos Resultados (Profundidade de
sondagem_ PS e Nível clínico de Inserção_ NCI)
Tervonen et al. (1991)
A resposta em curto prazo (3 a 4 meses) do tratamento periodontal não cirúrgico em
pacientes diabéticos e não diabéticos
34
diabéticos e 45 não diabéticos
Instrução de higiene oral (IHO) e
Raspagem e
Alisamento Corono-Radicular (RACR)
Houve melhora da profundidade de sondagem
Sem diferença estatística significativa entre os grupos
Welstfelt et al. (1996) Avaliar a recorrência da periodontite (5 anos) 20 diabéticos (tipo 1 e 2) 20 sem diabetes
Instrução de Higiene Oral e Raspagem e Alisamento Corono-Radicular em 4
sessões (T0, 6m, 12m, 24m e 60m)
Houve redução da profundidade de sondagem em ambos os grupos (p<0,001).
Sem diferença estatística significativa entre os grupos.
Christgau et al. (1998) Avaliar clinica, microbiologicamen te e imunologicamente o efeito da terapia não cirurgica em pacientes diabéticos e saudáveis 20 diabéticos 20 sem diabetes 2 fases:
1) Adequação bucal
2) RACR (uma sessão por quadrante)
Houve melhora da P. S. (p<0,005) e no NCI.
Não Houve diferença entre os grupos.
Faria-Almeida,
Comparar a resposta clinica e
10
diabéticos
IHO e RACR em 4 sessões (1h cada) em
Fonte: Dados da Pesquisa. Natal/RN, 2012
Há pouca evidência cientifica disponível para avaliar a resposta à terapia periodontal em pacientes diabéticos e não diabéticos com periodontite. Em diabéticos bem controlados, a resposta clínica e microbiológica ao tratamento periodontal parece ser semelhante à de indivíduos saudáveis (TERVONEN et al., 1991; CHRISTGAU et al., 1998). Embora muitos pacientes diabéticos demonstrem uma melhora imediatamente após a terapia, aqueles que têm pobre controle glicêmico podem ter uma recorrência mais rápida em bolsas periodontais mais profundas e uma resposta menos favorável em longo prazo (TERVONEN e KARJALAINEN, 1997).
Além de buscar informações sobre a resposta dos pacientes diabéticos, alguns estudos procuraram avaliar também os níveis glicêmicos, por meio do acompanhamento da Navarro e
Bascones (2006)
microbiologicamen te da terapia não cirurgica em
pacientes diabéticos e saudáveis
10 sem
diabetes 4 semanas; Avaliação: 3 e 6 meses
Houve diferença entre os grupos com relação a P. S. em todos os períodos analisados. Navarro-Sanches, Faria-Almeida e Bascones-Martinez (2007) Comparar a eficácia da terapia periodontal não-cirurgica em diabéticos e saudáveis 10 diabéticos (tipo 1 e 2) 10 sem diabetes
IHO e RACR em 4 sessões (1h cada) em 4 semanas;
Avaliação: 3 e 6 meses
Houve diferença estatística significativa entre os grupos com relação à profundidade de sondagem (p=0,02), sendo melhor no grupo diabético. Houve melhora de todos os paramêtros clínicos com diferença estatística.
Cruz et al. (2008)
Avaliar as
mudanças clinica e laboratoriais após 3 meses de FMSRP em pacientes com e sem diabetes mellito. 10 diabéticos (tipo 2) 10 sem diabetes
IHO e FMSRP (Quirynen et al.)
Não houve diferença significativa entre os grupos em nenhum parâmetro periodontal analisado. Mas a
profundidade de sondagem, a recessão gengival e o nível clínico de inserção tiveram melhoras significativas (p=0.0706; ANOVA).
Cirano et al. (2012)
Avaliar o potencial do FMUD (One-stage, Full mouth, ultrassonic
debridement) como tratamento para pacientes com diabetes tipo II e periodontite crônica e severa 16 diabéticos 15 sem diabetes
FMUD ( One-stage, Full mouth,
ultrassonic debridement)
hemoglobina glicada, após o tratamento periodontal não cirúrgico e não verificaram melhora no controle glicêmico (JANKET et al., 2005; DARRE et al., 2008; TEEUW et al., 2010). O estudo de Santos et al. (2009), que avaliou o Full Mouth (FMSRP) comparado ao Partial Mouth (PMSRP), observou os parâmetros clínicos em pacientes com pobre controle glicêmico
e com melhor controle glicêmico. Os autores encontraram que as duas formas de tratamento tiveram resultados similares, sem melhoras significativas no controle glicêmico (HbA1c). Entretanto, o grupo com melhor controle glicêmico apresentou maior benefício em relação ao nível clínico de inserção após seis meses, apresentando uma redução no nível clínico de inserção de 3,5 ± 0,8 mm para 3,1±0,8 mm, com diferença estatisticamente significativa (p<0,05).
Outros estudos clínicos de intervenção que também avaliaram o efeito do tratamento periodontal na melhora do controle glicêmico de pacientes diabéticos geralmente demonstram um resultado positivo, verificado pela redução dos níveis de hemoglobina glicada, todavia, ainda não há um consenso (JANKET et al., 2005; DARRE et al., 2008; TEEUW et al., 2010). Portanto, não há uma evidência forte o suficiente para estabelecer o fato de que a terapia periodontal melhorar o controle glicêmico.
3 OBJETIVOS
3.1 OBJETIVO GERAL
O presente estudo objetiva avaliar clinicamente o efeito da terapia periodontal não cirúrgica, em pacientes portadores de periodontite e diabetes mellito e sem diabetes.
3.2 OBJETIVOS ESPECÍFICOS
- Comparar os parâmetros clínicos periodontais (Profundidade de Sondagem, Nível Clínico de Inserção, Sangramento à sondagem, Índice de Placa Visível e Mobilidade) antes e após o tratamento periodontal, Full mouth desinfection, (baseline e três meses) nos dois grupos;
4 METODOLOGIA
4.1 CARACTERIZAÇÃO DO ESTUDO
O presente projeto consiste em uma pesquisa de campo aplicada, sendo um estudo quantitativo e com objetivo descritivo (MEDRONHO, 2004).
Assim, a metodologia a ser adotada se caracteriza por uma abordagem indutiva, sendo um estudo aninhado de intervenção e de prognóstico prospectivo (MEDRONHO, 2004).
4.2 CONSIDERAÇÕES ÉTICAS
Os procedimentos para a realização desta pesquisa respeitaram as diretrizes e normas que regulamentam as pesquisas envolvendo seres humanos, aprovadas pela Resolução número 196, de 10 de outubro de 1996, do Conselho Nacional de Saúde. O mesmo foi submetido ao Comitê de Ética em Pesquisa de Seres Humanos da Universidade Federal do Rio Grande do Norte (CEP/UFRN) e aprovado com o protocolo 125/11. A inclusão dos pacientes no estudo somente ocorreu após assinatura de Termo de consentimento livre e esclarecido.
4.3 UNIVERSO E AMOSTRA
O universo do estudo foi composto por indivíduos com idade entre 18 anos e 65 anos, atendidos em centros de saúde como Hospital Universitário Onofre Lopes (HUOL), o Centro Clínico da Ribeira da cidade de Natal que já tinham diagnóstico médico de diabetes. Os pacientes foram selecionados de acordo com os critérios de inclusão e exclusão delimitados adiante.
O processo de amostragem foi não probabilístico utilizando uma amostra por conveniência e delimitada através dos critérios de inclusão e exclusão, definidos abaixo:
Critérios de Inclusão:
Possuir o diagnóstico clínico de periodontite crônica, segundo Lopéz, Smith e Gutierrez (2002);
Possuir pelo menos 8 dentes naturais.
O diagnóstico de periodontite foi determinado pelo critério de López, Smith e Gutierrez (2002), ou seja, presença de quatro ou mais dentes com no mínimo um sítio com profundidade de sondagem em dentes (PS) maior ou igual a 4mm e perda de inserção clínica (PIC) maior ou igual a 3 mm (LOPEZ et al., 2002).
Critérios de exclusão:
Apresentar maiores complicações sistêmicas, como doença cardiovascular, Alzeihmer, doenças pulmonares ou cerebrais e síndromes metabólicas.
Uso de antibiótico ou tratamento periodontal nos 6 meses anteriores a pesquisa;
Longo tempo de administração de antiflamatórios ou imunossupressores; Fumar durante os últimos 5 anos;
Está grávida ou amamentando; Presença de aparelho ortodôntico.
Estes critérios foram rigorosamente observados e os pacientes com doença periodontal foram selecionados e divididos em dois grupos: Pacientes não diabéticos (Grupo Controle) e Pacientes diabéticos (Grupo Teste). Inicialmente, o cálculo amostral foi realizado de acordo com o Diagrama para cálculo do tamanho de amostra em Ensaios Clínicos, reproduzido de Altman (1991), utilizando o nível de significância de 5% e um poder do teste de 0,8, o número de indivíduos seria de 30 por grupo, então, cada grupo foi composto por 30 participantes mais 20% (risco de perda amostral), correspondendo a 38 pacientes.
Todos os pacientes realizaram o exame de hemograma, hemoglobina glicada e glicemia em jejum para verificar a existência da diabetes. Pacientes diabéticos com valores de glicose em jejum acima de 250 mg/dL ou com hemoglobina glicada acima de 9% eram aconselhados a procurar um médico para restabelecer o controle glicêmico, sendo de alto risco para intervenções dentárias (TERRA et al., 2011).
O tratamento periodontal não cirúrgico utilizado foi o Full mouth Scalling and Root Planing (FMSRP) (QUIRYNEN et al., 1995). Essa abordagem é realizada em até 24 horas,
de alcançar as tonsilas) e, adicionalmente, os pacientes são instruídos a fazer dois bochechos ao dia com solução de clorexidina a 0,12% por 1 minuto (sendo também 10 segundos de gargarejo), durante 14 dias.
4.4 COLETA DE DADOS
Os instrumentos utilizados para coleta de dados foram o exame clínico periodontal, ficha de registro de dieta e medicamentos e o exame sanguíneo.
4.4.1 Exame Clínico
Os pacientes foram submetidos a um exame clínico periodontal e os dados foram anotados numa ficha clínica, com intuito de se determinar a condição inicial e no momento seguinte, e assim obter a dinâmica dos parâmetros clínicos de doença periodontal.
Esse exame foi realizado por um único operador, utilizando a sonda periodontal da Carolina do Norte (Hu-Friedy, Rio de Janeiro, Brasil) a fim de se obter as variáveis listadas na tabela 1 abaixo.
Tabela 1 - Descrição das variáveis dependentes associadas à condição periodontal
Variável Tipo Categoria Descrição
Índice de Sangramento a sondagem Qualitativa Nominal 0-Presença 1-Ausência
Sangramento após a sondagem até a base do sulco/bolsa periodontal será verificado com a utilização da sonda da Carolina do Norte.
(MUHLEMAN; SON, 1972 )
Índice de Placa Visível
Qualitativa Nominal
0-Presença 1-Ausência
Quantidade de biofilme na região adjacente ao tecido gengival ou da mucosa. (AINAMO
e BAY, 1975)
Mobilidade Qualitativa
Nominal Mutuamente
Exclusiva
0- Presença 1- Ausência
Avaliação da mobilidade dental
Profundidade de Sondagem
Quantitativa contínua
A ser categorizado posteriormente
Distância, em milímetros (mm), da margem da gengiva/mucosa ao fundo da bolsa ou
sulco periodontal. Nível Clínico de Inserção Relativo Quantitativa contínua
A ser categorizado posteriormente
Em milímetros (mm), será obtida pela distância da junção cemento-esmalte ao
Supuração a sondagem
Qualitativa Nominal Mutuamente
Exclusiva
0-Presença 1-Ausência
Presença ou ausência de supuração nas bolsas periodontais após a sondagem
Recessão Gengival
Quantitativa Contínua
A ser categorizado posteriomente
Distância, em milímetros (mm), da junção cemento-esmalte (JCE) ou da cervical do dente à margem da gengiva/mucosa. (COX;
ZARB, 1987) Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
Neste momento, também foram coletadas as informações das variáveis independentes listadas na tabela 02.
Tabela 2 - Lista das variáveis independentes gerais que foram observadas
Variável Tipo Categoria Descrição
Gênero Categórica nominal mutuamente
exclusiva
0-Masculino
1-Feminino
Gênero do paciente
Idade Quantitativa discreta A ser categorizado posteriormente
Idade em anos
Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
4.4.2 Ficha de registro da dieta, medicamento e determinação do IMC
Os pacientes receberam uma ficha, nos períodos do estudo, em que foi registrado se os pacientes diabéticos seguiram os hábitos alimentares indicados pelo médico e sobre o uso de medicamentos, caso não haja cumprimento da dieta houve uma análise diferenciada do sujeito da pesquisa.
O índice de massa corpórea (IMC) foi determinado através da divisão do valor do peso (em kg) pela estatura ao quadrado. O IMC é utilizado pela Organização Mundial de Saúde (OMS) para classificação do estado nutricional de adultos e idoso, considerando a tabela abaixo (WHO, 2011).
Os valores recomendados pela Organização Mundial da Saúde são:
Tabela 3 - Classificação de obesidade segundo o Índice de massa corpórea.
CLASSIFICAÇÃO IMC (Kg/M²)
BAIXO PESO < 18,5
LIMITE NORMAL 18,5 > 24,9
OBESIDADE Pré-obeso
Obesidade Classe I Obesidade Classe II Obesidade Classe III
≥ 25,5 25 - 29,9 30.0 – 34.9 35.0 – 39.9 ≥ 40.0
Fonte: Obesity - Preventing and managing the global epidemic, Report of a WHO Consultation on obesity – Geneva, 3-5 June 1997.
Tabela 4 - Descrição das variáveis independentes associadas à dieta e medicamento.
Variável Tipo Categoria Descrição
IMC Quantitativa Contínua A ser categorizado posteriormente
Mede a quantidade de massa corpórea do indivíduo.
Uso de Medicamento Qualitativa Nominal
Mutuamente Exclusiva
A ser categorizado posteriormente
Utilização de medicação hipoglicemiante.
Registro da dieta Qualitativa Nominal
Mutuamente Exclusiva
0-Não 1-Sim
Realização de registro se o paciente está realizando a mesma dieta do inicio da pesquisa. Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
4.4.3 Exame Sanguíneo
Tabela 5 - Descrição das variáveis dependentes associadas ao exame sanguíneo
Variável Tipo Categoria Descrição
Nível de HbA1c Qualitativa Nominal
Mutuamente Exclusiva
0- HbA1c> 7% 1- HbA1c≤7%
Nível de HbA1c no sangue. Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
4.5 CRONOGRAMA DE COLETA DE DADOS:
Figura 1 - Desenho da coleta de dados
2 semanas 3 meses
T0 T1 T2
T0: Solicitação do Exame sanguíneo.
T1: Exame Periodontal + Full mouthScalling and Root Planing (FMSRP).
4.6 CASO CLÍNICO DA PESQUISA:
Paciente saudável sistemicamente: Fonte: Banco de dados da pesquisa ANTES DO TRATAMENTO:
Figura 2: Visão frontal da arcada antes do tratamento.
Figura 3: Visão lateral da arcada antes do tratamento.
APÓS O USO DO ULTRASSOM:
Figura 4: Visão frontal da arcada após o uso do ultrassom.
Figura 5: Visão lateral da arcada após o uso do ultrassom.
15 DIAS APÓS O FMSRP:
Figura 6: Visão frontal da arcada 15 dias após o FMSRP.
4.7 ANÁLISE ESTATÍSTICA
Para análise dos dados, as informações foram coletadas e inseridas em uma planilha eletrônica como o Microsoft Excel, versão 2010, para formar um banco de dados que posteriormente foi transferido para um software estatístico, o SPSS, Statistical Package for Social Sciences, versão 17.0. Os dados, então, foram tratados e analisados por estatística descritiva e inferencial, não-paramétrica, dispondo os resultados obtidos na forma de gráficos e tabelas de frequências absoluta e percentual.
Na análise estatística, o paciente foi considerado como unidade de análise, o p<0,05
5 RESULTADOS
5.1 CARACTERIZAÇÃO GERAL DA AMOSTRA
Inicialmente havia 34 pacientes no grupo controle e 16 no grupo teste. Destes, 8 pacientes desistiram da pesquisa no grupo controle e 2 no grupo teste, totalizando 26 pacientes no grupo controle e 14 no teste. Apenas um paciente era fumante e 30% da amostra consumiam bebidas alcoólicas.
No grupo teste, a amostra teve a mesma quantidade de pessoas do sexo feminino e masculino. Já no grupo controle tinham 17 mulheres e nove homens. Não foi encontrada associação significativa entre os grupos com relação ao sexo (Qui- quadrado, p>0.05). A média de idade dos pacientes do grupo teste foi de 59,71±1,60 anos e no grupo controle foi de 44,38±1,90 anos, havendo diferença significativa entre os grupos (Mann-Whitney teste, p=0.01). O grupo teste teve uma mediana de 16 dentes perdidos, enquanto que o grupo controle apresentou 8 dentes ausentes, havendo diferença entre os grupos (Mann-Whitney teste, p=0.01).
Nenhum paciente relatou mudança na dieta e medicação. O IMC dos pacientes permaneceu estável durante os três meses de acompanhamento.
5.2 PARAMÊTROS CLÍNICOS
Houve diferença significativa quando se comparou o grupo teste com o controle no
baseline tanto no índice de placa (Mann Whitney teste, p= 0,01) como no índice gengival
Tabela 6 - Índice de placa e Índice Gengival (%) (mediana/p25 e p75) no baseline e após 3 meses do
FMSRP, nos pacientes diabéticos e não diabéticos.
Fonte: Banco de dados da pesquisa. Natal/RN, 2012. IP, índice de placa; IG, índice gengival.
Wilcoxon Teste (p< 0,05)#;
Mann Whitney Teste* (inter-grupo) (p<0,05).
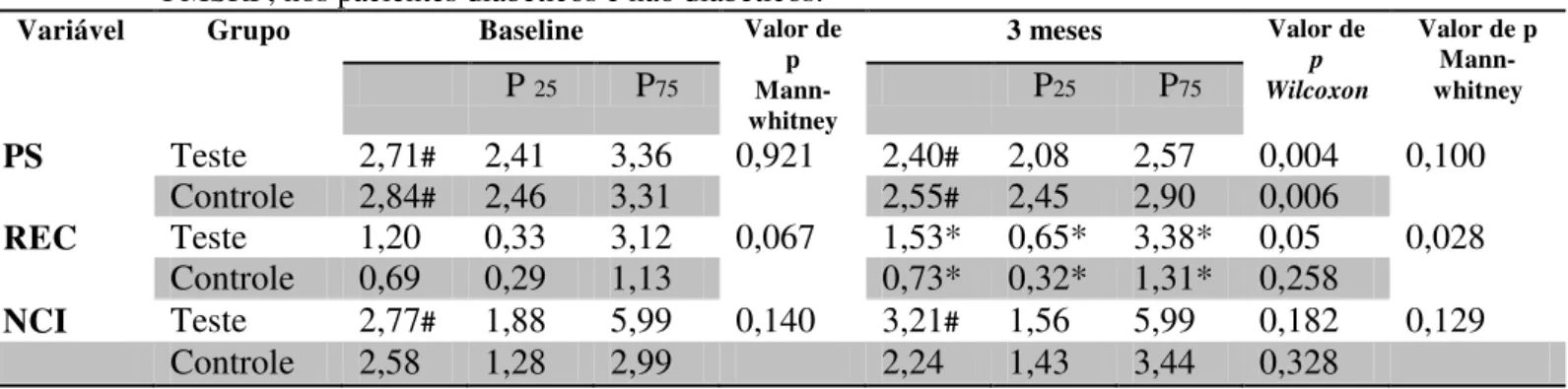
Em relação à profundidade de sondagem (PS), nível clínico de inserção (NCI) e recessão gengival (REC) quando se comparou o grupo teste com o controle não foi encontrada diferença significativa, exceto para recessão após 3 meses (Mann-Whitney teste). Verificou-se uma diferença significativa entre os períodos analisados para todas as variáveis exceto para o nível clínico de inserção e para a recessão do grupo controle.
Tabela 7 - Parâmetros clínicos periodontais (mm) (mediana/p25 e p75) no baseline e após 3 meses do FMSRP, nos pacientes diabéticos e não diabéticos.
Variável Grupo Baseline Valor de
p Mann-whitney
3 meses Valor de
p Wilcoxon
Valor de p Mann-whitney
P 25 P75 P25 P75
PS Teste 2,71# 2,41 3,36 0,921 2,40# 2,08 2,57 0,004 0,100
Controle 2,84# 2,46 3,31 2,55# 2,45 2,90 0,006
REC Teste 1,20 0,33 3,12 0,067 1,53* 0,65* 3,38* 0,05 0,028 Controle 0,69 0,29 1,13 0,73* 0,32* 1,31* 0,258
NCI Teste 2,77# 1,88 5,99 0,140 3,21# 1,56 5,99 0,182 0,129
Controle 2,58 1,28 2,99 2,24 1,43 3,44 0,328
Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
PS, profundidade de sondagem; NCI, nível clínico de inserção; REC, recessão. Wilcoxon Teste (p< 0,05)#; Mann-Whitney Teste (p<0,05)*.
Quando se caracterizou a profundidade de sondagem em sítios com profundidade até 3 mm; >3mm e ≤6mm e os sítios >6 mm quando se comparou um grupo em relação ao outro não foi observada diferença significativa em nenhuma das categorias da profundidade de sondagem (Mann Whitney teste, p>0,05). Entretanto, verificou-se uma diferença significativa
Variável Grupo Baseline Valor
de p Mann-whit- ney
3 meses Valor de p
Wilco- xon Valor de p Mann-whitney
P 25 P75 P25 P75
IP Teste 71,20*# 57,50 87,19 0,001 47,12# 31,18 58,96 0,001 0,64 Controle 48,52*# 31,70 75,93 37,50# 20,31 51,01 0,008
IG
para os grupos em relação aos períodos analisados em todas categorias conforme pode ser visualizado no gráfico abaixo.
Gráfico 1 - Porcentagem de sítios com profundidade de sondagem até 3 mm, maior que três e menor que 6 e maior que 6 mm..
* Diferença significativa do mediana das porcentagens no baseline em relação aos 3 meses (P<0,05,
Wilcoxon teste).
Fonte: Banco de dados da pesquisa
Com relação à mobilidade, os sítios foram divididos em porcentagem de sítios com mobilidade grau 0, grau1, grau 2 e grau 3. Os valores se encontram na tabela abaixo. Não foi encontrada diferença significativa entre os grupos em nenhum período avaliado (Mann Whitney teste, p>0,05) e nem quando se comparou o mesmo grupo nos dois períodos,
baseline e 3 meses (Wilcoxon teste, p>0,05).
Tabela 8 - Porcentagem de sítios com mobilidade grau 0, grau 1, grau 2 e grau 3 (%) (mediana/p25 e
p75) no baseline e após 3 meses do FMSRP, nos pacientes diabéticos e não diabéticos.
Variável Grupo Baseline 3 meses
P 25 P75 P25 P75
Mobililidade grau 0 Teste 78,89 61,16 100 97,22 59,28 100 Controle 90,27 37,40 95,91 90,27 30,47 95,91
Mobilidade grau 1 Teste 15,55 0 34,72 0 0 33,92
Controle 7,69 2,88 48,75 7,69 2,89 48,75
Mobilidade grau 2 Teste 0 0 0 0 0 1,39
0* 0,6*
1,4* 2,8*
5,95* 13,7*
15,1* 17,6*
94,05* 85,7* 83,5* 79,6*
0 20 40 60 80 100
Diabéticos Não diabéticos Diabéticos Não diabéticos
PS<3mm
PS>3 e <6mm
PS>6mm Baseline
Controle 0 0 0 0 0 0
Mobilidade grau 3 Teste 0 0 0 0 0 0
Controle 0 0 0 0 0 0
Fonte: Banco de dados da pesquisa. Natal/RN, 2012.
6 DISCUSSÃO
A relação de mutualidade existente entre a periodontite e o Diabetes Mellito (RYAN, 2008) instiga o interesse por investigações que procurem esclarecer o real resultado da terapia periodontal não cirúrgica nos pacientes diabéticos. O presente estudo teve como objetivo observar as alterações nos parâmetros clínicos periodontais após três meses do tratamento periodontal com o Full mouth Scalling and Root Planing (FMSRP) comparando pacientes
com periodontite com diabetes mellito sem diabetes.
O tamanho da amostra não alcançou o cálculo previamente realizado até o momento provavelmente devido aos rigorosos critérios de inclusão utilizados com o intuito de minimizar as variáveis de confundimento. Entretanto, tem sido observado nos estudos analisados que apresentam o mesmo desenho e objetivo deste, que a amostra tem um número reduzido de pacientes. Três trabalhos utilizaram até 10 pacientes por grupo (ALMEIDA et al., 2006; SANCHEZ et al., 2007; CRUZ et al., 2008) e as maiores amostras que foram encontradas foi de 20 pacientes por grupo (WESTFELT et al., 1996; CHRISTGAU et al., 1998) e 34 pacientes diabéticos e 45 sem alterações sistêmicas (TERVONEN et al., 1991), não diferindo muito do presente estudo.
A amostra foi bastante homogênea em relação ao sexo, mas em relação à idade, o grupo teste apresentou quase quinze anos a mais que o grupo controle, podendo explicar o motivo de possuírem o dobro (16 dentes) de elementos dentários ausentes em relação ao controle (8 dentes). Os estudos de Faria-Almeida, Navarro e Bascones (2006), Sanchez et al. (2008) , Cruz et al. (2008), Cirano et al. (2012) também apresentaram amostra de pacientes com diabetes com idade entre a quarta e sexta décadas.
Foram observadas reduções significativas nos índices de placa e gengival dentro de cada grupo (p<0,05) dos três meses para o baseline. Este mesmo resultado foi corroborado
por vários estudos (WESTFELT et al., 1996; CHRISTGAU et al., 1998; ALMEIDA et al., 2006; SANCHEZ et al., 2007; CRUZ et al., 2008; CIRANO et al., 2012). Entretanto, nenhum estudo, exceto o presente encontrou diferença entre os grupos no baseline, foi observado que
não existia uma homogeneidade no baseline entre os grupos avaliados, mostrando que, no
início, o grupo diabético possuía piores condições de higiene oral que o grupo controle, mas que, após três meses, não houve diferença significativa entre os grupos, havendo uma melhora em ambos os grupos.
no grupo controle de 2,84mm para 2,55mm. Essa diferença significativa corrobora os estudos de Cirano et al. (2012), Almeida, Navarro e Bascones (2006), Navarro-Sanchez, Faria-Almeida e Bascones-Martiz (2007) e Cruz et al. (2008). Apenas Faria-Faria-Almeida, Navarro e Bascones (2006) encontraram diferença significativa entre os grupos. Os resultados sugerem que o tratamento periodontal empregado demonstrou resultados favoráveis. Além disso, verifica-se que mesmo não sendo compensados e tendo pior condição de higiene no início do estudo os pacientes diabéticos também verificaram uma melhora dos parâmetros clínicos periodontais após o tratamento com FMSRP, revelando que somente a remoção do fator local, biofilme dental e cálculo, conseguiu uma melhor condição dos tecidos periodontais.
A recessão gengival aumentou 0,33mm no grupo teste e 0,04mm no grupo controle, havendo diferença em relação ao baseline no grupo teste e diferença significativa do grupo
teste em relação ao controle após três meses (Mann-Whitney teste). Esse aumento da recessão foi bem mais evidente no grupo teste, sendo uma possível explicação para a perda de inserção nesse grupo. Outros estudos como o de Cruz et al. (2008) que mostraram uma recessão no grupo teste foi de 0,12mm e no controle de 0,17mm. Nos estudos de Cirano et al (2012), os autores também observaram, respectivamente, 0,4mm e 0,6mm de recessão; já Faria-Almeida, Navarro e Bascones (2006) encontraram uma diferença de 1,0mm no grupo teste e 0,8mm no grupo controle, enquanto que no estudo de Navarro-Sanchez, Faria-Almeida e Bascones-Martiz, (2007) essa diferença foi de 0,5mm no grupo teste e 0,6mm no grupo controle. Todos esses resultados apresentaram diferenças significativas em relação ao baseline.
Pode-se observar também que o grupo controle ganhou 0,34 mm de nível de inserção clínica enquanto que o grupo teste perdeu 0,44mm de inserção, porém não houve diferenças estatísticas significativas nem entre os períodos avaliados e nem entre os grupos. Esses resultados diferem dos encontrados por Cirano et al. (2012), Faria-Almeida, Navarro e Bascones (2006), Navarro-Sanchez, Faria-Almeida e Bascones-Martiz, (2007) e Cruz et al. (2008), uma vez que verificaram diferenças significativas entre os períodos. Pode-se atribuir a essa piora no nível clínico de inserção dos pacientes diabéticos descompensados as alterações decorrentes da doença como alterações microvasculares, espessamento vascular e síntese do colágeno prejudicada. Mesmo assim, essa redução da inserção não chegou a 0,5mm.
de pacientes diabéticos e um grupo de não diabéticos, obtiveram resultados semelhantes (SANCHEZ et al., 2007; CIRANO et al., 2012). Já o estudo de Christgau et al. (1998) só mostrou diferença significativa apenas no grupo controle, nas bolsas periodontais mais rasas (até 3mm) e mais profundas (acima de 7mm). O único trabalho que encontrou diferenças significativas entre os grupos foi Sanchez et al. 2007 e esses autores atribuíram esse resultado a pior condição dos parâmetros periodontais, maior quantidade e profundidade de bolsas periodontais, já existentes no baseline no grupo diabético em relação ao grupo não diabético.
O estudo de Westfelt et al. (1996), em que participaram 20 pacientes diabéticos e 20 não diabéticos com um acompanhamento de até 5 anos, categorizou as bolsas periodontais em dois níveis: bolsas com profundidade maior que 4mm e bolsas com profundidade maior que 7mm. Ao realizar a análise após 12 e 60 meses, os autores verificaram uma redução nas porcentagens de sítios em ambos as categorizações das profundidades, com diferença significativa para as bolsas menores- PS>4mm (p<0,05) que nos diabéticos passaram 21,3% no baseline para 11,1% após 60 meses e no grupo controle foi de 23,4% dos sítios no início
passando para 13,5% e diferença altamente significativa para as bolsas mais profundas, PS>7mm (p<0,001), sendo incialmente nos diabéticos 0,6% passando para 0% e no controle 0,7% também chegando a 0%. O presente estudo também verificou uma redução significativa das bolsas periodontais, possuindo resultados semelhantes ao presente estudo.
Os pacientes diabéticos apresentaram um pequeno aumento do valor da hemoglobina glicada de 7,79% para 8,10%. Houve uma melhora dos parâmetros clínicos periodontais, embora não se conseguiu um melhor desempenho glicêmico. Alguns outros estudos também falharam em revelar uma redução do nível HbA1c ou a melhora da glicemia após o tratamento periodontal (JANKET et al., 2005; CRUZ et al., 2008; DARRE et al., 2008; TEEUW et al., 2010). Entretanto, outros trabalhos conseguiram encontrar uma melhora (RODRIGUES et al., 2003; ALMEIDA et al., 2006; SANCHEZ et al., 2007). Os valores da hemoglobina glicada em todos os momentos neste estudo foi maior que no estudo de Faria-Almeida, Navarro e Bascones (2006), também foi maior que o de Navarro-Sanchez, Faria-Almeida e Bascones-Martiz (2007) que era de 7,2 ± 1,3% e passou para 6,5 ± 1,1%; mas menor que o de Cruz et al. (2008), cujo nível foi inicialmente de 9,23±2,60% finalizando com 9,4±2,53%. Com relação a glicose em jejum o presente estudo corrobora com o de Faria-Almeida, Navarro e Bascones (2006) e Cruz et al. (2008) não encontrando diferença estatística entre os períodos (Wilcoxon Teste, p=0,397).
concentração da glicose em períodos curtos. Ela oferece uma média estimada do nível da glicose no período de 30 a 90 dias precedente ao exame (ROHLFING et al., 2002). Segundo Navarro-Sanchez, Faria-Almeida e Bascones-Martiz (2007), há uma tendência dos pacientes com maiores valores de HbA1c no início do estudo mostrarem uma maior redução em relação áqueles pacientes com valores mais baixos iniciais.
Existem diversos fatores que influenciam na alteração do estado glicêmico dos pacientes como: a grande variedade de metodologias e desenhos de estudos utilizados, pequena amostra, bom controle metabólico inicial, tempo de solicitação dos exames (os valores da hemoglobina glicada devem ser determinados entre 90 e 120 dias), o tipo de diabetes (tipo I ou II), idade dos indivíduos, severidade da doença periodontal, uso ou não de antibióticos (ALMEIDA et al., 2006; SANCHEZ et al., 2007; CIRANO et al., 2012). Além disso, segundo Janket et al. (2005), para se verificar uma redução significativa em relação a melhora glicêmica é necessário uma amostra maior que 246 indivíduos. Esse comportamento não foi encontrado no presente estudo, até mesmo pelo tempo de acompanhamento ter sido curto. Além disso, devido à amostra pequena não foi possível dividir os indivíduos diabéticos em aqueles que possuem um bom e um ruim controle metabólico para, assim, realizar inferências.
Segundo Cirano et al. (2012), o tratamento periodontal não cirúrgico por meio do Full MouthScalling and Root Planing é considerado uma alternativa válida, uma vez que promove
um resultado similar em pacientes diabéticos e não diabéticos. Esse protocolo foi utilizado para tratamento de periodontite crônica moderada e severa e encontrou-se resultados similares do ponto de vista clínico, microbiológico e imunológico comparado á terapia tradicional (KOSHY et al., 2005; WENNSTROM et al., 2005). Cruz et al. (2008), também não encontraram diferença na resposta clínica após utilizar o FMSPR nos pacientes diabéticos e sem diabetes. Santos et al. (2009), que avaliaram o Full Mouth (FMSRP) comparado ao Partial Mouth (PMSRP) em pacientes diabéticos, encontraram que as duas formas de
tratamento resultaram em melhora de todos os parâmetros clínicos, sem melhoras significativas no controle glicêmico (HbA1c). Esse mesmo resultado foi relatado em estudos que utilizaram a terapia convencional (CHRISTGAU et al., 1998; ALMEIDA et al., 2006) ou a terapia convencional complementada pela terapia cirúrgica (WESTFELT et al., 1996).
única dificuldade encontrada foi em conseguir realizar o tratamento nos pacientes que possuíam muitos dentes e com a doença periodontal avançada, devido ao menor tempo de realização dos procedimentos em relação à terapia convencional.
7 CONCLUSÃO
Portanto, mesmo com as limitações desse estudo, verifica-se:
1. O Full mouth desifection foi efetivo em produzir melhora nos parâmetros clínicos
periodontais em ambos grupos;
2. O Full mouth desifection não apresentou resultados diferentes nos indivíduos
diabéticos e não diabéticos, no período de 3 meses;