CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
CURSO DE MESTRADO
LUCILEIDE CASTRO DE OLIVEIRA
ESTUDO IMUNO-HISTOQUÍMICO DA EXPRESSÃO DA GLUT-1 E
MENSURAÇÃO DO ÍNDICE ANGIOGÊNICO (CD34) EM ADENOMAS
PLEOMÓRFICOS, CARCINOMAS ADENÓIDES CÍSTICOS E
CARCINOMAS MUCOEPIDERMÓIDES DE GLÂNDULAS SALIVARES
NATAL/RN
2012
LUCILEIDE CASTRO DE OLIVEIRA
ESTUDO IMUNO-HISTOQUÍMICO DA EXPRESSÃO DA GLUT-1 E
MENSURAÇÃO DO ÍNDICE ANGIOGÊNICO (CD34) EM ADENOMAS
PLEOMÓRFICOS, CARCINOMAS ADENÓIDES CÍSTICOS E
CARCINOMAS MUCOEPIDERMÓIDES DE GLÂNDULAS SALIVARES
NATAL/RN
2012
Dissertação apresentada ao Programa de
Pós-graduação em Patologia Oral da Universidade
Federal do Rio Grande do Norte como parte dos
requisitos necessários para obtenção do título de
Mestre em Patologia Oral.
Orientadora: Profa. Dra. Lélia Batista de Souza
Oliveira, Lucileide Castro de.
Estudo imuno-histoquímico da expressão da glut-1 e mensuração do índice angiogênico (cd34) em adenomas pleomórficos, carcinomas adenóides císticos e carcinomas mucoepidermóides de glândulas salivares / Lucileide Castro de Oliveira. – Natal, RN, 2012.
109 f. : il.
Orientador: Profa. Dra. Lélia Batista de Souza.
Dissertação (Dissertação) - Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Departamento de Odontologia. Programa de Pós-Graduação em Patologia Oral.
– –
– –
Divisão de Serviços Técnicos
Às minhas duas mães, Francisca Castro e Francisca Monteiro, as quais tenho um
amor infinito, uma por ter acreditado que a decisão que tomara seria a melhor para os
caminhos da minha vida e à outra pelo amor, compreensão, paciência e ensinamentos
concebidos, os quais foram fundamentais para que eu trilhasse os caminhos do bem e da
integridade moral.
Ao meu esposo, Marco Antonio Monteiro, companheiro de todas as horas, pelo seu
apoio incondicional ao meu crescimento pessoal e profissional, por me incentivar e me
encaminhar sempre no caminho do bem. Grata por ter entendido e suportado tantas ausências e
a distância.
Ao meu filho, João Marco, por me dar a oportunidade de conhecer e sentir, pelo
A DEUS, de onde advém toda a ciência desta terra, agradeço pela minha vida,
inteligência e, por ser em todos os momentos, meu refúgio e fortaleza.
A minha orientadora Prof. Dra. Lélia Batista de Souza, exemplo de dedicação e
competência na sua profissão, agradeço pela acolhida, pelos conhecimentos transmitidos,
pela sua disponibilidade para orientação e oportunidade de desenvolver este trabalho. Quero
ser grata também pela sua paciência e por ter me concedido um pouco da sua compreensão
no momento em que mais precisei.
Ao professor Dr. Leão Pereira Pinto, pela sua acolhida e pelo exemplo de dedicação,
competência e entusiasmo a ciência da Patologia Oral. Para mim será sempre um exemplo de
sabedoria e competência a serem perseguidos.
A professora Dra. Roseana de Almeida Freitas, agradeço pela sua sensatez, por
sempre ter uma palavra bem colocada, pela sua disponibilidade, boa vontade e pelos muitos
ensinamentos que sempre transmitiu.
Aos demais professores do Programa de Pós-graduação em Patologia Oral, Dra.
Márcia Miguel, Dra. Éricka Janine, Dra. Lélia Maria Queiroz, Dra, Hébel Galvão, Dra.
Ana Myrian e Dr. Antonio de Lisboa Lopes Costa, pela acolhida, boa convivência e
ensinamentos compartilhados que foram importantes para minha formação acadêmica.
Ao professor Dr. Cassiano Nonaka, pela sua sempre prontificação nos momentos em
que precisei de auxílio acadêmico e científico.
Ao Professor Jeconias Câmara, por ser, antes de tudo um amigo que com seu jeito
tenta me encaminhar pelos caminhos do bem. Grata pela orientação, pelas palavras de
incentivo e por despertar em mim o interesse pela patologia e pela docência. Para mim será
sempre um exemplo de dedicação ao ensino acadêmico de qualidade.
Aos professores e amigos do Departamento de Patologia e Medicina Legal da
Universidade Federal do Amazonas Dr. Luiz Ferreira, Dr. Dirceu Bennedicto, Dra. Neila
Falconi e, em especial a Dra. Luciana Fujimoto, Dra. Tatiana Libório, Pricila Macedo e
Aos colegas do Programa de Pós-graduação desta instituição, Águida, Pedro Paulo,
Joabe, Keila, Alessandra, Emeline, Cyntia, Ana Rafaela, Emília, Adriana, Felipe, Maiara,
Fernando, Rodrigo e Marcelo, e em especial ao amigos Ana Luíza, Denise, Roseane,
Clarissa, Bárbara, Natália, Dmitry, Edilmar e Pedro Carlos pela amizade, convivência
harmoniosa e companherismo desenvolvidos nesses anos. A amizade é a flor do querer bem
que desabrocha todos os dias através da convivência. Todos vocês são queridos a mim!
À Sandrinha, Canindé, Hévio e Ricardo, responsáveis técnicos pelos Laboratórios da
Disciplina de Patologia Oral, pela disponibilidade e auxílio fundamental no processamento
do material necessário à execução dessa pesquisa.
Aos funcionários da Disciplina de Patologia Oral Gracinha, Idelzuíte e Lourdinha,
pela disponibilidade em auxiliar, pela receptividade, boa convivência e palavras de incentivo.
A toda a irmandade do Centro Espiríta Beneficente União do Vegetal – Núcleo Natal, em especial a Silvana, Luísa, Júlia, Derenice, Izabelle, Sarah e Izaías, pela acolhida,
convivência, amizade, pelo suporte e apoio dado nos momentos difíceis em que fiquei sem
minha família. Aprendemos que o bem só sabe é aquele que recebe. Pois lhes digo que recebi
esse bem de todos vocês!
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo
“O bem é aquele que a gente faz e não sabe. O bem, só sabe mesmo é aquele que recebeu. Eu
mesmo não sei se fiz o bem.”
RESUMO
A expressão da proteína transportadora de glicose tipo 1 (GLUT-1), bem como a angiogênese, têm sido relacionadas ao comportamento clínico e agressividade em neoplasias de origem diversas. Acredita-se que a expressão desta proteína denote a demanda metabólica das células tumorais e, assim, a sua influência na formação de novos vasos sanguineos. O adenoma pleomórfico (AP) e o carcinoma adenoide cístico (CAC) e carcinoma mucoepidermóide (CME) representam, respectivamente, a neoplasia benigna e as malignas mais frequentes das glândulas salivares. O propósito deste estudo foi comparar a expressão imuno-histoquímica da GLUT-1, bem como correlacionar com a angiogênese em casos de APs, CACs e CMEs levando em consideração suas gradações histológicas. A amostra foi composta por 20 APs, 20 CACs e 10 CMEs os quais foram classificados de acordo com os graus histológicos apresentados. A expressão da GLUT-1 foi avaliada no parênquima das lesões, estabelecendo-se o percentual de células imunopositivas, de acordo com os escores: 0 (nenhuma célula imunomarcada), 1 (até 25% das células tumorais imunomarcadas), 2 (de 25-50% das células tumorais imunomarcadas) e 3 (mais de 25-50% das células tumorais imunomarcadas). O índice angiogênico foi analisado por meio da contagem de microvasos imunomarcados pelo anticorpo anti-CD34, em 5 campos (200x). A análise da expressão da GLUT-1 revelou diferenças estatisticamente significativas entre os grupos benignos e malignos (p = 0,022). O número médio de microvasos foi de 40,4 em APs, 21,2 em CACs e 66,5 em CMEs, com diferenças significativas entre os grupos (p < 0,001). Quando comparadas a expressão da GLUT-1 com o índice angiogênico em conjunto, não foi evidenciada correlação significativa entre a quantidade de microvasos e a expressão da GLUT-1 (r = 0,211; p = 0,141). Os resultados do presente estudo sugerem que as diferenças no comportamento biológico entre APs, CACs e CMEs podem estar relacionadas à expressão da GLUT-1 e que tumores benignos e malignos de glândulas salivares exibem diferenças no número médio de microvasos, com maiores índices nos tumores considerados mais agressivos. Além disto, o número de microvasos neoformados pode ser independente da demanda metabólica das células tumorais.
Palavras-chave: Neoplasias de glândulas salivares, adenoma pleomórfico, carcinoma
ABSTRACT
The expression of glucose transporter protein 1 (GLUT-1), as well the angiogenesis has been associated to clinical behavior and aggressiveness in tumors of various origin. It is believed that the expression of this protein denotes metabolic demand of the tumor cells and, thus its influence upon the formation of new blood vessels. Pleomorphic adenoma (PA) and the adenoid cystic carcinoma (ACC) and mucoepidermoid carcinoma (MEC) represent, respectively, the most commom benign and malignant tumors of salivary glands. The aim of this study was to analyze and compare the immunohistochemical expression of GLUT-1 and its correlation with angiogenesis in cases of PAs, ACCs and MECs considering their histological grades. The sample consisted of 20 PAs, 20 ACCs and 10 MECs. The cases were analyzed and classified according to their histological grades. The expression of GLUT-1 was evaluated in the parenchyma lesions, establishing the percentage of immunopositive cells, according to the following scores: 0 (no cell immunomarked), 1 (up to 25% of tumor cells immunostained), 2 (25 - 50% of tumor cells immunostained) and 3 (more than 50% of tumor cells immunostained). The angiogenic index was analyzed by counting the microvessels immunostained by anti-CD34 antibody, in 5 fields (200X). The analysis of the expression of GLUT-1 in tumor parenchyma showed statistically significant differences between benign and malignant groups (p = 0.022). The average number of microvessels in PAs was 40.4, 21.2 in ACCs and 66.5 in MECs, with significant differences between groups (p <0.001). When compared to the expression of GLUT-1 and angiogenic index as a whole, there was no significant correlation between the number of microvessels and the expression of GLUT-1 (r = 0.211, p = 0.141). In conclusion, the results of this study suggest not only that differences in biological behavior between PAs, ACCs and MECs may be associated to the expression of GLUT-1, but also that benign and malignant salivary gland present differences in the average number of microvessels, with higher levels considered more aggressive tumors. Furthermore, the number of newly formed microvessels can be independent of the metabolic demand of the tumor cells.
Key-words: Neoplasms of the salivary glands, pleomorphic adenoma, adenoid cystic
LISTA DE ILUSTRAÇÕES
Figura 7. Fotomicrografias evidenciando subtipos histológicos apresentados pelos CMEs: (a) baixo grau, (b) intermediário e (c) alto grau. (H/E, 100X)... 60
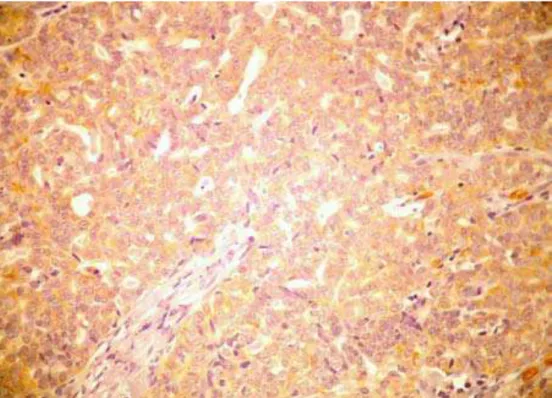
Figura 8. Fotomicrografia demonstrando a imunoexpressão da GLUT-1 no AP padrão clássico (ENVISION, 400X)... 64
Figura 9. Fotomicrografia demonstrando a imunoexpressão da GLUT-1 no AP padrão mixóide. (ENVISION, 400X)... 64
Página
Quadro 1. Características histopatológicas e valores de pontuação utilizados para a gradação do CME de acordo com OMS, 2005... 35
Quadro 2. Características histopatológicas para gradação do CME, adaptado de
Brandwein et al., (2001)... 36
Quadro 3. Especificidade, catálogo, fabricante, diluição, recuperação antigênica e
tempo de incubação dos anticorpos primários utilizados no estudo... 52
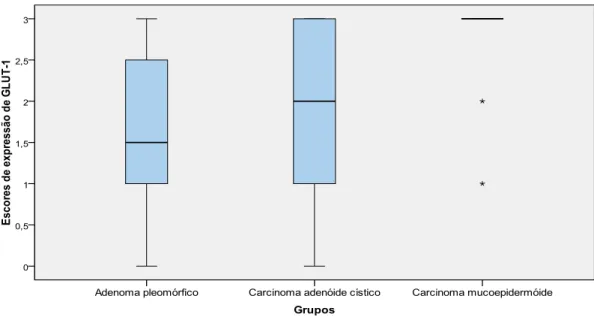
Gráfico 1. Box-plot relativo aos escores de expressão de GLUT-1 nos APs, CACs e CMEs. Natal, RN – 2012... 62
Gráfico 2. Box-plot relativo à quantidade de microvasos (CD34) nos APs, CACs e CMEs. Natal, RN – 2012... 71
Figura 1. Modelo estrutural bidimensional das GLUTs com 12 hélices transmembrânicas hidrofóbicas, inseridas na porção lipídica da
membrana plasmática e domínios terminais NH2 e COOH intracelulares.. 39
Figura 2. Modelo estrutural do canal central transmembranar polar que cria a possibilidade da instalação de pontes de hidrogênio com a glicose à
medida que ela se move através do canal... 40
Figura 3. Modelo esquemático simples para o transporte de glicose através da membrana... 40
Figura 4. Esquema simples da angiogênese a partir de rede vascular primitiva... 42
Figura 5. Fotomicrografias evidenciando subtipos histológicos apresentados pelos APs: (a) clássico, (b) mixóide e (c) celular. (H/E, 100X)... 57
Figura 10. Fotomicrografia demonstrando a imunoexpressão da GLUT-1 no AP padrão celular. (ENVISION, 400X)... 65
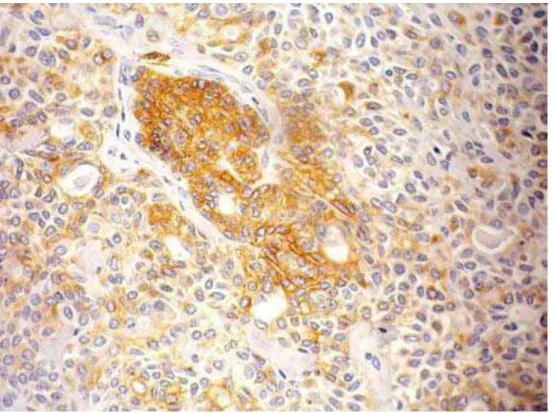
Figura 11. Fotomicrografia evidenciando a imunoexpressão da GLUT-1 no CAC padrão cribriforme. (ENVISION, 400X)... 66
Figura 12. Fotomicrografia evidenciando a imunoexpressão da GLUT-1 no CAC padrão tubular. (ENVISION, 400X)... 66
Figura 13. Fotomicrografia evidenciando a imunoexpressão da GLUT-1 no CAC padrão sólido. (ENVISION, 400X)... 67
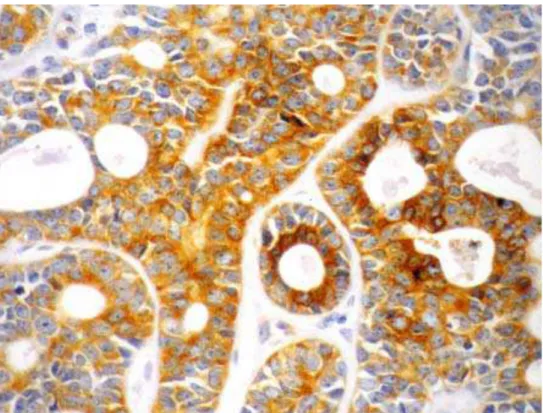
Figura 14. Fotomicrografia demonstrando a imunoexpressão da GLUT-1 no CME de baixo grau. (ENVISION, 400X)... 68
Figura 15. Fotomicrografia demonstrando a imunoexpressão da GLUT-1 no CME de grau intermediário. (ENVISION, 400X)... 68
Figura 16. Fotomicrografia evidenciando a imunoexpressão da GLUT-1 no CME de alto grau. (ENVISION, 400X)... 69
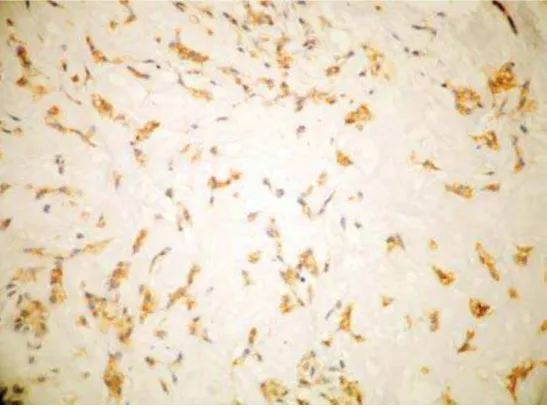
Figura 17. Fotomicrografia evidenciando a imunomarcação pelo CD34 em AP padrão clássico. (ENVISION, 400X)... 74
Figura 18. Fotomicrografia evidenciando a imunomarcação pelo CD34 em AP padrão mixóide. (ENVISION, 400X)... 74
Figura 19. Fotomicrografia evidenciando a imunomarcação pelo CD34 no AP padrão celular. (ENVISION, 400X)... 75
Figura 20. Fotomicrografia evidenciando a imunomarcação pelo CD34 no CAC padrão cribriforme. (ENVISION, 400X)... 76
Figura 21. Fotomicrografia evidenciando a imunomarcação pelo CD34 no CAC padrão tubular. (ENVISION, 400X)... 76
Figura 22. Fotomicrografia evidenciando a imunomarcação pelo CD34 no CAC padrão sólido. (ENVISION, 400X)... 77
Figura 23. Fotomicrografia evidenciando a imunomarcação pelo CD34 no CME de baixo grau. (ENVISION, 400X)... 78
Figura 24. Fotomicrografia evidenciando a imunomarcação pelo CD34 no CME de grau intermediário. (ENVISION, 400X)... 78
r
LISTA DE TABELAS
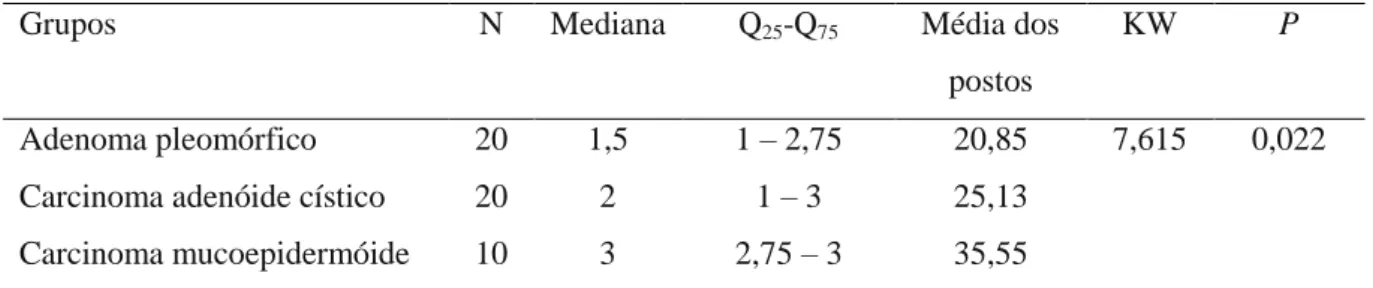
Tabela 1. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, estatística KW e significância estatística (p) para os escores de imunoexpressão de GLUT-1, em relação aos grupos de neoplasias de glândulas salivares. Natal, RN – 2012... 61
Tabela 2. Distribuição em números absolutos e percentuais dos casos de APs de acordo com o subtipo histológico e os escores de imunoexpressão de GLUT-1. Natal, RN – 2012... 63
Tabela 3. Distribuição em números absolutos e percentuais dos casos de CACs de acordo com o subtipo histológico e os escores de imunoexpressão de GLUT-1. Natal, RN – 2012... 63
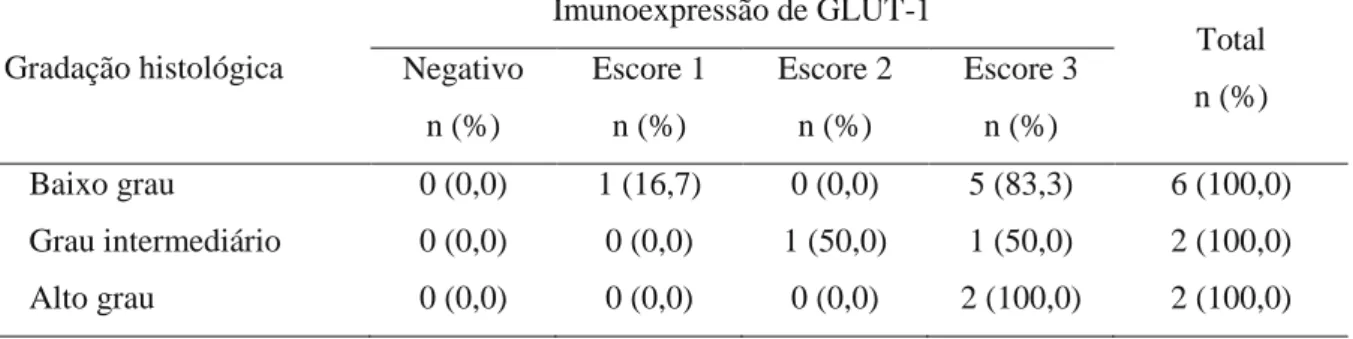
Tabela 4. Distribuição em números absolutos e percentuais dos casos de CMEs de acordo com a gradação histológica de malignidade e os escores de imunoexpressão de GLUT-1. Natal, RN – 2012... 63
Tabela 5. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, estatística KW e significância estatística (p) para o índice angiogênico (CD34), em relação aos grupos de neoplasias de glândulas salivares. Natal, RN – 2012... 70
Tabela 6. Tamanho da amostra, média e valores máximo e mínimo do índice angiogênico (CD34) em relação aos subtipos histológicos dos APs. Natal, RN – 2012... 71
Tabela 7. Tamanho da amostra, média e valores máximo e mínimo do índice angiogênico (CD34) em relação aos subtipos histológicos dos CACs. Natal, RN – 2012... 72
Tabela 8. Tamanho da amostra, média e valores máximo e mínimo do índice angiogênico (CD34) em relação aos graus histológicos de malignidade dos CMEs. Natal, RN – 2012... 72
Tabela 9. Tamanho da amostra, valor estatístico para o coeficiente de correlação de Spearman (r) e significância estatística (p) para o índice angiogênico (CD34) em relação aos escores de expressão de GLUT-1 nos APs, CACs e CMEs. Natal, RN – 2012... 73
LISTA DE ABREVIATURAS E SIGLAS
AP Adenoma pleomórfico.
AP2 Do inglês activating protein 2, refere-se ao gene AP2.
ATP Adenosina Trifosfato.
BSA Do inglês bovine albumim serum, traduzido como albumina soro bovino.
CAC Carcinoma adenóide cístico.
CD31 Do inglês cluster of differentiation 31, traduzido como grupamento de diferenciação 31.
CD34 Do inglês cluster of differentiation 34, traduzido como grupamento de diferenciação 34.
CD105 Do inglês cluster of differentiation 105, traduzido como grupamento de diferenciação 105.
CME Carcinoma mucoepidermóide.
CTNNB1 Do inglês, catenin (cadherin-associated protein) beta 1, refere-se ao gene
CTNNB1.
EMMPRIN Do inglês extracellular matrix metalloproteinase inducer, traduzido como indutor de metaloproteinase da matriz extracelular.
FGF Do inglês fibroblastic growth factor, traduzido como fator de crescimento fibroblástico.
aFGF Do inglês acid fibroblastic growth factor, traduzido como fator de crescimento fibroblástico ácido ou 1.
bFGF Do ingles basic fibroblastic growth factor, traduzido como fator de crescimento fibroblástico básico ou 2.
G-CSF Do inglês granulocyte colony-stimulating factor, traduzido como fator estimulador de colônia de granulócito.
GLUT-1 Do inglês glucose transporter protein 1, traduzido como proteína transportadora de glicose tipo 1.
H-ras Do inglês, v-Ha-ras Harvey rat sarcoma viral oncogene homolog, refere-se ao gene H-ras.
MAML2 Do inglês mastermind-like 2 ou v-maf musculoaponeurotic fibrosarcoma oncogene homolog (avian), refere-se ao gene MAML2.
MECT1 Do inglês mucepidermoid carcinoma translocated gene-1, refere-se ao gene MECT1.
mm2 Milímetros quadrados
MVC Do inglês mcrovessel count, traduzido como contagem microvascular.
MVD Do inglês mcrovessel density, traduzido como densidade microvascular.
MVV Do inglês mcrovessel volume, traduzido como volume microvascular.
µl Microlitro.
µm Micrômetros
OMS Organização Mundial de Saúde
PLAG1 Do ingles pleomorphic adenoma gene 1, refere-se ao gene PLAG1.
SGLT Do inglês sodium glicose transportation, traduzido como transportador de glicose acoplado ao sódio.
SOX4 Do inglês SRY-related HMG-box 4, refere-se ao gene SOX4.
TGFα Do inglês transforming growth factor-α, traduzido como fator transformador de crescimento-α.
TGFβ Do inglês transforming growth factor-β, traduzido como fator transformador de crescimento-β.
TNFα Do inglês tumor necrosis factor-α, traduzido como fator de necrose tumoral- α.
VEGF Do inglês vascular endotelial growth factor, traduzido como fator de crescimento endotelial vascular.
r
SUMÁRIO
Página
1 INTRODUÇÃO ... 26 2 REVISÃO DA LITERATURA ... 29
2.1 NEOPLASIAS DE GLÂNDULAS SALIVARES... 29
2.1.1 Considerações gerais... 29 2.1.2 Adenoma Pleomórfico... 30 2.1.3 Carcinoma Adenóide Cístico ... 32 2.1.4 Carcinoma Mucoepidermóide... 33
2.2 METABOLISMO ENERGÉTICO DE CÉLULAS NEOPLÁSICAS... 37
2.2.1 Proteína transportadora de glicose tipo 1 (GLUT-1)... 38
2.3 ANGIOGÊNESE EM TECIDOS NEOPLÁSICOS ... 41
2.3.1 Mensuração da angiogênese e CD34 ... 43 3 PROPOSIÇÃO ... 47 4 MATERIAL E MÉTODOS... 49
4.1 IMPLICAÇÕES ÉTICAS... 49
4.2 CARACTERIZAÇÃO DO ESTUDO... 49
4.3 POPULAÇÃO... 49
4.4 AMOSTRA ... 49
4.5 ANÁLISE MORFOLÓGICA DOS ESPÉCIMES... 49
4.6 ESTUDO IMUNO-HISTOQUÍMICO... 50
4.6.1 Método imuno-histoquímico... 50 4.6.2 Análise imuno-histoquímica do CD34... 52
4.6.3 Análise imuno-histoquímica da GLUT-1... 53 4.7 ANÁLISE ESTATÍSTICA... 54
5 RESULTADOS... 56 5.1 RESULTADOS MORFOLÓGICOS... 56
5.1.1 Adenomas Pleomórficos... 56 5.1.2 Carcinomas Adenoides Císticos... 58 5.1.3 Carcinomas Mucoepidermóides... 58
5.2 RESULTADOS DA ANÁLISE DA IMUNOEXPRESSÃO DA GLUT-1.... 61
5.3 RESULTADOS DA ANÁLISE DO ÍNDICE ANGIOGÊNICO... 70
6 DISCUSSÃO... 81
7 CONCLUSÕES... 90
REFERÊNCIAS... 92
APÊNDICES... 102 ANEXO... 108
r
1 INTRODUÇÃO
As glândulas salivares são glândulas exócrinas que desempenham funções importantes
no organismo, como lubrificação e proteção de dentes, da mucosa oral e esofágica e ainda
digestão de alimentos. Dividem-se em glândulas salivares maiores, compreendendo as
parótidas, sublinguais e submandibulares e as salivares menores que estão distribuídas por
quase toda a mucosa oral. Costituem-se de um grupo especializado de células que se arranjam
em ácinos produtores de material de secreção e de ductos excretores que se exteriorizam na
cavidade oral, além das células mioepiteliais que auxiliam na excreção da saliva
(KATCHBURIAN; ARANA, 2004; RAITZ; ARAÚJO, 2004; JUNQUEIRA; CARNEIRO,
2008).
Esse tecido, com certa frequência, é sede de processos proliferativos neoplásicos
benignos e malignos, constituindo uma área importante de estudo dentro da Patologia Oral
(SPEIGHT, 2007). Estes processos, por sua vez, constituem um grupo vasto e complexo de
tumores que apresentam comportamentos clínicos diferentes e padrões morfológicos diversos,
tornando difícil sua classificação, diagnóstico e tratamento (ETTL et al., 2008; LOIOLA et
al., 2009; OLIVEIRA et al., 2009). Neste contexto, os tumores benignos são os de maior
frequência em relação aos malignos e, dentre todos, o Adenoma Pleomórfico (AP) é o mais
prevalente, possuindo dados epidemiológicos, clínicos e histopatológicos bem esclarecidos.
Dentre os malignos, muitos estudos apontam como o mais frequente o Carcinoma
Mucoepidermóide (CME) seguido do Carcinoma Adenóide Cístico (CAC) (LIMA et al. 2005;
TAKAHAMA JUNIOR; ALMEIDA; KOWALSKI, 2009; TIAN et al., 2010; MORAIS et al.
2011; VENKATA; IRULANDY, 2011).
As características das células neoplásicas, bem como sua interação com o tecido
conjuntivo de suporte vêm sendo estudadas com intuito de esclarecer melhor o seu
comportamento clínico e o prognóstico para estas lesões, bem como estabelecer melhor
protocolos de tratamento mais efetivos (SCHOPPMANN et al., 2006; KOPPENOL;
BOUNDS; DANG, 2011). Dentre algumas características apresentadas pelas neoplasias, a
angiogênese e as alterações no metabolismo das células neoplásicas têm sido alvo de
pesquisas e, alguns marcadores biológicos são utilizados para este fim, como o CD34 para
angiogênese e o GLUT-1, visando verificar o metabolismo glicolítico nestes tecidos (ENDO
et al. 2007; ECKERT et al. 2008; KADEMANI et al. 2009; AYALA et al. 2010;
Em tumores de glândulas salivares, as pesquisas com este enfoque ainda são poucas,
principalmente as que correlacionam esses dois marcadores biológicos nos tumores citados
anteriormente (MORI et al., 2007; BONFITTO et al.,2010; DEMASI et al., 2010) . Desta
forma, o objetivo da presente pesquisa foi realizar um estudo imuno-histoquímico, analisando
o índice angiogênico no estroma de uma série de casos de APs, CACs e CMEs através da
contagem microvascular (MVC) expressa pelo CD34, bem como verificar o metabolismo das
células neoplásicas destes tumores através da expressão da proteína GLUT-1, para verificar se
existem ou não diferenças entre os tumores estudados, considerando seus comportamentos
clínicos, benignos ou malignos e os diferentes graus histológicos apresentados pelos mesmos.
2 REVISÃO DA LITERATURA
2.1 NEOPLASIAS DE GLÂNDULAS SALIVARES
2.1.1 Considerações gerais
As neoplasias benignas e malignas de origem em glândula salivar constituem um
grupo vasto e complexo de patologias (SPEIGHT, 2007; LOIOLA et al., 2009). Uma de suas
características é a capacidade de formar padrões morfológicos diversos e algumas vezes até
bem semelhantes entre um tumor e outro, tornando difícil o diagnóstico diferencial e
definitivo. Com relação a sua histogênese, podem originar-se dos diferentes tipos celulares
que formam o tecido glandular normal, como as células acinares mucosas e serosas, células
epitelias luminais e não luminais dos ductos salivares e, ainda as células mioepiteliais
presentes na estrutura glandular (COSTA et al., 2008; MARUYA et al., 2009).
Os fatores carcinogênicos determinantes para a origem e desenvolvimento destas
patologias ainda são bastante discutidos, não havendo consenso geral na grande maioria dos
casos, sobre um fator etiológico definido. Tem sido cogitada a interação do genótipo das
células destes tecidos com alguns carcinógenos clássicos, tais como o tabaco associado ao
alcoolismo crônico, além da relação de alguns tipos de tumores com a presença de certas
infecções virais, influências hormonais, radioterapia, dentre outros. Entretanto, nada de
caráter definitivo e esclarecedor (GOODE; EL-NAGGAR, 2005; LIMA et al., 2005).
A incidência global destes tumores por ano, de acordo com a Organização Mundial de
Saúde (OMS) varia desde 0.4 a 13.5 casos em 100 mil pessoas na população, constituindo
cerca de 3 a 10% dos tumores de cabeça e pescoço. Alguns destes tumores, por serem mais
frequentes, são bem documentados e relatados na literatura, possuindo um perfil
epidemiológico elucidado, entretanto o mesmo não acontece para as outras neoplasias deste
grupo, devido a sua menor frequência (EVESON et al., 2005; LIMA et al., 2005).
As neoplasias relatadas como mais frequentes nas glândulas salivares são o AP, CME
e CAC. Epidemiologicamente, são mais incidentes em indivíduos do sexo feminino, sendo os
benignos mais frequentes em faixas etárias mais jovens e os malignos em pessoas de idade
mais elevada. De forma geral, os tumores benignos são mais prevalentes, representando cerca
de 54 a 79%, e os malignos 20 a 46%. A glândula parótida tem se demonstrado como o sítio
submandibulares e 1% nas sublinguais. Nas glândulas salivares menores, apesar da frequência
ser menor, a maioria dos tumores incidentes nesta localização é maligno, cerca de 90%.
(LIMA et al., 2005; TAKAHAMA JUNIOR; ALMEIDA; KOWALSKI, 2009; NÓBREGA et
al., 2010).
2.1.2 Adenoma Pleomórfico
O AP é uma neoplasia benigna e de todos os tumores de glândula salivar é o mais
frequente, representando cerca de 70% dos tumores de parótida e 40 e 60% dos tumores de
glândulas submandibular e salivares menores, respectivamente (SPEIGHT, 2007; ITO et al.,
2009; ZHANG et al., 2009). A denominação tumor misto também tem sido utilizada para se
reportar a esta neoplasia, embora este termo esteja caindo em desuso considerando que não
são verdadeiros tumores mistos, pois se originam de um único folheto embrionário
(BURZLAFF; PURICELLI, 1996; ITO et al., 2009).
Sua origem e morfologia histológica estão atreladas às células epiteliais e mioepiteliais
das glândulas salivares. Estas, por sua vez, podem ser encontradas em diversos estados de
diferenciação, atribuindo-se à célula mioepitelial os vários padrões do estroma tumoral que se
observam especificamente nesta neoplasia (NAGEL et al., 2004; ZHANG et al., 2009).
Ao realizar um estudo retrospectivo de 6.982 casos de tumores benignos e malignos de
glândula salivar, Tian et al. (2010) verificaram que dos 4.743 tumores benignos encontrados,
3.281 foram histologicamente diagnosticados como APs, correspondendo a 69% das lesões
deste grupo; o sexo feminino foi mais acometido e com média de idade de 42 anos. Com
relação a localização anatômica, 65% destas neoplasias foram em glândula parótida, seguida
das glândulas salivares menores do palato e glândulas submandibulares.
Resultados similares foram encontrados no estudo de 599 casos realizado por Oliveira
et al. (2009), onde de 469 casos de tumores benignos, 406 corresponderam a APs, sendo que
298 estavam localizados em parótida, seguido da submandibular e glândulas salivares
menores. No que corresponde ao sexo, o feminino também foi o mais acometido, com média
de idade de 41 anos.
Clinicamente, o AP apresenta-se como uma massa compacta de tecido com
crescimento lento, indolor, podendo alcançar grandes proporções de tamanho. Geralmente,
mostra-se circunscrito, bem encapsulado porém, podem ocorrer casos de descontinuidade e
até ausência desta estrutura. As células epiteliais e mioepiteliais que compõem esta neoplasia
mesenquimal, conferindo ao tumor grande variedade de padrões microscópicos. Estas células
podem assumir, individualmente, formato plasmocitóide, fusiforme, cuboidal, basalóide,
escamoso e padrão ocasional de células claras, mucosas e sebáceas (ITO et al., 2009;
MARUYAMA et al., 2009).
Essas células em conjunto, geralmente, se arranjam solidamente na forma de ninhos e
lençóis, exibindo na grande maioria das vezes formação de estruturas ductiformes pequenas
ou dilatadas contendo no seu interior material eosinofílico por vezes proeminente (EVESON
et al., 2005; ITO et al., 2009; MARUYAMA et al., 2009). Da mesma forma, o estroma
tumoral apresenta certa variedade morfológica podendo ser mixóide, condróide,
mixocondróide, hialino e fibroso denso. Podem ser encontradas ainda, porém mais raramente,
diferenciação escamosa, óssea e adiposa (EVESON et al., 2005; ITO et al., 2009;
MARUYAMA et al., 2009; ZHANG et al., 2009).
Diante destes padrões morfológicos, Seifert et al. (1976) classificaram os APs em 4
tipos histológicos de acordo com a diferenciação de células epiteliais e mioepiteliais e a
quantidade de estroma tumoral presente. O tipo I ou clássico exibe equilíbrio entre
componente celular e estromal, com cerca de 30-50% de estroma. No II ou mixóide, 80% do
tumor corresponde a estroma predominantemente mixóide. No tipo III, também denominado
celular, o tumor apresenta somente cerca de 20-30% de componente estromal. O tipo IV
revela estroma tumoral em proporções semelhantes ao tipo III, porém exibe padrão
monomórfico de células epiteliais.
Os aspectos moleculares que envolvem a tumorigênese do AP vêm sendo estudados
através de pesquisas citogenéticas. A maioria destes estudos tem demonstrado que cerca de
30% destes tumores possuem um cariótipo normal enquanto 70% apresentam algum tipo de
aberração cromossômica, principalmente rearranjos envolvendo o cromossomo 8q12 e
12q13-15 (CHEUK; CHAN, 2007; DECLERCQ et al., 2008). O gene PLAG1 (do inglês
pleomorphic adenoma gene 1, traduzido como Gene 1 do adenoma pleomórfico) localizado
no cromossomo 8q12 é o mais frequentemente encontrado nas alterações citogenéticas na
neoplasia em questão, principalmente sofrendo translocação com o gene CTNNB1 (do inglês
catenin (cadherin-associated protein) beta 1, traduzido como catenina, caderina-associada a
proteína beta 1) localizado no cromossomo 3p21 (CHEUK; CHAN, 2007; VANDICK et al.,
2007; ELLEDGE, 2009).
O tratamento de escolha é a excisão cirúrgica e a proservação prolongada do paciente
é recomendada, pois apesar deste tumor, geralmente, ter curso clínico indolente e bom
tipos tumorais. Quando isto acontece, o AP passa a ser denominado de carcinoma ex-adenoma
pleomórfico que, na maioria das vezes, exibe comportamento agressivo com desenvolvimento
de metástases regionais e distantes para pulmões, ossos e vísceras (EVESON et al., 2005;
ARAÚJO et al., 2009).
2.1.3 Carcinoma Adenóide Cístico
O CAC é um tumor maligno de glândulas exócrinas, originando-se mais
frequentemente nas células epitelias e mioepiteliais das glândulas salivares da cavidade oral,
perfazendo cerca de 10% de todos os tumores destes tecidos; localiza-se de forma preferencial
na parótida, submandibular e salivares menores, havendo sempre variação de acometimento
nos estudos epidemiológicos (EL-NAGGAR; HUVOS, 2005; SOPRANI et al., 2007;
ZHANG; PENG, 2007; SOARES et al., 2008). Outros locais reportados como sítios de
incidência são mama, próstata, glândulas lacrimais, cérvice uterina e mucosa bronquial
(SOPRANI et al., 2007, SOARES et al., 2008; LUUKKAA et al., 2010).
Na análise epidemiológica de 6.982 casos de neoplasias benignas e malignas de
glândula salivar, Tian et al. (2010) verificaram que dos 2.239 tumores malignos encontrados
681 casos (30%) corresponderam ao CAC, sendo as glândulas salivares menores do palato o
sítio de maior ocorrência, seguidas da parótida e submandibular; não houve diferença
significativa de acometimento entre homens e mulheres e a média de idade foi de 51 anos. Em
outro levantamento realizado por Oliveira et al. (2009), de 130 neoplasias malignas 39 casos
(30%) receberam diagnóstico de CAC e as glândulas salivares menores foram as mais
acometidas seguidas da parótida e submandibular; o sexo de maior prevalência foi o feminino
e a média de idade foi de 56 anos.
Em relação à tumorigênese do CAC, estudos têm mencionado a ocorrência de
anormalidades cromossômicas principalmente em genes que codificam as proteínas laminina,
versican, biglican e colágeno tipo IV-α1. Também são relatadas superexpressões de fatores de
transcrição SOX4 (do inglês SRY-related HMG-box 4), genes da família AP2 (do inglês
activating protein 2) e membros da via de sinalização Wnt/βcatenina. A perda da
heterozigosidade no cromossomo 6q23-25 foi encontrada em 76% dos casos de CACs
(LEIVO, 2006; CHEUK; CHAN, 2007). Também tem sido relatada a existência de mutações
mitocondriais nestes tumores, as quais seriam importantes para a carcinogênese dos mesmos
Clinicamente, esta neoplasia manifesta-se como uma massa de tecido, por vezes,
nodular, de consistência endurecida, geralmente de crescimento lento e indolor. Entretanto, a
sintomatologia dolorosa pode estar presente pelo fato do tumor ser infiltrativo nos tecidos e
realizar invasão perineural e, em alguns casos, intraneural. Outra característica é que são
circunscritos, porém não encapsulados e o comportamento clinico é agressivo, com relatos de
altas taxas de recorrência e metástases distantes principalmente para pulmões, cérebro e ossos.
Metástases tardias são comuns e podem ocorrer mesmo depois de vários anos de ressecção do
tumor primário (SUNG et al., 2003; EL-NAGGAR; HUVOS, 2005; ZHANG; PENG, 2007;
SOARES et al., 2008; TIAN et al., 2010).
Histologicamente, o CAC compõe-se de células epiteliais ductais e mioepiteliais
modificadas que se arranjam em três padrões morfológicos distintos: cribriforme, tubular e
sólido. O primeiro caracteriza-se pela presença de células que variam de arredondadas à
cuboidais com núcleo basofílico, arranjadas em lençóis, contendo diversos espaços
pseudocísticos de tamanhos uniformes, lembrando cilindros ou aspecto de queijo suíço, que
contêm no seu interior material que pode variar de basofílico a eosinofílico. No padrão tubular
as células epiteliais se arranjam predominantemente em vários ductos ou túbulos de tamanho
variados e individualizados por tecido conjuntivo fibroso vascularizado. Já a variante sólida
exibe lençóis de células basofílicas arranjadas compactamente, com pouca tendência para
formar espaços pseudocísticos ou tubulares. Em alguns casos, os três padrões podem estar
presentes em uma mesma lesão, em proporções diferentes (PEREZ-ORDENEZ, 2003; JIA et
al., 2004; EL-NAGGAR; HUVOS, 2005; SOPRANI et al., 2007).
De acordo com os padrões morfológicos descritos anteriormente, os CACs têm sido
divididos em três níveis de gradação histológica que estão associadas ao prognóstico da lesão.
O grau I são os tumores que exibem padrão predominantemente tubular, com áreas
cribriformes. Geralmente possuem comportamento menos agressivo e bom prognóstico. O
grau II exibe o padrão cribriforme predominante, com áreas tubulares e algumas áreas sólidas
dispersas. As lesões de grau III caracterizam-se pelo predomínio do padrão sólido e
geralmente são mais agressivos, com prognóstico reservado (EL-NAGGAR; HUVOS, 2005;
SOPRANI et al., 2007; MALHOTRA; AGRAVAL; PANDEY, 2009).
2.1.4 Carcinoma Mucoepidermóide
Dentre os tumores malignos de glândula salivar, o CME tem se evidenciado como o
carcinoma mucossecretor e carcinoma epidermóide misto também foram utilizadas para
designar esta neoplasia (GOODE; EL-NAGGAR, 2005; WHITT; SCHAFER; CALLIHAN,
2008). Os casos documentados em glândulas salivares maiores ocorrem nesta ordem
decrescente de acometimento: parótida, submandibular e sublingual. Entretanto, a maioria dos
casos vem sendo registrados em glândulas salivares menores preferencialmente as do palato,
mucosa jugal, lábios, região retromolar e língua (PIRES et al., 2002;
GONZÁLEZ-ARRIAGADA et al., 2011).
A etiologia ainda não está bem esclarecida, mas fatores genéticos, exposição à
radiação ionizante e fumo são citados como importantes (FLORIAN et al., 2008; LIU et al.,
2009). Alguns estudos acerca das alterações genéticas em CMEs são descritos na literatura.
Mutações no gene H-ras tem sido reportadas, especialmente no códon 12 e/ou 13 em tumores
de alto grau de malignidade (GOODE; EL-NAGGAR, 2005). Translocações entre os genes
MECT1 (do inglês, mucepidermoid carcinoma translocated gene-1) e o gene MAML2 (do
inglês, mastermind-like) e produtos transcritos tem sido identificados nestes tumores, sendo
estes, possivelmente, contribuintes para o desenvolvimento destas lesões (GOODE;
EL-NAGGAR, 2005). Da mesma forma, o estudo de Bell et al. (2008) relata a fusão dos genes
MECT1 e MAML2 como sendo base para a carcinogênese em alguns tumores, incluindo o
CME.
Durante a revisão de 6.982 casos de neoplasias de glândula salivar, Tian et al. (2010)
encontraram que de 2.239 tumores malignos, 673 (30%) receberam o diagnóstico de CMEs.
As lesões estavam localizadas preferencialmente em mucosa do palato, parótida e glândulas
salivares menores da mucosa jugal. Houve uma ligeira predileção pelo sexo feminino e a
média de idade foi de 47 anos. Dos 599 tumores revisados por Oliveira et al. (2009), 30 casos
(5%) corresponderam a CMEs e o sítio de predileção foram glândulas salivares menores e
parótida. Houve ligeira predileção pelo sexo feminino e a média de idade foi 38 anos.
O CME manifesta-se como um aumento de volume geralmente assintomático, com
evolução rápida, sólido à palpação e fixo aos tecidos adjacentes, de formato nodular e
coloração que pode variar do azulado ao vermelho ou púrpura. Estas diferentes colorações são
atribuídas aos espaços císticos presentes na lesão tumoral que podem conter produtos de
degradação sanguínea ou ainda estase vascular associada ao tumor (FLORIAN et al., 2008).
Em alguns casos, sua forma de apresentação clínica pode simular processos não neoplásicos
ou até inflamatórios, exibindo ulceração, dor e parestesia (PIRES et al., 2002; NAGEL et al.,
Do ponto de vista histopatológico, CMEs são formados por células mucosas,
epidermóides e intermediárias, podendo ainda exibir células claras, cúbicas, cilíndricas altas e
de aspecto oncocítico. As células mucosas possuem citoplasma amplo, variando de coloração
pálida a ligeiramente eosinofílica, aspecto espumoso, exibindo francas áreas de material de
secreção. As células intermediárias podem variar em aparência e tamanho, desde pequenas,
por vezes de aspecto basalóide até uma aparência epidermóide. As células epidermóides por
sua vez exibem citoplasma eosinofílico abundante, com morfologia variando de arredondada
a oval, podendo assumir formato alongado poligonal e em outras áreas podem se mostrar
como células escamosas maduras (AUCLAIR; GOODE; ELLIS, 1992; ELLIS; AUCLAIR,
1996; PIRES et al., 2002).
Estes tipos celulares podem se arranjar solidamente na forma de ilhas, lençóis, ninhos
ou, ainda, forma de espaços císticos ou papilares císticos de diversos tamanhos revestidos, na
maioria das vezes, por células mucosas, embora os diversos tipos celulares citados
anteriormente possam ser encontrados. Estes espaços císticos ou microcísticos são separados
por tecido conjuntivo de densidade variada, podendo ainda exibir dilatações amplas contendo
no seu interior secreção mucosa variando de ligeiramente basofílica à eosinofílica
(AUCLAIR; GOODE; ELLIS, 1992; ELLIS; AUCLAIR, 1996; PIRES et al., 2002;
AZEVEDO et al., 2008).
Para realizar a gradação histológica do CME, alguns parâmetros microscópicos são
analisados tais como, presença de espaços císticos, invasão neural, necrose, mitoses e
anaplasia. Ao mesmo tempo são atribuídas pontuações para cada um destes parâmetros. De
acordo com estas características e a soma de suas respectivas pontuações os CMEs dividem-se
em baixo, intermediário e alto grau de malignidade (Quadro1) (OMS, 2005)
Característica histológica Pontuação
Componente cístico < 20% +2
Invasão neural +2
Necrose +3
Mitoses (4 ou + por 10 campos em grande aumento) +3
Anaplasia +4
Grau Histológico Pontuação
Baixo grau 0-4 Grau Intermediário 5-6 Alto grau 7 ou mais
Quadro 1. Características histopatológicas e valores de pontuação utilizados para a gradação do CME de acordo
CMEs de baixo grau exibem formação de espaços císticos abundantes revestidos
predominantemente por células mucosas com áreas associados às células intermediárias e
recebem escore de pontuação até 4. Os de grau intermediário exibem formações de espaços
císticos menos frequentes associadas à células intermediárias e epidermóides, exibindo escore
de pontuação de 5-6 e os de alto grau exibem células epidermóides predominantes além das
células mucosas arranjadas num padrão sólido, com escassas formações císticas, recebendo
escore de pontuação igual ou superior a 7 (AUCLAIR; GOODE; ELLIS, 1992; GOODE;
AUCLAIR; ELLIS, 1998; GOODE; EL-NAGGAR, 2005).
Outros critérios morfológicos têm sido sugeridos para realizar a gradação histológica
de CMEs naqueles casos em que a totalidade do tumor não pode ser avaliada, não podendo,
dessa forma, serem analisados todos os critérios propostos pela OMS. Brandwein et al.,
(2001) propuseram alguns parâmetros para que se realize a gradação histológica nestes casos
(Quadro 2).
Achados Característicos Características que definem o grau
Grau I Células mucosas predominantes; células intermediárias e formações císticas podem ser proeminentes e padrão de crescimento circunscrito.
Ausência de características do Grau III e do padrão
agressivo de invasão
pequenas ilhas presentes no front de tumoral.
Grau II Células intermediárias predominantes sobre células mucosas, sendo a maior parte em arranjo mais sólido, células escamosas podem ser vistas.
Padrão agressivo de invasão, ausência de características definidas do grau III.
Grau III Predominância de células escamosas, células intermediárias e mucosas também devem estar presentes a maioria em arranjo tumoral sólido.
Necrose, invasão vascular, óssea e perineural, >4 mitoses por 10 campos em maior aumento, alto grau de pleomorfismo nuclear.
A maioria dos estudos tem buscado associar a gradação histológica ao prognóstico
dessas lesões. Tumores de baixo grau, geralmente, têm um melhor prognóstico com taxas de
sobrevida de 95% em 10 anos. Já os tumores de grau intermediário e de alto grau, possuem
maior tendência para infiltrar, recidivar e produzir metástases. Estima-se que a sobrevida para
CMEs de alto grau seja de 35% em 10 anos (PIRES et al. 2002; GOODE; EL-NAGGAR,
2005; KOLOKITHAS et al. 2010). O tratamento de escolha para este tumor é essencialmente
cirúrgico com margem de segurança, podendo ser ainda associada a esvaziamento de
linfonodos regionais em caso de metástases para estas estruturas. A associação a outras
modalidades, como a radioterapia, pode auxiliar no tratamento, principalmente naqueles
tumores classificados como de alto grau de malignidade (PIRES et al. 2002; GOODE;
EL-NAGGAR, 2005; LIMA et al.2005; WHITT; SCHAFER; CALLIHAN, 2008).
2.2 METABOLISMO ENERGÉTICO DAS CÉLULAS NEOPLÁSICAS
A glicose, também denominada glucose ou dextrose é a fonte primária de energia para
todos os tipos celulares em humanos e um dos principais produtos advindos do processo de
fotossíntese. Bioquimicamente é classificada como um carboidrato do tipo monossacarídeo,
solúvel em água, formada por 6 átomos de carbono ligados a 12 átomos de hidrogênio e 6 de
oxigênio, apresentando a seguinte fórmula química C6H12O6 (MACHADO, 1998; VOET; VOET; PRATT, 2000; CAMPBELL; FARREL, 2007).
Existem dois processos metabólicos pelos quais as células do organismo humano
podem, através da glicose, obter energia visando manter sua arquitetura normal e realizar suas
funções vitais: glicólise aeróbica e anaeróbica (fermentação láctica). Na via aeróbica o
processo de obtenção de energia é altamente complexo, onde através de reações bioquímicas
ordenadas em glicólise, ciclo de Krebs e fosforilação oxidativa, as células obtém cerca de 36
ATPs (Adenosina Trifosfato), além de baixa produção de gás carbônico e água. Em condições
de baixas tensões e privação temporária de oxigênio, estas mesmas células podem sintetizar
energia pela fermentação láctica, onde a quebra da glicose dá origem ao piruvato que
posteriormente é reduzido a lactato, que no seu metabolismo final origina apenas duas ATPs
por molécula de glicose, além de ácido láctico, cujo acúmulo é danoso aos componentes
celulares (FERREIRA, 2010; ŠMERC; SODJA; LEGIŠA, 2011).
Células tumorais malignas possuem como característica comum a alteração do
metabolismo energético, passando de glicólise aérobica para anaeróbica com alto consumo da
glicose disponível nos tecidos, mesmo havendo a presença de oxigênio. Otto Warburg foi o
pioneiro a estudar o aspecto metabólico de células neoplásicas malignas e a partir de então
esta mudança na síntese de energia passou a ser designada de “efeito Warburg” (KOPPENOL;
BOUNDS; DANG, 2011). Posteriormente, ficou comprovada a existência de um menor teor
de glicose livre nos tecidos tumorais de diversas neoplasias devido aos seus maiores
Pesquisas relacionando oncogenes que provavelmente levam a esta mudança no
padrão fenotípico metabólico de aerobiose para anaerobiose mesmo na presença de oxigênio
tem sido relatadas, principalmente as mutações em genes que envolvem fatores que ativam o
metabolismo da glicose primeiramente facilitando sua captura dos tecidos para o interior das
células através da proteína transportadora de glicose tipo-1 (GLUT-1) e a ativação e
estabilização dos fatores que induzem a hipóxia que por sua vez auxiliam no aumento da
síntese de enzimas glicolíticas que trabalham na glicólise anaeróbica (SCHOPPMANN et al.,
2006; CHE et al., 2011; ŠMERC; SODJA; LEGIŠA, 2011).
2.2.1 Proteína transportadora de glicose tipo 1 (GLUT-1)
Uma características comum a todas as células é a capacidade de transporte de glicose
do meio extracelular para o intracelular através de sua membrana plasmática (MUECKLER,
1994). A glicose é uma molécula polar, insolúvel na membrana plasmática e, como citado
anteriormente, necessária para reações oxidativas e não oxidativas que culminam com a
produção de energia pelas células na forma de ATP. Para realizar a função do transporte da
glicose, a maioria das células possui dois tipos de proteínas carreadoras: os transportadores de
glicose ligados ao sódio (Na+SGLT) e as proteínas transportadoras de glicose. Os Na+SGLT
transportam glicose acoplando sua captura juntamente com o sódio e estão localizados em
tecidos como os do intestino e túbulos renais (BELL et al., 1990; MACHADO, 1998;
SCHEEPERS et al., 2004). A GLUTs realizam o carreamento da glicose através da difusão
facilitada, um tipo de transporte passivo, assegurando desta forma o suprimento constante de
glicose nas células para suas reações bioquímicas (OLSON; PESSIN, 1996).
As GLUTs constituem uma grande família com cerca de 14 membros detectados até o
momento (THORENS; MUECKLER, 2010). Estas são codificadas por genes denominados
GLUTs e são numeradas em algarismos arábicos de acordo com sua ordem de descoberta,
suas diferentes funções no mecanismo de transporte de glicose e o tipo de tecido onde se
distribuem (WOOD; TRAYHURN, 2003). Desta família, as mais bem elucidadas
correspondem as que vão da numeração 1 ao 12 e 14 (CARRUTHERS, 1990; WOOD;
TRAYHURN, 2003).
A primeira proteína facilitadora do transporte de glicose a ser identificada e isolada a
partir de células hepáticas foi denominada GLUT-1, que é codificada pelo gene de mesmo
nome, localizado no cromossomo 1 (1p35.31.3). Distribui-se amplamente no tecido cerebral e
muscular (WOOD; TRAYHURN, 2003). Desde então, pelo fato de se localizarem
principalmente no sistema nervoso central, a estrutura conformacional desta proteína vem
sendo bastante estudada visando correlacioná-la melhor com seu mecanismo de ação, visto
que a regulação destas proteínas poderia combater os efeitos da obstrução arterial nas células
neuronais e também em cardiomiócitos. Entretanto, pouco se sabe ainda sobre sua
característica estrutural, mas, postula-se que as proteínas deste grupo tenham 12 hélices das
quais 5 ou 6 associam-se lado a lado formando um cilindro hidrofóbico envolvendo um canal
hidrofílico, que atravessa a membrana plasmática, através do qual a glicose é transportada do
fluido extracelular para o citosol (Figuras 1 e 2) (VOET; VOET, PRATT, 2000; SULS et al.,
2008; THORENS; MUECKLER, 2010).
Figura 1 – Modelo estrutural bidimensional das GLUTS com 12 hélices transmembrânicas hidrofóbicas, inseridas na porção lipídica da membrana plasmática e domínios terminais NH2 e COOH intracelulares.
As GLUTs possuem sítios de ligação de ambos os lados da membrana. A glicose se
liga no lado extracelular da membrana ocorrendo neste instante a mudança conformacional da
proteína transportadora que oclui o seu primeiro sítio de ligação expondo a molécula de
glicose do lado citosólico. A glicose então se dissocia da proteína havendo nesta hora a
reversão do transportador de glicose a sua conformação habitual, como revela a figura 3
(VOET; VOET, PRATT, 2000).
FONTE: Voet; Voet; Pratt, (2000)
Figura 3 – Modelo esquemático simples para o transporte de glicose através da membrana.
Figura 2 – Modelo estrutural do canal central transmembranar polar que cria a possibilidade da instalação de pontes de hidrogênio com a glicose à medida que ela se move através do canal.
Estudos imuno-histoquímicos têm demonstrado nível de expressão aumentado da
GLUT-1 em tumores malignos originados em diversos órgãos e tecidos como mucosa oral,
esôfago, tireóide, ovários, mama e osso, evidenciando ainda nestes casos sua forte associação
com um prognóstico ruim (AIRLEY et al., 2001; MATSUZU et al. 2004; CHOI et al. 2007;
ENDO et al. 2007; AYALA et al. 2010).
Mori et al. (2007) analisaram a expressão imuno-histoquímica da GLUT-1 em tumores
de glândulas salivares benignos e malignos, bem como em amostras de tecido glandular
normal, obtendo como resultado sua não expressão em tecidos normais, baixo nível de
expressão em tumores benignos e altos níveis de expressão em tumores malignos,
evidenciando desta forma a alteração do metabolismo energético quando tecidos glandulares
salivares normais tornam-se neoplásicos. Dados semelhantes foram encontrados no estudo de
Bonfitto et al. (2010) onde na análise de CACs com áreas de transformação para alto grau,
verificaram que nestas áreas houve maior nível de expressão da GLUT-1 quando comparadas
com as áreas convencionais destes mesmos tumores. Resultados semelhantes foram
encontrados por Demasi et al. (2010) que ao estudarem casos de CMEs constataram que os
tumores que de alto grau de malignidade exibiam maior expressão de GLUT-1 do que os de
baixo e médio grau, demonstrando assim que quanto mais agressivo o tumor, maior a
expressão desta proteína.
2.3 ANGIOGÊNESE EM TECIDOS NEOPLÁSICOS
Reconhecidamente, o processo de formação de vasos sanguineos é um fator
importante para que haja crescimento e progressão tumoral (ZHANG; PENG, 2007; SHIEH et
al., 2009; KUMAR; ABBAS; FAUSTO, 2011). Existem dois mecanismos orgânicos
fisiológicos e patológicos através dos quais se obtêm uma rede capilar bem desenvolvida:
vasculogênese e angiogênese. Na vasculogênese células angioblásticas precursoras de células
endoteliais estabelecem uma rede vascular primitiva. Já na angiogênese uma nova rede capilar
é formada a partir do estímulo às células endoteliais de uma rede primitiva pré-existente,
sendo por este motivo também denominada neoangiogênese ou ainda neovascularização
(CLAPP et al., 2009; NIKITENKO, 2009; UCUZIAN et al., 2010).
A angiogênese é um processo complexo e dinâmico que envolve diversas vias de
sinalização intercelulares com a interação de fatores pró-angiogênicos e anti-angiogênicos
(Figura 5) (LALLA et al., 2003; KYZAS et al., 2005; SILVA et al., 2007; CLAPP et al.,
sanguíneo como preparação das mamas para lactação, ciclo reprodutivo feminino,
desenvolvimento embrionário e fetal. Também, se faz presente em processos patológicos,
como respostas inflamatórias, condições de isquemia parcial prolongada, crescimento tumoral
e metástase. Neste contexto é iniciada em resposta a hipóxia tecidual a qual desencadeia a
secreção de fatores angiogênicos compensatórios (LALLA et al., 2003; KUMAR; ABBAS;
FAUSTO, 2011).
Nos tecidos em estado de normalidade, as células endoteliais estão, geralmente, em
estado de repouso, pois secretam baixos níveis de fatores indutores e altos níveis de inibidores
de sua proliferação. Entre os principais reguladores pró-angiogênicos está o fator de
crescimento endotelial vascular (VEGF) e o fator de crescimento fibroblástico (FGF). O
VEGF se destaca como o fator indutor mais importante tanto na vasculogênese como na
angiogênese, sendo sintetizado e secretado por células mesenquimais, principalmente
fibroblastos e macrófagos. Caracteriza-se como um potente indutor de formação de vasos
sanguíneos no desenvolvimento inicial (vasculogênese) e tem papel central no crescimento de
novos vasos (angiogênese) em tumores, inflamação crônica e cicatrização de ferimentos. O
FGF pode ser secretado por macrófagos, mastócitos, células endoteliais e fibroblastos.
Apresenta-se nas formas de FGF-1 ou aFGF (ácido) e FGF-2 ou bFGF (básico) ambos
induzem a liberação de VEGF potencializando o mecanismo de angiogênese (FOLKMAN,
SHING, 1992; POON; FAN; WONG, 2001; ZHANG; PENG; CHEN, 2005; NETTO et al.,
2008).
A progressão de uma célula normal para malignidade envolve, entre outros fatores, a
capacidade da mesma de estimular a formação de novos vasos. Para isto, as células tumorais Figura 4 – Esquema simples da angiogênese a partir de rede vascular primitiva.
adquirem a capacidade de aumentar a secreção de fatores pró-angiogênicos e diminuírem a de
anti-angiogênicos. A maioria dos tumores, principalmente os sólidos, quando atingem ou
ultrapassam um volume de 2 mm2 passam a ter seu crescimento diretamente dependente de angiogênese (VOLPERT; DAMERON; BOUCK, 1997; NETTO et al., 2008).
Tem sido sugerido que o mecanismo pelo qual os fatores estimuladores e inibidores
ocorrem em tecidos neoplásicos esteja relacionado com a ativação de oncogenes ou inativação
de genes supressores de tumor que regulam fisiologicamente estes fatores; dentre estes tem
sido citados os membros da família FGF que induzem a angiogênese através da codificação
de aFGF e bFGF que são potentes estimuladores, bem como o oncogene ras que codifica
fatores de proliferação vascular como TGF-α e TGF-β, fator de crescimento insulínico-1
(IGF-1), fator de necrose tumoral alfa (TNF-α), fator estimulador de colônia de granulócito
(G-CSF), VEGF e prostaglandina E2, além de estimular a produção de moléculas
pró-angiogênicas da matriz extracelular. Por outro lado, a perda de um gene supressor tumoral
pode contribuir para a diminuição na produção de inibidores da angiogênese, causando efeito
estimulador na proliferação vascular (FOX; GASPARINI; HARRIS, 2001; SILVA et al.,
2007).
2.3.1 Mensuração da angiogênese e CD34
A atividade angiogênica pode ser mensurada em variados tumores e lesões não
neoplásicas através da análise qualitativa e/ou quantitativa de vasos imunomarcados por
anticorpos específicos. A avaliação qualitativa é realizada através da verificação de
intensidade de marcação (WAKULICH et al., 2002; FREITAS et al., 2005) enquanto a
análise quantitativa pode ser executada por meio da determinação da densidade microvascular
(MVD) que expressa a média de vasos por espécime; pela técnica de contagem microvascular
(MVC) ou ainda pelo volume microvascular (MVV) (MAEDA et al., 1995; VERMEULEN et
al., 2002; EL-GAZZAR; MACLUSKEY; OGEN, 2005; FREITAS et al., 2005).
A técnica de quantificação pela MVD consiste na seleção de três diferentes áreas de
maior densidade microvascular (“hot spots”) num aumento de 100x. Em outro momento, procede-se a contagem manual em microscopia de luz, em aumento de 200x em cada um dos
três campos, sendo a MVD expressa através do número de vasos por mm2. Nesta análise, células individuais ou grupo delas com ou sem lumens definidos que são separados por
células tumorais e por constituintes do tecido conjuntivo, são contabilizados como vasos
A contagem microvascular (MVC) é um método mais simples de ser empregado
exibindo bom valor prognóstico em tumores de cabeça de pescoço. A técnica consiste na
observação de cinco áreas de maior vascularização tecidual em aumento de 40x, em seguida
contam-se manualmente os vasos em aumento de 200x e o resultado é expresso pelo número
médio de vasos em cada secção histológica (MAEDA et al., 1995; FREITAS et al., 2005) .
A mensuração do volume microvascular (MVV) consiste em uma técnica para
determinação do volume dos microvasos. Em microscopia de luz, sob aumento de 200x, com
auxílio de uma ocular contendo retículo com 100 pontos marcados, são selecionados 15
campos aleatórios, totalizando 1.500 pontos. Em cada um destes campos, são quantificados os
vasos que coincidem com os pontos do retículo e o resultado é apresentado em porcentagem
de volume (PAZOUKI et al., 1997; SCHOR et al., 1998a)
Para imunomarcação de vasos, alguns marcadores biológicos têm sido utilizados tais
como fator de von Willebrand, CD31, CD34 e CD105, que têm afinidade por proteínas
específicas de células endoteliais, têm sido empregados para mensurar o índice de
angiogênese em diversas patologias, exibindo excelentes resultados de marcação e
funcionando como informação diagnóstica e prognóstica em diversas lesões proliferativas
neoplásicas e não neoplásicas (FOX; GASPARINI; HARRIS, 2001; SANDLUND et al.,
2006; NETTO et al., 2008).
O CD34 é uma glicoprotéina transmembrana presente em células endoteliais e
precursores hematopoiéticos e, de acordo com os protocolos estabelecidos no consenso
internacional acerca de critérios de avaliação em tumores, é um dos principais anticorpos
recomendados para identificação de vasos sanguineos em material parafinado (VERMEULEN
et al., 2002; BALUK; MACDONALD, 2008). O estudo da angiogênese através do marcador
anti-CD34 em tumores de cavidade oral tem sido alvo de algumas pesquisas e quando
positivo, funciona como marcador prognóstico (KADEMANI et al., 2009).
Em tumores de glândulas salivares, o estudo de Shi et al. (2007) em 75 casos de CMEs
evidenciou que a angiogênese, avaliada através do CD34, foi maior nos tumores localizados
em glândulas salivares menores do que naqueles originados em glândulas salivares maiores
assim como também em tumores em estágios mais avançados e de alto grau histológico.
Dados semelhantes foram encontrados nos estudos de Zhang; Peng e Chen (2005), onde a
análise da angiogênese em 80 casos de CACs revelou que o padrão histológico sólido exibiu
maior vascularização que os outros padrões, não havendo diferença significativa ente os
padrões cribriforme e tubular, assim como, também, em tumores que exibiam invasão
Da mesma forma Shieh et al. (2009) no estudo de 41 casos de CMEs observaram que
a imunomarcação de vasos pelo CD34 foi maior em tumores classificados como de grau
intermediário e alto grau do que nos de baixo grau de malignidade. Luukkaa et al., (2009)
estudaram a imunomarcação de vasos em CACs e CMEs e verificaram que a intensidade da
imunomarcação foi superior nos CMEs do que nos CACs e ainda muito mais intensa nos
casos classificados histologicamente como de alto grau de malignidade do que nos de baixo
3 PROPOSIÇÃO
Sabendo-se da importância da angiogênese e do metabolismo das células tumorais nos
processos neoplásicos, o objetivo da presente pesquisa foi analisar, através da
imuno-histoquímica, o índice angiogênico pelo CD34 em uma série de casos de Adenomas
Pleomórficos, Carcinomas Adenóides Císticos e Carcinomas Mucoepidermóides,
associando-o cassociando-om a expressãassociando-o da prassociando-oteína GLUT-1 pelas células tumassociando-orais afim de cassociando-orrelaciassociando-onar associando-os
achados da contagem microvascular ao metabolismo destas células bem como relacionar ao
comportamento clínico das lesões constantes do presente estudo, expresso pelos diferentes
graus histológicos apresentados por estas neoplasias.