ESTUDO DA EXPRESSÃO
IMUNO-HISTOQUÍMICA DAS MMPs -2, -7, -9
E -26 E DOS TIMPs -1 E -2 EM
ADENOMAS PLEOMÓRFICOS E
CARCINOMAS
ADENÓIDES
CÍSTICOS
DE
GLÂNDULAS
SALIVARES MENORES
ESTUDO
DA
EXPRESSÃO
IMUNO-HISTOQUÍMICA DAS MMPs -2, -7, -9 E -26
E DOS TIMPs -1 E -2 EM ADENOMAS
PLEOMÓRFICOS
E
CARCINOMAS
ADENÓIDES CÍSTICOS DE GLÂNDULAS
SALIVARES MENORES
Tese apresentada ao Colegiado do Programa
de Pós-Graduação em Patologia Oral da
Universidade Federal do Rio Grande do
Norte, como parte dos requisitos para
obtenção do Título de Doutor em Patologia
Oral.
Orientadora: Profª Drª Lélia Batista de Souza
Catalogação na Fonte. UFRN/ Departamento de Odontologia Biblioteca Setorial de Odontologia “ProfºăAlbertoăMoreiraăCampos”.
Freitas, Valéria Souza.
Estudo da expressão imuno-histoquímica das MMPs -2, -7, -9 e -26 e TIMPs -1 e -2 em adenomas pleomórficos e carcinomas adenóides císticos de glândulas salivares menores / Valéria Souza Freitas. – Natal, RN, 2011.
156 f. : il.
Orientador: Profa. Dra. Lélia Batista de Souza.
Tese (Doutorado em Patologia Oral) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral.
1. Adenoma pleomórfico – Tese. 2. Carcinoma adenóide cístico – Tese. 3. Metaloproteinases da matriz – Tese. 4. Inibidores teciduais de metaloproteinases – Tese. 5. Imuno-histoquímica – Tese. I. Souza, Lélia Batista de. II. Título.
Aos meus pais, Reginaldo (in memoriam) e Lila, pelo exemplo de amor e dedicação a família, e com quem aprendi os principais valores da vida: o amor, o desprendimento, a generosidade
e a simplicidade.
Ao meu querido amor Roberto e a Deus que com a sua imensa bondade permitiu este encontro que transformou a minha vida. Obrigada pelo seu amor, apoio incondicional, sabedoria, simplicidade e especialmente pelas incontáveis vezes que entendeu as minhas
ausências, compartilhou as minhas angústias e celebrou as minhas conquistas.
Aos meus irmãos, César, Bel e Eliene, pelo amor, carinho e pela alegria de viver juntos esta experiência terrena, em especial por cuidar da nossa mãe durante a minha ausência.
A minha sobrinha Larissa e as minhas afilhadas Érica e Geane pela oportunidade de aprender, mesmo sem a maternidade, sobre a pureza e os doces sentimentos da infância e adolescência.
A minha orientadora, Profa. Dra. Lélia Batista de Souza, pelo exemplo de dedicação a vida acadêmica e ao Programa de Pós-Graduação em Patologia Oral da Universidade Federal do Rio Grande do Norte (UFRN). O meu agradecimento especial pelos ensinamentos, atenção e
orientação dedicada durante todo o Curso de Doutorado.
Ao professor Dr. Leão Pereira Pinto pela dedicação ao Programa de Pós-Graduação em Patologia Oral. O meu agradecimento pelos ensinamentos, gentileza e
palavras de incentivo.
A Coordenação do Programa de Pós-graduação em Patologia Oral, em especial a professora Dra. Roseana de Almeida Freitas, o meu agradecimento pelo carinho, sensatez,
disponibilidade e ensinamentos.
Aos professores do Programa de Pós-Graduação em Patologia Oral, em especial a Dra. Lélia Maria Guedes Queiroz, Dr. Antônio de Lisboa Lopes Costa, Dra. Hébel Cavalcanti Galvão,
Dra. Márcia Cristina da Costa Miguel, Dra. Éricka Janine Dantas da Silveira e Dra. Ana Myrian Costa de Medeiros pela amizade e importante contribuição para a minha formação
acadêmica e profissional.
Aos professores Dr. Angelo Giuseppe Roncallie Dr. Kenio Costa Lima pelos ensinamentos,
colaboração na análise estatística durante os trabalhos das disciplinas e em especial por tornar mais interessante a estatística.
Ao professor Dr. Jean Nunes dos Santos, pelo tão presente apoio e em especial pela amizade sincera, incentivo e pelos ensinamentos. O meu agradecimento por contar sempre com a sua
colaboração, especialmente na criação do nosso desejado Laboratório de Patologia Oral da Universidade Estadual de Feira de Santana (UEFS).
A minha orientadora do Mestrado, professora Dra. Eneida de Moraes Marcílio Cerqueira. O meu muito obrigado pela sua contribuição na minha formação acadêmica e por proporcionar-me um encantamento especial pela Genética, na sempre gentil e agradável
Ao professor Dr. Benedicto Alves de Castro Silva pela gentileza, sabedoria e ensinamentos proporcionados durante todos estes anos de tão agradável convívio. Em especial, por ser o mentor e colaborar no nosso sonho em fundar o Núcleo de Câncer Oral (NUCAO) da UEFS.
Em todos estes anos de voluntariado no Hospital Aristides Maltez, o senhor sempre foi um exemplo de dedicação a profissão e amor ao próximo. Ao senhor a nossa eterna gratidão.
As minhas amigas irmãs Cristina Ruan e Betânia Fachetti pela amizade, cuidado zeloso, carinho, disponibilidade e incentivo de todas as horas.
Ao meu irmão de orientação Pedro, pela amizade, ajuda despretenciosa durante todo o Curso, disponibilidade e em especial pela simplicidade em compartilhar o seu saber.
Aos meus colegas da turma de Doutorado com quem sempre pude contar em todos os momentos do Curso. Ao carinho e delicadeza de Bruna Amaral. A Bruna Rafaela com quem
compartilhei muitos dos seminários das disciplinas, pelas doces palavras de incentivo que sempre acalmaram o meu coração. A Alexandre pelos agradáveis momentos de convivência e
alegria. A Cassiano pelo aprendizado com a troca de experiências.
Aos meus colegas das turmas de Mestrado e Doutorado, Felipe, Thais, Maiara, Emeline, Joabe, Cyntia, Dimitri, Domingos, Marta, Marcelo, Adriana, Deborah, Ruth, Alessandra, Ana
Rafaela, Pollianna, Karuza, George e Janaína, pelo acolhimento, carinho, disponibilidade e amizade. Um agradecimento carinhoso e saudoso a Marianne pelos inesquecíveis momentos de amizade e alegria compartilhados durante parte do Curso. A Águida pela amizade, atenção
e delicada companhia. A Keila pela atenção, carinho e agradável convivência.
Ao colega professor Dr. Manoel Antonio Gordón Núñez pela tão presente gentileza, atenção e carinho de todos os momentos.
Aos funcionários do Programa de Pós-graduação em Patologia Oral, Gracinha, Idelzuíte, Sandrinha, Lourdinha, Hévio e Canindé pela dedicação ao trabalho, colaboração constante e
As bibliotecárias da Biblioteca Setorial de Odontologia da UFRN, Cecília Isabel dos Santos e Mônica Karina Santos Reis pela elaboração da ficha catalográfica e revisão das referências.
As bolsistas de Iniciação Científica da Base de Pesquisa em Patologia Oral da UFRN, Andrea Barros, Carla Samily, Mila Fontes, Marcel Costa e Marília Queiroga pela colaboração
nos trabalhos científicos durante o Curso.
Aos meus colegas professores da UEFS e colaboradores do NUCAO, Márcio Campos, Nilton César Nogueira, Maria Emília Ramos, Fernando Bastos, Arlei Cerqueira, Michelle Miranda,
Maria do Carmo Nagahama, Tarsila Ramos, Bruno Cantharino e Gabriela Botelho pela substituição nas atividades de ensino, pesquisa e extensão que permitiram a conclusão deste
Curso.
A todos os meus colegas da Área de Odontologia Preventiva e Social e em especial a Joildo Guimarães e Técia Daltro pela amizade e carinho de todos os momentos.
As funcionárias da clínica da UEFS Rita Jeane e Zoraide pelo cuidado e carinho dispensado aos nossos pacientes. As funcionárias do Departamento de Saúde e do Colegiado do Curso de
Odontologia, Jailda Barreto, Jocely Almeida, Daniela Porto e Viviane Simas pela gentileza, disponibilidade e atenção dispensada durante o período de afastamento para o Doutorado.
Aos meus pacientes do NUCAO, pela oportunidade de aprender sobre a trasitoriedade de todas as coisas e a singeleza da vida. Neste convívio singular foi possível refletir sobre o mais básico dos ensinamentos do Mestre Jesus, que não estamos aqui para sermos servidos,
mas apenas para servir. Espero sempre ser digna da confiança e puder serví-los com simplicidade e amor. Para vocês um agradecimento muito especial.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo
SUMÁRIO
LISTA DE ILUSTRAÇÕES RESUMO
SUMMARY
1 INTRODUÇÃO... 24
2 REVISÃO DA LITERATURA... 27
2.1 Adenoma pleomórfico... 27
2.2 Carcinoma adenóide cístico... 31
2.3 Invasão, metástase tumoral e matriz extracelular ... 36
2.4 Metaloproteinases da matriz... 38
2.4.1 MMPs -2 e -9 (gelatinases A e B) ... 40
2.4.2 MMPs -7 e -26 (matrilisinas 1 e 2) ... 45
2.4.3 Regulação das metaloproteinases da matriz e seus inibidores teciduais... 50
2.4.4 Metaloproteinases da matriz e inibidores teciduais de metaloproteinases em tumores de glândulas salivares... 53
3 PROPOSIÇÃO... 61
4 MATERIAL E MÉTODOS... 63
4.1 Implicações éticas... 63
4.2 Caracterização do estudo... 63
4.3 População... 63
4.4 Amostra... 63
4.5 Estudo morfológico... 63
4.6 Estudo imuno-histoquímico... 64
4.7 Análise do perfil imuno-histoquímico... 67
4.8 Análise estatística... 68
5 RESULTADOS... 70
5.1 Caracterização da amostra... 70
5.2 Análise morfológica... 73
5.2.1 Adenomas pleomórficos... 73
5.2.2 Carcinomas adenóides císticos... 80
5.3 Análise imuno-histoquímica... 84
5.3.2 Análise da imunoexpressão das matrilisinas... 95
5.3.3 Análise da imunoexpressão dos inibidores teciduais das metaloproteinases... 101
6 DISCUSSÃO... 109
7 CONCLUSÕES... 125
REFERÊNCIAS... 127
LISTA DE ILUSTRAÇÕES
QUADROS
Quadro 1. Clone, especificidade, diluição, fonte, recuperação antigênica e tempo de incubação dos anticorpos utilizados... 66 Quadro 2. Análise da imunoexpressão nos espécimes de adenoma pleomórfico e carcinoma adenóide cístico, baseado no percentual de células imunopositivas... 67 Quadro 3. Análise da imunoexpressão nos espécimes de adenoma pleomórfico e
carcinoma adenóide cístico, baseado na intensidade de
coloração... 68 TABELAS
Tabela 15. Coeficiente de Correlação de Spearman para a análise de correlação entre a intensidade de expressão dos inibidores teciduais das metaloproteinases (TIMPs-1 e -2) e variáveis clínicopatológicas em adenomas pleomórficos de glândulas salivares menores, Natal, RN. 2011... 106 Tabela 16. Coeficiente de Correlação de Spearman para a análise de correlação entre a intensidade de expressão dos inibidores teciduais das metaloproteinases (TIMPs-1 e -2) e características clínicopatológicas em carcinomas adenóides císticos de glândulas salivares menores, Natal, RN. 2011... 107 FIGURAS
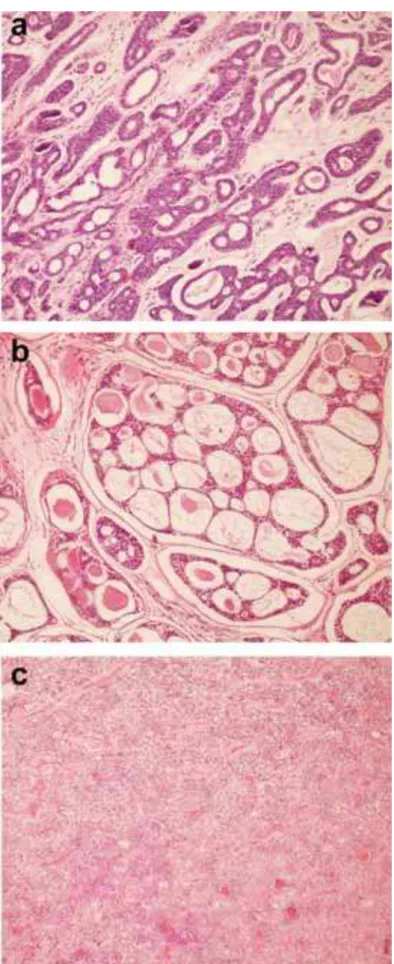
Figura 9. Forte expressão citoplasmática da MMP-2 em células tumorais e estromais
de adenoma pleomórfico de glândulas salivares menores
Lista de abreviaturas e siglas
ADAM-28 - adamalisina-28
AP - adenoma pleomórfico
AP-1 - do inglês, activating protein 1
AP-2 - do inglês, activating protein 2
Apo-CII - apoliproteína CII
Arg81 - aminoácido arginina
CAC - carcinoma adenóide cístico
CCND1 - gene da ciclina D1
CTNNB1 - do inglês, catenin, cadherin-associated protein, beta 1
EGF - do inglês, human epidermal growth factor
EGFR - do inglês, human epidermal growth factor receptor
EGFR2 - do inglês, human epidermal growth factor receptor 2
EMMPRIN - do inglês, extracellular matrix metalloproteinase inducer
FasL - Fas-ligante
FZ-7 - do inglês, frizzled-7
H/E - hematoxilina/eosina
HER-2/neu - receptor do fator de crescimento epidérmico humano do tipo 2
His81– aminoácido histidina
HMGA2 - do inglês, high mobility group AT-hook 2
HMGIC do inglês, high-mobility group nonhistone chromosomal - protein isoform I-C
ICAM-1 - do inglês, intercellular adhesion molecule 1
IGFBP-1 - do inglês, insulin-like growth factor-binding protein 1
LEF - do inglês, lymphoid enhancer-binding factor
LIFR - do inglês, leukemia inhibitory factor receptor
LOH - do inglês, loss of heterozygosity
MEC - matriz extracelular
MB - membrana basal
MMP - metaloproteinases da matriz
NF-B - do inglês, nuclear factor kappa-light-chain-enhancer of activated B cells
NGF - do inglês, nerve growth factor
p53 - proteína p53
PEA3 - do inglês, activator enhancer polyoma 3
PLAG 1 - do inglês, pleiomorphic adenoma gene 1
pRb - proteína retinoblastoma
pró-HB-EGF - do inglês, heparin-binding EGF-like growth factor
RT-PCR - do inglês real-time quantitative reverse transcription-polymerase chain
reaction
SISH - do inglês, silver enhanced in situ hybridization
SOX-4 - do inglês, transcription factor SOX-4
SP-1, ISRE - do inglês, interferon stimulated response element
Tcf4 - do inglês, transcription factor 4
TGF- - do inglês, transforming growth factor-beta
TNF- - do inglês, tumor necrosis factor-alpha
TGS - tumores de glândulas salivares
TIE - do inglês, tyrosine kinase with immunoglobulin-like and EGF-like domains
TIMP - inibidores teciduais de metaloproteinases
TrkA - receptor neurotrofina tirosina cinase A
VEGF - do inglês, vascular endothelial growth factor
VCAM-1 - do inglês, vascular cell adhesion protein 1
YB-1 - do inglês, Y box binding protein 1
RESUMO
O balanço entre a expressão das metaloproteinases da matriz (MMPs) e seus inibidores teciduais (TIMPs) tem sido relacionado a vários processos fisiológicos e patológicos, incluindo a morfogênese de glândulas salivares e os processos de invasão e metástase tumoral. O adenoma pleomórfico (AP) e o carcinoma adenóide cístico (CAC) representam, respectivamente, neoplasias benignas e malignas de glândulas salivares que, embora compartilhem a mesma origem celular, apresentam comportamentos biológicos distintos. O propósito deste estudo foi comparar a expressão imunohistoquímica das MMPs 2, 7, 9 e -26 e dos TIMPs -1 e -2 em casos de AP e CAC de glândulas salivares menores. Vinte casos de AP e vinte casos de CAC foram avaliados quanto à presença, intensidade e localização das MMPs e TIMPs no parênquima tumoral. A maioria dos APs e CACs apresentaram alta expressão das MMPs e dos TIMPs, predominantemente localizada nas células tumorais. Não houve diferença estatisticamente significativa na expressão das MMPs -2 (p=0,359), -7 (p=0,081) e -26 (p=0,553), bem como dos TIMPs -1 (p=0,657) e -2 (p=0,248), entre o parênquima dos APs e CACs. A MMP-9 demonstrou uma diferença significativa de expressão entre os dois tumores, apresentando o CAC uma marcação mais intensa para esta gelatinase (p=0,041). A forte expressão da MMP-9 observada no parênquima dos CACs sugere que esta gelatinase possa desempenhar um papel importante no comportamento biológico destes tumores. Por outro lado, apesar de não ocorrer uma diferença significativa entre as médias das MMPs -2, 7 e 26 nos tumores estudados, os dados quando analisados em conjunto sugerem que estas proteases podem estar participando de processos de remodelação tecidual em ambos os tumores, mas não apresentam uma relação direta com o padrão de agressividade do CAC. Entretanto, as matrilisinas poderiam influenciar indiretamente o comportamento deste tumor devido a sua capacidade de ativar a MMP-9, fortemente expressa no parênquima destes tumores.
SUMMARY
The balance between the expression of matrix metalloproteinases (MMPs) and their tissue inhibitors (TIMPs) has been related to various physiological and pathological processes, including salivary gland morphogenesis and tumor invasion and metastasis processes. Pleomorphic adenoma (PA) and adenoid cystic carcinoma (ACC) respectively represent benign and malignant neoplasias of salivary glands. Although they share the same cell origin, they present distinct biological behavior. The aim of this study was to compare the immunohistochemical expression of MMPs -2, -7, -9 and -26, and of TIMPs -1 and -2, in cases of PA and ACC of minor salivary glands. Twenty cases of PA and twenty cases of ACC were assessed according to the presence, intensity and location of MMPs and TIMPs in the tumor parenchyma. Most of the PAs and ACCs presented a high expression of MMP -2, -7, -9 and -26 and of TIMP -1 and -2, predominantly located in tumor cells. There was no significant difference in the expression of MMPs -2 (p=0.359), -7 (p=0.081) and -26 (p=0.553), as well as of TIMPs -1 (p=0.657) and -2 (p=0.248), between the parenchyma of PAs and ACCs. However, MMP-9 showed a significant difference of expression between the two tumors, with the ACC showing more intense marking for this gelatinase (p=0.041). The strong expression of MMP-9 observed in the parenchyma suggests that this gelatinase may play an important role in the biological behavior of these tumors. On the other hand, although there was no significant difference between the marking of MMP -2, 7 and 26 in the studied tumors, the data, when analyzed as a whole, suggest that these proteases may take part in the process of tissue remodeling in both tumors, but do not present a direct relation with the pattern of aggressiveness of ACC. Nonetheless, matrilisins may indirectly influence the behavior of this tumor due to their capacity of activating MMP-9, strongly expressed in the parenchyma of ACC.
1 INTRODUÇÃO
Os tumores de glândulas salivares (TGS) ainda que incomuns, compreendem uma importante área da Patologia Oral. A ampla variedade de comportamento biológico e a grande diversidade morfológica que estes tumores apresentam, suscitam, muitas vezes, dificuldades de diagnóstico, classificação e tratamento (SPEIGHT, BARRETT, 2002; SPEIGHT, 2007).
O adenoma pleomórfico (AP) é o tumor benigno de maior incidência em glândulas salivares, representando cerca de 60% das neoplasias desta localização (EVESON et al., 2005). Estes tumores destacam-se ainda pelo risco de transformação maligna, que pode variar entre 6 a 13% dos casos (GNEPP, 1993; ELLIS, AUCLAIR, 1996). Sua etiologia e patogênese ainda permanecem incertas. Análises citogenéticas têm identificado translocações cromossômicas recorrentes, com pontos de quebra principalmente no 8q12, 3p21 e 12q13-15, envolvendo respectivamente, o PLAG 1 (do inglês, pleiomorphic adenoma gene 1), CTNNB1 (do inglês, catenin, cadherin-associated protein, beta 1) e HMGA2 (do inglês, high mobility group AT-hook 2) (CHEUK, CHAN, 2007; VAN DICK et al., 2007).
O carcinoma adenóide cístico (CAC) constitui uma neoplasia de ocorrência rara, correspondendo a menos de 1% de todos os tumores malignos da região de cabeça e pescoço (DODD, SLEVIN, 2006) e aproximadamente 4% a 14,5% dos tumores de glândulas salivares em geral (ELLIS, AUCLAIR, 1996; LIMA et al., 2005). É caracterizado por crescimento indolente, porém, persistente, podendo evoluir para metástase tardia à distância (JIA et al., 2004).
As metaloproteinases da matriz (MMPs) constituem uma grande família de endoproteinases dependentes de zinco secretadas por vários tipos celulares e responsáveis por uma variedade de eventos proteolíticos. Dentre os mecanismos de controle das atividades proteolíticas das MMPs destaca-se a ação dos inibidores teciduais de metaloproteinases (TIMPs). Sob condições fisiológicas, as MMPs estão envolvidas em muitas funções incluindo migração celular, crescimento neural, cicatrização de feridas e morfogênese de órgãos epiteliais, sendo também consideradas como fatores cruciais na invasão e metástase de muitos cânceres humanos (NAGEL et al., 2004; MONAGHAN et al., 2007). Além disto, elas desempenham importantes funções na regulação da comunicação celular e processamento de moléculas bioativas, como receptores de superfície celular, citocinas, hormônios, moléculas de adesão e fatores de crescimento (UITTO et al., 2003; SORSA et al., 2004).
também têm sido desenvolvidas buscando compreender o papel destas MMPs em lesões de origem em glândulas salivares. O papel das MMPs -2 e -9 foi pesquisado na patogênese da Síndrome de Sjögren (AZUMA et al., 1997; AZUMA et al., 2000; PEREZ et al., 2005). Além disso, outros estudos foram realizados em neoplasias benignas e/ou malignas de glândula salivar (KAYANO et al., 2004; NAGEL et al., 2004; CHEN et al., 2005; HU et al., 2005; TIAN et al., 2005; WANG et al., 2005; WESTERNOFF et al., 2005; NASCIMENTO, 2006; DE VICENTE et al., 2008; LUUKKAA et al., 2008; LUUKKAA et al., 2009; ZHANG et al., 2009; LUUKKAA et al., 2010), na tentativa de melhor compreender o papel destas endoproteinases em processos neoplásicos devido ao atual conhecimento sobre a sua participação na angiogênese, invasão e metástase tumoral.
2 REVISÃO DA LITERATURA
2.1 Adenoma pleomórfico
O AP é a neoplasia mais freqüente das glândulas salivares maiores e menores (EVESON et al., 2005; ITO et al., 2005; LIMA et al., 2005; WEI-YUNG et al. 2005; JABER et al., 2006; AL-KHATEEB, LABABNEH, 2007; ANSARI, 2007; BUCHNER et al., 2007; PIRES et al., 2007; JONES, 2008; SUBHASHRAJ, 2008; WANG et al., 2008). Segundo Pires et al. (2007) estes tumores correspondem a 33% de todas as neoplasias benignas e malignas, 30% das neoplasias em parótidas e 33% de todas as neoplasias de glândulas salivares menores. De acordo com Eveson et al. (2005), este tumor representa em torno de 60% de todas as neoplasias de glândula salivar, sendo relatada uma incidência anual de 2,4-3,05 por 100.000 pessoas.
A neoplasia ocorre geralmente entre a quarta e a sexta décadas de vida, em indivíduos com idade média de 46 anos, tendo uma leve predileção pelo sexo feminino, apresentando-se tipicamente como uma massa firme de crescimento lento e indolor. A maioria dos casos ocorre na glândula parótida e quando acomete as glândulas salivares menores, o palato é a localização mais freqüente, seguido pelo lábio superior e mucosa jugal (EVESON et al., 2005; AL-KHATEEB, LABABNEH, 2007; BUCHNER et al., 2007; PIRES et al., 2007).
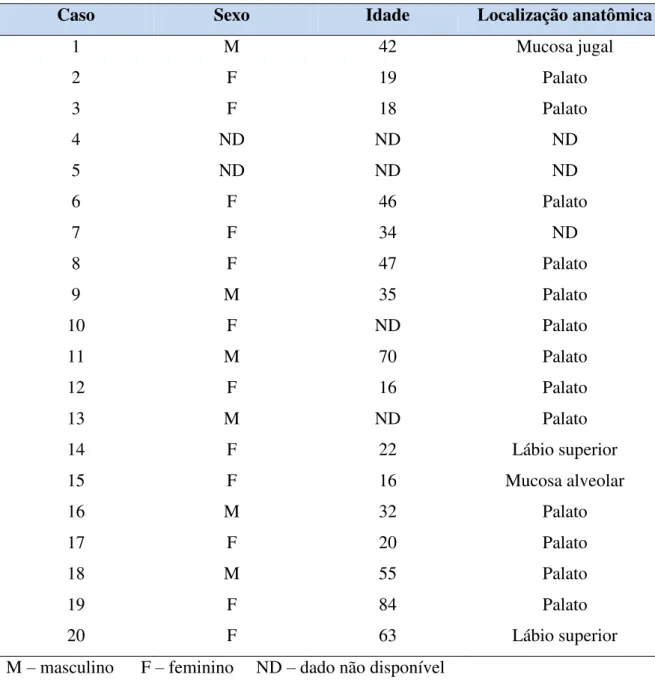
O AP é composto de células epiteliais e mioepiteliais que se arranjam em ninhos, cordões, lençóis celulares e estruturas ductiformes que se organizam em diversos padrões conferindo ao tumor uma ampla diversidade citomorfológica e arquitetural (DARDICK, 1996; ELLIS, AUCLAIR, 1996; EVESON et al., 2005).
O componente epitelial do AP demonstra uma variedade de tipos celulares incluindo células cuboidais, basalóides, escamosas, fusiformes, plasmocitóides e células claras. Raramente células mucosas e sebáceas são evidenciadas. Este componente forma ninhos, estruturas tipo ductos e áreas hipercelularizadas que podem compor o maior volume tumoral (EVESON et al., 2005). Ito et al.(2009) analisando as características histopatológicas de 189 casos de AP, concluíram que as células plasmocitóides eram o tipo celular mais freqüente nestes tumores seguido das células fusiformes e cuboidais.
ninhos de células fusiformes que quando organizadas de forma em paliçada podem
lembrar o Schwannoma(EVESON et al., 2005).
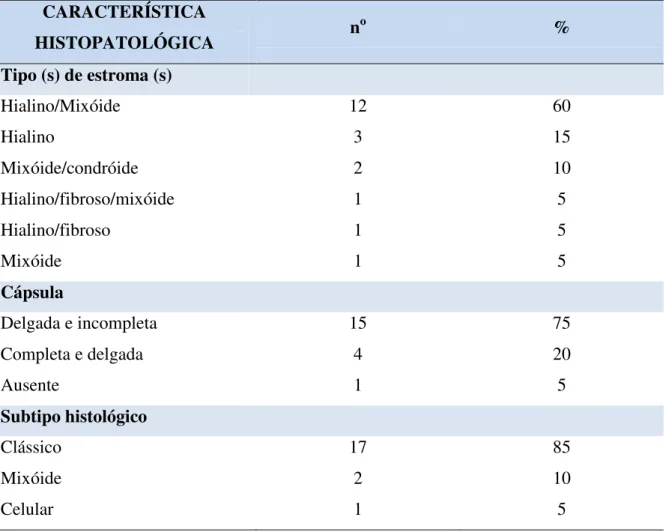
O componente estromal do AP é bastante variável podendo apresentar áreas mixóides, hialinas, fibrosas, condróides, condromixóides e mais raramente tecido ósseo e adiposo. Em meio à proliferação de células tumorais mioepiteliais podem ser evidenciadas áreas de diferenciação escamosa e mais raramente adiposa e óssea. As zonas cartilaginosas resultam do acúmulo de material mixo-hialino em torno de células individuais e apenas raramente se assemelham à cartilagem hialina madura. Geralmente, as lacunas presentes em áreas condróides apresentam um ou dois núcleos. Segundo alguns autores, nestas áreas apenas as células lacunares não podem ser distinguidas como condrócitos verdadeiros pelo método da imuno-histoquímica (MORINGA et al. 1987; TAKAI et al. 1994). Eventualmente, o material condróide pode representar a maior área do tumor. A presença de epitélio escamoso também pode ser evidenciada nos APs, podendo ser difuso e com formação de espaços císticos preenchidos por ceratina. Além disso, ainda podem ser observados em alguns tumores depósitos de material homogêneo, hialino e eosinofílico entre as células tumorais e no estroma, bem como a presença de material cristalóide (ELLIS, AUCLAIR, 1996; EVESON et al., 2005; M RG RITESCUăet al., 2005).
Os APs foram classificados histologicamente por Seifert et al. (1976) em 4 tipos com base na diferenciação das células epiteliais, na quantidade e natureza do estroma. O tipo I, conhecido como clássico, apresenta uma quantidade equilibrada entre as células epiteliais e o componente estromal, contendo 30-50% de estroma. No tipo II, o mixóide (rico em estroma), 80% do tumor corresponde a estroma. O tipo III, chamado de celular (rico em células), apresenta uma quantidade menor ou igual a 20-50% de estroma. O tipo IV contém um estroma em proporções semelhantes ao tipo III, mas apresenta uma diferenciação monomórfica focal no componente epitelial.
2005). Além disso, o AP mixóide geralmente apresenta ausência focal de cápsula, aumentando o risco de recorrência neste tipo histológico (STENNERT et al., 2001).
Normalmente, o AP é circunscrito e encapsulado. No entanto, essa cápsula pode ser incompleta ou mostrar infiltração pelas células tumorais, principalmente nos TGS menor (EVESON et al., 2005). A presença de extensões focais do tumor para a cápsula é muito comum nos APs, sendo um dos seus critérios diagnósticos (DARDICK 1996; EVESON et al., 2005). Infiltração capsular focal por células tumorais também foi observada em 80% dos 218 casos de APs de glândula parótida estudados por Zbären e Stauffer (2007).
As variações citológicas e histomorfológicas no AP são inúmeras, a única característica constante é a proliferação coordenada de células epiteliais e mioepiteliais, sendo que estas últimas têm uma tendência a superar numericamente as epiteliais. O desenvolvimento de estroma do tipo hialino e mixocondróide predominam em alguns casos mas, encontra-se ausente em outros e esta diversidade histológica contribui para confundir o AP com outros tumores de glândulas salivares benignos e malignos (DARDICK, 1996; EVESON et al., 2005).
Embora o AP possua características clínicas e morfológicas bem definidas, a sua patogênese não está totalmente esclarecida, bem como a influência de fatores que podem estar relacionados à sua malignização.
ainda identificadas e tem contribuído para a super-expressão do PLAG1 nestes tumores. A fusão do gene LIFR (do inglês, leukemia inhibitory factor receptor) com este gene foi encontrada em tumores com t(5;8) (p13;q12). Além desta, as fusões dos genes TCEA1-PLAG1 (também conhecido como SII) e CHCHD7-PLAG-1 também foram observadas como resultado de rearranjos crípticos em tumores com cariótipo normal (CHEUK, CHAN, 2007; VAN DICK et al. 2007; ELLEDGE, 2009).
O risco de transformação maligna nos APs foi relacionado aos casos com longo tempo de evolução e/ou aqueles submetidos a várias cirurgias e com história de recorrências (LEWIS et al., 2001). A taxa total de transformação maligna do AP foi estimada em cerca de 6 a 13% dos casos (GNEPP, 1993; ELLIS, AUCLAIR, 1996). Johns e Goldsmith (1989) relataram uma incidência de 1,6% de transformação maligna nos tumores com a duração de 5 anos, comparado com 9,4% naqueles que permaneceram sem tratamento durante 15 anos, demonstrando desta forma a necessidade de tratamento cirúrgico precoce. De acordo com a literatura, quando ocorre a transformação maligna do AP o carcinoma ex-adenoma pleomórfico é a sua contraparte maligna mais frequentemente encontrada. O tumor apresenta um comportamento agressivo, que geralmente está associado a metástases regionais e a distância em pulmões, ossos e vísceras que podem levar a um desfecho fatal (AUCLAIR, ELLIS, 1996; EVESON et al., 2005).
Algumas características histológicas preditivas à transformação maligna dos APs foram relatadas e incluíam atipias, aumento do número de mitoses, invasão da cápsula, hipercelularidade, extensa hialinização estromal, necrose e calcificações focais (LEWIS et al., 2001). Algumas dessas características como atipias, mitoses e invasão capsular também são evidenciadas em APs típicos e algumas lesões localizadas no palato podem apresentar hipercelularidade (WALDRON, 1991; EVESON, 2001). Para Auclair e Ellis (1996) as únicas características histológicas preditivas à transformação maligna do AP são a presença de estroma hialinizado e calcificações focais.
O tratamento indicado para os APs é a excisão cirúrgica, porém na glândula parótida, essa remoção é complicada devido a presença do nervo facial. Assim, nos tumores do lobo superficial recomenda-se a parotidectomia superficial com preservação do nervo facial, enquanto que no lobo profundo, se faz necessária a excisão total da glândula junto com o tumor (EVESON et al., 2005).
utilizado para os APs era a enucleação cirúrgica e a taxa de recorrência nestes tumores após este procedimento variava de 10 a 45%. Esta alta taxa levou a uma mudança na modalidade de tratamento para parotidectomia superficial. Desde a introdução desta técnica, a taxa de recorrência diminuiu para 2 a 5%. Alguns autores têm sugerido que a recorrência dos APs está associada à remoção incompleta do tumor primário devido a aspectos histopatológicos capsulares (cápsula incompleta, infiltração capsular, presença de pseudopodia e nódulos satélites), que podem comprometer a ressecção completa do tumor mesmo utilizando diferentes técnicas cirúrgicas (ZBÄREN, STAUFFER, 2007).
2.2 Carcinoma adenóide cístico
O CAC é um dos mais comuns tumores malignos de glândula salivar (AL-KHATEEB, LABABNEH, 2007; WANG et al., 2007; COPELLI et al., 2008; SUBHASHRAJ, 2008), compreendendo cerca de 20% de todas as neoplasias malignas desta localização. O tumor merece destaque devido ao seu aspecto microscópico, comportamento biológico, índice de recidiva e disseminação sistêmica (da CRUZ PEREZ et al., 2006; BIANCHI et al.,2008).
O CAC acomete principalmente pacientes na quinta e sexta décadas de vida (KIM et al., 1994; KOKEMUELLER et al., 2004) e raramente crianças e adolescentes são afetados (KOKEMUELLER et al., 2004; da CRUZ PEREZ et al., 2006). Para alguns autores não há predileção de ocorrência em relação ao sexo (KOKEMUELLER et al., 2004), enquanto que para outros o tumor é mais comum em homens (da CRUZ PEREZ et al., 2006). Alguns autores encontraram uma alta prevalência no sexo feminino para os casos localizados na glândula submandibular (EL-NAGGAR, HUVOS, 2005). A lesão ocorre em glândulas salivares especialmente no palato, parótida, submandibular e sublingual (da CRUZ PEREZ et al., 2006), bem como, em outros locais como as glândulas lacrimais, esôfago e árvore traqueobrônquica (SPIRO et al., 1992; KUEL et al., 1995; RAPIDIS et al., 2005).
(WAHLBERG et al., 2002; SHIRAI et al., 2003; FREITAS et al., 2004; JIA et al., 2004; MISUMI et al., 2004; YASUMATSU et al., 2004; BOBBIO et al., 2008). O CAC também tem tendência a apresentar invasão perineural em estágios precoces (KOWALSKI, PAULINO, 2002) e disseminação hematogênica, que ocorre freqüentemente durante o curso da doença, embora a invasão para linfonodos cervicais seja bastante rara (KOKEMUELLER et al., 2004).
O CAC apresenta altas taxas de metástase à distância comprometendo seriamente o tratamento destes tumores. Metástases tardias são comuns e podem ocorrer mesmo depois de vários anos da ressecção do tumor primário (FRANÇA et al., 2001; SUNG et al. 2003)
O CAC caracteriza-se histologicamente por dois tipos de células: ductal e célula mioepitelial modificada que se apresentam tipicamente com núcleos angulares, hipercromáticos e freqüentemente citoplasma claro, proliferando em forma de lençóis ou ilhas em meio a um estroma hialino abundante (EL-NAGGAR, HUVOS, 2005). Estas células organizam-se em três padrões histopatológicos: cribriforme, tubular e sólido, os quais se relacionam com o prognóstico destes tumores (SHIBUYA et al., 1999; PEREZ-ORDONEZ, 2003; JIA et al., 2004; EL-NAGGAR, HUVOS, 2005).
Devido aos parâmetros clínicopatológicos acima descritos não serem inequivocamente preditores da atividade do CAC, estudos tem investigado vários marcadores imuno-histoquímicos buscando melhor entender o comportamento biológico desses tumores. Níveis de expressão do antígeno nuclear de proliferação celular (PCNA) (CHO et al., 1999), do Ki-67 (CARLINFANTE et al., 2005), do receptor do fator de crescimento epidérmico (EGFR) (VERED et al., 2002 ), do receptor do fator de crescimento epidérmico humano do tipo 2 (HER-2/neu), do p53 (CARLINFANTE et al., 2005), da E-caderina (FRANCHI et al., 1999) e da ciclina D1
(YASUMATSU et al., 2004), foram avaliados mas, os resultados ainda não são
Cavalcante (2008) estudando APs e CACs procurou identificar o polimorfismo -160/CA da região promotora do gene CDH1 (E-caderina), na triagem de mutações no gene CTNNB1, e ainda na análise da expressão imuno-histoquímica das proteínas E-caderinaă eă -caderina destes tumores. Este estudo também correlacionou os achados imuno-histoquímicos com as possíveis mutações e polimorfismos. Os resultados do
estudo indicam que a expressão imuno-histoquímica do complexo E-caderina/
-catenina pode estar relacionada com a quantidade e a diferenciação do componente mioepitelial e não com o comportamento biológico dos tumores estudados. Os casos que exibiram polimorfismo no gene da E-caderina apresentaram redução na expressão protéica e as possíveis mutações nos genes CTNNB1 parecem não influenciar na expressãoădaăproteínaă -catenina.
Miguelă(2005)ăcomparouăaăexpressãoădasăintegrinasă 2 1,ă 3 1 e 5 1ăemăAPsă e CACs e investigou a diferença de expressão destas integrinas entre os subtipos histológicos do CAC. Os resultados do estudo indicam que a reduzida expressão da integrinaă 2 1ăobservadaănosăCACsăpodeăestarărelacionadaăcomăaămenorădiferenciaçãoă dasăcélulasădesteătumorăeăqueăaăaăreduzidaăexpressãoădaă 5 1ăpodeăestarăassociadaăcomă o comportamento agressivo do CAC. Os resultados ainda sugerem que a ausência e/ou redução da expressão das integrinas estudadas no CAC sólido pode desempenhar algum papel na patogênese e no comportamento mais agressivo deste subtipo histológico.
O tratamento de escolha para o CAC é a ressecção total e o valor de outras modalidades de terapias adjuvantes permanece controverso (KOKEMUELLER et al., 2004). O tipo de tratamento varia de acordo com o estágio do tumor, sendo a cirurgia e radioterapia pós-cirúrgica os métodos mais freqüentemente utilizados seguido de apenas cirurgia (MATSUBA et al., 1984; GARDEN et al., 1995; AVERY et al., 2000; SUNG et al., 2003). Alguns estudos não encontraram diferença significativa entre os casos que receberam radioterapia pós-operatória ou somente cirurgia (KHAN et al., 2001; KOKEMUELLER et al., 2004). Entretanto, alguns autores demonstraram um melhor controle local da doença com o uso combinado de cirurgia e radioterapia principalmente nos casos com margens cirúrgicas positivas (MATSUBA et al., 1986; MIGLIANICO et al., 1987; AVERY et al., 2000; MENDENHALL et al., 2004).
Para alguns autores, mesmo com o controle local da doença conseguido com a terapia combinada, as metástases à distância são pobremente controladas e representam a maior causa de insucesso no tratamento (FORDICE et al., 1999; SHIRAI et al., 2003). A cirurgia eletiva do pescoço não tem sido recomendada uma vez que o risco de metástase cervical é relativamente baixo (PROKOPAKIS et al., 1999; KHAN et al., 2001; MENDENHALL et al., 2004), a não ser para aqueles casos com suspeita clínica ou cirúrgica de envolvimento linfonodal (da CRUZ PEREZ et al., 2006). Mas, alguns autores têm indicado o esvaziamento cervical no primeiro momento cirúrgico para os tumores de base de língua e nasofaringe por estes locais apresentarem uma grande quantidade de vasos linfáticos (MENDENHALL et al., 2004).
O comportamento clínico agressivo do CAC com recorrência local e metástase tardia à distância indica a necessidade de realização de exames periódicos por toda a vida do paciente (KOKEMUELLER et al., 2004). A taxa de sobrevida varia de 78 a 83,1% no período de 5 anos sendo reduzida para 57 a 65 % em 10 anos (TAKAGI et al., 2001, COPELLI et al., 2008; CICCOLALLO et al., 2009).
Para da CRUZ PEREZ et al. (2006) a idade acima de 45 anos foi considerada um significativo fator prognóstico para a doença. Os CACs localizados na cavidade nasal, faringe, laringe e brônquios apresentaram um pior prognóstico quando comparados aos diagnosticados na cavidade oral (CICCOLALLO et al., 2009). As lesões que se desenvolviam primariamente na glândula submandibular e no seio paranasal também apresentaram um prognóstico desfavorável quando comparadas aquelas localizadas na parótida ou palato (TAKAGI et al., 2001). Pacientes que apresentaram sinais e sintomas da doença no período inferior a 18 meses do diagnóstico também possuíam uma menor taxa de sobrevida (NASCIMENTO et al. 1986; da CRUZ PEREZ et al., 2006).
A parestesia, associada com os tumores da glândula parótida, seio maxilar e cavidade nasal, também foi descrita como um significativo fator prognóstico (SPIRO et al. 1974; da CRUZ PEREZ et al. 2006). O estágio tumoral tem sido relacionado como um importante indicador de comportamento do CAC, mostrando que pacientes em estágios avançados da doença têm apresentado um pior prognóstico (SPIRO et al., 1992; TAKAGI et al., 2001; SUNG et al., 2003; da CRUZ PEREZ et al., 2006). A maioria dos estudos revelou que pacientes diagnosticados com CAC com predominância do padrão histológico sólido têm um pior prognóstico quando comparados aos que apresentavam predominantemente os subtipos cribriforme e tubular (MATSUBA et al. 1986; NASCIMENTO et al., 1986; CHUMMUN et al., 2001; KHAN et al., 2001; CHHIENG, PAULINO, 2002; SUNG et al., 2003; KOKEMUELLER et al., 2004; EL-NAGGAR, HUVOS, 2005). Altas taxas de metástase à distância também têm sido observadas no padrão sólido (COPELLI et al., 2008). As lesões com este padrão são consideradas de alto grau de malignidade com taxas de recorrência de até 100% em comparação respectivamente com 50 e 80% para as variantes tubular e cribriforme (TOMICH et al., 1991; STALLMACH et al., 2002). Alguns autores destacam que o padrão tubular representa a forma mais diferenciada do CAC, tendo o prognóstico mais favorável (YASUMATSU et al., 2004). Outros estudos não confirmaram o subtipo sólido como fator prognóstico importante ao curso da doença (PROKOPAKIS et al., 1999; FRIEDRICH et al., 2003). A presença de tumor nas margens da ressecção, a invasão perineural e a presença de metástase cervical também têm sido descritos como fatores prognósticos negativos (FORDICE et al. 1999;
PROKOPAKIS et al., 1999; TAKAGI et al., 2001;LICITRA et al., 2003; SUNG et al.,
2006). Alguns estudos não encontraram uma correlação entre invasão perineural e um pior prognóstico (SPIRO et al. 1974; MATSUBA et al. 1986; NASCIMENTO et al., 1986) mas, outros autores demonstraram um decréscimo na taxa de controle local da doença quando um maior número de fascículos nervosos estava envolvido pelas células tumorais (GRADEN et al., 1995).
2.3 Invasão, metástase tumoral e matriz extracelular
Uma característica importante das células malignas é a sua capacidade de invadir tecidos normais vizinhos e se espalharem através do sangue e do sistema linfático para órgãos distantes através do processo de metástase. As células malignas têm várias características que as distinguem das células normais com a auto-suficiência em sinais de crescimento, insensibilidade a sinais de crescimento inibitório, evasão da morte celular programada (apoptose), potencial replicativo ilimitado, angiogênese, invasão tecidual e metástase (HANAHAN, WEINBERG, 2000).
O processo de invasividade descreve a habilidade dessas células de vencer barreiras anatômicas como a MB e o estroma intersticial. A infiltração das células tumorais através da MB é um passo crítico no crescimento tumoral e para que estas células sejam capazes de se espalhar elas devem dissociar-se da ligação e controle das células vizinhas e da matriz extracelular (MEC). A motilidade celular requerida para a invasão tumoral é coordenada através de um balanço entre os receptores de adesão celular e esta matriz (KALLURI, 2003).
Um estudo foi realizado por Raitz et al. (2003) para avaliar o papel da MEC na morfogênese e diferenciação celular dos TGS originados do ducto intercalado. Foram analisadas proteínas desta matriz usando a imuno-histoquímica em 34 casos de neoplasias de glândula salivar (adenoma pleomórfico, mioepitelioma, adenoma de células basais, adenocarcinoma polimorfo de baixo grau e carcinoma adenóide cístico). Os resultados demonstraram que a laminina e o colágeno tipo IV foram expressos em todos os tumores estudados, nas estruturas ductiformes, separando-as do estroma ou ao redor de aglomerados de células. Além destas duas proteínas, a fibronectina também foi evidenciada no estroma de todos os casos, especialmente no tipo mixóide dos APs, com exceção dos espaços pseudocísticos dos CACs que foram apenas delimitados por laminina e colágeno tipo IV. A tenascina foi evidenciada ao redor das estruturas tubulares, células periféricas e entre as células plasmocitóides dos APs, enquanto que no estroma esta proteína foi evidenciada principalmente no subtipo hialino. As proteínas da MEC também foram evidenciadas nos variados padrões do CAC. No padrão tubular, a laminina e o colágeno tipo IV foram expressos ao redor de estruturas tubulares e no estroma. No padrão cribriforme, estas duas proteínas foram evidenciadas delimitando os espaços pseudocísticos e difusamente no interior destes espaços. No padrão sólido todas as proteínas foram imunomarcadas, especialmente a tenascina. Esta proteína foi principalmente observada em tumores menos diferenciados e com alto grau de malignidade como os CACs sólidos.
Bento et al. (2006) analisaram a expressão imuno-histoquímica da tenascina e fibronectina em 23 casos de AP de glândulas salivares. Todos os casos foram imunoreativos para a fibronectina mostrando forte expressão desta proteína nos estromas fibrosos e condróides. Uma fraca marcação foi evidenciada nos estromas hialinos e mixóides. A tenascina também foi mais fortemente expressa nos estromas fibrosos e condróides e moderadamente evidenciada nos estromas hialinos e mixóides. Os autores concluíram ainda que não houve uma diferença na expressão destas proteínas entre os TGS maior e menor.
A MEC é um compartimento dinâmico dessas moléculas e de vários fatores de crescimento e enzimas latentes, que afetam a ativação de célula para célula e as interações célula-matriz. A interação das células com a MEC é fundamental para o desenvolvimento normal e funcional dos organismos. Os processos de crescimento e migração celular são dependentes da remodelação da MEC que é regulada por um delicado equilíbrio entre a síntese e degradação de proteínas presentes nesta matriz. A degradação coordenada das macromoléculas da MEC é crucial para muitos processos biológicos. No entanto, a degradação excessiva de componentes desta matriz ocorre em processos patológicos como as feridas crônicas, arteriosclerose, artrite reumatóide, bem como na invasão e metástase tumoral (NAGASE et al., 2006; GILL, PARKS, 2008; NÖEL et al., 2008).
Compreender os mecanismos moleculares que envolvem a complexa interação entre as células tumorais e o estroma circundante representa um dos principais desafios na investigação do câncer. Evidências suportam a hipótese de que as MMPs mediam importantes mudanças no microambiente tumoral durante o processo de progressão dos tumores, assumindo um importante papel na comunicação molecular entre as células tumorais e o estroma (KESSENBROCK et al., 2010).
2.4 Metaloproteinases da matriz
Desde a observação destes autores, uma verdadeira família de compostos enzimáticos relacionados tem sido identificada (RODRÍGUEZ et al., 2010).
As MMPs compreendem uma grande família de enzimas proteolíticas dependentes de cálcio e zinco que além de degradar substratos da MEC também agem em outros componentes desta matriz como citocinas, quimiocinas, fatores de crescimento, receptores de superfície celular, proteases, sistema complemento e moléculas de adesão. Mais de 20 diferentes membros são conhecidos e foram agrupadas em seis subfamílias distintas de acordo com a organização do domínio e especificidade do substrato: colagenases (MMP-1, -8, -13 e -18), gelatinases (MMP-2 e -9), estromelisinas (MMP-3 e -10), matrilisinas (MMP-7, -26 e -11), MMPs tipo membrana (MMP-14, -15, -16, -17, -24 e -25) e outras MMPs (MMP -12, -19, -20, -21, -23,-27,-28) (NAGASE et al., 2006; FU et al., 2008; RODRÍGUEZ et al., 2010).
Estas enzimas são denominadas coletivamente de MMPs em razão de sua dependência de íons metálicos para atividade catalítica, habilidade para degradar proteínas estruturais da MEC e presença de seqüências evolutivas específicas que as distinguem de outros compostos enzimáticos intimamente relacionados (RA, PARKS, 2007).
A maioria das MMPs estão organizadas ao redor de um domínio catalítico conservado ao qual se incorpora um pró-peptídeo (Zn++), necessário à manutenção da latência da enzima; um peptídeo sinalizador, responsável pelo direcionamento de secreção do composto pela célula; e um domínio hemopexina C-terminal, o qual contribui para a especificidade de substrato e interações com inibidores endógenos (ALA-AHO, KÄHÄRI, 2005; FU et al., 2008).
Folgueras et al. (2004) destacam que este arquétipo é observado no subgrupo de proteases secretadas, composto pelas três colagenases humanas (MMP-1, -8 e -13), as duas estromelisinas (MMP-3 e -10), e quatro MMPs com características peculiares adicionais (MMP-12, -19, -20 e -27). Por sua vez, as matrilisinas (MMP-7 e -26) e a MMP-23 não apresentam o domínio hemopexina (SEIKI, YANA, 2003) e as gelatinases (MMP-2 e -9) incorporam três módulos de fibronectina tipo II, provendo um domínio compacto de ligação ao colágeno (BJÖRKLUND, KOIVUNEN, 2005).
(MT1-, MT2-, MT3- e MT5-MMP) associam-se à membrana celular através de domínios C-terminais transmembrana, ao passo que os dois componentes enzimáticos restantes (MT4- e MT6-MMP), integram-se à membrana plasmática por meio da molécula de ancoragem glicosilfosfatidilinositol.
As MMPs, em condições fisiológicas, têm um papel central na regulação da MEC durante o desenvolvimento embrionário e a remodelação tecidual (NAGASE et al., 2006; PAGE-MCCAW et al.,2007). Estas proteinases estão envolvidas em muitas funções incluindo a migração celular, crescimento neural, cicatrização e morfogênese de órgãos epiteliais como as glândulas salivares. Em condições fisiológicas de normalidade, elas são expressas em níveis muito baixos em tecidos adultos, exceto nos tecidos em remodelação como endométrio ciclando, tecido de mama normal em involução e na pele durante a cicatrização. Entretanto, as MMPs são também consideradas fatores cruciais nos processos de invasão, metástase e angiogênese em muitos cânceres humanos (BRAKEBUSH et al., 2002, MONAGHAN et al., 2007).
Apesar de estar claro que a associação entre as metaloproteinases e a progressão neoplásica está diretamente relacionada com a sua capacidade de romper as barreiras físicas representadas pela MB e MEC intersticial, as metaloproteinases também participam de outros processos do desenvolvimento tumoral, como a regulação da angiogênese através da modulação de fatores de crescimento e citocinas armazenadas na MEC (FRANCHI et al., 2002).
2.4.1 MMPs -2 e -9 (gelatinases A e B)
As MMPs -2 e -9 (gelatinases A e B, respectivamente) são provavelmente os membros mais estudados da família das MMPs. O interesse pelas gelatinases provém da sua habilidade para clivar o colágeno tipo IV, encontrado na MB. Estas proteinases desempenham um importante papel na angiogênese, bem como na remodelação tecidual, invasão e metástase, além de freqüentemente estarem associadas a um pior
prognóstico tumoral (COUSSENS et al.,ă2000;ăEGEBLAD,ăWERBă2002;ăAM LINEIă
et al., 2007).
insulin-like growth factor-binding protein 1), precursor do TNF- (do inglês, tumor necrosis factor-alpha), forma inativa do TGF- ă(do inglês, transforming growth factor-beta), -1PI (do inglês, alpha1-proteinase inhibitor) e interleucina-1 ă(STERNLICHT,ă
WERB, 2001; KERKELA, SAARIALHO-KERE, 2003; FOLGUERAS et al., 2004). Apesar da gelatinase A possuir especificidades de substratos da MEC semelhantes à MMP-9, esta metaloproteinase é regulada de forma diferente, tanto a nível transcricional, quanto extracelular (KUMAMOTO et al., 2003).
Para Aimes e Quigley (1995) e Björklund e Koivunen (2005), a principal diferença observada entre as MMPs-2 e -9, com relação ao substrato, constitui na capacidade da primeira em degradar colágeno fibrilar tipo I.
Patterson et al. (2001) reportaram que o processo de degradação do colágeno fibrilar tipo I pela MMP-2 depende apenas da ligação deste aos domínios hemopexina C-terminal e ao domínio catalítico, diferentemente do constatado para a degradação das gelatinas, processo que, além da interação com os domínios referenciados anteriormente, depende da associação desta proteína aos três módulos de fibronectina tipo II.
Enaltecendo o papel dos módulos de fibronectina tipo II, Hornebeck et al. (2002) afirmam que apesar de se verificar certa especificidade de ligação ao substrato de acordo com o módulo analisado, como evidenciado entre o primeiro destes e elastina, o segundo e gelatinas, e o terceiro módulo e colágeno tipo IV, é provável haver interação entre todos estes para uma associação efetiva entre componentes da MEC e esta protease.
Mattu et al. (2000), Opdenakker et al. (2001) e Xu et al. (2005) descrevem, ainda, que apesar desta sobreposição de substratos entre MMPs-2 e -9, a gelatinase A diferencia-se por sua síntese constitutiva, evidenciada em fibroblastos, macrófagos, células endoteliais e células epiteliais, ao passo que a MMP-9 apresenta expressão altamente regulada, sendo observada, em células inflamatórias como macrófagos, neutrófilos e eosinófilos.
Strongin et al. (1995) denotam que, ao contrário das demais MMPs, a gelatinase A é refratária à ativação através de serina proteases. Conforme estes pesquisadores, esta MMP sofre ativação na superfície celular, em decorrência de uma cascata singular, envolvendo MMP e TIMP-2. Para alguns autores, primeiramente, uma MT1-MMP liga-se ao domínio N-terminal de TIMP-2, permitindo ao domínio C-terminal deste inibidor de MMPs atuar como receptor do domínio hemopexina da MMP-2. Em seguida, outra MT1-MMP adjacente cliva e ativa a MMP-2 associada ao TIMP-2, na posição entre os aminoácidos Asn37-Leu38, gerando uma forma intermediária de 64kDa. Seqüencialmente, após esta clivagem inicial, uma porção residual do pró-peptídeo, entre os aminoácidos Asn80-Tyr81, é removida por outra molécula de MMP-2 ativada, permitindo, finalmente, a apresentação da forma completamente ativa desta enzima (DERYUGINA et al., 2001; SEIKI, 2003; HORNEBECK et al., 2005).
Conforme afirmam Strongin et al. (1995), enquanto o domínio C-terminal do TIMP-2 participa na ativação da MMP-2, seu domínio N-terminal atua como inibidor desta MMP. Além disso, Hornebeck et al. (2002) e Björklund e Koivunen (2005) reportam que as concentrações locais de TIMP-2 influenciam a ativação da MMP-2, sugerindo que níveis moderados ou baixos deste componente promovem a ativação desta MMP, ao passo que níveis maiores são capazes de inibir a ação da MMP-2 através da saturação das MT1-MMPs livres, necessárias à remoção do pró-peptídeo desta enzima.
Seiki (2003) corrobora quanto ao importante papel da ação conjunta de MT1-MMP e MT1-MMP-2. Segundo o autor, apesar de algumas linhagens de células neoplásicas epiteliais não revelarem expressão de gelatinase A, estes elementos celulares seriam capazes de utilizar a MMP-2 sintetizada por fibroblastos estromais, através de MT1-MMP expressa em suas superfícies celulares. Resumidamente, o autor sugere que o sistema MT1-MMP/MMP-2 consistiria em um importante mecanismo de invasão tumoral, degradando colágeno tipo IV, presente em MBs, bem como, colágeno I, presente na MEC.
A MMP-9 apresenta 82kDa em sua forma ativa e desempenha um papel enzimático importante na progressão de tumores, promovendo a degradação de vários substratos, participando de eventos necessários à migração das células tumorais e da angiogênese tumor-induzida (MATTU et al., 2000; FRIDMAN et al., 2003). A gelatinase B degrada substratos como gelatina, elastina, nidogênio, colágenos (I, IV, V, VII, XI e XIV), laminina, fibronectina, fibrilina, osteonectina, agrecana, vitronectina, decorina, proteínaămielínicaăbásica,ăplasminogênio,ă 2-macroglobulina, IGFBP-1, pré- TNF- ,ăpróăTGF- ,ă -1PI e interleucina-1 ă(STERNLICHT,ăWERB,ă2001;ăKERKELA,ă SAARIALHO-KERE, 2003; FOLGUERAS et al., 2004).
A região promotora do gene que codifica a MMP-9 exibe sítios de ligação para diversos fatores de transcrição, sendo comumente descritos na literatura as APs-1 e -2, NF-B (do inglês, nuclear factor kappa-light-chain-enhancer of activated B cells), SP-1, ISRE (do inglês, interferon stimulated response element) TIE (do inglês, tyrosine kinase with immunoglobulin-like and EGF-like domains) (MOOK et al., 2004).
Alguns autores descrevem a presença de um domínio adicional à estrutura da MMP-9, não evidenciado na gelatinase A, denominado de domínio semelhante ao colágeno tipo V. Este domínio, altamente glicolisado, situa-se entre o domínio de ligação ao zinco e o domínio hemopexina C-terminal (MATTU et al. 2000; BJÖRKLUND, KOIVUNEN, 2005). Apesar do significado biológico permanecer incompletamente compreendido, sugere-se como possíveis funções a associação colateral de diversas moléculas de gelatinases B, favorecendo ou prevenindo interações específicas entre os domínios hemopexina C-terminais destas enzimas, bem como, a sua ligação a moléculas da MEC (MATTU et al., 2000; OPDENAKKER et al., 2001).
Outra característica peculiarmente constatada na MMP-9 é a glicosilação, observada ao longo da molécula desta protease, constituída por diversos oligossacarídeos volumosos e altamente móveis. Funcionalmente, sugere-se que esta glicosilação possa ser responsável pela proteção de áreas específicas contra degradação, estabilização da molécula, impondo conformações específicas para determinados domínios, bem como, pelo direcionamento da enzima através de interações com a MEC ou receptores de superfície celular (MATTU et al., 2000; OPDENAKKER et al., 2001).
proteolíticos ou não-proteolíticos (STERNLICHT, WERB, 2001; BANNIKOV et al., 2002; FRIDMAN et al., 2003).
Diversas proteases foram implicadas na ativação da MMP-9, dentre as quais merecem destaque as MMPs-2, -3, -7 e -13. Dentre estas, a MMP-3, também denominada de estromelisina 1, apresenta-se como uma das mais importantes ativadoras efetivas da gelatinase B (FRIDMAN et al., 2003; BJÖRKLUND, KOIVUNEN, 2005).
Curran e Murray (2000) e Fridman et al. (2003) sugerem que a ativação da pró-enzima MMP-9 também seria resultado da cascata iniciada na superfície celular através de MT1-MMP, em decorrência desta forma de MMP associada à membrana celular ativar MMP-2 e, estas duas proteases, serem capazes de ativar MMP-13.
Dentre os mecanismos não-proteolíticos de ativação da MMP-9, destaca-se a modificação oxidativa das cadeias laterais dos resíduos de cisteína, o que resulta em diminuição de sua habilidade em estabelecer ligações efetivas ao íon catalítico zinco (BJÖRKLUND, KOIVUNEN, 2005), bem como, alterações conformacionais induzidas por ligações ao substrato (BANNIKOV et al., 2002). Não obstante, Fridman et al. (2003) enaltecem que, apesar das dúvidas a respeito da eficiência deste processo de ativação não-proteolítico, se confirmado, este mecanismo explanará, ao menos parcialmente, a presença de formas ativas de MMP-9 contendo o domínio pró-peptídico. Conforme já descrito para outras MMPs, alguns estudos demonstram uma possível associação funcional entre integrinas e gelatinase B (STERNLICHT, WERB, 2001; BJÖRKLUND, KOIVUNEN, 2005). Dentre estes, destaca-se a pesquisa realizada por Björklund et al. (2004), os quais, utilizando linhagens celulares de fibrossarcoma (HT-1080), verificaram co-imunoprecipitação da subunidade 5 de integrina e da forma zimogênica de MMP-9, bem como, co-localização destas moléculas na borda anterior da membrana plasmática, em relação ao sentido de migração na MEC, constatado através de imunofluorescência. Sabendo-se da utilização da integrina v5, por esta linhagem celular, no processo de adesão célula-matriz, estes autores sugerem uma provável interação entre esta molécula de adesão e a MMP-9, para consubstanciar a gelatinólise efetiva no espaço pericelular, favorecendo o processo de invasão local.
ativado da integrina v3, o qual, conseqüentemente, determinava a presença de MMP-9 enzimaticamente competente, conforme observado através de análises com Western Blot e zimografia. Coerentemente, o estudo das células de carcinoma de mama que não apresentavam integrina v3, em estado ativado, resultou na constatação apenas de formas pró-enzimáticas de gelatinase B.
Mook et al. (2004) e Turpeenniemi-Hujanen (2005) enfatizam o papel das MMPs-2 e -9 na angiogênese e no crescimento de tumores. Conforme os autores, há um acúmulo crescente de evidências que suportam a associação das MMPs, e em especial as gelatinases, com comportamento biologicamente agressivo e cursos clínicos imprevisíveis em alguns neoplasmas humanos.
As gelatinases A e B estão geralmente super-expressas em tecidos malignos, em comparação com suas contrapartes benignas (SASAKI et al., 2002; ASHA NAIR et al., 2003; MOOK et al., 2004; SORSA et al., 2004; MORÁN et al., 2005;
TURPEENNIEMI-HUJANEN, 2005). Valores séricos elevados destas
metaloproteinases estão também associados com a baixa sobrevida em muitos tipos de cânceres, como o de mama (TALVENSAARI-MATTILA et al., 1998, LEPPÄ et al., 2004), de próstata (TRUDEL et al., 2003), melanoma (VÄISÄNEN et al., 1998, NIKKOLA et al., 2005), carcinomas epidermóides na região de cabeça e pescoço (RIEDEL et al., 2000, RUOKOLAINEN et al., 2004) e pulmão (PASSLICK et al., 2000; YLISIRNIÖ et al., 2000). Por outro lado, alguns autores não encontraram nenhuma correlação entre a sobrevida de pacientes e a expressão das 2 ou MMP-9 em alguns tipos de câncer (VUORISTO et al., 2000; SASAKI et al., 2002, RAHKO et al., 2004), a exemplo do câncer colorretal onde nenhum significado prognóstico foi encontrado com a superexpresssão destas gelatinases (SIS et al., 2004; MORÁN et al., 2005).
2.4.2 MMPs -7 e -26 (matrilisinas -1 e -2)
de substrato e interações com inibidores das MMPs (WILSON et al., 1995; FOLGUERAS et al., 2004).
O gene que codifica a proteína MMP-7 está localizado no cromossomo 11q22.2-22.3. Diversos sítios de ligação para fatores de transcrição foram identificados no promotor do gene da matrilisina-1, dentre os quais destacam-se: sítio AP-1, sítio Tcf4 (do inglês, transcription factor 4), LEF (do inglês, lymphoid enhancer-binding factor ), sítio TIE (do inglês, inhibitory element TGF-) e sítio PEA3 (do inglês, activator enhancer polyoma 3) (BRABLETZ et al., 1999; STRONGIN, 2006).
Brabletz et al. (1999), Saeki et al. (2002) e Strongin (2006) enfatizam que dentre os principais fatores implicados no aumento da expressão de MMP-7 em neoplasias, merece destaque a -catenina. Sua atuação multifuncional, ora estabilizando complexos de adesão em associação à E-caderina, em células epiteliais, ora funcionando como fator
de transcrição nuclear como ponto final da via -catenina/WNT, sugerem um papel importante desta molécula na regulação da invasão local e metástase, em processos neoplásicos.
Diferentemente das demais MMPs, cuja expressão decorre de estímulo em resposta à injúria ou inflamação, a matrilisina-1 encontra-se expressa de forma constitutiva em tecido epitelial exócrino, na maioria dos tecidos adultos. Especificamente, a MMP-7 é sintetizada por glândulas salivares e glândulas anexas da pele, bem como, pelo epitélio glandular ou ductal do pâncreas, fígado, mama, intestino e trato urogenital (PARKS et al., 2001).
Outro aspecto importante da MMP-7 é o padrão de expressão desta protease em neoplasias. De acordo com Zhang et al. (2005), ao contrário das demais MMPs, as quais revelam expressão predominante em meio ao componente estromal, a MMP-7 localiza-se primariamente no parênquima neoplásico, especialmente em neoplasias de origem epitelial, conforme relatos descritos em carcinomas orais, esofágicos, colorretais, gástricos e de mama (FINGLETON et al., 2001; KITOH et al., 2004; GRAESSLIN et al., 2006).
Os principais substratos que sofrem proteólise por MMP-7 são: colágenos (I e IV desnaturados), elastina, entactina, gelatina 1, fibulina, fibronectina, laminina, vitronectina, agrecana, proteoglicanas, proteína ligante, mielina básica, endostatina, osteonectina,ă -1PI,ă 2-macroglobulina, caseína, FasL (Fas-ligante), integrina, E-caderina, sindecana-1, fibrinogênio, plasminogênio, pró-HB-EGF (do inglês, heparin-binding EGF-like growth factor), pró- -defensina, TNF- ,ăApo-CII (apoliproteína CII) e ADAM-28 (adamalisina-28). A MMP-7 tem sido relacionada à degradação de componentes da MB que é um evento crucial no processo de invasão e metástase (SIRES et al., 1994; CHAKRABORTI et al., 2003; FOLGUERAS et al., 2004; NAGASE et al., 2006).
Fingleton et al. (2001) identificaram um papel peculiar da ação de matrilisina-1 sobre a apoptose em cultura de linhagem de células epiteliais de glândula mamária humana (HBL 100). Estes autores verificaram que na presença crônica de MMP-7, ocorre seleção de uma sub-população celular mais resistente a apoptose mediada pela interação de Fas-L com seu receptor na membrana celular. Com seus resultados, Fingleton et al. (2001) sugerem que a expressão de matrilisina-1, reportada em estágios iniciais do desenvolvimento neoplásico, pode estar relacionada à seleção de células com menor propensão à destruição pelo sistema imune, favorecendo o acúmulo de modificações genéticas adicionais e, finalmente, o surgimento de tumores.
Goffin et al. (2003), em estudo utilizando RT-PCR, analisaram a expressão de diversas MMPs ao longo do ciclo menstrual, constatando três padrões distintos de expressão destas proteases, classificados em: MMPs restritas ao período menstrual, MMPs expressas por todo o ciclo e MMPs expressas predominantemente durante a fase proliferativa. A MMP-7, bem como uma protease intimamente relacionada, denominada de matrilisina-2 (MMP-26), foi evidenciada nesta última fase. Para estes autores, a expressão das matrilisinas-1 e -2 durante esta fase do ciclo menstrual sugere implicação destas proteases em diversos processos, como proliferação celular, rápido crescimento glandular, expansão estromal e angiogênese.
linfáticos e sangüíneos, no endométrio neoplásico, fato que enaltece o papel desta protease na degradação do colágeno tipo IV, presente em MBs, bem como, na ativação das formas zimogênicas de gelatinases A e B.
Alguns autores revelam uma correlação entre o grau de malignidade de neoplasias e a expressão de MMP-7. Como exemplo, merece destaque o estudo imuno-histoquímico realizado por Kitoh et al. (2004), em adenomas, carcinomas in situ e carcinomas invasivos da mucosa gástrica. Estes pesquisadores constataram um gradiente crescente na expressão de matrilisina-1 desde os adenomas aos carcinomas invasivos. A imunorreatividade para MMP-7 apresentou-se de forma mais significativa em áreas de invasão de vasos sangüíneos e linfáticos, enaltecendo o papel desta protease sobre componentes da MB e sua associação com o desenvolvimento de metástases de carcinomas gástricos.
A MMP-26, também denominada de matrilisina-2, constitui-se em um dos membros da família das MMPs descoberto recentemente, tendo sua estrutura incompletamente elucidada. O gene responsável pela codificação desta protease encontra-se situado no lócus cromossômico 11p15.3, relativamente distante do cluster 11q21-q23, que envolve pelo menos 8 genes responsáveis pela codificação das MMPs-1, -3, -7, -8, -10, -12, -13, -20 e -27 (AHOKAS et al., 2005; STRONGIN, 2006).
Dentre os principais substratos para MMP-26, destacam-se o colágeno tipo IV desnaturado, fibronectina, fibrinogênio, vitronectina, gelatina 1, 2-macroglobulina e 1-antitripsina,ă -1PI e IGFBP-1 (URIA, LÓPEZ-OTÍN, 2000; NABESHIMA et al., 2002). Adicionalmente, a MMP-26 é capaz de ativar a pró-MMP-9 em um sítio que determina a formação de uma forma ativa de gelatinase B mais estável do que quando ativada por outras MMPs, como a MMP-7 (ZHAO et al., 2003; AHOKAS et al., 2005).
Bioquimicamente, a MMP-26 distingue-se das outras MMPs em diversos aspectos. Dentre as características peculiares, destaca-se sua estrutura mínima, em virtude da inexistência do domínio Hemopexina-C terminal, essencial para a regulação da atividade e determinação da especificidade de substratos para esta protease (FOLGUERAS et al., 2004; STRONGIN, 2006). Adicionalmente, apesar de seu peso molecular semelhante ao da MMP-7, estas duas proteases compartilham apenas 40% de homologia em suas cadeias polipeptídicas (STRONGIN, 2006).