UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
NÍVEIS PRESSÓRICOS ELEVADOS EM MULHERES COM SÍNDROME
DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E FATORES DE RISCO
ASSOCIADOS
MARIA FÁTIMA DE AZEVEDO
Natal / RN
‐ ii ‐ UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
NÍVEIS PRESSÓRICOS ELEVADOS EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E FATORES DE RISCO ASSOCIADOS
DISSERTAÇÃO APRESENTADA AO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE, COMO PARTE DOS REQUISITOS PARA OBTENÇÃO DO TÍTULO DE MESTRE
MARIA FÁTIMA DE AZEVEDO
Orientador: Prof. Dr. George Dantas de Azevedo
Natal / RN
CATALOGAÇÃO NA FONTE
A994n
Azevedo, Maria Fátima.
Níveis pressóricos elevados em mulheres com síndrome dos ovários policísticos: prevalência e fatores de risco associados / Maria Fátima de Azevedo. – Natal, 2010.
51 f.
Orientador: Profº. Drº. George Dantas de Azevedo. Dissertação (Mestrado) – Programa de Pós-Graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
1. Síndrome dos ovários policísticos – Dissertação. 2.
Hipertensão arterial – Dissertação. 3. Fatores de risco. 4. Doenças cardiovasculares – Dissertação. I. Azevedo, George Dantas de. II. Título.
‐ iii ‐ UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora: Profa. Dra. Técia de Oliveira Maranhão
Natal / RN
2010
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
NÍVEIS PRESSÓRICOS ELEVADOS EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E FATORES DE RISCO ASSOCIADOS
Presidente da Banca: Prof. Dr. George Dantas de Azevedo
Banca Examinadora:
Rosana Maria dos Reis (FMRP-USP) – Membro titular externo
Maria Bernardete Cordeiro de Sousa (UFRN) – Membro titular interno Paulo Cesar Brandão Veiga Jardim (UFG) – Membro suplente externo Maria José Pereira Vilar (UFRN) – Membro suplente interno
Natal / RN
‐ v ‐
“V e nc e r nã o é c om pe t ir c om o out ro.
É de rrot a r os se us inim igos int e riore s.
É a própria re a liza ç ã o do se r. “
‐ vi ‐
Dedicatória
A minha mãe Sinezina “in memorian”, guerreira valorosa de uma personalidade transformadora, minha referência maior de amor, moral, ética e dignidade. Ao meu filho Edgar, dono de um refinado senso de humor, tem com sua
leveza iluminado meus dias e fortalecido a mais libertadora forma de amor. Ao meu pai Etelvino e meus irmãos Benivaldo, Daguia e Iracy, que são o meu
porto seguro, meu aconchego e a minha fonte de renovação.
AGRADECIMENTOS
A Deus por ter me feito mulher, nordestina, médica, cardiologista, me
agraciado com uma família maravilhosa e permitido uma vivência pessoal e
profissional riquíssima.
Ao meu orientador Prof. George Dantas de Azevedo, que com sua sabedoria e
serenidade, me acolheu, apontou os caminhos, me conduziu com paciência e
tolerância.
Às Doutoras Elvira Maria M. Soares, Tecia Maria de O. Maranhão pelo
recrutamento das pacientes no ambulatório de Ginecologia Endócrina da Maternidade
Escola Januário Cicco.
À Doutora Telma Maria de A. M. Lemos pela realização dos exames
bioquímicos no laboratório de Análises Clínicas e Toxicológicas da Faculdade de
Farmácia da Universidade Federal do Rio Grande do Norte.
Á Doutora Rosiane Viana Zuza Diniz pela presteza e disponibilidade no
atendimento aos meus apelos, sempre de maneira carinhosa me motivou e auxiliou
nas horas de desânimo.
Aos colaboradores Arthur Ivan Nobre Oliveira, Isabelle Braz de Oliveira Silva,
Joice Cristina Dantas Brandão Marinho, Julieta Alice Moreno Rodrigues pelo esforço
na coleta dos dados.
Aos integrantes da nossa base de pesquisa especialmente Eduardo Caldas Costa
pela organização do banco de dados, apoio estatístico e formatação do artigo,
sempre de forma tranqüilizadora. À minha amiga Joceline Cássia Ferezini de Sá pelo
Ao Programa de Pós-Graduação do Centro de Ciências da Saúde da
Universidade Federal do Rio Grande do Norte representado pela Profa. Drª. Tecia
Maria de Oliveira Maranhão pela oportunidade concedida para minha formação.
À Fundação de Apoio à pesquisa do Estado do Rio Grande do Norte (FAPERN) e
ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo
apoio financeiro ao projeto.
Meus sinceros agradecimentos às mulheres que participaram desse estudo e a
‐ix‐ LISTA DE ABREVIATURAS
ACTH = Hormônio adrenocorticotrófico
CC = Circunferência da cintura
CYP17 = Gene Citocromo P17
cm = centímetros
cm² = centímetros quadrado
DCV = Doença cardiovascular
FC = Freqüência cardíaca
FR = Fatores de risco
FSH = Hormônio folículo estimulante
GH = Hormônio de crescimento
HAS = Hipertensão arterial sistêmica
IGFBP-1 = Insulin-Like Growth Factor Binding Protein-1
IGF- I = Insulin-Like Growth Factor - 1
IMC = Índice de massa corporal
IL-6 = Interleucina 6
Kg = Kilograma
Kg/m² = Kilograma por metro quadrado
LH = Hormônio luteinizante
mg/dl = Miligramas por decilitros
mg/L = Miligramas por litro
mmHg = Milímetros de mercúrio
n = Número
PA = Pressão arterial
PAS = Pressão arterial sistólica
PAD = Pressão arterial diastólica
PCR = Proteína C reativa
RI = Resistência insulínica
SHBG = Globulina ligadora dos hormônios sexuais
SM = Síndrome metabólica
SOP = Síndrome dos ovários policísticos
TNF-α = Fator de necrose tumoral alfa
‐xi‐ RESUMO
Objetivo: investigar a prevalência de níveis pressóricos elevados e avaliar a correlação entre níveis de pressão arterial (PA) e outros fatores de risco
cardiovascular em pacientes com síndrome dos ovários policísticos (SOP).
Métodos: por meio de estudo transversal foram comparados os níveis de PA e parâmetros antropométricos e bioquímicos de risco cardiovascular em 113 mulheres
com SOP (idade 26,2±4,3 anos) e num grupo controle constituído por 242 mulheres
saudáveis da população geral (26,8±5,0 anos).
Resultados: o grupo SOP apresentou prevalência de PA alterada (≥130/85 mmHg) significativamente superior ao grupo controle (18,6% vs. 9,9%, respectivamente;
p<0,05). Mulheres com SOP apresentaram valores médios superiores de PA sistólica,
índice de massa corporal (IMC), circunferência da cintura (CC), triglicerídeos e
glicemia de jejum, além de níveis inferiores de HDL - colesterol, em comparação ao
grupo controle (p<0,01). No grupo SOP, os valores de PA sistólica e diastólica
apresentaram correlação positiva significativa com a idade, IMC, CC e triglicerídeos
(p<0,05).
Conclusão: A freqüência de mulheres com valores de PA acima do limite da normalidade foi significativamente maior no grupo SOP, em relação ao grupo
controle. Adicionalmente, os valores de PA se correlacionaram positivamente com
outros fatores de risco cardiovascular como obesidade e níveis de triglicerídeos.
Esses achados alertam para a relevância de estratégias preventivas em mulheres
com SOP, no sentido de evitar eventos mórbidos relacionados ao sistema
cardiovascular.
1. INTRODUÇÃO
A síndrome dos ovários policísticos (SOP) é uma das endocrinopatias mais
comuns, afetando cerca de 5 a 10% das mulheres em idade reprodutiva (1-4).
Estima-se que no mundo 105 milhões de mulheres entre 15 e 49 anos de idade
apresentem SOP, a qual é responsável por 72 a 82% das causas de
hiperandrogenismo (5-7)
De acordo com o consenso de Rotterdam (3), a SOP pode ser diagnosticada
após exclusão de outras causas de irregularidade menstrual e hiperandrogenismo
(hiperprolactenemia, formas não clássicas das hiperplasias adrenais congênitas,
síndrome de Cushing, neoplasias secretoras de andrógenos e hipotireodismo), pela
presença de, pelo menos, dois dos seguintes critérios: oligo ou amenorréia/
anovulação crônica, hiperandrogenismo laboratorial e/ ou manifestações clínicas do
excesso androgênico e morfologia policística dos ovários, com a presença de 12 ou
mais folículos, medindo 2 a 9 mm de diâmetro e ou volume ovariano acima de 10 cm³
à ultrassonografia (3, 4,8).
Vários estudos realizados em pacientes com SOP, especialmente no âmbito
das alterações cardiovasculares e metabólicas, já evidenciaram associação
importante com dislipidemia, resistência insulínica (RI), diabetes tipo 2 e obesidade.
Tais fatores, juntamente com alteração nos níveis pressóricos, compõem a chamada
Síndrome Metabólica (SM), uma entidade clínica intimamente relacionada à SOP e
fortemente associada ao aumento do risco cardiovascular (9-14).
A carga de doença cardiovascular e de mortalidade atribuída à elevação da
pressão arterial, estimada pelo estudo Global Burden of Disease 2000 revelou que
7,6 milhões de mortes em todo o mundo foi decorrente de uma pressão sistólica
‐ 14 ‐ 2001. Aproximadamente 80% delas ocorreram em países de baixo e médio
desenvolvimento e em faixas etárias compreendidas entre 45 e 60 anos de idade,
acarretando enormes prejuízos financeiros aos sistemas de saúde em todo o mundo.
Outro importante aspecto a ser considerado é que essas taxas de mortalidade
estiveram relacionadas a valores de pressão arterial considerados normais (115
mmHg), portanto abaixo dos limites de 140 x 90 mmHg recomendados atualmente
para intervenção (15,16).
Estudos apontam que mulheres com SOP apresentam redução da
complacência vascular, disfunção endotelial e maior nível de pressão arterial média,
quando comparadas a mulheres sem SOP, o que aumenta o risco de doença
cardiovascular aterosclerótica nessas pacientes. Wild et al.(12), analisando resultados
do seguimento de uma coorte de mulheres por cerca de 30 anos, demonstraram que
mulheres com antecedente de SOP apresentaram elevação de risco para
desenvolvimento de hipertensão arterial, diabetes tipo 2 e hipercolesterolemia, em
comparação com mulheres com história prévia de SOP.
Embora a alteração dos níveis pressóricos já esteja englobada no contexto da
SM e possa ser relacionada com os distúrbios metabólicos comumente encontrados
nessa população, há uma carência de estudos no que diz respeito à prevalência de
níveis pressóricos alterados em mulheres brasileiras com SOP e os fatores de risco
cardiovasculares associados a essa condição. Nesse sentido, buscamos desenvolver
um estudo com o objetivo de analisar a prevalência de níveis pressóricos alterados
em mulheres jovens com SOP e verificar sua relação com outros fatores de risco para
doenças cardiovasculares, em comparação a um grupo controle de mulheres jovens
ovulatórias saudáveis.
1.1 Objetivos
Investigar a prevalência de níveis pressóricos elevados em pacientes com
SOP, em comparação a um grupo controle de mulheres saudáveis da
população geral, e
Avaliar possíveis correlações entre os níveis de pressão arterial e outros
fatores de risco cardiovascular, em mulheres com SOP.
‐ 16 ‐ 2REVISÃO DA LITERATURA
2.1 SOP e Resistência Insulínica
Pelo menos 50% das mulheres com SOP são obesas e a maioria apresenta
algum grau de resistência periférica à ação da insulina (independente da obesidade)
e hiperinsulinemia (4,13). Vários dados confirmam a hipótese de que a resistência à
insulina (RI) e a hiperinsulinemia exerçam um papel patogênico na SOP. No sistema
nervoso central, a insulina parece estar envolvida na secreção anormal do LH e, em
nível periférico, promove a secreção ovariana de andrógenos, através do aumento da
expressão do gene CYP17 e da atividade do citocromo P450c17, tendo ação
sinérgica com o LH, tanto diretamente como através do estímulo da secreção do fator
de crescimento semelhante à insulina -1 (IGF-1). Adicionalmente, a insulina diminui a
síntese hepática de IGFBP-1 e da globulina ligadora dos hormônios sexuais (SHBG),
contribuindo para o aumento dos níveis de andrógenos livres (4,10).
Além dos mecanismos acima referidos, a dislipidemia associada com altos
níveis de triglicerídeos e baixos níveis de colesterol - HDL na síndrome metabólica é
atribuída ao efeito da insulina sobre o éster de colesterol, proteína que promove a
transferência de colesterol HDL para as VLDL e catabolismo resultante da
apolipoproteina A (17,18).
Nesse sentido, a RI emerge como fator agregador de um espectro de
2.2 SOP e Síndrome Metabólica
A síndrome metabólica (SM) e a SOP parecem estar relacionadas, embora
constituam duas diferentes entidades, de forma que mulheres com SOP são
comumente afetadas pela SM, enquanto mulheres com SM podem apresentar as
características reprodutivas e hormonais típicas da SOP. Esses achados clínicos
podem ser atribuídos apenas parcialmente à presença da obesidade em ambas as
síndromes. Adicionalmente, mulheres adultas com SM estão mais propensas ao
desenvolvimento de doenças cardiovasculares, da mesma forma que mulheres com
SOP também convivem com esse risco durante a pós-menopausa (11).
A definição da SM proposta pela National Cholesterol Education Program
Adult Treatment Panel III (NCEP ATPIII) (19) é a mais comumente usada para fins
clínicos e de pesquisa, considera a circunferência da cintura ≥ 102 cm para homens e
≥ 88 cm para mulheres, níveis de triglicerídeos ≥ 150 mg/dl, o HDL-colesterol < 40
mg/dl para homens e < 50 mg/dl par mulheres, glicemia de jejum ≥ 110 mg/dl e
pressão arterial 130 mmHg ou 85 mmHg, a presença de 3 critérios defini o
diagnóstico da síndrome. Para a International Diabetes Federation (IDF) (20)a SM é
definida pela associação entre obesidade abdominal avaliada pela circunferência
abdominal específica para cada grupo étnico, e dois ou mais dos parâmetros, que se
assemelham aos descritos pelo NCEP ATPIII, com a ressalva da glicemia em jejum ≥
100 mg /dl.
A prevalência de SM segundo os critérios do NCEP ATPIII nas pacientes
com SOP é elevada, sendo cerca de duas a quatro vezes maior que a observada em
mulheres da população geral, pareadas para a idade e IMC (21). No Brasil, existe um
elevado índice de SM nas mulheres com SOP, com prevalência geral de 28,4%,
chegando a 52,3% no subgrupo de mulheres obesas, conforme estudo conduzido em
‐ 18 ‐ Nas pacientes adultas com SOP, a prevalência de SM é maior naquelas com
IMC superior a 27 Kg/m² e naquelas com elevados níveis de insulina, não se
correlacionando com os níveis circulantes de andrógenos (22). Diferentemente, nas
adolescentes com SOP, a hiperandrogenemia é considerada um fator de risco para
SM, independentemente de obesidade, do grau de RI e dos níveis de SHBG (23).
Esses achados ressaltam que a associação entre SM e SOP envolve mecanismos
complexos, a depender não somente de fatores constitucionais, mas também dos
níveis de insulina, andrógenos e índice de massa corporal.
O hiperandrogenismo contribui para a adiposidade visceral e pode amplificar
os fenótipos metabólicos adversos da SOP de duas formas, através do agravamento
da deposição de gordura corporal, predominantemente abdominal e visceral, e da
modificação na produção ou ação das adipocitocinas pró-inflamatórias, tais como
interleucina-6 e o fator de necrose tumoral-α (IL-6 e TNF-α), com consequente
desenvolvimento da RI e hiperinsulinemia (17,24).
A própria hiperinsulinemia, característica fisiopatológica cardinal da SM,
exerce efeito inibitório na liberação do hormônio de crescimento (GH) pelos
somatotrofos. Através do bloqueio na síntese das proteínas carreadoras de IGF
(IGFBPs) pelo fígado, a hiperinsulinemia pode causar aumento da fração livre do
IGF-I (IGF-Insulin-like Growth Factor IGF-I), contribuindo na fisiopatologia da lesão de órgãos –
alvo (25).
2.3 SOP e Hipertensão Arterial Sistêmica
A hipertensão arterial sistêmica (HAS) afeta aproximadamente um terço dos
indivíduos em todo o mundo e, por essa razão, constitui-se em um dos mais
importantes fatores de risco para as doenças cardiovasculares (DCV) (26,27). Sua
morbimortalidade por DCV nas nações desenvolvidas e em desenvolvimento, bem
como é responsável por alta frequência de internações, com custos médicos e
socioeconômicos elevados (16).
A HAS é uma condição clínica multifatorial caracterizada por níveis elevados
e sustentados de pressão arterial. Associa-se freqüentemente com alterações
funcionais e/ou estruturais dos órgãos-alvo e alterações metabólicas, com
conseqüente aumento do risco de eventos cardiovasculares fatais e não fatais (28).
Numerosas evidências têm demonstrado que a aterosclerose se inicia na
infância e pode progredir lentamente até a vida adulta (29). Estudos longitudinais que
acompanharam crianças e adolescentes ao longo do tempo evidenciaram que a
presença dos fatores de risco em etapas precoces de vida é importante preditor de
anormalidades cardiovasculares futuras (16). O clássico estudo de Bogalusa trouxe
significativa contribuição para o entendimento do risco cardiovascular, a aterosclerose
e a morbimortalidade associada em crianças, adolescentes e adultos jovens (30).
Nesse contexto, por representar o maior grupo de mulheres jovens com alta
freqüência de fatores de risco cardiovasculares associados, destaca-se a relevância
da SOP como preditor da ocorrência de complicações cardiometabólicas (10).
Dentre os aspectos fisiopatológicos que podem justificar a associação entre
SOP e níveis pressóricos alterados destaca-se a RI, inflamação crônica,
hiperatividade adrenérgica e secreção de várias adipocitocinas (31). Os mecanismos
pelos quais a RI contribui para elevação da PA incluem modificações na musculatura
lisa vascular, alterando o transporte iônico, com aumento do nível de íons cálcio no
citoplasma e aumento da reatividade vascular às substancias vasoconstrictoras (10).
Além disso, ocasiona hipertrofia do músculo liso vascular com diminuição da
‐ 20 ‐ endotélio, retenção de sódio e ativação do sistema nervoso simpático, alterações que
podem preceder a instalação da HAS (32-34).
Todos os processos fisiopatológicos anteriormente citados estão diretamente
relacionados com a formação da placa aterosclerótica, pela indução de distúrbios nas
vias de sinalização comum tanto à ação da insulina como à produção do óxido nítrico,
aumentando o estresse oxidativo, os níveis de endotelina-1, a atividade do sistema
renina-angiotensina e a secreção de hormônios e citocinas pelo tecido adiposo
(32,35).
Considerando que alguns desses fatores já foram descritos em mulheres
com SOP, justifica-se a realização de estudos para verificar a associação entre SOP
e hipertensão artérial. Luque-Ramirez et al (36), observaram que mulheres com SOP
obesas apresentam aumento da freqüência cardíaca, uma vez que o excesso de
massa gorda leva a RI, aumento de ácidos graxos livres, apnéia obstrutiva do sono e
aumento da secreção de citocinas inflamatórias e leptina, fatores que induzem
ativação simpática e, consequentemente, vasoconstrição, ativação do sistema renina-
angiotensina e retenção de sódio. Em nosso meio, um estudo envolvendo análise da
variabilidade da freqüência cardíaca batimento-a-batimento mostrou que as mulheres
com SOP têm uma pior modulação autonômica cardíaca, em comparação com o
grupo controle, e que essa associação está fortemente relacionada ao ganho de
peso, dislipidemia, resistência insulínica e parâmetros de inflamação (37).
O papel da testosterona no desenvolvimento da HAS em pacientes jovens
com SOP é controverso, porém Chen et al (38) demonstraram que o índice de
andrógenos livres e os níveis de testosterona total se correlacionam com a pressão
arterial sistólica e pressão arterial diastólica, de maneira independente da presença
de RI, obesidade ou dislipidemia. A testosterona é capaz de estimular a reabsorção
estímulo do sistema renina-angiotensina-aldosterona, aumentando o volume
extracelular e a pressão arterial. Nas mulheres com SOP, a atividade plasmática da
renina está elevada quando comparada ao grupo controle (38,39).
Em suma, as evidências apontam que HAS é um fator de risco cardiovascular
modificável que pode levar a sérios desfechos clínicos. Por outro lado, inúmeros
trabalhos demonstram que a SOP se associa a modificações endócrinas e
metabólicas que afetam adversamente o perfil de risco cardiovascular. Desse modo,
justifica-se a realização do presente estudo, com objetivo de avaliar a prevalência de
anormalidades da pressão arterial em mulheres jovens com SOP, na população
brasileira, como subsídio para a formulação de medidas preventivas e curativas
nesse grupo de pacientes.
‐ 22 ‐ 3 ARTIGO
NÍVEIS PRESSÓRICOS ELEVADOS EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E FATORES DE RISCO
ASSOCIADOS
Níveis pressóricos elevados em mulheres com síndrome dos ovários policísticos:
prevalência e fatores de risco associados
Elevated blood pressure in women with polycystic ovary syndrome: prevalence and
associated risk factors
Maria Fátima de Azevedo1,2, Eduardo Caldas Costa1,3, Arthur Ivan Nobre Oliveira3,
Isabelle Braz de Oliveira Silva3, Joice Cristina Dantas Brandão Marinho3, Julieta Alice
Moreno Rodrigues3,George Dantas Azevedo3,4
1Programa de Pós-graduação em Ciências da Saúde, Universidade Federal do Rio
Grande do Norte, Natal-RN, Brasil; 2Departamento de Medicina Clínica, Centro de
Ciências da Saúde, Universidade Federal do Rio Grande do Norte, Natal-RN, Brasil;
3
Grupo de Pesquisa Saúde da Mulher, Universidade Federal do Rio Grande do Norte,
Natal-RN, Brasil; 4Departamento de Morfologia, Centro de Biociências, Universidade
Federal do Rio Grande do Norte, Natal-RN, Brasil.
Financiamento parcial do CNPq, FAPERN, Ministério da Saúde e Secretaria Estadual
de Saúde Pública do RN (Edital PPSUS – Pesquisa para o SUS).
George Dantas de Azevedo. Departamento de Morfologia, Centro de Biociências,
‐ 24 ‐
Universitário. 59078-970 – Natal/RN. Fone: (84) 3215 3431. E-mail:
georgedantas@uol.com.br
Resumo
Objetivo: Mulheres com síndrome dos ovários policísticos (SOP) têm elevada
prevalência de síndrome metabólica (SM), diabetes tipo 2 e complicações
cardiovasculares. Embora já esteja englobada no contexto da SM, a associação entre
pressão arterial (PA) alterada e SOP ainda não está completamente esclarecida.
Portanto, o objetivo do presente estudo foi investigar a prevalência de níveis
pressóricos elevados em pacientes com SOP e correlacionar os níveis de PA com
outros fatores de risco cardiovascular. Métodos: Por meio de estudo transversal foram
alocadas 113 mulheres com SOP (26,2±4,3 anos) e um grupo controle de mulheres
saudáveis da população geral (n=242; 26,8±5,0 anos). Valores de PA foram
classificados de acordo com as V Diretrizes Brasileiras de Hipertensão. Resultados: O
grupo SOP apresentou prevalência de PA alterada (≥130/85 mmHg)
significativamente superior ao grupo controle (18,6% vs. 9,9%, respectivamente;
p<0,05). Mulheres com SOP apresentaram valores médios superiores de PA sistólica,
índice de massa corporal (IMC), circunferência da cintura (CC), triglicerídeos e
glicemia de jejum, além de níveis inferiores de HDL - colesterol, em comparação ao
grupo controle (p<0,01). No grupo SOP, os valores de PA sistólica e diastólica
apresentaram correlação positiva significativa com a idade, IMC, CC e triglicerídeos
(p<0,05). Conclusões: De acordo com os resultados obtidos, é possível concluir que a
freqüência de mulheres com valores acima do limite da normalidade das cargas
pressóricas foi significativamente maior no grupo SOP, em relação ao grupo controle.
Adicionalmente, os valores de PA se correlacionaram com outros fatores de risco
em mulheres com SOP, no sentido de evitar eventos mórbidos relacionados ao
sistema cardiovascular.
Palavras-chave: síndrome dos ovários policísticos, hipertensão arterial, fatores de
risco, síndrome metabólica, doenças cardiovasculares.
Abstract
Purpose: Women with polycystic ovary syndrome (PCOS) show increased prevalence
of metabolic syndrome (MS), type 2 diabetes and cardiovascular complications.
Although it already encompasses MS, the association between altered blood pressure
(BP) and PCOS is still not fully understood. Therefore, the purpose of this study was
to investigate the prevalence of altered BP in a sample of women with PCOS and
compare the levels of BP with other cardiovascular risk factors. Methods: A
cross-sectional study composed of 113 PCOS women (26.2±4.3 years) and a control group
of healthy women from the general population (n=242; 26.8±5.0 years). BP values
were classified according to the V Brazilian Guidelines of Hypertension. Results: The
PCOS group showed higher prevalence of altered BP (≥130/85 mmHg) than the
control group (18.4% vs. 9.9%, respectively; p<0.05). PCOS women had higher mean
systolic BP, body mass index (BMI), waist circumference (WC), triglycerides and
fasting glucose, and lower HDL-cholesterol, compared with the control group (p<0.01).
In the PCOS group, the values of systolic and diastolic BP showed a significant
positive correlation with age, BMI, WC and triglycerides (p<0.05). Conclusion:
According with obtained results, it’s possible conclude that the frequency of women
with values of BP above the normal limit was significantly higher in the PCOS group
than in the control group. The BP values also correlated with other cardiovascular risk
factors. These findings underscore the importance of preventive strategies in PCOS
‐ 26 ‐ Keywords: polycystic ovary syndrome, hypertension, risk factors, metabolic syndrome,
cardiovascular diseases.
Níveis pressóricos elevados em mulheres com síndrome dos ovários policísticos:
prevalência e fatores de risco associados
Elevated blood pressure in women with polycystic ovary syndrome: prevalence and
associated risk factors
Introdução
A síndrome dos ovários policísticos (SOP) é uma das mais comuns
endocrinopatias que acometem mulheres em idade reprodutiva, com prevalência
variando entre 5-10%1-3. Trata-se de uma disfunção ovariana caracterizada por
anovulação crônica, oligo-amenorréia, hiperandrogenismo, infertilidade e presença de
ovários morfologicamente policísticos3.
Vários estudos realizados em pacientes com SOP, especialmente no âmbito
das alterações cardiovasculares e metabólicas, já evidenciaram associação
importante com dislipidemia, resistência insulínica (RI), diabetes tipo 2 e obesidade4-8.
Tais fatores, juntamente com alteração nos níveis pressóricos, compõem a síndrome
metabólica (SM), uma entidade clínica intimamente relacionada à SOP e fortemente
associada ao aumento do risco cardiovascular9,10.
A hipertensão arterial (HAS) apresenta elevada prevalência em todo o mundo
e cursa com alta morbimortalidade, caracterizando-se como importante fator de risco
cardiovascular. Tem etiologia multifatorial, apresentando relação com fatores
elucidada11-13. No contexto clínico, a identificação dos fatores modificáveis que
contribuem para o desenvolvimento da HAS é de fundamental importância, a fim de
que medidas preventivas possam ser implementadas precocemente12,13.
A associação entre HAS e SOP ainda não está completamente esclarecida
14-16
. Embora a alteração dos níveis pressóricos já esteja englobada no contexto da SM
e possa ser relacionada com os distúrbios metabólicos comumente encontrados
nessa população, há uma carência de estudos no que diz respeito à prevalência de
níveis pressóricos alterados em mulheres brasileiras com SOP e os fatores de risco
cardiovascular associados a essa condição. A investigação dessa problemática pode
contribuir para o preenchimento de lacunas científicas em relação ao risco
cardiovascular em pacientes com SOP, fornecendo embasamento para a prevenção
e o diagnóstico precoce de HAS nessa parcela específica da população feminina.
Diante do exposto, o objetivo do presente estudo foi analisar a prevalência de
níveis pressóricas alterados em pacientes com SOP, atendidas no ambulatório de
Ginecologia Endócrina da Maternidade Escola Januário Cicco da Universidade
Federal do Rio Grande do Norte (UFRN), Natal-RN, e verificar os fatores de risco
cardiovascular associados, em comparação a um grupo controle constituído por
mulheres saudáveis da mesma faixa etária.
Métodos
A pesquisa em questão utilizou um desenho do tipo observacional, de caráter
transversal e analítico. Foram estudados dois grupos de mulheres na faixa etária de
18 a 34 anos: o grupo caso, formado por mulheres com diagnóstico de SOP e o
grupo controle, composto por mulheres hígidas, não grávidas, da população geral. O
tamanho amostral foi definido por meio de técnica de amostragem por
‐ 28 ‐ bairro da cidade de Natal-RN, de acordo com a proporção populacional dos mesmos.
Para esse cálculo estatístico foi adotado poder de 80% e alfa de 5%. Os dados foram
coletados durante o período de julho de 2004 a julho de 2008.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital
Universitário Onofre Lopes da UFRN (n° 126/04) e todas as voluntárias que
concordaram em participar do estudo assinaram termo de consentimento livre e
esclarecido.
O grupo SOP foi formado por 113 mulheres residentes na cidade de Natal-RN,
recrutadas no ambulatório de Ginecologia Endócrina da Maternidade Escola Januário
Cicco da UFRN. O diagnóstico de SOP foi firmado de acordo com os critérios de
Rotterdam3, pela presença de pelo menos dois dos três fatores seguintes: 1) oligo ou
anovulação, caracterizado por oligomenorréia ou amenorréia; 2) sinais clínicos de
excesso de androgênio (hirsutismo e/ou presença de acne) e/ou elevação dos níveis
séricos de testosterona; e 3) achados ultrassonográficos de morfologia policística dos
ovários (presença de 12 ou mais folículos em cada ovário medindo entre 2 e 9 mm de
diâmetro e/ou aumento de volume ovariano > 10 mL).
O grupo controle foi selecionado a partir de uma amostra representativa da
população feminina residente na cidade do Natal-RN, compreendendo inicialmente
534 mulheres, não grávidas, que se submeteram à aplicação de questionário e
exame físico direcionado. Dessas, 339 participaram da segunda fase da coleta de
dados, que consistiu na realização de dosagens bioquímicas e hormonais. Desse
subgrupo, foram selecionadas 242 pacientes por contemplarem os critérios de
inclusão estabelecidos: ser saudável, ter entre 18-34 anos, apresentar ciclos
menstruais regulares e não apresentar achados clínicos sugestivos de
Foram excluídas de ambos os grupos mulheres com diagnóstico prévio de
hiperplasia adrenal congênita forma não clássica, disfunção de tireóide e
hiperprolactinemia. Outros critérios de exclusão foram: disfunção renal, disfunção
hepática e uso de medicações com potencial para afetar a função reprodutiva ou
metabólica, tais como contraceptivos orais, drogas antiandrogênicas,
hipoglicemiantes orais, estatinas ou terapia com glicocorticóides, até 60 dias antes de
ingressarem no estudo.
Todas as pacientes foram submetidas a exame clínico constando de medida
da massa corporal (kg), estatura (m), circunferências da cintura (CC) e pressão
arterial (PA). A CC foi mensurada no ponto médio entre a última costela e a crista
ilíaca. O índice de massa corporal (IMC) foi calculado pela seguinte fórmula: massa
corporal (kg) / estatura² (m), sendo expresso em kg/m². A categorização do IMC foi
realizada de acordo com critérios estabelecidos pela Organização Mundial da Saúde
(OMS)17.
A medida da PA foi realizada pelo método auscultatório, estando a paciente
sentada e utilizando manguito de tamanho adequado à circunferência do braço,
respeitando-se a proporção largura/comprimento de 1:2. Foram realizadas três
aferições da PA, com intervalo de dois minutos entre elas, sendo considerada a
média das duas últimas medidas. A classificação das pacientes no que se refere a PA
foi realizada de acordo com as V Diretrizes Brasileiras de HAS13.
Amostras de sangue venoso foram coletadas entre 08h00min e 10h00min,
após jejum prévio de 12 horas. A glicose sérica foi medida pelo método glicose
oxidase e os níveis de colesterol total, HDL-colesterol e triglicerídeos foram
‐ 30 ‐ LDL-colesterol foi calculado usando a fórmula de Friedewald: LDL-colesterol =
colesterol total (HDL-colesterol + triglicerídeos / 5).
Os dados apresentaram distribuição normal, avaliados pelo método
Kolmogorov Smirnov. Os resultados estão expressos em média, desvio padrão da
média, freqüência absoluta e freqüência relativa. Para análise de diferença entre os
grupos foram utilizados o teste t de Student para amostras independentes e o teste
qui-quadrado. Para análise de correlação entre a PA e variáveis antropométricas e
bioquímicas foi utilizado o coeficiente de correlação de Pearson. O pacote estatístico
SPSS® versão 17.0 para Windows (SPSS, Inc., Chicago IL) foi utilizado para esses
fins, sendo considerado estatisticamente significativo um p-valor < 0,05.
Resultados
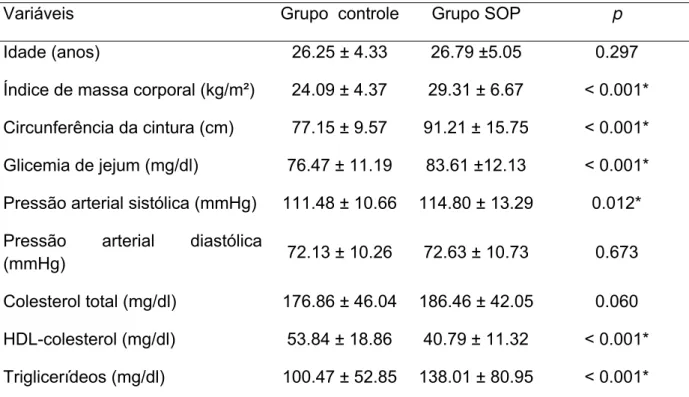
Conforme apresentado na tabela 1, os grupos foram homogêneos com
relação à idade. Entretanto, o grupo SOP apresentou maior média de IMC, CC,
glicemia de jejum, triglicerídeos e PA sistólica, além de menor média de HDL -
Tabela 1. Características clínicas e laboratoriais dos grupos estudados.
Variáveis Grupo controle Grupo SOP p
Idade (anos) 26.25 ± 4.33 26.79 ±5.05 0.297
Índice de massa corporal (kg/m²) 24.09 ± 4.37 29.31 ± 6.67 < 0.001*
Circunferência da cintura (cm) 77.15 ± 9.57 91.21 ± 15.75 < 0.001*
Glicemia de jejum (mg/dl) 76.47 ± 11.19 83.61 ±12.13 < 0.001*
Pressão arterial sistólica (mmHg) 111.48 ± 10.66 114.80 ± 13.29 0.012*
Pressão arterial diastólica
(mmHg) 72.13 ± 10.26 72.63 ± 10.73 0.673
Colesterol total (mg/dl) 176.86 ± 46.04 186.46 ± 42.05 0.060
HDL-colesterol (mg/dl) 53.84 ± 18.86 40.79 ± 11.32 < 0.001*
Triglicerídeos (mg/dl) 100.47 ± 52.85 138.01 ± 80.95 < 0.001*
* - diferença estatisticamente significativa (teste t de Student para amostras independentes – p < 0,05).
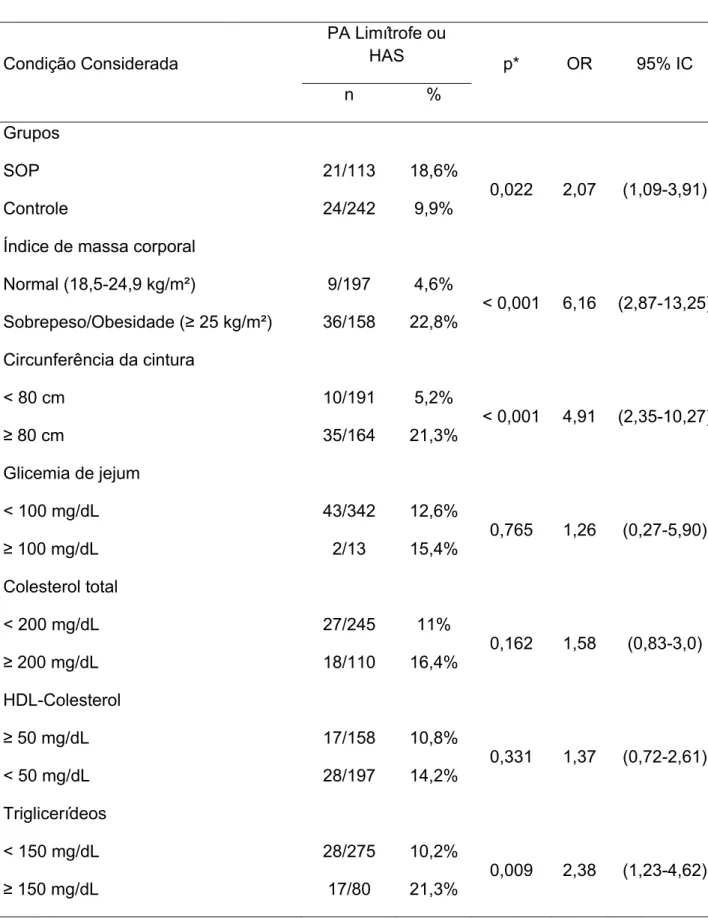
A tabela 2 mostra a associação entre diversas condições de risco
cardiovascular e presença de níveis pressóricos alterados (PA ≥ 130/85 mmHg).
Nesse sentido, foi observada maior prevalência de níveis pressóricos elevados no
grupo SOP quando comparado ao grupo controle (odds ratio = 2,07; intervalo de
confiança 95% = 1,09-3,91). Ainda no tocante às outras condições de risco
cardiovascular, verificou-se que as variáveis sobrepeso/obesidade (IMC ≥ 25 kg/m²),
obesidade central (CC ≥ 80 cm) e níveis alterados de triglicerídeos (≥ 150 mg/dL)
apresentaram associação significativa com a ocorrência de cargas pressóricas
‐ 32 ‐ Tabela 2. Associação entre diversas condições de risco cardiovascular e presença de
níveis pressóricos alterados
Condição Considerada
PA Limítrofe ou
HAS p* OR 95% IC
n % Grupos SOP Controle 21/113 24/242 18,6% 9,9%
0,022 2,07 (1,09-3,91)
Índice de massa corporal
Normal (18,5-24,9 kg/m²)
Sobrepeso/Obesidade (≥ 25 kg/m²)
9/197
36/158
4,6%
22,8%
< 0,001 6,16 (2,87-13,25)
Circunferência da cintura
< 80 cm
≥ 80 cm
10/191
35/164
5,2%
21,3%
< 0,001 4,91 (2,35-10,27)
Glicemia de jejum
< 100 mg/dL
≥ 100 mg/dL
43/342
2/13
12,6%
15,4%
0,765 1,26 (0,27-5,90)
Colesterol total
< 200 mg/dL
≥ 200 mg/dL
27/245
18/110
11%
16,4%
0,162 1,58 (0,83-3,0)
HDL-Colesterol
≥ 50 mg/dL
< 50 mg/dL
17/158
28/197
10,8%
14,2%
0,331 1,37 (0,72-2,61)
Triglicerídeos
< 150 mg/dL
≥ 150 mg/dL
28/275
17/80
10,2%
21,3%
0,009 2,38 (1,23-4,62)
No que se refere à correlação entre a PA sistólica (PAS) e diastólica (PAD)
com os fatores de risco cardiovascular analisados na presente pesquisa, é possível
observar que, em ambos os grupos (SOP e controle), houve correlação dos níveis
pressóricos com idade, IMC e CC. Além disso, no grupo SOP foi observada
correlação entre PAS e PAD com triglicerídeos (Tabela 3).
Tabela 3. Correlação entre variáveis antropométricas e bioquímicas com a pressão
arterial sistólica e diastólica em mulheres com SOP e controle
Grupos
SOP (n=113) Controle (n=242)
Variáveis
PAS
(mmHg)
PAD
(mmHg)
PAS
(mmHg)
PAD
(mmHg)
Idade (anos) 0.343* 0.373* 0.190* 0.215*
Índice de massa corporal (kg/m²) 0.450* 0.561* 0.299* 0.283*
Circunferência da cintura (cm) 0.482* 0.559* 0.306* 0.282*
Glicemia de jejum (mg/dl) 0.127 0.049 0.059 0.018
Colesterol total (mg/dl) 0.152 0.174 0.103 0.133*
HDL-colesterol (mg/dl) 0.049 -0.054 0.019 -0.069
Triglicerídeos (mg/dl) 0.358* 0.295* 0.006 0.001
PAS – pressão arterial sistólica; PAD – pressão arterial diastólica; * - correlação estatisticamente significativa (p < 0,05 – coeficiente de correlação de Pearson).
Analisando especificamente o grupo com SOP, as variáveis associadas com
maior prevalência de alteração nos níveis pressóricos (PA ≥ 130/85 mmHg) foram
IMC ≥ 30 kg/m², CC ≥ 88 cm e níveis aumentados de triglicerídeos (≥ 150 mg/dL)
‐ 34 ‐ Tabela 4. Prevalência de níveis pressóricos alterados em mulheres com síndrome
dos ovários policísticos, de acordo com diferentes variáveis antropométricas e
bioquímicas
Grupo SOP (n=113)
Variáveis Categorias Normotensa Limítrofe/HAS p
Índice de massa corporal (kg/m²) Normal Sobrepeso Obesidade 35 (100%) 25 (89,3%) 32 (64%) - 03 (10,7%) 18 (36%) 0,001*
Circunferência da cintura (cm)
< 80
80 < 88
≥ 88
31 (96,9%) 14 (93,3%) 47 (71,2%) 01 (3,1%) 01 (6,7%) 19 (28,8%) 0,019*
Glicemia de jejum (mg/dl)
< 100
100 < 110
≥ 110
85 (81%) 05 (100%) 02 (66,7%) 20 (19%) - 01 (33,3%) 0,643
Colesterol total (mg/dl)
< 200
≥ 200
63 (81,8%)
29 (80,6%)
14 (18,2%)
07 (19,4%)
0,934
HDL - colesterol (mg/dl)
< 50
≥ 50
69 (80,2%) 23 (85,2%) 17 (19,8%) 04 (14,8%) 0,793 Triglicerídeos (mg/dl) < 150
≥ 150
66 (88%)
26 (68,4%)
09 (12%)
12 (36,6%)
0,041*
Discussão
Os resultados do presente estudo mostram que a prevalência de níveis
pressóricos elevados (pressão limítrofe e HAS) em mulheres jovens com SOP da
região Nordeste do Brasil é significativamente superior à prevalência observada na
população geral de mesma faixa etária. Somado a isso, verificou-se que o estado de
sobrepeso/obesidade e o aumento dos triglicerídeos séricos foram fatores associados
significativamente com o aumento dos níveis pressóricos nas pacientes com SOP.
Analisando-se a prevalência detectada de anormalidade dos níveis pressóricos
em mulheres com SOP, em relação aos resultados de diversos estudos conduzidos
no Brasil sobre a prevalência de HAS em mulheres jovens18-20, nossos dados alertam
para a relevância da provável associação entre SOP e alteração da PA. Tal fato
merece ainda mais atenção se considerarmos que a elevação das cargas pressóricas
representa um fator de risco independente, linear e contínuo para doença
cardiovascular (DCV)12.
Dentre os aspectos fisiopatológicos que podem justificar a associação entre
SOP e níveis pressóricos alterados destaca-se a RI, característica bastante comum
nessas pacientes21, 22. Os mecanismos pelos quais a RI contribui para elevação da
PA incluem diminuição da complacência arterial e interferência no mecanismo de
vasodilatação dependente do endotélio, alterações que podem preceder a instalação
da HAS23, 24. Além disso, esses processos fisiopatológicos estão diretamente
relacionados com a formação da placa aterosclerótica, que desempenha papel central
no desenvolvimento da disfunção endotelial (evento precoce no processo de
aterosclerose), pela indução de distúrbios nas vias de sinalização comum tanto à
‐ 36 ‐ estresse oxidativo, os níveis de endotelina-1, a atividade do sistema
renina-angiotensina e a secreção de hormônios e citocinas pelo tecido adiposo23, 25,26. Todo
esse quadro favorece a instalação de um perfil de risco cardiometabólico relevante
nas mulheres com SOP.
Somado aos aspectos supracitados, os valores superiores de IMC e CC
observados no grupo SOP evidenciam maior freqüência de sobrepeso/obesidade e
distribuição de gordura centralizada nessa população, achado já demonstrado
previamente por outros autores27-30. Este dado ganha importância considerando os
relatos prévios de Luque-Ramirez et al.31, que sugerem uma associação mais
significativa entre aumento ponderal e valores de PA nas pacientes com SOP do que
em mulheres hígidas. Nesse sentido, estudos sugerem que nas mulheres com SOP o
excesso de adiposidade abdominal poderia contribuir para a hiperatividade do eixo
hipotálamo-hipófise-adrenal, com conseqüente desenvolvimento de um
hipercortisolismo funcional32, 33.
Adicionalmente, o aumento da atividade do sistema nervoso simpático (SNS)
no leito vascular contribui para elevar o risco cardiovascular nas mulheres com
SOP32. Nesse contexto, a concentração sérica de testosterona pode ser um forte e
independente preditor da elevada atividade do SNS e PAS34. Somado a isso, o
aumento da atividade do SNS está associado com ativação do sistema
renina-angiotensina, gerando um ciclo vicioso de estimulação entre os dois sistemas mais
poderosos no que se refere ao controle da PA35.
Interessantemente, Chen et al.36 evidenciaram uma associação que corrobora
o que foi exposto previamente. Esses autores demonstraram correlação positiva entre
SOP, independente da idade, RI, obesidade e dislipidemia. A despeito desses
achados, os mecanismos pelos quais o estado hiperandrogênico provoca a elevação
dos níveis pressóricos ainda permanecem não completamente elucidados.
No que diz respeito à análise dos níveis pressóricos de forma dicotomizada, os
resultados do presente estudo apontam que a média da PAS do grupo SOP foi
superior a encontrada nas mulheres hígidas (ver Tabela 1). Achado semelhante foi
relatado por Holte et al.18 em estudo envolvendo monitorização ambulatorial da
pressão arterial (MAPA). Os autores demonstraram que o grupo SOP apresentou
maior média de PAS (126 ± 11 vs. 119 ± 12 mmHg) e PA média (92 ± 7 vs. 86 ± 7
mmHg) durante o dia, em relação ao grupo controle, constituído por mulheres com
ovários normais e regularidade menstrual.
De acordo com os resultados obtidos no presente estudo, é possível concluir
que, na população considerada, a prevalência de níveis pressóricos alterados (PA ≥
130/85 mmHg) em mulheres jovens com SOP é quase o dobro da registrada nas
mulheres hígidas da população geral (18,6 vs. 9,9%). Somado a isso, verificou-se,
especificamente no grupo SOP, que as pacientes obesas e com concentração
elevada de triglicerídeos apresentaram maior prevalência de elevação dos níveis
pressóricos.
Esses achados alertam para a importância da adoção de estratégias
preventivas e terapêuticas com foco na redução do sobrepeso/obesidade e
dislipidemia, visando ao controle mais adequado da PA nesse subgrupo específico da
população feminina. Para tal, o investimento na modificação do estilo de vida dessas
pacientes deve ser considerado, principalmente com adoção de dieta saudável e
‐ 38 ‐ encontram-se em andamento, com objetivo de melhor elucidar os mecanismos
fisiopatológicos envolvidos na associação entre SOP e elevação das cargas
pressóricas.
Agradecimentos
Às Doutoras Elvira Maria M. Soares, Técia Maria de O. Maranhão pelo
recrutamento das pacientes no ambulatório de Ginecologia Endócrina da Maternidade
Escola Januário Cicco. À Doutora Telma Maria de A. M. Lemos pela realização dos
exames bioquímicos no laboratório de Análises Clínicas e Toxicológicas da
Referências
1. Asunción M, Calvo RM, San Millán JL, Sancho J, Avila S, Escobar-Morreale HF. A
prospective study of the prevalence of the polycystic ovary syndrome in unselected
Caucasian women from Spain. J Clin Endocrinol Metab. 2000; 85(7):2434-8.
2. Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic Ovary Syndrome.
Lancet. 2007; 370:685-97.
3. The Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group.
Revised 2003 consensus on diagnostic criteria and long-term health risks related
to polycystic ovary syndrome. Fertil Steril. 2004;81(1):19-25.
4. Kandaraki E, Christakou C, Diamanti-Kandarakis E. Metabolic syndrome and
polycystic ovary syndrome... and vice versa. Arq Bras Endocrinol Metabol. 2009;
53(2): 227-37.
5. Kuba VM, Cavalieri PM, Christóforo AC, Faria Junior R, Caetano R, Coeli CM, et
al. Insulin resistance and metabolic profile in lean and overweight/obese polycystic
ovary syndrome patients. Arq Bras Endocrinol Metabol. 2006; 50(6):1026-33.
6. Soares EM, Azevedo GD, Gadelha RG, Lemos TM, Maranhão TM. Prevalence of
the metabolic syndrome and its components in Brazilian women with polycystic
ovary syndrome. Fertil Steril. 2008; 89(3): 649-55.
7. Ehrmann D, Liljenquist D, Kasza K, Azziz R, Legro R, Ghazzi M, et al. Prevalence
and predictors of the metabolic syndrome in women with polycystic ovary
syndrome. J Clin Endocrinol Metab. 2006; 91(1):48-53.
8. Apridonidze T, Essah P, Iuorno M, Nestler JE. Prevalence and characteristics of
metabolic syndrome in women with polycystic ovary syndrome. J Clin Endocrinol
‐ 40 ‐ 9. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al.
Diagnosis and management of the metabolic syndrome: an American Heart
Association/National Heart, Lung, and Blood Institute scientific statement. Curr
Opin Cardiol. 2006; 21(1): 1-6.
10. Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet. 2005;
365:1415-28.
11. He J, Whelton PK. Epidemiology and prevention of hypertension. Med Clin North
Am. 1997; 81:1077-97.
12. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al.
Seventh Report of the Joint National Committee on prevention, detection,
evaluation, and treatment of high blood pressure. Hypertension. 2003; 42:1206-52.
13. V Diretrizes Brasileiras de Hipertensão Arterial – Sociedade Brasileira de
Cardiologia, Sociedade Brasileira de Hipertensão, Sociedade Brasileira de
Nefrologia. Arq Bras Cardiol. 2007; 89:(3):24-e79.
14. Zimmermann S, Phillips RA, Dunaif A, Finegood DT, Wilkenfeld G, Ardeljan M, et
al. Polycystic ovary syndrome: lack of hypertension despite profound insulin
resistance. J Clin Endocrinol Metab. 1992; 75:508-13.
15. Holte J, Gennarelli G, Berne C, Bergh T, Lithell H. Elevated ambulatory day-time
blood pressure in women with polycystic ovary syndrome: a sign of a
pre-hypertensive state? Hum Reprod. 1996; 11:23-8.
16. Sampson M, Kong C, Patel A, Unwin R, Jacobs HS. Ambulatory blood pressure
profiles and plasminogen activator inhibitor (PAI-1) activity in lean women with and
without the polycystic ovary syndrome. Clin Endocrinol (Oxf). 1996; 45:623-9.
17. World Health Organization. Obesity preventing and managing the global epidemic.
18. Passos VMA, Assis TD, Barreto SM. Hipertensão arterial no Brasil: estimativa de
prevalência a partir de estudos de base populacional. Epidemiol. Serv. Saúde.
2006; 15(1): 35-45.
19. Hartmann M, Dias-da-Costa JS, Olinto MTA, Pattussi MP, Tramontini A.
Prevalência de hipertensão arterial sistêmica e fatores associados: um estudo de
base populacional em mulheres no Sul do Brasil. Cad. Saúde Pública. 2007;
23(8): 1857-66.
20. Castro RAA, Moncau JEC, Marcopito LF. Prevalência de hipertensão arterial
sistêmica na cidade de Formiga, MG. Arq Bras Cardiol. 2007;88(3):334-9.
21. Teede HJ, Hutchison S, Zoungas S, Meyer C. Insulin resistance, the metabolic
syndrome, diabetes, and cardiovascular disease risk in women with PCOS.
Endocrine. 2006; 30(1): 45-53.
22. Lord J, Thomas R, Fox B, Acharya U, Wilkin T. The central issue? Visceral fat
mass is a good marker of insulin resistance and metabolic disturbance in women
with polycystic ovary syndrome. BJOG. 2006; 113(10): 1203-9.
23. Puder JJ, Varga S, Kraenzlin M, De Geyter C, Keller U, Müller B. Central fat
excess in polycystic ovary syndrome: relation with low-grade inflammation and
insulin resistance. J Clin Endocrinol Metab. 2005; 90(11): 6014-21.
24. Kelly CJG, Speirs A, Gould GW, Petrie JR, Lyall H, Connell JMC. Altered vascular
function in young women with polycystic ovary syndrome. J Clin Endocrinol Metab.
2002; 87:742-6.
25. Silva, RC, Pardini D P, Kater CE. Síndrome dos ovários policísticos, síndrome
metabólica, risco cardiovascular e o papel dos agentes sensibilizadores da
insulina. Arq Bras Endocrinol Metab. 2006; 50(2):281-90.
26. Hall JE, Zappe D, Kassab S. Mechanism of obesity induced hypertension. New
‐ 42 ‐ 27. Cleland SJ, Petrie JR, Small M, Elliott HL, Connell JM. Insulin action is associed
with endothelial function in hypertension and type 2 diabetes Hypertension 2000;
35:507-11.
28. Cascella T, Palomba S, De Sio I, Manguso F, Giallauria F, De Simone B, et al.
Visceral fat is associated with cardiovascular risk in women with polycystic ovary
syndrome. Hum Reprod. 2008;23:153-9.
29. Carmina E, Bucchieri S, Esposito A, Del Puente A, Mansueto P, Orio F, Di Fede G,
Rini G. Abdominal fat quantity and distribution in women with polycystic ovary
syndrome and extent of its relation to insulin resistance. J Clin Endocrinol Metab.
2007; 92:2500-5.
30. Costa EC, Soares EM, Lemos TM, Maranhão TM, Azevedo GD. Central obesity
índex and cardiovascular risk factors in polycystic ovary syndrome. Arq Bras
Cardiol 2010;94:633-8.
31. Luque-Ramirez M, Alvarez-Blasco F, Mendieta-Azcona C, Botella-Carretero JI,
Escobar-Morreale HF. Obesity is the major determinant of the abnormalities in
blood pressure found in young women with the polycystic ovary syndrome. J. Clin.
Endocrinol. Metab. 2007; 92:2141-8.
32. Sverrisdottir YB, Mogren T, Kataoka J, Janson PO, Stener-Victorin E. Is polycystic
ovary syndrome associated with high sympathetic nerve activity and size at birth?
AM J Physiol Endocrinol Metab. 2008;294:576-81
33. Pasquali R, Cantobelli S, Casimirri F, Capelli M, Bortoluzzi L, Flamia R, et al. The
hypothalamic-pituitary-adrenal axis in obese women with different patterns of body
fat distribution. J Clin Endocrinol Metab. 1993;77:341-6.
34. Wu ZY, Wu XK, Zhang YW. Relationship of menopausal status and sex hormones
35. Homburg R. Androgen circle of polycystic ovary syndrome. Hum Reprod. 2009;
24(7):1548-55.
36. Chen MJ, Yang WS, Yang JH, Chen CL, Ho HN, Yang YS. Relationship between
androgen levels and blood pressure in young women with polycystic ovary
‐ 44 ‐
4 COMENTÁRIOS, CRÍTICAS E CONCLUSÕES
Tudo começou quando estava próximo do fim, parece paradoxal, mas é real.
Ao perceber que o tempo normal do exercício na academia estava para ser
concluído, despertou um enorme desejo interior de realizar promessas perdidas nas
esquinas da vida, como agregar ao currículo a formação Stricto Sensu.
O encontro com Programa de Pós-Graduação do Centro de Ciências da
Saúde tem sido surpreendente, o acolhimento foi uma experiência encantadora, um
misto de solidariedade, compreensão, sinergia e respeito. Na busca do saber me
entreguei ao aprendizado passo a passo, vencendo o medo inicial, as limitações do
tempo, as dificuldades com as novas competências, arriscando, pedindo ajuda e
saboreando tudo que me ensinavam. Aprendi com os professores especialmente com
professor George Dantas de Azevedo que o saber tem sabor quando resulta de
experiências vindas dos experimentos, das vivências observacionais. Leonardo Boff
tem razão – “O Sábio vê além das aparências. Não se deixa iludir por elas”.
Com o incentivo e apoio, o projeto de pesquisa foi elaborado com o propósito
de responder a uma questão não esclarecida, como a prevalência de níveis
pressóricos elevados em mulheres com SOP em comparação ao grupo controle e
fatores de risco associados. Este trabalho recebeu financiamento parcial do CNPq,
FAPERN, Ministério da Saúde e Secretaria Estadual da Saúde através do Edital
PPSUS (Pesquisa para o SUS).
Os resultados do nosso estudo nos permitem concluir que a SOP se associa
a fatores de risco cardiovasculares. Mulheres com SOP apresentam maior
prevalência de níveis elevados da pressão arterial e isso pode contribuir para
Mundialmente a doença cardiovascular é a maior causa de morte entre as
mulheres, é responsável por um terço de todos os óbitos.. O número de vítimas fatais
e não fatais, o impacto econômico, social e na saúde publica é imensurável.
Intervenções populacionais de base e individuais são fundamentais para reduzir a a
carga global das doenças cardiovasculares nas mulheres. Mesmo modestos
controles como a redução, em uma década, de apenas 2% da mortalidade impediria
36 milhões de mortes no mundo (40).
As evidências têm demonstrado uma prevalência elevada de doença
cardiovascular em mulheres com SOP, isso tem preocupado a comunidade científica
mundial, tanto que, recentemente Wild et al. 2010 (34) recomendaram a estratificação
do risco cardiovascular nessa população de mulheres, considerando fatores
familiares, genéticos, ambientais, metabólicos e endócrinos com intenção de
subsidiar as decisões no que se refere a agressividade da terapia preventiva.
Entendendo que, a SOP é uma desordem de múltiplos órgãos, muitos sinais
e sintomas e múltiplos estágios e que o diagnóstico precoce dessa síndrome é de
fundamental importância no sentido de prevenir, nesse grupo de mulheres jovens de
alto risco, o desenvolvimento das complicações cardiovasculares, iniciamos
juntamente com o Departamento de Cardiologia da Mulher da Sociedade Brasileira
de Cardiologia a inclusão desse tema nas programações científicas dos congressos
nacionais e regionais.
Concluindo a primeira fase do meu desafio, sinto-me rejuvenescida, motivada e muito
agradecida pela riqueza de conteúdo que adquiri, por todo incentivo, colaboração e
‐ 46 ‐ 6. REFERÊNCIAS BIBLIOGRÁFICAS
1. Asunción M, Calvo RM, San Millán JL, Sancho J, Avila S, Escobar-Morreale
HF. A prospective study of the prevalence of the polycystic ovary syndrome in
unselected Caucasian women from Spain. J Clin Endocrinol Metab. 2000;
85(7):2434-8.
2. Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic Ovary Syndrome.
Lancet. 2007; 370:685-97.
3. The Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group.
Revised 2003 consensus on diagnostic criteria and long-term health risks
related to polycystic ovary syndrome. Fertil Steril. 2004;81(1):19-25.
4. Ehrmann DA. Polycystic ovary syndrome. N Engl J Med. 2005;352:1223-36.
5. Azziz R, Sanchez A, Knochenhauer ES, Moran C, Lazenby J, Stephens KC, et
al. Androgen excess in women: experience with over 1,000 consecutive
patients. J Clin Endocrinol Metab. 2004; 89(2):453-62.
6. Carmina E. Rosato F, Janni A, Rizzo M, Longo RA. Relative prevalence of
different androgen excess disords in 950 women referred because of clinical
hyperandrogenism. J Clin Endocrinol Metab 2006; 91: 2-6
7. Azziz R, Marin C, Hoq L, Badamgarav E, Song P. Health care-related
economic burden of the polycystic ovary syndrome during the reproductive life
span. J Clin Endocrinol Metab. 2005;90(8):4650-8.
8. Franks S. Diagnosis of polycystic ovarian syndrome: in defense of the
Rotterdam criteria. J Clin Endocrinol Metab. 2006; 91: 786-9
9. Ehrmann D, Liljenquist D, Kasza K, Azziz R, Legro R, Ghazzi M, et al.
Prevalence and predictors of the metabolic syndrome in women with polycystic
10. Silva Rdo C, Pardini DP, Kater CE. Polycystic ovary syndrome, metabolic
syndrome, cardiovascular risk and the role of insulin sensitizing agents. Arq
Bras Endocrinol Metabol 2006;50(2):281-90.
11. Kandaraki E, Christakou C, Diamanti-Kandarakis E. Metabolic syndrome and
polycystic ovary syndrome... and vice versa. Arq Bras Endocrinol Metabol.
2009; 53(2): 227-37.
12. Wild S, Pierpoint T, Mckeigue P, Jacobs H. Cardiovascular disease in women
with polycystic ovary syndrome at long-term follow-up: a retrospective cohort
study. Clin Endocrinol 2000; 52: 595-600.
13. Dunaif A. Insulin resistance and the polycystic ovary syndrome: mecanism and
implications for pathogenes. End Rev 1997; 18: 774-800.
14. Soares EM, Azevedo GD, Gadelha RG, Lemos TM, Maranhão TM. Prevalence
of the metabolic syndrome and its components in Brazilian women with
polycystic ovary syndrome. Fertil Steril. 2008; 89(3): 649-55.
15. Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. Global
burden of hypertension: analysis of worldwide data. Lancet. 2005; 365:217-23.
16. Magalhães MEC, Brandão AA, Pozzan R, et. al. Prevenção da hipertensão
arterial: para quem e quando começar?.Rev Bras Hipertens 2010;17(2):93-97.
17. Swenson TL. The role of the cholesteryl ester transfer protein in lipoprotein
metabolism. Diabetes Metab Rev 1991;7(3):139-53.
18. Chen YD, Sheu WH, Swislocki AL, Reaven GM. High density lipoprotein
turnover in patients with hypertension. Hypertension 1991;17(3):386-93.
19. Third report of the National Cholesterol Education Program (NCEP) expert
panel on detection, evaluation, and treatment of high blood cholesterol in adults
‐ 48 ‐ 20. Alberti KG, Zimmet P, Shaw J; IDF Epidemiology Task Force Consensus
Group. Lancet 2005;366(9491):1059-62.
21. Ehrmann D, Liljenquist D, Kasza K, Azziz R, Legro R, Ghazzi M, et al.
Prevalence and predictors of the metabolic syndrome in women with polycystic
ovary syndrome. J Clin Endocrinol Metab. 2006; 91(1):48-53.
22. Apridonidze T, Essah PA, Luorno MJ, Nestler JE. Prevalence and
characteristics of the metabolic syndrome in women with polycystic ovary
syndrome. J Clin Endocrinol Metab 2005; 90:1929-3.
23. Coviello, AD, Legro RS, Dunaif A. Adolescent girls with polycystic ovary
syndrome have an increased risk of the metabolic syndrome associated with
increasing androgen levels independent of obesity and insulin resistence. J Clin
Endocrinol Metab 2007; 91:492-497.
24. Marshall JC. Obesity in adolescent girls: is excess androgen the real bad
actor?. J Clin Endocrinol Metab 2006; 91(2): 393-5.
25. Barreto-Filho JAS, Oliveira JLM, Marques C, Aguiar-Oliveira MH. Papel do eixo
GH/IGF-1 na fisiopatologia da síndrome metabólica: resistência insulínica e
lesão de órgãos- alvo. Rev Bras Hipertens 2005; 12(3):159-164.
26. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr,
Jones DW, Materson BJ, Oparil S, Wright JT Jr, Roccella EJ; Joint National
Committee on Prevention, Detection, Evaluation, and Treatment of High Blood
Pressure. National Heart, Lung, and Blood Institute; National High Blood
Pressure Education Program Coordinating Committee. Seventh report of the
Joint National Committee on Prevention, Detection, Evaluation, and Treatment
of High Blood Pressure. Hypertension 2003;42(6):1206-52.
27. Williams B. The year in hypertension. J Am Coll Cardiol 2009; 55(1):65-73.
29. Kavey RA, Daniels SR, Lauer RM, Atkins DL, Hayman LL, Taubert K. American
Heart Association Guidelines for Primary Prevention of Atherosclerotic
Cardiovascular Disease Beginning in Childhood. Circulation;2003;107:1562-6.
30. Berenson GS, Srinivasan SR, Bao W, Newman WP 3rd, Tracy RE, Wattigney
WA. Association between multiple cardiovascular risk factors and
atherosclerosis in children and young adults. The Bogalusa Heart Study. N
Engl J Med 1998;338(23):1650-6.
31. Stener-Victorin E, Ploj K, Larsson BM, Holmang A. Rats with steroid-induced
polycystic ovaries develop hypertension and increased sympathetic nervous
system activity. Reprod Biol.Endocrinol 2005;3:44.
32. Kelly CJ, Lyall H, Petrie JR, Gould GW, Connell JM, Rumley A, Lowe GD,
Sattar N. A specific elevation in tissue plasminogen activator antigen in women
with polycystic ovarian syndrome. J Clin Endocrinol Metab 2002;87(7):3287-90.
33. Dokras A. Cardiovascular disease risk factors in polycystic ovary syndrome.
Semin Reprod Med 2008;26(1):39-44.
34. Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF,
Futterweit W, Lobo R, Norman RJ, Talbott E, Dumesic DA. Assessment of
cardiovascular risk and prevention of cardiovascular disease in women with the
polycystic ovary syndrome: a consensus statement by the Androgen Excess
and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab.
2010;95(5):2038-49.
35. Cleland SJ, Petrie JR, Small M, Elliott HL, Connell JM. Insulin action is
associated with endothelial function in hypertension and type 2 diabetes
Hypertension 2000; 35:507-11.
36. Luque-Ramirez M, Alvarez-Blasco F, Mendieta-Azcona C, Botella-Carretero JI,
‐ 50 ‐ blood pressure found in young women with the polycystic ovary syndrome. J
Clin Endocrinol Metab 2007; 92: 2141-2148.
37. de Sá JC, Costa EC, da Silva E, Zuttin RS, da Silva EP, Lemos TM, Azevedo
GD. Analysis of heart rate variability in polycystic ovary syndrome. Gynecol
Endocrinol 2010; in press.
38. Chen MJ, Yang WS, Yang JH, Chen CL, Ho HN, Yang YS. Relationship
between androgen levels and blood pressure in young women with polycystic
ovary syndrome. Hypertension 2007;49(6):1442-7.
39. Reckelhoff JF. Polycystic ovary syndrome: androgens and hypertension.
Hypertension 2007;49(6):1220-1.
40. Evidence-based guidelines for cardiovascular disease prevention in women:
ABSTRACT
Objective: To investigate the prevalence of altered blood pressure in a sample of women with PCOS and compare the levels of BP with other cardiovascular risk
factors.
Methods: Across-sectional study were composed of 113 PCOS women (26.2 ± 4.3 years) and a control group of healthy women from the general population (n = 242,
26.8 ± 5.0 years).
Results: The PCOS group showed higher prevalence of altered BP (≥ 130/85 mmHg) was significantly higher than the control group (18.6% vs. 9.9% respectively, p <0.05).
Women with PCOS had higher mean systolic blood pressure, body mass index (BMI),
waist circumference (WC), triglycerides and fasting glucose, and lower levels of HDL -
cholesterol, compared with the control group (p <0,01). In the PCOS group, the values
of systolic and diastolic BP showed a significant positive correlation with age, BMI,
waist circumference and triglycerides (p <0.05).
Conclusion: The frequency of women with blood pressure values above the normal limit was significantly higher in the PCOS group compared with the control group. The
BP values also correlated with other cardiovascular risk factors. These findings
underscore the importance of preventive strategies in PCOS women to avoid
pathological events related to the cardiovascular system.
Keywords: polycystic ovary syndrome, hypertension, risk factors, cardiovascular disease.