MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
MANIFESTAÇÕES OCULARES EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E ASSOCIAÇÃO COM FATORES
DE RISCO METABÓLICOS E INFLAMATÓRIOS
JOSÉ EDVAN DE SOUZA JÚNIOR
ii
JOSÉ EDVAN DE SOUZA JÚNIOR
MANIFESTAÇÕES OCULARES EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E ASSOCIAÇÃO COM FATORES
DE RISCO METABÓLICOS E INFLAMATÓRIOS
Tese apresentada ao Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte, como requisito para obtenção
do título de Doutor em Ciências da Saúde. .
ORIENTADOR: Prof. Dr. George Dantas de Azevedo
iii
Catalogação da Publicação na Fonte
Universidade Federal do Rio Grande do Norte - UFRN
Souza Júnior, José Edvan de.
Manifestações oculares em mulheres com síndrome dos ovários policísticos: prevalência e associação com fatores de risco metabólicos e inflamatórios / José Edvan de Souza Júnior-Natal. -Natal, 2015.
105 f: il.
Orientador: Prof. Dr. George Dantas de Azevedo.
Tese (Doutorado) – Programa de Pós-graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
1.Doença do olho seco – Tese. 2. Pressão intraocular – Tese. 3. Síndrome dos ovários policísticos – Tese. I. Azevedo, George Dantas de. II. Título.
iv
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
v
JOSÉ EDVAN DE SOUZA JÚNIOR
MANIFESTAÇÕES OCULARES EM MULHERES COM SÍNDROME DOS OVÁRIOS POLICÍSTICOS: PREVALÊNCIA E ASSOCIAÇÃO COM FATORES
DE RISCO METABÓLICOS E INFLAMATÓRIOS
Presidente da Banca: Prof. Dr. George Dantas de Azevedo (UFRN)
BANCA EXAMINADORA:
Prof. Dr Gustavo Salata Romão (UNAERP) Prof. Dr. Francisco Irochima Pinheiro (UNP) Profa. Dra. Elvira Maria Mafaldo Soares (UFRN)
vi
“... Eu quero viver nessa metamorfose ambulante,
do que ter aquela velha opinião formada sobre tudo...”
vii
DEDICATÓRIA
A Deus, força suprema;
A minha esposa Micheline Morgane, pela paciência de conviver comigo durante este período de muitas atribulações, estresses e ausências. Mas, não dispensando o cuidado e carinho para comigo. Amo-te.
Aos meus filhos, Maria Luíza e Matheus José, minhas obras-primas, fonte de estímulo nessa jornada. Amor incomparável.
Aos meus pais, José Edivan e Maria das Graças, pelo exemplo de dignidade e honestidade;
viii
AGRADECIMENTOS
Ao Professor Doutor George Dantas de Azevedo, Orientador diferenciado, muito além da vanguarda do respeito ao orientando. Possuidor de vasto e eclético conhecimento acadêmico-científico, na realidade, os programas de capacitação precisam não somente de “um George, mas de vários Georges”. Produziríamos quantitativamente e qualitativamente mais. Agradeço, Professor, por acreditar na multidisciplinaridade Ginecologia/Oftalmologia.
Ao Professor Dr. André Newton do Monte Negreiros ( In memorian), grande amigo e co-orientador fiel.
Ao Professor Dr. Carlos Alexandre de Amorim Garcia, colaborador e facilitador desse projeto. Sem sua valiosa ajuda, este sonho não teria se realizado;
Às Professoras Doutoras Técia Maranhão, Elvira Mafaldo e Telma Lemos, importantíssimas figuras humanas, essenciais na feitura dessa pesquisa;
Ao Professor Wilton Queiroz pelo apoio na análise bioestatística;
ix
Aos professores, coordenadores, funcionários e alunos do DINTER, companheiros guerreiros;
A todos os funcionários dos ambulatórios de Ginecologia e Oftalmologia, e do LIAC;
x
Lista de abreviaturas, siglas e símbolos
AH Humor aquoso – do inglês, aqueus humor ALT Alanina-aminotransferase
AST Aspartato-aminotransferase
BMI Índice de massa corporal – do inglês, body mass index
CCT Espessura corneana central – do inglês, central corneal thickness C/D Relação entre o diâmetro da escavação e diâmetro do disco
óptico – do inglês, ratio between the diameter of the cup of the optic disc and optical disc diameter
CFNR Camada de fibras nervosas da retina
cm Centímetro
CP1 Componente principal 1 CP2 Componente principal 2
CSF Subcampo central – do inglês, central subfield
D Dioptrias
DED Doença do olho seco – do inglês, dry eye disease DM Diabetes Mellitus
DM2 Diabetes Mellitus tipo 2 DOS Doença do olho seco
DR Retinopatia diabética – do inglês, diabetic retinopathy
Dr. Doutor
xi
ETDRS Pesquisa e estudo do tratamento precoce na retinopatia diabética – do inglês, early treatment diabetic retinopathy study research FSH Hormônio folículo-estimulante – do inglês, Follicle-stimulating
hormone
g Gramas
Gama-GT Gama-glutamiltransferase
Gamma-GT Gama-glutamiltransferase – do inglês, gamma-glutamytransferase
h Horas
HAS Hipertensão arterial sistêmica
HD-OCT Tomografia de coerência óptica de alta definição – do inglês, high-definition optical coherence tomography
HDL-C Lipoproteína da alta densidade-colesterol – do inglês, high-density lipoprotein
HOMA Modelo de avaliação da homeostase – do inglês, homeostasis model assessment
HUOL Hospital Universitário Onofre Lopes
IDF Federação Internacional de Diabetes – do inglês, International Diabetes Federation
IIM Subcampo macular inferior interno – do inglês, inferior inner macula
IL-6 Interleucina-6
IMC Índice de massa corporal
IOM Subcampo macular inferior externo – do inglês, inferior outer macula
xii
LH Hormônio luteinizante – do inglês, luteinizing hormone Kg/m2 Quilograma por metro quadrado
MEJC Maternidade Escola Januário Cicco mg/dl Miligrama por decilitro
mg/l Miligrama por litro mg/ml Miligrama por mililitro min Minutos
ml Mililitro
mlU/ml Mililitro de Unidade Internacional por mililitro mm Milímetro
mm3 Mlilímetro cúbico mmHg Milímetro de mercúrio
MS Síndrome metabólica – do inglês, metabolic syndrome NCEP ATP III Terceiro relatório do programa nacional de educação em Colesterol, painel de tratamento de adulto – do inglês, Third Report National Cholesterol Education Program;
Adult treatment Panel
ng/ml Nanograma por mililitro
NGF Fator de crescimento do nervo – do inglês, nerve growth factor NIM Subcampo macular nasal interno – do inglês, nasal inner macula NOM Subcampo macular nasal externo – do inglês, nasal outer macula OCT Tomografia de coerência óptica – do inglês, optical coherence
xiii OMS Organização Mundial da Saúde
P Probabilidade estatística
PC1 Principal componente 1 PC2 Principal componente 2
PCI Índice pressão/córnea – do inglês, pressure-to-cornea índex PCOS Síndrome dos ovários policísticos – do inglês, polycystic ovary
syndrome
PCR Proteína C reativa pg/ml Picograma por mililitro PIO Pressão intraocular Prof. Professor
Profa. Professora
QUICKI Índice quantitativo de controle de sensibilidade insulínica – do inglês, Quantitative insulin sensitivity check index
RD Retinopatia diabética
RNFLs Camada de fibras nervosas da retina – do inglês, retinal nerve fiber layers
SBP Pressão sanguinea sistólica – do inglês, systolic blood pressure SD Desvio padrão – do ingles, standard deviation
SHBG Globulina ligadora de hormônio sexual – do ingles, sex hormone – binding globulin
SIM Subcampo macular superior interno – do inglês, superior inner macula
xiv SM Síndrome metabólica
SN-DREAMS Sankara Nethralaya – epidemiologia e estudo da genética da Retinopatia diabética – do inglês, Sankara Nethralaya Diabetic Retinopathy Epidemiology and Molecular Genetic Study
SOP Síndrome dos ovários policísticos
TCLE Termo de consentimento livre e esclarecido
TFBUT Tempo de ruptura do filme lacrima – do inglês, tear film break-up time
TIM Subcampo macular temporal interno – do inglês, temporal inner macula
TNF-α Fator de necrose tumoral alfa – do inglês, tumor necrosis factor alpha
TOM Subcampo macular temporal externo – do inglês, temporal outer macula
TRFL Tempo de ruptura do filme lacrimal
TSH Hormônio estimulante da tireóide – do inglês, thyroid stimulating hormone
U/l Unidades internacionais por litro
UFRN Universidade Federal do Rio Grande do Norte UNAERP Universidade de Ribeirão Preto
UNP Universidade Potiguar
V CD Relação entre o diâmetro vertical da escavação e diâmetro vertical do disco óptico – do inglês, ratio between the vertical diameter of the cup of the optic disc and optical disc vertical diameter
xv > Maior que
< Menor que
≥ Maior ou igual que
≤ Menor ou igual que
± Mais ou menos
xvi Sumário
Dedicatória... vii
Agradecimentos... viii
Lista de abreviaturas, siglas e símbolos... x
Resumo... xvii
1 INTRODUÇÃO... 19
2 JUSTIFICATIVA... 24
3 OBJETIVOS... 25
4 MÉTODO... 26
5 ARTIGO(S) PRODUZIDO(S)... 37
6 COMENTÁRIOS, CRÍTICAS E SUGESTÕES... 84
7 REFERÊNCIAS... 87
xvii
xviii
Conclusões: Há uma associação da SOP, suas alterações metabólicas e inflamatórias com alterações do filme lacrimal e com mudanças na PIO. A diminuição na espessura da CFNR macular e aumento da espessura total macular estão possivelmente associadas às alterações metabólicas, e, o aumento na espessura da CFNR ao redor do nervo óptico estão provavelmente associadas às alterações hormonais, inerentes à SOP.
19 1 INTRODUÇÃO
A Síndrome dos Ovários Policísticos (SOP) inicialmente foi descrita por Stein e Leventhal em 1935 (1), e ainda hoje não tem uma etiologia completamente elucidada, embora se saiba que fatores ambientais e genéticos estejam implicados na sua gênese (2). É uma desordem endócrino-ginecológica complexa e heterogênea que acomete, aproximadamente, 5 a 10 % das mulheres em idade reprodutiva, sendo a desordem endócrina mais comum em americanas pré-menopáusicas(3-5),. Há quase cinco milhões de
mulheres acometidas por esta síndrome nos Estados Unidos, e quase 105 milhões em todo o mundo(6). Suas principais manifestações clínicas incluem: irregularidade menstrual(7) e infertilidade, hirsutismo, acne, alopecia androgenética, obesidade e acantose nigricans, manifestando-se de maneira heterogênica, principalmente diferindo-se na prevalência e intensidade entre diferentes grupos de mulheres portadoras de SOP (de acordo com os diversos fenótipos e particularidades específicas quanto à apresentação clínica e perfil de risco cardiovascular)(8). Considerada a endocrinopatia mais comum durante a vida reprodutiva feminina, caracteriza-se pela presença de dois dos seguintes critérios diagnósticos, segundo o Consenso de Rotterdam: 1) Alteração do ciclo menstrual, entendida como oligomenorréia (ausência do ciclo menstrual por 03 ou mais meses); 2) Sinais de hiperandrogenismo clínico e/ou laboratorial, como hirsutismo, acne, recesso temporal ou pele oleosa, ou testosterona total elevada (acima de 0,82 ng/ml); 3) Anormalidade ultrassonográfica ovariana com presença de 12 ou mais folículos em cada ovário medindo cerca de 2-9 mm de diâmetro e/ou volume ovariano maior que 10 mL(3, 5, 9).
20
algum grau de resistência à insulina, e esta anormalidade contribui para o hiperandrogenismo, que é responsável pelos sinais e sintomas característicos da SOP(10, 13), sendo também essa alteração endócrina característica da SM(4).
Na atualidade, a SM é o transtorno metabólico mais comum e complexo, de etiologia multifatorial e caracterizado pela junção de fatores de risco para o desenvolvimento de diabetes tipo II(14), doenças cardiovasculares e dislipidemias(8, 15-20). De acordo com o Third Report of the National
Cholesterol Education Program (NCEP-ATP III), o diagnóstico de SM depende
da presença de, pelo menos, três das seguintes alterações: 1) Circunferência abdominal > 102 cm em homens e > 88 cm em mulheres; 2) glicemia de jejum ≥ 110mg/dl; 3) triglicerídeos ≥ 150mg/dl; 4) pressão arterial sistólica ≥ 130 mmHg ou diastólica ≥ 85mmHg; e 5) HDL < 50mg/dl(15, 21). Os critérios acima são os mais utilizados, no entanto, outras classificações vêm sendo propostas, no sentido de adequar o diagnóstico às especificidades dos diferentes grupos populacionais, sobretudo no que concerne à circunferência da cintura e ponto de corte para glicemia de jejum(22-26).
Desde 1964 até os dias de hoje, há interesse em se estudar a relação da SOP com a saúde ocular (27-33). Tendo em vista a freqüente associação da SOP com SM e alterações do metabolismo glicídico, especula-se investigar a presença de alterações oftalmológicas precoces em mulheres com SOP, como estratégia para prevenir o comprometimento ocular, que poderia ocorrer em médio e longo prazo, como consequência das repercussões metabólicas. Além disso, a presença de receptores de hormônios esteróides sexuais em vários tecidos oculares, como cristalino, retina, coróide, córnea, íris, corpo ciliar, glândulas lacrimais, pálpebras, conjuntiva bulbar e glândulas de Meibomius , leva-nos a acreditar que as modificações hormonais, como o hiperandrogenismo, podem também acarretar modificações oftalmológicas potencializando o impacto sobre a função visual nestas pacientes (34).
21
hormonais e a manifestações oculares como olho seco(28, 35). A DOS é uma entidade multifatorial caracterizada por desconforto visual e instabilidade do filme lacrimal, potencialmente danosa à superfície ocular, acompanhada de hiperosmolaridade lacrimal e inflamação(36, 37). Recentes estudos têm proporcionado também uma melhor compreensão do impacto desta entidade sobre a qualidade de vida e os custos econômicos estimados e derivados dela(38). DOS também leva ao comprometimento funcional da acuidade visual e o seu impacto é visto em atividades no trabalho, leitura, uso de computadores e caixas de banco, e no ato de dirigir à noite. Os sintomas da DOS podem ser debilitantes ao ponto de afetar a saúde psicológica e a sensação geral de bem-estar. Adicionalmente, esta síndrome predispõe ao aparecimento de infecções da superfície ocular (39).
O hiperandrogenismo e a resistência insulínica são as duas principais características fisiopatológicas da SOP. Ambas interferem na síntese do filme lacrimal, principalmente na camada lipídica, através da modulação da secreção das glândulas de Meibomius (28, 29, 31), potencializadas pela presença de síndrome metabólica, obesidade e dislipidemias (40-43). O excesso de produção da camada lipídica conduz a uma instabilidade do filme lacrimal que se rompe com facilidade, conduzindo a uma evaporação da camada aquosa e, consequentemente, hiperosmolaridade da lágrima. A hiperosmolaridade provoca danos ao epitélio da superfície ocular, ativando células do sistema imune e uma cascata de eventos inflamatórios que libera mediadores da inflamação [fator de necrose tumoral-α(TNF-α), interleucina-6(IL-6) e proteína C reativa] na lágrima (37, 44, 45). O dano epitelial envolve morte por apoptose, perda de células caliciformes e alterações na expressão de mucina, levando ao aumento da instabilidade e hiperosmolaridade da lágrima, completando o ciclo vicioso (36, 46).
22
considerada o principal fator de risco relacionado ao desenvolvimento de Hipertensão ocular e glaucoma primário de ângulo aberto (47). Alguns estudos demonstraram o risco de conversão de hipertensão ocular para glaucoma em 10% num seguimento de 06 anos(51), e, em 18% durante um seguimento de 05 anos(52). O Glaucoma é uma neuropatia óptica progressiva com alterações típicas da papila do nervo óptico e perda progressiva do campo de visão, consequentemente com decréscimo na acuidade visual e na qualidade de vida. Quando não diagnosticada e tratada adequadamente leva à cegueira irreversível. De acordo com a Organização Mundial de Saúde (OMS), o glaucoma é considerado a segunda causa de cegueira no mundo(53). Estima-se que em 2020 tenhamos 79,6 milhões de pessoas com essa doença, e, aproximadamente 10% de cegos bilateralmente (53, 54).
Atualmente, diversos estudos descrevem a presença de lesões típicas de retinopatia diabética (RD) como microaneurismas, hemorragias retinianas e exsudatos duros e/ou algodonosos, em pacientes sem Diabetes Mellitus (DM)(55-57), e sua associação com intolerância à glicose, componentes da SM, HAS, nefropatia, acidente vascular cerebral e outros fatores de risco cardiovasculares. Recentes dados também demonstram a associação de marcadores inflamatórios sistêmicos e ateromas na artéria carótida, com retinopatia em pessoas sem DM(57). Isso reforça a idéia de que a retinopatia poderia ser considerada um marcador pré-clínico de DM e HAS(56, 57). Na verdade, os achados oftalmoscópicos da retinopatia podem representar manifestações subclínicas de dano microvascular precoce de alterações no metabolismo da glicose e nas cifras pressóricas sangüineas (56). No estudo SN-DREAMS, report 14 foi demonstrado em pessoas do sexo feminino que a
23
Recentemente, a introdução da tomografia de coerência óptica [optical coherence tomography (OCT)], exame não invasivo que disponibiliza informações detalhadas sobre a microestrutura retiniana e medidas da sua espessura, com alta resolução, precisão e reprodutibilidade, possibilitou a detecção de mudanças retinianas subclínicas, ao nível microvascular, em olhos sem edema macular clinicamente significativo em diabéticos ou até mesmo em olhos sem sinais de RD na oftalmoscopia, retinografia ou na angiografia fluoresceínica. A detecção destas mudanças pode oferecer novas perspectivas para o diagnóstico precoce e melhor entender os mecanismos da RD. Koleva-Georgieva at al demonstraram que a espessura retiniana macular total foi maior em pacientes diabéticos, com ou sem RD, quando comparados com pessoas saudáveis(60, 61), através do uso de OCT. Em contraste, a análise da espessura da camada de fibras nervosas da retina (CFNR) na região macular mostrou-se ser mais delgada (61). Estudos iniciais em pacientes com SOP demonstraram um aumento da espessura da CFNR ao redor do nervo óptico, quando comparadas com mulheres saudáveis, e sua relação com o hiperandrogenismo (32), e a relação da testosterona com a ação neuroprotetora(62-65).
24 2 JUSTIFICATIVA
O resultado crônico das alterações etiopatogênicas, comuns tanto à síndrome dos ovários policísticos quanto à síndrome metabólica, é o aparecimento de diabetes tipo II, coronariopatias (66-68), hipertensão arterial sistêmica, obesidade e dislipidemias (69). Doenças como estas são mais comuns, na população em geral, acima dos 40 anos de idade. A despeito da sabida associação entre síndrome dos ovários policísticos e suas alterações metabólicas e inflamatórias, poucos estudos foram realizados para avaliar a frequência de anormalidades oftalmológicas em mulheres jovens com síndrome dos ovários policísticos, obesidade, intolerância à glicose, resistência à insulina e síndrome metabólica. O fato da síndrome metabólica ocorrer em uma idade mais precoce nas mulheres portadoras de síndrome dos ovários policísticos do que nas mulheres em geral justifica uma necessidade maior de rastrear as alterações oculares nessas pacientes. Isso porque há uma preocupação acerca das possíveis repercussões futuras sobre a saúde da mulher, não apenas relacionadas ao sistema reprodutivo, mas, sobretudo ao sistema cardiovascular.
As mulheres portadoras de síndrome dos ovários policísticos necessitam de abordagem multidisciplinar, buscando a identificação de fatores de risco e visando a redução da morbidade e mortalidade femininas. Com isso, a possibilidade de oferecer uma senescência com saúde, uma melhor qualidade de vida e dignidade, faz-se necessária.
25 3 OBJETIVOS
GERAL:
o Avaliar a prevalência de alterações oftalmológicas em mulheres jovens com Síndrome dos Ovários Policísticos estratificadas pela presença de condições clínicas, metabólicas e inflamatórias.
ESPECÍFICOS:
o Estimar a prevalência de alterações do filme lacrimal e da doença do olho seco em mulheres jovens com SOP;
o Estimar as mudanças na pressão intra-ocular em mulheres jovens com SOP;
o Estimar a prevalência de alterações retinianas em mulheres jovens com SOP;
o Verificar a existência de fatores de risco para o desenvolvimento de alterações oftalmológicas, e a idade de ocorrência, nas portadoras de SOP;
o Avaliar parâmetros de comprometimento ocular que possam predizer a ocorrência precoce de alterações oculares nas portadoras de SOP;
26 4 MÉTODO
Este estudo envolveu um desenho metodológico de corte transversal, com a participação de 92 mulheres entre 18 a 34 anos, divididas em 02 grupos: grupo SOP, formado por 45 voluntárias com o diagnóstico de síndrome dos ovários policísticos e grupo controle, formado por 47 voluntárias ovulatórias saudáveis. Todas foram recrutadas nos ambulatórios de Ginecologia Endócrina e de Planejamento Familiar da Maternidade Escola Januário Cicco (MEJC), e examinadas no ambulatório de Oftalmologia do Hospital Universitário Onofre Lopes (HUOL), na Universidade Federal do Rio Grande do Norte (UFRN), de maio de 2012 a março de 2013. Esta pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do HUOL (Protocolo 586/11), e as voluntárias assinaram Termo de Consentimento Livre e Esclarecido (TCLE).
Amostra
O cálculo amostral levou em consideração a realização de estudos prévios com esse mesmo grupo de mulheres e estimativas baseadas na prevalência da SOP na população e diferenças de 20% entre os parâmetros avaliados nos grupos SOP e controle. Para esse cálculo, considerou-se alfa de 5% e poder estatístico de 80%, sendo empregado o software estatístico GraphPad StatMate® versão 1.01i (GraphPad Software, Inc, San Diego, USA).
Como critérios de inclusão para o grupo SOP, foram adotados os critérios de diagnóstico estabelecidos no Consenso de Rotterdam (The
Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group,
2004)(9), segundo os quais a síndrome deve ser diagnosticada na presença de dois dos seguintes parâmetros: distúrbio menstrual, como oligomenorréia e/ou amenorréia; quadro clínico e/ou laboratorial de hiperandrogenismo e sinais ecográficos de ovários policísticos. Para o grupo controle, foram alocadas voluntárias com ciclos menstruais regulares, ausência de sinais clínicos e/ou laboratoriais de hiperandrogenismo e ovulação comprovada por dosagem de progesterona feita entre o 21o - 22o dias do ciclo.
27
de medicamentos capazes de interferir no metabolismo dos carboidratos, dos lipídeos e na função renal (como diuréticos, antihipertensivos, antilipêmicos, corticosteróides), comprometimento das funções hepática e/ou renal, tabagismo, etilismo ou uso de drogas ilícitas.
Para constituição dos grupos, todas as voluntárias foram submetidas a uma rigorosa avaliação de seleção, que constou de exame clínico geral e ginecológico, avaliação de dados antropométricos, ultrassonografia pélvica e avaliação de parâmetros laboratoriais (bioquímicos, hormonais e marcadores inflamatórios), além de exame oftalmológico completo.
Procedimentos e Protocolos
Protocolo de avaliação clínica e antropométrica (12): Todas as voluntárias foram submetidas à anamnese detalhada e exame físico geral e ginecológico completos. A anamnese registrou dados sobre o início, a evolução e condições associadas ao quadro clínico apresentado, sobretudo fazendo a caracterização do ciclo menstrual. Foram registrados os antecedentes gineco-obstétricos, investigando a ocorrência de gravidez terminada em parto ou abortamento nos 03 meses precedentes. Foi pesquisada história pessoal de doença cardiocirculatória aguda nos três últimos meses, bem como o uso de aspirina e anticoagulantes nos últimos 15 dias e uso de corticosteróides nos últimos 60 dias. Hábitos de vida, história atual e pregressa de outras doenças e os antecedentes familiares de diabetes mellitus, doença cardiovascular, dislipidemia e obesidade foram anotados. Foram aferidas as medidas da pressão arterial, do peso, da altura, das circunferências da cintura e quadril.
28
sulfato de deidroepiandrosterona, androstenediona, insulina, proteína-C reativa (PCR), fator de necrose tumoral α (TNF-α) e interleucina-6 (IL-6).
As dosagens de glicose no plasma foram realizadas pelo método enzimático da glicose oxidase, empregando-se o critério para diagnóstico de diabetes e intolerância à glicose, recomendado pelo American Diabetes
Association (Expert Committee on the Diagnosis and Classification of Diabetes Mellitus, 2007). Os níveis de colesterol total, HDL-colesterol, triglicerídeos e
demais dosagens bioquímicas foram mensurados pelo método colorimétrico/enzimático utilizando-se kits comerciais (Biosystems, Barcelona, Spain). Os exames bioquímicos foram realizados no Laboratório Integrado de Análises Clínicas, da Faculdade de Farmácia da UFRN, seguindo a rotina instituída nesse Serviço.
As dosagens hormonais e de marcadores inflamatórios foram feitas pelo método de quimioluminescência, no aparelho “Immulite” da DPC MED LAB, com kits Med Lab (Diagnostic Products Corporation, Los Angeles, CA). Os ensaios laboratoriais foram realizados no Laboratório Multidisciplinar do Programa de pós-graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte.
Foi também realizada ecografia pélvica de todas as mulheres, com o intuito de afastar ou confirmar a presença de morfologia ovariana policística. Os exames foram realizados aparelho de ultrassom Medison, modelo Sonoace 8000 EX, no Serviço de Imagem da Maternidade Escola Januário Cicco, da Universidade Federal do Rio Grande do Norte.
-29
colesterol ≥ 160mg/dl, Triglicerídeos ≥ 150mg/dl ou HDL-colesterol < 50mg/dl (75). Consideramos, ainda, PCR ≥ 03 mg/ml, TNF-α > 8,1 pg/ml e IL-6 > 5,9 pg/ml valores anormais.
Protocolo de avaliação Oftalmológica: Todas as participantes foram submetidas a exame oftalmológico completo que constava em medida da acuidade visual com correção, biomicroscopia do segmento anterior com lâmpada de fenda, biomicroscopia de fundo de olho com lente de Volk de 78D, medida da pressão intra-ocular com o Tonômetro de Goldmann, retinografia simples e tomografia de coerência óptica dos segmentos anterior e posterior. Todas as voluntárias que foram incluídas na pesquisa apresentavam acuidade visual corrigida ≥ 20/40, pressão intra-ocular < 21 mmHg e equivalente esférico entre ± 5,00 D. Aquelas que apresentavam alguma doença oftalmológica ou com alguma doença ocular externa não relacionada à DOS, submetidas a cirurgia ocular prévia, utilizando medicamentos tópicos ou sistêmicos que interfiram com a função lacrimal ou pressão intra-ocular, foram excluídas.
30
Quadro 01. Questionário para pesquisa de sintomas da doença do olho seco.
Questionário de Olho Seco
Nunca Raramente Ás vezes Muitas vezes Todo tempo
1. Você sente seus olhos secos ou ressecados?
2. Você sente sensação de areia nos olhos?
3. Você sente sensação de ardor nos olhos?
4. Você sente seus olhos pegajosos?
5. Você sente seus olhos úmidos ou lacrimejantes?
6. Seus olhos ficam vermelhos?
7. Você percebe crostas (caspas) ou secreção no seu cílios?
8. Você tem alguma dificuldade para abrir os olhos pela manhã?”
Nota: traduzido e adaptado de Schein et al e Lin et al.
31
leitura do TRFL, orientava-se piscar normalmente; Repetia-se mais duas vezes, e realizava-se a média das 03 leituras, para cada olho.
A impregnação com fluoresceína é um método padrão para demonstrar danos à superfície ocular. Padrões de coloração anormais da córnea e conjuntiva foram observados à lâmpada de fenda com o filtro azul de cobalto, na área interpalpebral, e foi realizado após a primeira leitura do TRFL (28, 46, 78). (quadro 02)
Quadro 02. Esquema utilizado para avaliar danos à superfície ocular. Fluorecein Staining( Oxford Schema)
Panel Grade Criteria OD OE
A
0
Equal to or less than panel A
B
I
Equal to or less than panel B, greater than A
C
II
Equal to or less than panel C, greater than B
D
III
Equal to or less than panel D, greater than C
E
IV
Equal to or less than panel E, greater than D
>E V Greater than panel E
Nota: reproduzido de “ Dry Eye WorkShop”, 2007
32
fórnice temporal inferior, onde permanecia por 05 minutos. Durante este período, as voluntárias eram orientadas a olhar ligeiramente para cima e piscarem normalmente. Após a remoção da fita, a extensão de umidade em que ela se encontrava , era medida (38, 46, 77, 79);
Na margem palpebral, os orifícios das glândulas de Meibomius foram avaliados, após compressão do 1/3 médio da pálpebra inferior, para determinar a presença de obstrução dos seus orifícios, como também o aspecto da secreção, e a presença, ou não, de telangiectasias (quadro 03)(79).
Quadro 03. Estudo das disfunções das glândulas de Meibomius. Disfunção da glândula de Meibomius
Grau Critérios (05 glândulas) OD OE
0 Sem glâdula obstruída
1 1 a 2 glândulas obstruídas
2 3 a 4 glândulas obstruídas
3 5 glândulas obstruídas
Telangiectasia da margem palpebral OD OE
Sim (S) ou Não(N)
Grau Critérios (Aspecto do Meibum) OD OE
0 Líquido Claro
1 Líquido Claro/Turvo
2 Líquido mais turvo
3 Líquido em “pasta de dente”
Nota: adaptado e tradizido de Viso et al
33
Schirmer menor ou igual a 5 milímetros ou disfunção das glândulas de Meibomius (38, 79).
b) Propedêutica/pressão intra-ocular: Para avaliar a PIO, realizamos 03 medidas sucessivas com o Tonômetro de aplanação de Goldmann na região central corneana, em cada olho, após a instilação de 01 gota de anestésico tópico e 01 gota de fluoresceína tópica, às 07:00 horas. A média desses valores foi calculada, para cada olho. Para correlacionar a medida da pressão intra-ocular com a espessura corneana central, realizamos a medida da espessura corneana central utilizando o programa “Anterior Segment Cube 512x128”, com o aparelho Cirrus HD-OCT (Carl Zeiss Meditec). 02 medidas foram realizadas automaticamente, e a média foi obtida. De acordo com o 3° Consenso de Glaucoma de Ângulo Aberto, o “pressure-to-cornea index”(PCI) é um índice adotado para integrar a PIO e a espessura corneana central em um único fator de risco unificado para o desenvolvimento de Glaucoma (80). É calculado da seguinte maneira:
PCI=IOP/(CCT)3 PCI, pressure-to-cornea índex (mmHg/mm3 );
IOP, Intraocular Pressure (mmHg);
CCT, Central Corneal Thicknes (mm);
c) Propedêutica/retina: Após midríase farmacológica com colírio de tropicamida a 01% (Mydriacyl colírio, Alcon Laboratórios), as fotografias do fundo de olho foram realizadas com o retinógrafo Visucam NNM/FA (Carl Zeiss Meditec, Dublin, Califórnia) e avaliadas com a graduação de acordo com o
Early Treatment Diabetic Retinopathy Study (ETDRS) e um escore de
severidade da retinopatia foi atribuída de acordo com a escala modificada do
Airlie House Classification System (81).
34
35
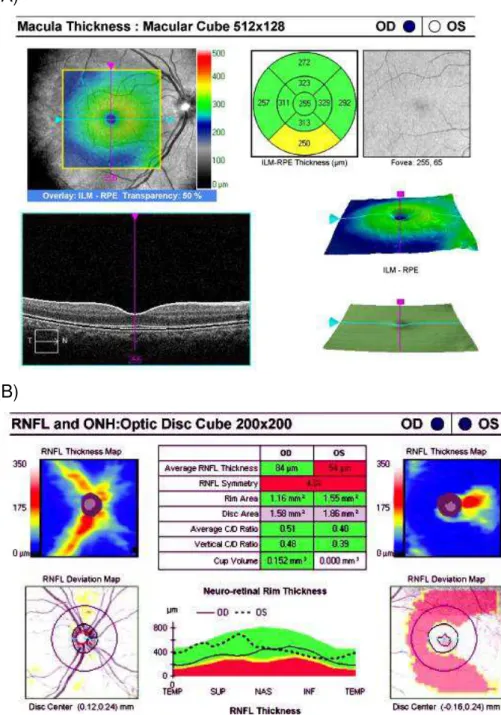
Figura 01 A) Programa “Macular Cube 512x128” que mede a espessura macular total, fornecendo um mapa com 09 sub-campos de espessuras setoriais em três círculos concêntricos, conforme definidos pelo ETDRS. B) Programa “Optic Disc Cube 200x200” para medir a CFNR ao redor do nervo óptico, fornecendo um mapa com 04 áreas e os parâmetros do disco óptico. O mesmo é utilizado na região macular para medir a espessura da camada de fibras nervosas da mácula.
A)
36
Estatística: O teste de Kolmogorov-Sminorv foi utilizado para avaliar a distribuição dos dados. Para as variáveis quantitativas de distribuição normal, apresentadas em média±desvio padrão, utilizamos o teste “t” de Student; e para aquelas com distribuição não paramétrica, apresentadas em mediana (percentis 25-75), utilizamos o teste de Mann-Whitney. Para as variáveis qualitativas, apresentadas em proporções, adotamos o teste do Qui-quadrado e teste de Fisher. A associação do TRFL com as condições clínicas, metabólicas e inflamatórias foi realizada através de MANOVA multifatorial. A associação de
impregnação por fluoresceína (Fluorecein Staining), testes de Schirmer-1, obstrução das glândulas de Meibomius e diagnóstico de DOS, com as condições clínicas, metabólicas e inflamatórias foi realizada através do Modelo Linear Generalizado (Teste Qui-Quadrado de Wald). A associação da PIO e PCI com as condições clínicas, metabólicas e inflamatórias foi realizada através de MANOVA multifatorial. Foi feita a redução de dimensão para as
variáveis de espessura macular total, CFNR ao redor do nervo óptico e da mácula, através da extração de Componentes Principais – CP1 e CP2, pra cada modelo. A associação dos componentes principais com as condições clínicas foi realizada através de MANOVA multifatorial. O coeficiente de
correlação de Pearson foi usado para as análises de correlação. SPSS® 20.0 para Windows (SPSS, Inc., Chigago IL) e STATISTICA StatSoft 7.0 foram utilizados como pacotes estatísticos; Um valor de p<0,05 foi considerado
37 5 ARTIGOS PRODUZIDOS
Artigo 1. Souza-Júnior JE, Garcia CAA, Soares EMM, Maranhão TMO, Lemos TMAM, Azevedo GD. Polycystic ovary syndrome: aggressive or protective factor for the retina? Evaluation of macular thickness and retinal nerve fiber layers using high-definition optical coherence tomography. Journal of Ophthalmology. Volume 2015, ID 193078. O periódico tem fator de impacto 1.935, Qualis B1 da CAPES para a área de Medicina II. [Artigo publicado].
38
ARTIGO 1
Polycystic ovary syndrome: aggressive or protective factor for the retina? Evaluation of macular thickness and retinal nerve fiber layers using
39
Title: Polycystic ovary syndrome: aggressive or protective factor for the retina? Evaluation of macular thickness and retinal nerve fiber layers using high-definition optical coherence tomography.
Author names:
José Edvan Souza-Júnior1,2, Carlos Alexandre de Amorim Garcia3, Elvira Maria Mafaldo Soares4, Técia Maria Oliveira Maranhão1,4, Telma Maria Araújo Moura Lemos5 and George Dantas Azevedo1,6
1Post-Graduate Program in Health Sciences, Federal University of Rio Grande
do Norte, Natal-RN, Brazil.
2Department of Biomedical Sciences, State University of Rio Grande do Norte,
Mossoró-RN, Brazil
3Departamento of Surgery, Onofre Lopes University Hospital, Federal University
of Rio Grande do Norte, Natal-RN, Brazil.
4Departament of Obstetrics and Gynecology, Federal University of Rio Grande
do Norte, Natal, RN, Brazil.
5Department of Clinical and Toxicological Analyses, Federal University of Rio
Grande do Norte, Natal, RN, Brazil.
6Departament of Morphology, Federal University of Rio Grande do Norte,
Natal-RN, Brazil.
Institutional address: José Edvan de Souza Júnior. State University of Rio Grande do Norte, Faculty of Health Sciences, Department of Biomedical Sciences. Central campus. St. Atirador Miguel Antônio da Silva Neto, s/n, Aeroporto, ZIP Code:59607-360, Mossoró, RN, Brazil.
40 ABSTRACT
41 INTRODUCTION
Polycystic ovary syndrome (PCOS) is a complex and heterogeneous endocrine-gynecological disorder that affects approximately 5-10% of women of reproductive age and is the most common endocrine disorder in premenopausal American women (1-3). It is characterized by the variable presence of menstrual irregularity, hyperandrogenism and microcystic ovaries (4). It may be associated with metabolic syndrome (5), insulin resistance (2, 6-9), glucose intolerance, type 2 diabetes (10), cardiovascular disease, obesity and dyslipidemia (3, 6, 11-13).
From 1964 to the present day, there has been interest in studying the relationship between PCOS and eye health (14-20). Given the frequent association of PCOS with metabolic syndrome (MS) and changes in glucose metabolism, this study seeks to investigate the presence of early retinal changes in women with PCOS as a strategy to prevent ocular involvement. Furthermore, the presence of sex steroid hormone receptors in various ocular tissues, especially the retina and choroid, leads us to believe that hormonal changes such as hyperandrogenism may also cause changes in the posterior segment of the eye, increasing the potential impact on visual function in these patients (21).
42
43 MATERIALS AND METHODS
This cross-sectional study involved women aged 18 to 34 years who were divided into two groups: the PCOS group composed of 45 volunteers with a diagnosis of PCOS, and a control group, consisting of 47 healthy ovulatory volunteers. Participants were recruited from the outpatient clinics of Januário Cicco Maternity School (Maternidade Escola Januário Cicco), and they were examined in the Ophthalmologic Clinic of the Onofre Lopes University Hospital (Hospital Universitário Onofre Lopes), Federal University of Rio Grande do Norte (UFRN), between May 2012 and March 2013. The study was approved by the Institutional Ethics Committee (Protocol 586/11), and volunteers signed informed consent forms.
Inclusion criteria for the PCOS group were based on diagnostic criteria established by the Rotterdam Consensus (The Rotterdam
ESHRE/ASRM-Sponsored PCOS consensus workshop group, 2004), according to which the
syndrome should be diagnosed when two of the following parameters are present: menstrual disorder, such as oligomenorrhea and/or amenorrhea; clinical and/or laboratory findings of hyperandrogenism; and ultrasound evidence of polycystic ovaries. The control group consisted of volunteers who had regular menstrual cycles, absence of clinical and/or laboratory signs of hyperandrogenism and ovulation confirmed by progesterone measurements taken between the 21st and 22nd days of the menstrual cycle.
Exclusion criteria included: women with other endocrine disorders, renal or liver failure; chronic users of drugs that might interfere with the metabolism of carbohydrates, lipids and with renal function (such as diuretics, antihypertensives, antilipemic agents, corticosteroids); impairment of hepatic and/or renal function; smoking; alcohol consumption; or illicit drug use. Women who had any eye disease or who had undergone any ocular surgery were also excluded.
44
recorded, including the occurrence of pregnancies ending in childbirth or miscarriage in the preceding 3 months. Personal history of acute cardiocirculatory disease in the past three months, aspirin and anticoagulant use over the past 15 days and use of corticosteroids in the last 60 days were also investigated. Lifestyle habits, current and previous histories of other diseases and family histories of diabetes mellitus, cardiovascular disease, dyslipidemia and obesity were also assessed. Blood pressure, weight, height and waist and hip circumference measurements were taken.
The laboratory evaluation consisted of a complete blood count, routine urinalysis, and a 75-g oral glucose tolerance test. Additionally, urea, creatinine, triglycerides, total cholesterol and fractions, ALT (alanine aminotransferase), AST (aspartate aminotransferase), gamma-GT (gamma-glutamyl transpeptidase), SHBG (sex hormone-binding globulin) TSH (thyroid-stimulating hormone), FSH (follicle-stimulating hormone), LH (luteinizing hormone), total testosterone, dehydroepiandrosterone sulfate, androstenedione, insulin, C-reactive protein, TNF-α (tumor necrosis factor α) and IL-6 (interleukin-6) levels were measured. Measurements of plasma glucose were performed using the glucose oxidase enzymatic method. Levels of total cholesterol, high-density lipoprotein (HDL)-cholesterol, triglycerides and other biochemical parameters were measured with colorimetric/enzymatic methods by using commercial kits (BioSystems, Barcelona, Spain). Levels of hormonal and inflammatory parameters were determined by using commercially available diagnostic kits in the IMMULITE 2000 automated chemiluminescence-immunoassay system (Diagnostic Products Corporation, Los Angeles, CA).
45
The ophthalmologic evaluation protocol included measurement of corrected visual acuity, anterior segment slit-lamp biomicroscopy, fundus biomicroscopy with a Volk 78D lens, measurement of intraocular pressure with a Goldmann tonometer, retinography and optical coherence tomography of the posterior segment. For volunteers who were menstruating, the ophthalmologic evaluation was performed at the early follicular phase, in order to minimize possible interference of hormonal fluctuations of the menstrual cycle. All volunteers who were included in the study had visual acuity ≥ 20/40, intraocular pressure < 21 mmHg and spherical equivalent within ± 5.00 D. After pharmacologic mydriasis with tropicamide eye drops, photographs of the fundus were taken with a Visucam NNM/FA fundus camera (Carl Zeiss Meditec, Dublin, California) and evaluated according to the Early Treatment Diabetic Retinopathy Study (ETDRS) grading system. A retinopathy severity score was assigned according to the modified Airlie House Classification System (31).
Cirrus spectral-domain HD-OCT (Carl Zeiss Meditec, Dublin, California) was performed to obtain measures of retinal thickness. For measurement of total macular thickness, "Macular Cube 512x128" software was used, where a macular scan is performed on a 6 mm x 6 mm area over 2.4 seconds, including 512 horizontal B-scans with 128 A-scans for each section and providing a map with 09 sub-fields of sectoral thicknesses in three concentric circles with diameters of 1, 3 and 6 mm, as defined by ETDRS (Figure 1A) (32, 33). "Optic Disc Cube 200x200" software was used to measure the thickness of the RNFL in the optic nerve region, performing 200 horizontal B-scans with 200 A-scans for each section. The software automatically determines the center of the optic disc and measures nerve fiber thickness along a circular path with a radius of 1.73 mm in peripapillary diameter, providing a map of four areas (Figure 1B). The same "Optic Disc Cube 200x200" software was then used on the macular region and along a circular path with a radius of 1.73 mm in diameter. Centering on the fovea, we measured the thickness of the nerve fiber layer in the macular region (Figure 1B) (25). Low-quality scans were excluded and defined as: (A) signal strength < 7; (B) decentration of the fovea or optic disc; and (C) image artifacts captured.
46
normal distribution, and the results are expressed as the mean ± standard deviation. The Mann-Whitney test was used for variables with non-parametric distribution that were expressed as median (25th-75th percentiles). The Chi-square and Fisher exact tests were adopted for qualitative variables and results are expressed as proportions. Size reduction was applied to the variables total macular thickness (09 variables) and RNFL around the optic nerve (04 variables) and the macula (04 variables) using Principal Component Analysis for each model. Association of principal components (PC1 and PC2) with clinical conditions was tested using a multivariate analysis of variance (MANOVA) model. A p value < 0.05 was considered statistically significant in all
47
Figure 1 (A) "Macular Cube 512x128" software, measuring total macular thickness, producing a map with09 sub-fields of sectoral thicknesses in three concentric circles, as defined by ETDRS. (B) "Optic Disc Cube 200x200" software for measuring the RNFL around the optic nerve, producing a map with 04 areas and optic disc parameters. The same software was used in the macular region to measure the thickness of the nerve fiber layer of the macula.
A)
48 RESULTS
Table 1 shows a comparison of clinical, anthropometric, biochemical, hormonal and inflammatory characteristics between the PCOS and control group volunteers. The prevalence rates of metabolic syndrome were 31.8% in patients with PCOS and 21.2% for control group volunteers, according to NCEP criteria (p=0.301), and 31.8% and 24.2% in PCOS patients and controls, respectively, according to IDF criteria (p = 0.466). The prevalence rates of glucose intolerance were 20.9% in the PCOS group and 10.7% in the control group (p =0.215). The prevalence rates of insulin resistance were 33.3% in the PCOS group and 9.1% in the control group (p = 0.01). Obesity was more frequent in PCOS group than in the control group (53.3% and 19.1%, respectively; p=0.001). A significantly higher rate of women with altered inflammatory parameters was also observed in the PCOS group than in the control group (55.9% and 15.2%, respectively; p = 0.001).
From 45 eyes of the volunteers in the PCOS group, 42 were selected (3 eyes were excluded, 2 due to refractive errors > or < than 5.00 D, and 1 due to signal strength < 7 when performing OCT). Likewise, from 47 eyes of the volunteers in the control group, 40 were selected (7 eyes were excluded, 4 due to refractive errors > or < than 5.00 D, and 3 due to signal strength < 7 when performing OCT).
49
The mean value of the superior RNFL in the optic nerve region was significantly thicker in the PCOS group than in the control group. Additionally, the mean value of the CUP VOLUME (optic disc parameter) was significantly lower in the PCOS group than in the control group (Table 3).
50
Table 1. Comparison of clinical, anthropometric, biochemical, hormonal and inflammatory characteristics between PCOS and control groups.
PCOS group Control Group P
Age (years) 26.6±4.7 26.8±4.2 0.7871
Body mass index (Kg/m2) 30.6±6.0 27.2±4.0 0.0021
Waist circumference - WC (cm) 93.1 ± 15.0 87.7 ± 11.0 0.0491
SBP - systolic blood pressure (mmHg) 115(107.8-123) 110(110-120) 0.3662
1/HOMA 0.7(0.3-1.4) 1.1(0.7-1.5) 0.0312
QUICKI 0.3591(0.3-0.4) 0.3872(0.3-0.4) 0.0312
Total cholesterol (mg/dl) 154.9 ± 28.0 149.7 ± 25.6 0.4071
HDL-cholesterol (mg/dl) 39.3 ± 10.5 43.4 ± 8.6 0.0771
LDL-cholesterol (mg/dl) 95.6 ± 23.4 91.2 ± 26.2 0.4431
Triglycerides (mg/dl) 113.2 ± 51.1 74.9 ± 30.8 < 0.00011
Fasting glucose (mg/dl) 71.2 ± 15.9 74.1 ± 8.3 0.2921
120-m glucose (mg/dl) 104.9 ± 25.4 100.6 ± 29.9 0.5251
Urea (mg/dl) 24.5 ± 7.9 22.6 ± 4.6 0.1921
Aspartate aminotransferase (U/l) 21.9 ± 7.3 16.4 ± 4.6 0.0011
Alanine-aminotransferase (U/l) 25.9 ± 11.8 17.4 ± 8.6 0.0021
Total testosterone (ng/dl) 138.1 ± 95.9 109.5 ± 27.9 0.0491
Luteinizing hormone - LH (mlU/ml) 5.7 ± 4.2 3.2 ± 4.6 0.0171
Follicle-stimulating hormone - FSH (mlU/ml) 4.1 ± 2.2 2.7 ± 2.3 0.0111
Fasting insulin (mIU/ml) 12.8 ± 11.5 6.6 ± 4.9 < 0.0021
Tumor necrosis factor - TNF-α (pg/ml) 7.1 ± 3.9 6.0 ± 1.4 0.01291
C-reactive protein (mg/l) 316.5 ± 214.7 44.9 ± 23.1 < 0.00011
Interleukin 6 (pg/ml) 6.2 ± 2.2 3.7 ± 1.2 < 0.00011
1Student’s t-test, independent samples; 2 Mann-Whitney test; PCOS, polycystic ovary syndrome;
51
Table 2. Total macular thickness and RNFL in the macular region using HD-OCT: comparison between PCOS and control groups:
PCOS Group Control Group p
Total macular thickness (µm)
Central subfield (CSF) 242.9 ± 19.7 241.2 ± 19.8 0.7011 Superior inner macula (SIM) 320.0 ± 15.0 323.8 ± 14.1 0.2391 Temporal inner macula (TIM) 305.5 ± 12.3 308.6 ± 14.2 0.2971 Inferior inner macula (IIM) 316.3 ± 14.5 317.0 ± 21.4 0.8651 Nasal inner macula (NIM) 322.5 ± 15.4 322.8 ± 15.5 0.9411 Superior outer macula (SOM) 282.6 ± 15.0 285.6 ± 14.6 0.3581 Temporal outer macula (TOM) 260.7 ± 12.6 263.5 ± 13.6 0.3491 Inferior outer macula (IOM) 268.9 ± 14.8 268.8 ± 15.0 0.9801 Nasal outer macula (NOM) 300.7 ± 14.1 299.4 ± 19.6 0.7371
Retinal nerve fiber layer (macula, µm)
Average macular RNFL 38.6 ± 4.8 41.0 ± 9.5 0.1681 Superior macular 33.9 ± 5.2 35.2 ± 7.3 0.3341 Temporal macular 52.5 ± 15.0 54.2 ± 16.1 0.6361 Inferior macular 33.8 ± 7.2 35.6 ± 7.0 0.2581 Nasal macular 35.0 ± 11.3 35.2 ± 8.0 0.9451
1Student’s t-test, independent samples;
Table 3. The optic disc parameters and RNFL thickness around the optic nerve using HD-OCT: comparison between PCOS and control groups.
PCOS Group Control Group P
Optic disc parameters
CUP VOLUME(mm3) 0.1 ± 0.1 0.2 ± 0.2 0.0011 Average C/D ratio 0.40 ± 0.1 0.5 ± 0.2 0.0711 Average vertical C/D ratio 0.4 ± 0.1 0.5 ± 0.2 0.1001
Retinal nerve fiber layer (optic nerve, µm)
Average RNFL 101.2 ± 11.2 98.0 ± 9.0 0.1621 Superior 128.0 ± 18.0 120.0 ± 15.1 0.0361
Temporal 66.3 ± 9.7 65.4 ± 8.7 0.6521
Inferior 135.0 ± 17.5 130.6 ± 15.0 0.2221
Nasal 75.8 ± 14.5 77.6 ± 9.9 0.5121
1
52
Table 4. Total macular thickness using HD-OCT: comparison between PCOS and control groups after metabolic stratification.
PCOS group + insulin resistance
Control group + insulin resistance
p1
Total macular thickness (µm)
Temporal inner macula (TIM) 304.5 ± 7.5 292.7 ± 11.0 0.035
Inferior inner macula (IIM) 316.3 ± 12.3 288.0 ± 33.0 0.017
Nasal inner macula (NIM) 324.1 ± 11.9 302.0 ± 15.6 0.010
Nasal outer macula (NOM) 301.3 ± 13.2 283.0 ± 4.6 0.035
1
53 DISCUSSION
The aim of this study was to evaluate changes in total macular thickness and in the RNFL in the macula and around the optic disc in women with PCOS in comparison with healthy ovulatory patients. This was achieved using HD-OCT, and results were stratified according to the presence of metabolic syndrome, inflammation, obesity, glucose intolerance and/or insulin resistance. Our study is the first to analyze HD-OCT data for women with PCOS in association with metabolic changes. The results demonstrated that there was increased total macular thickness in patients with PCOS in the presence of insulin resistance compared to the control group. As for RNFL, there was increased thickness in the region around the optic nerve and decreased thickness in the macula, suggesting that retinal changes in PCOS differ according to eye region.
The endocrine, inflammatory, and metabolic changes associated with PCOS have consequences for vision, including neurovascular metabolic changes in the retina. Some studies have revealed fundoscopic alterations of the retina, such as retinal hemorrhages and exudates, in the absence of diabetes and diabetic retinopathy (34-36), and their association with inflammatory markers, metabolic syndrome and other cardiovascular risk factors. The advent of OCT has brought about increased interest in the study of retinal microstructure in research focusing on early and pre-clinical diagnosis, as OCT is characterized by high resolution, accuracy and reproducibility.
54
macular region. This decrease occurs because abnormal Müller cells secondarily induce a progressive neuronal loss (37). The inability to maintain adequate osmotic equilibrium between the intra- and extracellular milieu leads to caspase 3 activation (38), followed by apoptosis of retinal ganglion cells and astrocytes, and consequently axonal loss (25, 37).
55 CONCLUSION
So, is PCOS an aggressive or protective factor for the retina? One can imagine that different regions of the retina respond differently to the neuroprotective action of testosterone and to the neurodegenerative action of metabolic changes. In summary, our results suggest that PCOS may represent a protective factor in the RNFL around the optic nerve, possibly through the action of testosterone. Conversely, when associated with metabolic abnormalities, PCOS may represent an aggressive factor in the macular region (macular RNFL and total macular thickness). Prospective studies involving women with PCOS are needed to further elucidate this neuroprotection/neurodegeneration interface in relation to the sensorineural layer of the eye. Such studies may or may not lead to the use of this layer as an indicator of protection/compromise of the eye, which in turn would facilitate the establishment of preventive clinical strategies for women with PCOS.
Conflict of Interest
56 REFERENCES
1. Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. Lancet. 2007 Aug 25;370(9588):685-97.
2. de Azevedo GD, Costa EC, Micussi MT, de Sa JC. [Lifestyle
modifications in the polycystic ovary syndrome: role of physical exercise and importance of multidisciplinary approach]. Revista Brasileira de Ginecologia e Obstetrícia : Revista da Federação Brasileira das Sociedades de Ginecologia e Obstetrícia. 2008 May;30(5):261-7.
3. Soares EM, Azevedo GD, Maranhao TM. [Metabolic syndrome in women with polycystic ovary syndrome: prevalence in the city from northeast region of Brazil]. Arq Bras Endocrinol Metabol. 2007 Aug;51(6):1027-8. 4. Hillman JK, Johnson LN, Limaye M, Feldman RA, Sammel M, Dokras A.
Black women with polycystic ovary syndrome (PCOS) have increased risk for metabolic syndrome and cardiovascular disease compared with white women without PCOS. Fertility and Sterility. 2014 Feb;101(2):530-5.
5. Soares EM, Azevedo GD, Gadelha RG, Lemos TM, Maranhao TM. Prevalence of the metabolic syndrome and its components in Brazilian women with polycystic ovary syndrome. Fertility and Sterility. 2008 Mar;89(3):649-55.
6. Apridonidze T, Essah PA, Iuorno MJ, Nestler JE. Prevalence and
characteristics of the metabolic syndrome in women with polycystic ovary syndrome. Journal of Clinical Endocrinology and Metabolism. 2005 Apr;90(4):1929-35.
7. Legro RS, Castracane VD, Kauffman RP. Detecting insulin resistance in polycystic ovary syndrome: purposes and pitfalls. Obstet Gynecol Surv. 2004 Feb;59(2):141-54.
57
9. Carmina E, Lobo RA. Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Fertility and Sterility. 2004 Sep;82(3):661-5.
10. Celik C, Tasdemir N, Abali R, Bastu E, Yilmaz M. Progression to
impaired glucose tolerance or type 2 diabetes mellitus in polycystic ovary syndrome: a controlled follow-up study. Fertility and Sterility. 2014
Apr;101(4):1123-8 e1.
11. Ehrmann DA, Liljenquist DR, Kasza K, Azziz R, Legro RS, Ghazzi MN. Prevalence and predictors of the metabolic syndrome in women with polycystic ovary syndrome. Journal of Clinical Endocrinology and Metabolism. 2006 Jan;91(1):48-53.
12. Sung YA, Oh JY, Chung H, Lee H. Hyperandrogenemia is implicated in both the metabolic and reproductive morbidities of polycystic ovary syndrome. Fertility and Sterility. 2014 Mar;101(3):840-5.
13. Kao YH, Chiu WC, Hsu MI, Chen YJ. Endothelial progenitor cell
dysfunction in polycystic ovary syndrome: Implications for the genesis of cardiovascular diseases. International Journal of Fertility and Sterility. 2013 Jan;6(4):208-13.
14. Zilliacus H, Nystroem B. Visual disturbance, a symptom in
Stein-Leventhal's syndrome. Acta Obstetricia et Gynecologica Scandinavica. 1964;42(Suppl. 6):161-5.
15. Bonini S, Mantelli F, Moretti C, Lambiase A, Micera A. Itchy-dry eye associated with polycystic ovary syndrome. American Journal of Ophthalmology. 2007 May;143(5):763-71.
16. Yavas GF, Ozturk F, Kusbeci T, Ermis SS, Yilmazer M, Cevrioglu S, et al. Meibomian gland alterations in polycystic ovary syndrome. Current Eye Research. 2008 Feb;33(2):133-8.
17. Coksuer H, Ozcura F, Oghan F, Haliloglu B, Karatas S. Effects of hyperandrogenism on tear function and tear drainage in patients with polycystic ovary syndrome. Journal of Reproductive Medicine. 2011 Jan-Feb;56(1-2):65-70.
58
19. Demir M, Guven D, Koc A, Ozdemir S, Can E. Retinal nerve fiber layer thickness in women with polycystic ovary syndrome. Journal of
Ophthalmology. 2013;2013:752186.
20. Acmaz G, Atas M, Gulhan A, Acmaz B, Atas F, Aksoy H. Evaluation of the macula, retinal nerve fiber layer, and choroid thickness in women with polycystic ovary syndrome using spectral-domain optical coherence tomography. Reproductive Sciences (Thousand Oaks, CA). 2014 Feb 27:1933719114522523.
21. Gupta PD, Johar K, Sr., Nagpal K, Vasavada AR. Sex hormone receptors in the human eye. Survey of Ophthalmology. 2005 May-Jun;50(3):274-84.
22. Koleva-Georgieva DN, Sivkova NP. Optical coherence tomography for the detection of early macular edema in diabetic patients with
retinopathy. Folia Medica (Plovdiv). 2010 Jan-Mar;52(1):40-8.
23. Sikorski BL, Malukiewicz G, Stafiej J, Lesiewska-Junk H, Raczynska D. The diagnostic function of OCT in diabetic maculopathy. Mediators of Inflammation. 2013;2013:434560.
24. Demir M, Dirim B, Acar Z, Yilmaz M, Sendul Y. Central macular thickness in patients with type 2 diabetes mellitus without clinical retinopathy. Journal of Ophthalmology. 2013;2013:767931.
25. Park HY, Kim IT, Park CK. Early diabetic changes in the nerve fibre layer at the macula detected by spectral domain optical coherence
tomography. British Journal of Ophthalmology. 2011 Jan 7;95(9):1223-8. 26. Obesity: preventing and managing the global epidemic. Report of a WHO
consultation. World Health Organ Technical Report Series. 2000;894:i-xii, 1-253.
27. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care. 2003 Jan;26 Suppl 1:S5-S20. 28. Alberti KG, Zimmet P, Shaw J. The metabolic syndrome--a new
worldwide definition. Lancet. 2005 Sep 24-30;366(9491):1059-62. 29. Alberti KG, Zimmet P, Shaw J. Metabolic syndrome--a new world-wide
59
30. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002 Dec 17;106(25):3143-421.
31. Grading diabetic retinopathy from stereoscopic color fundus
photographs--an extension of the modified Airlie House classification. ETDRS report number 10. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991 May;98(5 Suppl):786-806. 32. Sole Gonzalez L, Abreu Gonzalez R, Alonso Plasencia M, Abreu Reyes
P. [Normal macular thickness and volume using spectral domain optical coherence tomography in a reference population]. Archivos de la
Sociedad Española de Oftalmología. 2013 Sep;88(9):352-8.
33. Sng CC, Cheung CY, Man RE, Wong W, Lavanya R, Mitchell P, et al. Influence of diabetes on macular thickness measured using optical coherence tomography: the Singapore Indian Eye Study. Eye (London). 2012 May;26(5):690-8.
34. Peng XY, Wang FH, Liang YB, Wang JJ, Sun LP, Peng Y, et al. Retinopathy in persons without diabetes: the Handan Eye Study. Ophthalmology. 2010 Mar;117(3):531-7, 7 e1-2.
35. Jeganathan VS, Cheung N, Tay WT, Wang JJ, Mitchell P, Wong TY. Prevalence and risk factors of retinopathy in an Asian population without diabetes: the Singapore Malay Eye Study. Archives of Ophthalmology. 2010 Jan;128(1):40-5.
36. Ojaimi E, Nguyen TT, Klein R, Islam FM, Cotch MF, Klein BE, et al. Retinopathy signs in people without diabetes: The multi-ethnic study of atherosclerosis. Ophthalmology. 2010 Nov 3;118(4):656-62.
37. Vujosevic S, Midena E. Retinal layers changes in human preclinical and early clinical diabetic retinopathy support early retinal neuronal and Muller cells alterations. Journal of Diabetes Research.
2013;2013:905058.
60
39. Dissen GA, Garcia-Rudaz C, Paredes A, Mayer C, Mayerhofer A, Ojeda SR. Excessive ovarian production of nerve growth factor facilitates development of cystic ovarian morphology in mice and is a feature of polycystic ovarian syndrome in humans. Endocrinology. 2009
Jun;150(6):2906-14.
40. Bialek M, Zaremba P, Borowicz KK, Czuczwar SJ. Neuroprotective role of testosterone in the nervous system. Polish Journal of Pharmacology. 2004 Sep-Oct;56(5):509-18.
41. Byers JS, Huguenard AL, Kuruppu D, Liu NK, Xu XM, Sengelaub DR. Neuroprotective effects of testosterone on motoneuron and muscle morphology following spinal cord injury. Journal of Comparative Neurology. 2012 Aug 15;520(12):2683-96.
61
ARTIGO 2
Ocular manifestations in Brazilian women with polycystic ovary syndrome: prevalence of changes in tear film and intraocular pressure
62
Title: Ocular manifestations in Brazilian women with polycystic ovary syndrome: prevalence of changes in tear film and intraocular pressure and association with the metabolic and inflammatory status.
Running title: Polycystic ovary syndrome and ocular manifestations.
Author names:
José Edvan Souza-Júnior1,2, Carlos Alexandre de Amorim Garcia3, Elvira Maria Mafaldo Soares4, Técia Maria Oliveira Maranhão1,4, Telma Maria
Araújo Moura Lemos5 and George Dantas Azevedo1,6
1Post-Graduate Program in Health Sciences, Federal University of Rio Grande
do Norte, Natal-RN, Brazil.
2Department of Biomedical Sciences, State University of Rio Grande do Norte,
Mossoró-RN, Brazil
3Departamento of Surgery, Onofre Lopes University Hospital, Federal University
of Rio Grande do Norte, Natal-RN, Brazil.
4Departament of Tocogynecology, Federal University of Rio Grande do Norte,
Natal, RN, Brazil.
5Department of Clinical and Toxicological Analyses, Federal University of Rio
Grande do Norte, Natal, RN, Brazil.
6Departament of Morphology, Federal University of Rio Grande do Norte,
Natal-RN, Brazil.
Institutional address: José Edvan de Souza Júnior. State University of Rio Grande do Norte, Faculty of Health Sciences, Department of Biomedical Sciences. Central campus. St. Atirador Miguel Antônio da Silva Neto, s/n, Aeroporto, ZIP Code: 59607-360, Mossoró, RN, Brazil.
Email: profjedvan@gmail.com
The Institutional Ethics Committee (Onofre Lopes University Hospital) approved the research protocol (number 586/2011)
63 ABSTRACT
PURPOSE: To assess the prevalence of changes in the tear film and intraocular pressure (IOP) among Brazilian women with polycystic ovarian syndrome (PCOS) and healthy volunteers. Another aim was to assess the association between the metabolic and inflammatory status with ocular manifestations.
METHODS: A cross-sectional study involving 45 women with PCOS and 47 healthy ovulatory women was performed. All volunteers were submitted to clinical, gynecological and ophthalmological examinations. Evaluation consisted of a comprehensive protocol including: (1) Dry Eye Questionnnaire; (2) tear film break-up time (TFBUT); (3) fluorescein staining test; (4) Schirmer-1 test; (5) measurement of IOP; and metabolic and inflammatory parameters.
RESULTS: The prevalence of dry eye disease (DED) was significantly higher in women with PCOS when compared to the control group (44.4% and 13.8%, respectively, p=0.007). Significant associations were observed between changes in DED tests and the PCOS diagnosis. Additionally, higher mean values were obtained in the PCOS group when compared to the control group for intraocular pressure (14.2 ± 2.3 and 12.9 ± 1.9 mmHg, respectively; p=0.011). There was a significant correlation between the increase of PCI (pressure-to-cornea index) and PCOS/metabolic syndrome (p=0.005).
CONCLUSION: A significant association between PCOS and DED and increased IOP was observed in this sample of Brazilian women. The metabolic and inflammatory changes were also significantly associated with changes in the tear film and IOP.