MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
SÍNTESE E AVALIAÇÃO DA ATIVIDADE ANTITUMORAL DE NANOGÉIS DE
FUCANA A DA ALGA MARROM
Spatoglossum schröederi
(C.Agardh)
Kützing
JAILMA ALMEIDA DE LIMA
SÍNTESE E AVALIAÇÃO DA ATIVIDADE ANTITUMORAL DE NANOGÉIS DE
FUCANA A DA ALGA MARROM
Spatoglossum schröederi
(
C.Agardh)
Kützing
Tese apresentada ao Programa de
Pós-Graduação em Ciências da Saúde da
Universidade Federal do Rio Grande do
Norte como requisito para a obtenção do
título de Doutor em Ciências da Saúde.
Orientador:
Prof. Dr. Hugo Alexandre de O. Rocha
CATALOGAÇÃO NA FONTE
L732s
Lima, Jailma Almeida de.
Síntese e avaliação da atividade antitumoral de nanogéis de fucana A da alga marrom Spatoglossum schöederi (C. Agardh) Kützing / Jailma Almeida de Lima. – Natal, 2014.
106f. : il.
Orientador: Prof. Dr. Hugo Alexandre de O. Rocha.
Tese (Doutorado) – Programa de Pós-Graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
1. Fucanas – Tese. 2. Polissacarídeos sulfatados – Tese. 3. Atividade antitumoral – Tese. 4. Nanogéis – Tese. I. Rocha, Hugo Alexandre de O. II. Título.
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenador do Programa de Pós-Graduação em Ciências da Saúde:
JAILMA ALMEIDA DE LIMA
SÍNTESE E AVALIAÇÃO DA ATIVIDADE ANTITUMORAL DE NANOGÉIS DE
FUCANA A DA ALGA MARROM
Spatoglossum schröederi
(
C.Agardh)
Kützing
Aprovada em: 21 / 03 / 2014
Banca Examinadora:
Presidente da Banca:
Prof. Dr. Hugo Alexandre de Oliveira Rocha (UFRN)
Membros da Banca
Profa. Dra Valéria Soraya de Farias Sales (UFRN)
Prof. Dr. Artur da Silva Carriço (UFRN)
Profa. Dra. Valquíria Pereira de Medeiros (UFJF)
Dedico esta obra
A Deus.
Só tenho que agradecer-Te. Obrigada, Senhor, por tudo! Grande é a sua Bondade e Misericórdia!
A minha Mãe, Francisca (Rosa).
Dedico esta obra
A Hugo Rocha,
O meu eterno agradecimento por ser um educador nato, e por proporcionar não só a mim, mas todos ao seu redor, a possibilidade de crescimento e busca por algo melhor. Obrigada, Hugo, por tudo!
A Família BIOPOL,
Obrigada a todos àqueles que fazem ou que já fizeram parte desta história...
Dayanne (Dayn ou amigan), Mariana, Sara, Karol, Cinthia, Leandro, Diego (Popó), Ruth, Rafael, Gabriel, Moacir, Raniere, Joanna, Letícia, Kaline, Arthur, Vinicius, Max, Rony, Marília, Monique, Ajax, Fred, Larisse, Regina, Sarah (pequena), Mônica, Pablo, Danielle, Almino Afonso, Jéssica, Mariane, Fernanda (Pôia), Leonardo Nobre (Leo), Profa. Fabiana Lima, Ana Karina, Ana Karinne (Donana), Daniel, Fernando, Ivan, Nednaldo, Eduardo, Edjane, Valquíria.
Dedico esta obra
A “amigannn” Dayn,
Obrigada pela amizade, pelo companheirismo e por ter me proporcionado fazer parte de sua família. Obrigada também pela confiança, bem mais que isso, pelo privilégio de
ser madrinha de seu filho Heitor e suplente de Helena!
A NOSSA AMIZADE É Mais que uma mão estendida,
mais que um belo sorriso, mais do que a alegria de dividir, mais do que sonhar os mesmos sonhos
ou doer as mesmas dores, muito mais do que o silêncio que fala
ou da voz que cala para ouvir é a amizade, o alimento
que nos sacia a alma e nos é ofertado por alguém
Agradecimentos especiais
À UFRN, à Pós-graduação em Ciências da Saúde e ao Departamento de Bioquímica pela oportunidade de concluir esse curso de Pós-graduação, assim como as agências
Financiadoras CAPES e CNPq.
Agradeço novamente ao meu orientador Prof. Dr. Hugo Rocha pela oportunidade oferecida, pela atenção e auxílio prestados durante a pesquisa.
A todos os professores do CCS (UFRN), aos coordenadores do programa de pós-graduação (PPGCSa) e às secretárias do programa.
As professoras da banca de qualificação: Profa. Naisandra Bezerra e Profa. Ivonete Araújo
A todos os professores do DBQ (UFRN), em especial, a Profa. Edda Lisboa Leite, pela sua força e por toda a sua contribuição à instituição. Obrigada por sempre ter participado e me proporcionado grandes ensinamentos, principalmente de vida!
Aos meus amigos de laboratório pela colaboração e ajuda nos meus experimentos e também em tudo que precisei:
A Dayn (“amigann” e comadre) que tanto amo por me compreender e por sempre ter uma palavra amiga. Tenho por ti um enorme carinho. Obrigada por fazer parte de sua vida e de
seus flhos Helena e Heitor e daqui a alguns meses de Heloísa.
A Karol, por ser esse doce de pessoa, alguém muito especial para mim! Tenho certeza que seu futuro será brilhante e, mais que isso, queria agradecer-te por sempre estar perto nas horas mais difíceis com carinho e compreensão! Você sempre deixa o laboratório mais
alegre.
A Cinthia. Você é meu exemplo de transformação! Obrigada por tudo, obrigada por ter confiado a mim a tarefa tão importante de ser madrinha (casamento) e mais que isso, de
poder fazer parte da sua vida e de conviver com seu filho Davi. Obrigada A Ruth (Lut Lut), a “safada” que amo de paixão, a Rafael (super Rafildo), que não é o
ABC, mas é o mais querido, Leandro (Lelê) exemplo de profissional e de amigo.
Agradeço também de forma especial a Mariana e a Sara, por terem sido as primeiras a me incentivarem a vir para a Bioquímica. A Mariana, por me apoiar, por estar comigo em
tudo que preciso, por me fazer ver meus erros, por ser essa grande amiga, te adoro! A Sara, por ser nosso pilar de conhecimento “nosso Google”, aquela que nos socorre sempre e em qualquer tempo, te adoro muito. Muito obrigada, amigas, vocês são demais e
muito importantes para mim, estarão sempre no meu coração!!!
Agradeço muito a todos, todos vocês são mais que especiais nessa trajetória, a vocês o meu eterno agradecimento: Gabriel, Moacir, Joanna, Pablo, Raniere, Fernanda (Pôia), Leonardo Nobre (Leo), Letícia, Kaline, Arthur, Vinicius, Max, Rony, Marília, Monique,
Ajax, Fred, Larisse, Regina, Sarah (Pequena), Mônica, Danielle, Almino Afonso, Jéssica, Profa. Fabiana Lima, Ana Karina, Ana Karinne (Donana), Daniel, Fernando,
Ivan, Diego (Popó) e Valquíria.
Agradeço de forma especial a todos os amigos que fiz aqui no Departamento de Bioquímica: Adriana Brito, Ana Katarina, Luciana Rabêlo, Jonalson, Anderson (Negão), Paula Ivani (Paulinha), Antônio, Marina, Ingrid, Lívia, Ana Katarina, Jefferson, Rômulo, Ana
Aos amigos dos laboratórios LAMA e LBMG. Conheci pessoas maravilhosas e que me ajudaram bastante no desenvolvimento de algumas técnicas: Beatriz Mesquita, Susana, Nilmara, Paula Anastácia, Rita, Mayara, Jana, Felipe, Isabel, Dani (Pôia branca), Leonam
Agradeço a mais nova professora da genética, Susana Moreira, você superou todas as dificuldades e chegou lá, que bom que ficarás por aqui. Tu és giro!!!
A todos que me ajudaram direta ou indiretamente nesta tese: Danilo Cavalcanti, Karla (Farmácia), Priscyla (UFPE), Guiman, Marina e Haroldo.
A Lurdinha, pessoa batalhadora, de uma humildade e sabedoria enorme. Você é uma pessoa especial e que ensinou muito, não só a parte laboratorial, mas principalmente sobre a vida. Sou
muito grata pelos seus ensinamentos e pelos momentos “felizes” que compartilhamos. Muito obrigada por tudo.
Agradeço, de forma especial, àqueles que contribuíram de forma diferencial para minha formação como pessoa: aos meus grandes amigos e amigas Joanna D'arc e sua filha Joyce (que acompanhamos seu crescimento), Sara, Mariana Santana, Chrístier e Railson,
vocês foram uma das melhores conquistas, todos vocês são formidáveis e pessoas muito especiais pra mim. Muito obrigada por me aturarem e me aceitarem como sou. Muito obrigada do fundo do coração. Agradeço também a Adaíres e a Wanessa por fazerem
parte dessa história.
Agradeço à família de Dayn: Leonardo Oliveira (Leo), Dona Célia, Seu José, França, Drielle, Dmitryev, Dastaev (Patrícia e Monick), Dmetryus, Seu Abelardo, Helena, meu afihado Heitor, Heloísa e a Dona Ceiça. Muito obrigada pela força e pelo carinho. Também
dedico esta tese a vocês!
Muito obrigada a todos que fazem parte da Ong “Vida é Alegria”: Mileide, dona Neide, Sara, Mariana, Adaíres, Ricardo, Narjara, Adriana Sabiana, Adineide, Jobson, Fernando, Gian, Claudinha, Josie, Josi e todos pelos quais tenha esquecido o nome, mas que fazem
parte desse grupo pela oportunidade de ajudar a tantas crianças!
Agradeço a todos os amigos que trabalham comigo no CRI
Inês, Josinete, Patrícia, Elias, Mércia, Lúcia, Ana Tereza, Severina, Lidiane, Adriana Pinto, Sueldo, Cimária e Tarciana por compreenderem e me apoiarem nessa batalha que foi o
doutorado.
Agradeço a Tarciana, minha companheira do coração, muito obrigada pelo apoio e por ser tão especial para mim. Agradeço também a todos da sua família: Taísa, Vanessa, Rosa,
Maria, Seu Tarcísio e Antônio.
Agradeço também de forma especial aos grandes amigos Eutália e André. Vocês são dois anjos que Deus colocou no mundo, não tenho palavras para descrever
como sou feliz por ter vcoês como amigos!
Agradeço a minha “mãe” Vivi e a Mari também por, apesar de longe, estarem tão perto de mim.
Como foi difícil escrever essa parte! Por mais que eu possa agradecer, ainda assim seria muito pouco, não há como agradecer pelas alegrias, pelo apoio, pelo carinho, pelo consolo nas frustações. São muitas as pessoas a quem gostaria de agradecer, mas poderá ser que ao longo dos agradecimentos a memória possa esquecer de uma ou outra pessoa, mas
“
Talvez não tenha conseguido fazer o melhor, mas lutei para que o melhor fosse feito. Não sou o que deveria ser, mas Graças a Deus, não sou o que era antes”.RESUMO
Fucanas são polissacarídeos sulfatados encontrados em algas marrons
e equinodermos. Tem sido demonstrado que uma fucana denominada de
fucana A, obtida da alga marrom
Spatoglossum schröederi
, apresenta uma
série de efeitos biológicos, em particular, a atividade antitumoral. Com intuito
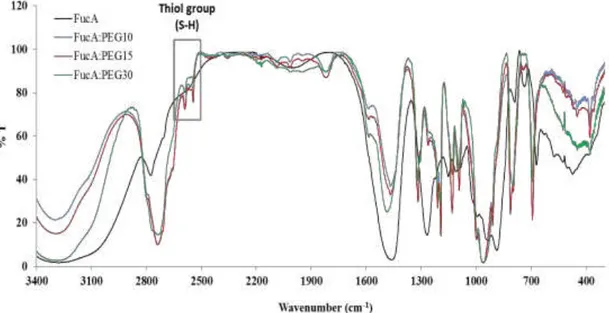
de se potencializar essa atividade, foram adicionados grupamentos tióis a
estrutura da fucana A. Posteriormente, os nanogéis foram sintetizados pela
formação de nanocomplexos entre a fucana A tiolada e o polietileno glicol
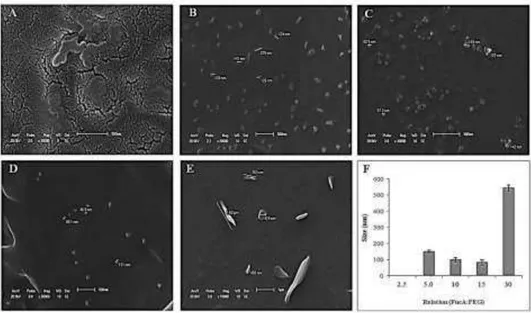
(PEG) em várias relações 2.5, 5.0, 10, 15 e 30. Os nanogéis com as relações
de 10 e 15 (FucA:PEG10 e FucA:PEG15) foram os que se apresentaram com
os menores tamanhos, mais esféricos, com diâmetro em torno de 186,95 ±
10,62 nm e carga de superfície ligeiramente negativa. Após a síntese dos
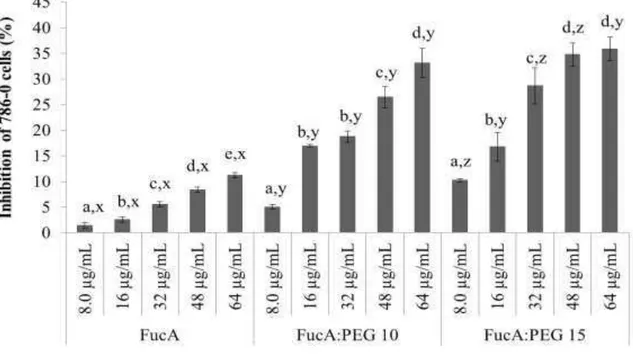
nanogéis, estes foram submetidos aos ensaios antiproliferativos com células da
linhagem tumoral 786-0 nas concentrações 8,0 a 64 µg/mL. As células foram
analisadas durante um período de 24, 48 e 72 horas. Os dados mostraram que
em todas as concentrações de nanogéis de fucana A, a atividade
antiproliferativa foi tempo e dose dependente, o mesmo não sendo observado
para a fucana A avaliada isoladamente. O nanogel de FucA:PEG15 também
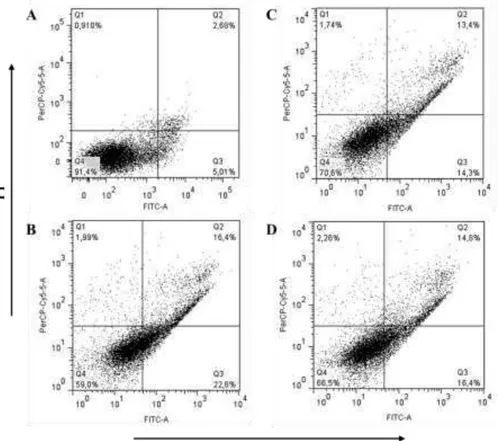
induziu apoptose por mecanismos dependentes e independentes de caspases.
Posteriormente, FucA:PEG15 também foi marcado com FITC sendo
completamente incorporado pelas células 786-0 após 1 hora. Quando a
endocitose celular foi parada, o FucA:PEG15 teve o seu efeito antiproliferativo
reduzido. Apesar de FucA:PEG15 não possuir efeito anticoagulante por aPTT e
PT (até 100 µg/mL), ele apresesentou efeito antioxidante e angiogênico. Esses
dados mostram que o nanogel de fucana A exibe várias efeitos
(antiproliferativa, antioxidante e antiangiogênica) e, portanto, o seu potencial
para a terapia do câncer deve ser investigada.
LISTA DE ABREVIATURAS E SIGLAS
µL Microlitros
786-0 Linhagem de células derivadas de adenocarcinoma renal aPTT Tempo de tromboplastina parcialmente ativada
B16-F10 Linhagem de células de melanoma murino CAT Capacidade antioxidante total
CO2 Dióxido de carbono DAPI 4′,6′-diamino-2-fenilindol DAPI 4',6-diamidino-2-phenylindole DLS Dynamic light scattering
DMEM Meio de cultura sintético complexo –Dubelcco’s Modified Eagle’s Medium DMSO Dimetilsulfóxido
DPPH 2,2-difenil-1-picrilhidrazila ECs Células endoteliais ativadas EHS Tumor Engelbreth-Holm-Swarm
F0.5 Fração precipitada com 0,5 volumes de acetona F0.6 Fração precipitada com 0,6 volumes de acetona F0.7 Fração precipitada com 0,7 volumes de acetona F0.9 Fração precipitada com 0,9 volumes de acetona F1.1 Fração precipitada com 1,1 volumes de acetona F1.3 Fração precipitada com 1,3 volumes de acetona F2.0 Fração precipitada com 2,0 volumes de acetona FITC Isotiocianato de fluoresceína
Fuc A Fucana A
g Grama
G0 Fase do ciclo celular em que a célula permanece indefinidamente na intérfase HeLa Linhagem de células de carcinoma cervical humano
HepG2 Linhagem de Células de hepatocarcinoma humano HS-5 Linhagem de células estromais da medula óssea humana kDa Kilodalton
M Molar
MEV Microscópio eletrônico de varredura mg Miligrama
Mili-Q Água ultrapura Min. Minutos mL Mililitros mM Milimolar mm Milímetros
MW Peso molecular nm Nanômetros PA Para análise
Panc-1 Linhagem de células de adenocarcinoma de pâncreas PBS Solução tampão de salino fosfato
PDA Tampão 1,3 diamino propano acetato PEG Polietileno glicol
pH Potencial de hidrogênio PI Iodeto de propídio PT Tempo de protrombina
RAEC Linhagem de células endoteliais de aorta de coelho
LISTA DE FIGURAS
Figura 1. Alga marrom S. schröederi (C. Agardh) Kützing. A) em exsicata (Foto:
SUMÁRIO
RESUMO... x
LISTA DE ABREVIATURAS E SIGLAS... xi
LISTA DE FIGURAS... xiii
1. INTRODUÇÃO... 15
2. JUSTIFICATIVA... 18
3. OBJETIVOS... 19
3.1. OBJETIVO GERAL... 19
3.2. OBJETIVOS ESPECÍFICOS... 19
4. MÉTODOS... 20
4.1. MATERIAIS BIOLÓGICOS... 21
4.1.1. Algas... 21
4.1.2. Linhagens e culturas celulares... 22
4.2. EXTRAÇÃO E PURIFICAÇÃO DA FUCANA A... 22
4.2.1. Obtenção do pó cetônico... 22
4.2.2. Proteólise... 22
4.2.3. Fracionamento do extrato bruto com concentrações crescentes de acetona... 23
4.2.4. Cromatografia em coluna de troca iônica... 23
4.3. SÍNTESE E CARACTERIZAÇÃO DOS NANOGÉIS... 24
4.3.1. Síntese das fucanas tiolada... 24
4.3.2. Caracterização físico-química dos nanogeis de fucanas... 24
4.3.3. Transmitância dos nanogéis... 24
4.3.4. Dynamic Light Scattering (DLS)... 25
4.3.5. Estabilidade... 25
4.3.6. Microscopia eletrônica de varredura (MEV)... 25
4.3.7. Microscopia confocal... 25
4.3.8. Espectroscopia de infravermelho... 26
4.3.9. Atividade antiproliferativa... 26
4.3.10. Conjugação da fucana A com fluoresceína (FITC)... 27
4.3.11. Avaliação da viabilidade e morte celular por anexina V-FITC/ iodeto de propídio (PI)... 27
4.3.12. Atividade antioxidante... 28
4.3.13. Atividade anticoagulante... 28
4.3.14. Ensaio de formação de tubo de matrigel... 28
4.4. ANÁLISE ESTATÍSTICA... 29
5. ARTIGOS PRODUZIDOS... 30
5.1. ARTIGO 1 (SUBMETIDO)... 32
5.2. CAPÍTULO DE LIVRO... 55
5.3. ARTIGO 2... 77
5.4. ARTIGO 3... 83
6. COMENTÁRIOS, CRÍTICAS E SUGESTÕES... 91
7. REFERÊNCIAS... 93
8. ANEXOS... 96
8.1. NORMAS PARA FORMATAÇÃO DA TESE (CCS)... 97
8.2. NORMAS DA REVISTA PARA SUBMISSÃO (MARINE DRUGS)... 100
8.3. DECLARAÇÃO... 105
1. INTRODUÇÃO
O câncer é um dos problemas mais complexos que os sistemas de saúde
mundial enfrentam e essa doença está prestes a se tornar uma das maiores
causas de mortalidade nas próximas décadas. Segundo a Organização
Mundial de Saúde (WHO) o número de casos de câncer no mundo deverá
aumentar em 75% até 2030. E segundo esta mesma pesquisa, essa taxa pode
ser ainda mais alta e chegar a 90% em países mais pobres [1, 2].
Para o tratamento do câncer, os três principais tratamentos atuais são a
cirurgia, a radioterapia e a quimioterapia, cuja escolha depende do tipo de
tumor e do estágio de seu desenvolvimento [3]. Embora esses tratamentos
sejam de grande valor, podem apresentar desvantagens e limitações, como
complicações pós-cirúrgicas e toxicidade sistêmica. Por essa razão, pesquisas
que buscam métodos alternativos e/ou complementares de tratamento estão
em evidência e visam sempre ser mais eficientes em relação às terapias
convencionais [4].
Atualmente, a nanotecnologia exibe um indispensável papel
especialmente no campo da medicina (nanomedicina) e vem sendo apontada
como uma das grandes promessas do futuro. As abordagens nanoterapêuticas
têm tratado diferentes tipos de câncer e têm tornado possível uma nova era na
quimioterapia, já que vários tipos de nanoestruturas (dendrímeros,
nanossondas magnéticas, nanoesferas, nanopartículas, hidrogéis, lipossomos,
dentre outros) têm sido sintetizados para atingir as células cancerosas, tanto
para o diagnóstico quanto para terapias específicas [5, 6], já que esses
sistemas nanométricos oferecem a vantagem de reduzir ou eliminar efeitos
colaterais da quimioterapia por atuarem diretamente nas células cancerosas e
não permanecerem livres na via sistêmica.
Além disso, eles têm atraído crescente interesse devido o seu potencial como
nanocarreadores de vários compostos, dentre eles os biopolímeros [7, 8].
Entre a numerosa quantidade de biopolímeros que tem sido proposta para
a preparação de nanogéis, polissacarídeos têm inúmeras vantagens sobre os
polímeros sintéticos por serem não tóxicos, biocompatíveis, biodegradáveis e
solúveis em água [9]. Ao longo dos últimos anos, um polímero em especial tem
chamado a atenção na área dos polissacarídeos, é conhecido como fucana.
Fucana é um termo utilizado para denominar uma família de polissacarídeos
sulfatados cujo açúcar mais representativo é a
α
-
L-fucose sulfatada. Elas são
encontradas em algas marrons e em equinodermas (ouriço e pepino do mar)
[10, 11].
Ao longo de algumas décadas nosso grupo de pesquisa (localizado no
Laboratório de Biotecnologia de Polímeros Naturais
–
BIOPOL
–
UFRN, sob a
responsabilidade do Prof. Dr. Hugo Rocha) tem intensificado os estudos com
os polissacarídeos extraídos da alga marrom
Spatoglossum schröederi
(Dictyotaceae). Essa alga sintetiza três tipos de fucanas e a obtida em maior
quantidade foi nomeada de fucana A [12, 13]. A disponibilidade permanente
desse organismo em grandes quantidades tornou-a uma excelente escolha
para a prospecção de compostos bioativos.
Em estudos anteriores, Barroso e colaboradores trabalhando com a
fucana A da
S. schröederi
observaram que esse polímero não apresentava
atividade anticoagulante
in vitro
, porém, demonstrou atividade antitrombótica
in
vivo
, sendo observado um efeito dose-dependente alcançando a saturação ao
redor de 20 µg/g de peso de rato. A fucana A também apresentou um efeito
tempo-dependente, alcançando a saturação por volta de 16h após a sua
administração [13].
genotoxicidade [15] foram realizados e não mostraram nenhum efeito danoso
provocado pela fucana A, mesmo utilizando altas concentrações. Ainda neste
mesmo trabalho, a atividade citotóxica da fucana A foi testada contra várias
linhagens tumorais, onde foi observado que esse polímero inibiu a proliferação
celular em torno de 43,7% para as células Panc-1 e HeLa (0,05 a 1 mg/mL) e
que ele não matou células normais.
A citotoxicidade para células tumorais também foi encontrada para a
heparina (polissacarídeo sulfatado de origem animal com estrutura química
semelhante a da fucana). Esse polímero demonstrou atividade antiproliferativa
frente a uma gama de linhagens celulares [16, 17].
Esse grande interesse pelas fucanas de algas pode estar relacionado
com a sua semelhança estrutural com a heparina, o que daria a esse
polissacarídeo atividades semelhantes às deste glicosaminoglicano. Além
disso, por serem de origem vegetal, elas poderiam apresentar menores riscos
de contaminações e são encontradas em abundância na natureza, já que são
recursos naturais renováveis.
No caso da heparina, têm sido desenvolvidos sistemas de nanogéis que
são resistentes ao ambiente extracelular e que não se degradam no interior
celular, promovendo a liberação controlada da heparina no interior das células
tumorais e, por conseguinte, a morte celular por apoptose induzida pela
heparina. Assim, quando Bae e colaboradores, utilizando nanogéis de
heparina, trataram células tumorais B16-F10, observaram que a proliferação
celular foi inibida em cerca de 50%, enquanto que a heparina sozinha inibiu o
crescimento celular em aproximadamente 10% [18].
2. JUSTIFICATIVA
O Estado do Rio Grande do Norte possui uma grande diversidade de
espécies de macroalgas marinhas, organismos estes que são potências
produtores de compostos com grande potencial farmacológico e biotecnológico.
Dentre eles, destacam-se os polissacarídeos sulfatados. Apesar do potencial
dos polissacarídeos sulfatados encontrados em nossa região, esses compostos
ainda não são conhecidos, o que faz com que esses recursos naturais não
sejam aproveitados.
Recentemente, foram encontradas fucanas com alta atividade
antitumoral, sintetizadas por algas do litoral potiguar e o nosso grupo de
pesquisa vem se dedicando a pesquisar as fucanas dessas algas. Mas, apesar
da forte atividade antiproliferativa já encontrada em algumas fucanas de algas
marrons, há um empecilho que dificulta os avanços dos estudos com fucanas
antiproliferativas que é o seu caráter iônico, elas podem assim se ligar a uma
gama de proteínas extracelulares antes de entrarem no interior celular, o que
exige uma elevada concentração de fucanas para que elas possam
desempenhar o seu efeito.
Devido a isso, a síntese de nanogéis de fucana foi o recurso utilizado
neste trabalho para intensificar os estudos de suas atividades biológicas,
especialmente, o seu efeito antitumoral, já que os nanogeís são liberados
(introduzidos) diretamente dentro das células tumorais, sem s
erem “perdidos
na circulação”
. Para tal, uma parceria foi estabelecida com a Universidade do
3. OBJETIVOS
3.1. GERAL
Sintetizar um nanogel de fucana A pela adição de grupos tióis e avaliar seu efeito antiproliferativo e apoptótico frente a linhagem tumoral 786-0, como também seu efeito antioxidante, anticoagulante e angiogênico.
3.2. ESPECÍFICOS
Extrair os polissacarídeos sulfatados da alga marrom
S. schröederi
por
fracionamento cetônico;
Obtenção da fucana A por cromatografia de troca iônica da fração
cetônica F0.6v;
Sintetizar nanogéis a partir da fucana A obtida;
Caracterizar físico-quimicamente os nanogéis de fucana A;
Avaliar as atividades antiproliferativa, anticoagulante, antioxidante e
antiangiogênica dos nanogéis produzidos e da fucana A livre;
Avaliar a capacidade dos nanogéis de fucana em induzir apoptose em
células tumorais;
4. MÉTODOS
4.1. MATERIAIS BIOLÓGICOS
4.1.1. Algas
A alga marinha marrom
Spatoglossum schröederi
(C. Agardh) Kützing
(Figura 1) foi coletada na Praia de Búzios, município de Nísia Floresta (litoral
sul do Rio Grande do Norte), em marés baixas entre 0,0 a 0,2 metros a uma
temperatura situada entre 28-30°C. As algas foram recolhidas quando já
desprendidas do substrato, mas permanecendo flutuando nas águas de
maré-baixa.
As algas foram trazidas ao laboratório no mesmo dia da coleta e
acondicionadas em sacos de polietileno, lavadas em água corrente,
examinadas cuidadosamente para remoção de epífitas, inclusões calcárias e
sais, sendo postas para secar em estufa aerada a 45°C. Em seguida foram
trituradas, pesadas e guardadas em frascos de vidro hermeticamente fechados.
Figura 1 – Alga marrom S. schröederi (C. Agardh) Kützing. A) em exsicata (Foto:
4.1.2. Linhagens e culturas celulares
As linhagens celulares de adenocarcinoma renal (786-0) e de endotélio
da aorta de coelho (RAEC) foram mantidas em meio RPMI e HAM-F12,
respectivamente. Todas as células foram cultivadas a 37°C em uma incubadora
umidificada na presença de 5% CO2, com os meios suplementados com 10%
de soro fetal bovino (SFB) e antibióticos (100 U/mL de penicilina e
100 μg/m
L
de estreptomicina). As células 786-0 foram doadas pela Profa. Dra. Carmen
Ferreira (Departamento de Bioquímica, UNICAMP, Brasil) e as RAEC pela
Profa. Dra. Helena Nader (Departamento de Bioquímica, UNIFESP, Brasil).
4.2. EXTRAÇÃO E PURIFICAÇÃO DA FUCANA A
4.2.1. Obtenção do pó cetônico
A alga seca e pulverizada foi suspensa em dois volumes de acetona PA
para despigmentação e delipidação do material. Essa solução ficou a
temperatura ambiente durante um período de 24 horas. Posteriormente, a
mistura foi decantada e o resíduo colocado para secar a 45°C sob aeração e
denominado de
“
pó cetônico
”
. Esse pó foi utilizado em seguida na proteólise.
4.2.2. Proteólise
4.2.3. Fracionamento do extrato bruto com concentrações crescentes de
acetona
O extrato polissacarídico bruto obtido foi fracionado com volumes
crescentes de acetona, obtendo-se as frações polissacarídicas. Os valores de
acetona adicionados foram determinados pela turvação da solução, que
caracteriza a precipitação de polissacarídeos devido à adição desse solvente
polar. Adicionou-se um volume de acetona, sob agitação leve, necessário para
que se visualizasse uma turvação da solução, essa solução foi mantida em
repouso a 4ºC durante 18h, o precipitado foi coletado por centrifugação a 8.000
x g por 15 minutos a 4ºC e seco a pressão reduzida.
Em seguida, esse procedimento foi repetido até que não se visualizasse
mais a formação de precipitado. As frações obtidas foram denominadas
conforme o volume de acetona no qual foram precipitadas (F0.5, F0.6, F0.7,
F0.9, F1.1, F1.3 e F2.0).
4.2.4. Cromatografia em coluna de troca iônica
A fração cetônica F0.6 (que contém a fucana A) foi submetida à
complexação com a resina de troca iônica Lewatite (10 mg de material para
cada 1,0 mL de resina) e a eluição foi realizada passo a passo utilizando-se
molaridades crescentes de NaCl, como descrito por Dietrich e colaboradores
[20]. Foram coletadas frações, com volume total de três vezes o volume da
resina, para cada molaridade de sal (0.3, 0.5, 0.7, 1.0, 1.5, 2.0, e 3.0 M), as
quais foram separadas pela ausência de positividade para o método de
fenol-ácido sulfúrico [21]. O fluxo de coleta foi de 1 mL/min, sendo o volume de
eluição igual para todas as molaridades coletadas.
4.3. SÍNTESE E CARACTERIZAÇÃO DOS NANOGÉIS
4.3.1. Síntese das fucanas tiolada
As fucanas inicialmente foram dissolvidas em tampão citrato (0,1 M, pH
3.0) e postas para reagir com periodato de sódio por 2h a 4°C. Após esse
procedimento, as fucanas, agora tioladas, foram conjugadas com cisteamina
por aminação redutiva. Para tal, após diálise contra água destilada, as fucanas
modificadas reagiram com a cisteamina por duas horas em PBS. Após esse
período, foi acrescido à solução boridreto de sódio 0,1 M lentamente, sendo a
solução agitada por 1h a 4°C. Essa solução foi então dialisada sob atmosfera
de nitrogênio par minimizar a oxidação dos grupos tiois e posteriormente
liofilizada [18].
4.3.2. Caracterização físico-química dos nanogeis de fucanas
As fucanas tioladas foram em seguida misturadas com polietileno glicol
(PEG) em diferentes proporções (2.5, 5.0, 10, 15 e 30), o que permitiu
posteriormente escolher qual a melhor proporção para a síntese do nanogel. A
mistura seca de fucana tiolada e PEG foi solubilizada em DMSO e incubada
por 6h a 37°C. A complexação entre a fucana e o PEG ocorreu através de
pontes de hidrogênio. Após esse período, a solução foi sonicada por 3 minutos
gerando pontes dissulfeto entre as moléculas de fucana tioladas. O nanogel
resultante foi exaustivamente dialisado e assim ficando livre das moléculas de
PEG e DMSO residuais.
4.3.3. Transmitância dos nanogéis
4.3.4.
Dynamic Light Scattering
(DLS)
O diâmetro e o potencial zeta dos nanogéis foram medidos por
espectroscopia de correlação de fótons usando o equipamento DLS da
Brookhaven 90 Plus (Brookhaven Instruments Corporation, New York, USA).
Os nanogéis de fucana A foram preparados em água a 25°C a uma
concentração de 1 mg/mL.
4.3.5. Estabilidade
A estabilidade foi avaliada analisando o nanogel, solubilizado em água,
para a sua distribuição de tamanho. A análise foi realizada semanalmente, até
42 dias, conforme descrito anteriormente. A solução nanogel foi mantida a 4°C
durante o estudo e removidos para análise 24 horas antes de cada medição,
sempre realizada a 25°C.
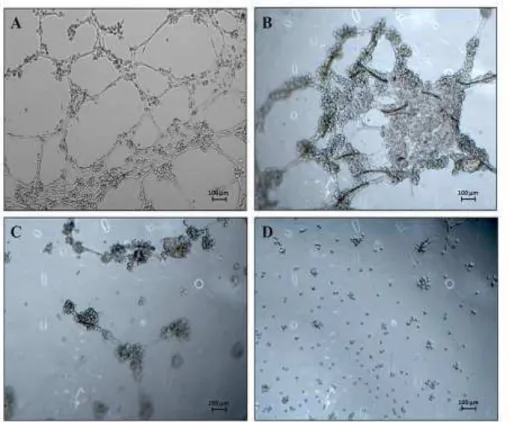
4.3.6. Microscopia eletrônica de varredura (MEV)
Tamanho e forma dos nanogéis A fucana foram avaliados por
microscopia eletrônica de varredura. Para ambas as experiências, 50 µL da
solução de nanogel foi depositado sobre uma superfície limpa de mica, deixado
a secar a 25ºC e, em seguida, observada em microscópio de varredura
Shimadzu, modelo SSX550 (Shimadzu Scientific Equipment, UK).
4.3.7. Microscopia confocal
As células 786-0 (1 × 10
5) foram colocadas em lamínulas de vidro de 12
mm de diâmetro em placas de 24 wells (Nunc; Naperville, IL, USA). Após 3 dias
em cultura, as células foram lavadas três vezes com PBS (0,1 M, pH 7,4), e,
em seguida, tratadas com a fucana A ou com o nanogel de fucana marcado
com fluoresceína em meio RPMI isento de soro por 15, 30 ou 60 min a 37°C.
vezes em PBS novamente e em seguida adicionado Fluoromount-G (EM
Sciences; Ft. Washington, WA, EUA) e colocado uma lamínula de vidro e
examinadas com um microscópio confocal ou de fluorescência (Zeiss Axio
Examiner LSM 710, Jena, Alemanha).
4.3.8. Espectroscopia de infravermelho
A espectroscopia de infravermelho foi realizada em espectrômetro
Perkin-Elmer de 4400 a 400 cm
-1no Departamento de Química da
Universidade Federal do Rio grande do Norte. A fucana A e os nanogéis de
fucana A (~5 mg) foram analisados após secagem em aparelho de
Abdenhalden sob a forma de pastilha de KBr contendo P2O5 a 60ºC.
4.3.9. Atividade antiproliferativa
A atividade antiproliferativa dos nanogéis obtidos foi avaliada pelo ensaio
colorimétrico do MTT (3-(4,5-dimethylthiazol-2-yl)2,5-diphenil tetrazolium
bromide) [22]. Esse método é baseado na redução do MTT a cristais de
formazan pelas células vivas.
4.3.10. Conjugação da fucana A com fluoresceína (FITC)
A fim de visualizar a incorporação celular do nanogel (FucA:PEG15) e da
fucana A, ambas foram marcadas com sal de sódio de fluoresceína (Sigma).
Resumidamente, 5 mg de fucana A ou nanogel foram colocados para reagir
com 1 mg de fluoresceína em solução 0,1 M de PBS (pH 7,0), sendo agitada
durante 1 hora, protegida da luz, a temperatura ambiente. A solução foi
dialisada contra água destilada (MW 12 kDa) e, em seguida, liofilizada.
4.3.11. Avaliação da viabilidade e morte celular por anexina V-FITC/ iodeto
de propídio (PI)
4.3.12. Atividade antioxidante
Quatro testes foram realizados para analisar a atividade antioxidante do
nanogel e da fucana A; foram eles: poder redutor, DPPH, sequestro de radicais
superóxido e capacidade antioxidante total. A metodologia foi seguida de
acordo com o descrito por Costa e colaboradores [23] e Vinayak, Sabu e
Chatterji [24].
4.3.13. Atividade anticoagulante
Os ensaios de tempo de tromboplastina parcial ativada (aPTT) e tempo
de protrombina (PT) foram realizados seguindo o protocolo fornecido pelos
“kits” comerciais adquiridos. Para esses ensaios foi utilizada uma massa de
100 µg para o nanogel (FucA:PEG15) e para a fucana A, sendo considerado o
possuidor de atividade aquela amostra capaz de prolongar em duas vezes o
tempo normal de coagulação. Foram utilizadas como meio de comparação da
atividade anticoagulante, a clexane (heparina de baixo peso molecular). Os
tempos de coagulação foram determinados utilizando-se um coagulômetro
automático.
4.3.14. Ensaio de formação de tubo de matrigel
4.4. ANÁLISE ESTATÍSTICA
5. ARTIGOS PRODUZIDOS
5.1. Artigo 1 (SUBMETIDO)
Evaluation of potential antitumor activity of fucan nanogel
Periódico: Marine Drugs
Nanotechnology (The reference number for the article is NANO-102955)
Fator de impacto: 3.978
ISSN: 1660-3397 (Printed version)
ISSN: 1660-3397 (Online version)
Qualis: Medicina II
–
A2
Indexada: PubMed
–
indexado por MEDLINE
5.2. Capítulo de livro
Chapter 6
–
Application of Marine Polysaccharides in Nanotechnology
Periódico: Marine Medicinal Glycomics
Biotechnology in Agriculture, Industry and Medicine Biochemistry
Research Trends
In: Vitor Hugo Pomin. (Org.). Marine Medicinal Glycomics. 1ed.New York: Nova
Science, 2013, v. 01, p. 65-114.
Binding: ebook
ISBN: 978-1-62618-649-1
5.3. Artigo 2
Evaluation of acute and subchronic toxicity of a non-anticoagulant, but
antithrombotic algal heterofucan from the
Spatoglossum schröederi
in
Wistar rats
Periódico: Brazilian Journal of Pharmacognosy
Rev. Bras. Farmacogn. Braz. J. Pharmacogn. 21(4): Jul./Aug. 2011
Fator de impacto: 0.68
Indexada: SCOPUS, SciELO, EMBASE e GEOBASE
5.4. Artigo 3
Evaluating the possible genotoxic, mutagenic and tumor cell
proliferation-inhibition effects of a non-anticoagulant, but antithrombotic algal
heterofucan
Periódico: Journal of applied toxicology : JAT.
J Appl Toxicol. 2010 Oct;30(7):708-15. doi: 10.1002/jat.1547.
Fator de impacto: 2.597
ISSN: 0260-437X (Printed version)
ISSN: 1099-1263 (Online version)
Qualis: Medicina II
–
B1
5.1. ARTIGO 1 (SUBMETIDO)
Mar. Drugs 2014, 12, 1-x manuscripts; doi:10.3390/md120x000x
marine drugs
ISSN 1660-3397
www.mdpi.com/journal/marinedrugs
Article
Evaluation of potential antitumor activity of fucan
nanogel
Jailma Almeida-Lima
1,2, Arthur Anthunes Jacome Vidal
1, Dayanne Lopes
Gomes
1,2, Ruth Medeiros Oliveira
1, Leonardo Thiago Duarte Barreto Nobre
3,
Mariana Santana Santos Pereira Costa
1, Nednaldo Dantas-Santos
2, Helena
Bonciani Nader
3, Francisco Miguel Gama
4, Edda Lisboa Leite
1, Hugo Alexandre
Oliveira Rocha
1,2*1
Laboratory of Biotechnology of Natural Polymers (BIOPOL), Department of
Biochemistry, Federal University of Rio Grande do Norte (UFRN), Natal-RN
59078-970, Brazil; E-Mails: biolottus23@yahoo.com.br (J.A.-L.); arthur_bio@hotmail.com
(A.A.J.V.); dayanne_gomes@hotmail.com (D.L.G.); rmo_85@hotmail.com
(R.M.O.); marispc_bio@yahoo.com.br (M.S.S.P.C); eddaleite@cb.ufrn.br (E.L.L);
hugo@cb.ufrn.br (H.A.O.R)
2