JPediatr(RioJ).2014;90(6):572---579
www.jped.com.br
ARTIGO
ORIGINAL
Glycogen
storage
disease
type
I:
clinical
and
laboratory
profile
夽
,
夽夽
Berenice
L.
Santos
a,
Carolina
F.M.
de
Souza
b,
Lavinia
Schuler-Faccini
a,b,c,
Lilia
Refosco
b,
Matias
Epifanio
d,e,
Tatiele
Nalin
f,
Sandra
M.G.
Vieira
g,he
Ida
V.D.
Schwartz
b,c,∗aProgramadePós-Graduac¸ãoemSaúdedaCrianc¸aedoAdolescente,UniversidadeFederaldoRioGrandedoSul(UFRGS),
PortoAlegre,RS,Brasil
bServic¸odeMedicinaGenética,HospitaldeClínicasdePortoAlegre,PortoAlegre,RS,Brasil
cDepartmentodeGenética,UniversidadeFederaldoRioGrandedoSul(UFRGS),PortoAlegre,RS,Brasil dPontifíciaUniversidadeCatólicadoRioGrandedoSul(PUC-RS),PortoAlegre,RS,Brasil
eHospitalSãoLucas,PortoAlegre,RS,Brasil
fProgramadePós-Graduac¸ãoemGenéticaeBiologiaMolecular,UniversidadeFederaldoRioGrandedoSul(UFRGS),
PortoAlegre,RS,Brasil
gServic¸odeMedicinaPediátrica,HospitaldeClínicasdePortoAlegre,PortoAlegre,RS,Brasil
hProgramadePós-Graduac¸ãoemCiênciaemGastroenterologiaeHepatologia,UniversidadeFederaldoRioGrandedoSul
(UFRGS),PortoAlegre,RS,Brasil
Recebidoem15deabrilde2013;aceitoem28defevereirode2014
KEYWORDS
Inbornerrors ofmetabolism; Glycogenstorage diseasetypeI; Clinicalaspects; Diagnoses; Nutritionalstatus
Abstract
Objectives: Tocharacterizetheclinical,laboratory,andanthropometricprofileofasampleof BrazilianpatientswithglycogenstoragediseasetypeImanagedatanoutpatientreferralclinic forinbornerrorsofmetabolism.
Methods: Thiswasacross-sectionaloutpatientstudybasedonaconveniencesamplingstrategy. Dataondiagnosis,management,anthropometricparameters,andfollow-upwereassessed.
Results: Twenty-onepatientswereincluded(medianage10years,range1---25years),allusing uncookedcornstarchtherapy.Medianageatdiagnosiswas7months(range,1---132months), and19patientsunderwentliverbiopsyfordiagnosticconfirmation.Overweight,shortstature, hepatomegaly,andliver noduleswerepresentin16 of21,fourof21,nine of14,andthree of14patients,respectively.Acorrelationwasfoundbetweenheight-for-ageandBMI-for-age Z-scores(r=0.561;p=0.008).
Conclusions: Diagnosis of glycogen storage disease type I is delayed in Brazil. Most pati-ents undergo liver biopsy for diagnostic confirmation, even though the combination of a
DOIserefereaoartigo:http://dx.doi.org/10.1016/j.jped.2014.02.005
夽 Comocitaresteartigo:SantosBL,deSouzaCF,Schuler-FacciniL,RefoscoL,EpifanioM,NalinT,etal.GlycogenstoragediseasetypeI:
clinicalandlaboratoryprofile.JPediatr(RioJ).2014;90:572---9.
夽夽EstudoconduzidonaUniversidadeFederaldoRioGrandedoSul,HospitaldeClínicasdePortoAlegre,PortoAlegre,RS,Brasil.
∗Autorparacorrespondência.
E-mail:ischwartz@hcpa.ufrgs.br(I.V.D.Schwartz).
GlycogenstoragediseasetypeI 573
characteristicclinicalpresentationandmolecularmethodscanprovideadefinitivediagnosis inalessinvasive manner.Obesityisasideeffectofcornstarchtherapy, andappearstobe associatedwithgrowthinthesepatients.
©2014SociedadeBrasileiradePediatria.PublishedbyElsevierEditoraLtda.Allrightsreserved.
PALAVRAS-CHAVE
Errosinatosdo metabolismo; Doenc¸adedepósito deglicogêniotipoI; Aspectosclínicos; Diagnósticos; Estadonutricional
Doenc¸adedepósitodeglicogêniotipoI:perfilclínicoelaboratorial
Resumo
Objetivos: Caracterizaroperfilclínico,laboratorialeantropométricodeumaamostrade paci-entesbrasileiroscomdoenc¸adedepósitodeglicogêniotipoItratadosemumambulatóriode referênciaparaerrosinatosdometabolismo.
Métodos: Estefoiumestudoambulatorialtransversalcombaseemumaestratégiade amos-tragem deconveniência.Foramavaliadososdadoscomrelac¸ãoaodiagnóstico,tratamento, parâmetrosantropométricoseacompanhamento.
Resultados: Foramincluídos21pacientes(idademédiade10anos,faixa1-25anosdeidade), etodosseencontravamemterapiadeamidodemilhocru.Aidademédianaépocado diagnós-ticofoidesetemeses(faixa,1-32meses),e19pacientesforamsubmetidosabiópsiahepática para confirmac¸ãododiagnóstico.Sobrepeso,baixaestatura,hepatomegaliaenódulos hepá-ticosforamfatorespresentesem16de21,quatrode21,novede14etrêsde14pacientes, respectivamente.Foiencontradaumacorrelac¸ãoentreosescoreszparapesoparaidadeeIMC paraidade(r=0,561;p=0,008).
Conclusões: Odiagnósticodadoenc¸adedepósitodeglicogêniotipoItemsidotardionoBrasil. Amaioriadospacientesfoisubmetidaaconfirmac¸ãododiagnóstico,apesardeoquadroclínico característicoeosmétodosmolecularespoderemfornecerumdiagnósticodefinitivodeforma menosinvasiva.Obesidadeéumefeitocolateraldaterapiacomamidodemilhoepareceestar associadaacrescimentonessespacientes.
©2014SociedadeBrasileiradePediatria.PublicadoporElsevierEditoraLtda.Todososdireitos reservados.
Introduc
¸ão
Adoenc¸adedepósitodeglicogêniotipoI(GDSI,doenc¸ade vonGierke)écausadapeladeficiênciadeglicose-6-fosfatase (G6Pase),umaenzimaquecatalisaahidrólisede glicose-6-fosfato(G6P)emglicoseefosfatoinorgânico(Pi),umpasso importantena manutenc¸ãodahomeostasedaglicose.São reconhecidosdois subtiposprincipais daGSDI: GSDtipoIa (GSDIa), que é o resultado de uma mutac¸ão que afeta a subunidadecatalíticadaG6Pase-alfa(ouG6PC),eGSDtipo Ib(GSDIb),queécausadaporumdefeitonatranslocasede G6P (ouG6PT).1 A GSDI é herdada em um padrão
autos-sômicorecessivoe suaincidência éestimadaem umpara
100.000nascidosvivos,sendoaGSDhepáticamaiscomum.2
Pacientes com GSDIa apresentam hepatomegalia, uma
característica de ‘‘fácies de boneca’’, baixa estatura e
fadigacrônica.OsachadoslaboratoriaissugestivosdeGSDIa
incluem hipoglicemia após quatro a seis horas de jejum,
acidose láctica, hipertrigliceridemia e hiperuricemia. Os
testesfuncionaisparaumdiagnósticodiferenciadode
hipo-glicemiamostramausênciaderespostaglicêmicaainjec¸ão
de glucagon e piora da hiperlactatemia,3 ao passo que
a análise histopatológica dabiópsia hepática mostra
acú-mulo de glicogênio no fígado. Na GSD tipo Ib, o quadro
clínico é bem semelhante ao da GSDIa, porém pode ser
acompanhada de neutropenia, com infecc¸ões recorrentes
(principalmentedotratogastrointestinal)eumamaior
inci-dência de doenc¸a inflamatória do intestino.4 Apesar de
osmétodos padrão-ouropara diagnóstico daGSDIa serem
avaliac¸ão daatividade de G6PCou G6PT notecido
hepá-ticoe/oudetecc¸ãodemutac¸õespatogênicasnosgenesque
codificamaG6PCeG6PT,podesedarinícioaumaterapia
específicacombaseexclusivamente nosachadosclínicose
histopatológicos.3OacessoaostestesdeDNA/enzimáticosé
limitado,poiselessãodisponibilizadosapenasapoucos
cen-trosnacionaiseinternacionaisselecionados, normalmente
noâmbitodeprojetosdepesquisa.
OtratamentodaGSDIé basicamentealimentar3 e
con-siste em refeic¸ões frequentes --- preferencialmente que
contenhamcarboidratosdeliberac¸ãolenta,comoamidode
milhocru---emintervalosregularesecomrestric¸ãoquanto
àingestãodefrutose, sacarosee lactose.Em neonatos,a
estratégiadetratamentorecomendadaincluialimentac¸ões
frequentes e infusão contínua de glicose à noite a uma
taxade6-8mg/kg/minpormeiodeumasondanasogástrica
oudegastrostomia.Aeficáciadotratamentoémedidapelo
monitoramento dos parâmetros de crescimento e
bioquí-micos,bem como por ultrassom abdominalparaavaliar o
volumedofígadoeapresenc¸adenódulos.Omanejo
dieté-ticoadequadoreduzoriscodecomplicac¸õesdelongoprazo,
queincluembaixaestatura,osteoporoseouperdamineral
óssea, doenc¸a renal com hipertensão, proteinúria,
cálcu-losrenais,nefrocalcinose,adenomashepatocelulares(com
potencial de transformac¸ão maligna), pancreatite
secun-dáriaahipertrigliceridemiaehipoglicemiapotencialmente
574 SantosBLetal.
Oobjetivodesteestudofoiavaliaroperfilclínicoe
labo-ratorialdeumaamostradepacientesbrasileiroscomGSDI
recrutadosdeumambulatóriodereferênciaparaerros
ina-tosdometabolismo.Nossaprincipalhipótesedepesquisafoi
queodiagnósticodaGSDItemsidotardionoBrasil,tanto
porfaltadeacessoamétodosdediagnósticoquantopormá
conscientizac¸ãodacondic¸ãoporprestadoresdeservic¸osde
saúde,dificultando,assim,umrápidoacessoatratamento
eaconselhamentogenético.
Métodos
EsteestudofoiaprovadopeloComitêdeÉticadoHospitalde ClínicasdePortoAlegre(HCPA,Brasil).Foiobtido consenti-mentoinformadoporescritodetodososindivíduosantesda participac¸ãonoestudo.
Estafoiumacasuísticaambulatorialcomanálise trans-versal das variáveis de interesse. Foi utilizada uma estratégiadeamostragemdeconveniência.Oestudofoi rea-lizadoentre marc¸o de2011 e janeiro de 2013. O critério deinclusãofoi umdiagnóstico deGSDIestabelecido utili-zandopelomenosdoisdosseguintesmétodos(odiagnóstico foiconfirmadoemtodospacientesdeformaindependente pelos autores): a) Diagnóstico Clínico, definido por mais de12mesesdecuidadosespecializados(acompanhadopor umhepatologista ou médico geneticista) e manifestac¸ões clínicascompatíveiscomGSDI(hipoglicemiacom hiperlacta-temia,hipertrigliceridemia,hiperuricemia,hepatomegalia e/oudéficitdecrescimentoebaixaestaturaeníveisnormais de creatinofosfoquinase [CPK]) no momento do diagnós-ticooudainclusãonoestudo;b)HistóricoFamiliarPositivo compatívelcomheranc¸aautossômicarecessiva,desdeque aGSDI tenha sido confirmada por métodoenzimáticos ou análisedeDNAno(s) parente(s)afetado(s);c)Diagnóstico Histopatológico,definidocomopresenc¸adealterac¸ões his-tológicas no tecido hepático compatíveis com GSD, como núcleoshiperglicogenados,fibrosediscretaealterac¸õesde gorduracomvacúoloslipídicos;7d)DiagnósticoEnzimático,
definidoporatividadenegligenciável(<10%)daG6Paseem
amostrasde tecidohepático frescas oucongeladas; oue)
DiagnósticoMolecular,definidopelapresenc¸ademutac¸ões
patogênicasnogeneG6PC(parapacientescomGSDIa)ouno
geneSLC37A3 (para oscomGSDIb), detectadaspor
méto-dos moleculares. Essa distinc¸ão entre GSDIa e GSDIb foi
principalmentecombaseemachadosclínicos(ausênciaou
presenc¸ade neutropenia,respectivamente), pois os
diag-nósticosmolecularesnãoestavamdisponíveisparaamaioria
dospacientes.
Os pacientes foram convidados a participar do estudo
apósconsultasderotina.Osque concordaramem
partici-parforamtodosavaliadospelomesmopesquisadoreforam
submetidos a verificac¸ão direcionada do histórico, exame
físicoeavaliac¸ãoantropométrica.Osúltimosvalores
labo-ratoriais(glicemia,lactato,colesterol,triglicerídeos,ácido
úrico)eachadosdeimagemdisponíveisparacadapaciente
foramobtidospormeiodeumarevisãodeprontuários.Os
examesrealizadosatétrêsmesesantesdaavaliac¸ão
antro-pométrica foram considerados aceitáveis. As variáveis de
interesseforamsexo,consanguinidade,idadeatual,idade
na época dodiagnóstico (definido como idade na qual os
pais relataram um diagnóstico específico de GSD ou, se
indisponível, a idade na época do diagnóstico conforme
observadonoprimeiroprontuáriodopaciente contendoos
resultados dostestes de diagnósticoe o iníciodo manejo
dietético),parâmetroslaboratoriais(atuaisenomomento
dodiagnóstico), biópsia hepáticaparaexame
histopatoló-gicoouanálisemolecular,dadosclínicosedeimagematuais
(avaliac¸ãoantropométrica,ultrassomdofígado,densidade
mineralósseaecomposic¸ãocorporalpormeiode
absorcio-metriadeduplaenergiaderaios-X[DEXA]).
A avaliac¸ão antropométrica consistiu da avaliac¸ão de
peso (kg) e altura(cm). O peso corporal foiavaliado
uti-lizando escalas digitais com uma capacidade máxima de
150kgeumaresoluc¸ãode100g,certificadospeloInstituto
NacionaldeMetrologia,QualidadeeTecnologia(Inmetro).
Os pacientes foram pesados nus e descalc¸os. O peso foi
medidocom umestadiômetrodeparede comprecisão de
1mm. Em adolescentes, foi utilizada a escala de Tanner.
As medidas e classificac¸ões antropométricas paraidade e
sexoforamcalculadasnoconjuntodesoftwareAnthroPlus
daOMS.Asvariáveisdeinteresseforamescoreszparapesoe
IMCparaidade,conformepropostopelaSociedadeBrasileira
dePediatria.8
Otamanhodofígado foimedidopor ultrassonografiae
avaliadoparanormalidadecombasenostamanhosde
refe-rênciaparacrianc¸aspublicadosem2010porDhingraetal.9
Quando nãodisponíveis os dadosobjetivos sobre o
tama-nho do fígado, utilizamos, em vez disso, a impressão do
ultrassonografista(normalouaumentado).
Oscritériosdeadequac¸ãodocontrolemetabólico
tive-ramcombaseoEstudoEuropeusobreDoenc¸adeDepósito
de Glicogênio TipoI (ESGSD I):5 glicemia> 63mg/dL,
tri-glicerídeos< 530mg/dL, ácidoúrico <7mg/dL, IMCentre
desvios-padrão0e+2elactato>2,5mmol/L(esteutilizado
comorelac¸ãolactatourinário/creatininanãoestava
dispo-nível).Aausênciadeadenomashepáticosealturaparapeso
adequada(escorez>-2SD)sãoparâmetrosimportantespara
a avaliac¸ão daadequac¸ão docontrole metabólico, porém
nãofazempartedoESGSDI.5
Foram realizadas análises estatísticas no ambiente de
software20.0doPacoteEstatísticoparaasCiênciasSociais®
(SPSSInc.,Chicago,IL,EUA).Asvariáveiscontínuasforam
expressas como médias e desvios-padrão ou medianas e
intervalos interquartis.A análisedavariância(ANOVA) foi
utilizadaparacomparac¸ãodeescoresz paraalturae IMC.
O nível designificância foi estabelecido em 5%. Osdados
foram inseridos em uma planilha do Microsoft Excel
2010paraWindows(Microsoft,Redmond,WA,USA)e
anali-sadosnoSPSS20.0(IBMCorp.,Armonk,NY,EUA).
Resultados
Nototal, 21pacientes foramincluídos noestudo:17 com GSDIaequatrocomGSDIb.Atabela1apresentaoperfilda
amostranomomentododiagnóstico.
Atabela2mostraosdadosantropométricose
laborato-riais,bemcomoaconformidadecomaterapiadeamidode
milho cru. Dentreos pacientes, 16 apresentaram excesso
de peso corporal (seis de 21 obesidade grave [escore z
paraIMCparaidade>+3];seisde21obesidade;quatrode
21 sobrepeso). O escore z médio para IMC para idade foi
Glycogen
storage
disease
type
I
575
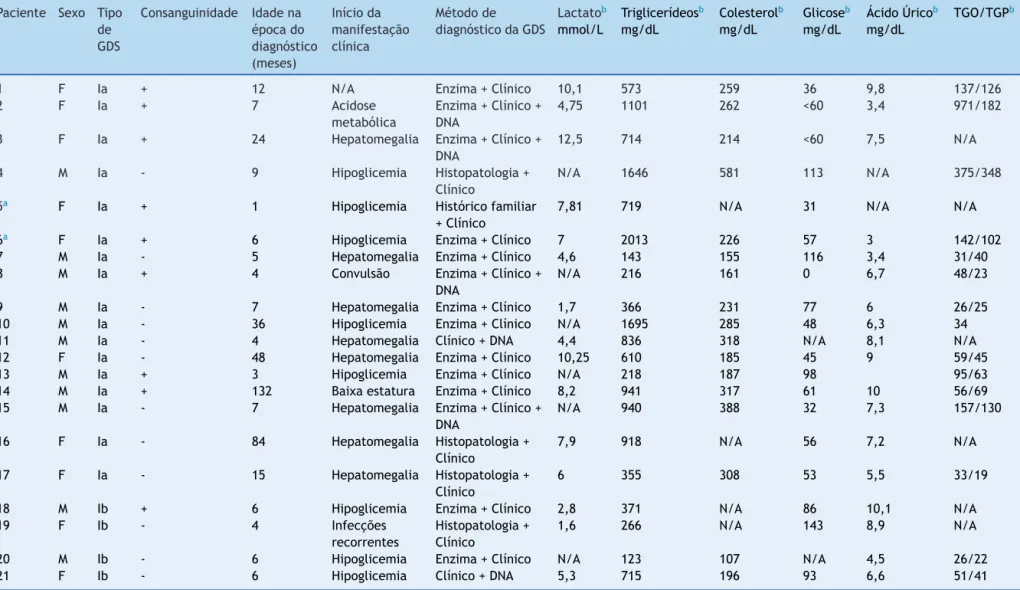
Tabela1 Resumodosachadosnodiagnósticodentrepacientescomdoenc¸adedepósitodeglicogênio(GDS)tipoI(n=21)
Paciente Sexo Tipo de GDS
Consanguinidade Idadena épocado diagnóstico (meses)
Inícioda manifestac¸ão clínica
Métodode diagnósticodaGDS
Lactatob mmol/L
Triglicerídeosb mg/dL
Colesterolb mg/dL
Glicoseb mg/dL
ÁcidoÚricob mg/dL
TGO/TGPb
1 F Ia + 12 N/A Enzima+Clínico 10,1 573 259 36 9,8 137/126
2 F Ia + 7 Acidose
metabólica
Enzima+Clínico+ DNA
4,75 1101 262 <60 3,4 971/182
3 F Ia + 24 Hepatomegalia Enzima+Clínico+
DNA
12,5 714 214 <60 7,5 N/A
4 M Ia - 9 Hipoglicemia Histopatologia+
Clínico
N/A 1646 581 113 N/A 375/348
5a F Ia + 1 Hipoglicemia Históricofamiliar
+Clínico
7,81 719 N/A 31 N/A N/A
6a F Ia + 6 Hipoglicemia Enzima+Clínico 7 2013 226 57 3 142/102
7 M Ia - 5 Hepatomegalia Enzima+Clínico 4,6 143 155 116 3,4 31/40
8 M Ia + 4 Convulsão Enzima+Clínico+
DNA
N/A 216 161 0 6,7 48/23
9 M Ia - 7 Hepatomegalia Enzima+Clínico 1,7 366 231 77 6 26/25
10 M Ia - 36 Hipoglicemia Enzima+Clínico N/A 1695 285 48 6,3 34
11 M Ia - 4 Hepatomegalia Clínico+DNA 4,4 836 318 N/A 8,1 N/A
12 F Ia - 48 Hepatomegalia Enzima+Clínico 10,25 610 185 45 9 59/45
13 M Ia + 3 Hipoglicemia Enzima+Clínico N/A 218 187 98 95/63
14 M Ia + 132 Baixaestatura Enzima+Clínico 8,2 941 317 61 10 56/69
15 M Ia - 7 Hepatomegalia Enzima+Clínico+
DNA
N/A 940 388 32 7,3 157/130
16 F Ia - 84 Hepatomegalia Histopatologia+
Clínico
7,9 918 N/A 56 7,2 N/A
17 F Ia - 15 Hepatomegalia Histopatologia+
Clínico
6 355 308 53 5,5 33/19
18 M Ib + 6 Hipoglicemia Enzima+Clínico 2,8 371 N/A 86 10,1 N/A
19 F Ib - 4 Infecc¸ões
recorrentes
Histopatologia+ Clínico
1,6 266 N/A 143 8,9 N/A
20 M Ib - 6 Hipoglicemia Enzima+Clínico N/A 123 107 N/A 4,5 26/22
21 F Ib - 6 Hipoglicemia Clínico+DNA 5,3 715 196 93 6,6 51/41
Todosospacientes apresentarammanifestac¸õesclínicasnaépocadodiagnósticoouestavam emtratamentocomumgastroenterologistapediátricooumédicogeneticistanaépoca
dainclusãonoestudoeapresentaramevidênciahistopatológicadeacúmulodeglicogêniohepáticoe/ouatividadedaG6Pasea<10%notecidohepáticoe/oupresenc¸ademutac¸ões
patogênicasnogenedaG6Paseeausênciadealtosníveisdecreatinofosfoquinase.
a Pacientes5e6formamumsibship,eopaciente6éoirmãomaisvelho.
b Valoresnaépocadodiagnóstico;+,presenc¸a;-,ausência;N/A,nãoaplicável.Intervalosdereferência:lactato,0,5---2,2mmol/L;triglicerídeos,≤100mg/dLemidades<10anos,≤
130mg/dLemidadesentre10-19anos,≤150mg/dLemadultos;colesteroltotal,<129mg/dL;glicose,60-99mg/dL;ácidoúrico,2,4---7mg/dL;TGO<37mg/dL;TGP,<41mg/dL.
576
Santos
BL
et
al.
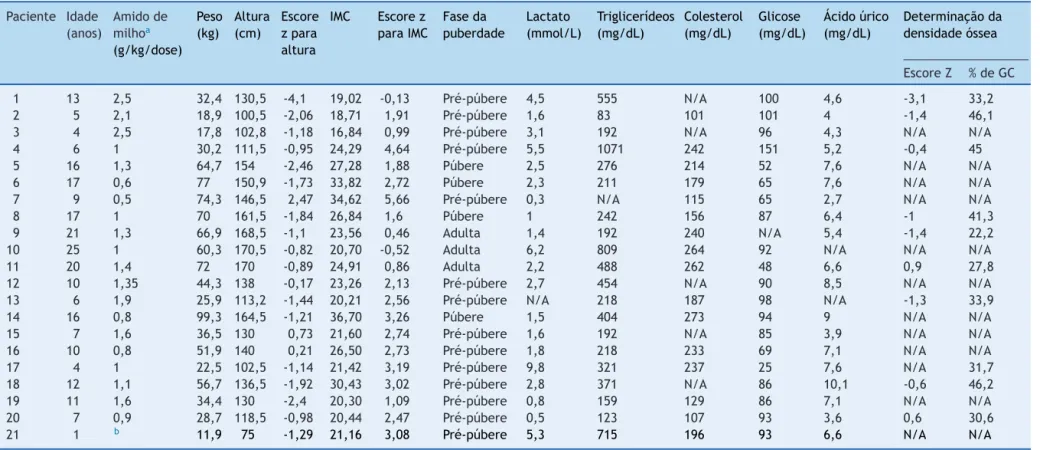
Tabela2 Últimaavaliac¸ãoantropométricaelaboratorialdepacientescomdoenc¸adedepósitodeglicogêniotipoI(n=21)
Paciente Idade (anos)
Amidode milhoa (g/kg/dose)
Peso (kg)
Altura (cm)
Escore zpara altura
IMC Escorez
paraIMC
Faseda puberdade
Lactato (mmol/L)
Triglicerídeos (mg/dL)
Colesterol (mg/dL)
Glicose (mg/dL)
Ácidoúrico (mg/dL)
Determinac¸ãoda densidadeóssea
EscoreZ %deGC
1 13 2,5 32,4 130,5 -4,1 19,02 -0,13 Pré-púbere 4,5 555 N/A 100 4,6 -3,1 33,2
2 5 2,1 18,9 100,5 -2,06 18,71 1,91 Pré-púbere 1,6 83 101 101 4 -1,4 46,1
3 4 2,5 17,8 102,8 -1,18 16,84 0,99 Pré-púbere 3,1 192 N/A 96 4,3 N/A N/A
4 6 1 30,2 111,5 -0,95 24,29 4,64 Pré-púbere 5,5 1071 242 151 5,2 -0,4 45
5 16 1,3 64,7 154 -2,46 27,28 1,88 Púbere 2,5 276 214 52 7,6 N/A N/A
6 17 0,6 77 150,9 -1,73 33,82 2,72 Púbere 2,3 211 179 65 7,6 N/A N/A
7 9 0,5 74,3 146,5 2,47 34,62 5,66 Pré-púbere 0,3 N/A 115 65 2,7 N/A N/A
8 17 1 70 161,5 -1,84 26,84 1,6 Púbere 1 242 156 87 6,4 -1 41,3
9 21 1,3 66,9 168,5 -1,1 23,56 0,46 Adulta 1,4 192 240 N/A 5,4 -1,4 22,2
10 25 1 60,3 170,5 -0,82 20,70 -0,52 Adulta 6,2 809 264 92 N/A N/A N/A
11 20 1,4 72 170 -0,89 24,91 0,86 Adulta 2,2 488 262 48 6,6 0,9 27,8
12 10 1,35 44,3 138 -0,17 23,26 2,13 Pré-púbere 2,7 454 N/A 90 8,5 N/A N/A
13 6 1,9 25,9 113,2 -1,44 20,21 2,56 Pré-púbere N/A 218 187 98 N/A -1,3 33,9
14 16 0,8 99,3 164,5 -1,21 36,70 3,26 Púbere 1,5 404 273 94 9 N/A N/A
15 7 1,6 36,5 130 0,73 21,60 2,74 Pré-púbere 1,6 192 N/A 85 3,9 N/A N/A
16 10 0,8 51,9 140 0,21 26,50 2,73 Pré-púbere 1,8 218 233 69 7,1 N/A N/A
17 4 1 22,5 102,5 -1,14 21,42 3,19 Pré-púbere 9,8 321 237 25 7,6 N/A 31,7
18 12 1,1 56,7 136,5 -1,92 30,43 3,02 Pré-púbere 2,8 371 N/A 86 10,1 -0,6 46,2
19 11 1,6 34,4 130 -2,4 20,30 1,09 Pré-púbere 0,8 159 129 86 7,1 N/A N/A
20 7 0,9 28,7 118,5 -0,98 20,44 2,47 Pré-púbere 0,5 123 107 93 3,6 0,6 30,6
21 1 b 11,9 75 -1,29 21,16 3,08 Pré-púbere 5,3 715 196 93 6,6 N/A N/A
EscoreszparaalturaparaidadeeIMCcalculadosnoAnthroeAnthroPlusdaOMS.Adeterminac¸ãodadensidadeósseafoifeitaemumdispositivoLunariDXA(GEHealthcare).Escores
zparadensidademineralósseacalculadosecomposic¸ãocorporalexpressacomopercentualdegorduracorporal(%deGC).Escoreszparadensidademineralósseanãocalculadosno
paciente17devidoàidade<5anos.N/A,nãoaplicável.
Intervalosdereferência:lactato,0,5---2,2mmol/L;triglicerídeos,≤100mg/dLemidades<10anos,≤130mg/dLemidadesentre10-19anos,≤150mg/dLemadultos;colesteroltotal,
<129mg/dL;glicose,60-99mg/dL;ácidoúrico,2,4---7mg/dL.
IMC,índicedemassacorporal.
a Todosospacientesestavamemterapiadoamidodemilhocru(4-6vezes/dia)enenhumestavafazendoinfusãocontínuadeglicoseànoite.
GlycogenstoragediseasetypeI 577
6,0
5,0
4,0
3,0
2,0
1,0
–1,0
–5,0 –4,0 –3,0 –2,0 –1,0 0,0
Altura escore z
IMC escore z
1,0 2,0 3,0 0,0
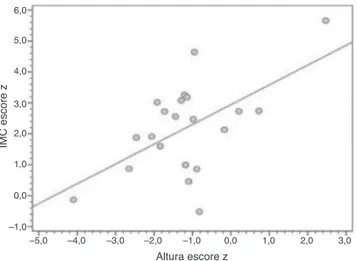
Figura1 Correlac¸ãoentreescoresz paraIMC paraidade e alturaparaidade(r=0,561;p=0,008).
IMC,índicedemassacorporal.
foide-1,16(-1,76a-0,58);quatrode21pacientes apresen-tarambaixaestatura,umdosquaisapresentoumuitobaixa estatura(escorez<-3).Afigura1mostraumarepresentac¸ão
gráficadacorrelac¸ãopositivaesignificativaentreosescores
zparaalturaeIMC.
Acomposic¸ãocorporalfoianalisadaem10pacientes(oito
comGSDIa,doiscom GSDIb)(tabela2). Paraavaliac¸ão do
tamanhodofígado,14pacientesforamsubmetidosà
ultras-sonografiaabdominal;desses,cincoapresentaramtamanho
normaldofígadoeumdelesapresentouumnódulohepático
visível.Osoitopacientesrestantesapresentaram
hepatome-galia,edoisapresentarammaisdetrêsnódulosdetectáveis.
Discussão
Acaracterizac¸ãodahistórianaturaldedoenc¸asraraseda eficáciadetratamentosparaessasdoenc¸asésempre pre-judicada poramostras pequenas.10 O pequenonúmero de
pacienteséatribuívelnãoapenasàraridadedessasdoenc¸as,
mas também ao subdiagnóstico, principalmente de casos
commanifestac¸õesclínicasrelativamenteleves.Portanto,
estudos como este --- a primeira caracterizac¸ão de uma
populac¸ão de pacientescom GSDInoBrasil --- são
primor-diais,considerandoseupapelfundamentalempossibilitara
realizac¸ãoposteriordeumameta-análiseeatingir
conclu-sõesmaiscompletas.
O diagnósticodaGSDIfoi tardionessa amostra,
confir-mandonossahipótese inicial.Deacordocom aliteratura,
a idade normal no início dos sintomas em pacientes com
GSDI é de três meses.4 Este estudo não avaliou a
variá-vel‘‘idade noinício dossintomas’’,poisacreditamosque
ela está sujeita a uma ampla gama de vieses,
principal-mente de memória.Estudos mostraram quediagnóstico e
iníciodotratamentoprecoces estãoassociadosa menores
chancesdecomplicac¸ões.3Emnossaamostra,odiagnóstico
clínicoprecocefoiestabelecidoemumpaciente(paciente
5), que desenvolveu sintomas antes do primeiro mês de
vida e tinha umirmãomais velho (paciente 6) com
diag-nósticoconfirmado deGSDIa.Oúltimodiagnóstico foiaos
132mesesdeidade,nopaciente14,queapresentou
hipogli-cemiasubclínicaefoidiagnosticadoapósumainvestigac¸ão
detrêsanosdesencadeadapelabaixaestaturadomesmo,
representando,assim,umfenótipodecertaformaatenuado
da doenc¸a. Apesar de a hipoglicemia ser um dos
princi-paissintomas que despertam suspeita clínica de GSDI, às
vezeselapodepassardespercebidadevidoaousodeácido
láctico como um substrato para metabolismo cerebral.11
Portanto,apesardeahipoglicemiasintomáticaserrelatada
commaisfrequência,suaausêncianãodetermina
diagnós-ticodeGSDI.Em2003,Shiehetal.publicaramumrelatode
casodescrevendoodiagnósticotardiodaGSDIesugeriram
quepodemocorrerformas‘‘maisleves’’dadoenc¸a.11Ainda
em2003,umartigorecomendouqueadolescentescom
hipe-ruricemia e hiperlipidemia inexplicadas fossem avaliados
paraGSDI,mesmoemcasodeausênciadehipoglicemia.12
Comrelac¸ãoaosprocedimentosdediagnóstico,a
maio-riadospacientesemnossaamostrafoisubmetidaàbiópsia
defígado.13Esseachadoémuitosurpreendenteemvirtude
doaumentomundialnaacessibilidadedetestesgenéticos.
OgeneG6PCépequeno(12,5kb,5 éxons)e,assim,
facil-mente sequenciado, principalmente porque ele é afetado
pormutac¸õescomunsnapopulac¸ãobrasileira,comop.347X
e p.R83C, como relatado por Reis et al. em 2011.14 Em
nossaamostra,essasmutac¸õesforamencontradasem
qua-tro e três dos 10 pacientes com GSDIa, respectivamente
(dados não mostrados). Apesar não inteiramente
despro-vidode risco, a coletadesangue para testes genéticos é
umprocedimentobemmenosinvasivoedispendiosoquea
biópsiadefígadoparaavaliac¸ãohistopatológicaoude
ati-vidadeenzimática.A análisehistológicaisolada dotecido
hepático sem mensurac¸ão da atividade enzimática não é
suficienteparadeterminarotipodeGSD,apesardepoder
demonstrardeposic¸ãodeglicogênioegorduraeservaliosa
nodiagnóstico diferenciado de outras doenc¸as hepáticas.
Poroutrolado,ensaiosenzimáticosestãodisponíveis
ape-nasem muito poucos centros e estão associados a vários
desafiosdelogística,comotransportedotecido(as
amos-trasdevemestarpreferencialmentefrescasoucongeladas)
paraolaboratóriodereferência.
Nossosdadossugeremumatendênciadepacientescom
maiores escores z para altura para idade e também
com maiores escores z para IMC para idade.15 Apesar de
essa tendência ter sido afetada por valores
discrepan-tes,ela sugere que manejo dietético intensivo leva a um
melhorcrescimentoàcustadeganhodepesosignificativo,
conformerelatadoanteriormenteporWeinsteineWolfsdorf
em 2002.6 O tratamento daobesidade em pacientes com
GSDIécertamenteumtemaquemerecemaiorinvestigac¸ão.
Oretardodocrescimentoéumachadodegrande
impor-tânciaemcrianc¸as comGSDI,16 e baixaestaturaé comum
emadultoscomadoenc¸a.Emnossaamostra,pacientescom
controlemetabólicoinadequado,deacordocomoESGSDI,4
apresentaram ospiores escoresz paraaltura para idade.
A fisiopatologia da baixa estatura na GSDI ainda precisa
ser elucidada, porém estudos realizados desde 2008 têm
mostradoque controle metabólicoadequado pode
melho-raro crescimento.17,18 Alterac¸ões hormonais, variac¸ão no
pH sanguíneo(devido àacidose metabólica) e
hiperlacta-temiapodemcontribuirpara essedéficit de crescimento.
Deacordocomos critériosdoESGSD I,5 metadedetodos
os pacientes em nossa amostra apresentaram controle
metabólicoadequadodesuadoenc¸a,apesardealguns
578 SantosBLetal.
pelomenosem parte, crescimentoquaseadequado dessa
populac¸ão(18de21pacientesapresentaramescoreszpara
alturaparaidade>-2SDs).
A finalidade do manejo dietético da GSDI é
imi-tar a produc¸ão de glicose endógena. As estratégias de
administrac¸ão exógena de dextrose para manutenc¸ão da
normoglicemiaforam avaliadase modificadas nos últimos
anos. Alimentac¸ões frequentes contendo amido
parcial-mente cozido, alimentac¸ão gástrica noturna contínua por
gotejamento(CNGDF)dedextrose viatubo nasogástricoe
terapiadeamidodemilhocru(UCCS)sãoalgumasdas
estra-tégiasdisponíveis.Nenhum dos pacientesnesta casuística
estavasendoalimentadoànoitedeformacontínua;todos
estavamem terapia deamidodemilhocru (cincoouseis
dosespor24horas,inclusive duranteanoite).Uma
meta--análise recente15 comparou vários estudos de UCCS (uso
diurnoenoturno)aestudosdeCNGDF,econstatoumelhora
emcurtoelongoprazosdocontrolemetabóliconos
pacien-tesdevidoàUCCS.19 Portanto,aCNGDFdeveserrestritaa
casosespecíficos, poisainconveniênciadeseralimentado
porumabombaeoriscodehipoglicemiaseveraemcasode
interrupc¸ãoabruptadaalimentac¸ão(p.ex.devidoàqueda
deenergiaoumaufuncionamentodabomba)nãosuperaram
osbenefíciosdocontrolemetabólicodaadministrac¸ão
inter-mitentedeUCCSduranteanoite.Umafórmulamodificada
deamidodemilho(Glycosade®,Vitaflo,NestléHealth
Nutri-tion,Vevey,Suíc¸a),ecomaprovac¸ãoconcedidapelaagência
deAdministrac¸ãodeAlimentoseMedicamentos(FDA),em
2012,éumaalternativaquepodepossibilitarqueos
paci-entesdurmamduranteanoite.20
AhepatomegaliavistaempacientescomGSDIpodeser
resultado de deposic¸ão de glicogênio e doenc¸a do fígado
gordurososecundáriaaoaumentonofluxodeácidosgraxos
livresdotecidoadiposoparaofígado.21Ultrassomderotina
dofígadoé umtipodediagnósticonãoinvasivoque pode
serutilizadoparaavaliarosucessoemlongoprazodo
trata-mento.Comonossaanálisedosachadosultrassonográficos
tevecomobaseumarevisãodeprontuários,avariabilidade
dooperador é umapreocupac¸ão. A histologia dos
adeno-mashepatocelularesnaGSDIésemelhanteàdosadenomas
vistosemoutrasdoenc¸as.Váriashipótesestentaram
expli-carodesenvolvimentodealterac¸õesadenomatosas,como
desequilíbrios na proporc¸ão de glucagon/insulina,
sobre-cargadeglicogêniocelulareativac¸ãodoproto-oncogene.21
Ostrêspacientescomadenomashepáticosemnossa
casuís-ticatinham16,17e25anosdeidade(pacientes5,6e10,
respectivamente).Ospacientes5e6apresentaramcontrole
metabólicoinadequado,comhiperuricemiaehipoglicemia
apesardebaixosníveisdetriglicerídeoselactatoquase
nor-mal.Opaciente10,omaisvelhoemnossaamostra,também
apresentoucontrolemetabólicoinadequado.
Adenomas hepatocelulares podem ocorrer em 22%-75%
dosadultoscomGSDIa,eoriscodetransformac¸ãomaligna
édeaproximadamente10%.21Comoamaioriadospacientes
tinhamenosde20anosdeidade,espera-sebaixa
incidên-ciadeadenomas nessapopulac¸ão,independentemente do
controlemetabólico.Atéagora,nãoexistemcasosde
hepa-tocarcinomaemnossacasuística.
Dosnove pacientessubmetidos aexamesdedensidade
óssea,apenasum(paciente1)apresentou‘‘baixamassa
cor-póreaparaaidadecronológica’’deacordocomaDeclarac¸ão
de Posic¸ão Oficial de 2008da Sociedade Brasileira de
Densitometria Óssea.22 Vários mecanismostêm sido
suge-ridos para explicar a baixa densidade mineral óssea vista
empacientescomGSDI:acidosepersistente,perdade
cál-cionaurinasemsubstituic¸ãoadequada,reduc¸ãodamatriz
óssea (hipoglicemia leva à diminuic¸ão da glicosilac¸ão das
proteínasdamatrizóssea)ealterac¸õesnosníveisdo
hormô-niodocrescimento(GH).18Adicionalmente,váriospacientes
comGSDIapresentamcrescimentopuberalanormal,5 eos
esteroides sexuaisdesempenham umimportantepapel na
formac¸ão óssea, principalmente durante a puberdade.22
Algunstecidosdevemserlevadosemconsiderac¸ãoao
ana-lisaradensidademineralósseaemcrianc¸aseadolescentes,
como maturac¸ão óssea, sexo e fase da puberdade.23 Em
geral,ospacientesavaliadosnestacasuísticaapresentaram
boadensidademineralóssea,apesardesuaGSDI.
Apesar da raridade da GSDI, a mesma não pode
ser ignorada pelos pediatras. O agente utilizado para
tratamento desse erro inatodometabolismo está
pronta-mentedisponívelemqualquermerceariaousupermercado.
Aadministrac¸ãodeamidodemilhocomonutracêutico
(ali-mentoutilizadoparafinsmedicinais)empacientescomGSDI
possui o ganho de peso excessivo como efeito colateral,
devidoaoaumentonoconsumototaldecarboidratoe
tam-bém provavelmente à inatividade física relativa. Nenhum
estudoavaliouaeficáciadeexercíciosfísicosempacientes
comGSDI,eosmesmosnãosãocontraindicados.Portanto,
a atividade física, acompanhada de uma prescric¸ão
die-tética bem formulada considerando os períodos de pré
e pós-exercício, pode ser uma estratégia válida para a
administrac¸ãodoganhodepesoempacientescujocontrole
metabóliconãoésatisfatório.
A maiorconscientizac¸ão dessa doenc¸a entre os
pedia-trasdeveajudarnasuabuscaporumdiagnósticoetiológico
em casos de hipoglicemia, hepatomegalia, dislipidemia e
baixaestatura,quepodemsertratadosinadequadamente.
Odiagnósticoprecocecombaseemachadosclínicose
labo-ratoriais é viável, fácil e acessível, mesmo em casos de
acessolimitadoacuidadosespecializados.Contudo,o
inves-timentoemcentrosdediagnósticomolecularespecializado
deve ser garantido e necessário, pois o uso de métodos
moleculares praticamente eliminaa necessidadede
bióp-siahepática.Otratamentoprecocepodeserinstituídoem
qualquerservic¸odesaúde,nãoexigeintervenc¸ões
comple-xase reduzo riscodemorte,principalmenteporprevenir
a hipoglicemiasevera. Pacientesadequadamente tratados
podemtervidasintelectualesocialmentegratificantessem
limitac¸ões,excetoumadietaespecial.
Financiamento
FIPE-HCPA,FAPERGSeCNPq.
Conflitos
de
interesse
Osautoresdeclaramnãohaverconflitosdeinteresse.
Agradecimentos
GlycogenstoragediseasetypeI 579
multidisciplinardaclínicadeErrosInatosdoMetabolismodo Servic¸odeGenéticaMédicadoHCPA,aosservic¸osde Gas-troenterologiaeHepatologiadoHCPAedaPUC,aoSIEMe àAnaCarolinaMonteiro,porajudá-los nesteartigoe com odiagnósticoeatendimentodospacientes.Gostaríamosde agradecertambémao Dr.TerryDerkspelas oportunidades deaprendizado inestimáveise ao Dr.David Weinstein por suas diversas lic¸ões, que contribuíram direta ou indireta-menteparaesteestudoequeaindapodemsetornaraforc¸a motrizparaumgrupodepesquisamulticêntrica.
Referências
1.KoeberlDD,KishnaniPS,BaliD,ChenYT.Emergingtherapies forglycogenstoragediseasetypeI.TrendsEndocrinolMetab. 2009;20:252---8.
2.AnnabiB,HiraiwaH,MansfieldBC,LeiKJ,UbagaiT, Polymero-poulosMH,etal.Thegeneforglycogen-storagediseasetype1b mapstochromosome11q23.AmJHumGenet.1998;62:400---5. 3.FroissartR,PiraudM,BoudjemlineAM,Vianey-SabanC,Petit
F, Hubert-Buron A, et al. Glucose-6-phosphatase deficiency. OrphanetJRareDis.2011;6:27.
4.YamaguchiT,IharaK,MatsumotoT,TsutsumiY,NomuraA,Ohga S,et al. Inflammatorybowel disease-like colitis in glycogen storagediseasetype1b.InflammBowelDis.2001;7:128---32. 5.RakeJP,VisserG,LabruneP,LeonardJV,UllrichK,SmitGP,etal.
GuidelinesformanagementofglycogenstoragediseasetypeI --- EuropeanStudyonGlycogenStorageDiseaseTypeI(ESGSDI). EurJPediatr.2002;161:S112---9.
6.WeinsteinDA,WolfsdorfJI.Effectofcontinuousglucose the-rapy with uncooked cornstarch on the long-term clinical course of type 1a glycogen storage disease. Eur J Pediatr. 2002;161:S35---9.
7.Gö˘güs¸S, Koc¸ak N, Ciliv G, Karabulut E, Akc¸ören Z, Kale G, etal.Histologic featuresoftheliverintypeIaglycogen sto-ragedisease:comparativestudybetweendifferentagegroups andconsecutivebiopsies.PediatrDevPathol.2002;5:299---304. 8.SociedadeBrasileirade Pediatria(SBP).Avaliac¸ãonutricional dacrianc¸aedoadolescente:manualdeorientac¸ão.SãoPaulo: DepartamentoCientíficodeNutrologia.SociedadeBrasileirade Pediatria;2009.
9.DhingraB,SharmaS,MishraD,KumariR,PandeyRM,Aggarwal S.Normalvaluesofliverandspleensizebyultrasonographyin Indianchildren.IndianPediatr.2010;47:487---92.
10.DerksTG,MartensDH,SentnerCP,vanRijnM,deBoerF,Smit GP,etal.DietarytreatmentofglycogenstoragediseasetypeIa:
uncookedcornstarchand/orcontinuousnocturnalgastric drip--feeding?MolGenetMetab.2013;109:1---2.
11.ShiehJJ,PanCJ,MansfieldBC,ChouJY.Aglucose-6-phosphate hydrolase,widelyexpressedoutsidetheliver,canexplain age--dependent resolution of hypoglycemia in glycogen storage diseasetypeIa.JBiolChem.2003;278:47098---103.
12.ShiehJJ,LuYH,HuangSW,HuangYH,SunCH,ChiouHJ,etal. Misdiagnosisassteatohepatitisinafamilywithmildglycogen storagediseasetype1a.Gene.2012;509:154---7.
13.OvchinskyN,MoreiraRK,LefkowitchJH,LavineJE.Liverbiopsy inmodernclinicalpractice:apediatricpoint-of-view.AdvAnat Pathol.2012;19:250---62.
14.deC,ReisF,CaldasHC,NoratoDY,SchwartzIV, GiuglianiR, BurinMG,etal.GlycogenstoragediseasetypeIa:molecular studyinBrazilianpatients.JHumGenet.2001;46:146---9. 15.Freedman DS. Determination of body size measures and
blood pressure levels among children. J Pediatr (Rio J). 2013;89:211---4.
16.Moses SW. Pathophysiology and dietary treatment of the glycogen storage diseases. J Pediatr Gastroenterol Nutr. 1990;11:155---74.
17.MosesSW.Historicalhighlightsandunsolvedproblemsin glyco-genstoragediseasetype1.EurJPediatr.2002;161:S2---9. 18.MelisD,PivonelloR,ParentiG,DellaCasaR,SalernoM,Balivo
F,etal.Thegrowthhormone-insulin-likegrowthfactoraxisin glycogenstoragediseasetype1:evidenceofdifferentgrowth patternsandinsulin-likegrowthfactorlevelsinpatientswith glycogenstoragediseasetype1aand1b.JPediatr.2010;156, 663-670.e1.
19.ShahKK,O’DellSD.Effectofdietaryinterventionsinthe main-tenanceofnormoglycaemiainglycogenstorage diseasetype 1a:asystematicreviewandmeta-analysis.JHumNutrDiet. 2013;26:329---39.
20.CorreiaCE,BhattacharyaK,LeePJ,ShusterJJ,TheriaqueDW, ShankarMN,etal.Useofmodifiedcornstarchtherapytoextend fastinginglycogenstoragediseasetypesIaandIb.AmJClin Nutr.2008;88:1272---6.
21.BandsmaRH,SmitGP,KuipersF.Disturbedlipidmetabolismin glycogenstoragediseasetype1.EurJPediatr.2002;161:S65---9. 22.Lewiecki EM, Gordon CM, Baim S, Leonard MB, Bishop NJ, Bianchi ML, et al. International Society for Clinical Densi-tometry 2007 Adult and Pediatric Official Positions. Bone. 2008;43:1115---21.