Nota Técnica
*e-mail: ricardovilla@ufmt.br
CÂMARA DE VOLATILIZAÇÃO: UMA ALTERNATIVA PARA AVALIAÇÃO DA EFICIÊNCIA DE AMOSTRAGEM
DE α- E β-ENDOSSULFAM EM FASE GASOSA
João L. Freixo, Diego B. da Silva, Eliana F. G. de C. Dores e Ricardo D. Villa*
Departamento de Química, Universidade Federal de Mato Grosso, Cuiabá – MT, Brasil
Recebido em 19/9/12; aceito em 5/3/13; publicado na web em 24/5/13
VOLATILIZATION CHAMBER: AN ALTERNATIVE FOR EVALUATING THE SAMPLING EFFICIENCY OF α- AND β-ENDOSULFAN IN THE GAS PHASE. The efficiency of XAD®-2 resin in sampling the pesticides α and β-endosulfan from air contaminated in the laboratory was evaluated. Sampling efficiency ranged from 87 to 108% for α-endosulfan and from 71 to 84% for β-endosulfan with relative standard deviation lower than 19%. The pesticides were not detected in the second section of the cartridge showing the good retention capacity of XAD®-2 for these analytes. Method quantification limits were 0.32 and 0.34 µg m-3 for α and β-endosulfan, respectively. These results suggest that the proposed method may be useful for evaluating occupational exposure to these compounds.
Keywords: XAD®-2; air pollution; organochlorine.
INTRODUÇÃO
O endossulfam é um agrotóxico organoclorado com propriedades inseticidas e acaricidas utilizado há mais de cinco décadas em várias partes do mundo com o objetivo de controlar diversos insetos e ácaros nas culturas de soja, trigo, legumes, frutas, nozes, café, tabaco, dentre outras.1-3 O produto técnico disponibilizado comercialmente corres-ponde a uma mistura contendo mais de 95% dos diastereoisômeros α-endossulfam e β-endossulfam (Figura 1), os quais estão presentes na proporção de 2:1 a 7:1, dependendo da marca comercial.1
O endossulfam pertence ao grupo dos compostos conhecidos como poluentes orgânicos persistentes (POPs), os quais são caracteri-zados pela elevada toxicidade, persistência no ambiente e capacidade de serem transportados pelos diversos compartimentos ambientais para regiões muito distantes do ponto de aplicação.1,2,4,5
Em função de sua elevada toxicidade, a exposição ao endossul-fam pode provocar diversos danos aos organismos vivos, tais como desordens físicas congênitas, deficiências mentais, intoxicações, infertilidade, dentre outros, podendo inclusive provocar a morte.2,4
Tendo em vista os efeitos deletérios associados à exposição ao en-dossulfam, seu uso foi banido em mais de 62 países2 e no ano de 2011 foi incluído no Anexo A da Convenção de Estocolmo sobre POPs.6 No caso particular do Brasil, terceiro maior consumidor mundial deste agrotóxico,7 a Agência Nacional de Vigilância Sanitária (ANVISA),8 por meio da RDC n° 28 de 09/08/2010, proibiu sua importação e
fabricação em todo território nacional a partir de 31 de julho de 2012, além de sua comercialização a partir de 31 de julho de 2013.
A característica semi-volátil do endossulfam, expressa pelos valores de pressão de vapor dos isômeros α e β (Figura 1), associada ao seu uso global e intenso, evidenciam a vulnerabilidade de conta-minação atmosférica por estes compostos.2,4 De uma maneira geral, estima-se que cerca de 30-50% da quantidade de agrotóxicos aplicada nas lavouras pode ser perdida para a atmosfera nas formas de vapor, adsorvidas em material particulado ou como aerossol.9
Os relatos da presença de agrotóxicos na atmosfera datam do final dos anos 50, ocasião em que o uso de organoclorados, tais como DDT, lindano e dieldrin era bastante intenso.10 Apesar dos primeiros trabalhos sobre contaminação atmosférica por agrotóxicos datarem de mais de meio século, a quantidade destes ainda é relativamente escassa em comparação àqueles envolvendo as matrizes água e solo. Alguns autores têm investigado a presença de agrotóxicos em amostras de ar coletadas em áreas rurais e urbanas, motivando a avaliação detalhada da contaminação atmosférica por estes compostos.11-14
A determinação dos agrotóxicos na atmosfera é precedida de duas principais etapas, sendo a primeira e mais crítica a amostragem, na qual geralmente se emprega um adsorvente sólido associado ou não a um filtro; e a segunda que consiste na extração dos agrotóxicos retidos nestes suportes. A capacidade de adsorção de vários grupos de compostos orgânicos presentes na atmosfera, aliada à possibilidade de diversas reutilizações após lavagem, tem feito da resina polimérica hidrofóbica de estireno divinilbenzeno (XAD®) a mais utilizada na etapa de amostragem.15,16
Para as matrizes sólidas como solo e sedimento, ou líquidas como a água, o procedimento mais utilizado para a validação dos métodos analíticos é o estudo de adição e recuperação utilizando amostras for-tificadas ou materiais de referência certificados, quando disponíveis.17 Devido às dificuldades para a manipulação de amostras gasosas, a validação de métodos para determinação de agrotóxicos em ar ainda não é uma prática sistemática e somente alguns estudos apresentam dados sobre parâmetros de validação.15 Destes, alguns avaliam a eficiência da extração dos analitos do adsorvente, pré-concentrados durante a amostragem,14,18-20 outros avaliam as possíveis perdas dos analitos retidos no adsorvente, passando ar pelo cartucho previamente fortificado com os padrões dos agrotóxicos.21,22 Embora haja uma preocupação em relação à eficiência da extração dos agrotóxicos
retidos no adsorvente, a otimização e a avaliação da eficiência de amostragem ainda requerem investigação.15
Neste contexto, o presente trabalho objetivou desenvolver e vali-dar um método para determinação dos agrotóxicos α-endossulfam e β-endossulfam na fase gasosa do ar utilizando a resina XAD®-2 como adsorvente na etapa de amostragem. A exatidão e precisão do método foram avaliadas por meio da amostragem dos analitos presentes em ar contaminado em laboratório.
PARTE EXPERIMENTAL
Solventes, padrões primários e adsorvente
Os padrões de α-endossulfam e β-endossulfam com pureza su-perior a 99% foram adquiridos da Analytical Standard. Como padrão interno foi utilizado heptacloro, com pureza superior a 99%, adquirido da Dr. Ehremstorfer. No preparo das soluções padrão foi utilizado tolueno (Mallinckrodt Ultimar) grau pesticida. Nos procedimentos de extração foi utilizada uma mistura na proporção 7:3 (v/v) dos solven-tes acetato de etila (Tedia) e n-hexano (Mallinckrodt Chemicals) grau pesticida. Toda vidraria foi previamente lavada com solução 1% (v/v) de Extran Alcalino MA – 01 (Merck) e posteriormente enxaguada com acetona P.A. (Quemis). Como adsorvente para amostragem dos analitos foi utilizada a resina XAD®-2 do fabricante Supelco.
Equipamentos
Na secagem das vidrarias não volumétricas foi utilizada uma estufa da marca Nevoni, modelo NV 1.4. Todas as pesagens foram feitas em balança analítica (precisão ± 0,0001 g) da marca Bel Mark, modelo 210 A. Micropipetas da marca Eppendorf de volumes fixo (50 µL) e ajustável (100 – 1000 µL) foram usadas no preparo das soluções padrão. Para amostragem dos agrotóxicos foram utilizadas bombas de sucção do fabricante SKC, modelo 224-PCXR8, cujas vazões foram previamente ajustadas com calibrador do mesmo fabricante. Durante a amostragem e determinação do perfil de volatilização dos analitos a câmara de volatilização foi mantida em banho termostatizado (Banho Maria – MA 146) do fabricante Marconi. Banho ultrassônico da marca Bransonica, modelo 3510R-MTH, que operou na frequência de 42 kHz (± 6%), foi utilizado na extração dos agrotóxicos. Os extratos contendo os agrotóxicos foram pré-concentrados em evaporador ro-tatório Büchi R-134 (80 rpm, 40 °C e 400 mBar) e levados até quase secura sob corrente de nitrogênio 5.0. Para quantificação dos agro-tóxicos foi utilizado um cromatógrafo do fabricante Agilent modelo 6890 acoplado a detector de captura de elétrons do mesmo fabricante.
Preparo das soluções padrão
Soluções estoques individuais, nas concentrações de 100 µg mL-1 foram preparadas a partir dos padrões primários dos agrotóxicos em estudo. A partir destas soluções foi preparada uma solução interme-diária mista na concentração de 10,0 µg mL-1, a qual foi empregada no preparo das soluções de trabalho nas concentrações de 1,0; 2,0; 3,0; 5,0; 6,0 e 9,0 µg mL-1. Estas últimas foram utilizadas para a ob-tenção das curvas analíticas e nos experimentos de volatilização dos agrotóxicos. Todas as soluções padrão foram preparadas em tolueno. Cada ponto da curva analítica continha o padrão interno heptacloro na concentração de 2,02 µg mL-1.
Condições cromatográficas
Na determinação dos agrotóxicos foi utilizada coluna capilar HP-5MS, 30 m x 0,25 mm x 0,25 µm, sob fluxo constante de 1 mL min-1
do gás de arraste hélio 6.0. A rampa de temperatura partiu de 92 °C (2,5 min), 15 °C min-1 até 175 °C (13 min) e 20 °C min-1 até 280 °C (2 min), resultando num tempo total de corrida de 28,28 min. A temperatura do injetor foi de 280 °C com injeção de 1 µL no modo splitless (t = 1,0 min). Para quantificação dos analitos foi utilizado heptacloro como padrão interno.
Avaliação dos parâmetros instrumentais
Para avaliar a sensibilidade e linearidade do detector foi constru-ída uma curva analítica a partir de injeções de soluções mistas dos padrões dos agrotóxicos no intervalo de concentração de 0,05 a 2,0 µg mL-1. Os limites de detecção (LD) e quantificação (LQ) instrumental foram estimados com base nos parâmetros da curva analítica, con-forme Ribani et al.17 A precisão instrumental foi avaliada por meio de três injeções sequenciais de uma solução mista dos padrões dos agrotóxicos na concentração de 0,50 µg mL-1.
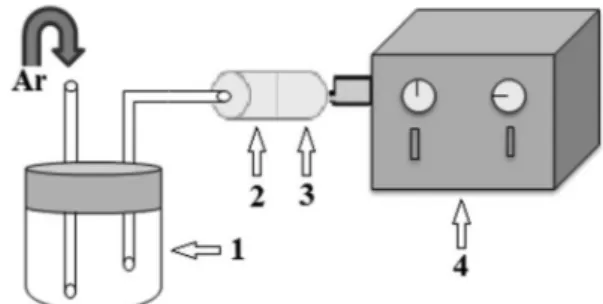
Aparato para simulação da contaminação atmosférica por agrotóxicos
O aparato utilizado consistiu de uma câmara de volatilização de vidro, medindo 9,0 cm de altura e 7,0 cm de diâmetro, um cartucho de polipropileno com 5,5 cm de comprimento e orifícios de entrada e saída medindo, respectivamente, 1,0 cm e 0,5 cm de diâmetro e uma bomba de sucção. Os cartuchos foram empacotados em laboratório com 80 mg da resina XAD®-2 na primeira seção e 40 mg na segunda, sendo cada seção separada por lã de vidro (Figura 2).
Após adição da solução dos agrotóxicos na câmara de vidro a bomba de sucção foi acionada, a uma vazão de 2,0 L min-1, contri-buindo para volatilização dos agrotóxicos. Para auxiliar o processo de volatilização, a câmara foi mantida em banho termostatizado a 35 °C. Os agrotóxicos seguiram o fluxo de ar em direção aos cartuchos de XAD®-2 onde ficaram retidos. O emprego da segunda seção do cartucho visa avaliar a possível ocorrência de “breakthrough”, isto é, passagem dos analitos de uma seção para outra, o que possibilita a identificação de falhas no processo de amostragem.
Após os experimentos o sistema foi desmontado e os agrotóxicos remanescentes na câmara de volatilização, bem como aqueles adsor-vidos na resina, foram extraídos e quantificados de modo a avaliar a eficiência de amostragem.
Extração dos agrotóxicos da câmara de volatilização
A extração dos agrotóxicos remanescentes na câmara após os ensaios de volatilização foi feita com três porções de 2,0 mL de uma solução extratora composta pela mistura hexano:acetato de etila 7:3 (v/v).
Os extratos obtidos foram transferidos para balões tipo pêra e concentrados em rota evaporador (40º C, 300 mbar) até um volume aproximado de 300 µL. Em seguida, com auxílio de pipeta Pasteur, este volume foi transferido para insert de vidro com capacidade de 400 µL e concentrado a quase secura sob corrente de nitrogênio. O extrato foi retomado com 300 µL de solução de padrão interno, heptacloro, na concentração de 2,02 µg mL-1. As amostras foram devidamente armaze-nadas a 4° C para posterior análise por cromatografia em fase gasosa. A exatidão da extração dos agrotóxicos da câmara foi avaliada pelo método de adição e recuperação. Para isso, foram adicionadas em triplicata diferentes massas de agrotóxicos na câmara de volatilização, 100, 200, 300, 600, 900 e 1000 ng, as quais foram extraídas por meio da lavagem com a solução extratora hexano:acetato de etila 7:3 (v/v).
Extração dos agrotóxicos adsorvidos na XAD®-2.
A extração dos agrotóxicos retidos na XAD®-2 foi feita com base no método proposto por Santos et al..23 Em resumo, a XAD® -2, proveniente dos cartuchos de amostragem, foi transferida para tubos de ensaio de vidro, com 100 mm de comprimento e 18 mm de diâmetro, e submetida a três extrações líquido-sólido sequenciais. Cada extração utilizou 2,0 mL da solução extratora hexano: acetato de etila 7:3 (v:v) e foi assistida por ultrassom (42 kHz) durante 15 minutos. Após as extrações os extratos obtidos foram tratados da mesma forma que os provenientes da câmara de volatilização, cujo procedimento foi descrito anteriormente.
Determinação do perfil de volatilização dos agrotóxicos em estudo
A fim de definir o tempo de amostragem em laboratório, fo-ram feitos ensaios para determinar o perfil de volatilização do α e β-endossulfam. Para isso, 100 µL de uma solução 10,0 µg mL-1 destes compostos em tolueno foram adicionados à câmara de volatilização, mantida em banho termostatizado a 35° C. Os experimentos tiveram início com o acionamento da bomba de sucção que operou a uma vazão de 2,0 L min-1. O parâmetro avaliado nestes ensaios foi a taxa de volatilização dos agrotóxicos em diferentes intervalos de tempo: 1, 2, 4 e 6 horas. Após cada experimento, os analitos remanescentes na câmara foram extraídos e quantificados.
Avaliação da eficiência de amostragem da XAD®-2
A eficiência da amostragem foi avaliada com base na razão percentual da massa dos analitos retidos na XAD®-2 e volatilizada na câmara. Nestes ensaios foram adicionadas à câmara as seguintes massas dos analitos: 300, 500 e 1000 ng. Para cada massa os ensaios foram feitos em quadruplicatas. As condições experimentais utilizadas foram as mesmas do estudo do perfil de volatilização, com tempo de amostragem de 6 horas. Após cada experimento os agrotóxicos retidos na XAD®-2 e aqueles eventualmente remanescentes na câmara de volatilização foram extraídos e quantificados. Os limites de detecção (LDM) e quantificação do método (LQM) foram calculados conforme procedimento descrito por Thier e Zeumer.24 Ao contrário do LD e LQ instrumental, os referidos limites consideram não somente a capacidade do equipamento em detectar a quantidade do analito injetada, mas todas as etapas do processo analítico.25
RESULTADOS E DISCUSSÃO
Avaliação da resposta instrumental
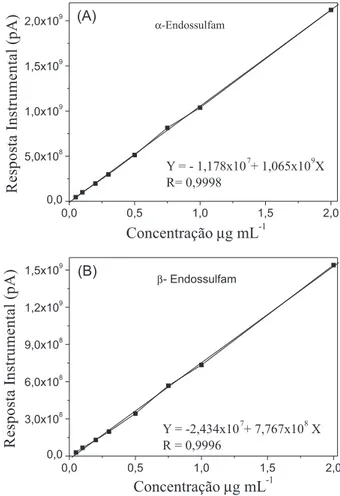
A resposta instrumental foi avaliada pela injeção de soluções
mistas dos padrões no intervalo de 0,050 a 2,0 µg mL-1 (Figura 3). Com base nos valores de r das retas ajustadas (r > 0,99) e no exame visual das curvas analíticas,26 a resposta instrumental em função da concentração dos analitos apresentou elevada correlação linear na faixa de trabalho utilizada.
O coeficiente angular (Figura 3) evidencia uma elevada sensi-bilidade instrumental aos analitos estudados. Uma avaliação visual dos cromatogramas permitiu verificar que o equipamento é capaz de discriminar incrementos de sinal analítico da ordem de 2x104 pA, o que torna possível identificar diferenças de concentrações da ordem de 25x10-6 µg L-1.
O coeficiente de variação das respostas instrumentais, provenien-tes de três injeções sequenciais do padrão dos agrotóxicos a 0,50 µg mL-1, ficou abaixo de 10%, indicando uma boa precisão instrumen-tal.27 Os valores de LD para o α-endossulfam e β-endossulfam foram de 0,020 e 0,030 µg mL-1, respectivamente. Nesta mesma ordem, os valores de LQ foram de 0,070 e 0,10 µg mL-1.
A menor massa recuperada nos experimentos de volatilização foi obtida na extração do α-endossulfam no ensaio em que foram adicionados à câmara de volatilização 0,10 µg deste agrotóxico e recuperados, por extração, cerca de 0,078 µg. Para as determinações cromatográficas, esta massa foi retomada em 300 µL da solução de padrão interno. Logo, a concentração do α-endossulfam nos extratos mais diluídos foi de 0,26 µg mL-1, ou seja, cerca de quatro vezes maior que o LQ deste agrotóxico, contribuindo assim para aumentar a exatidão das medidas. Resultado semelhante foi obtido para β-endossulfam onde a concentração do extrato mais diluído foi de 0,32 µg mL-1, ou seja, aproximadamente três vezes superior ao valor do seu LQ.
Avaliação do método de extração dos agrotóxicos da câmara de volatilização e da XAD®-2
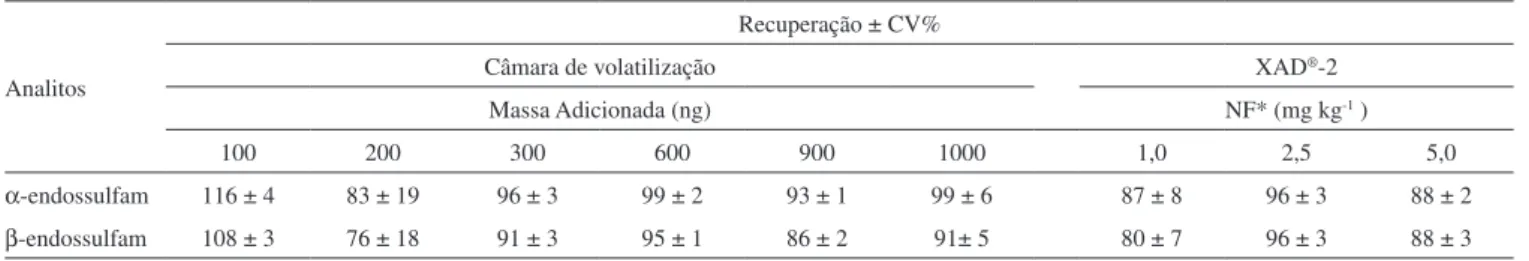
O método de extração dos agrotóxicos fortificados na resina XAD®-2 proporcionou recuperações entre 80 e 96%, com coeficien-tes de variação (CV) inferiores a 9% (Tabela 1). De acordo com a Association of Official Analytical Chemists (AOAC),26 são aceitáveis valores de recuperação entre 75-120% e 80-115% para os níveis de fortificação de 1 mg kg-1 e 10 mg kg-1, respectivamente. Quanto ao CV, os valores recomendados pelo mesmo órgão26 para os níveis de fortificação estudados, ou seja, 1,0, 2,5 e 5,0 mg kg-1, são inferiores a 13, 15 e 17%, respectivamente. Cabe destacar, no entanto, que o trabalho de Thier e Zeumer,24, que foca a determinação de agrotóxicos, elenca como aceitáveis recuperações na faixa de 70-120% com CV menor ou igual a 20%. Além disso, o próprio documento da AOAC26 remete ao fato de que o Departamento de Agricultura dos Estados Unidos (USDA) admite recuperações entre 50 e 150% nos seus estudos de proficiência sobre resíduos de agrotóxicos.
Nos ensaios para recuperação dos agrotóxicos adicionados na câmara de volatilização foram obtidas recuperações entre 76 e 116% e CV inferior a 20%, indicando também boa exatidão e precisão do método empregado (Tabela 1).
Avaliação do perfil de volatilização da α e β-endossulfam
Na avaliação do perfil de volatilização dos analitos foi observado que aproximadamente 65% da quantidade inicial adicionada à câmara volatilizaram nas duas primeiras horas (Figura 4). Após esse período a volatilização foi mais lenta, atingindo 85% para α-endossulfam e 100% para β-endossulfam após seis horas de experimento.
O isômero α-endossulfam apresentou uma taxa de volatilização maior que o β (Figura 4), fato este condizente com suas propriedades
físico-químicas, especialmente a maior pressão de vapor (0,4 mPa; 25 °C) quando comparada ao isômero β (0,08 mPa; 25 °C).28 Ademais, considerando que a maior parte do agrotóxico adicionado à câmara foi volatilizada em seis horas, este tempo, coincidente com o de duração da bateria utilizada na bomba de sucção, foi estabelecido para os experimentos de avaliação da eficiência de amostragem da XAD®-2.
Estes resultados são coerentes com os obtidos por Santos et al.,23 que monitoraram a presença de agrotóxicos em amostras de ar coletadas em diferentes localidades do município de Lucas do Rio Verde/MT. Estes pesquisadores observaram que a presença do isô-mero α-endossulfam no ar foi mais frequente que do β-endossulfam.
Avaliação da eficiência da amostragem dos agrotóxicos com a XAD®-2
A eficiência da amostragem foi avaliada em função do percentual de recuperação dos agrotóxicos volatilizados na câmara e retidos no cartucho de XAD®-2 (Tabela 2).
As porcentagens de recuperação dos agrotóxicos retidos nos cartuchos de XAD®-2 na etapa de amostragem variaram de 71 a 108%, com CV inferior a 19%. Com exceção das recuperações para β-endossulfam nos níveis de fortificação 4,0 e 8,7 mg kg-1, bem como do CV da α-endossulfam no nível de fortificação 2,9 mg kg-1, os demais resultados ficaram dentro da faixa de aceitação recomendada pela AOAC.26 Contudo, conforme já destacado, também são aceitas recuperações na faixa de 70-120%, com CV igual ou menor que 20%,24 ou ainda recuperações entre 50-150%.26 Sendo assim, os re-sultados obtidos indicaram uma boa capacidade da resina XAD®-2 em reter os agrotóxicos estudados, bem como a viabilidade do emprego da câmara de volatilização na validação do método proposto. Cabe ainda ressaltar que não foram detectados resíduos dos agrotóxicos na segunda seção dos cartuchos de XAD®-2, evidenciando a ausência do efeito “breakthrough” e, consequentemente, a inexistência de perdas significativas durante a amostragem.
Limites de detecção e quantificação do método de amostragem
Na estimativa do LDM e LQM foi considerado como base de Tabela 1. Recuperação dos agrotóxicos aplicados na câmara de volatilização e na resina de XAD®-2
Analitos
Recuperação ± CV%
Câmara de volatilização XAD®-2
Massa Adicionada (ng) NF* (mg kg-1 )
100 200 300 600 900 1000 1,0 2,5 5,0
α-endossulfam 116 ± 4 83 ± 19 96 ± 3 99 ± 2 93 ± 1 99 ± 6 87 ± 8 96 ± 3 88 ± 2 β-endossulfam 108 ± 3 76 ± 18 91 ± 3 95 ± 1 86 ± 2 91± 5 80 ± 7 96 ± 3 88 ± 3 *Níveis de Fortificação.
Tabela 2. Avaliação da eficiência de amostragem da resina XAD®-2 Agrotóxico NF* (mg kg-1) MR (%)** CV (%)
α-endossulfam
10,2 87 8
4,7 99 12
2,9 108 18
β-endossulfam
8,7 74 11
4,0 71 4
3,1 84 9
*Nível de fortificação dos cartuchos com os analitos volatilizados a partir da câmara. **Média das recuperações.
Figura 4. Perfil de volatilização dos agrotóxicos a partir da câmara de vo-latilização. Condições experimentais: massa adicionada 1,0 µg, vazão 2,0 L
cálculo o volume total de ar que atravessou o cartucho no tempo de amostragem de seis horas, ou seja, 0,72 m3.
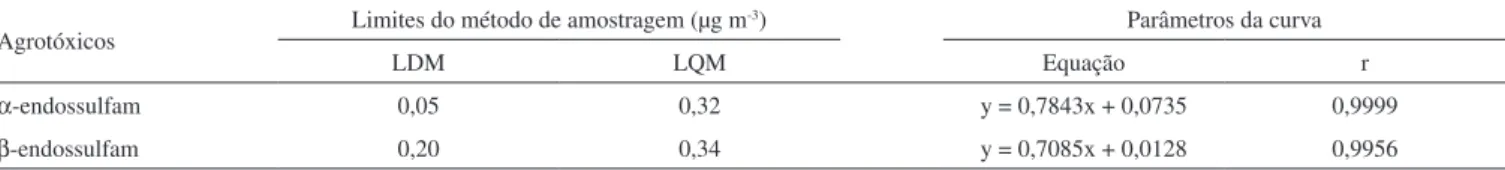
De acordo com o método proposto por Thier e Zeumer,24 o LDM é calculado com base nos resultados para o menor nível de fortifi-cação, ou seja, o desvio padrão combinado e o valor da variável t de Student unilateral para 95% de confiança. Além disso, considera também o coeficiente angular da reta ajustada obtida em função das diferentes massas dos agrotóxicos adicionadas e recuperadas. O LQM corresponde ao menor nível de fortificação estudado que atenda si-multaneamente aos seguintes requisitos: recuperação maior ou igual a 70%, CV menor ou igual a 20% e LQM maior ou igual ao LDM.
Sendo assim, para estimar o LDM (Tabela 3) foi traçada para cada agrotóxico uma curva relacionando a massa do composto adicionada no ar, por meio da câmara de volatilização, e aquela determinada nesta matriz pelo método de amostragem proposto. O LQM (Tabela 3) para cada analito foi calculado em função dos menores níveis de fortifi-cação avaliados (Tabela 2), os quais atenderam simultaneamente aos três requisitos citados anteriormente.
Nos experimentos de amostragem do presente trabalho foram empregadas bombas de baixo volume, as quais são preferencialmente indicadas em avaliações da atmosfera de ambientes fechados (indoor), como por exemplo, aquelas relativas à exposição ocupacional. Dada a escassez de trabalhos relacionados à determinação de α-endossulfam e β-endossulfam neste tipo de ambiente, os limites aqui estimados não puderam ser comparados com a literatura.
Trabalhos que determinaram estes agrotóxicos em ambientes abertos (outdoor)18,29-31 relatam concentrações da ordem de 49 a 5710 pg m-3, que são inferiores aos limites apresentados na Tabela 3.
Cabe destacar que o LDM e o LQM dependem tanto do volume de amostragem como da capacidade do cartucho reter os analitos, que dentre outros fatores, depende da massa de resina utilizada no empacotamento do mesmo. Scheyer et al.,32 por exemplo, ao em-pregarem volume de amostragem entre 240 – 360 m3 e cartuchos com 20 g de XAD®-2, obtiveram valores de LQM para diversos agrotóxicos, incluindo o α e β endossulfam, na faixa de 2,5 pg m-3 a 625 pg m-3 ou seja, valores bastante inferiores ao obtidos no presente trabalho.
CONCLUSÕES
Após os ensaios de volatilização com α-endossulfam e β-endossulfam empregando a câmara de volatilização, restou evi-denciado que este aparato é uma boa alternativa para contornar as dificuldades encontradas nos testes de adição e recuperação envol-vendo amostras gasosas. Os parâmetros instrumentais avaliados, bem como os métodos analíticos utilizados, atenderam aos protocolos de validação.
A resina XAD®-2 foi apropriada para amostragem do α-endossulfam e β-endossulfam presentes na atmosfera contamina-da em laboratório. Esta característica contamina-da resina associacontamina-da às pequenas dimensões e simplicidade do aparato de amostragem sugere que o método proposto possa ser útil para avaliar a exposição ocupacional a estes compostos, principalmente durante a aplicação, quando as concentrações são maiores comparadas ao período de pós-aplicação.
Outra aplicação que se vislumbra é a determinação dos agrotóxicos em ambientes indoor, como, por exemplo, nos depósitos dos agrotóxicos. Em que pese o fato da comercialização do endossulfam no Brasil ser extinta a partir de 31 de julho de 2013, seu uso em alguns países continuará ocorrendo, tendo em vista a resistência quanto ao seu banimento total, principalmente por questões econômicas, como no caso da Índia, maior produtor mundial deste agrotóxico.2 Sendo assim, o desenvolvimento de métodos precisos e exatos para determinação do endossulfam nos diferentes compartimentos ambientais é extrema-mente importante, em função da sua capacidade de ser transportado para regiões muito distantes do ponto de aplicação.
REFERÊNCIAS
1. Weber, J.; Halsall, C.J.; Muir, D.; Teixeira, C.; Small, J.; Solomon, K.; Hermanson, M.; Hung, H.; Bidleman, T.; Sci. Total Environ. 2010, 408,
2966.
2. EJF, End of the Road for Endosulfan: pushing for a global ban on a
deadly pesticide, Environmental Justice Foundation, London, UK, 2009.
3. http://extoxnet.orst.edu/pips/endosulf.htm, acessada em Maio 2013. 4. Khan, K.H; Int. J. Biosci. 2012, 2, 9.
5. AMAP (2004) AMAP Assessment 2002: Persistent Organic Pollutants (POPs) in the Artic. Artic Montitoring and Assessment Programme (AMAP). Oslo, Norway.
6. h t t p : / / c h m . p o p s . i n t / C o nve n t i o n / P O P s R ev i ew C o m m i t t e e / Reviewedchemicals/tabid/781/Default.aspx, acessada em Maio 2013. 7.
http://www.brasil.gov.br/noticias/arquivos/2011/05/10/agrotoxico-endosulfan-sera- totalmente-banido-do-brasil-ate-2013, acessada em Maio 2013.
8. http://www.brasilsus.com.br/legislacoes/resolucoes/105067-28.html, acessada em Maio 2013.
9. Samsonov, Y.N.; Makarov, V.I.; Koutsenogil, K.P.; Pest. Sci. 1998, 52,
292.
10. Unsworth, J.B.; Wauchope, R.D.; Klein, A.W.; Dorn, E.; Zeeh, B.; Yeh, S.M.; Akerblom, M.; Racke, K.D.; Rubin, B.; Pure Appl. Chem. 1999, 71, 1359.
11. Herceg, R. S.; Krauthacker, B.; Bull. Environ. Contam. Toxicol. 2003, 71, 1034.
12. Motelay-Massei, A.; Harner, T.; Shoeib, M.; Diamond, M.; Stern, G.; Rosenberg, B.; Environ. Sci. Techno. 2005, 39, 5763.
13. White, L. M.; Ernst, W. R.; Julien, G.; Garron, C.; Leger, M.; Pest
Manage. Sci. 2006, 62, 126.
14. Batterman, S.A.; Chernyak, S.M.; Gouden, Y.; Matooane, M.; Naidoo, R.N.; Sci. TotalEnviron. 2008, 397, 119.
15. Yusà, V.; Coscollà, C.; Mellouki, W.; Pastor, A.; Guardia, M.; J.
Chromatogr. A 2009, 1216, 2972.
16. Kosikowska, M.; Biziuk, M.; Trend Anal. Chem. 2010, 29, 1064. 17. Ribani, M.; Bottoli, C. B. G.; Collins, C. H.; Jardim, I. C. S. F.; Melo,
L. F. C.; Quim.Nova 2004, 27, 771.
18. Alegria, H.; Bidleman, T.F.; Figueros, M.S. Environ. Pollut. 2006, 140,
483.
19. Aulagnier, F.; Poissant, L.; Brunet, D.; Beauvais, C.; Pilote, M.; Deblois, C.; Dassylva, N.; Sci. Total Environ. 2008, 394, 338.
20. Ferrari, F.; Trevisan, M.; Capri, E.; J. Environ. Qual. 2003, 32, 1623.
Tabela 3. Limites de detecção e quantificação do método de amostragem e parâmetros da curva obtida pela massa adicionada e recuperada na etapa de amostragem
Agrotóxicos Limites do método de amostragem (µg m
-3) Parâmetros da curva
LDM LQM Equação r
α-endossulfam 0,05 0,32 y = 0,7843x + 0,0735 0,9999
β-endossulfam 0,20 0,34 y = 0,7085x + 0,0128 0,9956
21. Baker, L.W.; Fitzell, D.L.; Seiber, J.N.; Parker, T.R.; Shibamoto, T.; Poore, M.W.; Longley, K.E.; Tomlin, R.P.; Propper, R.; Duncan, D.W.;
Environ. Sci. Techno. 1996, 30, 1365.
22. Borràs, E.; Sánchez, P.; Muñoz, A.; Tortajada-Genaro, L.A.; Anal. Chim. Acta 2011, 699, 57.
23. Santos, L.G.D.; Lourencetti, C.; Pinto, A.A.; Pignati, W.A.; Dores, E.F.G.C.; J.Environ. Sci. Health, Part B 2011, 46, 150.
24. Thier, H. P.; Zeumer, H.; Manual of pesticides residue analysis, 1st ed., Wiley-VHC: New York, 1987.
25. Brito, N.M.; Junior, A.O.P.; Polese, L.; RIBEIRO, M.L.; Pesticidas: Rev.
Ecotoxicol. eMeio Amb. 2003, 13, 129.
26. http://www.aoac.org/vmeth/SLV_Guidelines_Dietary%20Supplements. pdf, acessada em Maio 2013.
27. Wood, R.; Trend Anal. Chem. 1999, 18, 624.
28. http://www.syrres.com/what-we-do/databaseforms.aspx?id=386, acessada em Maio 2013 (α-endossulfam CAS 959-98-8 e β-endossulfam CAS 33213-65-9).
29. Yao, Y.; Tuduri, L.; Harner, T.; Blanchard, P.; Waite, D.; Poissant, L.; Murphy, C.; Belzer, W.; Aulagnier, F.; LI, Y.; Sverko, E.; Atmos.
Environ. 2006, 40, 4339.
30. Gouin, T.; Wania, F.; Ruepert, C.; Castilho, L. E.; Environ. Sci. Techno.
2008, 42, 6625.
31. Daly, G.; Lei, Y. D.; Texeira, C.; Muir, D. D. C. G.; Wania, F.; Environ.
Sci. Technol. 2007, 41, 6020.
32. Scheyer, A.; Morville, S.; Mirabel, P.; MILLET, M.; Atmos. Environ.