UNIVERSIDADE ESTADUAL PAULISTA - UNESP
CÂMPUS DE JABOTICABAL
ASPECTOS BIOLÓGICOS, MORFOMETRIA E TÉCNICA DE
CRIAÇÃO DE Abaris basistriata CHAUDOIR, 1873 E
Selenophorus seriatoporus PUTZEYS, 1878
(COLEOPTERA: CARABIDAE)
Crislany de Lima Barbosa Andrade
Engenheira Agrônoma
UNIVERSIDADE ESTADUAL PAULISTA - UNESP
CÂMPUS DE JABOTICABAL
ASPECTOS BIOLÓGICOS, MORFOMETRIA E TÉCNICA DE
CRIAÇÃO DE Abaris basistriata CHAUDOIR, 1873 E
Selenophorus seriatoporus PUTZEYS, 1878
(COLEOPTERA: CARABIDAE)
Crislany de Lima Barbosa Andrade
Orientador: Prof. Dr. Francisco Jorge Cividanes
Tese apresentada à Faculdade de Ciências Agrárias e Veterinárias – Unesp, Câmpus de Jaboticabal, como parte das exigências para a obtenção do título de Doutora em Agronomia (Entomologia Agrícola).
Andrade, Crislany de Lima Barbosa
A553a Aspectos biológicos, morfometria e técnica de criação de Abaris basistriata Chaudoir, 1873 e Selenophorus seriatoporus Putzeys, 1878 (Coleoptera: Carabidae) / Crislany de Lima Barbosa Andrade. - - Jaboticabal, 2014
xiv, 64f. ; 28 cm
Tese (Doutorado) – Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, 2014
Orientador: Francisco Jorge Cividanes
Banca Examinadora: Sérgio Ide, Amarildo Pasini, Raphael de Campos Castilho, Arlindo Leal Boiça Junior
Bibliografia
1. Carabidae. 2. Aspectos biológicos. 3. Morfometria. 4. Predador.
Titulo. II. Jaboticabal-Faculdade de Ciências Agrarias e Veterninárias.
CDU 631.95: 595.762
DADOS CURRICULARES DA AUTORA
CRISLANY DE LIMA BARBOSA ANDRADE – nasceu no dia 20 de
outubro de 1983, em Dourados, Estado de Mato Grosso do Sul. Em dezembro de 2008 formou-se em Engenharia Agronômica pela Universidade Estadual de Mato Grosso do Sul - UEMS, Unidade Universitária de Aquidauana. Iniciou suas atividades de pesquisa em Entomologia Agrícola em março de 2004, no Laboratório de Entomologia Agrícola da UEMS, Unidade Universitária de Aquidauana, desenvolvendo trabalho sobre biologia, ocorrência e comportamento de Liogenys fuscus Blanchard, 1850 (Coleoptera: Scarabaeidae), sob orientação do professor Dr. Sérgio Roberto Rodrigues. Em março de 2009 ingressou no Curso de Mestrado em Agronomia (Entomologia Agrícola) da Faculdade de Ciências Agrárias e Veterinárias – FCAV/UNESP, Câmpus de Jaboticabal, sob orientação do professor Dr. Francisco Jorge Cividanes. Durante o período de realização do Curso de Mestrado foi bolsista da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES, com a aprovação da dissertação intitulada
“Sem sonhos, a vida não tem brilho.
Sem metas, os sonhos não têm alicerces.
Sem prioridades, os sonhos não se tornam reais”
A Deus, pelo seu grande amor por mim...
Aos meus pais José Nunes Barbosa e Neuza Aparecida de Lima Barbosa
pelo carinho, amor, conselhos, palavras de incentivo, apoio e orações.
Aos meus irmãos Aldenir de Lima Barbosa, Eliel de Lima Barbosa,
Márcia de Lima Barbosa Silvino e Elaine de Lima Barbosa Bastos
pela amizade e companheirismo desses anos todos.
Dedico...
Ao meu esposo Daniel Júnior de Andrade pela força, carinho, amor e
incentivo para terminar mais essa etapa de minha vida.
AGRADECIMENTOS
A Deus, por ser meu refúgio e a minha fortaleza em todos os momentos de minha vida.
Ao Prof. Dr. Francisco Jorge Cividanes pela orientação, incentivo e por todos os seus ensinamentos que contribuíram para a minha vida profissional.
À Universidade Estadual Paulista (UNESP), Faculdade de Ciências Agrárias e Veterinárias, Câmpus de Jaboticabal, pela oportunidade de realização do Curso de Doutorado.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela concessão de bolsa de estudos.
À Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), pelo auxílio financeiro concendido (Processo nº 2012/11687-4).
Ao Prof. Dr. José Carlos Barbosa, do Departamento de Ciências Exatas da FCAV/UNESP, pela orientação nas análises estatísticas.
Aos professores do Programa de Pós-Graduação em Agronomia, área de concentração Entomologia Agrícola da FCAV/UNESP: Julio César Galli, Arlindo Leal Boiça Júnior, Gilberto José de Moraes, Nelson Wanderley Perioto e Ricardo Antonio Polanczyk, pelo aprendizado durante as disciplinas cursadas.
Aos funcionários do Departamento de Fitossanidade da FCAV/UNESP, Lígia D. T. Fiorezzi e Alex Antonio Ribeiro, pela amizade e ajuda concedida.
À Sidinéia Terezinha Soares de Matos e Patrícia Otsuji, estagiárias do Laboratório de Ecologia de Insetos da FCAV/UNESP, pelo inestimável auxílio na condução dos experimentos e também pela amizade.
Aos colegas do Laboratório de Ecologia de insetos: Laís da Conceição dos Santos, Tatiana de Oliveira Ramos, Alessandra Karina Otuka, Ivan Carlos Fernandes Martins, Robson José da Silva, Ezequias Teófilo Correia, Danilo Henrique da Matta e Mariana Nardin Batista.
SUMÁRIO
Página
Lista de Figuras... ix
Lista de Tabelas... xi
RESUMO... ABSTRACT…... 1 2 1. INTRODUÇÃO... 2. REVISÃO DE LITERATURA... 2.1 Aspectos gerais da família Carabidae... 3 5 5 2.2 Aspectos ecológicos de Carabidae... 7
2.3 Hábitos alimentares de Carabidae... 8
2.4 Controle biológico... 10
2.5 Aspectos morfológicos de Carabidae... 13
3. MATERIAL E MÉTODOS... 15
3.1 Manutenção de adultos e obtenção de ovos... 15
3.2 Criação de Tenebrio molitor... 17
3.3 Experimento preliminar para determinar a umidade a ser utilizada nos substratos para criação das larvas dos carabídeos... 17
3.4 Ciclo biológico completo de Abaris basistriata e Selenophorus seriatoporus em diferentes substratos de criação... 19
3.5 Preferência de oviposição em teste com chance de escolha... 21
3.6 Profundidade de postura no solo de A. basistriata e S. seriatoporus... 23
3.7 Preferência alimentar e consumo de T. molitor... 24
3.8 Estudos morfométricos e aspectos morfológicos de carabídeos... 25
4. RESULTADOS E DISCUSSÃO... 26
4.1 Experimento preliminar para determinar a umidade a ser utilizada nos substratos para criação das larvas dos carabídeos... 26
4.2 Ciclo biológico completo de A. basistriata e S. seriatoporus em diferentes substratos de criação... 28
4.3 Preferência de oviposição em teste com chance de escolha... 39
4.5 Preferência alimentar e capacidade de consumo de T. molitor... 43
4.6 Morfometria e aspectos morfológicos de carabídeos... 45
5. CONCLUSÕES... 56
LISTA DE FIGURAS
Página
1 Vista superior do recipiente dividido por silicone em duas partes, uma contendo substrato solo e a outra com papel e algodão, utilizados na criação de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)... 16 2 Recipientes plásticos com guardanapo de papel (A), vermiculita fina (B)
e solo (C) utilizados para criação das larvas de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)... 21 3 Vista superior do recipiente utilizado na avaliação de preferência de
oviposição de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)... 22 4 Recipiente revestido lateralmente com plástico preto e fechados na
parte superior com tecido “voile” utilizado na avaliação em diferentes profundidades a oviposição de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e
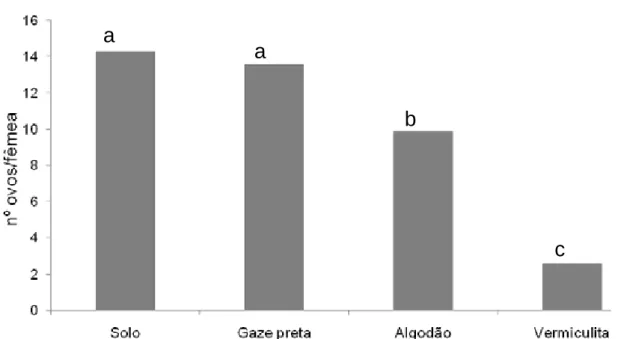
Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)... 24 5 Preferência de oviposição por adultos de Abaris basistriata Chaudoir,
1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) em diferentes substratos no período de quatro semanas... 40 6 Preferência de oviposição por adultos de Selenophorus seriatoporus
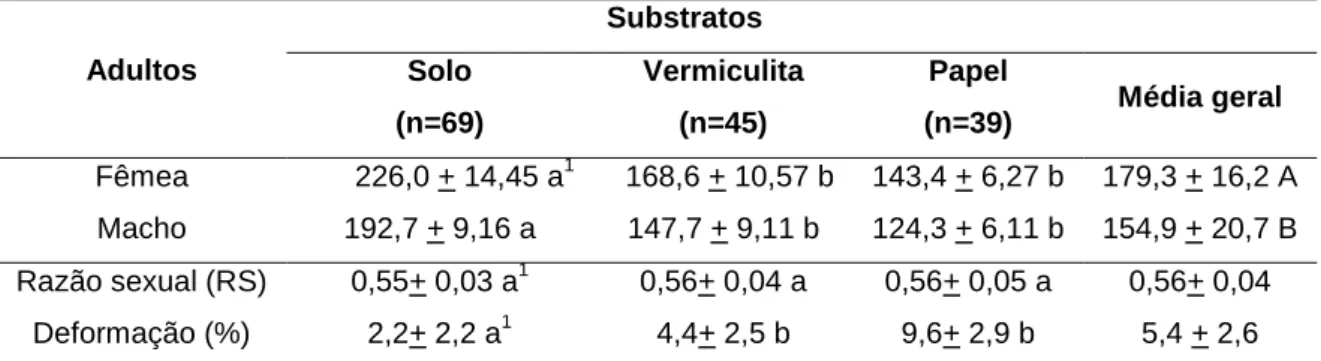
Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini) em diferentes substratos no período de quatro semanas... 41 7 Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae:
8 Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae:
Harpalinae: Pterostichini): Pupa (A) e adultos (B)... 50 9 Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera:
Carabidae: Harpalinae: Harpalini): Ovo (A), larva de primeiro instar (B), larva de segundo instar (C) e larva de terceiro instar (D)... 54 10 Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera:
LISTA DE TABELAS
Página
1 Sobrevivência das larvas (% + EP) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e
Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini) em
diferentes substratos e umidades após 20 dias da eclosão larval... 27 2 Duração média (dias + EP) do desenvolvimento de diferentes fases e do
ciclo biológico (ovo-adulto) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini)... 29 3 Duração média (dias + EP) do desenvolvimento de diferentes fases e do
ciclo biológico (ovo-adulto) de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini)... 30 4 Viabilidade (média + EP) das fases de desenvolvimento e do ciclo
biológico (ovo-adulto) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini)... 31 5
6
7
8
9
Viabilidade (média + EP) das fases de desenvolvimento e do ciclo biológico (ovo-adulto) de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini)... Longevidade média (dias + EP) de fêmeas e machos, razão sexual e deformação de adultos de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini)... Longevidade média (dias + EP) de fêmeas e machos, razão sexual e deformação de adultos de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini)... Duração média (dias + EP) dos períodos de pré-oviposição, oviposição e pós-oviposição de fêmeas de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini)... Duração média (dias + EP) dos períodos de pré-oviposição, oviposição, pós-oviposição de fêmeas de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini)...
31
34
35
36
10
11
12
Fecundidade, número de larvas eclodidas e viabilidade de ovos (média+ EP) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) pertencente à geração F1... Fecundidade, número de larvas eclodidas e viabilidade de ovos (média+ EP) de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini) pertencente à geração F1... Número de ovos (média + EP) por fêmea de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e
Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini) em
diferentes gradientes de profundidades do solo... 37 38 43 13 14 15 16
Consumo diário e total (média + EP) de larvas de Tenebrio molitor Linnaeus, 1758 (Coleoptera: Tenebrionidae: Tenebrioninae: Tenebrionini) de 3mm por larvas de diferentes instares de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e
Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)...
Consumo diário (média + EP) de larvas de Tenebrio molitor Linnaeus, 1758 (Coleoptera: Tenebrionidae: Tenebrioninae: Tenebrionini) de 5mm por fêmeas e machos de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus
seriatoporus Putzeys, 1878 (Harpalinae: Harpalini)...
Dimensões (média + EP) de estruturas corporais (mm) dos três instares larvais e de fêmea e macho de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini)... Dimensões (média + EP) de estruturas corporais (mm) dos três instares larvais e de fêmea e macho de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini)...
45
45
47
ASPECTOS BIOLÓGICOS, MORFOMETRIA E TÉCNICA DE CRIAÇÃO DE Abaris
basistriata CHAUDOIR, 1873 E Selenophorus seriatoporus PUTZEYS, 1878
(COLEOPTERA:CARABIDAE)
RESUMO – Os carabídeos (Coleoptera: Carabidae) são reconhecidos
mundialmente como importantes agentes de controle biológico de pragas agrícolas. Os objetivos deste trabalho foram estudar os aspectos biológicos, morfometria e técnica de criação de Abaris basistriata Chaudoir, 1873 (Harpalinae: Pterostichini) e Selenophorus
seriatoporus Putzeys, 1878 (Harpalinae: Harpalini) utilizando como dieta larvas de Tenebrio molitor Linnaeus, 1758 (Coleoptera: Tenebrionidae: Tenebrioninae:
Tenebrionini). Os estudos foram conduzidos em câmara climatizada mantida a 26±1°C, 70±10% de umidade relativa e fotofase de 14h. Os recipientes para postura de ovos e criação de larvas, pupas e adultos foram preenchidos com os seguintes substratos esterilizados e umedecidos: (1) solo, (2) vermiculita fina e (3) guardanapo de papel. O ciclo biológico (ovo a adulto) de A. basistriata e S. seriatoporus apresentou diferença no período de duração nos substratos solo e papel. A viabilidade dos ovos e das larvas de primeiro e segundo instares foi similar nos três substratos estudados, enquanto o terceiro instar e a pupa apresentaram maior sobrevivência no solo quando comparado com a vermiculita e o papel. O substrato solo foi o mais favorável para a longevidade de
A. basistriata, sendo as fêmeas mais longevas que os machos, enquanto em S. seriatoporus esse parâmetro biológico foi similar. Abaris basistriata apresentou menor
período de pré-oviposição e maior período de oviposição e pós-oviposição no substrato solo. Também, a fecundidade e viabilidade de A. basistriata foram superiores quando criado em recipiente com solo em relação à vermiculita ou papel. As larvas de T. molitor foram adequadas para a criação de A. basistriata e S. seriatoporus em laboratório. A baixa umidade dos subtratos solo, vermiculita e papel diminuiram a sobrevivência das larvas dos carabídeos. O solo foi o substrato que proporcionou melhores condições para o ciclo biológico completo de A. basistriata e S. seriatoporus, enquanto a vermiculita e o papel foram substratos de fácil manuseio que possibilitaram a criação das larvas de 1º e 2º instares de A. basistriata e 1º instar de S. seriatoporus. As larvas recém-eclodidas de A. basistriata apresentaram duas manchas escuras na região frontal da cabeça e as de S. seriatoporus duas fileiras de microespinhos.
BIOLOGICAL ASPECTS, MORPHOMETRY AND REARING PROTOCOL OF Abaris
basistriata CHAUDOIR, 1873 AND Selenophorus seriatoporus
PUTZEYS, 1878 (COLEOPTERA: CARABIDAE)
ABSTRACT - The family Carabidae (Coleoptera) is recognized worldwide as containing important species of biological control agents of agricultural pests. Our aim was to study the biology, morphometrics and rearing protocol of Abaris basistriata Chaudoir, 1873 (Harpalinae: Pterostichini) and Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini) using Tenebrio molitor Linnaeus, 1758 (Coleoptera: Tenebrionidae: Tenebrioninae: Tenebrionini) larvae as the diet. The study was conducted in environmental chambers at 26±1°C, 70±10% relative humidity, under a photoperiod of 14:10h (L:D). Containers used to egg laying and rearing larvae, pupae, and adults, were filled with one of the following types of sterilized and moistened substrate: (1) soil, (2) fine vermiculite, or (3) paper napkins. The life cycle (egg to adult) of A. basistriata and S. seriatoporus showed differences in duration in soil and paper substrates. The viability of eggs and larvae of first and second instars was similar in the three substrates studied, while the third instar and pupae in the soil showed improved survival when compared with vermiculite and paper. The soil substrate was more favorable to the longevity of A. basistriata, and the females live longer than males, while in S. seriatoporus this biological parameter was similar. Abaris basistriata showed lower pre-oviposition period and higher oviposition and post-oviposition on soil. Also, fecundity and viability of A. basistriata were higher when created in the container with respect to the soil or vermiculite and paper. The T. molitor larvae were adequate to keep creating
A. basistriata and S. seriatoporus in the laboratory. The moisture conditions of subtrato
interfere in larval survival of carabid. The soil was the substrate that provided better conditions for the complete life cycle of A. basistriata and S. seriatoporus, however the vermiculite and paper were easy to handle substrates that made possible the creation of the 1st and 2nd instar larvae of A. basistriata and 1st instar of S. seriatoporus. The newly hatched larvae of A. basistriata presented two dark spots on the front of the head and S. seriatoporus two lines of microspines.
1. INTRODUÇÃO
O conhecimento das características biológicas e das técnicas de criação de insetos predadores em condições de laboratório permite a realização contínua de estudos, sem depender da sua ocorrência em campo (PARRA, 2002; LUNDGREN et al., 2005) e pode também proporcionar a introdução de indivíduos visando ao controle biológico (SYMONDSON et al., 2002). O aumento do número de insetos predadores por geração em laboratório pode ser alcançado a partir de pequeno número de adultos provenientes do campo (CHAMBERS, 1977), mas tal procedimento é viável somente se as condições de criação proporcionarem um ambiente adequado para o desenvolvimento dos insetos (GOULET, 1976; HUK; KÜHNE, 1999). A determinação dessas condições exige esforços que envolvem observações e testes que podem ser de difícil realização caso a espécie seja de ocorrência rara ou pouco estudada (GWIAZDOWSKI et al., 2011).
O desenvolvimento larval dos coleópteros (Insecta: Coleoptera) necessita de condições muito específicas, principalmente as relacionadas com a estrutura do substrato (PETERSEN, 1998). Segundo Lundgren et al. (2005), os substratos podem afetar a cutícula das larvas e/ou interferir na mudança de instar, e a consistência pode restringir a movimentação das larvas. Além disso, alguns substratos não retém água de forma adequada influenciando adversamente o desenvolvimento larval.
No Brasil, existem poucas informações sobre a biologia e técnicas de criação de espécies de carabídeos observadas em agroecossistemas. Também existem poucos relatos sobre a morfologia de larvas, pupas e adultos. Em outros países encontram-se disponíveis informações sobre espécies de carabídeos (BOUSQUET; LIEBHERR, 1994; HURKA; PAPOUSEK, 2002). Os estudos morfológicos e morfométricos de insetos permitem a correta identificação da espécie, sendo fundamentais para o sucesso de programas de controle biológico. Além disso, essas informações também servem de base para a criação de carabídeos e emprego desses besouros predadores em programas de controle biológico (PARRA, 2002). A morfologia e morfometria relacionam-se diretamente com a descrição de imaturos e adultos, cujas características são utilizadas na construção de chaves de identificação. Também estes estudos encontram aplicação na distinção de caracteres morfológicos ligados ao dimorfismo sexual e na influência da sazonalidade sobre a morfologia de uma espécie (FERREIRA et al., 2006).
No Brasil, Abaris basistriata Chaudoir, 1873 (Pterostichini) e Selenophorus
seriatoporus Putzeys, 1878 (Harpalini) caracterizam-se como espécies dominantes e
com ampla distribuição em agroecossistemas da região nordeste do estado de São Paulo (CIVIDANES et al., 2009). Em estudo sobre o efeito da dieta na fecundidade e viabilidade de carabídeos observou-se que larvas de Tenebrio molitor Linnaeus, 1758 (Coleoptera: Tenebrionidae: Tenebrioninae: Tenebrionini) foram favoráveis para a criação de A. basistriata e S. seriatoporus em laboratório (BARBOSA et al., 2012). Entretanto, não existem informações sobre o desenvolvimento do ciclo biológico completo desses carabídeos em laboratório.
A expansão e evolução dos programas de Manejo Integrado de Pragas têm exigido o refinamento das técnicas de criação de insetos, visando à implementação de novas tecnologias de controle de pragas, tais como o controle biológico com predadores e parasitoides (CÔNSOLI; PARRA, 1997).
2. REVISÃO DE LITERATURA
2.1 Aspectos gerais da família Carabidae
Os besouros da família Carabidae pertencem à subordem Adephaga (BALL; BOUSQUET, 2000), tendo distribuição mundial e constituindo uma das poucas famílias da classe Insecta que contém mais de 40.000 espécies descritas (LOVEI; SUNDERLAND, 1996), com pelo menos 5.000 espécies identificadas na região Neotropical (REICHARDT, 1977). Na América do Norte, Carabidae constitui a terceira maior família de Coleoptera, com mais de 2.600 espécies agrupadas em 189 gêneros (TRIPLEHORN; JOHNSON, 2005). No Brasil registram-se cerca de 203 gêneros e 1.132 espécies (COSTA et al., 1988). A fauna de carabídeos da região Neotropical é diversificada e não totalmente estudada, existindo poucas informações sobre a ecologia desses predadores (REICHARDT, 1977).
Apesar da maior diversidade de espécies ocorrer nas regiões tropicais (ERWIN, 1985), a maior parte do conhecimento existente sobre esses insetos predadores está relacionada com pesquisas desenvolvidas nas regiões temperadas do Hemisfério Norte (LOVEI; SUNDERLAND, 1996; KROMP, 1999).
São reconhecidos três principais grupos ecológicos na família Carabidae: os geófilos (ou mesófilos), os hidrófilos e os arborícolas. Os geófilos são encontrados em solo sem associação com a água; os hidrófilos ocorrendo em ambientes aquáticos e os arborícolas em ambiente que tenha plantas arbóreas (LAWRENCE; BRITTON, 1994).
Mais recentemente, Ball e Bousquet (2000) agruparam as espécies da família Carabidae em higrófilas, mesófilas e xerófilas. Como característica os higrófilos vivem em zonas ribeirinhas, pântanos e florestas pantanosas escuras e os mesófilos são encontrados em florestas úmidas ou prados, sem dependerem da presença de córregos ou rios. Por outro lado, os xerófilos são encontrados em florestas secas, campinas e em áreas desérticas.
podem ser encontrados estudos envolvendo espécies da família Carabidae, sendo
Calosoma granulatum Perty, 1830 (Carabinae: Carabini) a espécie mais estudada,
devido principalmente ao seu potencial como agente de controle biológico de pragas (PEGORARO; FOERSTER, 1988).
Os trabalhos sobre ocorrência e distribuição de carabídeos em áreas agrícolas também se direcionaram para C. granulatum. Pegoraro e Foerster (1988) realizaram estudos de abundância e distribuição de larvas e adultos da espécie na cultura da soja (Glycine max (L.) Merr.) (Fabaceae), enquanto Pasini e Foerster (1996) trabalharam com a dispersão do inseto e o efeito de inseticidas na cultura da soja.
Estudos realizados mais recentemente com predadores em várias culturas relataram a composição e a ocorrência de várias espécies de carabídeos. Cividanes e Barbosa (2001) avaliaram os efeitos do plantio direto e da consorciação soja-milho sobre inimigos naturais, relacionando os carabídeos Lebia concinna (Brullé, 1837) (Harpalinae: Lebiini) e Metius sp. (Pterostichini). A consorciação de culturas e o plantio direto podem influenciar a dinâmica populacional de insetos, aumentando ou diminuindo a densidade populacional de pragas e de inimigos naturais (CIVIDANES; YAMAMOTO, 2002). Em outro estudo, 24 espécies de carabídeos foram identificadas e tiveram sua ocorrência estudada em fragmentos florestais e área de hortaliças (CIVIDANES; SOUZA; SAKEMI, 2003).
Martins et al. (2009) observaram maior ocorrência de espécies de carabídeos no sistema de plantio direto quando comparado com convencional. Entre as espécies de carabídeos destacou-se A. basistriata por ter se caracterizado como dominante na cultura e fragmento florestal.
Cividanes et al. (2009) determinaram as espécies e a estrutura das comunidades de Carabidae em cinco áreas de fragmento florestal e cultura soja/milho ou pomar laranja (Citrus sp.) (Rutaceae). A maior diversidade ocorreu na transição entre fragmento florestal e área cultivada e as comunidades de carabídeos de fragmento florestal tiveram maior similaridade com a comunidade do pomar de laranja do que com a de cultura soja/milho.
Cividanes et al. (2010) estudaram a distribuição e a preferência de hábitat de Carabidae em fragmento de floresta e pomar de laranja, encontrando 91% de carabídeos em fragmento de floresta e 86% em pomar de laranja. As espécies dos carabídeos A. basistriata, Athrostictus sp. 1 (Harpalinae: Harpalini), Tetracha
brasiliensis (Kirby, 1818), Pseudabarys sp. 1 (Pterostichini), S. seriatoporus, Selenophorus sp.4 distinguiram-se como dominantes. Abaris basistriata teve
preferência pelo pomar de laranja e fragmento florestal, enquanto Athrostictus sp.1,
Pseudobarys sp., Selenophorus sp.4 e S. seriatoporus mostraram-se associados ao
pomar.
2.2 Aspectos ecológicos de Carabidae
O ciclo de vida para muitas espécies de carabídeos ainda não é totalmente conhecido. Algumas espécies hibernantes em regiões de clima temperado, o ciclo de ovo a adulto pode ter duração de até quatro anos (LOVEI; SUNDERLAND, 1996). No Brasil, constatou-se em laboratório que C. granulatum, alimentado com lagartas de
Anticarsia gemmatalis Hübner, 1818 (Lepidoptera: Noctuidae: Noctuinae: Noctuini)
completou o ciclo biológico de ovo a adulto em 22 dias (PEGORARO; FOERSTER, 1985).
Pterostichini desenvolveram cuidado parental, pois as fêmeas ovipositam no solo ou em troncos podres e permanecem no local até que as larvas eclodam e se tornem pigmentadas. A presença da fêmea junto aos ovos, aparentemente, tem por objetivo a proteção ao ataque de predadores (BALL; BOUSQUET, 2000).
Pasini e Foerster (1996) relataram que larvas de C. granulatum foram mais ativas durante o dia, enquanto adultos durante a noite, sendo os machos três vezes mais abundantes do que as fêmeas. Muitas espécies da família Carabidae, tanto as larvas como os adultos, possuem hábito noturno e durante o dia utilizam como abrigo pedras, tábuas, escombros e troncos (TRIPLEHORN; JOHNSON, 2005).
Sasakawa (2010) observou que os carabídeos Amara gigantea (Motschulsky, 1844) (Harpalinae: Zabrini), A. lucens Baliani, 1943 e A. macronota Solsky, 1875 copularam em plantas, sendo que as fêmeas se alimentaram de sementes e flores.
2.3 Hábitos alimentares de Carabidae
Quanto ao hábito alimentar, a maioria dos carabídeos é predadora. Ball e Bousquet (2000) relataram que os adultos de diversas espécies são geralmente polífagos, embora existam aquelas que apresentam alta especialização quanto ao hábito alimentar; entretanto algumas espécies apresentam hábitos fitofágicos ou até detritívoros (HURKA; JAROSIK, 2003; IKEDA, 2010). As espécies predadoras se alimentam principalmente de moluscos (Molusca: Gastropoda), oligoquetos (Annelida: Oligochaeta), aranhas (Arthropoda: Arachnida: Aranae) e outros pequenos artrópodes (Arthropoda), principalmente insetos, incluindo ovos e pupas desses organismos (LOVEI; SUNDERLAND, 1996; KROMP, 1999; HOLLAND; LUFF, 2000; YAMAZAKI; SUGIURA, 2006).
Vários estudos vem sendo realizados em relação aos hábitos alimentares de carabídeos. Bilde e Toft (1997) estudaram o consumo das espécies de pulgões (Insecta: Hemiptera: Aphididae) de cereais Metopolophium dirhodum (Walker, 1849) (Aphidinae: Macrosiphini), Sitobion avenae (Fabricius, 1775) (Macrosiphini) e
Rhopalosiphum padi (Linnaeus, 1758) (Aphidinae: Aphidini) em relação a outros tipos
Amara impuncticollis (Say, 1823) consome lagartas de Agrotis ipsilon (Hufnagel, 1766)
(Noctuini) e observaram que é um predador voraz dessa praga.
Mundy et al. (2000) observaram maior preferência de espécie Pterostichus
cupreus (Linnaeus, 1758) (Pterostichini) por pulgões, em relação a colêmbola
(Arthropoda: Entognatha: Collembola). Fawki e Toft (2005) estudaram a preferência alimentar de Amara similata (Gyllenhal, 1810), constatando que dietas à base de insetos adicionados à dieta de sementes favorecem o desenvolvimento. Sasakawa (2010) constatou que a mistura de dietas à base de sementes e larvas de T. molitor é essencial para o desenvolvimento larval de A. gigantea. Frank (2010) ofereceu pupas de Drosophila melanogaster Meigen, 1830 (Diptera: Drosophilidae: Drosophilinae: Drosophilini) e sementes de Poa pratensis L. (Poaceae) como alimentos alternativos para larvas de Poecilus chalcites (Say, 1823) (Pterostichini) e Anisodactylus ovularis (Casey, 1914) (Harpalini), observando uma redução do canibalismo em ambas as espécies.
Yamazaki e Sugiura (2006) estudaram a alimentação de adultos de Scarites
aterrimus Morawitz, 1863 e não observaram diferença na frequência da alimentação de
presas vivas e mortas constituídas de larvas de Phaenicia sericata (Meigen, 1826) (Diptera: Calliphoridae: Calliphorinae: Luciliini) e do tatuzinho Armadillidium vulgare (Latreille, 1804) (Arthropoda: Crustacea: Isopoda: Armadillidiidae), por essa espécie de carabídeo.
De acordo com Brandmayr (1990), os carabídeos que se alimentam de sementes são considerados mais especializados. Klimes e Saska (2010) afirmaram que devido a esta especialização os insetos granívoros são considerados inteiramente dependentes de sementes para seu desenvolvimento.
Jorgensen e Toft (1997b) observaram que sementes de Poa annua L. (Poaceae) apresentaram maior valor nutritivo quando comparada com a dieta à base do pulgão R.
padi ao Harpalus rufipes (DeGeer, 1774) (Harpalini).
Honek e Jarosik (2000) avaliaram a preferência alimentar de Harpalus affinis (Schrank, 1781) e H. distinguendus (Duftschmid, 1812) utilizando sementes de 28 espécies de plantas. As espécies apresentaram diferença no consumo em função da época em que o alimento foi oferecido, mas não ocorreu diferença na preferência com relação aos tipos de sementes. Sasakawa (2010) observou que fêmeas de A. gigantea,
A. lucens e A. macronota consumiram proporcionalmente mais sementes que machos.
Quanto ao efeito de diferentes dietas sobre aspectos reprodutivos, Wallin et al. (1992) estudaram três espécies de carabídeos, Bembidion lampros (Herbst, 1784) (Trechinae: Bembidiini), P. cupreus e Pterostichus melanarius (Illiger, 1798), observando que a dieta à base de pulgão favoreceu a fecundidade. Weseloh (1993) verificou que poucas fêmeas de Calosoma sycophanta (Linnaeus, 1758) colocaram ovos quando alimentadas com uva. Entretanto, verificou que fêmeas alimentadas com larvas da mariposa cigana, Lymantria dispar (Linnaeus, 1758) (Lepidoptera: Lymantriidae), colocaram maior quantidade de ovos.
Sasakawa (2007a) estudou o efeitos da dieta sobre a fecundidade e o desenvolvimento larval do carabídeo granívoro A. macronota. Saska (2008) estudou o efeito da dieta sob a fecundidade de três espécies de Carabidae, Amara aenea (DeGeer, 1774), A. familiaris (Duftschmid, 1812) e A. similata. Sasakawa (2009) estudou o efeito da dieta sobre a maturação sexual de machos, fecundidade de fêmeas e desenvolvimento larval de carabídeo granívoro Anisodactylus punctatipennis Morawitz, 1862.
2.4 Controle biológico
apresentam alta especialização quanto ao hábito alimentar: adultos de Carabus spp. (Carabini) alimentam-se de vermes e caracóis, Calosoma spp. de lagartas, Cychrini (Carabinae) de caracóis e de lesmas, enquanto que Notiophilus spp. (Nebriinae: Notiophilini) e Loricera spp. (Loricerinae) são predadores de colêmbolas.
Os carabídeos são citados como predadores de muitas pragas agrícolas, incluindo afídeos (Aphididae), larvas de insetos pertencentes a várias ordens, pupas, lesmas (Mollusca: Gastropoda) e mesmo sementes de plantas herbáceas, que geralmente são consideradas plantas daninhas (KROMP, 1999; HOLLAND; LUFF, 2000; CHOCOROSQUI; PASINI, 2000; SUENAGA; HAMAMURA, 2001; WYCKHUYS; ONEIL, 2006). Muitas espécies atuam no controle biológico natural de pragas em várias culturas, entre as quais se destacam Alabama argillacea (Hübner, 1823) (Noctuidae: Calpinae) em algodão (Gossypium spp.) (Malvaceae) (ALLEN, 1977; CHOCOROSQUI; PASINI, 2000), A. gemmatalis em soja (FULLER, 1988), Diatraea saccharalis (Fabricius, 1794) (Lepidoptera: Crambidae: Crambinae: Chiloini) em cana-de-açúcar (Saccharum
officinarum L.) (Poaceae) e sorgo (Sorghum bicolor (L.) Moench) (Poaceae) (FULLER;
REGAN, 1988), Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae) em repolho (Brassica oleracea var. capitata L.) (Brassicaceae) (SUENAGA; HAMAMURA, 2001) e Spodoptera frugiperda (J. E. Smith, 1797) (Noctuidae: Hadeninae) em milho (WYCKHUYS; ONEIL, 2006).
Kromp (1999) relatou que os carabídeos são reconhecidos por reduzirem populações de pulgões em plantios de cereais e de beterraba (Beta vulgaris L.) (Chenopodiaceae).
O carabídeo Pseudophonus pubescens Müller, 1776 (=Harpalus (Pseudophonus)
pubescens) (Harpalini), foi considerado uma das mais importantes espécies de inimigos
naturais, capaz de reduzir o número de pulgões Acyrthosiphon pisum (Harris, 1776) (Macrosiphini) na cultura do feijão (Phaseolus vulgaris L.) (Fabaceae) (SADEJ; NIETUPSKI, 2000).
Honek e Jarosik (2000) verificaram que a presença de várias espécies de carabídeos em culturas de trigo (Triticum spp.) (Poaceae), ervilha (Pisum sativum L.) (Fabaceae) e colza (Brassica napus L.) (Brassicaceae) coincidiram com a época em que essas culturas estavam com altas populações de pulgões.
Fitzgerald et al. (2001) observaram que os carabídeos Calathus fuscipes (Goeze, 1777) e P. melanarius alimentaram-se do pulgão do morango (Fragaria sp.) (Rosaceae)
Chaetosiphon fragaefolii (Cockerell, 1901) (Macrosiphini). Verificaram que C. fuscipes
tem taxa de consumo médio de 12 pulgões/dia, enquanto que para P. melanarius foi de 9 pulgões/dia. Relataram também que os indivíduos dessas espécies foram capazes de atingirem a parte área das plantas para se alimentarem dos pulgões.
Suenaga e Hamamura (2001), ao realizarem levantamentos populacionais de insetos em campos de repolho, verificaram que a maior ocorrência de espécies de carabídeos coincidiu com o pico populacional da P. xylostella. Os autores observaram que possivelmente os carabídeos apresentaram grande potencial de predação de lagartas, sendo considerados agentes de controle biológico eficientes para o controle de pragas na cultura do repolho.
Mckemey et al. (2001) relataram que P. melanarius consumiu lesmas presentes na cultura, indicando o carabídeo como importante agente de controle natural dessa praga. Por outro lado, depois de estudarem a preferência dos carabídeos Pterostichus
madidus (Fabricius, 1775) e Nebria brevicollis (Fabricius, 1792) (Nebriinae: Nebriini) por
Sasakawa (2010) estudou a predação de sementes por A. gigantea, A. lucens e
A. macronota e observou como esses carabídeos granívoros desempenham papel
importante como agentes de controle de plantas daninhas em agroecossistemas temperados.
No Brasil, Correa-Ferreira e Pollato (1989), estudando a biologia e o consumo de lagartas de A. gemmatalis pelo carabídeo Callida sp. (Lebiini), verificaram o consumo de 66 lagartas de segundo instar durante o período larval, enquanto que os adultos consumiram 48 lagartas pequenas. Todavia, Chocorosqui e Pasini (2000) não observaram diferença significativa na taxa de consumo de pupas de A. argillacea por machos e fêmeas de C. granulatum, que atingiu 1,5 e 1,7 pupas/dia, respectivamente, enquanto larvas do predador consumiram 1,8 pupas/dia. Cerantola et al. (2002) verificaram que adultos do carabídeo Feroniomorpha bradytoides (Fairmaire, 1884) (=
Feroniola bradytoides) (Pterostichini) consumiram por dia, respectivamente 8,7 e 10,8
lagartas de segundo e quarto instares de S. frugiperda.
2.5 Aspectos morfológicos de Carabidae
Os carabídeos são insetos holometábolos que normalmente depositam os ovos isoladamente no solo. As larvas são ativas e do tipo campodeiforme, com pernas e mandíbulas desenvolvidas e presença de urogonfos, apresentando geralmente três instares antes de pupar em uma câmara no interior do solo (LOVEI; SUNDERLAND, 1996). Além disso, as larvas caracterizam-se por serem bem ativas, apresentando hábito predatório, alojando-se em galerias no solo onde aguardam a presa para atacar (LOVEI; SUNDERLAND, 1996; TRIPLEHORN; JOHNSON, 2005).
pernas, que nos machos são mais largos, cuja função principal é facilitar a cópula (STURANI, 1962; RIDDICK; MILLS, 1994). A longevidade pode exceder o período de uma safra agrícola, mas existem espécies que podem viver por até quatro anos (REICHARDT, 1977; THIELE, 1977; LOVEI; SUNDERLAND, 1996).
Sobre características morfológicas de larva, pupa e adulto das espécies A.
basistriata e S. seriatoporus não existem relatos. Por outro lado, em outros países,
encontram-se disponíveis informações sobre espécies de carabídeos pertencentes às tribos citadas anteriormente. Por exemplo, Abaris bigenera Bates, 1882 foi a primeira espécie desse gênero a ter descrita a fase larval por Bousquet e Liebherr (1994), no México, enquanto Hurka e Papousek (2002) descreveram as características morfológicas dos três instares larvais de oito espécies de Harpalus Latreille, 1802, na República Tcheca. No Brasil, a maioria das informações sobre a morfologia e morfometria de carabídeos da região Neotropical foi mencionada por Reichardt, em 1967 e 1972, referindo-se às espécies das tribos Galeritini (Harpalinae) e Lebiini. Relatos disponíveis sobre descrição morfológica de estágios imaturos e adultos de carabídeos observados em agroecossistemas referem-se à C. granulatum (COLEN, 2004).
influência da sazonalidade sobre a morfologia de uma espécie (FERREIRA et al., 2006).
3. MATERIAL E MÉTODOS
O estudo foi conduzido na Universidade Estadual Paulista, Câmpus de Jaboticabal, SP, no Laboratório de Ecologia de Insetos e na área experimental da Fazenda de Ensino, Pesquisa e Produção, da Faculdade de Ciências Agrárias e Veterinárias (FCAV/UNESP). Em laboratório, os estudos ocorreram em câmara climatizada mantida a 26±1°C, 70±10% de umidade relativa e fotofase de 14h. Todo material utilizado na condução dos experimentos (solo, vermiculita fina, guardanapo de papel, gazes tingidas de preto, papel filtro e algodão) foram esterilizados em autoclave (121°C durante 30 minutos). A manutenção da umidade no interior dos recipientes foi obtida umedecendo-se os subtratos e o algodão com água deionizada. A confirmação das espécies de carabídeos foi feita pelo Dr. Sérgio Ide, do Instituto Biológico, São Paulo, SP e pelo Dr. George Ball, da Universidade de Alberta, Edmonton, Canadá.
Os adultos vivos de A. basistriata e S. seriatoporus foram obtidos por meio de visitas diárias em 20 trincheiras-armadilhas (CLARK et al., 1994), instaladas no solo de cultura de milho nos períodos chuvosos de 2011-2012 e 2012-2013. Cada armadilha foi constituída de chapa de calha galvanizada de 90 cm de comprimento e 10 cm de
largura, dobrada ao meio longitudinalmente em forma de “V”, que foi instalada com a
borda permanecendo ao nível da superfície do solo. As extremidades da chapa ficaram em contato com as bordas de copos plásticos vazios (14 x 8 cm) também instalado no solo. Também se capturou adultos manualmente na mesma área experimental que se encontravam as armadilhas instaladas.
3.1 Manutenção de adultos e obtenção de ovos
coletados no campo foram formados casais (n=30) de cada espécie e mantidos em recipientes plásticos transparentes do tipo gerbox (11 x 11 x 3,5 cm). A identificação de machos e fêmeas de A. basistriata e S. seriatoporus foi realizada observando-se os tarsos do primeiro par de pernas, que nos machos apresentam-se mais dilatados que nas fêmeas (RIDDICK; MILLS, 1994).
O recipiente contendo um casal foi dividido em duas partes por uma barreira de silicone de 1 cm de altura, sendo uma das partes preenchida com solo peneirado e a outra forrada com papel filtro. O solo utilizado foi coletado na camada (0-20 cm) de um Latossolo Vermelho eutrófico de textura argilosa (Embrapa, 1999), situado em área do Departamento de Fitossanidade da UNESP-Jaboticabal-SP. O solo serviu como local de oviposição; pedaços de borracha sintética de Etil Vinil Acetato (E.V.A.) preta funcionaram como abrigo para os adultos, enquanto alimento e água foram disponibilizados em papel filtro e chumaço de algodão, respectivamente (Figura 1). O solo e o algodão foram umedecidos a cada dois dias, com auxílio de pisseta.
Figura 1. Vista superior do recipiente dividido por silicone em duas partes, uma
contendo substrato solo e a outra com papel e algodão, utilizados na criação de Abaris
Diariamente, os casais foram alimentados com larvas de T. molitor “ad libitum” e
o solo dos recipientes peneirado (mesh 30) para se averiguar a presença de ovos dos carabídeos que receberam tratamento para desinfecção através de imersão em solução de sulfato de cobre (CuSO4) a 1%, durante dois minutos (ÁVILA et al., 2000). Após este tratamento, os ovos foram utilizados nos experimentos com A. basistriata e S.
seriatoporus.
3.2 Criação de Tenebrio molitor
A criação de T. molitor foi efetuada de acordo com metodologia relatada por Santos e Boiça Júnior (2002). A sala de criação ficou sob condições controladas de temperatura (26°C r 1°C), umidade relativa (70±10%) e fotofase (12 horas). Os adultos e larvas de T. molitor foram mantidos em bandejas plásticas de 24 cm de comprimento x 20 cm de largura x 15 cm de altura, contendo como substrato alimentar 400 g de farelo de trigo e 50 g de lêvedo de cerveja. O fundo dessas bandejas foi revestido com papel sulfite branco para a realização das posturas. A água foi fornecida através de potes plásticos de 100 mL com a extremidade superior voltada para baixo e vedada por
uma placa de Petri de 9 cm de diâmetro revestida por uma esponja de “nylon” de 2 cm
de espessura. Quinzenalmente, as folhas de papel contendo os ovos foram retiradas e transferidas para novas bandejas com alimento. O substrato alimentar também foi trocado quinzenalmente separando-se larvas, pupas e adultos, que foram mantidos em bandejas distintas.
A criação de T. molitor foi realizada separando-se larvas de tamanho médio de 3 mm para alimentação das larvas dos carabídeos, enquanto as larvas de 5 mm de T.
molitor foram utilizadas para alimentação dos adultos dos carabídeos. As pupas e os
adultos de T. molitor obtidos foram utilizados na manutenção da criação.
3.3 Experimento preliminar para determinar a umidade a ser utilizada nos
substratos para criação das larvas dos carabídeos
experimento com três diferentes umidades do solo (10%, 50% e 80%), para se determinar a umidade ideal para a criação das larvas dos carabídeos.
Assim, para verificar o desenvolvimento das larvas no substrato solo e desenvolver uma técnica de criação de fácil manuseio, além do solo também foram testados outros dois tipos de substratos (vermiculita fina Refratil® com granulometria de 1,00-2,00mm e guardanapo de papel Scott® com 80% celulose e 20% fibras secundárias) a 10%, 50% e 80% de umidade. Esses substratos foram selecionados considerando-se metodologia relatada por Lundgren et al. (2005).
A metodologia adotada para a determinação da Capacidade de Campo (CC) do solo baseou-se em Medina et al. (1998). Todo o solo do vaso foi saturado com água e, após total drenagem, mensurou-se a massa úmida do solo, com o auxílio de uma balança digital, com precisão de milésimo de grama, obtendo-se, assim, o peso real de água necessária para manter o solo na CC. Com base nesse peso, calculou-se a necessidade hídrica de cada tratamento para mantê-lo durante todo o desenvolvimento do experimento na CC preestabelecida. A quantidade de água necessária para o solo atingirem 10%, 50% e 80% de umidade foi de 50g, 250g e 400 g de água para cada kg de solo, respectivamente.
O método ultilizado para a determinação da porcentagem de umidade na vermiculita e papel foi atráves do peso do substrato (100g) em três diferentes quantidades de água. A quantidade de água utilizada para vermiculita foi de 30g, 150g e 240g, enquanto que para o papel foi 40g, 200g e 320g, para manter esses substratos a 10%, 50% e 80% de umidade.
Para a manutenção da umidade no interior do recipiente nos substratos estudados, diariamente os potes plásticos foram pesados para verificar se a umidade mantida era a mesma da preestabelecida. Quando o pote plástico não apresentava o peso padronizado, adicionava-se a quantidade de água necessária preestabelecida para o substrato.
dos ovos relatados no item 3.1 foram individualizadas nestes potes de criação para evitar o canibalismo, conforme observado em testes preliminares.
Diariamente foram oferecidas larvas de T. molitor “ad libitum” para alimentação
das larvas dos carabídeos e verificada a umidade dos substratos. A determinação da presença de larvas vivas dos carabídeos foi efetuada após 20 dias da individualização das larvas recém-eclodidas.
O delineamento estatístico adotado nos experimentos foi o inteiramente casualizado (DIC), enquanto o desenvolvimento larval em diferentes substratos e umidades utilizou-se esquema fatorial (3 x 3), sendo o fator A (três tipos de substratos) e o fator B (três umidades do substrato), com dez repetições por tratamento. Os dados foram submetidos à análise de variância pelo teste F e as médias comparadas pelo Teste de Tukey, a 5% de probabilidade. Antes de serem analisados estatisticamente os dados foram transformados em arco seno . Na apresentação dos dados foram usados valores não transformados.
3.4 Ciclo biológico completo de A. basistriata e S. seriatoporus em diferentes
substratos de criação
Neste experimento também fora utilizados solo, vermiculita fina e guardanapo de papel como substrato de criação. Inicialmente, os ovos das duas espécies dos carabídeos foram transferidos para placas de Petri (9 x 1,5 cm) contendo os três substratos, mantidos com 50% de umidade e observados diariamente para determinação da eclosão das larvas. Os parâmetros biológicos observados no período de incubação foram: duração e viabilidade.
Posteriormente, comparou-se a influência dos substratos no desenvolvimento das larvas dos carabídeos. As larvas de A. basistriata e S. seriatoporus foram criadas em potes plásticos transparentes de 140 mL, preenchidos com 3 cm de solo, vermiculita fina e guardanapo de papel e umedecidos, fechados na parte superior com tecido tipo
libitum”. Diariamente, os recipientes foram inspecionados para se determinar a
presença de exúvia e mortalidade larval, bem como verificar a umidade do substrato e renovar o alimento.
O início da fase pré-pupa foi considerado quando as larvas cessaram a alimentação e iniciaram a confecção da câmara pupal. As pupas foram mantidas nos mesmos potes de criação das larvas e evitou-se revolver o solo para não desfazer a câmara pupal. Diariamente, os recipientes foram inspecionados para registrar a mortalidade das pupas, bem como verificar a umidade.
Os parâmetros biológicos determinados nas fases larval e pupal foram: duração e viabilidade dos instares e dos períodos.
Após a emergência, os adultos permaneceram sem manuseio por 24 horas, permitindo a esclerotização do tegumento. Posteriormente foram separados por sexo formando-se um casal por recipientes plásticos do tipo gerbox (11 x 11 x 3,5 cm) com solo, vermiculita e guardanapo de papel (mantidos com 50% de umidade) que serviram como local de criação e oviposição. Os casais foram alimentados com larvas de tamanho médio de cerca de 5,0 mm de T. molitor “ad libitum”. Diariamente, os
recipientes foram vistoriados para se registrar o número de ovos, sendo esses ovos transferidos para placas de Petri (9 x 1,5 cm) contendo os três substratos, umedecidos e observados diariamente para determinação da eclosão das larvas pertencente à geração F1 de laboratório. Neste caso foram determinados os períodos de pré-oviposição, oviposição e pós-pré-oviposição, fecundidade e viabilidade. A deformação das asas, a longevidade de machos e fêmeas e a razão sexual foram obtidas considerando-se o total de adultos emergidos. A razão considerando-sexual foi calculada pela fórmula: RS= número de fêmeas/número de machos + fêmeas.
O delineamento estatístico foi o inteiramente casualizado (DIC), sendo três tratamentos (solo, vermiculita fina e guardanapo de papel), com dez repetições por tratamento.
em log (x + 5). Os dados expressos em porcentagem foram transformados em arco seno . Na apresentação dos dados foram usados valores não transformados.
Figura 2. Recipientes plásticos com guardanapo de papel (A), vermiculita fina (B) e solo
(C) utilizados para criação das larvas de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini).
3.5 Preferência de oviposição em teste com chance de escolha
Para auxiliar na determinação da técnica de criação e incrementar o conhecimento da biologia dessas espécies foram considerados dois experimentos.
O primeiro foi realizado com A. basistriata e o segundo com S. seriatoporus, obtidos da criação de manutenção dos carabídeos (item 3.1) pertencentes à geração F1, durante um período de quatro semanas. Bandejas plásticas de 21 cm de comprimento x 21 cm de largura x 7 cm de altura foram utilizadas como arenas, divididas em quatro áreas iguais, tendo cada área um recipiente plástico medindo 3 cm de diâmetro por 1,5 cm de altura, contendo no seu interior solo, vermiculita fina, algodão e gazes tingidas de preto, utilizados como substrato de oviposição. No ponto central da arena foi colocado um pedaço de borracha de Etil Vinil Acetato preta
(E.V.A.), para servir de abrigo para os carabídeos. No ponto central liberou-se uma fêmea e um macho para a escolha do substrato de oviposição (Figura 3).
Figura 3. Vista superior do recipiente utilizado na avaliação de preferência de
oviposição de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini).
A cada dois dias o alimento foi trocado, o substrato umedecido e os ovos contados. Os ovos foram retirados do substrato de oviposição da seguinte maneira: (i) lavando-se a gaze em água corrente sobre um tecido fino “voile”, onde ficavam retidos, (ii) para o algodão, a vermiculita e o solo foram necessários vistoriar cuidadosamente o substrato com auxílio de um pincel fino n°1 sob estereomicroscópio.
No primeiro e segundo experimento, o delineamento estatístico foi o inteiramente casualizado (DIC), com quatro tratamentos e 20 repetições. Os dados foram submetidos à análise de variância pelo teste F e as médias comparadas pelo Teste de
Vermiculita
Solo
Gaze preta
Tukey, a 5% de probabilidade. Antes de serem analisados estatisticamente os dados de número de ovos foram transformados em log (x + 1). Na apresentação dos dados foram usados valores não transformados.
3.6 Profundidade no solo das posturas de A. basistriata e S. seriatoporus
Para determinar a profundidade no solo das posturas foram formados 20 casais de cada espécie de carabídeo provenientes do campo, que foram mantidos em recipientes plásticos transparentes de 30 cm de altura x 10 cm de diâmetro, contendo 20 cm de solo, com base na metodologia relatada por Pasini (1995). Os recipientes foram revestidos lateralmente com plástico preto e fechados na parte superior com
tecido “voile”. A partir da superfície do solo delimitaram-se, nas laterais externas dos recipientes, as seguintes profundidades: (0 a 4 cm; 4 a 8 cm; 8 a 12 cm; 12 a 16 cm e 16 a 20 cm) (Figura 4).
Diariamente foram registrados os ovos localizados nas diferentes profundidades, durante 30 dias. Cada camada de solo de 4 cm foi vistoriada em bandejas plásticas e posteriormente devolvida ao recipiente do experimento. Os procedimentos para a alimentação dos adultos e manuseio de ovos estão descritos no item 3.1. O parâmetro biológico avaliado foi o número de ovos por fêmea.
Figura 4. Recipiente revestido lateralmente com plástico preto e fechados na parte
superior com tecido “voile” utilizado na avaliação em diferentes profundidades a oviposição de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini).
3.7 Preferência alimentar e capacidade de consumo de Tenebrio molitor
A preferência alimentar de A. basistriata e S. seriatoporus por larvas e /ou pupas de T. molitor foi determinada por meio de testes com chance de escolha, com base na metodologia proposta por Pasini (1995).
De acordo com resultados de testes preliminares, foram oferecidas diariamente quantidade de larvas de T. molitor considerada “ad libitum”, isto é, cinco larvas de 5mm de comprimento de T. molitor para os adultos de A. basistriata e dez larvas de mesmo comprimento para adultos de S. seriatoporus. Para as larvas de primeiro, segundo e terceiro instares de A. basistriata e S. seriatoporus foram oferecidas cinco larvas de 3mm de comprimento de T. molitor. Os recipientes utilizados nos experimentos com os adultos foram placas de Petri de 2,6 cm de altura por 14,5 cm de diâmetro, contendo
0 cm
4 cm
8 cm
12 cm
16 cm
1,0 cm de solo esterilizado. Enquanto que para as larvas foram utilizadas placas de Petri de 9,0 cm de diâmetro por 1,7 cm de altura, contendo 1,0 cm de solo esterilizado.
As larvas de T. molitor foram oferecidas aos adultos de carabídeos durante 15 dias, enquanto que para as larvas dos carabídeos o alimento foi oferecido desde o primeiro instar até o início da fase de pré-pupa. Diariamente, foi anotado o número de presas consumidas, com retirada de restos alimentares e reposição de alimento.
O delineamento experimental utilizado foi o inteiramente casualizado, com dois tratamentos representados pelas fêmeas e machos de A. basistriata e S. seriatoporus, com dez repetições de cada espécie por tratamento. Para as larvas de A. basistriata e
S. seriatoporus foram comparados o consumo entre os instares larvais, utilizando-se
larvas desses carabídeos de acordo com o número obtido em cada fase de desenvolvimento.
3.8 Estudos morfométricos e aspectos morfológicos de carabídeos
Para a realização dos estudos morfométricos de A. basistriata e S. seriatoporus, foram avaliados 10 indivíduos de cada espécie nos estágios de ovo, larva (incluindo os diferentes instares larvais), pupa e adulto (10 machos e 10 fêmeas). Para isso, as larvas e adultos foram mortos por resfriamento, submetidos à temperatura média de -6º C, durante 30 minutos antes de ser feito as medições. As descrições relativas aos aspectos de coloração foram feitas utilizando-se exemplares vivos.
As larvas também foram mensuradas o comprimento dos urogonfos. Além disso, foram realizadas mensurações da distância dorsal entre a margem anterior do pronoto e o ápice do abdômen das pupas (BOUSQUET; LIEBHERR, 1994; HURKA; PAPOUSEK, 2002; RICHARDSON, 2010).
Os dados das mensurações de A. basistriata e S. seriatoporus foram registrados e os valores médios calculados.
4. RESULTADOS E DISCUSSÃO
4.1 Experimento preliminar para determinar a umidade a ser utilizada nos
substratos para criação das larvas dos carabídeos
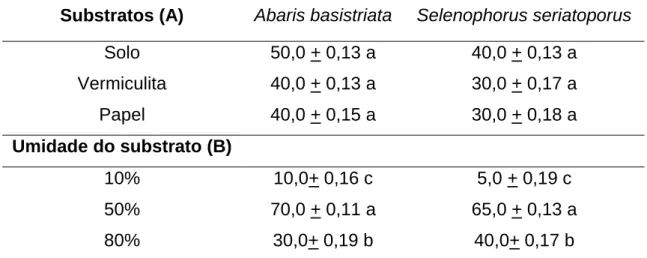
Os resultados mostraram que não houve diferença significativa entre os substratos avaliados quanto à sobrevivência de larvas de A. basistriata e S.
seriatoporus. Portanto, os três substratos avaliados podem ser utilizados em criações
de A. basistriata e S. seriatoporus (Tabela 1).
Por outro lado, a umidade do substrato foi um fator que influenciou significativamente a sobrevivência de larvas de A. basistriata e S. seriatoporus (Tabela 1). Independentemente do tipo de substrato empregado verificou-se que a umidade de 50% foi a mais favorável para a sobrevivência das larvas dos carabídeos.
Os resultados também evidenciaram que a quantidade de água nos substratos pode favorecer ou desfavorecer a sobrevivência de larvas de A. basistriata e S.
seriatoporus. O mesmo foi observado por Kirk (1975) para larvas do carabídeo P. chalcites que se mostraram sensíveis ao teor de umidade no substrato. A reduzida
(1992) e Lövei e Sunderland (1996), os quais vincularam para larvas tal fragilidade à fraca quitinização e mobilidade limitada das larvas.
Huk e Kühne (1999) relataram maior mortalidade de larvas de Carabus clathratus Linnaeus, 1761 criadas em substratos secos em comparação aos substratos úmidos. As espécies de carabídeos conhecidas habitam solos mais úmidos e com vegetação, raramente sendo encontrados em solos muito secos (LÖVEI; SUNDERLAND, 1996). De acordo com Honek e Matinková (1991), as espécies de carabídeos são reconhecidas por preferirem hábitats que lhes forneçam ótimas condições microclimáticas, como a temperatura, a umidade e a luz, sendo os fatores mais importantes a atuarem sobre esses insetos.
Esta avaliação inicial da sobrevivência de larvas de A. basistriata e S.
seriatoporus em função do tipo de substrato, bem como as condições de umidade
destes foi fundamental para dar prosseguimento ao estudo de biologia.
Tabela 1. Sobrevivência das larvas (% + EP) de Abaris basistriata Chaudoir, 1873
(Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini) e Selenophorus seriatoporus Putzeys, 1878 (Harpalinae: Harpalini) em diferentes substratos e umidades após 20 dias da eclosão larval.
Substratos (A) Abaris basistriata Selenophorus seriatoporus
Solo 50,0 + 0,13 a 40,0 + 0,13 a
Vermiculita 40,0 + 0,13 a 30,0 + 0,17 a
Papel 40,0 + 0,15 a 30,0 + 0,18 a
Umidade do substrato (B)
10% 10,0+ 0,16 c 5,0 + 0,19 c
50% 70,0 + 0,11 a 65,0 + 0,13 a
80% 30,0+ 0,19 b 40,0+ 0,17 b
1
Médias seguidas pela mesma letra na coluna não diferem significativamente pelo teste de Tukey (P ˃
4.2 Ciclo biológico completo de A. basistriata e S. seriatoporus em diferentes
substratos de criação
A duração do ciclo biológico de ovo a adulto de A. basistriata variou de 36,1 a 38,4 dias (Tabela 2). Enquanto na espécie S. seriatoporus variou de 43 a 52,2 dias, com diferença significativa entre os substratos (Tabela 3). Os ovos de A. basistriata mantidos em solo, vermiculita e guardanapo de papel apresentaram período embrionário de 6,0, 5,9 e 5,5 dias, respectivamente, os quais não diferiram significativamente entre si, o mesmo se verificando com a duração do período embrionário de S. seriatoporus (Tabela 3). Larvas de terceiro instar e pupas de A.
basistriata apresentaram desenvolvimento mais rápido no solo. Por outro lado, larvas de
terceiro instar e pupas de S. seriatoporus apresentaram desenvolvimento mais rápido no solo e na vermiculita. Larvas de primeiro e segundo instares apresentaram duração similar nos três substratos para as duas espécies de carabídeos.
Tabela 2. Duração média (dias + EP) do desenvolvimento de diferentes fases e do ciclo
biológico (ovo-adulto) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini).
Substratos Ovo
Instar
Larva Pupa Ciclo
biológico
1° 2° 3°
Solo
(n=120) 6,0+0,12a 1
4,5+0,12a 5,4+0,12a 13,1+0,35b 22,9+0,40b 6,0+0,10b 36,1+0,44b Vermiculita
(n=120) 5,9+0,11a 4,6+0,10a 5,5+0,13a 14,4+0,39a 24,3+0,43a 7,0+0,13a 37,3+0,87ab Papel
(n=120) 5,5+0,12a 4,8+0,11a 5,8+0,16a 15,1+0,33a 25,5+0,48a 7,3+0,17a 38,4+0,51a 1
Médias seguidas pela mesma letra na coluna não diferem significativamente pelo teste de Tukey (P ˃ 0,05).
n= número inicial de indivíduos avaliados por tratamento.
Nesse estudo foi determinado pela primeira vez a duração do ciclo biológico completo de uma espécie do gênero Abaris Dejean, 1831. No México, em estudo sobre a descrição larval de A. bigenera, Bousquet e Liebherr (1994) relataram a duração do primeiro e segundo instares da espécie, que foi um dia mais longo do verificado no presente estudo para os instares correspondentes de A. basistriata. No Brasil, as informações sobre o ciclo biológico de carabídeos são escassas, principalmente sobre a tribo Pterostichini que inclui o gênero Abaris (Will, 2002). Também nesse estudo foi determinado pela primeira vez a duração do ciclo biológico completo de uma espécie do gênero Selenophorus Dejean, 1831. O período de duração do ciclo biológico de A.
basistriata e S. seriatoporus nos três substratos estudados (Tabelas 2 e 3) foi maior do
Tabela 3. Duração média (dias + EP) do desenvolvimento de diferentes fases e do ciclo
biológico (ovo-adulto) de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini).
Substratos Ovo
Instar
Larva Pupa Ciclo
biológico
1° 2° 3°
Solo
(n=50) 7,0+0,34a 1
8,3+0,42a 8,1+0,33a 12,0+1,01b 28,4+1,56b 7,4+0,45b 43,0+2,39a Vermiculita
(n=50) 7,0+0,33a 8,6+0,44a 8,4+0,34a 14,0+1,09b 31,0+1,67b 7,6+0,47b 45,8+2,67b Papel
(n=50) 7,1+0,35a 8,8+0,46a 8,5+0,38a 20,4+1,20a 37,7+1,84a 8,5+0,55a 52,2+2,96c 1
Médias seguidas pela mesma letra na coluna não diferem significativamente pelo teste de Tukey (P ˃ 0,05). n= número inicial de indivíduos avaliados por tratamento.
Para estudos que visam determinar o período de duração do ciclo biológico de A.
basistriata e S. seriatoporus (Tabelas 2 e 3) a escolha do substrato adequado é
fundamental. Fatores intrínsecos dos substratos desempenham um papel importante no sucesso ou no fracasso do desenvolvimento destes carabídeos. Petersen (1998) destacou que o desenvolvimento larval de carabídeos necessita de condições muito específicas, principalmente as relacionadas com a estrutura do substrato. De acordo com Lundgren et al. (2005), os substratos mais abrasivos podem afetar a cutícula das larvas e/ou interferir na mudança de instar, e a consistência do substrato pode restringir a movimentação das larvas de carabídeos. Além disso, alguns substratos não retém água de forma adequada influenciando adversamente o desenvolvimento larval.
A viabilidade dos ovos e das larvas de primeiro e segundo instares de A.
basistriata foi similar nos substratos estudados. No terceiro instar e na fase de pupa
Tabela 4. Viabilidade (média + EP) das fases de desenvolvimento e do ciclo biológico
(ovo-adulto) de Abaris basistriata Chaudoir, 1873 (Insecta: Coleoptera: Carabidae: Harpalinae: Pterostichini).
Substratos Ovo Instar Pupa Ciclo
biológico
1° 2° 3°
Solo
(n=120) 84,2+4,56a 1
90,6+2,30a 89,9+2,51a 91,5+2,65a 91,6+3,79ª 57,5+ 4,72a
Vermiculita
(n=120) 83,3+4,31a 90,3+2,05a 89,5+2,11a 76,4+3,22b 73,0+1,84b 37,5+ 3,93b Papel
(n=120) 82,5+4,39a 90,1+2,50a 88,0+2,67a 66,7+2,57b 69,3+4,23b 32,5+ 4,35b 1
Médias seguidas pela mesma letra na coluna não diferem significativamente pelo teste de Tukey (P ˃ 0,05). n= número inicial de indivíduos avaliados por tratamento.
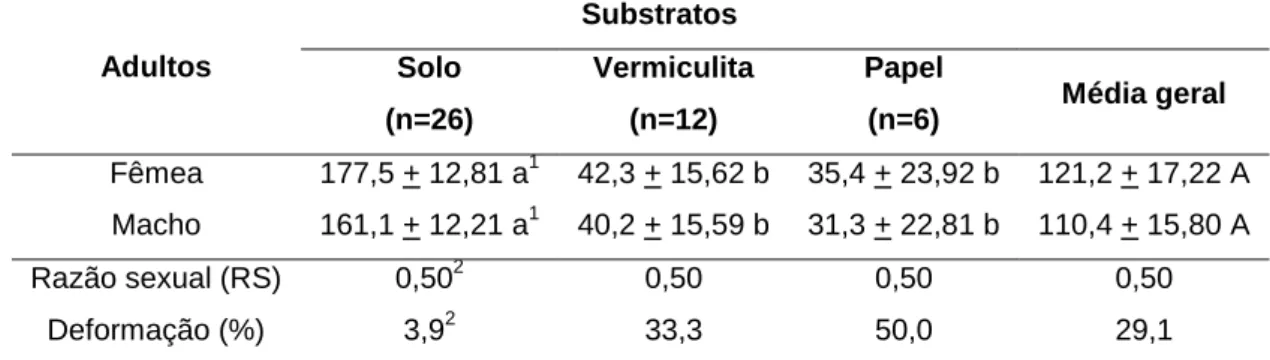
A viabilidade dos ovos e das larvas de primeiro instar de S. seriatoporus foi similar em função do substrato empregado (Tabela 5). Esse parâmetro biológico foi significativamente maior quando larvas de segundo e terceiro instares e pupas do carabídeo ficaram mantidas no solo. A viabilidade do ciclo biológico (ovo-adulto) diferiu significativamente entre os três substratos, destacando-se novamente o solo por ter proporcionado a viabilidade mais elevada. Entre as larvas criadas no solo, vermiculita e papel, 52,0, 24,2 e 12,3%, respectivamente, atingiram a fase adulta.
Tabela 5. Viabilidade (média + EP) das fases de desenvolvimento e do ciclo biológico
(ovo-adulto) de Selenophorus seriatoporus Putzeys, 1878 (Insecta: Coleoptera: Carabidae: Harpalinae: Harpalini).
Substratos Ovo Instar Pupa Ciclo
biológico
1° 2° 3°
Solo
(n=50) 88,1+4,96a 1
84,7+3,67a 86,3+2,60a 87,0+5,85a 91,7+6,11ª 52,0+ 4,87a
Vermiculita
(n=50) 84,2+4,12a 75,8+3,41a 78,6+2,33b 67,3+4,98b 70,0+7,16b 24,2+ 4,49b Papel
(n=50) 82,0+4,27a 70,7+3,12a 66,8+2,54b 48,7+6,56c 54,2+8,77c 12,3+ 5,11c 1
n= número inicial de indivíduos avaliados por tratamento.
As larvas de A. basistriata escavaram galerias horizontais no solo, enquanto as larvas de S. seriatoporus confeccionaram na vertical. Com relação à formação de câmara pupal, ressalta-se que o solo proporcionou a formação da câmara pupal pelas larvas de A. basistriata e S. seriatoporus, estrutura que provavelmente foi responsável pela elevada viabilidade constatada em larvas de terceiro instar (Tabelas 4 e 5). O papel e vermiculita não proporcionaram a confecção de câmaras pupais. A formação de câmara pupal é muito comum entre carabídeos. Goulet (1976) observou a ocorrência de câmara pupal em 80 espécies de carabídeos. Pegoraro e Foerster (1985) verificaram que a pupação de C. granulatum ocorreu no solo com a formação de câmara com solo compactado, a uma profundidade de 8 a 12 cm.
Cornelisse e Hafernik (2009) e Gwiazdowski et al. (2011) ressaltam que cada espécie de Carabidae necessita de substrato de criação específico, o que justifica a determinação de substratos de fácil manuseio e adequados para o inseto. Segundo Lundgren et al. (2005), o solo pode proporcionar um dos ambientes mais adequados para criação de carabídeos, especialmente devido a retenção de umidade e estrutura física que apresenta. Esses autores avaliaram cinco tipos de solo para a criação do carabídeo P. chalcites e relataram que o solo Fer-TiI® não esterilizado foi o mais adequado para o desenvolvimento larval, com menor duração (27,7 dias) e maior taxa de pupação (70 a 80%). No presente estudo, a alta viabilidade das pupas de A.
basistriata e S. seriatoporus no solo provavelmente ocorreu devido à presença de
câmara pupal, que proporcionou umidade adequada para o desenvolvimento dessa fase (Tabelas 4 e 5).