Universidade Federal de Minas Gerais Instituto de Ciências Exatas
Departamento de Química
Sandra Aparecida Alexandre
DISPERSÃO DE NANOTUBOS DE CARBONO E NANOCRISTAIS DE CELULOSE EM DIFERENTES QUITOSANAS: ESTUDO DAS SUSPENSÕES E
PROPRIEDADES DE NANOCOMPÓSITOS POLIMÉRICOS
UFMG/ICEX /DQ.1063ª D.583ª
Sandra Aparecida Alexandre
DISPERSÃO DE NANOTUBOS DE CARBONO E NANOCRISTAIS DE CELULOSE EM DIFERENTES QUITOSANAS: ESTUDO DAS SUSPENSÕES E
PROPRIEDADES DE NANOCOMPÓSITOS POLIMÉRICOS
Orientador: Prof. Dr Rodrigo Lassarote Lavall Coorientador: Prof. Dr. Fabiano Vargas Pereira
Belo Horizonte 2015
AGRADECIMENTOS
A Deus pela oportunidade, pela força e por ter colocado inúmeras pessoas maravilhosas em meu caminho, as quais foram fundamentais para a conclusão deste trabalho.
Ao professor Dr. Rodrigo Lassarote Lavall, meus sinceros agradecimentos pela orientação, dedicação, profissionalismo, oportunidade, confiança, paciência e principalmente pela amizade.
Ao professor Dr. Fabiano Vargas Pereira pela coorientação, apoio e confiança. À Professora Dra. Glaura Goulart Silva pela cooperação durante a realização deste trabalho.
À professora Dra. Patrícia Santiago de Oliveira Patrício (CEFET-MG), cujo apoio foi de fundamental importância no desenvolvimento da pesquisa.
À Samara e Claudilene pela ajuda com os ensaios mecânicos e espectros FTIR. À Meiriane e Marcelo pela ajuda com as medidas de viscosimetria.
Ao Felipe Medeiros pelas análises térmicas. À Ana Paula pela amizade e espectros Raman. Ao Paulo pela amizade e espectros de RMN 1H. Ao Welligton pela ajuda no Raman e com os gráficos À Juliana e Luíza pela ajuda com a formatação.
Ao professor Dr Luiz Carlos de Oliveira e seus alunos Ana e Henrique, pela ajuda com as análises de UV-Vis.
À Nathalia, João e Débora pelos NCCs, conversas e colaborações.
Aos companheiros de laboratórios ( Lab 133, Lab 117, Lab 227 e Lab 217) pela convivência e por proporcionarem um ambiente de trabalho produtivo.
Aos técnicos do Centro de Microscopia da UFMG, em especial Miquita e Érico, pelas imagens de MEV e MET.
À Juliana (UFMG) pelas difrações de raios X.
Aos funcionários do Depto. de Química que contribuíram de alguma forma para que este trabalho fosse concluído. Em especial aos funcionários da secretaria, Lílian e Paulete.
“Faça o que for necessário para ser feliz. Mas não se esqueça
que a felicidade é um sentimento simples, você pode encontrá-la
e deixá-la ir embora por não perceber sua simplicidade. Ela
transmite paz e não sentimentos fortes, que nos tormenta e
provoca inquietude no nosso coração. Isso pode ser alegria,
paixão, entusiasmo, mas não felicidade ...”
Mario Quintana
i
RESUMO
DISPERSÃO DE NANOTUBOS DE CARBONO E NANOCRISTAIS DE CELULOSE EM DIFERENTES QUITOSANAS: ESTUDO DAS SUSPENSÕES E
PROPRIEDADES DE NANOCOMPÓSITOS POLIMÉRICOS
No presente trabalho foram preparadas diferentes suspensões pela dispersão de nanotubos de carbono funcionalizados (MWCNT-COOH) e/ou nanocristais de celulose (NCC) em soluções ácidas de quitosana de baixa massa molar ( ̅̅̅̅ = 3,3x104 g/mol e ̅̅̅̅ = 25%) e de alta massa molar ( ̅̅̅̅ = 3,7x105 g/mol e ̅̅̅̅ = 31%) e glicerol (10% (m/m)) com o emprego de ultrassom de ponta. As dispersões foram caracterizadas de forma a verificar qual a concentração de cada nanocarga seria possível dispersar nessas quitosanas sem a utilização de etapas posteriores de centrifugação. Foi verificado que concentrações de nanotubos da ordem de 2% (m/m) e de 0,5% (m/m) são efetivamente dispersas nessas matrizes (de baixa e alta massas molares, respectivamente) e que as mesmas permanecem estáveis mesmo após 3 meses ou mais de repouso, evidenciando a estabilização das cargas pela quitosana e a obtenção de dispersões termodinâmicas. A partir dessas suspensões, foram preparados nanocompósitos poliméricos binários (QUI/ MWCNT-COOH ou NCC) e ternários (QUI/MWCNT-COOH/NCC) por evaporação do solvente e transvasamento (casting). A adição de MWCNT-COOHs e NCCs influencia a estabilidade térmica das matrizes de quitosana (avaliada por termogravimetria), indicando possível interação entre as cargas e a matriz. Dados de espectroscopia vibracional na região do infravermelho dos filmes dos compósitos evidenciaram a interação carga/matriz o que foi corroborado pelas imagens de microscopias eletrônicas de varredura e transmissão. Essas imagens mostraram uma boa adesão das cargas à matriz polimérica como resultado da interação MWCNT-COOH/QUI e NCC/QUI e QUI/MWCNT-COOH/NCC. Além disso, outro indício dessa interação é que nas imagens (obtidas na superfície de fratura) não foram observadas regiões que indicassem que o nanotubo foi puxado para fora da matriz no momento da fratura, além de nanotubos curvados e entrelaçados na matriz polimérica, ligando
“pontos” da superfície fraturada. Essa morfologia é essencial para a transferência de tensão entre nanotubo e matriz quando o material é sujeito a uma solicitação mecânica. De fato, os ensaios mecânicos mostraram que tanto os nanotubos (em menor escala) e os NCC são excelentes agentes de reforço para a quitosana. Foram verificados aumentos nas propriedades como módulo de elasticidade, resistência a tração, alongamento na ruptura e tenacidade. Além disso, nos compósitos ternários, a sinergia entre matriz, nanotubos e nanocristal permitiu o preparo de nanocompósitos com propriedades superiores às verificadas nos compósitos binários empregando baixas concentrações das nanocargas, especialmente na matriz de quitosana de alta massa molar.
ii
ABSTRACT
DISPERSION OF CARBON NANOTUBES AND CELLULOSE NANOCRYSTALS IN DIFFERENTS CHITOSANS: STUDIES ON SUSPENSIONS AND POLYMERS
NANOCOMPOSITES PROPERTIES.
In this study different suspensions were prepared by dispersing functionalized carbon nanotubes (MWCNT) and/or cellulose nanocrystals (NCC) in acidic solutions of low ( ̅̅̅̅ = 3,3x104 g/mol and ̅̅̅̅ = 25%) and high molar mass ( ̅̅̅̅ = 3,7x105 g/mol and ̅̅̅̅ = 31%) chitosans and glycerol (10% by weight) with the use of a tip ultrasound. The dispersions were characterized in order to find what concentration of each nanofiller would be possible to disperse with those chitosans without the use of further centrifugation steps. It was found that concentrations of NCC of about 10wt% and 1w% and nanotubes in the order of 2wt% and 0.5wt% were effectively dispersed in such matrices (high and low molecular weights, respectively) and the suspensions remain stable even after 3 months or more (at rest), indicating the filler stabilization by the chitosan with the preparation of thermodynamic dispersions. From these suspensions, binary (CHI /MWCNT or NCC) and ternary (CHI/MWCNT/NCC) polymer nanocomposites were prepared by casting technique. The addition of MWCNTs and NCCs affects the thermal stability of the chitosan (as measured by thermogravimetry), indicating possible interaction between the filler and matrix. Infrared spectroscopy data of the composite films showed the interaction filler/chitosan, which was corroborated by the scanning and transmission electronic microscopies images. These images showed good adhesion of the fillers to the polymer matrix as a result of MWCNT/CHI, NCC/CHI and CHI/MWCNT/NCC interactions. Furthermore, another evidence of this interaction (obtained in the fracture images) is the fact that no nanotube was pulled out from the matrix with the fracture, as well the observation of curved nanotubes connecting "points"of the fractured surface. This morphology is essential to the transfer of tension between the fillers and matrix when the material is subjected to mechanical stress. In fact, the mechanical tests showed that both the nanotubes (in a smaller scale) and NCC are excellent reinforcement for chitosan. Increases were observed in properties such as modulus, tensile strength, elongation at break and toughness. Moreover, in the ternary composite, the synergy between the matrix, nanocrystals and nanotubes allowed the preparation of nanocomposites with superior properties to those found in the binary systems using low concentrations of the nanofiller, especially in the high molecular weight chitosan matrix.
iii
Lista de Figuras
Figura 1: Representação das estruturas (a) celulose (b) quitina ... 3
Figura 2 : Reação de desacetilação das cadeias poliméricas de quitina ... 5
Figura 3:Representação da estrutura primária de quitosana, com x representando o grau de acetilação ... 6
Figura 4: Representação esquemática das regiões amorfas e cristalinas presentes em polímeros semicristalinos() ... 6
Figura 5: Representação da hidrólise ácida dos nanocristais de celulose (NCCs) ... 7
Figura 6: Representações esquemáticas : (a) Estrutura de folhas de grafeno (53), e morfologias propostas para nanotubos de carbono (SWCNT) (b) zigzag (c) quiral e (d) armchair (55). ... 9
Figura 7: Representação da funcionalização de um nanotubo de parede simples por meio de oxidação ácida, com auxílio do programa ChemBioChemistry® ... 10
Figura 8: Estrutura molecular do glicerol ... 11
Figura 9: Curva tensão-deformação típica para Polímeros Semicristalinos ... 14
Figura 10: Amostras de quitosanas (a) Sigma-Aldrich e (b) Polymar ... 22
Figura 11: Fotografia dos Nanocristais de celulose (NCCs) dispersos em água (a) sob luz natural (b) sob luz polarizada ... 24
Figura 12: Espectros FTIR para as amostras de quitosana ( pulverizada) ... 32
Figura 13: Espectros de RMN 1H da amostra de quitosana Polymar (em destaque estrura primária da quitosana na parte superior e os picos presentes no espectro na região ente 3,5 e 1,5 ppm na parte inferior). ... 34
Figura 14: Espectro de RMN 1H da amostra de quitosana Sigma-Aldrich (em destaque os picos entre 3,5 e 1,5 ppm) ... 34
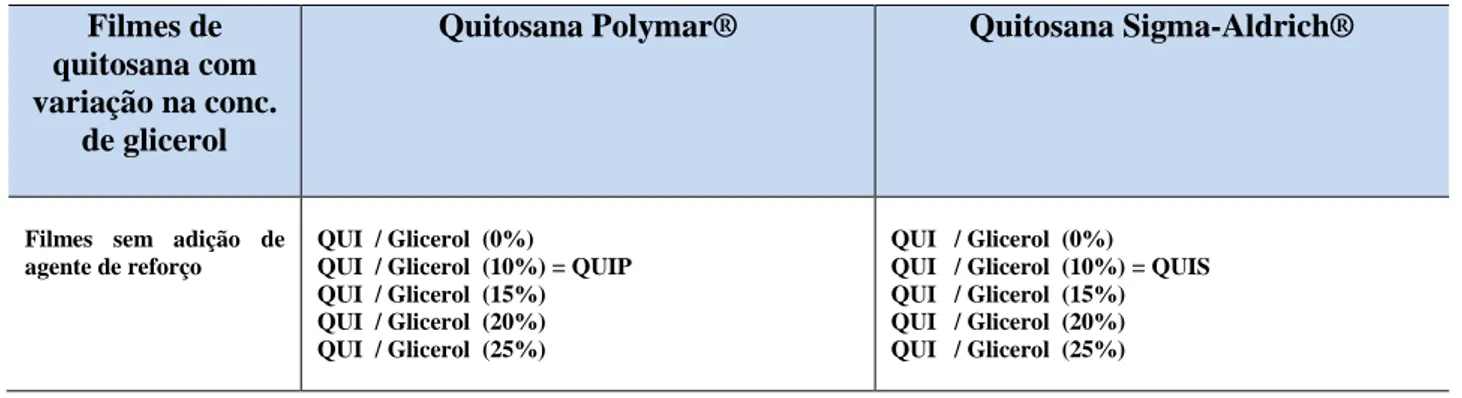
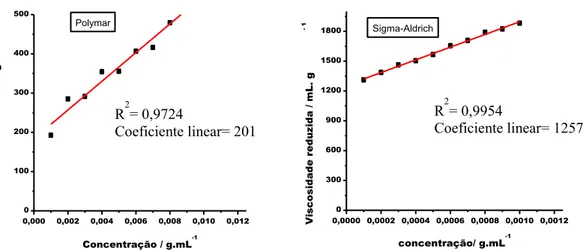
Figura 15: Gráficos da Viscosidade reduzida em função da concentração para as amostras: (a) Polymar e (b) Sigma-Aldrich ... 35
Figura 16: Difratogramas de raios X para as amostras de quitosana Polymar (esquerda) e Sigma-Aldrich (direita). ... 37
Figura 17: Curvas TG em ar e N2 para as amostras de quitosanas Polymar e Sigma-Aldrich ... 38
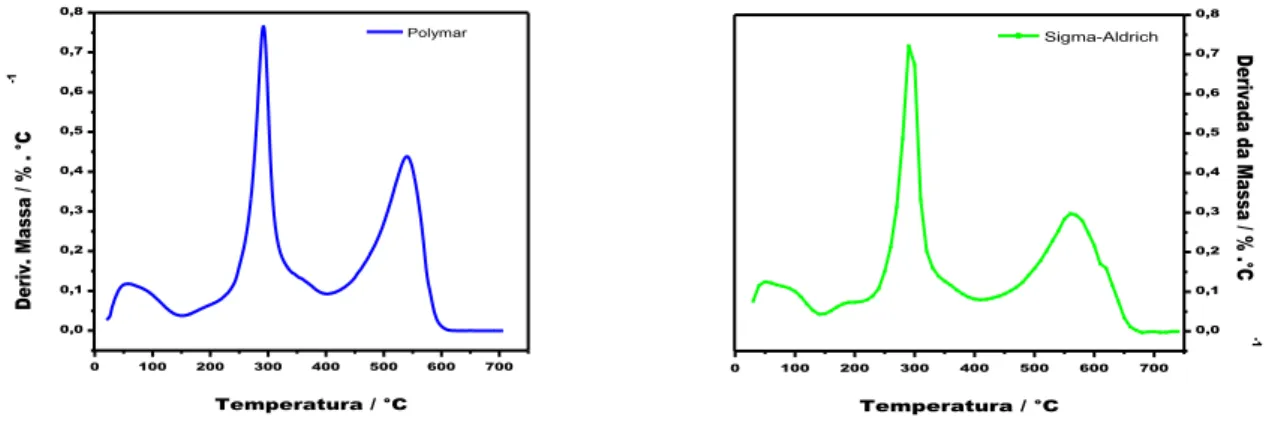
Figura 18: Curvas DTG em ar das amostras de quitosana Polymar e Sigma-Aldrich. ... 39
Figura 19: Espectros Raman das amostras MWCNT (a) e MWCNT-COOH (b) ... 41
iv
Figura 21: Imagens de MEV dos MWCNT (sem modificação), escalas (a) 1 m e (b)
500nm ... 43 Figura 22: Imagens de MEV dos MWCNT-COOH, em diferentes regiões e com diferentes
escalas (a) 2 m e (b) 1 m ... 44 Figura 23: Imagens de MET dos MWCNT ( sem modificação), escalas ( a) 200nm, (b) 10 nm e ( c e d ) 5 nm. ... 44 Figura 24: Imagens de MET dos MWCNT-COOH, escalas (a) 500nm, (b) 200nm, (c) 10nm, (d) 5nm. ... 45 Figura 25: Espectro de FTIR para amostra de NCCs secos ... 46 Figura 26: Difratograma da amostra de NCCs ... 47 Figura 27: Imagens por MEV dos NCCs dispersos em diferentes soluções de quitosana em ácido acético 2% (v/v) e depositados sobre placas de silício previamente ionizadas, escalas (
a, b) 2 m e (c, d ) 1 m. ... 48 Figura 28: Curvas TG/DTG para amostras de NCCs em atmosfera de N2(g) ... 49
v 0,8% (m/m) de MWCNT-COOH (e) com 0,8% e 0,5% (m/m) de MWCNT-COOH (f)
QUIP/NCC(5%)(direita) e QUIP/MWCNT-COOH(0,8%)/NCC(5%)(esquerda) ... 56
Figura 38: Filmes dos nanocompósitos fabricados com a matriz QUIS: (a) e (b) sem adição de reforço (direita) e com 0,5% (m/m) de MWCNT-COOH (esquerda) (c) e (d) com 0%, 0,1%, 0,3% e 0,5% (m/m) de MWCNT-COOH (e) sem adição de reforço) (f) QUIS/ NCC(1%) ( direita) e QUIS/MWCNT-COOH (0,5%)/NCC(1%) (esquerda)... 57
Figura 39: Imagens de microscopia ótica dos filmes e nanocompósitos fabricados com a quitosana Polymar®, com aumento 100x: (a) QUIP, (b) QUIP/MWCNT-COOH(0,3%) e (c) QUIP/NCC (25%) ... 57
Figura 40: Imagens de microscópia ótica dos filmes e nanocompósitos fabricados com a quitosana Sigma-Aldrich, com aumento 100x : (a) QUIS, (b) QUIS/MWCNT-COOH (0.3%) e (c) QUIS/NCC (10%) ... 58
Figura 41: Imagens de MEV Filme de quitosana contendo 10% (m/m) de glicerol sem adição de reforço (QUIP) ... 59
Figura 42: Imagens de MEV Nanocompósitos QUIP/MWCNT-COOH(0,5%) ... 59
Figura 43: Imagens MEV Nanocompósitos QUIP/MWCNT-COOH(1,2%) ... 59
Figura 44: Imagens MEV Nanocompósitos QUIP/MWCNT-COOH (3,0%) ... 60
Figura 45: Imagens de MEV Nanocompósitos QUIP/NCC (10%) ... 60
Figura 46: Imagens MEV Nanocompósitos QUIP/ MWCNT-COOH (0,8%) / NCC (10%) 60 Figura 47: Imagens por MEV de filmes de quitosana contendo 10% (m/m) de glicerol sem adição de refoço (QUIS) ... 61
Figura 48: Imagens por MEV de nanocompósitos QUIS/MWCNT-COOH (0,5%) ... 61
Figura 49: Imagens MEV nanocompósitos QUIS/MWCNT-COOH (0,5%)/ NCC (10%) .. 61
Figura 50: Imagens MET Nanocompósitos microtomizados QUIP/ MWCNT-COOH (0,8%) ... 63
Figura 51: Imagens de MET de nanocompósito microtomizados QUIS/MWCNT-COOH(0,8%) /NCC (15%) ... 63
Figura 52: Imagens de MET de nanocompósitos microtomizados QUIS/MWCNT-COOH (0,5%) /NCC (10%) ... 64
Figura 53: (a) Espectros FTIR dos filmes de quitosana Polymar (sem reforço) com: 0%, 10%, 15%, 20% e 25% de glicerol (b) ampliação da região espectral de 1200-800 cm-1 . 65 Figura 54: (a) Espectros dos filmes de quitosana Sigma-Aldrich (sem reforço) com: 0%, 10%, 15%, 20% e 25% m/m de glicerol (b) ampliação da região entre 1200-800 cm-1 ... 66
Figura 55: Espectros no IRFT dos nanocompósitos QUIP/ MWCNT-COOH (0-3%) ... 68
viii
Lista de Tabelas
ix
Lista de Abreviatura e símbolos
QUI: quitosana
QUIP: solução/matriz fabricada com a quitosana da marca Polymar® contendo 10% de glicerol % (m/m)
QUIS: solução/matriz fabricada com a quitosana da marca Sigma-Aldrich® contendo 10% de glicerol % (m/m)
GA: grau de acetilaçao GD: grau de desacetilaçao
Icr: grau ou índice de cristalinidade NCCs: nanocristais de celulose CNT: nanotubos de carbono
MWCNT: nanotubos de carbono de paredes múltiplas.
MWCNT-COOH: nanotubos de carbono de paredes múltiplas sumetidos a oxidação ácida (carboxilação ácida)
SUMÁRIO
1. INTRODUÇÃO ... 1
2. REVISÃO BIBLIOGRÁFICA ... 3
2.1. Quitina...3
2.2. Quitosana...4
2.3. Nanocristais de celulose (NCCs)...7
2.4. Nanotubos de carbono (CNTs)...8
2.5. Plastificantes...10
2.6. Compósitos e nanocompósitos poliméricos...11
2.7. Propriedades mecânicas de materiais poliméricos...13
2.8. Viscosidade...17
3. OBJETIVOS...20
4. PARTE EXPERIMENTAL...21
4.1. Reagentes...21
4.2. Purificação das amostras de quitosana...21
4.3.Funcionalização dos nanotubos de carbono de paredes múltiplas (MWCNT-COOHs)...22
4.4. Extração dos nanocristais de celulose (NCCs)...23
4.5. Preparo dos fluidos poliméricos para fabricação dos filmes de quitosana com diferentes concetrações de glicerol...24
4.6. Preparo dos fluidos poliméricos para fabricação dos nanocompósitos ...24
4.7. Fabricação de filmes de quitosana sem reforço e dos nanocompósitos poliméricos...25
4.8.Espectroscopia de ressonância magnética de hidrogênio (RMN1H) ...26
4.9. Medidas viscosimétricas...27
4.10. Espectroscopia Raman...28
4.11. Espectroscopia de absorção molecular (UV-Vis)...28
4.13. Análise termogravimétrica (TG)...29
4.14. Difração de raios X...29
4.15. Microscopia ótica ...30
4.16.Microscopia eletrônica de varredura e de transmissão (MEV e MET) ...30
4.17. Ensaios mecânicos...31
5. RESULTADOS E DISCUSSÃO...32
5.1. Caracterização das amostras de quitosana...32
5.1.1. Espectroscopia na região do infravermelho (FTIR)...32
5.1.2. Espectroscopia de ressonância magnética de hidrogênio ( RMN1H)...33
5.1.3. Viscosimetria capilar das soluções poliméricas de quitosana em solução tampão ...35
5.1.4. Difração de raios X...36
5.1.5. Análises termogravimétricas (TG)...38
5.2.Caracterização das amostras de nanotubos de carbono (CNTs)...40
5.2.1. Espectroscopia Raman...40
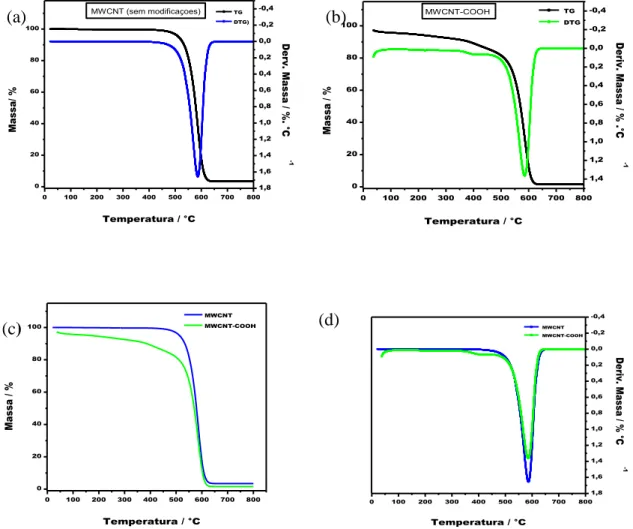
5.2.2. Análise termogravimétrica (TG)...41
5.2.3. Microscopia Eletrônica de Varredura e de transmissão (MEV e MET)...43
5.3. Caracterização das amostras de nanocristais de celulose ...46
5.3.1. Espectroscopia na região do infravermelho (FTIR)...46
5.3.2. Difração de raios X...47
5.3.3. Microscopia Eletrônica de Varredura (MEV)...48
5.3.4. Análise termogravimétrica (TG)...49
5.4. Caracterização dos fluidos poliméricos...50
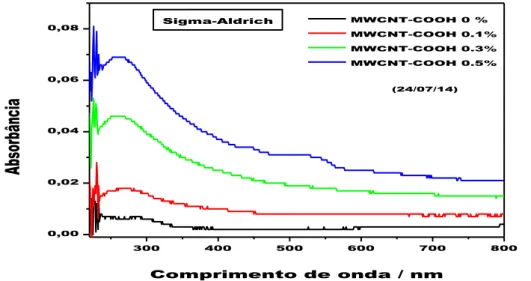
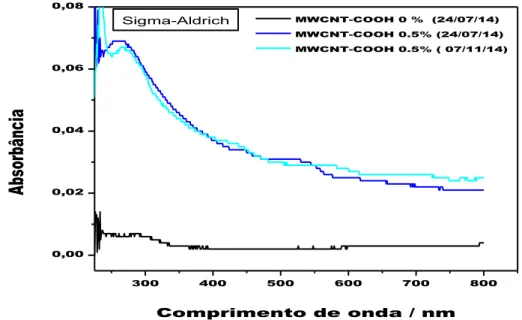
5.4.1. Espectroscopia no UV-Vis dos fluidos poliméricos contendo MWCNT-COOH...51
5.4.2. Microscopia eletrônica de transmissão (MET) e microscopia eletrônica de varredura (MEV) de amostras de fluidos poliméricos...54
5.5. Caracterização dos filmes de quitosana com 0-25% (m/m) sem adição de reforço e dos nanocompósitos poliméricos com adição de MWCNT-COOHs e/ou NCCs...56
5.5.1. Microscopia ótica (MO)...57
5.5.2. Microscopia Eletrônica de Varredura (MEV)...58
5.5.3. Microscopia eletrônica de transmissão (MET)... 62
5.5.5. Análise termogravimétrica (TG)...71
5.5.6 Ensaios de tração: em função da deformação ...76
6. CONCLUSÕES...91
7. REFERÊNCIAS BIBLIOGRÁFICAS...93
1
1.
INTRODUÇÃONos últimos anos, os temas poluição e limitação dos recursos naturais do planeta, têm sido amplamente discutidos. No caso das indústrias de materiais poliméricos, a obtenção de matéria-prima, a reciclagem e a disposição final dos resíduos estão entre as principais preocupações econômicas e ambientais(1). Tendo em vista esse cenário atual, a busca por novas alternativas de polímeros naturais em relação aos polímeros sintéticos, principalmente os derivados da indústria petroquímica, tem se intensificado cada vez mais. A biodegradabilidade associada na maioria dos casos a um baixo custo, é outra característica que tem impulsionado o aumento do uso dos polímeros naturais e de seus derivados.
Dentre os polímeros encontrados na natureza, a celulose e a quitina são os dois mais abundantes. Sendo a celulose encontrada principalmente na biomassa de vegetais e a quitina em exoesqueletos de crustáceos e insetos(2,3,4).
A quitosana é o principal derivado da quitina, sendo obtida através da desacetilação desta por meio de tratamento básico com aquecimento. Durante a reação de desacetilação, ocorre a conversão de parte dos grupos acetamidos presentes nas cadeias poliméricas da quitina em grupos aminos. Dentre as várias características da quitosana que possibilitam inúmeras aplicações industriais de materiais e biomédicas, destacam-se a biodegradabilidade, atoxicidade e compatibilidade, sendo assim um polímero muito versátil quando comparado com a maioria dos polímeros naturais(5,6).
Sob as formas de filmes e membranas, a quitosana também pode ser usada como embalagem de alimentos, filtros, materiais de engenharia e biotecnologia, etc. Tanto para os filmes como para as membranas, as propriedades mecânicas, a permeabilidade, o comportamento térmico entre outros parâmetros, dependem diretamente das características da quitosana, principalmente da massa molar e do grau de desacetilação (GD)(4,7).
Porém, o uso de quitosana pela indústria de materiais tem sido limitado, principalmente devido as suas pobres propriedades mecânicas em comparação aos polímeros sintéticos. Visando a melhora das propriedades mecânicas da quitosana, é comum a adição de materiais fibrosos e/ou particulados como as nanoargilas, nanofibras de vidro, nanotubos de carbono entre outros, como agentes de reforço à matriz polimérica, originando então compósitos ou nanocompósitos(4, 8, 9,10,11,12).
2 nanocristais de celulose (NCCs), é necessário também que elas estejam bem dispersas e distribuídas na matriz polimérica, e possuírem uma razão de aspecto superior a 10, a fim de possibilitar uma eficiente transferência de tensão quando o compósito é submetido a uma solicitação mecânica(8,13,14).
Além dos agentes de reforço, é comum a adição de plastificantes para melhorar a processabilidade dos filmes e membranas de quitosana, pois de modo geral, os materiais fabricados com este polímero puro são quebradiços e poucos flexíveis(6).
É descrito também na literatura melhoras mecânicas significativas com o emprego de cargas nanométricas, em especial nanotubos de carbono (CNT) ou nanocristais de celulose (NCCs), como agentes de reforço na fabricação de nanocompósitos binários tendo como matriz a quitosana(QUI)(8, 11). Porém, não há relatos de pesquisas que envolvam o uso simultâneo de nanotubos de carbono e nanocristais de celulose e possíveis alterações sobre as propriedades físico-químicas dos materiais, em especial filmes, fabricados com estes nanocompósitos ternários em relação aos fabricados com os nanocompósitos binários e quitosana sem adição de reforço.
3
2.
REVISÃO BIBLIOGRÁFICANeste capítulo será apresentada uma revisão bibliográfica sobre nanocompósitos poliméricos precedida da discussão sobre os materiais que foram usados na fabricação dos mesmos: quitosana, plastificantes e agentes de reforço. A viscosimetria também será abordada, por ser uma das principais técnicas usadas para a determinação de massa molar viscosimétrica média de soluções de quitosana em regime diluído(15,16). Também serão discutidas algumas propriedades mecânicas obtidas através de ensaios de tração necessárias para a compreensão dos resultados apresentados. As demais técnicas usadas na avaliação das propriedades físico-químicas dos fluídos poliméricos, dos filmes de quitosana com diferentes concentrações de glicerol (sem adição de reforço) e dos nanocompósitos, como as análises térmicas e espectroscópicas, não serão abordadas por tratarem-se de técnicas multidisciplinares e em geral bastante conhecidas pelos profissionais da área de Ciências Exatas.
2.1. Quitina
A quitina é um homopolímero de cadeias poliméricas lineares constituídas basicamente pela repetição de resíduos de 2-acetamido-2-desoxi-D-glicopiranose (5, 17,
18)
. É o segundo polímero natural mais abundante na crosta terrestre depois da celulose, diferenciada desta última pela presença de grupos acetamidos no lugar de hidroxilas nas posições do carbono 2 das cadeias poliméricas, como mostrado na Figura 1(5, 14, 17, 19).
Figura 1: Representação das estruturas (a) celulose (b) quitina
A quitina exibe três tipos de morfologias: α, e que diferem no arranjo de suas cadeias na estrutura cristalina e que podem ser evidenciadas por experimentos de difração
a)
4 de raios X. A quitina α é a que apresenta altos índices de cristalinidade e estabilidade, sendo encontrada principalmente em cutículas dos organismos artrópodes, cuja função parece estar relacionada a proteção corporal de organismos(5,20).
Em sua forma bruta, isto é, sem sofrer modificações químicas, todas as formas polimórficas de quitina são praticamente insolúveis em água e pouco solúveis em soluções ácida diluídas(5,21).
A principal fonte de quitina comercial são os exoesqueletos de crustáceos como caranguejos, camarões e siris. O processo de extração da quitina presente nos exoesqueletos compreende basicamente as etapas :
i) desmineralização; ii) desproteinização; iii) despigmentação.
Para a etapa de desmineralização são usadas soluções de vários ácidos, como as preparadas com o HCl em diferentes concentrações. A desproteinização ocorre com o emprego de soluções alcalina, em geral usam-se soluções de NaOH em torno de 5% (em volume) e temperaturas superiores a 100°C(5,20). Os pigmentos continuam presentes na quitina mesmo após as etapas de desproteinização e desmineralização, sugerindo então que eles não estejam complexados a materiais inorgânicos e nem a proteínas. Para a remoção dos pigmentos, os dois métodos mais usados são: extração por solvente (acetona ou álcool etílico) ou branqueamento com uso de KMNO4, NaClO, NaHSO3 ou H2O2( 5, 20).
A quitina, embora possua excelentes propriedades como biodegradabilidade, abundância natural e baixa toxicidade, possui solubilidade limitada em muitos solventes, o que acaba limitando o seu emprego em diversas aplicações(5, 22).
2.2. Quitosana
5 Figura 2 : Reação de desacetilação das cadeias poliméricas de quitina
De acordo com a extensão da desacetilação sofrida, o polímero poderá se tornar solúvel em soluções ácidas fracas a moderadas, devido à protonação dos grupos aminos originados pela reação(6, 23,24, 25).
Quando o polímero possuir grau médio de desacetilação ( ̅̅̅̅ superior a 60% e for solúvel em soluções ácidas com pH abaixo de 6, o material obtido passará então a se chamar quitosana (5,20).
O grau médio de desacetilação ( ̅̅̅̅ está diretamente relacionado com as condições empregadas na reação de desacetilação, além das características físico-químicas e morfológicas da quitina de origem. Normalmente as condições empregadas nas reações de desacetilação da quitina são: meio básico (soluções de NaOH(aq) 40-60% (m/m) e aquecimento entre 110 e 115°C durante um intervalo de 1 a 6h. (5, 22, 26, 27,28). De modo geral, quanto menor o ̅̅̅̅, menos drástico foi o processo empregado na desacetilação, resultando um polímero com cadeias maiores. Um grau de desacetilação próximo de 100% só é possível em condições reacionais severas. Porém, geralmente com degradação das cadeias poliméricas originando polímeros de baixíssima massa molar ou mesmo oligômeros.
De acordo com a literatura as quitosanas são classificadas como de altas massas molares quando possuírem massa molar superior a 3x105 g/mol, de médias massas molares quando 2x105>M.M.>1x105 g/mol e de baixa massa molar quando possuírem massas menores a 105 g/mol(2,20).
Assim, o termo quitosana, não se refere a uma substância única, e sim um grupo de produtos parcialmente desacetilados, com diferentes graus de desacetilação (GD) e massas molares (M.M.), que são solúveis em soluções aquosas diluídas de ácidos orgânicos e inorgânicos(5,29). Dentre os solventes empregados para preparo de soluções de quitosana, as soluções de ácido acético entre 1 e 5 % v/v estão entre as mais usadas(3, 6, 11) .
6 Figura 3:Representação da estrutura primária de quitosana, com x representando o grau de acetilação
A quitosana é um polímero semicristalino, sendo que de modo geral o grau de cristalinidade (Icr) está relacionado com o grau de desacetilação (GD). Isso é justificado pelo fato de quanto menor o GD, maior semelhança da quitosana com a quitina origem, que por sua vez possui altos índices de cristalinidade. A cristalinidade afeta diretamente as propriedade mecânicas. Em geral, quanto mais cristalino o polímero, maior a rigidez, em contrapartida menos dúctil ele será(20).
Figura 4: Representação esquemática das regiões amorfas e cristalinas presentes em polímeros semicristalinos(31)
Um outro parâmetro importante para sistemas poliméricos é a temperaturas de transição vítrea (Tg). A atribuição da Tg para amostras de quitosana pura na literatura é bastante controversa, sendo dificultada pela presença de água e variação na extensão dos domínios cristalinos. Santos e colaboradores(17) relataram valores de Tg entre 10 e 40 °C, através de análise por calorimetria exploratória diferencial (DSC), para amostras de quitosana comercais com diferentes M.M. e GD, derivadas de quitina de carangueijos. Sakurai e colaboradores(1), trabalhando com uma quitosana com GD=96% e massa molar 9,0 x104 g/mol , estimaram também por DSC a Tg da amostra em 203 °C. Existem ainda autores inferem ausência de Tg para amostras de quitosana que possuem estrutura predominante semicristalina(20).
Como já mencionado anteriormente, a quitosana devido as suas propriedades como biodegradabilidade, baixa toxicidade, alta biocompatibilidade, capacidade de remoção de
Região amorfa
7 cátions em águas residuais e capacidade de formação de filmes, vem sendo muito estudada nos últimos anos por profissionais e pesquisadores da área de materiais. Alguns trabalhos desenvolvidos por vários grupos de pesquisas sobre possíveis aplicações dos compósitos de quitosana com adição de nanotubos em sensores e biosensores eletroquímicos de glicose, colesterol, peróxido de hidrogênio, entre outros têm sido divulgados em vários veículos científicos(32).
2.3. Nanocristais de celulose (NCCs)
A celulose é o composto orgânico mais abundante da crosta terrestre, sendo formada por
ligações do tipo -1,4-D-glicose(33) (Figura 4). Na natureza a celulose não ocorre de forma isolada, em especial no caso das plantas superiores, umas das maiores fontes deste polímero, que têm a biomassa das suas fibras vegetais formada principalmente por hemicelulose, lignina e celulose(30, 34).
Como a celulose pode ser obtida a partir de inúmeras fontes vegetais como eucalipto e algodão, além de resíduos de produtos agrícolas como bagaço da cana-de-cana e cascas de arroz, ela constitui uma interessante fonte renovável e de baixo custo para o preparo dos chamados nanocristiais de celulose (NCCs) ou nanowhiskers(35, 36, 37).
Os NCCs são extraídos por hidrólise ácida das fibras celulósicas(38). Durante a reação, as regiões amorfas das fibras de celulose são destruídas deixando intactos os segmentos cristalinos isolados, ou seja, os NCCs que podem ser purificados numa etapa posterior. Em geral, a hidrólise com H2SO4 é a mais usada, por gerar suspensões aquosas dos NCCs mais
estáveis devido a presença dos grupos sulfatos inseridos na suas superfícies durante o processo de obtenção (Fig. 5)(3, 30, 39).
Figura 5: Representação da hidrólise ácida dos nanocristais de celulose (NCCs)
8 da matéria-prima (ex. algodão, madeira e outros) e as condições empregadas na hidrólise(3,
30, 36, 37,40, 41, 42).
O comprimento (L) e o diâmetro (D), e consequentemente a razão de aspecto (L/D) dos NCCs também dependerão da fonte de celulose e das condições empregadas na hidrólise. No caso dos NCCs de celulose de eucalipto, as dimensões ficam próximas de 200 nm por 5 nm, e a razão de aspecto próxima de 40(3,30, 43, 44). O módulo de elasticidade para os NCCs, estimados por difração de raios X (DRX), espectroscopias Raman e microscopia de força atômica (MFA), varia de acordo as direções das cadeias poliméricas, sendo próximo de 220 GPa na direção paralela e 15 GPa na direção perpendicular(30, 45).
Outra característica importante dos NCCs é a presença dos grupos –OH, que os tornam altamente compatíveis com matrizes poliméricas hidrofílicas, como por exemplo a quitosana, devido a capacidade de fazer ligações de hidrogênio com os grupos funcionais aminos e hidroxilas presentes na cadeia polimérica deste polímero(8).
Como os NCCs podem ter suas superfícies modificadas, eles também são potenciais materiais de reforço para outros tipos de matrizes poliméricas(3). No entanto, uma desvantagem verificada, principalmente quando são inseridos grupos éster-sulfatos, é a diminuição da estabilidade térmica dos nanocristais de celulose, para valores abaixo de 200°C(30,36).
Assim, devido as suas características como alto grau de cristalinidade, módulo de elasticidade elevado, biocompatibilidade, susceptibilidade a modificação química e relativa facilidade de obtenção, os nanocristais têm sido cada vez mais estudados como agente de reforço para diversos materiais, principalmente para matrizes poliméricas.
2.4. Nanotubos de carbono (CNTs)
A partir da década 90 com as pesquisas publicadas por Ijima(46), os nanotubos de carbono começaram a despertar um enorme interesse da comunidade científica. Desde então, devido as suas excelentes propriedades elétricas, térmicas e mecânicas, como também a capacidade de atuarem como agentes de reforço em compósitos, eles têm sido bastante estudados e usados para a fabricação de novos materiais(10, 47).
9
carbon nanotubes-SWCNT) e nanotubos de paredes múltiplas ( multi wall carbon
nanotubes-MWCNT)(49, 50,51).
As conformações que os nanotubos podem assumir interferem diretamente nas suas propriedades físico-químicas, em especial nas propriedades elétricas. Dentre as estruturas possíveis segundo o ângulo de enrolamento de uma folha de grafeno (modelo idealizado) estão: = 0º zig/zag e 0< <30º quiral (semicondutoras); = 30º armchair (metálica)
(49,51,52,53,54)
. Na Figura 6 (a) se encontra uma ilustração de como os nanotubos se relacionam estruturalmente como uma folha de grafeno. Na Figura 6 (b), (c) e (d), estão representadas as estruturas propostas para nanotubos de carbono (paredes simples) segundo o modelo idealizado do enrolamento de uma folha de grafeno, utilizando o programa Gaussian 03 W(55).
Figura 6: Representações esquemáticas : (a) Estrutura de folhas de grafeno (53), e morfologias propostas para nanotubos de carbono (SWCNT) (b) zigzag (c) quiral e (d) armchair (55).
As estruturas tubulares dos CNTs possuem diâmetro na ordem de nanômetros e comprimento que podem atingir até a escala de mícrons. Em virtude disso, eles são materiais com alta razão de aspecto (L/D), além de apresentarem elevado módulo de elasticidade, entre 250 a 950 GPa , tornando-os por esses motivos excelentes candidatos como agentes de reforço para matrizes poliméricas(56, 57, 58).
No caso de nanocompósitos com adição de nanotubos e empregando como matriz polimérica a quitosana, a maioria dos trabalhos encontrados na literatura relatam o emprego de concentrações que variam entre 0,1 a 2,0% (m/m)(9, 11,32).
10 dispersão, novas propriedades físico-químicas podem ser criadas, gerando assim novas aplicações e novos materiais (10). Em geral a modificação química das superfícies dos CNTs se dá por meio de oxidação em meio ácido sob aquecimento (Figura 7).
Figura 7: Representação da funcionalização de um nanotubo de parede simples por meio de oxidação ácida, com auxílio do programa ChemBioChemistry®
As regiões que apresentam maior quantidade de defeitos na estrutura, como nas extremidades dos nanotubos, são as mais propensas a sofrer uma maior extensão de funcionalização. O grau de funcionalização, além da natureza do nanotubo de partida, depende também das condições usadas durante o processo de oxidação. Todavia é necessário o controle cuidadoso dos parâmetros reacionais de modo a minimizar quebras e/ou degradação dos nanotubos(9).
2.5. Plastificantes
A flexibilidade, ductilidade e tenacidade dos polímeros podem ser melhorados com a adição dos aditivos chamados de plastificantes. Porém, a presença deles também promovem diminuição da resistência mecânica , redução da dureza e rigidez dos materiais poliméricos finais(58,59).
Os plastificantes mais comuns são líquidos de baixa massa molar, constituídos por pequenas moléculas. Acredita-se que essas pequenas moléculas ao ocuparem posições entre grandes cadeias poliméricas, aumentam a distância efetiva entre elas, atuando como
“lubrificantes” internos, diminuindo então as forças de atrito e de interação intermoleculares entre elas, com isso eles aumentam a mobilidade molecular e consequentemente a flexibilidade dos materiais poliméricos(58,59).
11 Ao escolher um dado tipo ou mesmo uma combinação de plastificantes, devem ser priorizados aqueles que possuírem estrutura(s) e carácter(s) químico(s) compatíveis com a matriz polimérica. Assim, para polissacarídicos, os polióis se mostram mais adequados como plastificantes. No caso específico de fabricação de filmes e membranas de quitosana, o glicerol (Figura 8) é um dos plastificantes mais utilizados. Segundo a literatura, uma concentração entre 10 e 20% (m/m) é a ideal para melhorar a flexibilidade(6,14).
Figura 8: Estrutura molecular do glicerol
2.6. Compósitos e nanocompósitos p oliméricos
Um compósito é considerado como qualquer material multifásico formado por múltiplos domínios de diferentes fases (não gasosas) no qual pelo menos um tipo de domínio de fase é uma fase contínua(60,58). No caso de compósitos poliméricos pelo menos um dos componentes deverá ser um polímero ( em geral a fase contínua). Quando o(s) constituinte(s) da fase dispersa adicionada à matriz polimérica, tiver pelo menos uma dimensão em escala manométrica, o material final poderá ser chamado de nanocompósito polimérico(20, 59).
A fabricação de compósitos poliméricos geralmente visa reforço mecânico (melhora de propriedades como rigidez, tenacidade e outras), mas há situações em que a fase dispersa é usada com a finalidade de enchimento ou preenchimento (redução de custos)(58).
12 Quanto mais elevado o valor do Módulo de Elasticidade do material, mais rígido ele será e consequentemente menor a deformação plástica por ele sofrida sob a ação de uma dada tensão(58).
Materiais com dimensões pequenas em geral possuem altos graus de perfeição, e são virtualmente livres de defeitos, conferindo-lhes resistências mecânicas excepcionalmente elevadas, em especial altos módulos de elasticidade(36). Além disso, alguns nanomateriais com razão de aspecto elevada garantem uma transferência de tensão mais eficaz ao longo do material, ou seja, uma melhor dispersão de tensão(36,58).
Um ganho de reforço também depende de uma forte interação entre os materiais na interface matriz-partícula. Com isso, a compatibilidade entre matriz e a carga de reforço é fundamental, pois ela afeta diretamente a dispersão e distribuição das partículas ao longo da matriz polimérica, como também na adesão entre elas. Quanto mais dispersas, distribuídas e aderidas a matriz, melhor será o reforço exercido pelas partículas, além de diminuir a possibilidade de geração de pontos defeitos ao longo do compósito.
Tang e colaboradores(9) trabalhando com uma quitosana chinesa da marca ZHEIJIANG GOLDEN-SHELL BIOCHEMICAL CO®, de viscosidade 140 MPa e ̅̅̅̅ = 85%, fizeram a dispersão de nanotubos de carbono com dimensões de 10-30nm de comprimentos e 5-15 µm em soluções de quitosana por três diferentes procedimentos: mistura física (G), sonificação (U) e mistura física juntamente com sonificação (GU). Foram utilizadas soluções poliméricas de quitosana 2% (m/v) em acido acético 2% (v/v). Foram preparados três tipos de nanocompósitos empregando G, U e GU, com 2% (m/m) de nanotubos de carbono (sem modificação). De acordos com os autores, ao se utilizar somente o ultrasson, não foi possível dispersar satisfatoriamente os nanotubos de carbono, prejudicando as propriedades mecânicas dos nanocompósitos. Somente com os procedimentos denominados G e GU foram obtidos aumentos de 17% e 45%, respectivamente, na tensão na ruptura em relação ao filme de quitosana pura (sem adição de reforço e aditivos). Porém, a adição de nanotubos de carbono ocasionou a diminuição na elongação dos nanocompósitos, com redução de 60% e 46% na deformação, para G e GU respectivamente.
13 (IKA Ultra- Turres) a 18000 rpm por 30 min. Para o nanocompósito QUI/ MWCNT-COOH(0,8% m/m) foram verificados aumentos de 92% para o módulo de elasticidade e de 98% na tensão na ruptura, porém, com redução de cerca e 61% na deformação. Já para o nanocompósito QUI/ MWCNT-COOH(2,0% m/m), os autores encontraram aumentos de 99% no módulo de elasticidade e 97% na tensão na ruptura, porém com redução em torno de 73% na deformação.
Khan e colaboradores(61) avaliaram o efeito de reforço de NCCs extraídos de fibras comerciais de madeira branqueada provenientes da empresa canadense POINTE-CLAIRE®, numa matriz de quitosana de alta massa molar e com ̅̅̅̅≈88%, da marca KITOMER BIOTECH® . Os autores observaram aumentos de 8,8%, 16,55%, 25,3% e 24% na tensão de ruptura para as concentrações de 1, 3, 5 e 10% (m/m) de NCCs, respectivamente. Para o módulo de elasticidade foram observados aumentos de 46%, 56%,85% e 75% com a adição de 1, 3, 5 e 10% (m/m) de nanocristais de celulose. Já a capacidade de elongação diminuiu com o aumento na concentração de NCCs, sendo observadas deformações de 8,58% no filme de quitosana pura (sem reforço) e de 6,28%, 4,87%, 3,98% e 3,95% para os compósitos preparados com NCC nas concentrações de 1, 3, 5 e 10% (m/m).
Mesquita e colaboradores(62) avaliaram o efeito da adição de 1 a 60% de NCCs numa matriz de quitosana com ̅̅̅̅=92%, proveniente da empresa PHYTOMARE FOOD SUPPLEMENTS®. Eles encontraram aumentos de cerca de 112% e 150% na tensão de ruptura e módulo de elasticidade, respectivamente, para os nanocompósitos contendo 40% (m/m) de NCC. Para o nanocompósito com adição de 60% (m/m) de nanocristais de celulose esses pesquisadores verificaram aumentos em torno de 150% para a tensão máxima e superiores a 160% para o módulo de elasticidade.
2.7. Propriedades mecânicas de materiais poliméricos
A análise das propriedades mecânicas dos materiais fabricados a partir de polímeros é de fundamental importância, uma vez que elas afetam diretamente no seu desempenho e aplicação. Quando comparados a outros materiais como metais e cerâmicos, os polímeros geralmente apresentam resistência mecânica bastante inferior, devido principalmente a sua estrutura e interações intermoleculares entre suas cadeias(63).
14 Existem três maneiras principais pelas quais a força pode ser aplicada: tração, compressão e cisalhamento. Já as seções transversais dos corpos-de prova podem ser circular ou retangular(58).
Nos ensaios de tração, normalmente um dos mais usados, a amostra é deformada, usualmente até a ruptura, por uma força que aumenta gradativamente na direção uniaxial ao longo do eixo maior do corpo-de-prova. O equipamento usado para realização dos ensaios de tração é projetado para alongar o corpo-de-prova, que se encontra preso a uma garra fixa e outra móvel, a uma taxa constante e ao mesmo tempo medir a força instantânea aplicada e o alongamento resultante(58).
O resultado obtido no ensaio é expresso sob a forma de curvas de tensão em função da deformação, sendo que o tipo de polímero ( cristalinidade, presença de ligações cruzadas) o ambiente (umidade relativa do ar e teor de O2(g)), a temperatura e a velocidade do ensaios
influenciam diretamente as formas das curvas. Para polímeros semicristalinos, como a quitosana, a forma da curva de tensão-deformação é similar à curva mostrada na Figura 9 a seguir(58, 59, 63).
0 10 20 30 40
0 20 40 60
Tensã
o(MPa
)
Deformação (%)
região de deformação elástica
ponto de escoamento
ínicio da região de deformação plástica
ponto de ruptura
Figura 9: Curva tensão-deformação típica para Polímeros Semicristalinos
As principais propriedades obtidas nos ensaios de tração são: Módulo de Elasticidade (ou Módulo de Young), Tensão de Escoamento, Tensão e Deformação na Ruptura e Tenacidade(58).
15 i) Módulo de elasticidade
Para a maioria dos materiais metálicos e alguns polímeros, quando submetidos a uma tensão relativamente baixa, a tensão aplicada e a deformação apresentada pelo corpo são proporcionais entre si, de acordo com uma relação conhecida como Lei de Hooke (58, 59):
( 1 ) = E
onde é a tensão aplicada ( N/m2), E constante de proporcionalidade e
é a deformação (adimensional).
A deformação sofrida por um corpo é dada pela equação a seguir:
( 2 ) = Δl/lo
em que Δl = l – lo, l é o comprimento da região útil do corpo-de-prova no instante a ser
medido e lo o comprimento inicial da região útil (58, 59).
A inclinação da região elástica fornece a constante de proporcionalidade, também conhecida como módulo de elasticidade ou módulo de Young (E). O módulo de elasticidade pode ser considerado como uma medida da rigidez ou resistência à deformação elástica. Assim, quanto maior a inclinação da reta na região linear da curva tensão-deformação, mais rígido será o material (59, 59, 66).
O módulo de elasticidade para polímeros são relativamente baixos (entre 0,1-2,0 GPa). Para o aço, fica em torno de 207 GPa e para o Tungstênio, 407 GPa. Para os polímeros semicristalinos que são compostos por regiões cristalinas e amorfas, o módulo de elasticidade pode ser considerado como um tipo de combinação entre os módulos das duas fases(48, 58, 59).
16 ii) Tensão no escoamento
Um material ao sofrer uma deformação permanente pode não funcionar como desejado, torna-se, então fundamental o conhecimento de onde se inicia o afastamento da linearidade (elasticidade)(58).
Para materiais que apresentam escoamento, a tensão máxima que ocorre após o término da região elástica linear (limite ou ponto escoamento), é usada como indicativo de início da deformação permanente. Em geral, quando o ponto de escoamento é atingido observa-se um pequeno ponto de estricção no corpo-de-prova, devido ao ordenamento das cadeias poliméricas levando a um aumento localizado na resistência na curva tensão-deformação. A região após o escoamento, com uma diminuição real da tensão é então denominada região plástica(58, 59, 63).
iii) Limite de resistência à tração (Tensão na ruptura)
O limite de resistência à tração para polímeros corresponde ao ponto onde ocorre a fratura, sendo que o seu valor pode ser maior, menor ou até mesmo igual ao valor encontrado para a tensão máxima no escoamento(58, 59 63).
iv) Ductilidade ( Deformação ( %) na ruptura)
A ductilidade expressa o grau de deformação plástica que foi suportado até a ruptura. Um material que apresenta uma deformação plástica muito pequena, ou mesmo não apresenta nenhuma deformação plástica pode ser considerado frágil. Já materiais poliméricos que apresentam ponto de escoamento nítido e se deformam plasticamente, apresentam comportamento dúctil(58, 59).
A ductilidade pode ser expressa como deformação percentual ( %) sofrida pelo corpo -de-prova até a ruptura:
( 3 ) % = ( lf– lo) / lo
17 v) Tenacidade
A tenacidade pode ser considerada como a habilidade de um dado material absorver energia até a sua ruptura. Para que um material seja tenaz ele deve exibir tanto resistência como ductilidade. A tenacidade pode ser obtida pela área abaixo da curva tensão versus deformação até o ponto de ruptura e sua unidade é energia por volume (J/m3)(58,59, 64).
2.8. Viscosidade
Um fluido pode ser considerado como sendo uma forma de matéria que se deforma ou escoa continuamente sob a ação de uma tensão de cisalhamento ( ). De acordo com o comportamento apresentado em resposta a tensão aplicada e velocidade de cisalhamento, ele pode ser classificado como newtoniano ou não-newtoniano. Se a viscosidade for independente das condições de deformação o fluido será newtoniano, por outro lado se ela variar com a tensão de cisalhamento e a velocidade de deformação aplicada, o fluido será não-newtoniano(16, 65).
De acordo com a equação de Newton para o escoamento viscoso, a viscosidade ( ) de um fluido newtoniano, contido entre duas placas paralelas que se movem segundo o eixo x, e submetido a uma tensão de cisalhamento perpendicular ao deslocamento é dada pelas seguintes relações(51, 58):
( 4 ) = F/A
( 5 ) = dv/dx
( 6 ) = → = /
Sendo: F = força (N), A = área (m2), = taxa de cisalhamento (s-1), dv = taxa de variação da velocidade, dx = taxa de variação da distancia e = coeficiente de viscosidade .
A unidade do coeficiente de viscosidade ( ), também chamado de viscosidade dinâmica ou absoluta no Sistema Métrico Absoluto é o poise (1 P = g/ (cm.s), no sistema SI é o Pa.s ( 1 Pa.s = Kg/m.s= N.s/m2). A conversão de um sistema de unidades para outro e dada por(51,66) :
18 A viscosidade cinemática (υ), por sua vez é uma grandeza definida a partir da
relação entre a viscosidade dinâmica e a densidade ( /ρ ). Sua unidade no Sistema Métrico Absoluto é o stoke (1stoke = 1cm2/s)(66).
( 7 ) = /ρ
As medidas de viscosidade de um líquido, podem ser determinadas por meio de medidas do tempo gasto no seu escoamento através de um tubo capilar, usando as leis de Poiseuille, ou do tempo gasto na queda de um corpo ao percorrê-lo por meio da lei de Stokes. Existem várias expressões para se medir viscosidade e cada uma delas pode ser útil em diferentes contextos(5,51). Na Tabela 1 se encontram alguns tipos de viscosidades com suas respectivas relações:
Tabela 1:Tipos de Viscosidades e suas respectivas relações
Nome Símbolo Equação Unidade
Viscosidade relativa
ηrel ηrel= η(soluçao) /η(solvente) Adimensional
Viscosidade especifica
ηesp ηesp= [η(soluçao) - η(solvente)] /η(solvente)
ηesp= ηrel-1
Adimensional
Viscosidade reduzida
ηred ηred= ηesp / C ( concentraçao) mL.g-1
Viscosidade inerente
ηine ηine=ln (ηrel)/C mL.g-1
Viscosidade intríseca
[η] [η] = ηesp/ C → 0 mL.g-1
Também existem vários tipos de viscosímetros baseados nas Leis de Poiseuille e de Stokes. A escolha de qual modelo adotar vai depender das características do líquido que se
deseja estudar. Dentre os viscosímetros mais conhecidos têm-se o Viscosímetro de Oswald
que segue as leis de Poiseuille e é usado para substâncias de baixa a média viscosidade, e o
Viscosímetro de Höppler que segue a Lei de Stokes para substâncias mais viscosas(67).
Quase todos os polímeros lineares, como a quitosana (QUI), o poliproprileno (PP) e
o poliestireno (PS) em determinadas faixas de concentração podem ser considerados como
fluidos newtonianos e com isso a sua viscosidade intrínseca pode ser relacionada com a
massa molar viscosimétrica média, através da equação de Staudinger- Mark- Houwink(5,
51,65, 68)
.
( 8 ) [η] = K ( V
19 K e a são constantes determinadas experimentalmente para um dado sistema polímero-solvente em uma determinada temperatura. A viscosidade intrínseca [ ] é obtida através da extrapolação do gráfico da viscosidade reduzida versus concentração, sendo definida como:
( 9 ) [ ] = ( red) x C → 0
20
3.
OBJETIVOS:Este trabalho de mestrado teve como objetivo avaliar a eficiência da dispersão de cargas nanométricas (nanotubos de carbono e naocristais de celulose) em soluções de quitosana (com diferentes massas molares e graus de acetilação médios), bem como estudar a influência dessas nanocargas nas propriedades termomecânicas das matrizes de quitosana com o preparao de nanocompósitos poliméricos (binários e ternários).
Objetivos específicos:
i) Modificação e caracterização de MWCNT-COOHs por tratamento ácido
ii) Caracterização dos NCCs obtidos por hidrólise ácida da polpa de eucalipto, fornecidos pelo grupo de pesquisa liderado pelo coorientador deste projeto. iii) Estudos das soluções de quitosana/plastificante e das suspensões de
quitosana/plastificante/nanocargas.
iv) Fabricação de filmes de quitosana, usando duas amostras com diferentes graus de desacetilação (GD) e massas molares viscosimetricas ( ̅̅̅̅̅), sem adição de agente de reforço, variando-se apenas a concentração de plastificante (glicerol): 0%, 10%, 15%, 20% e 25% (m/m).
v) Fabricação dos filmes dos nanocompósitos binários e ternários com a adição de diferentes concentrações de agentes de reforço MWCNT-COOHs e/ou NCCs, tendo como matrizes poliméricas os sistemas quitosanas com glicerol 10% (m/m).
21
4.
PARTE EXPERIMENTAL4.1. Reagentes
Foram usadas duas quitosanas comerciais como matrizes poliméricas, sendo uma da marca Polymar® (CE, Brasil) e outra da Sigma- Aldrich® (St. Louis, U.S.A.), ambas não possuíam especificações dos fabricantes quanto a massa molar média e grau de acetilação (GA). A quitosana Polymar® segundo fabricante é basicamente proveniente da quitina dos exoesqueletos de camarões enquanto a da Sigma-Aldrich® é derivada das carapaças de caranguejos e siris.
Como agentes de reforço foram usados o nanotubo de paredes múltiplas (MWCNT) C-tube 100 da marca coreana CNT-CO®, que sofreu modificação química de superfície por meio de tratamento ácido e nanocristais de celulose (NCC’s) em suspensão aquosa, obtidos a partir de tratamentos químicos da fibras de celulose de eucalipto.
A água ultrapura usada no preparo das soluções poliméricas foi obtida a partir de um sistema Mili-Q® lotado na infraestrutura do Depto. de Química da UFMG.
Os demais reagentes ácidos, básicos e o plastificante utilizados no presente trabalho se encontram listados na Tabela 2, eles não foram submetidos à tratamentos prévios, a não ser quando especificado.
Tabela 2: Reagentes usados nos procedimentos experimentais
Reagentes Marca
Glicerol Synth®
Àcido Ácetico Glacial Vetec®
Hidróxido de Amônio Synth®
Ácido Sulfúrico Synth®
Ácido Nítrico Synth®
Peroxido de Hidrogênio Vetec®
4.2. Purificação das amostras de quitosanas
22 Figura 10: Amostras de quitosanas (a) Sigma-Aldrich e (b) Polymar
De modo geral a quitosana possui aspecto esbranquiçado, porém, como pode ser observado na foto acima, a quitosana da marca Polymar (Figura 10 b) apresenta uma coloração marrom, devida possivelmente a um processo de despigmentação pouco eficiente. É comum submeter quitosanas comerciais a processos de purificação para remoção de resíduos oriundos da reação de desacetilação e moagem. No caso das amostras usadas neste trabalho, somente a quitosana da Polymar® passou por purificação, pois a nível macroscópico, era possível detectar a presença de impurezas. Já a quitosana da Sigma-Aldrich® foi usada como recebida, pois de acordo com o fabricante possuia teor de pureza superior a 99%.
Para a purificação na forma neutra da quitosana comercial Polymar®, foram solubilizados 10 g do polímero em 3 L de solução de ácido ácetico 2% (v/v) sob agitação por 24h. Após esse período foram feitas filtrações à vácuo em papel de filtro de filtração rápida, média e lenta respectivamente para remoção de impurezas. As soluções filtradas foram neutralizadas com NH4OH até o pH próximo de 8, para permitir a preciptação da
quitosana. O precipitado obtido foi lavado com água destilada até o pH próximo de 6,8 e em seguida colocado numa placa de vidro e seco a estufa á vácuo a 60º C durante 24h . Por último, a quitosana recristalizada seca à vácuo foi submetida a uma moagem num moinho de facas.
4.3. Funcionalização dos nanotubos de carbono de parede múltipla (MWCNTs)
A modificação química da superfície dos nanotubos de carbono ocorreu por meio de tratamento ácido, sendo que para cada 3g de MWCNTs foram adicionados 176 mL da mistura HNO3/H2SO4 (3:1, v/v). O balão contendo o MWCNTs e a mistura ácida foi
acoplado a um agitador mecânico sob agitação 430 rpm e o sistema foi submetido ao banho de ultrasson a 50ºC por 3h. A amostra de nanotubos funcionalizados obtida (MWCNT-COOH) foi filtrada a vácuo e lavada sucessivas vezes até a água da lavagem atingir o pH da água destilada.
23
4.4. Extração dos nanocristais de celulose ( NCCs)
A extração dos nanocristais de celulose (NCCs) a partir da polpa de eucalipto compreendeu três etapas, como mostrado a seguir:
i) Deslignificação da polpa de eucalipto:
A hidrólise da lignina da polpa celulósica ocorreu por meio de tratamento com NaOH 2% (m/m) e aquecimento a 90ºC. A quantidade de solução e o tempo gasto dependeram da quantidade de massa celulósica. As fibras celulósicas deslignificadas obtidas nesta etapa foram filtradas e lavadas com agua destilada.
ii) Branqueamento das fibras deslignificadas
O branqueamento das fibras deslignificadas foi feito à 90ºC durante 3h, sendo que para cada 50 g de fibras, adicionou-se solução tampão pH= 4 (ácido acético/ clorito de sódio ( NaClO2)), até completar o volume de 1L. Após a etapa de branqueamento, foi feita nova
filtração, seguida de lavagens até o pH da água de lavagem atingir o pH água destilada. A fibra branqueada foi então seca a temperatura ambiente e depois triturada usando liquidificador.
iii) Hidrólise ácida das fibras deslignificadas e branqueadas.
Na última etapa, a fibra branqueada foi submetida à hidrólise ácida com H2SO4 65%
(v/v) á 50ºC em banho-maria sob agitação mecânica constante até adquirir uma coloração marrom, indício de fim da reação.
24
Figura 11: Fotografia dos Nanocristais de celulose (NCCs) dispersos em água (a) sob luz natural (b) sob luz polarizada
4.5. Preparo dos fluidos poliméricos para fabricação dos filmes de quitosana com diferentes concentrações de glicerol
Para a fabricação dos filmes com diferentes concentrações de glicerol e sem adição de agente de reforço, as massas de quitosana foram primeiramente solubilizadas em soluções aquosas de ácido acético.
Depois de 14h de agitação ocorreu então a adição do glicerol (plastificante), nas concentrações : 0%, 10%, 15%, 20% e 25% (m/m), mantendo-se a agitação por mais 8h. Por último, todas as soluções foram submetidas ao ultrassom de pontas, 6min para as soluções da Polymar® e 8 min para as da Sigma-Aldrich®.
Para a fabricação dos fluidos poliméricos da quitosana Polymar® (precurssores do nanocompósitos) foram usados 0,75 g do polímero e 0,0833 g de glicerol em 35 mL de solução de ácido acético 2% (v/v). Já para o preparo dos fluidos poliméricos da Sigma-Aldrich® adicionou-se 0,50 g do polímero e 0,05 g de glicerol em 50 mL de solução de ácido acético 5% (v/v).
4.6. Preparo dos fluidos poliméricos para fabricação dos nanocompósitos
Para a fabricação de todos os nanocompósitos com a adição de agentes de reforço (MWCNT-COOHs e/ou NCCs), como já mencionado anteriormente, foram escolhidas como precursoras das matrizes poliméricas as soluções de quitosana com adição de glicerol na concentração 10% (m/m), visando melhorar a processabilidade dos mesmos.
Para facilitar a descrição dos diferentes sistemas, adotou-se a nomenclatura a seguir:
QUIP: solução/matriz de quitosana Polymar com adição de glicerol 10% (m/m) QUIS: solução/matriz de quitosana Sigma-Aldrich com adição de glicerol 10% (m/m)
25 Para o preparo das dispersões/fluidos poliméricos precursores dos nanocompósitos, foram adicionadas às soluções QUIP e QUIS, as diferentes massas dos agentes de reforço (MWCNT-COOH(s) e/ou NCC(aq)) dispersos em 10 mL de solução de ácido ácetico (2% ou
5% v/v) com auxílio do ultrassom de pontas por 2 min.
Por último, os fluidos finais contendo quitosana/glicerol/agente de reforço, também foram submetidos ao ultrassom de pontas, por 6min para os preparados com a quitosana da Polymar® e 8 min para os preparados com a quitosana da Sigma-Aldrich®.
4.7. Fabricação de filmes quitosana sem reforço e dos nanocompósitos
Todos os filmes deste trabalho foram obtidos por evaporação do solvente ( técnica
Casting). Os fluidos poliméricos foram depositados em placas de acrílico de 9 cm de
diâmetro, que foram colocadas em estufa por 2 dias. Os fluidos da quitosana Polymar® foram secos a 40°C e os fluidos da quitosana Sigma-Aldrich® a 50°C. Depois de formados e ainda acondicionados nas placas, os filmes foram colocados por 2h em estufa à vácuo a 50°C para remoção de solvente residual.
Devido as soluções de quitosana da Sigma-Aldrich® serem mais viscosas do que as soluções da Polymar®, a dispersão dos agentes de reforço nessa primeira matriz ficou limitada. Por isso, utilizou-se concentrações de nanotubos de carbono até 0,5% (m/m) e nanocristais de celulose até 10% (m/m). Na Tabela 3 estão listados os sistemas obtidos com adição de 0-25% (m/m) de glicerol e na Tabela 4 são descritos os nanocompósitos preparados a partir das matrizes poliméricas contendo 10% (m/m) de glicerol, QUIP e QUIS, com as respectivas concentrações de agente de reforço.
Tabela 3: Filmes de quitosana com variação na concentração de glicerol ( sem adição de agente reforço)
Filmes de quitosana com variação na conc.
de glicerol
Quitosana Polymar® Quitosana Sigma-Aldrich®
Filmes sem adição de agente de reforço
QUI / Glicerol (0%) QUI / Glicerol (10%) = QUIP QUI / Glicerol (15%) QUI / Glicerol (20%) QUI / Glicerol (25%)
26 Tabela 4: Descrição dos Nanocompósitos Poliméricos de Quitosana contendo 10% (m/m) de glicerol (QUIP e QUIS) com adição de MWCNT-COOHs e/ou NCCs como agentes de reforço.
Nanocompósitos Amostras preparadas com a matriz QUIP (Polymar®)
Amostras preparadas com a matriz QUIS ( Sigma-Aldrich®)
Binários contendo
MWCNT-COOHs
QUIP / MWCNT-COOH (0,1%) = PA1 QUIP/ MWCNT-COOH (0,5%) = PA2 QUIP / MWCNT-COOH (0,8%) = PA3 QUIP / MWCNT-COOH (1,2%) = PA4 QUIP / MWCNT-COOH (2,0%) = PA5 QUI P/ MWCNT-COOH (3,0%) = PA6
QUIS / MWCNT-COOH (0,1%) = SA1 QUIS/ MWCNT-COOH (0,3%) = SA2 QUIS / MWCNT-COOH (0,5%) = SA3
Binários contendo NCCs
QUIP / NCC (1%) = PB1 QUIP / NCC (5%) = PB2 QUIP / NCC (10%) = PB3 QUIP / NCC (15%) = PB4 QUIP / NCC (25%) = PB5
QUIS / NCC (1%) = SB1 QUIS / NCC (5%) = SB2 QUIS/ NCC (10%) = SB3
Ternários contendo
MWCNT-COOH e
NCCs
(MWCNT-COOH conc. fixa 0,5% (m/m))
QUIS/ MWCNT-COOH (0,5%) / NCC (1%) = SC1 QUIS/ MWCNT-COOH (0,5%) / NCC (5%) = SC2 QUI S/MWCNT-COOH (0,5%)/NCC (10%) = SC3
Ternários contendo MWCNT-COOH e NCCs
(MWCNT-COOH conc. fixa 0,8% (m/m))
QUIP / MWCNT-COOH (0,8%) / NCC (1%) = PD1 QUIP / MWCNT-COOH (0,8%) / NCC (5%) = PD2 QUIP / MWCNT-COOH (0,8%) / NCC (10%) = PD3 QUIP / MWCNT-COOH (0,8%) / NCC (15%) = PD4 QUIP / MWCNT-COOH (0,8%) / NCC (25%) = PD5
Ternários contendo
MWCNT-COOH e
NCCs
(MWCNT-COOH conc. fixa 2,0% (m/m))
QUIP / MWCNT-COOH (2,0%) / NCC (1%) = PE1 QUIP / MWCNT-COOH (2,0%) / NCC (5%) = PE2 QUIP / MWCNT-COOH (2,0%) / NCC (10%) = PE3 QUIP / MWCNT-COOH (2,0%) / NCC (15%) = PE4 QUIP / MWCNT-COOH (2,0%) / NCC (25%) = PE5
4.8. Espectroscopia de Ressonância Magnética Nuclear de Hidrogênio (RMN 1H)
A espectroscopia de RMN 1H foi utilizada para estimar o grau médio de acetilação ( ̅̅̅̅) das amostras de quitosanas, ou seja, o percentual de grupos acetamidos residuais que permaneceram presentes na cadeia polimérica após a reação de desacetilação da quitina.
De acordo com o procedimento descrito por Signini e colaboradores(70), o grau médio de acetilação pode ser calculado através da Equação 10, que relaciona a razão das áreas dos picos na região em trono de 2,1 ppm (devido aos núcleos de hidrogênio metílicos do grupo acetamida -A1 CH3, do carbonona posição 8 na estrutura da quitosana) e a região
próxima de 3,2 ppm (relativo ao hidrogênio na posição 2 do anel de glucosamino -A2 CH).
( 10 ) % ̅̅̅̅ =
27 Para a obtenção dos espectros de RMN 1H foram preparadas soluções de quitosana das marcas Polymar® e Sigma-Aldrich®, nas concentrações de 15 mg/mL e 7 mg/mL ( em D2O:HCl, na proporção de 99:1), respectivamente. Os sistemas foram homogeinizados em
agitador magnético em frascos lacrados por 18h.
As análises das soluções de quitosana foram realizadas à 25°C num espectrômetro BRUKER-AVANCE DPX® de 200 MHz, pertencente a infraestrutura do Departamento de Química/UFMG.
4.9. Medidas viscosimétricas
As massas molares viscosimétricas médias (
V
M ) das quitosanas foram determinadas por viscosimetria capilar em regime diluído. Soluções “mães” de concentração igual a 10 g/L para a quitosana Polymar® e 1 g/L para a quitosana da Sigma-Aldrich® foram preparadas em tampão com pH≈ 4,5 (0,3 mol/L ácido acético/ 0,2 mol/L acetato de sódio) de acordo com os procedimentos descritos nos trabalhos de Santos e colaboradores(17) e de Rinaudo(24). A partir destas soluções “mães”, outras soluções de concentrações diferentes foram obtidas por diluição.
As viscosidades relativas ( rel) das soluções foram medidas com base no tempo de
escoamento de alíquotas fixas de 6 mL, utilizando-se um viscosímetro de Ostwald de 100 mL. A partir dos valores de rel , as viscosidades reduzidas ( red = sp/c) foram calculadas e
construídos os gráficos de sp/c em função da concentração para cada amostra.
Pela extrapolação da reta ajustada até a diluição infinita tem-se a viscosidade
intrínseca [ ] (Equação 11). E então a massa molar viscosimétrica média ( V
M ) é calculada
através da equação de Mark-Howink-Sakurada(51) (Equação 12).
( 11 ) [ ] =
( 12 ) [ ] = K ̅̅̅̅̅a

![Tabela 6: Valores dos parametros de ̅̅̅̅, [η], ̅̅̅̅̅ e Icr das amostras de quitosana](https://thumb-eu.123doks.com/thumbv2/123dok_br/15131208.13376/57.892.110.800.763.891/tabela-valores-dos-parametros-icr-das-amostras-quitosana.webp)