Lesão de isquemia e reperfusão no transplante renal:
paradigmas hemodinâmico e imunológico
Ischemia and reperfusion injury in renal transplantation:
hemodynamic and immunological paradigms
Lúcio Roberto Requião-Moura1, Marcelino de Souza Durão Junior1,
Ana Cristina Carvalho de Matos1, Alvaro Pacheco-Silva2
RESUMO
A lesão de isquemia e reperfusão é um evento inevitável no transplante de rim, tendo como consequências retardo na função do enxerto, aumento no tempo de hospitalização e dos custos, aumento no risco de rejeição aguda e potencial impacto negativo na evolução a longo prazo. Atualmente, vários fatores estão implicados na fisiopatologia da lesão de isquemia e reperfusão, podendo ser didaticamente divididos em dois paradigmas: hemodinâmico e imunológico. O paradigma hemodinâmico é classicamente descrito como a privação de oxigênio pela interrupção do fluxo sanguíneo, envolvendo diversos sistemas hormonais e pela produção de radicais livres de oxigênio após a reperfusão. O paradigma imunológico tem sido descrito mais recentemente e envolve as células do sistema imune, sobretudo as células T, como papel fundamental na lesão. De acordo com esses conceitos, novas estratégias de prevenção dos impactos da lesão de isquemia e reperfusão têm sido estudadas, especialmente formas mais fisiológicas de preservação do órgão, como a preservação em máquina de perfusão e o uso de anticorpos depletores de linfócitos antes da reperfusão. A perfusão em máquina reduz a prevalência de retardo na função do enxerto e o tempo de hospitalização, além de melhorar a sobrevida do enxerto a longo prazo. Já o uso de anticorpos depletores de linfócitos, como Timoglobulina®, antes da reperfusão, pode diminuir a prevalência de retardo na função do enxerto e a disfunção crônica do mesmo.
Descritores: Traumatismo por reperfusão; Isquemia; Função retardada do enxerto; Rejeição de enxerto; Perfusão/utilização
ABSTRACT
Ischemia and reperfusion injury is an inevitable event in renal transplantation. The most important consequences are delayed graft function, longer length of stay, higher hospital costs, high risk of acute rejection, and negative impact of long-term follow-up. Currently, many
factors are involved in their pathophysiology and could be classified into two different paradigms for education purposes: hemodynamic and immune. The hemodynamic paradigm is described as the reduction of oxygen delivery due to blood flow interruption, involving many hormone systems, and oxygen-free radicals produced after reperfusion. The immune paradigm has been recently described and involves immune system cells, especially T cells, with a central role in this injury. According to these concepts, new strategies to prevent ischemia and reperfusion injury have been studied, particularly the more physiological forms of storing the kidney, such as the pump machine and the use of antilymphocyte antibody therapy before reperfusion. Pump machine perfusion reduces delayed graft function prevalence and length of stay at hospital, and increases long-term graft survival. The use of antilymphocyte antibody therapy before reperfusion, such as Thymoglobulin™, can reduce the prevalence of delayed graft function and chronic graft dysfunction.
Keywords: Reperfusion injury; Ischemia; Delayed graft function; Graft rejection; Perfusion/utilization
INTRODUÇÃO
A lesão renal aguda (LRA) de etiologia isquêmica é a forma mais comum de doença renal intrínseca em adul-tos, estando associada a desfechos clínicos adversos e a
altas taxas de mortalidade.(1) A incidência de LRA em
pacientes internados varia entre 2 a 7%, podendo ser superior a 10% em pacientes internados em unidades
de terapia intensiva.(2) A mortalidade dos pacientes com
LRA em rins nativos, atualmente, é da ordem de 50%,
variando de 30 a 70%.(3,4) Do ponto de vista
fisiopato-lógico, a doença isquêmica do túbulo renal era
consi-1 Hospital Israelita Albert Einstein, São Paulo, SP, Brasil. 2 Universidade Federal de São Paulo, São Paulo, SP, Brasil.
Autor correspondente: Lucio Roberto Requião Moura – Gestão de Transplantes, Hospital Israelita Albert Einstein – Rua Monsenhor Henrique Magalhães, 96, casa II laranja, 1o andar – Morumbi
CEP: 05653-110 – São Paulo, SP, Brasil – Tel.: (11) 2151-0432 – E-mail: lrequiao@einstein.br Data de submissão: 5/5/2014 – Data de aceite: 8/2/2015
derada como resultante da hipóxia tecidual.(5) Ao se
observar que, com o restabelecimento do fornecimento de oxigênio ao tecido lesado, não ocorria o restabeleci-mento imediato da filtração glomerular, estudos passa-ram a demonstrar dois importantes conceitos: primeiro que a reperfusão após a isquemia fazia parte da fisiopa-togenia da lesão, por meio da geração de espécies livres de oxigênio, com modificações no ambiente celular do túbulo renal; segundo que se fazia necessário um de-terminado tempo para recuperação da estrutura tubu-lar.(1,5,6) Dessa forma, a lesão de isquemia e reperfusão
(LIR) passou a ser o mecanismo fisiopatogênico central da LRA isquêmica, com a participação de diversos
sis-temas hormonais.(5,6)
Na última década, porém, o conhecimento da fi-siopatogenia da LIR foi ampliado, identificando com-ponentes do sistema imunológico como mediador da lesão.(7-11) Assim, a hipóxia é o insulto inicial e
desenca-deador da LIR, mas a abordagem de um novo paradig-ma para essa lesão envolve células do sisteparadig-ma imune, principalmente células T e moléculas de ativação e ade-são celular, o paradigma imunológico. Apesar de pouco frequente em rins nativos, a LIR é um evento inevitável em transplantes de órgãos sólidos. A relação entre mor-talidade e LIR está bem estabelecida em rins nativos, porém não é tão clara no transplante de rim, e não é possível afirmar que a LIR seja um fator independente de mortalidade nessa modalidade de tratamento − ape -sar de haver relação com aumento no risco de rejeição aguda (RA) e de perda do enxerto renal a longo prazo. Dessa forma, apresentaremos aqui algumas considera-ções sobre a LIR no transplante renal.
PARADIGMA HEMODINÂMICO
O paradigma hemodinâmico da LIR no transplante de órgãos parte do princípio de que os fatores centrais en-volvidos na LIR são o desbalanço entre oferta e con-sumo de oxigênio no enxerto, o que envolve o manejo do doador, sobretudo o doador em morte encefálica; as variáveis relacionadas à retirada do órgão; a forma de preservação; o tempo que o órgão permanece sem circulação sanguínea; e os efeitos da reperfusão. Re-sultados clínicos com transplante renal podem ser in-fluenciados pelo tempo prolongado de armazenagem do órgão, o que se correlaciona com o atraso inicial na função do enxerto, complicações com o manejo da imu-nossupressão e tempo de hospitalização, entre outros desfechos.(6)
Entre a retirada do órgão do doador falecido até a reperfusão no receptor, o tecido renal é exposto a dois processos diferentes: isquemia quente e isquemia fria.
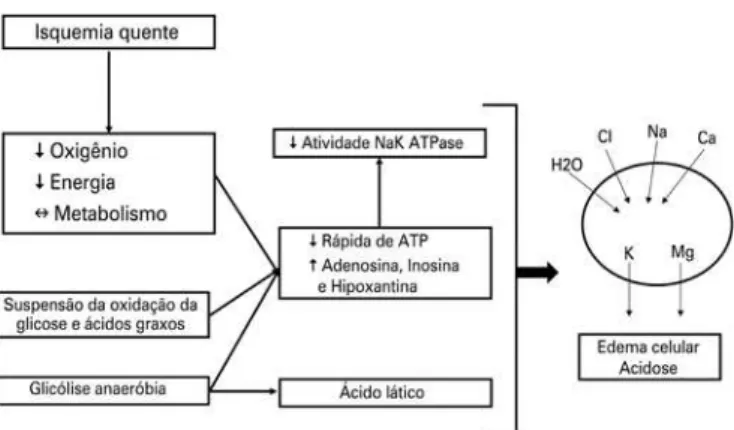
O tempo de isquemia quente é definido pelo período entre o clampeamento da artéria no doador até a per-fusão com solução de preservação. Esse é o período em que o dano celular é mais evidente. Durante a isque-mia quente, ocorre a interrupção abrupta da oferta de oxigênio para as células, com consequente redução do metabolismo aeróbico, suspensão da oxidação de glico-se e ácidos graxos, e transferência da glicóliglico-se para a via anaeróbia, o que reduz, de forma significativa, a quan-tidade de trifosfato de adenosina (ATP) intracelular (Figura 1). Com pouco ATP disponível, ocorre redução da atividade da Na/K/ATPase, com desbalanço hidroe-letrolítico entre o intra e o extracelular, favorecendo a formação de edema celular. Além disso, o metabolismo anaeróbio aumenta substancialmente a quantidade de ácido lático, causando queda no pH intracelular. Estu-dos mostram que rins expostos a mais de 1 hora de is-quemia quente tornam-se inviáveis e, quando por mais que 5 minutos, já estão associados com os desfechos
desfavoráveis da LIR.(1,6) O período correspondente à
perfusão do enxerto até o desclampeamento da anas-tomose no receptor é o tempo de isquemia fria (TIF).
NAK ATPase: bomba de sódio e potássio ATP dependente; H2O: água; Cl: cloro; Na: sódio; Ca: cálcio; K: potássio; mg: magnésio; ATP: trifosfato de adenosina.
Figura 1. Impacto da isquemia quente no ambiente intracelular
PARADIGMA IMUNOLÓGICO
Existem pelo menos cinco linhas de evidências de-monstrando a participação dos linfócitos T e de suas moléculas de superfície na lesão: (1) linfócitos são
en-contrados nos tecidos após isquemia;(10,11) (2) citocinas
classicamente produzidas por essas células estão
am-plamente expressadas no tecido (upregulation) após a
lesão;(12,13) (3) moléculas como CD11/CD18 e ICAM-1,
responsáveis pela adesão leucocitária, são mediadores
de LIR experimental;(13-15) (4) o linfócito T é mediador
de LIR em fígados murinos;(16) (5) o bloqueio de vias de
CTLA4, reduz significantemente os impactos da lesão
em modelos experimentais.(17)
Corroborando essas evidências, um elegante
experi-mento realizado em camundongos knockout para
célu-las T CD4+/CD8+ demonstrou que, na ausência do
fe-nótipo CD4+, a LIR era dramaticamente atenuada.(18)
Os mecanismos de ativação do linfócito T na LIR pro-postos seguem, por sua vez, três linhas de evidências: (1) ativação do linfócito T de forma aloantígeno inde-pendente; (2) mobilização do linfótico T da circulação para o local da lesão, por meio da migração transendo-telial; e (3) agressão ao tecido-alvo do insulto inicial.
Especula-se que espécies reativas de oxigênio pode-riam modificar a estrutura de moléculas próprias,
tor-nando-as antigênicas.(19) Após alcançar o sítio da lesão,
não se sabe qual o papel desempenhado pelo linfócito. Lai et al., entretanto, demonstraram que a infiltração de células T ocorre na primeira hora após o insulto, per-manecendo no tecido por cerca de 4 horas e deixando o tecido livre após 24 horas, modelo que passou a ser chamado de hit-and-run.(11)
ASPECTOS CLÍNICOS
Clinicamente, a LIR no transplante renal manifesta-se como o retardo na função do enxerto (RFE), apesar de não haver um consenso para sua definição clínica. Em um estudo que analisou 65 publicações, entre 1984 e 2004, que abordavam a definição de RFE, os autores identificaram 18 diferentes definições baseadas em dois critérios: necessidade de diálise após o transplante ou a não ocorrência de redução da creatinina, entretanto os parâmetros objetivos, como tempo de diálise após o transplante ou taxa de redução da creatinina, variaram
enormemente (Tabela 1).(20) Essa ausência de
padroni-zação nos conceitos tem dificultado estabelecer dados precisos, como a prevalência e seu impacto em desfechos de curto e longo prazo.
O RFE é a complicação mais comum no período pós-transplante imediato com doador falecido, afetan-do de 8 a 50% desse tipo de transplante nos Estaafetan-dos
Unidos, chegando a 80% no Brasil.(21,22) Em estudo
rea-lizado pelo nosso grupo com pacientes transplantados de rim de doador falecido entre 2000 a 2005 no Hospital Israelita Albert Einstein e na Universidade Federal de São Paulo, observamos prevalência de RFE de 58,6%. Quando comparamos esses pacientes àqueles que tam-bém receberam enxertos de doador falecido, mas que tiveram função imediata, observamos que pacientes com mais de 50 meses em diálise antes do transplante tiveram risco de RFE 42% maior do que aqueles com menor tempo em diálise, e que TIF superior a 24 horas
aumentou em 57% esse risco.(23) Apesar do tempo de
isquemia quente ser mais lesivo ao órgão, com equipes capacitadas, hoje em dia, raramente esse tempo ultra-passa 5 minutos, sendo o TIF uma das principais
va-riáveis relacionadas com o RFE.(21-24) Há aumento na
incidência de RFE da ordem de 8% para cada
aumen-to de 6 horas no TIF.(23) Outros fatores, como
compa-tibilidade do sistema de HLA (sigla do inglês human
leukocyte antigen), doador de critério expandido (ou
idade do doador isoladamente), raça e sexo do receptor, Tabela 1. Diferentes definições utilizadas para retardo na função do enxerto
Definições Estudos Pacientes
Definições baseadas em diálise
Necessidade de diálise na primeira semana após o transplante
41 259.251
Necessidade de diálise na primeira semana após o transplante, desde que rejeição hiperaguda e complicações vasculares ou urológicas sejam afastadas
2 760
Necessidade de diálise após o transplante 2 737
Necessidade de diálise nos primeiros 10 dias após o transplante
1 41
Ausência de qualquer tipo de função renal que imponha necessidade de 2 ou mais diálises na primeira semana após o transplante
1 547
Necessidade de diálise na primeira semana após o transplante, tendo-se excluído uma única diálise imediatamente após o transplante, caso tenha sido indicada por hipercalemia
1 319
Retorno à diálise de manutenção nos primeiros 4 dias após o transplante
1 263
Definições baseadas na creatinina
Aumento na creatinina ou redução <10% nos 3 dias consecutivos após o transplante
5 1471
Redução da creatinina <30% e/ou creatinina urinária <1.000mg no segundo dia de transplante
2 401
Creatinina >2,5mg/dL no sétimo dia após o transplante 1 99
Tempo necessário para o clearance de creatinina ser >10mL/min superior a 1 semana
1 843
Não redução da creatinina nas primeiras 48 horas, na ausência de rejeição
1 291
Combinação
Não redução da creatinina sérica a níveis inferiores aos do pré-transplante, mesmo com volume urinário adequado
1 158
Aumento da creatinina nas primeiras 6-8 horas após o transplante ou volume urinário <300mL, a despeito de volemia adequada e uso de diuréticos
1 143
Diálise após o transplante ou creatinina >150mcmol/L 8 dias após o transplante
1 112
Volume urinário <1,0L em 24 horas e <25% de redução na creatinina nas primeiras 24 horas após o transplante
1 244
Volume urinário <75mL/hora nas primeiras 48 horas ou não redução na creatinina >10% nas primeiras 48 horas
1 66
Necessidade de diálise na primeira semana após o transplante ou não redução na creatinina nas primeiras 24 horas após o transplante
também têm sido implicados na associação com
intensi-dade da LIR após o transplante renal.(21,23-25)
O RFE ocasiona hospitalização prolongada, au-mento dos custos e maior complexidade no manejo de
drogas imunossupressoras.(26-29) O aumento no tempo
de hospitalização causado adiciona cerca de US$ 25.000
por paciente no custo do transplante.(29) Outra
conse-quência imediata é a dificuldade no manejo inicial dos imunossupressores, especialmente os inibidores da
cal-cineurina e os inibidores da mTOR (mammalian target
of rapamycin).(30) Especula-se ainda que o RFE esteja
associado ao risco de RA, bem como a disfunção crô-nica do enxerto (DCE). Alguns estudos têm observa-do correlação de prevalências entre RFE e RA, senobserva-do que o risco de RA pode ser duplicado em pacientes que
apresentam RFE.(21-23,24). Na figura 2, estão
apresenta-das as associações entre RFE e RA, de acordo com o tempo de transplante. Na barra da esquerda estão apre-sentadas as incidências de RA de acordo com RFE ou função imediata do enxerto entre 628 pacientes
trans-plantados na cidade de São Paulo (SP).(23) Nas demais
barras (demonstradas com o símbolo # na figura 2) estão demonstradas as incidências de RA entre o trans-plante e a alta hospitalar, entre a alta e 6 meses após o transplante, e os episódios de RA ocorridos após a alta
hospitalar e até 6 meses de transplante.(21)
diferença de função, entretanto, pode comprometer a
sobrevida do enxerto. Troppman et al.(31) observaram
que RFE, na ausência de RA, não teve influência nos
desfechos clínicos. Ojo et al.,(21) entretanto, observaram
uma redução de 14% na sobrevida do enxerto após 1 ano de transplante de pacientes com RFE que não tiveram RA.
ESTRATÉGIAS PARA ATENUAR OS EFEITOS DA LESÃO DE ISqUEMIA E REPERFUSÃO
Do ponto de vista hemodinâmico, cuidado adequado com o doador, sobretudo para evitar instabilidade he-modinâmica e necessidade de grandes quantidades de drogas vasoativas, evitar grandes variações eletrolíticas e reduzir o TIF, são estratégias eficazes em reduzir a prevalência de LIR. Ainda como estratégias de melho-ra hemodinâmica, a preservação adequada do órgão também tem impacto positivo. Com o objetivo de ate-nuar o impacto negativo dos efeitos celulares da priva-ção de oxigênio (Figura 1), são utilizadas soluções de preservação e resfriamento do órgão. As soluções de preservação tentam mimetizar o ambiente eletrolítico e osmótico intracelular, com o objetivo de estabilizar a membrana plasmática, evitar o edema e reduzir ao mí-nimo possível o dano celular ocasionado pela isquemia
e pela acidose.(32) Além disso, os rins a serem
implanta-dos são preservaimplanta-dos à temperaturas tão baixas quanto 4°C, o que reduz as taxas de metabolismo em 90 a 95% e, com isso, diminui o consumo de ATP e o desvio do
metabolismo para as vias anaeróbias.(1,24,32)
Duas estratégias de perfusão de solução de preser-vação podem ser utilizadas: a estática, na qual o rim é preservado com solução hipotérmica e acondicionado em recipientes termoprotetores, ou a perfusão mecâni-ca contínua, que, além de utilizar a solução hipotérmi-ca de preservação, mantém fluxo pulsátil dessa solução circulando no enxerto, mimetizando a circulação de
fluxo sanguíneo.(33,34) A perfusão mecânica parece estar
associada à redução dos impactos negativos da LIR. Em um estudo conduzido por Moers et al., 672 rins de 336 doadores falecidos foram pareados 1:1 para os dois
tipos diferentes de perfusão.(33) Houve redução na
pre-valência de RFE (30,1% para 22,9%; p=0,03), de au-sência primária da função do enxerto (4,8% para 2,1%; p=0,08) e do tempo em RFE (13 para 10 dias; p=0,04), ou seja, os resultados foram favoráveis à perfusão me-cânica. Em análise multivariada, o uso dessa estratégia reduziu em 43% o risco de RFE. Ao final de um ano de seguimento (94% x 90%; p=0,04) e de 3 anos (91% x 87%; p=0,04), a sobrevida do enxerto foi significati-vamente melhor nos pacientes que receberam rins de perfusão mecânica.(33,34)
FIE: função imediata do enxerto; RFE: retardo na função do enxerto; RA: rejeição aguda; m: meses; NS: não significativo.
Figura 2. Correlação de prevalências entre retardo na função do enxerto e rejeição aguda
Quando se avaliam desfechos de longo prazo, como DCE ou sobrevida do enxerto, é discutível se o RFE, isoladamente, teria impacto negativo ou se o impacto seria causado pelo efeito da RA ou das duas variáveis superajuntadas. Nós avaliamos a influência do RFE na função renal de pacientes transplantados com doador falecido e observamos pior função, por meio das
medi-das dos clearance de creatinina, em até 2 anos de
No Brasil, a estratégia de preservação utilizada em larga escala é a perfusão estática. Recentemente, nos-so grupo começou a utilizar uma estratégia mista: re-cebemos os rins em perfusão estática, que é a forma distribuída pela central de transplante, e mantemos o rim em preservação mecânica pulsátil até o momento da cirurgia. O racional para colocar o rim na máqui-na mesmo após o perfusão estática é de que, dentro do paradigma hemodinâmico, observam-se alterações re-gionais no fluxo sanguíneo, o que pode ser comprovado pelo aumento da resistência vascular intrarrenal, com
consequente redução do fluxo plasmático.(35) A análise
dos primeiros transplantes realizados com essa estraté-gia mista (colocar o rim na máquina, após a perfusão es-tática) demonstrou redução significativa na resistência intrarrenal nas primeiras 6 horas de perfusão mecânica (Figura 3A), tendo como consequência aumento signi-ficativo no fluxo intrarrenal (Figura 3B). Em ambas as figuras, T0 foi o momento em que o rim iniciou a perfu-são em máquina, ou seja, final do TIF em perfuperfu-são está-tica e Tf o tempo final de perfusão em máquina. O tem-po entre T0 e Tf entre esses pacientes foi 9,3 horas. Não observamos redução na prevalência de RFE, entretanto nesses primeiros casos avaliados houve redução signi-ficativa no tempo em diálise após o transplante, com
consequente redução no tempo de internação hospita-lar (Figura 4). Observamos redução no tempo de inter-nação de 21,4±12,6 dias para 12,8±6,0 dias (p=0,03), bem como tendência à redução do tempo em diálise de 8,0±7,8 dias para 4,4±6,1 dias (p=0,20).
Figura 4. Tempo de internação e tempo em diálise (tempo D) após o transplante com a máquina de perfusão
No contexto do paradigma imunológico, uma série de trabalhos, tanto experimentais quanto clínicos, de-monstraram o benefício do uso de drogas depletoras de leucócitos ou de anticorpos dirigidos contra molécu-las de adesão, atenuando os efeitos da LIR. Com base nesses conceitos, Yokota et al., em estudo experimen-tal, demonstraram que o uso de anticorpos depletores de células T CD4+ em camundongos atenuou a LIR, e que esse efeito foi potencializado pela realização de
timectomia prévia à lesão.(36) Tendo evoluído o
conheci-mento dos principais mecanismos de ação dos anticor-pos antilinfocitários ALA, principalmente na depleção linfocitária e como moduladores das células T, em para-lelo com o crescente conhecimento do papel das células T na LIR, houve um interesse em avaliar o benefício desses anticorpos. O anticorpo policlonal direcionado contra timócitos de humanos (ATG) é o anticorpo po-liclonal mais estudado e tem como características uma ação rápida, antígeno-específica, com consequente de-pleção e modulação da resposta imune. Os benefícios do uso de ATG na LIR estariam suportados pela redu-ção da massa de linfócitos circulantes e pelo bloqueio do maquinário necessário para a migração do linfócito para o sítio da lesão.(37)
Beiras-Fernandez et al., utilizando um modelo de LIR em primatas não humanos, demonstraram que o uso de ATG reduziu significativamente a infiltração de
T0: momento em que o rim iniciou a perfusão em máquina; Tf: tempo final de perfusão em máquina.
Figura 3. Hemodinâmica intrarrenal após o uso da máquina de perfusão
A
leucócitos no tecido conectivo, vaso, tecido perivascular
e no próprio músculo.(38) Esses achados traduziram-se
em menores escores de lesão, com menor índice de ne-crose, áreas de hemorragia e áreas de infiltração difusa, tanto no tecido muscular quanto no tecido conectivo dos animais que utilizaram a droga. Todos esses concei-tos deram suporte para o uso de ATG com o objetivo de reduzir os efeitos da LIR. Goggins et al. confirmaram essa hipótese, demonstrando que o uso da dose ante-rior ao desclampeamento da anastomose vascular re-duziu significantemente a ocorrência de RFE (14,8% x 35,5%), entretanto esses resultados não foram
reprodu-zidos em outros estudos.(39) Comparamos duas coortes
de pacientes pareadas, sendo que uma utilizou indução
com Timoglobulina® e outra não, e não observamos
re-dução na prevalência de RFE.(40)
CONCLUSÃO
A lesão de isquemia e reperfusão no transplante renal, hoje em dia, é entendida à luz de dois diferentes para-digmas: hemodinâmico e imunológico. Além da clássica privação da circulação, com redução da atividade aeró-bica e da lesão causada pelos radicais livres de oxigênio na reperfusão e o envolvimento dos sistemas hormonais, tem-se discutido o envolvimento do sistema imune na gênese da lesão de isquemia e reperfusão, sobretudo o papel central das células T e suas moléculas de super-fície. O manejo adequado de doadores, a redução nos tempos de isquemia quente e fria, e as estratégias mais fisiológicas de armazenagem dos rins estão relacionados com redução do impacto da lesão de isquemia e reperfu-são na evolução do transplante renal. De igual modo, o bloqueio do sistema imune por meio da depleção das cé-lulas T ativadas, bem como a neutralização das molécu-las de superfície dessas célumolécu-las, com o uso de anticorpos policlonais depletores de linfócitos, pode ter um papel protetor dos enxertos e este ainda é um campo de explo-ração para melhorar os desfechos em curto e longo pra-zo, sobretudo no transplante renal de doador falecido.
REFERÊNCIAS
1. Molitoris BA. Ischemic acute renal failure: exciting times at our fingertips. Curr Opin Nephrol Hypertens. 1998;7(4):405-6.
2. Waikar SS, Liu KD, Chertow GM. Diagnosis, epidemiology and outcomes of acute kidney injury. Clin J Am Soc Nephrol. 2008;3(3):844-61.
3. Hsu CY, Chertow GM, McCulloch CE, Fan D, Ordoñez JD, Go AS. Nonrecovery of kidney function and death after acute on chronic renal failure. Clin J Am Soc Nephrol. 2009;4(5):891-98.
4. Coca SG, Yusuf B, Shlipakmg, Garg AX, Parikh CR. Long-term risk of mortality and other adverse outcomes after acute kidney injury: a systematic review and meta-analysis. Am J Kidney Dis. 2009;53(6):961-73. Review.
5. Brady H, Singer GG. Acute renal failure. Lancet. 1995;346(8989):1533-40. Review.
6. Tilney NL, Guttmann RD. Effects of initial ischemia/reperfusion injury on the transplanted kidney. Transplantation. 1997;64(7):945-7.
7. Lucinskas FW, Ma S, Nusrat A, Parkos CA, Shaw SK. Leukocyte transendothelial migration: a junctional affaire. Semin Immunol. 2002;14(2):105-13. Review. 8. Rabb H, O’Maera YM, Maderna P, Coleman P, Brady HR. Leukocytes, cell
adhesion molecules and ischemic acute renal failure. Kidney Int. 1997; 51(5):1463-8. Review.
9. Molitoris BA, Marss J. The role of cell adhesion molecules in ischemic acute renal failure. Am J Med. 1999;106(5):583-92. Review.
10. Pinheiro HS, Camara NOS, Noronha IL, Maugeri IL, Franco MF, Medina JO, et al. Contribution of CD4+ T cells to the early mechanisms of ischemia-reperfusion injury in a mouse model of acute renal failure. Braz J Med Biol Res. 2007;40(4):557-68.
11. Lai LW, Yong KC, Igarashi S, Lien YHH. A Sphingosine-1-phosphate type 1 receptor agonist inhibits the early T-Cell transient following renal ischemia-reperfusion injury. Kid Int. 2007;71(12):1223-31.
12. Bacon KB, Permack BA, Gardner P, Schall TJ. Activation of dual T cell signaling pathways by the chemokine RANTES. Science. 1995;269(5231):1727-30. 13. Takada M, Nadeu KC, Shaw GD, Marquette KA, Tilney NL. The citokine-adhesion
molecule cascade in ischemia-reperfusion injury of the rat kidney. Inhibition by a soluble P-selectin ligand. J Clin Invest. 1997;99(11):2682-90. Review. 14. Rabb H, Mendiola CC, Saba SR, Dietz JR, Smith CW, Bonventre JV, et al.
Antibodies to ICAM-1 protect kidneys in severe ischemic reperfusion injury. Biochem Biophys Res Commun. 1995;211(1):67-73.
15. Kelly KJ, Williams WW, Colvin RB, Meehan SM, Springer TA, Gutierrez-Ramos JC, et al. Intercellular adhesion molecule-1-deficient mice are protected against ischemic renal injury. J Clin Invest. 1996;97(4):1056-63.
16. Zwacka RM, Zhang Y, Halldorson J, Schlossberg H, Dudus L, Engelhardt JF. CD4+ T-lymphocytes mediate ischemia/reperfusion-induced inflammatory responses in mouse liver. J Clin Invest. 1997;100(2):279-89
17. Takada M, Chandraker A, Nadeu KC, Sayeh MH, Tilney NL. The role of B7 costimulatory pathway in experimental cold ischemia/reperfusion injury. J Clin Invest. 1997;100(5):1199-203.
18. Burne MJ, Daniels F, Ghandour A, Mauiyyedi S, Colvin RB, O’Donnell MP. Identification of the CD4+ T Cell as a major pathogenic factor in ischemic acute renal failure. J Clin Invest. 2001;108(9):1283-90.
19. Land WG. The role of postischemic reperfusion injury and other nonantigen-dependent inflammatory pathways in transplantation. Transplantation. 2005; 79(5):505-14. Review.
20. Yarlagadda SG, Coca SG, Garg AX, Doshi M, Poggio E, Marcus RJ, et al. Marked variation in the definition and diagnosis of delayed graft function: a systematic review. Nephrol Dial Transplant. 2008;23(9):2995-3003. 21. Ojo AO, Wolf RA, Held PJ, Prot FK, Schmouder RL. Delayed graft function:
risk factors and implications for renal allograft survival. Transplantation. 1997; 63(7):968-74.
22. Azevedo LS, Castro MC, Carvalho DB. Incidência de função retardada do enxerto em transplantes renais no Brasil. J Bras Transp. 2004;7:82-5. 23. Requião-Moura LR, Durão Mde S, Tonato EJ, Matos AC, Ozaki KS, Câmara
NO, et al. Effects of ischemia and reperfusion injury on long-term graft function. Transplantation Proceedings. 2011;43(1):70-3.
24. Pfaff WW, Howard RJ, Patton PR, Adams VR, Rosen CB, Reed AI. Delayed graft function after renal transplantation. Transplantation. 1998;65(2):219-23. 25. Shoskes DA, Halloran PF. Ischemic injury induces altered MHC gene
expression in kidney by an interferon-gamma-dependent pathway. Transplant Proc. 1991;23(1 Pt 1):599-601.
26. Shoskes DA, Cecka JM. Deleterious effects of delayed graft function in cadaveric renal transplant recipients independent of acute rejection. Transplantation. 1998;66(12):1697-701.
27. Almond PS, Troppmann C, Escobar F, Frey DJ, Matas AJ. Economic impact of delayed graft function. Transplant Proc. 1991;23(1 Pt 2):1304.
of prolonged delayed graft function on long-term graft outcome in cadaveric kidney transplantation. Clin Transplant. 1994;8(2 Pt 1):101-6.
29. Freedland SJ, Shokes DA. Economic impact of delayed graft function and suboptimal kidneys. Transplantation Rev. 1999;13(1):23-30.
30. Cravedi AU, Codreanu I, Satta A, Turturro M, Sghirlanzoni M, Remuzi G, et al. Cyclosporine prolongs delayed graft function in kidney transplantation: are rabbit anti-human thymocyte globulin the answer? Nephron Clin Pract. 2005;101(2):c65-71.
31. Troppman C, Gillingham KJ, Gruessner RW, Dunn DL, Payne WD, Najarian JS, et al. Delayed graft function in the absence of rejection has no long-term impact A study of cadaver kidney recipients with good graft function at 1 year after transplantation. Transplantation. 1996;61(9):1331-7
32. Ploeg RJ. Kidney transplantation with the UW and Euro-Collins solutions. A preliminary report of a clinical comparison. Transplantation. 1990;49(2):281-4. 33. Moers C, Smits JM, Maathuis M-HJ, Treckmann J, van Gelder F, Napieralski
BP, et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Eng J Med. 2009;360(1):7-19.
34. Moers C, Pirenne J, Paul A, Ploeg RJ; Machine Preservation Trial Study Group.
Machine perfusion or cold storage in deceased-donor kidney transplantation. N Eng J Med. 2012;366(8):770-1.
35. Bonventre JV, Yang L. Cellular pathophysiology of ischemic acute kidney injury. J Clin Invest. 2011;121(11):4210-21. Review.
36. Yokota N, Daniles F, Crosson J, Rabb H. Protective effect of T cell depletion in murine renal ischemia-reperfusion injury. Transplantation. 2002;74(6):759-63. 37. Mueller TF. Thymoglobulin: an immunologic overview. Curr Opin Organ
Transplant. 2003;8(4):305-12.
38. Beiras-Fernandez A, Chappell D, Hammer C, Thein E. Influence of polyclonal anti-thymocyte globulins upon ischemia-reperfusion injury in a non-human primate model. Transplant Immunology. 2006;15(4):273-9.
39. Goggins W, Pascual M, Powelson J, Magee C, Tolkoff-Rubin N, FarrellmL, et al. A prospective, randomized, clinical trial of intraoperative versus postoperative thymoglobulin in adult cadaveric renal transplant recipients. Transplantation. 2003;76(5):798-802.