UFMG/ICEx/DQ. 1090ª T. 497ª
Plínio César de Carvalho Pinto
Carbonatação Mineral de Resíduos Sólidos Industriais e Urbanos ricos em Ca (II): escória de aciaria, pó de clínquer e resíduos de gesso
Belo Horizonte 2015
iii | P á g i n a
“A ciência humana de maneira nenhuma nega a existência de Deus. Quando considero quantas e quão maravilhosas coisas o homem compreende, pesquisa e consegue realizar, então reconheço claramente que o espírito humano é obra de Deus, e a mais notável”
iv | P á g i n a
AGRADECIMENTOS
Agradeço a Deus por ter me dado a paz, a saúde e a inspiração para realização deste trabalho. Por me fazer perceber que nesta trajetória de quatro anos da minha vida, o mais importante não foram as palavras e Figuras registradas neste documento, tampouco os artigos científicos que serão publicados nas revistas internacionais. Graças a Deus, descobri que o essencial na minha carreira como pesquisador serão os valores, a paixão e a vontade que ele semeou em meu coração, que me farão dedicar a minha vida à educação e a ciência para transformação social do nosso país. Aos meus pais pela luta e dedicação que sempre tiveram na minha criação. Ao amor e carinho, que me deram a base sólida para seguir nos caminhos retos da vida. E ao meu irmão pela amizade e o apoio que sempre me fez acreditar no valor da família.
Ao meu orientador Geraldo M. de Lima pelo empenho na minha formação científica, pelo apoio incondicional nos trabalhos de laboratório e pela amizade.
Ao professor Luciano A. Montoro pela realização das medidas de microscopia eletrônica de varredura no Centro de Microscopia da UFMG.
À Ana Paula pela colaboração nas medidas de espectroscopia de Infravermelho e espectroscopia Raman no Laboratório de Tecnologias Ambientais do DQ/UFMG.
À Paula pela realização das medidas de carbono inorgânico total no Laboratório de Tecnologias Ambientais do DQ/UFMG.
À Prof. Luiza M. P. Dolabella pelo empréstimo de reagentes e pelas discussões teóricas sobre as técnicas de titulação e fotometria de chama usadas neste trabalho.
Aos alunos de Iniciação Científica (Tamíris, Fabiano, Cristiane, Vinícius, Gabriela, Mariana, Rayane, Arthur, Lucas e Layane) que trabalharam comigo durante o doutorado. Eles me ajudaram a entender que o essencial no laboratório não é o resultado e sim a vida das pessoas.
v | P á g i n a Jeferson, Lenka e vários outros, que me deram a satisfação de conviver com eles e que de alguma forma ajudaram na realização deste trabalho.
A todos os funcionários da Química (biblioteca, secretaria, oficinas, laboratórios, portaria, cantina, xerox), que contribuíram direta e indiretamente na realização deste trabalho.
vi | P á g i n a
SUMÁRIO
LISTA DE SÍMBOLOS E ABREVIATURAS ... x
RESUMO ... xi
ABSTRACT ... xii
LISTA DE TABELAS... xiii
LISTA DE FIGURAS ... xv
1 INTRODUÇÃO E OBJETIVOS ... 1
1.1 Revisão bibliográfica ... 1
1.1.1 Ciclo de carbono ... 1
1.1.2 Efeito estufa ... 4
1.1.3 Aquecimento global e Mudanças climáticas ... 5
1.1.4 Políticas públicas mundiais sobre Mudanças Climáticas... 7
1.1.5 Tecnologias de Captura e Armazenamento de Carbono... 8
1.1.6 Conversão química de CO2 ... 23
1.1.7 Carbonatação mineral ... 24
1.1.8 Carbonatação de resíduos industriais e urbanos ... 27
1.2 Objetivos ... 36
1.3 Relevância e justificativa ... 36
2 PARTE EXPERIMENTAL ... 37
2.1 Materiais e reagentes ... 37
2.2 Procedimentos ... 38
2.2.1 Caracterização química e física dos materiais sólidos e das soluções aquosas ... 38
vii | P á g i n a 2.2.3 Novo método de integração da captura de CO2 com a carbonatação
mineral e regeneração dos reagentes ... 44
2.2.4 Carbonatação mineral de pó de forno de clínquer ... 48
2.2.5 Carbonatação mineral de resíduos de gesso e produção de sulfato de amônio ... 48
2.2.6 Estudo preliminar de viabilidade técnica, econômica, comercial e do impacto ambiental e social da carbonatação mineral de escória de aciaria ... 49
3 RESULTADOS E DISCUSSÕES ... 50
3.1 Caracterização química e física de escória de aciaria ... 50
3.2 Lixiviação de escórias de aciaria ... 52
3.2.1 Seleção do melhor reagente ... 52
3.2.2 Influência dos parâmetros de lixiviação na extração de íons cálcio de escórias de aciaria com cloreto de amônio ... 56
3.2.3 Etapas de reação na lixiviação de escórias com cloreto de amônio ... 57
3.2.4 Caracterização química dos resíduos de escória após a lixiviação com cloreto de amônio 0,5 mol L-1 ... 59
3.3 Precipitação de carbonato de cálcio com injeção de gás carbônico em lixiviados de escória com cloreto de amônio ... 61
3.3.1 Caracterização química dos sólidos produzidos na carbonatação com injeção de CO2 ... 64
3.4 Precipitação de carbonato de cálcio com adição de carbonato de sódio em lixiviados de escória com cloreto de amônio ... 71
3.4.1 Caracterização química dos sólidos produzidos na carbonatação com a adição de carbonato de sódio ... 74
3.5 Conclusão parcial... 77
3.6 Novo método de integração da captura de CO2 com a carbonatação mineral e regeneração dos reagentes ... 78
viii | P á g i n a 3.6.2 Caracterização química dos sólidos produzidos nos testes de
captura de CO2 com diferentes soluções salinas amoniacais ... 90
3.6.3 Preparo da solução de lixiviação e do NaHCO3 da captura de CO2 com uma solução salina amoniacal (8 % NH3 e 26 % NaCl) ... 92
3.6.4 Lixiviação de escórias de aciaria com a solução de NH4Cl produzida na captura de CO2 ... 95
3.6.5 Precipitação de carbonato de cálcio após a lixiviação com a solução de NH4Cl sem HCO3- da captura de CO2 ... 98
3.6.6 Ciclos de lixiviação de Ca2+ de escórias e precipitação de CaCO3 através do reuso da solução de lixiviação ... 100
3.6.7 Regeneração final dos reagentes (cloreto de sódio e amônia) .. 112
3.7 Ciclos de lixiviação de Ca2+ de pó de forno de clínquer e precipitação de CaCO3 através do reuso da solução de lixiviação ... 117
3.7.1 Caracterização química dos materiais da carbonatação mineral de pó de forno de clínquer ... 119
3.8 Carbonatação mineral de resíduos de gesso e produção de sulfato de amônio ... 122
3.8.1 Lixiviação de resíduos de gesso com água ... 124
3.8.2 Caracterização química dos resíduos de gesso durante a lixiviação ... 125
3.8.3 Carbonatação de resíduos de gesso ... 130
3.8.4 Caracterização química dos produtos da carbonatação ... 133
3.8.5 Produção de sulfatos de amônio ... 134
3.8.6 Caracterização química dos sulfatos de amônio ... 135
3.8.7 Rendimento da carbonatação mineral e da produção de sulfato de amônio a partir de resíduos de gesso ... 137
ix | P á g i n a
4 CONCLUSÕES ... 142
5 PRODUÇÃO CIENTÍFICA ... 144
6 SUGESTÕES DE TRABALHOS FUTUROS ... 144
7 REFERÊNCIAS BIBLIOGRÁFICAS ... 146
x | P á g i n a
LISTA DE SÍMBOLOS E ABREVIATURAS
CCD: Charge-Coupled Device CCS: Carbon Capture and Storage CFC: Clorofluorcabonetos
CO2eq: CO2 equivalente
COPs: Conferência das Partes
DQ/UFMG: Departamento de Química da Universidade Federal de Minas Gerais
ECBMR: Enhanced Coal Bed Methane Recovery EOR: Enhanced Oil Recovery
EVTECIAS: Estudo de viabilidade técnica, econômica, comercial e impacto ambiental e social
FGD: Flue-Gas Desulphurization
HCNM: Hidrocarbonetos não metânicos HFC: hidrofluorcabonetos
IGCC: Integrated Gasification Combined Cycle IPCC: Intergovernmental Panel on Climate Change PFC: perfluorcabonetos
SWOT: Strenghts, weaknesses, Opportunities, Threats TCD: Thermal-conductivity detector
xi | P á g i n a
RESUMO
Neste trabalho foi investigada a carbonatação mineral de resíduos de escória de aciaria, pó de forno de clínquer, gesso da construção civil, fosfogesso e gesso FGD (Flue Gas Desulphurization - dessulfurização de gases de exaustão). Estudaram-se o desempenho de vários reagentes e as condições experimentais (concentração, temperatura, tempo, proporção sólido-líquido) para extração de íons cálcio destes resíduos, assim como as condições experimentais para precipitação de carbonato de cálcio através da injeção de CO2 ou adição de carbonato de sódio. Foi estabelecida
uma nova técnica que integra a captura de CO2 com a carbonatação mineral e
regenera mais de 95 % dos reagentes. Além disso, a nova técnica possibilita a reutilização da solução de lixiviação em vários ciclos de lixiviação e carbonatação. Ela foi aplicada com sucesso para escórias de aciaria e pó de forno de clínquer. Também foi estabelecida uma técnica que captura o CO2, converte-o em carbonato de cálcio e
produz sulfato de amônio, a partir da solubilização de resíduos de gesso com água. Em ambas técnicas, carbonato de cálcio é produzido com alto valor comercial devido ao alto grau de pureza, ao tamanho e morfologia dos cristais.
Palavras-chave: carbonatação mineral, carbonato de cálcio, CO2, processo
xii | P á g i n a
ABSTRACT
In this work was investigated the mineral carbonation of steel slag waste, cement kiln dust and gypsum waste: construction gypsum, phosphogypsum and FGD (Flue-Gas Desulphurization) gypsum. It was studied the best reagents and optimal conditions (concentrations, temperature, time, liquid-solid ratio) for extracting calcium ion these residues, as well as the best conditions for calcium carbonate precipitation by CO2 injection or addition of sodium carbonate. A new process that integrates CO2
capture and mineral carbonation has developed with the advantage of regenerating most of starting materials. Furthermore, the new process allows the reuse of the leach solution in several cycles of lixiviation and carbonation. It has been successfully applied to steel slag and cement kiln dust. Finally, a new process that captures CO2
and produces calcium carbonate and ammonium sulphate has been developed, by solubilizing gypsum waste in water.
In both cases, calcium carbonate is produced with high commercial value due to the high degree of purity, size and morphology of crystals.
Keywords: mineral carbonation, calcium carbonate, CO2, Solvay process,
xiii | P á g i n a
LISTA DE TABELAS
Tabela 1: Alguns processos de captura em função da concentração de CO2 e
pressão dos gases de emissão de algumas indústrias e do setor elétrico. Tabela 2: Armazenamento potencial de CO2 de diferentes tecnologias.
Tabela 3: Composição química das escórias de aciaria.
Tabela 4: Carbonatação do lixiviado de escória ácida com ácido cítrico, ácido lático e cloreto de amônio em diversas concentrações.
Tabela 5: Lixiviação de escórias com cloreto de amônio em sistema fechado. Tabela 6: Matriz do Planejamento Composto Central para o estudo de captura de CO2 e precipitação de NaHCO3 de soluções salinas amoniacais.
Tabela 7: Lixiviação de íons cálcio das escórias de aciaria com a solução de NH4Cl produzida na captura de CO2 por uma solução salina amoniacal similar à do
processo Solvay em função da diluição da concentração de amônio e eliminação dos íons HCO3- da solução.
Tabela 8: Concentração de íons no extrato de solubilização de escórias segundo a norma ABNT NBR 10006.
Tabela 9: Composição dos produtos de carbonatações consecutivas com o reuso da escória e da solução de lixiviação, segundo refinamento de Rietveld dos difratogramas.
Tabela 10: Composição dos produtos de carbonatações consecutivas com o reuso da escória e da solução de lixiviação, segundo cálculos teóricos das perdas de massa registradas na análise térmica.
Tabela 11: Concentração de íons metálicos em solução após as lixiviações de pó de forno de clínquer.
Tabela 12: Composições dos produtos das carbonatações consecutivas com o reuso do pó de forno de clínquer e da solução de lixiviação, segundo cálculos teóricos das perdas de massa registradas na análise térmica.
Tabela 13: Características da solução após a lixiviação de resíduos de gesso com água.
xiv | P á g i n a Tabela 15: Matriz do planejamento Composto Central para a carbonatação de resíduo de gesso da construção civil.
xv | P á g i n a
LISTA DE FIGURAS
Figura 1: Representação do Ciclo do carbono e sua alteração pelo homem. Figura 2: Emissões globais antropogênicas de gases de efeito estufa em 2010 (a) e estimativa de emissões brasileiras de gases de efeito estufa em 2010 (b).
Figura 3: Emissões globais (a) e brasileiras (b) de CO2 da queima de
combustíveis fósseis por setor econômico em 2012.
Figura 4: Emissões brasileiras de gases de efeito estufa entre 1990 e 2010. Figura 5: Efeito estufa.
Figura 6: Forçamento radiativo natural e antrópico.
Figura 7: Potencial de redução das emissões de CO2 de diferentes tecnologias.
Figura 8: Tecnologias de captura de CO2.
Figura 9: Sistema de absorção química de CO2 em soluções aquosas de
aminas e regeneração.
Figura 10: Etapas de reação das aminas na captura de CO2.
Figura 11: Sistema de adsorção de CO2 em adsorventes sólidos e dessorção
de CO2 por aumento de temperatura ou abaixamento de pressão.
Figura 12: Sistema de captura de CO2 por permeabilidade seletiva em
membranas.
Figura 13: Separação de CO2 por resfriamento até a sua condensação.
Figura 14: Representação da formação de hidratos de CO2.
Figura 15: Classificação das tecnologias de captura de CO2.
Figura 16: Diagrama de fases do CO2.
Figura 17: Técnica de injeção de CO2 em reservatórios de petróleo para
recuperação de óleo avançada (a) e injeção de CO2 em camadas de carvão para
produção de metano (b).
Figura 18: Armazenamento de CO2 no fundo do oceano.
Figura 19: Principais produtos químicos comerciais sintetizados a partir de CO2.
Figura 20: Carbonatação mineral de rochas e resíduos com altas concentrações de cálcio ou magnésio.
Figura 21: Capacidade de conversão de CO2 em carbonato dos resíduos
xvi | P á g i n a Figura 22: Fluxo simplificado de produção de aço.
Figura 23: Destinação e aplicação dos agregados siderúrgicos no Brasil em 2012.
Figura 24: Fluxo simplificado de produção de cimento.
Figura 25: Processo simplificado de produção de fertilizantes da Fosfértil em Uberaba/MG.
Figura 26: Montagem experimental da captura de CO2 com salmouras
amoniacais.
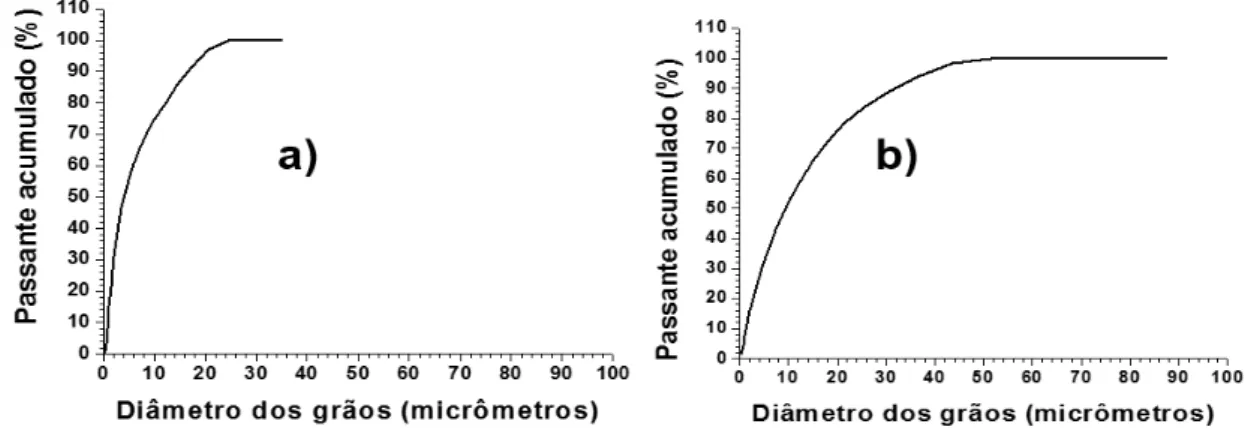
Figura 27: Análise granulométrica por difração de laser da escória ácida (a) e da escória básica (b).
Figura 28: Extração de Ca2+ da escória ácida e pH final de lixiviação de
diferentes reagentes.
Figura 29: Concentração de íons no lixiviado de escória ácida com ácido cítrico, ácido lático e cloreto de amônio 1 mol L-1.
Figura 30: Curvas de equilíbrio das espécies do ácido carbônico em solução aquosa.
Figura 31: Influência dos parâmetros de lixiviação na extração de Ca2+ da
escória ácida com cloreto de amônio 0,3 mol L-1.
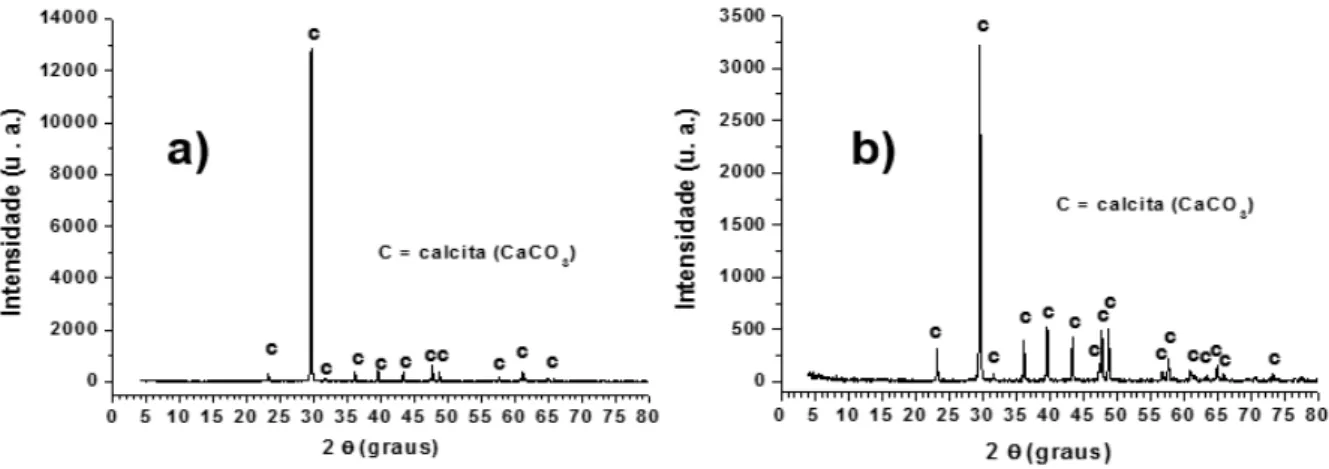
Figura 32: Difratogramas dos resíduos de escória ácida (a) e básica (b) após lixiviação com cloreto de amônio 0,5 mol L-1, 85 °C, 45 min.
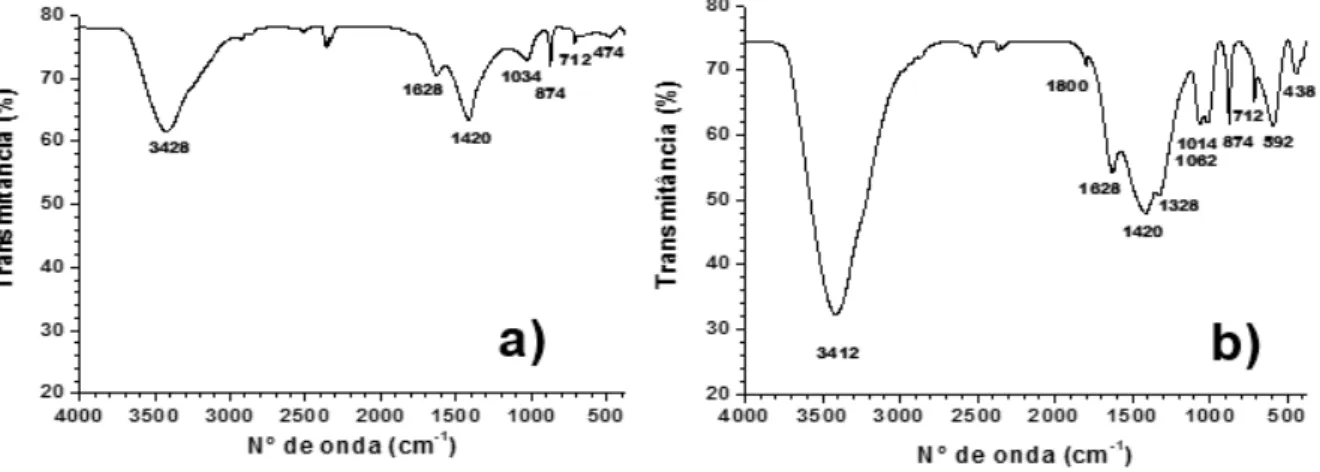
Figura 33: Espectros de infravermelho de escórias ácidas e básicas com seus respectivos resíduos de lixiviação com cloreto de amônio 0,5 mol L-1, 85 °C, 45 min.
Figura 34: Análise térmica dos resíduos de escória após a lixiviação com cloreto de amônio 0,5 mol L-1, 85° C e 45 min.
Figura 35: Fluxograma de precipitação de carbonato de cálcio com injeção de CO2, usando os lixiviados de escórias de aciaria com cloreto de amônio 0,1 mol L-1.
Figura 36: Influência da temperatura e do pH na precipitação de carbonato de cálcio com injeção de CO2, usando 250 mL de lixiviado de escória de aciaria com
cloreto de amônio 0,1 mol L-1.
Figura 37: Difratogramas dos produtos da carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
xvii | P á g i n a Figura 39: Modos vibracionais do grupo carbonato.
Figura 40: Espectros Raman dos produtos da carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
Figura 41: Análise térmica do produto da carbonatação da escória ácida (a) e escória básica (b) com injeção de gás carbônico em atmosfera de argônio.
Figura 42: Difratogramas das impurezas do processo de carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
Figura 43: Espectro de infravermelho das impurezas do processo de carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
Figura 44: Espectro Raman das impurezas do processo de carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
Figura 45: Análise térmica das impurezas do processo de carbonatação da escória ácida (a) e básica (b) com injeção de gás carbônico.
Figura 46: Fluxograma de precipitação de carbonato de cálcio com adição de carbonato de sódio, usando os lixiviados de escórias de aciaria com cloreto de amônio 0,1 mol L-1.
Figura 47: Diagrama de fases da sílica em soluções aquosas básicas.
Figura 48: Difratogramas dos sólidos retidos no filtro em pH 11 do processo de carbonatação da escória ácida (a) e básica (b) com adição de carbonato de sódio.
Figura 49: Espectros de infravermelho dos sólidos retidos no filtro em pH 11 do processo de carbonatação da escória ácida (a) e básica (b) com adição de carbonato de sódio.
Figura 50: Espectros Raman dos sólidos retidos no filtro em pH 11 do processo de carbonatação da escória ácida (a) e básica (b) com adição de carbonato de sódio. Figura 51: Análise térmica do sólido retido no filtro em pH 11 do processo de carbonatação da escória ácida (a) e básica (b) com adição de carbonato de sódio.
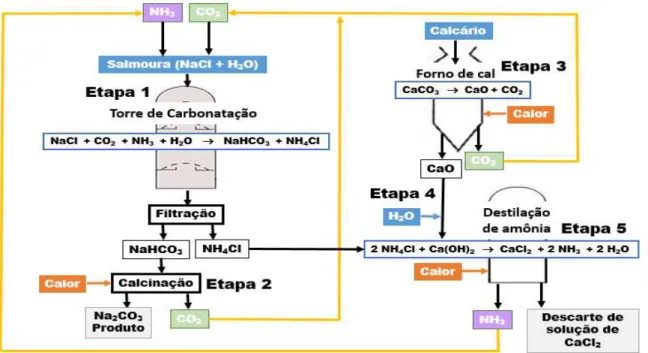
Figura 52: Fluxograma do processo Solvay para produção de carbonato de sódio.
Figura 53: Método de captura de CO2, carbonatação mineral e regeneração dos
reagentes.
Figura 54: Ciclo global de reações do processo de captura e conversão de CO2
em carbonato de cálcio com a regeneração dos reagentes.
xviii | P á g i n a Figura 56: Superfície de resposta e o gráfico de contorno do tempo (min) necessário para a eficiência de captura de CO2 de soluções salinas amoniacais reduzir
de 100 % para 50 %.
Figura 57: Gráfico de Pareto e correlação do tempo (min) necessário para a eficiência de captura de CO2 de soluções salinas amoniacais reduzir de 100 % para
50 %.
Figura 58: Superfície de resposta e o gráfico de contorno da massa de NaHCO3
(g) precipitada em 50 mL de soluções salinas amoniacais.
Figura 59: Gráfico de Pareto e correlação da massa de NaHCO3 (g) precipitada
em 50 mL de soluções salinas amoniacais.
Figura 60: Difratograma do sólido precipitado no ensaio 3 do teste de captura de CO2.
Figura 61: Espectro de Infravermelho do sólido precipitado no ensaio 3 do teste de captura de CO2.
Figura 62: Análise térmica do sólido precipitado no ensaio 3 do teste de captura de CO2.
Figura 63: Difratogramas do NaHCO3 bruto e lavado com água e seco em
estufa.
Figura 64: Espectros de Infravermelho do sólido da captura de CO2 (NaHCO3)
bruto e lavado com água e seco em estufa.
Figura 65: Análise térmica do sólido da captura de CO2 (NaHCO3) bruto e
lavado com água e seco em estufa.
Figura 66: Cinética de decomposição térmica dos íons HCO3- na solução de
NH4Cl da captura de CO2.
Figura 67: Eficiência de precipitação de Ca2+ como CaCO3 em função do
número de mols do reagente adicionado em relação ao número de mols de Ca2+
dissolvidos no lixiviado.
Figura 68: Concentrações de HCO3-, NH4+, Ca2+ e a variação do pH na solução,
no final de cada etapa do processo de reuso da solução e reuso da escória nas lixiviações.
Figura 69: Concentrações de HCO3-, NH4+, Ca2+ e a variação do pH na solução,
xix | P á g i n a Figura 70: Difratogramas dos produtos de carbonatações consecutivas com o reuso da escória e da solução de lixiviação.
Figura 71: Espectros de infravermelho dos produtos de carbonatações consecutivas com o reuso da escória e da solução de lixiviação.
Figura 72: Análise térmica dos produtos de carbonatações consecutivas com o reuso da escória e da solução de lixiviação.
Figura 73: Imagem obtida por microscopia eletrônica de varredura do produto de carbonatação purificado.
Figura 74: Montagem experimental do sistema de regeneração final de amônia e cloreto de sódio.
Figura 75: Variação das concentrações de amônio e hidrogenocarbonato em solução em função do tempo de reação da regeneração de NaCl e NH3 a 102°C.
Figura 76: Difratograma de raios X do cloreto de sódio recristalizado após a regeneração final e evaporação completa da água da solução de lixiviação.
Figura 77: Espectro de infravermelho do cloreto de sódio recristalizado após a regeneração final e evaporação completa da água da solução de lixiviação.
Figura 78: Análise térmica do cloreto de sódio recristalizado após a regeneração final e evaporação completa da água da solução de lixiviação.
Figura 79: Concentrações de HCO3-, NH4+, Ca2+ e a variação do pH na solução,
no final de cada etapa do processo de reuso da solução e reuso do pó de forno de clínquer nas lixiviações.
Figura 80: Difratogramas do pó de forno de clínquer e dos resíduos após as lixiviações com a solução de NH4Cl da captura de CO2.
Figura 81: Análise térmica do pó de forno de clínquer e dos resíduos após as lixiviações com a solução de NH4Cl da captura de CO2.
Figura 82: Difratogramas de produtos das carbonatações do ciclo de reuso da solução de lixiviação aplicado a carbonatação mineral de pó de forno de clínquer.
Figura 83: Análise térmica de produtos das carbonatações do ciclo de reuso da solução de lixiviação aplicado a carbonatação mineral de pó de forno de clínquer.
Figura 84: Processo de conversão de CO2 em carbonato de cálcio a partir de
resíduos de gesso.
xx | P á g i n a Figura 86: Influência da proporção gesso/água na extração de íons cálcio de resíduos de gesso durante a lixiviação com água.
Figura 87: Difratogramas dos resíduos de gesso antes e após a lixiviação com água.
Figura 88: Espectros de infravermelho dos resíduos de gesso antes e após a lixiviação com água.
Figura 89: Representação da unidade básica do sulfato de cálcio dihidratado. Figura 90: Análise térmica dos resíduos de gesso.
Figura 91: Superfície de resposta e gráfico de contorno da massa de CaCO3
(g) precipitada na carbonatação de resíduo de gesso da construção civil.
Figura 92: Gráfico de Pareto e correlação das variáveis que influenciam na precipitação de CaCO3 de resíduo de gesso da construção civil.
Figura 93: Difratogramas dos produtos das carbonatações de resíduos de gesso.
Figura 94: Espectros de infravermelho dos produtos das carbonatações de resíduos de gesso.
Figura 95: Análise térmica dos produtos das carbonatações de resíduos de gesso.
Figura 96: Difratogramas dos sulfatos de amônio produzidos na carbonatação de resíduos de gesso.
Figura 97: Espectros de infravermelho dos sulfatos de amônio produzidos na carbonatação de resíduos de gesso.
Figura 98: Análise térmica dos sulfatos de amônio produzidos na carbonatação de resíduos de gesso.
Figura 99: Fluxograma de desenvolvimento da tecnologia de carbonatação mineral.
Figura 100: Análise SWOT do negócio de carbonatação mineral para indústrias de ferro e aço.
Figura 101: Processo cíclico de aproveitamento de resíduos (calor, CO2 e
xxi | P á g i n a Figura 102: Processo cíclico de captura de CO2, produção de carbonato de
Página | 1
1 INTRODUÇÃO E OBJETIVOS
1.1 Revisão bibliográfica
1.1.1 Ciclo de carbono
O elemento carbono é onipresente na natureza. Seus compostos são constituintes de toda matéria orgânica e são fundamentais na manutenção da vida de todos os seres vivos através da respiração, fotossíntese e da regulação do clima (MARTINS et al., 2003). O carbono pode estar presente na natureza como um gás: gás carbônico (CO2), monóxido de carbono (CO), metano (CH4) e hidrocarbonetos
não metânicos (HCNM). Pode se apresentar como um composto orgânico: carboidrato, proteína, lipídeo, etc. Também pode se apresentar como ácido carbônico (H2CO3), hidrogenocarbonato (HCO3 -) e carbonato (CO3 2-) dissolvidos em água ou
como carbonatos sólidos formados, principalmente de metais alcalinos terrosos (CaCO3 e MgCO3). Dessa forma, o carbono é armazenado e transportado entre os
três compartimentos físicos do planeta Terra: a hidrosfera (oceanos, mares, rios, lagos, águas subterrâneas, vapor de água e gelo), a litosfera (rochas e solo) e a atmosfera (conjunto dos gases) (GLIKSON, 2008; WIKIPEDIA, 2014). A Figura 1 representa o ciclo natural do carbono no planeta Terra e a alteração causada pelas atividades humanas.
Página | 2 O gás carbônico pode ser emitido naturalmente na atmosfera pela decomposição da matéria orgânica, pela respiração de animais e plantas e por atividades vulcânicas. Também pode ser absorvido naturalmente da atmosfera pela fotossíntese, pela formação das rochas sedimentares e do solo e pela acidificação das águas superficiais. Porém, a humanidade tem alterado o ciclo natural do carbono, principalmente, através das atividades agropecuárias e da urbanização, que desmatam as florestas e descobrem o solo (GOVAERTS et al., 2009), e pela queima de combustíveis fósseis para produção de energia e para as atividades industriais (IEA CO2 EMISSIONS, 2013). Em 2010, foram emitidos 49 Gt de gases de efeito estufa
para a atmosfera (IPCC MITIGATION OF CLIMATE CHANGE, 2014). Dados quantitativos deste fenômeno estão apresentados nas Figuras 2, 3 e 4.
Fonte: adaptado de IPCC Mitigation of Climate Change, 2014; MCTI, 2013
Figura 2: Emissões globais antropogênicas de gases de efeito estufa em 2010 (a) e estimativa de emissões brasileiras de gases de efeito estufa em 2010 (b).
Fonte: adaptado de IEA, 2014
Figura 3: Emissões globais (a) e brasileiras (b) de CO2 da queima de
Página | 3
Fonte: MCTI, 2013
Figura 4: Emissões brasileiras de gases de efeito estufa entre 1990 e 2010.
O Brasil tem um histórico de grandes emissões de gases de efeito estufa, principalmente, pelo desmatamento de florestas e queimadas. Porém, elas foram reduzidas drasticamente através do controle do desmatamento da Amazônia e do Cerrado e do incentivo ao manejo de florestas. Em 2010, correspondeu a 22 % das emissões totais de gases de efeito estufa. O setor agropecuário é fortemente emissor de metano e óxido nitroso, principalmente pela fermentação entérica de gado bovino, manejo agrícola dos solos e manejo de dejetos de animais. Em 2010, correspondeu a 35 % das emissões totais de gases de efeito estufa. O setor de tratamento de resíduos é fortemente emissor de metano e CO2 pela decomposição anaeróbica da matéria
orgânica presente nos aterros sanitários, esgotos domésticos e efluentes de indústrias alimentícias. Em 2010, correspondeu a 4 % das emissões totais de gases de efeito estufa. O setor industrial é grande emissor de CO2, principalmente através da indústria
siderúrgica, de cimento e cal e indústria química. Em 2010, correspondeu a 7 % das emissões totais de gases de efeito estufa. O setor de energia é grande emissor de CO2 pela queima de combustíveis fósseis e de emissões fugitivas. Em 2010,
Página | 4 um país modelo, pois 43 % da sua energia é proveniente de fontes renováveis. Em especial, as usinas hidrelétricas que atendem uma demanda de 81 % do consumo de energia elétrica no Brasil (IEA CO2 EMISSIONS, 2013). Logo, a emissão brasileira de
CO2 pela queima de combustíveis fósseis para geração de energia representa uma
parcela menor das emissões totais de CO2 em relação a média global.
1.1.2 Efeito estufa
Para a manutenção da vida dos seres vivos na biosfera do planeta Terra é necessário haver temperaturas médias de 15 °C e a preservação de grande parte da água no estado líquido (TOLENTINO e ROCHA-FILHO, 1998). Esta temperatura média é alcançada graças ao equilíbrio entre fatores que causam o resfriamento e fatores que causam o aquecimento do nosso planeta. A energia proveniente da luz solar, que é composta por radiações eletromagnéticas na região do ultravioleta, visível e infravermelho, incide diretamente na superfície terrestre e aquece-a. Uma parte da energia solar é refletida pelas nuvens, aerossóis e pela própria superfície da Terra e se perde para o espaço contribuindo para o resfriamento da Terra. Uma outra parte da energia solar incidente é irradiada pela Terra como radiação infravermelha e se perderia no espaço. Porém, o planeta Terra possui uma atmosfera densa de gases, que absorvem esta radiação infravermelha e mantém a Terra aquecida como uma estufa. Este fenômeno conhecido como efeito estufa é provocado pela absorção da radiação infravermelha pelos gases do efeito estufa: água, gás carbônico (CO2), gás
metano (CH4), óxido nitroso (N2O), hexafluoreto de enxofre (SF6), clorofluorcabonetos
Página | 5
Fonte: adaptado de CO2CRC Figura 5: Efeito estufa.
1.1.3 Aquecimento global e Mudanças climáticas
Em 1988, foi criado no Estados Unidos pelo Programa das Nações Unidas para o Meio Ambiente e pela Organização Meteorológica Mundial, o Painel Intergovernamental sobre Mudança do Clima (Intergovernmental Panel on Climate Change – IPCC). Este painel é responsável pela revisão científica de todos os aspectos do aquecimento global e mudanças climáticas. Ele conta com a colaboração voluntária de mais de 3500 especialistas de mais de 130 países (IPCC ON LINE, 2014) (PORTAL BRASIL IPCC, 2014). Desde a sua criação o IPCC já divulgou 5 relatórios técnicos nos anos de 1990, 1995, 2001, 2007 e 2014, que descrevem todos os estudos científicos sobre as mudanças climáticas, as suas consequências para a humanidade e o que deve ser realizado para mitigar os efeitos destas mudanças no clima (IPCC ON LINE, 2014).
Página | 6 (chuva), na salinidade do oceano, nos padrões de vento e aspectos de eventos climáticos extremos, como secas, precipitações fortes, ondas de calor e intensidade dos ciclones tropicais (IPCC THE PHYSICAL SCIENCE BASIS, 2013). Dessa forma, os ecossistemas serão modificados e influenciarão na vida de vários seres vivos, podendo levar a extinção ou superpopulação de algumas espécies. Doenças infecciosas transmitidas por insetos e outros animais vetores podem surgir e se espalhar em regiões vulneráveis (DAILY e EHRLICH, 1996; UNEP YEAR BOOK, 2014). Além disso, a disponibilidade de recursos hídricos para fins domésticos e industriais será modificada e poderá afetar a produção de alimentos e a economia mundial (UNEP YEAR BOOK, 2010).
Vários fatores exercem influência sobre o aquecimento da Terra como: a atividade solar, a posição da Terra em relação ao sol, efeito estufa, absorção da radiação solar pela camada de ozônio, aerossóis, atividades vulcânicas, nuvens, trilhas de condensação de aviões, etc. Porém, os cientistas do IPCC têm concluído que a emissão dos gases de efeito estufa contribui para a maior parte do aquecimento global observado nos últimos 50 anos. A medida da influência de um fator na alteração do equilíbrio energético do sistema climático da Terra é expressa através do forçamento radiativo em Watts por metro quadrado. Valores positivos tendem a aquecer a Terra e valores negativos tendem a resfriá-la, segundo a Figura 6.
* NCC: nível de confiança dos modelos climáticos
Fonte: adaptado de IPCC 2013
Página | 7 De acordo com o gráfico de forçamento radiativo, o IPCC tem concluído que o aumento na concentração de gás carbônico na atmosfera proveniente das atividades humanas é o fator predominante no aquecimento global e nas mudanças climáticas (HASSELMANN, et al., 2003).
1.1.4 Políticas públicas mundiais sobre Mudanças Climáticas
Em 1992 foi realizado o primeiro grande reconhecimento político e público para a questão climática através da criação da Convenção-Quadro sobre Mudanças Climáticas, que é debatida anualmente pelos países signatários na Conferência das Partes ou COPs. Atualmente, o IPCC conta com 195 membros. A primeira COP foi realizada em 1995, em Berlim, capital da Alemanha (PLANALTO ON LINE, 2014). Desde então foram amplamente discutidas as informações divulgadas nos relatórios técnicos do IPCC, foram estabelecidas as metodologias para levantamento do inventário das emissões de gases de efeito estufa e o Protocolo de Quioto, que determinava para os países desenvolvidos, uma meta de redução de 5 % das emissões de gases de efeito estufa medidas em 1990, a ser cumprida entre os anos de 1995 a 2012. Porém, o protocolo só foi ratificado em 2005 com 55 países que correspondiam a mais de 55 % das emissões de gases de efeito estufa. Houveram intensas negociações e definições dos mecanismos do Protocolo de Quioto (AMBIENTE BRASIL, 2014). Elas originaram o mecanismo de desenvolvimento limpo, que previa que países com grandes emissões poderiam aumentá-las, sem alterar a emissão global de CO2,financiando projetos de redução das emissões de CO2 em
países com baixas emissões. Criaram-se os sumidouros, que são projetos de reflorestamento para absorção de CO2. Aprovaram-se também a redução de CO2
através do combate ao desmatamento, o mercado de crédito de carbono, o fundo para financiamento de países em desenvolvimento e a adoção de transferência de tecnologias limpas (UOL TERRA, 2014).
Página | 8 1,259 Gt de CO2eq). Ele tornou-se o primeiro país a assumir formalmente uma meta
de controle de emissão de CO2 até 2020 (MCTI, 2013).
Devido às divergências entre os membros, o protocolo de Quioto não foi cumprido, principalmente pelos principais emissores mundiais, Estados Unidos e China, que não quiseram assumir metas de redução de gases de efeito estufa, para não prejudicar o desenvolvimento de suas economias.
A União Europeia (UE) anunciou em outubro de 2014, um acordo de redução de 40 % das emissões de gases de efeito estufa medidos em 1990, a ser cumprido até 2030 (FOLHA ON LINE, 2014). Este é um sinal positivo, mas as negociações com os demais países devem avançar, para que as nações se comprometam e reduzam as emissões globais de gases de efeito estufa em 80 % até 2050. Isto é o que determinam os especialistas do IPCC, para que a temperatura média global não aumente mais do que 2°C (G1 GLOBO, 2014; IEA TECHNOLOGY ROADMAP, 2013).
Em novembro de 2014, China e Estados Unidos firmaram um acordo político importante para combater as mudanças climáticas. A China se comprometeu a reduzir as suas emissões, a partir de 2030, tendo 20 % de energia limpa em sua matriz energética. Por sua vez, o Estados Unidos se comprometeu a reduzir 27 % das suas emissões em relação aos níveis de 2005 (GREENPEACE, 2014). Os dois países são os principais emissores mundiais de gases de efeito estufa (Estados Unidos 16 % e China 29 % das emissões globais). As emissões de gases de efeito estufa da União Europeia correspondem a 11 % das emissões globais. Índia, Japão, Coréia do Sul, Canadá, República Islâmica do Irã e Arábia Saudita completam a lista dos principais emissores de gases de efeito estufa por combustão de combustíveis fósseis (IEA CO2
EMISSIONS, 2013).
1.1.5 Tecnologias de Captura e Armazenamento de Carbono
Página | 9 de energia. A China e a Índia mais do que triplicaram as suas emissões de CO2 entre
1990 a 2011, porque a matriz energética deles é fortemente dependente da combustão de carvão mineral em termoelétricas. Este recurso natural é muito abundante nestes países (IEA CO2 EMISSIONS, 2013).
É evidente que o mundo precisa investir em uma matriz energética baseada em fontes renováveis como a energia solar, energia eólica, geotérmica, biocombustíveis, etc. É necessário também incentivar o consumo consciente (MINISTÉRIO DO MEIO AMBIENTE, 2014) e o aumento da eficiência energética nas máquinas, equipamentos e processos industriais (INSTITUTO NACIONAL DE EFICIÊNCIA ENERGÉTICA, 2014). Porém, esta mudança depende de uma nova visão política e cultural, do estímulo a adoção de uma economia de baixo carbono (MCKINSEY & COMPANY, 2010) e do desenvolvimento científico e tecnológico para aumentar a eficiência e a vantagem econômica das tecnologias limpas.
Enquanto estas mudanças não acontecem e as atividades humanas permanecem emitindo grandes quantidades de gases de efeito estufa, o IPCC tem estimulado a adoção de uma tecnologia denominada Captura e Armazenamento de Carbono (Carbon Capture and Storage – CCS), como forma de reduzir as emissões de CO2. A CCS pode reduzir 17 % das emissões de CO2 até 2050, Figura 7.
Fonte: adaptado de IEA Technology Roadmap, 2013
Página | 10 A CCS é composta de três etapas: 1ª Separação do CO2 de misturas gasosas
(captura de CO2), 2ª Compressão e Transporte do CO2, 3ª Armazenamento do CO2
(JONES, 2011; GIBBINS e CHALMERS, 2010).
1.1.5.1 Captura de CO2
A captura de CO2 é etapa com o maior custo, correspondendo a
aproximadamente 75 % do custo total da CCS (JONES, 2011). Portanto, muita pesquisa tem sido feita para melhorar a eficiência desta etapa e abaixar os custos da CCS. A Figura 8 apresenta um esquema atual das tecnologias de captura de CO2
estudadas.
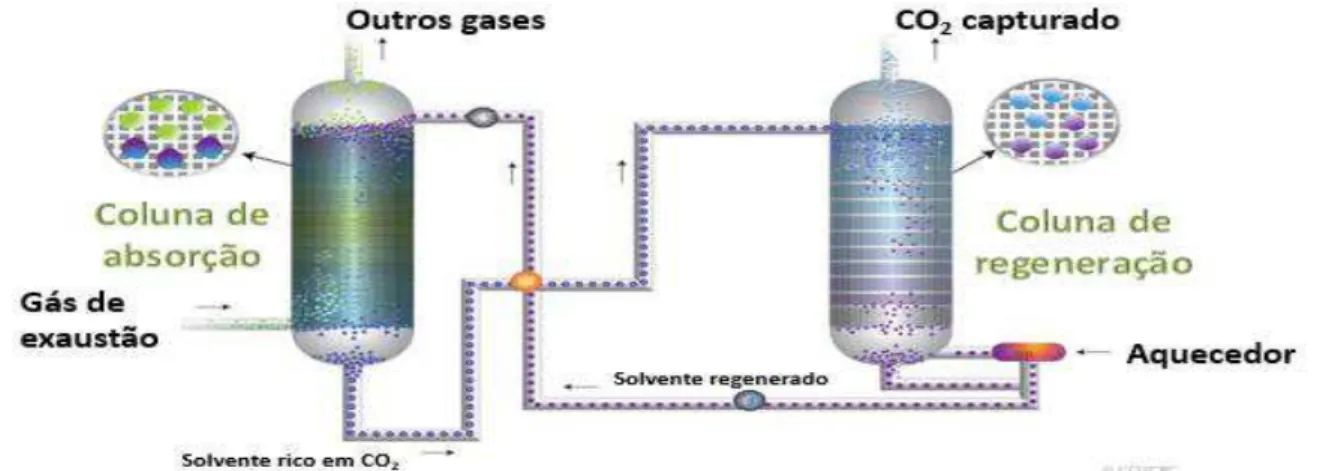
Figura 8: Tecnologias de captura de CO2.
Captura de CO2 por absorção química
A absorção química de CO2 é uma operação unitária em que um solvente em
contato com uma corrente gasosa contendo CO2, solubiliza-o seletivamente.
Geralmente, o fluxo do solvente é contrário ao da corrente gasosa e os equipamentos são projetados para aumentar a superfície de contato e a turbulência, para que ocorra com eficiência a transferência de massa e energia (JUNIOR, 2009). O método comercial mais adotado industrialmente no processamento de gás natural e hidrogênio utiliza soluções aquosas de aminas: monoetanolamina e metildietanolamina (EBNER e RITTER, 2009). A solução de amina captura entre 85 % a 90 % do CO2 em uma coluna de absorção. Esta solução rica em CO2 é bombeada
Página | 11 Figura 9 (MACDOWELL, et al., 2010).
Fonte: adaptado de CO2CRC, 2014 Figura 9: Sistema de absorção química de CO2 em soluções aquosas alcalinas
e regeneração.
As aminas primárias e secundárias capturam o CO2, segundo o esquema de
reações da Figura 10 (a), e as aminas terciárias, de acordo com a Figura 10 (b). A regeneração é realizada pelo aquecimento para decomposição do íon hidrogenocarbonato em CO2 e H2O, recuperando assim a amina (XIE et al., 2010).
Fonte: adaptado de D'Alessandro et al., 2010
Figura 10: Esquema de reações das aminas na captura de CO2.
Página | 12 por volatilização, a temperatura de regeneração e a corrosividade para preservar os equipamentos. Além disso, busca-se aumentar a eficiência e a velocidade de absorção de CO2, a fim de abaixar os custos da captura de CO2.
Captura de CO2 por adsorção
Adsorção é o fenômeno superficial caracterizado pela acumulação ou transferência de massa de uma substância em uma interface líquido, sólido-gás, gás-líquido, entre outras. Ela pode ser dividida em Adsorção física, quando a substância é adsorvida através de interações intermoleculares na superfície do material adsorvente; e Adsorção Química, quando a substância é adsorvida através de ligações químicas na superfície do material adsorvente (IQ/USP ON LINE, 2014; DANTAS, 2009). De maneira geral, a adsorção de CO2 em adsorventes sólidos ou
líquidos, deve ocorrer em pressões elevadas e a dessorção de CO2, deve ser
realizada pelo aumento de temperatura ou abaixamento da pressão, Figura 11.
Fonte: adaptado de CO2CRC, 2014 Figura 11: Sistema de adsorção de CO2 em adsorventes sólidos e dessorção
de CO2 por aumento de temperatura ou abaixamento de pressão.
Para a captura de CO2 por adsorção são empregados processos comerciais
Página | 13 al., 2014), compósitos inorgânicos (SANTOS et al., 2009), derivados de amidinas (Park e Kim, 2010), sais complexos de aminoácidos (LU et al., 2010), óxidos (STANMORE e GILOT, 2005; OZCAN et al., 2014) e hidróxidos (Couling et al., 2012).
Captura de CO2 por separação em membranas
A separação de CO2 de outros gases pode ser realizada por membranas
poliméricas constituídas de acetato de celulose, poliimidas, poliamidas, polivinilamina, entre outros, através da dissolução e difusão de CO2 na membrana. Logo, a
permeabilidade e a seletividade ao CO2 são parâmetros importantes na escolha da
membrana para a captura de CO2 (JONES, 2011). Elas possuem uma menor
eficiência de separação de CO2 em relação a absorção química e necessitam
trabalhar em pressões elevadas, para haver um gradiente de pressão entre as duas faces da membrana, Figura 12. Em geral, membranas poliméricas não são resistentes a elevadas temperaturas, por isso membranas inorgânicas funcionalizadas têm sido estudadas, mas o custo ainda é mais elevado do que as membranas poliméricas (RODDY e YOUNGER, 2010; PLASYNSKI et al., 2009). A resistência mecânica das membranas também é um importante desafio tecnológico para o processamento de gases.
Fonte: adaptado de CO2CRC, 2014 Figura 12: Sistema de captura de CO2 por permeabilidade seletiva em
membranas.
Captura de CO2 biológica
A captura de CO2 também pode ser realizada através da fotossíntese de algas
ou cianobactérias (LI et al., 2012; YASUMOTO et al., 2014). Estes microrganismos utilizam o CO2 dissolvido em um substrato aquoso no seu metabolismo como fonte de
Página | 14 muito sensível a variáveis como pH, temperatura, luminosidade e disponibilidade de nutrientes, que afetam diretamente o crescimento dos microrganismos. Além disso não tem demonstração em escala industrial e possui muitas incertezas em relação ao impacto ambiental da biomassa. Há uma série de estudos relacionados a bioengenharia para a transformação genética de microrganismos para a captura de CO2 e sua transformação bioquímica em compostos de interesse comercial. Bactérias
autotróficas têm sido testadas para a captura de CO2 (JAJESNIAK et al., 2014).
Captura de CO2 criogênica
A captura de CO2 pode ser realizada por resfriamento da mistura de gases em
pressões elevadas, a fim de condensar seletivamente o CO2 pela diferença dos pontos
de ebulição dos gases da mistura, Figura 13. Porém, este processo consome muita energia, necessita de desidratação do gás em uma etapa anterior e só é eficiente para concentrações elevadas de CO2 na mistura gasosa (> 50 % v/v) (GRANDE e BLOM,
2014). O resfriamento da mistura gasosa em pressão atmosférica pode capturar o CO2 no estado sólido, porém é necessária a remoção completa da água para evitar a
formação de gelo, que bloquearia equipamentos e tubulações (TUINIER et al., 2010). A empresa ExxonMobil inventou e patenteou a tecnologia conhecida como (CFZ™ - Controlled Freeze Zone), que pode ser usada na captura de CO2 e na remoção de
impurezas do gás natural através do resfriamento dos gases.
Fonte: adaptado de CO2CRC, 2014 Figura 13: Separação de CO2 por resfriamento até a sua condensação.
Uma alternativa estudada é a formação de hidratos de CO2 através do
congelamento de um fluxo de água saturado com CO2. O CO2 é capturado através do
Página | 15 entre as unidades de troca de calor para tornar a planta industrial mais eficiente em energia (KENARSARI et al., 2013).
Fonte: adaptado de Kenarsari et al., 2013
Figura 14: Representação da formação de hidratos de CO2.
Classificação das tecnologias de captura de CO2
Tecnologias de captura de CO2 usadas para o tratamento dos gases de
emissão de uma termelétrica, principal fonte estacionária de emissão de CO2 em nível
mundial (27% das emissões totais de CO2), são agrupadas em três grandes grupos:
pós-combustão, pré-combustão e oxi-combustão, Figura 15.
A captura de CO2 de emissões industriais pode ser classificada como
pós-combustão, quando se usa ar atmosférico nas reações de combustão para geração de calor e energia, ou como oxi-combustão, quando se usa O2 de elevada
concentração, para o mesmo fim.
Fonte: adaptado de IPCC, 2005
Página | 16 Pós-combustão
Este sistema é o mais usado para a captura de CO2 de gases de exaustão
provenientes da geração de energia elétrica. Ele realiza a combustão com ar atmosférico de materiais combustíveis, onde o calor gerado na reação é utilizado para produção de vapor de água. Este vapor é o responsável pelo acionamento de uma turbina a vapor, para geração de eletricidade (RUBIN, 2008). O gás de emissão da combustão é composto principalmente de N2 do ar, além de menores concentrações
de CO2, O2 e H2O. Outras impurezas provenientes do combustível incluem NOx, SOx,
e materiais particulados. Como a mistura gasosa possui pressão atmosférica e concentração de CO2 relativamente baixa (12-20 % v/v), o método mais eficiente para
a separação de CO2 é a absorção química em soluções aquosas alcalinas.
Pré-combustão
Neste sistema, é usada a gaseificação de materiais combustíveis. Vapor de água e gás oxigênio, em baixas quantidades, reagem com o combustível em pressões e temperaturas elevadas, produzindo gás de síntese (mistura de CO, H2, CO2 e CH4).
Logo é necessário um reator de deslocamento gás-água para converter CO e CH4 em
CO2 e H2 usando vapor de água (PLASYNSKI et al., 2009). As usinas termoelétricas,
que utilizam este sistema são mais eficientes, pois produzem eletricidade através de uma turbina a vapor (que recupera o calor dos gases), mas também através de uma turbina a gás, que queima H2. Estas usinas são chamadas de IGCC (Integrated
Gasification Combined Cycle - Ciclo Combinado com Gaseificação Integrada) (HOFFMANN, 2010).
Embora as etapas iniciais de conversão do combustível sejam mais elaboradas e caras do que o sistema de pós-combustão, as altas pressões dos gaseificadores modernos e as altas concentrações de CO2 produzidas pelos reatores de
deslocamento fazem com que a separação do CO2 seja facilitada. Os processos de
adsorção são os mais adequados para a captura de CO2 (RUBIN, 2008).
Oxi-combustão
Este sistema é similar a combustão convencional para geração de eletricidade. Porém, o ar atmosférico é substituído por O2 de elevada concentração, para reduzir a
concentração de N2 nos gases de emissão. Desta forma, o gás de emissão será
composto por CO2 e água, além de impurezas como N2, NOx, SOx. O vapor de água
pode ser condensado sob resfriamento, obtendo-se CO2 de elevada concentração.
pós-Página | 17 combustão, pois há produção de um menor volume de gás e com alta concentração de CO2 (RUBIN, 2008). Apesar disso, este sistema não tem sido usado em grande
escala, porque ele exige uma unidade de separação de O2 do ar, além da reciclagem
do gás para diminuir a temperatura da combustão, o que aumenta o custo da planta industrial.
Processos industriais
As tecnologias de captura de CO2 podem ser aplicadas para as indústrias, pois
alguns processos químicos como a produção do aço, que usa o CO como agente redutor do óxido de ferro contido no minério (equação 1), e a produção de cimento e cal, que calcina o calcário para a produção do clínquer e da cal (equação 2), respectivamente, emitem o CO2 como produto da reação química e não apenas da
combustão para geração de calor e energia no processo industrial (equação 3). 1/2 Fe2O3(s) + 3/2 CO (g) Fe (s) + 3/2 CO2(g) Eq. 1
CaCO3(s) Δ CaO (s) + CO2(g) Eq. 2
C6H12O6(glicose) + 6 O2(g) 6 H2O (l) + 6 CO2(g) Eq. 3
O gás hidrogênio poderia ser considerado um combustível limpo, pois sua combustão gera água (equação 4), porém, a produção economicamente viável deste gás é realizada, principalmente, pela reforma a vapor de metano em conjunto com a reação de deslocamento gás-água, que contribui também para a produção de CO2
(equações 5 e 6) (KALE e KULKARNI, 2013).
H2(g) + O2(g) H2O (g) Eq. 4
CH4(g) + H2O (g) CO (g) + 3 H2(g) Eq. 5
CO (g) + H2O (g) CO2(g) + H2(g) Eq. 6
Dessa forma, a maioria dos processos industriais que utilizam gás hidrogênio provocam a emissão de grandes quantidades de CO2. A produção comercial de
amônia, que utiliza gás hidrogênio como matéria-prima (equação 7), em geral, é uma grande emissora de CO2.
N2(g) + H2(g) 3 NH3(g) Eq. 7
Portanto, a implantação da captura de CO2 nas indústrias pode reduzir 20 %
das emissões globais de CO2 (OECD/IEA, 2013). Os principais setores responsáveis
pelas emissões de CO2 são ferro e aço, cimento, produtos químicos (amônia para
Página | 18 Seleção da tecnologia de captura de CO2
A eficiência de uma tecnologia de captura de CO2 depende de parâmetros
como: concentração de CO2, temperatura, pressão, umidade e impurezas presentes
na mistura gasosa. Portanto, a escolha da tecnologia ou de uma combinação de tecnologias de captura de CO2 a serem adotadas, depende das características da
mistura gasosa (biogás, gás natural, ar atmosférico, gases de combustão, gases de emissão industrial, etc.). Por exemplo: o ar atmosférico não exige o seu resfriamento, porém a baixa concentração de CO2 (0,04% v/v) e a pressão baixa inviabilizam a
captura de CO2 do ar (MAZZOTTI et al., 2013). A Tabela 1 descreve a tecnologia mais
adequada de captura de CO2 em emissões de algumas indústrias e do setor elétrico,
em função dos dois parâmetros principais: concentração de CO2 e pressão da mistura
Página | 19 Tabela 1: Alguns processos de captura em função da concentração de CO2 e
pressão dos gases de emissão de algumas indústrias e do setor elétrico.
Fonte de CO2 Pureza do CO2 (por volume) Pressão de CO2 Processos de captura
Processo A lt a Médi a al ta Médi a baixa B ai xa
P. parcial (kPa) S
ó P ur if ic aç ão (e x. : des idra ta çã o) C ri ogên ic a S ol ve nt e fí si co A dsorv ent e Mem bra na S ol ve nt e qu ím ic o
Óxido de etileno 100% 2500 X
Fermentação 100% 100 X
Forno de clínquer
(O2) > 90% 95 X
Oxicombustão 80 - 98% 90 X X
DRI (H2 de carvão
ou gás)1 20-96% incerto X X X X
IGCC (O2) 20 - 40% 500 a 3000 X
Remoção de gases
ácidos 2 - 65% 20 a 5000 X X X
Gás de alto forno
(reciclagem) 60 - 75% 60 a 75 X
Etileno 8 - 18% 200 a 500 X X
Hidrogênio 15 - 20% 300 a 550 X
IGCC (ar) 12 - 14% 250 a 1000 X
Gás de alto forno 14 - 33% 14 a 33 X
Forno de clínquer
(ar) 14 - 40% 14 a 40 X
Carvão pulverizado 12 - 14% 12 a 14 X
Aquecedores
industriais 3 - 13% 3 a 13 X
Caldeira a gás 7 - 10% 7 a 10 X
Turbina a gás 3% 3 X
Necessidade de compressão posterior: médi
a
baixa al
ta
baixa médi
a
al
ta
Fonte: adaptado de OECD/IEA, 2013
1.1.5.2 Transporte de CO2
Após a etapa de separação e compressão, o CO2 pode ser transportado por
gasodutos, caminhões, navios ou trens para o local de armazenamento (PEREZ et al., 2012). O transporte de CO2 por dutos sob altas pressões é o método mais econômico
para transportar grandes quantidades por longas distâncias (ZHANG et al., 2012). O CO2 é transportado na fase líquida ou como fluido supercrítico. Neste último caso, o
CO2 apresenta propriedades intermediárias entre um gás (baixa viscosidade) e um
líquido (alta densidade), quando é comprimido e aquecido acima de seu ponto crítico
1 DRI (Direct-reduced iron): tecnologia de redução direta do minério de ferro através de uma mistura de gases
Página | 20 (73,8 bar e 31 °C), Figura 16.
Fonte: Power Engineering International, 2015
Figura 16: Diagrama de fases do CO2.
A presença de água e contaminantes como SO2 e NO2 torna o gás mais
corrosivo, devido a formação de ácidos inorgânicos (H2CO3, H2SO4 e HNO3). Portanto,
o CO2 deve ser transportado puro e seco, para não danificar as tubulações e
equipamentos metálicos (COLE et al., 2011). Isto exige uma purificação do CO2 antes
da etapa de transporte, o que aumenta os custos da CCS.
Na operação de transporte do CO2 por gasodutos pode ocorrer um vazamento,
que produzirá uma dispersão fria de CO2 e mais densa que o ar, podendo causar a
morte de seres vivos presentes no local do acidente por asfixia ou congelamento (ZHANG et al., 2006; HERZOG et al., 2013). Por isso é importante que haja uma adequada seleção do tipo de material, diâmetro e espessura do tubo. Além disso, a aplicação de um revestimento externo, uma proteção catódica e uma cobertura com solo, pode inibir a corrosão da tubulação e diminuir os riscos de acidentes (KOORNNEEF et al., 2009). Portanto, o transporte de CO2 por gasodutos exige um
Página | 21 1.1.5.3 Armazenamento de CO2
Campos de petróleo e camadas de carvão mineral
Atualmente CO2 tem sido injetado comercialmente em campos maduros de
petróleo, para aumentar a mobilidade do óleo e a produtividade do reservatório, através da técnica denominada Recuperação de Óleo Avançada (Enhanced Oil Recovery - EOR), Figura 17. A injeção de CO2 também tem sido aplicada em camadas
de carvão para produção de gás natural através da técnica conhecida como Recuperação Avançada de Metano em Camadas de Carvão (Enhanced Coal Bed Methane Recovery - ECBMR). O CO2 injetado na camada é preferencialmente
adsorvido pela matriz do carvão, resultando na liberação do metano (HERZOG e DRAKE, 1996; CEPAC, 2014).
Fonte: CORELAB, 2014; CEPAC, 2014
Figura 17: Técnica de injeção de CO2 em reservatórios de petróleo para
recuperação de óleo avançada (a) e injeção de CO2 em camadas de carvão para
produção de metano (b).
Aquíferos salinos
Aquíferos salinos profundos são formações rochosas porosas, permeáveis e preenchidas com água salgada. O CO2 pode ser armazenado na forma gasosa
através da vedação por uma rocha impermeável ou saturado nos poros de uma rocha porosa. Também pode ser solubilizado ou precipitado na solução salina. Esta técnica tem sido aplicada em escala comercial por empresas petrolíferas, como Statoil e British Petroleum (MICHAEL et al., 2010).
A injeção de CO2 em reservatórios de petróleo, camadas de carvão ou
Página | 22 às falhas na vedação dos poços perfurados e não pode vazar por falhas e fraturas nas rochas, que selam o reservatório. Portanto, o armazenamento geológico de CO2, deve
ser criteriosamente planejado, operado e monitorado por longos anos, para garantir que o CO2 não retorne para a atmosfera (PAN e CONNELL, 2011; MAZUMDER et al.,
2006; EMBERLEY et al., 2004; KEATING et al., 2013; SIRIWARDANE et al., 2013; BRUNET et al., 2013).
Fundo do oceano
O armazenamento de CO2 no leito oceânico tem sido estudado (ADAMS e
CALDEIRA, 2008; TURLEY et al., 2010). A injeção direta de CO2 no fundo do oceano
(profundidade maior que 3000 m), onde se encontram pressão alta e baixa temperatura, manteriam o CO2 no estado líquido, e ele afundaria ao invés de flutuar,
Figura 18. Estas condições fazem com que o CO2 se transforme em um composto
sólido chamado de hidrato de CO2. O grande inconveniente desta técnica é que a
solubilização do CO2 promove a acidificação da água e pode alterar o ecossistema
marinho (MENGERINK et al., 2014; WOLF-GLADROW e ROST, 2014).
Fonte: adaptado de Relatório Especial do IPCC, 2005
Figura 18: Armazenamento de CO2 no fundo do oceano.
Enfim, o armazenamento do CO2 exige uma barreira física para aprisioná-lo
sob altas pressões e mantê-lo fora da atmosfera em condições seguras. A compressão do CO2 é necessária para facilitar o transporte e reduzir o volume para
ser armazenado (LACKNER, 2002). Portanto, o armazenamento de CO2 encontra
Página | 23 se encontrar um local adequado próximo da fonte geradora e aos custos com o monitoramento, que se perpetuarão durante milhares de anos (RILEY, 2010).
1.1.6 Conversão química de CO
2A conversão de CO2 em produtos químicos comerciais dispensa a necessidade
de seu armazenamento. Ele pode ser usado como matéria-prima na síntese de diversos produtos da Química fina (ureia, ácidos carboxílicos e carbonatos), na síntese de combustíveis ou commodities químicas (metanol, metano, ácido fórmico, ácido acrílico) e na síntese de polímeros (policarbonatos e poliuretanas), Figura 19 (MACDOWELL et al., 2010; ARESTA et al., 2001).
Fonte: adaptado de MacDowell et al., 2010
Figura 19: Principais produtos químicos comerciais sintetizados a partir de CO2.
O CO2 é uma molécula apolar com geometria linear e termodinamicamente
estável nas condições ambientais. O átomo de carbono central é eletrofílico, devido a deficiência de elétrons (YIN e MOSS, 1999). Logo, ele pode ser atacado por nucleófilos. Reações do CO2 com água, amônia, hidróxidos e aminas são favorecidas
termodinamicamente (MACDOWELL et al., 2010). Por outro lado, o elevado estado de oxidação do átomo de carbono exige a sua redução para a conversão em alguns produtos de interesse da indústria química. Neste caso é necessária a adição de energia ao sistema, para ativar a reação. As estratégias usadas são a adição de energia física (eletroquímica ou fotoquímica) e a adição de espécies químicas reativas. Esta demanda de energia para a redução do CO2 em processos industriais
Página | 24 (SAKAKURA et al., 2007). Catalisadores baseados em metais de transição são os mais utilizados e que apresentam os melhores resultados (QIAO et al., 2014; JADHAV et al., 2014; KUHL et al., 2014).
A conversão de CO2 em produtos da indústria química tem baixo potencial de
mitigar o aquecimento global, porque a demanda comercial destes produtos é pequena comparada às emissões antropogênicas de CO2 (WHIPPLE & KENIS, 2010).
Além disso, a indústria química emite CO2, em grande parte dos seus processos
industriais.
1.1.7 Carbonatação mineral
O IPCC tem sugerido o uso da carbonatação mineral, a fim de diminuir as emissões de CO2 provenientes da queima de combustíveis fósseis (IPCC, 2005). Ela
consiste em transformar rochas ou resíduos urbanos e industriais com altas concentrações de cálcio ou magnésio nos seus respectivos carbonatos, Figura 20.
Fonte: adaptado de Bobicki et al., 2012
Figura 20: Carbonatação mineral de rochas e resíduos com altas concentrações de cálcio ou magnésio.
A principal vantagem da carbonatação mineral é que o CO2 é armazenado
Página | 25 e peridotitos ricos em olivinas (mistura de Mg2SiO4 e Fe2SiO4), serpentinitos ricos em
minerais do grupo serpentina (Mg3Si2O5(OH)4) e rochas ricas em talco
(Mg3Si4O10(OH)2). As rochas indicadas para a carbonatação mineral, que contêm
cálcio, são ricas em wollastonita (CaSiO3) ou anortita (CaAl2Si2O8) (OELKERS et al.,
2008).
A carbonatação mineral é a tecnologia atual que apresenta o maior potencial de armazenamento de CO2, Tabela 2.
Tabela 2: Armazenamento potencial de CO2 de diferentes tecnologias.
Capacidade Global (Gt de C)
Estimativa de emissão de CO2 em 100 anos 2300
Reservas globais de carvão comprovadas 1000 a 10000
Opções de armazenamento de CO2
Carbonatação mineral > 10000 a 1000000
Aquíferos salinos profundos 100 a 10000
Reservatórios depletados de óleo e gás 100 a 900
Camadas de carvão 10 a 100
Reflorestamento 50 a 100
Recuperação avançada de óleo 10
Produtos químicos < 0,1 por ano
Fonte: adaptado de Sanna et al., 2012
Na natureza, os silicatos de magnésio e cálcio reagem com o CO2 atmosférico
formando carbonatos em um processo denominado de intemperismo, equações 8, 9 e 10 (OLAJIRE, 2013). Este é um dos processos do ciclo natural do carbono responsável por absorver o CO2 da atmosfera ao longo de milhares de anos
(KIRCHOFER et al., 2012; OELKERS et al., 2008). A pressão baixa e a baixa concentração de CO2 na atmosfera (0,04 % v/v), além das dificuldades inerentes das
reações sólido-gás, são os principais fatores que afetam a cinética do intemperismo de rochas ricas em silicatos de cálcio ou magnésio.
Mg3Si2O5(OH)4 (s) + 3 CO2 (g) → 3 MgCO3(s) + 2 SiO2(s) + 2 H2O (l) + 64 kJ.mol-1 Eq. 8
Mg2SiO4 (s) + 2 CO2 (g) → 2 MgCO3(s) + SiO2(s) + 2 H2O (l) + 90 kJ.mol-1 Eq. 9
CaSiO3 (s) + CO2 (g) → CaCO3(s) + SiO2(s) + 90 kJ.mol-1(de CO2, a 25 °C e 1 bar) Eq. 10
A reação de formação de carbonato de cálcio ou carbonato de magnésio é exotérmica e termodinamicamente favorecida em baixas temperaturas. A reação reversa de decomposição dos carbonatos é favorecida com a elevação da temperatura (acima de 900 °C para CaCO3 e acima de 300 °C para MgCO3)
Página | 26 O processo de carbonatação mineral consiste em uma etapa de solubilização dos silicatos liberando os íons cálcio ou magnésio em solução aquosa, seguido da reação com os íons CO32- da dissolução do CO2 em água, precipitando os respectivos
carbonatos. A cinética do processo é lenta e a etapa limitante é a solubilização dos silicatos (OELKERS et al., 2008). A formação de uma camada de sílica ou carbonato na superfície do silicato durante a carbonatação dificulta ainda mais a conversão de CO2 em carbonato (OLAJIRE, 2013).
A carbonatação mineral é classificada em: carbonatação mineral in-situ e carbonatação mineral ex-situ.
1.1.7.1 Carbonatação mineral in-situ
É um método em que o CO2 é injetado com ou sem água em uma rocha porosa
no subsolo reagindo diretamente com a rocha. De forma similar ao armazenamento geológico, este método reduz o custo com o transporte de reagentes, produtos e da própria rocha. Porém, a seleção da rocha é crítica, porque ela deve ter uma permeabilidade e porosidade adequadas para armazenar o CO2 e os carbonatos,
reatividade alta com o CO2, além de possuir uma camada de rocha, que funciona
como selo, para evitar vazamentos para a atmosfera. A formação de carbonatos ocorre em escalas de tempo geológicas e vários estudos têm sido realizados para prever a cinética da reação (ex.: OLAJIRE, 2013; OELKERS et al., 2008). Este é o método de carbonatação, que aproveita melhor o calor liberado da reação, que é exotérmica (equações 8, 9 e 10).
1.1.7.2 Carbonatação mineral ex-situ
É o método que utiliza reações químicas controladas em uma planta industrial, a fim de aumentar a velocidade da carbonatação. Neste caso, são necessárias a mineração, britagem e moagem da rocha, para aumentar a sua área superficial e torná-la mais reativa. Há um grande consumo de energia nestas etapas de preparação da rocha, além do transporte dos materiais e das condições usadas na reação (temperatura e pressão).