Luana Márcia Bezerra Batista
Características estruturais e fotocatalíticas do compósito
oxihidróxido de nióbio/vermiculita
_______________________________________
Dissertação de Mestrado
Natal/RN, outubro de 2014
Luana Márcia Bezerra Batista
CARACTERÍSTICAS ESTRUTURAIS E FOTOCATALÍTICAS DO
COMPÓSITO OXIHIDRÓXIDO DE NIÓBIO/VERMICULITA.
Natal, RN 2014
Dissertação apresentada ao programa de Pós-graduação
em Química da Universidade Federal do Rio Grande do
Norte, como parte dos requisitos para obtenção do título de
Mestre em Química na área de Química Inorgânica e
Catálise.
Orientadora: Profa. Dra. Ana Paula de Melo Alves Guedes
UFRN / Biblioteca Central Zila Mamede. Catalogação da Publicação na Fonte.
Batista, Luana Márcia Bezerra
Características estruturais e fotocatalíticas do compósito oxihidróxido de nióbio/vermiculita / Luana Márcia Bezerra Batista. – Natal, RN, 2014. 97 f..: il.
Orientadora: Profª. Drª. Ana Paula de Melo Alves Guedes. Co-orientador: Prof. Dr. Francisco Laerte de Castro.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Instituto de Química. Programa de Pós-Graduação em Química.
1. Vermiculita - Dissertação. 2. Oxihidróxido de nióbio - Dissertação. 3. Adsorção - Dissertação. 4. Oxidação - Dissertação. 5. Oxidação fotocatalítica. I. Guedes, Ana Paula de Melo Alves. II. Castro, Francisco Laerte de. III Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
Agradeço primeiramente a Deus pela saúde e força concedida.
Aos meus pais e irmão, Marlone Gondim Batista, Maria Lúcia Bezerra Batista e
Marcelo Bezerra Batista, por todo apoio e incentivo ao longo dos meus estudos.
Aos meus avós, tios e primos por sempre terem acreditado em mim.
À minha orientadora, Profa. Dra. Ana Paula de Melo Alves, pela amizade,
colaboração, incentivo, discussões e confiança depositada em mim durante os dois anos de
mestrado.
Ao meu co-orientador, Dr. Francisco Laerte de Castro, pelos ensinamentos durante
parte do meu mestrado no CTGÁS-ER.
À profa. Dra. Grazielle Tavares Malcher que durante a graduação foi minha tutora do
Programa de Educação Tutorial, pelos ensinamentos e contribuições durante uma parte da
minha vida acadêmica.
Ao meu namorado, Franciel Aureliano, por todo seu apoio, compreensão, incentivo
mesmo nos momentos ruins e pela sua colaboração neste trabalho.
As minhas queridas amigas Janiele Mayara, Anallicy Paiva e Isabel Silva que mesmo
um pouco afastadas, estiveram comigo na graduação e mestrado me ajudando e incentivando.
Ao meu amigo de laboratório João Leonardo, pelas experiências trocadas durante esses
dois anos de mestrado e pela contribuição neste trabalho.
Aos meus queridos amigos e egressos do PET-Química: Anallicy Paiva, Lorena
Medeiros, Edson Lima, Everton Henrique, Gilberto de Lima, Arthur Felipe, Carlos
Augusto C. Kramer e Mário Rodrigues.
Ao Instituto de Química, Laboratório de Peneiras Moleculares, Laboratório de
Microscopia Eletrônica de Varredura pela realização de análises IV, DRX e MEV/EDS
respectivamente que contribuíram para a realização deste trabalho.
Ao CTGÁS-ER e ao Laboratório de Meio Ambiente pela disponibilidade do
equipamento para a realização dos testes de adsorção e oxidação.
Aos colegas do Laboratório de Catálise e Petroquímica-LCP, Franciel, Leonardo,
Andresa, Anéliese, Taísa, Íria, Kléber, Regineide, Danielle, Lidiane, João Paulo, Hélson,
Ramalho, Gabriela e Márcia, pelo convívio e aprendizado.
Ao Conselho Nacional de Pesquisa – CNPq pela bolsa concedida.
RESUMO
BATISTA, L.M.B. Características Estruturais e Fotocatalíticas do Compósito
Oxihidróxido de Nióbio/Vermiculita. 2014, Outubro. Dissertação de Mestrado –
Universidade Federal do Rio Grande do Norte.
A preparação de novos compósitos usando argilas naturais como suporte, vem sendo estudada na literatura, em virtude das mesmas serem encontradas na natureza e como consequência, apresentarem um baixo preço. As argilas podem ser empregadas como suportes para óxidos metálicos aumentando a quantidade de sítios ativos presentes na sua superfície, e assim, podem ser aplicadas para os mais variados fins como adsorção, catálise e fotocatálise. Uns dos materiais que estam em destaque são os compostos de nióbio, em especial os óxidos, por apresentarem ótimas propriedades oxidativas e fotocatalíticas. Neste cenário, o trabalho teve como objetivo sintetizar o compósito oxihidróxido de nióbio (NbO2OH)/vermiculita, bem como avaliar sua eficácia com relação à vermiculita sódica (V0) e ao NbO2OH. O compósito foi preparado através do método de precipitação-deposição. Em seguida, foi caracterizado por difratometria de raios-X (DRX), espectroscopia de absorção do infravermelho (IV), espectroscopia de energia dispersiva de raios-X (EDS), análise termogravimétrica (TG/DTG), microscopia eletrônica de varredura (MEV), adsorção e dessorção de N2 pelo método B.E.T e investigação da distribuição de carga. A aplicação do material NbO2OH/V0 foi dividida em duas etapas: (I) através dos métodos de adsorção e oxidação e (II) por meio da oxidação fotocatalítica usando a irradiação solar. Os estudos de adsorção, oxidação e oxidação fotocatalítica foram monitorados com relação a porcentagem de remoção da cor do corante azul de metileno (AM) através da espectroscopia de UV-Vis. Os resultados de DRX evidenciaram diminuição e alargamento na reflexão d(001) da argila após modificação, o IV indicou a presença tanto da argila quanto do oxihidróxido de nióbio ao apresentar bandas em 1003 e 800 cm-1 referentes, respectivamente, ao estiramento Si-O e Nb-O. A presença do nióbio foi confirmada também por EDS que indicou quantidade 17 % em massa do metal. A análise térmica constatou a estabilidade do compósito em 217 ºC e as micrografias mostraram que houve diminuição no tamanho das partículas da argila. A investigação da distribuição de carga do NbO2OH/V0 constatou que o material apresentou uma superfície heterogênea com cargas negativas baixa, média e elevada. O teste de adsorção mostrou que o compósito NbO2OH/V0 apresentou maior capacidade adsortiva conseguindo remover 56 % da cor do AM, enquanto o material V0 removeu apenas 13 %. O NbO2OH não apresentou capacidade adsortiva em virtude da formação de agregados-H. A porcentagem de remoção da cor do corante para os testes de oxidação apresentou pouca diferença com relação a adsorção, sendo 18 e 66 % de remoção da cor do corante para V0 e NbO2OH/V0, respectivamente. O material NbO2OH/V0 apresentou excelente atividade fotocatalítica conseguindo remover em apenas 180 minutos 95,5 % da cor do AM comparado a 41,4 % da V0 e 82,2 % do NbO2OH, comprovando a formação de um novo compósito com propriedades distintas dos seus precursores.
ABSTRACT
BATISTA, L.M.B. Structural and Photocatalytic characteristics of niobium Oxyhydroxide/Vermiculite– basead composite. 2014, October. Master Thesis - University Federal of Rio Grande do Norte.
The preparation of nanostructured materials using natural clays as support, has been studied in literature under the same are found in nature and consequently, have a low price. Generally, clays serve as supports for metal oxides by increasing the number of active sites present on the surface and can be applied for various purposes such as adsorption, catalysis and photocatalysis. Some of the materials that are currently highlighted are niobium compounds, in particular, its oxides, by its characteristics such as high acidity, rigidity, water insolubility, oxidative and photocatalytic properties. In this scenario, the study aimed preparing a composite material oxyhydroxide niobium (NbO2OH) / sodium vermiculite clay and evaluate its effectiveness with respect to the natural clay (V0) and NbO2OH. The composite was prepared by precipitation-deposition method and then characterized by X-ray diffraction, infrared spectroscopy (XRD), energy dispersive X-ray (EDS), thermal analysis (TG/DTG), scanning electron microscopy (SEM), N2 adsorption-desorption and investigation of distribution of load. The application of the material NbO2OH/V0 was divided in two steps: first through oxidation and adsorption methods, and second through photocatalytic activity using solar irradiation. Studies of adsorption, oxidation and photocatalytic oxidation monitored the percentage of color removal from the dye methylene blue (MB) by UV-Vis spectroscopy. The XRD showed a decrease in reflection d (001) clay after modification; the FTIR indicated the presence of both the clay when the oxyhydroxide niobium to present bands in 1003 cm-1 related to Si-O stretching bands and 800 cm-1 to the Nb-O stretching. The presence of niobium was also confirmed by EDS indicated that 17 % by mass amount of the metal. Thermal analysis showed thermal stability of the composite at 217 °C and micrographs showed that there was a decrease in particle size. The investigation of the surface charge of NbO2OH/V0 found that the material exhibits a heterogeneous surface with average low and high negative charges. Adsorption tests showed that the composite NbO2OH/V0 higher adsorption capacity to remove 56 % of AM, while the material removed from V0 only 13 % showed no NbO2OH and adsorptive capacity due to the formation of H-aggregates. The percent removal of dye color for the oxidation tests showed little difference from the adsorption, being 18 and 66 % removal of dye color for V0 and NbO2OH/V0 respectively. The NbO2OH/V0 material shows excellent photocatalytic activity managing to remove just 95,5 % in 180 minutes of the color of MB compared to 41,4 % and 82,2 % of V0 the NbO2OH, proving the formation of a new composite with distinct properties of its precursors.
LISTA DE FIGURAS
Figura 1 Exemplos de reações químicas na presença de catalisador homogêneo (a) e
heterogêneo (b) ... 18
Figura 2 Ilustração dos Sítios ácidos de Lewis e Brönsted em um material mesoporoso do tipo MCM-41 impregnado com ferro ... 19
Figura 3 Catalisadores Heterogêneos (a) Zeólita-Y, (b) e (c) Materiais Mesoporosos (Família M41S e o SBA-15, respectivamente) e (d) MOF (MIL-101) ... 19
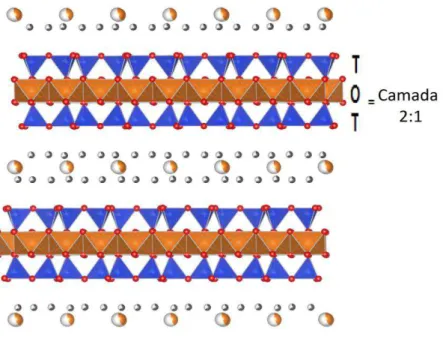
Figura 4 Representação esquemática de uma folha tetraédrica (a) e octaédrica (b) de um argilomineral ... 21
Figura 5 Estrutura das folhas de argilominerais do tipo 1:1(a) e 2:1 (b) ... 22
Figura 6 Ilustração da vermiculita não expandida (a) e expandida (b) ... 23
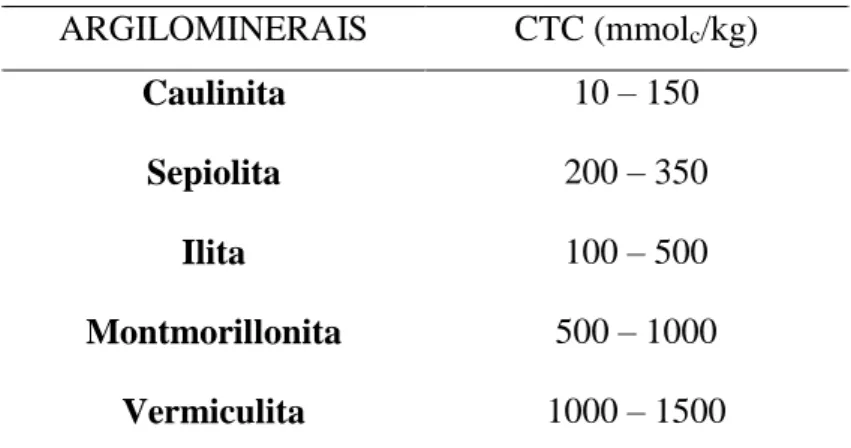
Figura 7 Estrutura da Vermiculita ... 24
Figura 8 Nióbio Metálico ... 27
Figura 9 Esquema da geração do complexo peroxo de nióbio na superfície do oxihidróxido de nióbio ... 31
Figura 10 Elucidação do fenômeno da adsorção na fase gás-sólido ... 32
Figura 11 Exemplos de adsorventes (a) carvão ativado, (b) biossorventes (cascas de nozes) e (c) resíduo industrial (cinzas) ... 33
Figura 12 Mecanismos utilizados na oxidação de substâncias orgânicas (a) adição eletrofílica radicalar, (b) transferência eletrônica, (c) abstração de hidrogênio ... 34
Figura 13 Diagrama de um processo fotocatalítico sobre a superfície de um fotocatalisador ... 36
Figura 14 Estrutura do corante Púrpura de Tiro ... 37
Figura 15 Estrutura do corante Azul de metileno ... 38
Figura 16 Espectros UV-Vis do Azul de Metileno (a) e da adsorção do mesmo em argila montmorilonita no tempo de 1 min (b) e 24 h (c) ... 39
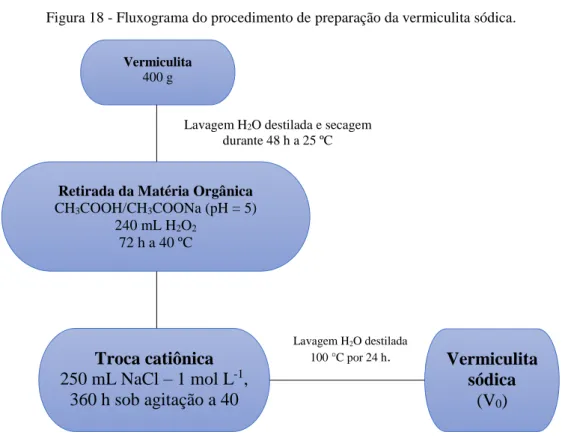
Figura 17 Vermiculita sódica não moída (a) e moída com granulometria malha 100 (b) 42 Figura 18 Fluxograma do procedimento de preparação da vermiculita sódica ... 42
Figura 19 Oxihidróxido de Nióbio ... 43
Figura 20 Fluxograma do procedimento de preparação do compósito ... 44
Figura 22 Filossilicatos interestratificado regularmente e aleatoriamente ... 53
Figura 23 Difratograma da vermiculita sódica (V - vermiculita; H – hidrobiotita;
B – biotita) ... 54
Figura 24 Difratogramas da vermiculita sódica, do oxihidróxido de nióbio e do
compósito (V - vermiculita; H - hidrobiotita; N - oxihidróxido de nióbio) ... 55
Figura 25 Espectros de infravermelho da vermiculita sódica, do oxihidróxido de nióbio
e do compósito ... 57
Figura 26 Curva Termogravimétrica da vermiculita sódica ... 59
Figura 27 Curvas Termogravimétricas do oxihidróxido de nióbio (a) e do compósito
(b) ... 60
Figura 28 Micrografias da vermiculita sódica (a-b), do oxihidróxido de nióbio (c-d) e
do compósito (e-f) ... 62
Figura 29 Espectros do AM e da adsorção do mesmo em vermiculita sódica,
oxihidróxido de nióbio e compósito ... 64
Figura 30 Espectros da derivada de segunda ordem calculada a partir dos espectros de
adsorção do azul de metileno em vermiculita sódica no tempo de 2 min (a) e
2 h (b) ... 65
Figura 31 Espectros da derivada de segunda ordem calculada a partir dos espectros de
adsorção do azul de metileno em oxihidróxido de nióbio no tempo de 2 min
(a) e 2 h (b) ... 66
Figura 32 Ilustrações esquemáticas das possíveis espécies do corante formadas na
superfície dos adsorventes ... 67
Figura 33 Espectros da derivada de segunda ordem calculada a partir dos espectros de
adsorção do AM em NbO2OH/V0 no tempo de 2 min (a) e 2 h (b) ... 68
Figura 34 Espectro da adsorção do AM em vermiculita sódica (a), oxihidróxido de
nióbio (b) e compósito (c) ... 69
Figura 35 Gráfico da porcentagem de remoção da cor na adsorção do AM em
vermiculita sódica e compósito ... 70
Figura 36 Espectros da oxidação do azul de metileno com H2O2 (a), vermiculita
sódica (b), oxihidróxido de nióbio (c) e compósito (d) ... 71
Figura 37 Gráfico da porcentagem de remoção da cor na oxidação do AM em H2O2
(Branco), vermiculita sódica e compósito ... 72
NbO2OH/V0 ... 73
Figura 39 Espectros da oxidação fotocatalítica do AM com H2O2 (a), vermiculita
sódica (b), oxihidróxido de nióbio (c) e compósito (d) ... 74
Figura 40 Gráfico da porcentagem de remoção da cor na oxidação fotocatalítica do
AM na presença H2O2, vermiculita sódica, oxihidróxido de nióbio e
compósito ... 75
Figura 41 Ilustração da solução do corante AM após 180 min de reação fotocatalítica
com H2O2 (a), vermiculita sódica (b), oxihidróxido de nióbio (c) e
compósito (d) ... 76
Figura 42 Reações que ocorrem na banda de valência e na banda de condução do
oxihidróxido de nióbio ao ser incidindo a irradiação UV ... 77
Figura 43 Gráfico da cinética de primeira ordem para o AM + H2O2, vermiculita,
LISTA DE TABELAS
Tabela 1 Capacidade de troca catiônica de alguns argilominerais ... 25
Tabela 2 Estruturas e fases do oxihidróxido de nióbio em diferentes temperaturas ... 30
Tabela 3 Atribuições para as principais bandas dos espectros de infravermelhos dos
materiais em estudo ... 58
Tabela 4 Faixas de temperatura e suas respectivas perdas de massas para a
vermiculita sódica, oxihidróxido de nióbio e o compósito ... 61
Tabela 5 Dados da composição química e área especifica da vermiculita sódica, do
oxihidróxido de nióbio e do compósito ... 63
Tabela 6 Parâmetros Cinéticos da descoloração do corante azul de metileno através
LISTA DE SIGLAS
AM Azul de Metileno
BC Banda de Condução
BV Banda de Valência
CBMM Companhia Brasileira de Metalurgia e Mineração
CTC Capacidade de Troca Catiônica
DNPM Departamento Nacional de Produção Mineral
DRX Difratometria de raios-X
DTG “Derivative thermogravimetry”– Termogravimetria derivada
e-BC Elétrons gerados na banda de condução
EDS Espectroscopia de Energia Dispersiva de Raios-X
FT-IR “Fourier transform infrared spectroscopy” – Espectroscopia no
infravermelho por transformada de Fourier
h+
BV Buracos formados na banda de valência
IUPAC “International Union of Pure and Applied Chemistry” – União
Internacional da Química Pura e Aplicada
IV Espectroscopia de absorção do Infravermelho
MCM-41 Mobil Composition of Matter – Material mesoporoso sintetizado pela
Mobil Corporation
MEV Microscopia Eletrônica de Varredura
MOFs “Metal Organic Frameworks” - Redes Metalorgânica
NbO2OH Oxihidróxido de Nióbio
POAs Processos Oxidativos Avançados
SBA-15 Santa Bárbara Amorphous-15 – Material mesoporoso sintetizado por
pesquisadores da universidade de Santa Bárbara-USA
SBET Área Específica pelo método B.E.T
SDEA Segunda Derivada do Espectro de Adsorção
TG Termogravimetria
UV Ultravioleta
UV-Vis Ultravioleta Visível
V0 Vermiculita Sódica
SUMÁRIO
1 INTRODUÇÃO ... 14
2 OBJETIVO ... 16
2.1 OBJETIVOS ESPECÍFICOS ... 16
3 FUNDAMENTAÇÃO TEÓRICA ... 17
3.1 CATALISADORES HETEROGÊNEOS ... 17
3.2 ARGILAS ... 20
3.2.1 Argilas como suporte ... 21
3.2.2 Argilominerais ... 21
3.2.3 Vermiculita ... 23
3.2.3.1 Aplicações da Vermiculita ... 26
3.3 NIÓBIO ... 27
3.3.1 Aplicações do Oxihidróxido de Nióbio ... 30
3.4 ADSORÇÃO ... 32
3.5 PROCESSOS OXIDATIVOS AVANÇADOS (POAs) ... 34
3.5.1 Fotocatálise ... 35
3.6 CORANTES ... 37
4 MATERIAIS E MÉTODOS ... 41
4.1 REAGENTES ... 41
4.2 PREPARAÇÃO DA VERMICULITA SÓDICA ... 41
4.3 SÍNTESE DO OXIHIDRÓXIDO DE NIÓBIO (NbO2OH) ... 43
4.4 PREPARAÇÃO DO COMPÓSITO - NbO2OH/V0 ... 43
4.5 CARACTERIZAÇÕES DOS MATERIAIS ... 44
4.5.1 Difratometria de Raios-X (DRX) ... 45
4.5.2 Espectroscopia de Absorção do Infravermelho por transformada de Fourier (FTIR) ... 45
4.5.3 Análise Termogravimétrica (TG/DTG) ... 46
4.5.4 Microscopia Eletrônica de Varredura (MEV) ... 47
4.5.5 Espectroscopia de Energia Dispersiva Raios-X (EDS) ... 47
4.5.6 Adsorção e Dessorção de Nitrogênio ... 48
4.5.7 Investigação da Distribuição de Carga ... 48
4.7 TESTES DE OXIDAÇÃO FOTOCATALÍTICA ... 50
4.7.1 Estudo Cinético ... 50
5 RESULTADOS E DISCUSSÃO ... 53
5.1 DIFRATOMETRIA DE RAIOS-X (DRX) ... 53
5.2 ESPECTROSCOPIA DE ABSORÇÃO DO INFRAVERMELHO POR TRANSFORMADA DE FOURIER (FTIR) ... 56
5.3 ANÁLISE TERMOGRAVIMÉTRICA (TG/DTG) ... 58
5.4 MICROSCOPIA ELETRÔNICA DE VARREDURA (MEV) E ESPECTROSCOPIA DE ENERGIA DISPERSIVA RAIOS-X (EDS) ... 61
5.5 INVESTIGAÇÃO DA DISTRIBUIÇÃO DE CARGA ... 63
5.6 TESTES DE ADSORÇÃO E OXIDAÇÃO ... 69
5.7 TESTES DE OXIDAÇÃO FOTOCATALÍTICA ... 74
5.7.1 Estudo Cinético ... 77
6 CONCLUSÕES ... 79
7 TRABALHOS FUTUROS ... 81
1
INTRODUÇÃO
O desenvolvimento de novos catalisadores é estratégico para a indústria e o meio
ambiente, uma vez que a maioria dos processos industriais necessitam de catalisadores
(homogêneos e/ou heterogêneos) para a produção de substâncias químicas. Por outro lado,
esses novos materiais são cruciais para o tratamento adequado de poluentes, reaproveitamento
de resíduos ou mesmo na otimização dos processos industriais diminuindo assim os rejeitos
lançados no meio ambiente. Em vista disso, alguns grupos de pesquisas tentam sintetizar
catalisadores eficientes para fins específicos, estando em destaque os catalisadores do tipo
heterogêneo, em virtude da sua facilidade de separação e reutilização após o término da
reação catalítica.
Devido à enorme diversidade de processos industriais que utilizam catalisadores, tem
havido um crescimento significativo na demanda mundial (de vendas) dos mesmos, aonde no
ano de 2012 chegou a aproximadamente 16,3 bilhões de dólares e para o ano de 2016 existe a
previsão que seja de 19,5 bilhões de dólares (aumento de 5,8 %). As áreas principais que
demandam o uso de catalisadores são: produtos químicos, petroquímicos, produtos de refino
de petróleo, polimerização e emissões ambientais (FREEDONIA GROUP, 2014; ARMOR,
2011). Com isso, percebe-se a importância econômica do desenvolvimento de novos
catalisadores (FREEDONIA GROUP, 2014).
Existem diversos tipos de sílicas e aluminossilicatos sendo aplicados hoje em dia na
catálise, como por exemplo: zeólitas, MCM-41, SBA-15, argilas entre outros. As argilas
naturais são materiais interessantes por apresentarem as seguintes características: serem
materiais sustentáveis, abundantes na crosta terrestre, apresentarem alta capacidade de troca
catiônica e possuírem baixo valor comercial. Entre as argilas mais estudadas, encontra-se a
vermiculita, um aluminossilicato de alumínio, ferro e magnésio, formada por alteração
hidrotermal de minerais como mica e biotita (HONGO et al., 2012). No Brasil, as reservas
dessa argila localizam-se nos estados de Goiás, Pernambuco, Paraíba e Bahia (PAULA,
2013).
A vermiculita tem sido relatada na literatura como adsorvente e catalisador,
principalmente por sua elevada capacidade de troca de cátions, causada por substituições
isomórficas entre as camadas octaédricas e tetraédricas. No entanto, em alguns casos, a alta
capacidade de troca catiônica (CTC) não é suficiente para a remoção de poluentes e
pilarização, tratamentos com ácidos inorgânicos fortes e inserção de óxidos sobre a sua
superfície para a formação de materiais compósitos, a fim de melhorar a eficiência da
vermiculita como catalisador e/ou adsorvente (LIU et al., 2014).
Dentre os tipos de alterações que podem ser realizadas na vermiculita, a incorporação de
óxidos metálicos visando à formação de materiais compósitos, é importante, pois uni as
propriedades de dois materiais distintos, podendo dessa forma desenvolver um bom
adsorvente e/ou catalisador para remover poluentes do ecossistema. Porém, poucos estudos
usando como fase ativa o nióbio são encontrados na literatura, por isso usamos no presente
trabalho o oxihidróxido de nióbio (NbO2OH) como fase ativa.
O oxihidróxido de nióbio é insolúvel em água e apresenta elevada acidez. Esse óxido
metálico tem uma estrutura rígida, sofrendo pouca expansão ou compressão quando imerso
numa solução aquosa. Por outro lado, possui boa seletividade, estabilidade e possibilidade de
troca catiônica, podendo ser aplicado na oxidação de contaminantes orgânicos. Além disso,
em virtude do seu band gap (região energética entre as bandas de condução e de valência de
um material semicondutor) ser bem parecido com o do dióxido de titânio, é relatado na
literatura como um eficiente fotocatalisador (RODRIGUES; SILVA, 2009; TAGLIAFERRO
et al., 2005).
Com intuito de avaliar a eficiência de catalisadores, alguns métodos para remoção de
poluentes orgânicos são utilizados, tais como adsorção e os processos oxidativos avançados
(POAs). Entre esses, a adsorção destaca-se devido à sua fácil execução, baixo custo e por
produzir um efluente de boa qualidade, e os POAs por normalmente promoverem a
mineralização dos compostos orgânicos recalcitrantes por meio da geração de radicais
hidroxilas. Sendo normalmente utilizado como molécula modelo para testar esses materiais, o
corante orgânico-catiônico azul de metileno (AM), por ser um composto simples e fácil de ser
manipulado.
Neste contexto, o trabalho teve como objetivo sintetizar e caracterizar um novo material
compósito, oxihidróxido de nióbio/vermiculita sódica, a fim de melhorar a capacidade de
adsorção e oxidação da argila natural. Como também, avaliar a sua eficiência como
adsorvente, catalisador e fotocatalisador através da porcentagem de remoção da cor do corante
2 OBJETIVO
O trabalho teve como objetivo a síntese, caracterização do compósito oxihidróxido de
nióbio/vermiculita e avaliação da eficiência do mesmo como adsorvente, catalisador e
fotocatalisador usando o corante azul de metileno como molécula modelo.
2.1 OBJETIVOS ESPECÍFICOS
Sintetizar o compósito oxihidróxido de nióbio/vermiculita, através do método de
precipitação-deposição;
Aplicar os materiais V0, NbO2OH e NbO2OH/V0 na adsorção, oxidação e oxidação
fotocatalítica do corante azul de metileno, para conhecer a eficiência do compósito
NbO2OH/V0 com relação aos materiais que o constituem;
Aplicar o modelo de Langmuir-Hinshelwood reduzido à cinética de primeira ordem aos
resultados obtidos no teste de oxidação fotocatalítica, a fim de conhecer o fotocatalisador com
3 FUNDAMENTAÇÃO TEÓRICA
Nesta seção serão abordados os conteúdos necessários para compreensão da temática do
presente trabalho. Os conteúdos abordados estão subdivididos através dos seguintes assuntos:
Catalisadores Heterogêneos, Argilas, Nióbio, Adsorção, Processos Oxidativos Avançados
(POAs) e Corantes.
3.1 Catalisadores Heterogêneos
Um catalisador geralmente possui a capacidade de diminuir a energia de ativação do
processo introduzindo novos caminhos para a reação química. Consequentemente ele aumenta
a velocidade do mesmo sem ser consumido, ou seja, interage com os reagentes convertendo-os em produtconvertendo-os e se regenerando na fase final do processo.
Largamente utilizados nas indústrias e nos laboratórios, os catalisadores hoje em dia
desempenham um papel importante na busca de um meio ambiente mais limpo, através da
degradação de poluentes e no desenvolvimento de processos industriais que produzam uma
menor quantidade de produtos secundários indesejáveis. Devido a isso, os catalisadores são
usados em 90 % dos processos químicos como, por exemplo, na produção de combustíveis,
fertilizantes, tintas, derivados de petróleo entre outras (SHRIVER; ATKINS, 2008;
FECHETE et al., 2012).
Os processos catalíticos heterogêneos são os mais empregados na indústria química, e
ocorrem quando catalisadores e reagentes encontram-se em fases diferentes. A catálise
heterogênea possui algumas vantagens em relação à homogênea, como a facilidade em
separar o catalisador do meio reacional e reutilizá-lo (SILVA et al., 2008). A Figura 1(a)
Figura 1 - Exemplos de reações químicas na presença de catalisador homogêneo (a) e heterogêneo (b).
(a) CH2 = CH2 + H2 (p ≤ 1 atm) CH3 - CH3 Catalisador = Rh(PPh3)Cl
(b) N2 (g) + 3 H2 (g) 2 NH3 (g) Catalisador = Fe(s)
Fonte: Batista (2014).
A atividade catalítica de um catalisador do tipo heterogêneo geralmente está ligada com
a sua área específica, diâmetro de poro e com os sítios ácidos, básicos, metálicos e oxidantes
encontrados na sua superfície (ÖZKAR, 2013).
A área específica de um catalisador sólido é de extrema importância para que o mesmo
tenha um bom desempenho durante um processo catalítico. Em vista disso, a redução do
tamanho das partículas do mesmo é uma das maneiras para elevar sua área e aumentar a
acessibilidade dos reagentes aos seus sítios ativos. A maioria dos materiais utilizados como
catalisadores possuem muitas irregularidades na superfície, as mesmas são associadas a poros
de diâmetro pequeno, fazendo com que a área superficial do sólido aumente, facilitando a sua
atividade catalítica (AKHTAR et al., 2014; MORAES, 2012). Esses poros, segundo a União
Internacional de Química Pura e Aplicada (IUPAC), são divididos de acordo com o tamanho
do seu diâmetro (d) em: microporos (d < 2nm), mesoporos (d entre 2 e 50 nm) e macroporos
(d > 50nm).
A presença de metais ou óxidos metálicos em catalisadores heterogêneos caracterizam
os seus sítios ativos. Esses sítios são classificados em dois tipos: sítios ácidos de Lewis e
Brönsted. Segundo Moreno (2009), os sítios ácidos de Brönsted são representado a partir de
um íon hidrogênio (H+) ligado a um átomo de oxigênio (-OH) em superfícies de óxidos.
Nesses materiais, os grupos básicos são os íons oxigenados (O-) resultantes da dissociação do
próton ou gerados por desidratação de duas hidroxilas terminais (X-OH + X-OH → X-O- +
H2O). A acidez de Lewis está associada aos sistemas não próticos resultantes da interação
com metais, principalmente os metais de transição, através de seus orbitais d incompletos,
capazes de receber elétrons (SHRIVER; ATKINS, 2008). No caso de materiais conhecidos
como aluminossilicatos, a acidez também pode ser gerada a partir da substituição isomórfica
do silício tetraédrico pelo alumínio octaédrico.
A partir da aplicação de catalisadores heterogêneos em uma reação e por meio dos
atividade catalítica, seletividade e compreender a ação dos sítios ácidos de Brönsted e Lewis
(FELLENZ et al., 2012). A Figura 2 ilustra os sítios ácidos de Lewis e Brönsted presentes em
um catalisador mesoporoso, Fe/MCM-41, sendo o primeiro associado com a presença de
nanopartículas de ferro e o segundo com os grupos silanóis que o material MCM-41 possui.
Figura 2 – Ilustração dos Sítios ácidos de Lewis e Brönsted em um material mesoporoso do tipo MCM-41 impregnado com ferro.
Fonte: Adaptado de Fellenz (2012).
Desde a descoberta da catálise heterogênea, diversos catalisadores foram sintetizados e,
por conseguinte modificados com a inserção de um ou mais metais na sua estrutura com o
intuito de melhorar a sua atividade catalítica. Dessa forma, ampliando a quantidade de
sistemas reacionais em que os mesmos podem ser utilizados. Dentre esses sólidos,
destacam-se: as zeólitas (Figura 3a), os materiais mesoporosos ordenados (Figura 3b-c), Redes
Metalorgânicas (MOFs) (Figura 3d) e as argilas (um dos materiais de estudo deste trabalho).
Figura 3 - Catalisadores Heterogêneos (a) Zeólita-Y, (b) e (c) Materiais Mesoporosos (Família M41S e o SBA-15, respectivamente) e (d) MOF (MIL-101).
(a) (b) (c) (d)
3.2 ARGILAS
Argila é um material de ocorrência natural, terroso, composto por diversos minerais de
baixa granulometria, que exibe plasticidade em teores de água adequado, e ao ser seca ou
queimada pode endurecer.Também pode ser considerada uma rocha constituída por diversos
minerais (filossilicatos, quartzo, feldspato etc) (GUGGENHEIM; MARTIN, 1995).
Durante a última década do século XXI, intensificou-se o uso de argilas para uma
variedade de aplicações, por serem materiais versáteis que apresentam características atrativas
(ZHOU; KEELING, 2013; VDOVIĆ et al., 2010), tais como:
Baixo custo e fácil manuseio;
Apresentarem área específica mediana, que surge a partir da estrutura em camadas,
juntamente com a capacidade de intumescimento e o potencial para a deslaminação;
As partículas apresentarem tamanho pequeno na faixa de micro a nano escala e serem
naturalmente carregadas, o que irá conduzir o aparecimento de fortes interações
eletrostáticas;
A elevada capacidade de troca catiônica e o seu alto poder de adsorção.
Em virtude das propriedades físico-químicas apresentadas acima, argilas podem ser
utilizadas pela indústria de tintas para promover a dispersão uniforme de pigmento e para
reduzir a sedimentação; por ceramistas e indústria de cerâmica para produzir pratos, copos,
taças, tubos etc.; como aglutinante para a pelotização de minérios de ferro; em indústrias
ambientais e farmacêuticas (CECILIA et al., 2013; ZHOU; KEELING, 2013). As argilas
também são aplicadas como suporte catalítico, catalisadores e adsorventes, tanto na sua forma
natural quanto após modificações experimentais como calcinação, pilarização, troca catiônica,
organofilização, por meio de tratamento com soluções ácidas e inserção de óxidos metálicos
(LIU et al., 2014).
Além disso, as argilas apresentam uma significativa importância econômica. Isso pode
ser notado, ao sabermos que no Brasil, por exemplo, entre as 41 principais reservas minerais
no ano de 2011, seis foram de argilas (bentonita, caulim, crisotila, vermiculita, talco e
pirofilita) que apresentaram respectivamente uma produção mundial de 10,3 x 106 ton, 34 x
3.2.1 Argilas como suporte.
Na década de 1990, houve um aumento na utilização de reagentes e catalisadores
suportados, na utilização de sistemas heterogêneos para purificação dos produtos de reação.
As vantagens desses catalisadores incluem o baixo custo, a elevada reatividade e a facilidade
com que as reações são realizadas (BRIGATTI et al., 2006).
As argilas possuem uma área especifica normalmente mediana, sendo dessa forma,
usadas como suporte para apoiar compostos reativos. Na utilização de argilas como suporte,
existe a possibilidade de adsorção do componente ativo sobre a superfície externa do suporte,
em vez de ser meramente encapsulados como um catalisador intercalado, por isso não são
observadas mudanças notáveis na distância entre as lamelas. Nesse caso, a espécie ativa pode
ser imobilizada através de ligações químicas ou interações mais fracas, tais como: ligações de
hidrogênio, efeito doador-aceitador e adsorção física (BRIGATTI et al., 2006).
3.2.2 Argilominerais.
As argilas naturais são constituídas, aproximadamente, por 90 % em massa de minerais,
que apresentam estrutura cristalina lamelar constituídos por cátions de Al, Fe, Mg hidratados,
com folhas contínuas de tetraedros de SiO4 (Figura 4a) ligados covalentemente a folhas
octaédricas de hidróxidos de metais tri (Al3+) e divalentes (Mg2+), Figura 4b, conhecidos
como “argilominerais” (LEI; PLANK, 2014; BRIGATTI et al., 2006; MADEJOVÁ, 2003).
Figura 4 – Representação esquemática de uma folha tetraédrica (a) e octaédrica (b) de um argilomineral.
Os argilominerais apresentam lamelas com espessura menor que 1 nm, formadas pelo
compartilhamento de três dos quatro átomos de oxigênios presentes nos tetraedros de silício
(SiO4) e por octaedros que contém metais (Al, Mg, ou Fe) no centro e seis átomos de oxigênio
nos vértices. Essas lamelas são unidas através de ligações de hidrogênio ou forças
eletrostáticas encontradas entre as camadas e os cátions interlamelares, formando estruturas
bidimensionais (LEI; PLANK, 2014; BRIGATTI et al., 2006; LUNA, 1999).
Estima-se a existência de quarenta tipos de argilominerais na crosta terrestre,
classificados por meio de semelhanças na sua composição química e estrutura cristalina (a
forma com que as folhas tetraédricas e octaédricas são combinadas). Se houver apenas uma
folha tetraédrica e uma octaédrica formando uma lamela, o argilomineral pertence à família
1:1, Figura 5a. Nas estruturas, T-O ou 1:1, a unidade de célula inclui seis sítios octaédricos e
quatro tetraédricos, sendo inclusos nessa família os argilominerais caulinita, crisolita, haloisita
entre outros (MOORE; REYNOLDS, 1997). No entanto, se uma folha octaédrica estiver no
meio de duas folhas de tetraedros de silício, compondo uma lamela que possui forma de um
“sanduíche”, Figura 5b, o argilomineral é pertencente à família 2:1 ou T-O-T (onde T =
tetraedro e O = octaedro) (LEI; PLANK, 2014; YANG et al, 2014; TESKE et al., 2013;
COELHO, 2007; MONTE, 2003; MADEJOVÁ, 2003; LUNA; SCHUCHARDT 1999).
Figura 5 – Estrutura das folhas de argilominerais do tipo 1:1 (a) e 2:1 (b).
Para argilominerais da família 2:1, a unidade de célula é constituída por seis sítios
octaédricos e oito tetraédricos. Dessa forma, quando todos os seis sítios octaédricos estiverem
ocupados por cátions divalentes, Mg2+, às estruturas são conhecidas como trioctaédricas.
Porém, se apenas quatro dos seis sítios octaédricos forem ocupados por cátions trivalentes
(Al3+ ou Fe3+), a estrutura é denominada como dioctaédrica (KORICHI et al., 2012;
COELHO, 2007). Como exemplo de argilominerais do tipo 2:1, podem ser citados a
vermiculita, biotita, sepiolita, montmorillonita, saponita, muscovita entre outros (MOORE;
REYNOLDS, 1997).
3.2.3 Vermiculita
Largamente explorada durante os últimos 60 anos, a vermiculita (Figura 6a) é um
aluminossilicato hidratado de magnésio, ferro e alumínio, de fórmula molecular [(Mg, Fe)3
[(Si, Al)4 O10] [OH]2 4H2O], formado por meio de alteração hidrotérmica em baixa
temperatura ou por intemperismo de minerais do tipo mica como biotita, ilita, flogopita ou
muscovita.Quando essa alteração hidrotérmica ocorre de forma completa, a tendência é que a
vermiculita apresente partículas de tamanho pequeno, e consequentemente, possua uma maior
quantidade de minerais interestratificados. (ALI et al., 2014; HUO et al., 2012; BEZERRA,
2014; BARABASZOVÁ; VALÁŠKOVÁ, 2013; UGARTE et al., 2008; SCHACKOW et al,
2014).
Figura 6 - Ilustração da vermiculita não expandida (a) e expandida (b).
O nome vermiculita advém do latim vermiculare – que significa “criar vermes” e
refere-se à característica de esfoliação aprerefere-sentada por esrefere-se tipo de sólido quando o mesmo é
rapidamente aquecido, apresentando movimentação parecida com a de vermes, como pode ser
notado na Figura 6b (TANG et al., 2012; DEER et al., 2010; UGARTE et al., 2008). Essa
argila é constituída pelo argilomineral de mesmo nome, que apresenta estrutura cristalina
lamelar, classificado como 2:1, ou seja, constituído por duas folhas tetraédricas e uma
octaédrica, formando uma lamela TOT (tetraedro - octaedro - tetraedro), Figura 7. Sendo
essas lamelas separadas por uma ou duas camadas de moléculas de água arranjadas em um
formato hexagonal (TANG et al., 2012; HONGO et al., 2012; WANG et al, 2011).
Figura 7 – Estrutura da vermiculita.
Fonte: Adaptado de Brand (2014).
As folhas tetraédricas desse argilomineral são compostas por SiO4, onde o Si4+ pode ser
substituído por Al3+.As folhas octaédricas são constituídas por átomos de alumínio, oxigênio
e hidrogênio, formando AlO(OH), em que o Al3+ pode ser trocado por Mg2+ ou Fe2+ (WANG
et al., 2013; BRIGATTI et al., 2006; MAQUEDA et al., 2009). Essas substituições
isomórficas, fazem com que tanto as folhas tetraédricas quanto as octaédricas possuam carga
negativa. Dessa forma, a estrutura do argilomineral terá uma deficiência de cargas, que será
compensada (equilibrada) por cátions trocáveis (Na+, K+, Ca2+ entre outros) presentes no seu
espaço interlamelar, ocasionando a possibilidade de troca catiônica (PADILLA-ORTEGA et
Na Tabela 1, pode ser observado que dentre os argilominerais mais conhecidos, a
vermiculita, é o que possui a maior capacidade de troca catiônica (CTC) sendo estimada em
valores na faixa de 1000 a 1500 mmolc/kg. De acordo com Costa (1999) as variações nos
valores da CTC em argilominerais podem ser relacionadas à interestratificação dos mesmos
com outros minerais, o grau de substituição isomórfica na grade cristalina e o grau de
intercalamento por metais entre as folhas de alumina e siloxana. A CTC tem sido expressa de
acordo com o sistema internacional de unidades (SI) em mmolc/kg (milimol de carga por kg
de solo), cmolc/kg (centimol de carga por kg) ou meq/100 g (milequivalente por 100 g de
solo), onde 1 meq/100 g = 10 mmolc/kg = 1 cmolc/kg.
Tabela 1 - Capacidade de troca catiônica de alguns argilominerais.
Fonte: Adaptado de Bezerra (2014) e Ronquim (2010).
O uso da vermiculita bem como sua descoberta ocorreu nos Estados Unidos
(SZNELWAR; SCALABRIN, 2009). No Brasil sua exploração teve início na década de 50
em São Paulo (Tatuí), porém foi identificada em 1942 no município de Liberdade –MG.
Atualmente, a vermiculita, é extraída de jazidas encontradas nos estados da Paraíba, Goiás,
Pernambuco e Bahia. No ano de 2012, segundo Paula (2013), essas jazidas foram
responsáveis pela produção de 51.986 toneladas de vermiculita, e um consumo interno de
15.388 toneladas, sendo sua industrialização realizada por empresas de pequeno e médio porte
como, por exemplo, a Brasil Minérios Ltda. e a Mineração Phoenix Ltda (PAULA, 2013;
SZNELWAR; SCALABRIN, 2009). Com isso, o Brasil ocupou no ano de 2012, a quarta
posição mundial na sua produção, com 9,1 % da produção total, perdendo apenas para África
do Sul (34 %), China (20,9 %) e EUA (17,4 %) (PAULA, 2013; SZNELWAR;
SCALABRIN, 2009).
ARGILOMINERAIS CTC (mmolc/kg)
Caulinita 10 – 150
Sepiolita 200 – 350
Ilita 100 – 500
Montmorillonita 500 – 1000
3.2.3.1 Aplicações da Vermiculita.
Em virtude das propriedades citadas e por ser um material facilmente encontrado e
consequentemente de baixo custo, a vermiculita possui uma ampla gama de aplicações. A
argila comercializada é aplicada de acordo com sua granulometria e pureza: com
granulometria mais fina são aplicadas na construção civil, na produção de fertilizantes e na
alimentação para animais e as de granulometria mais grossa são utilizadas para fins de
horticultura, cultivo e germinação de sementes (UGARTE et al., 2008).
Além disso, a vermiculita, pode ser utilizada na adsorção de compostos orgânicos (LIU;
LEE, 2014) e metais pesados (HONGO et al., 2012; PADILLA-ORTEGA et al., 2014),
devido suas propriedades de superfície, em particular, área específica, porosidade, elevado
espaçamento basal e alta CTC, fazendo com que a mesma possua maior interação com os
poluentes (ALI et al., 2014). Zhao (2008) aplicou a vermiculita natural e ativada com HCl – 2
mol L-1, na adsorção do corante azul de metileno (28,79 mg.L-1), chegou à conclusão que a
vermiculita ativada exibiu melhor capacidade de adsorção, cerca de 11, 7 mg.g-1, enquanto a
argila natural apresentou 6,88 mg.g-1.
A literatura também relata aplicações da vermiculita na catálise heterogênea e na
fotocatálise, normalmente como suportes catalíticos. Purceno (2012) aplicou a vermiculita,
após moição, na oxidação do corante índigo de carmim por meio do processo Fenton
heterogêneo em pH = 7. Através da espectroscopia de Mössbauer, conseguiu constatar que a
argila possuiu 70 % Fe3+ e 30 % de Fe2+, obtendo assim resultados igualmente eficientes ao
processo Fenton homogêneo. Wang (2013) usou a argila vermiculita natural e ativada como
suporte para o dióxido de titânio, utilizou o corante azul de metileno para testar a atividade
catalítica desses materiais por meio da fotocatálise. A partir disso, observou que os
catalisadores apresentaram um ótimo desempenho fotocatalítico, em função da sinergia entre
3.3 NIÓBIO
Descoberto no início do século XIX pelo químico inglês Charles Hatchett, o nióbio
(Nb), é um elemento químico que fica localizado na tabela periódica no grupo V, na segunda
série dos metais de transição (5º período/bloco d), possui número atômico 41 ([Kr] 4d4, 5s1),
massa molar igual a 92,90637 g/mol, raio atômico e eletronegatividade iguais a 2,08 nm e
-1,6, respectivamente. No entanto, assim que foi encontrado esse elemento recebeu o nome de
“colômbio” e apenas quarenta e três anos após, em 1844, foi que o químico/mineralogista
Heinrich Rose extraiu um metal de uma amostra de tântalo e nomeou-o como nióbio, em
homenagem a mitologia grega onde a deusa Nióbe é a filha do rei Tântalo (SOUSA et al.,
2013; LEITUNE et al., 2013; PEREIRA JÚNIOR, 2009; AZEVEDO, 2010).
O nióbio, Figura 8, é um metal refratário, que apresenta estrutura cúbica de corpo
centrado, que pode ser encontrado em cinco estados de oxidação (Nb+5 a Nb-1), sendo o mais
estável o que apresenta número de oxidação (Nox) igual a +5 (DOKUMACI et al, 2013;
BURNHAM et al., 2012; NOWAK; ZIOLEK, 1999).
Figura 8 – Nióbio Metálico.
Fonte: CBMM (2014).
Apesar da pouca quantidade presente na crosta terrestre (20 mg/kg), o nióbio, destaca-se
por suas características físico-químicas, tais como: a baixa densidade (8,57 g/cm³), elevados
ponto de fusão (2468 ºC) e ebulição (4744 ºC), resistência ao ataque de ácidos com exceção
do ácido fluorídrico ou mistura de HF/HNO3, reatividade com oxigênio e nitrogênio em
quando puro, possui excelente ductilidade e maleabilidade (YANG et al., 2014; SILVA, 2010;
YOON, 2010; ANDRADE et al., 2000; PEREIRA JÚNIOR, 2009).
Essas propriedades fizeram com que o nióbio fosse largamente utilizado na indústria
nuclear, no processo de fabricação de aço para estabilizar a estrutura de fase de aços
inoxidáveis, em equipamentos eletrônicos e de diagnóstico como o RMN, no
desenvolvimento de materiais como superligas à base de Ni, (YANG et al., 2014;
DOKUMACI et al, 2013; YOON, 2010). Esse metal também é aplicado em aceleradores de
partículas subatômicas, em implantes cirúrgicos como ligas de nióbio-titânio, nas indústrias
automobilística, naval (plataformas marítimas), aeroespacial (na fabricação de propulsores e
injetores de foguetes) e de construção civil (edifícios, pontes) entre outros (PEREIRA
JÚNIOR, 2013; PEREIRA JÚNIOR, 2009; SOUSA et al., 2013; LIMA, 2010).
O nióbio foi um material pouco utilizado e de custo elevado, diferentemente dos dias de
hoje, restringindo-se o seu uso na produção de superligas e aço inoxidáveis. Isso acontecia,
porque esse metal era produzido por meio do tratamento de um mineral pouco abundante
conhecido como columbita-tantalita (Fe, Mn) (Nb, Ta2) O6 (PEREIRA JÚNIOR, 2009).
Entretanto, descobriu-se na década de 50, no Brasil e Canadá, reservas de outro mineral
chamado de pirocloro (Na3, Ca)2 (Nb, Ti) (O, F)7, onde o nióbio está na forma de óxido, e
com isso houve uma melhoria na disponibilidade e consequentemente no preço desse metal
(NOGUEIRA, 2011; AZEVEDO, 2010; PEREIRA JÚNIOR, 2009; LIMA; 2010; SOUSA,
2013).
O Brasil, de acordo com dados do Departamento Nacional de Produção Mineral –
DNPM, apresenta a maior reserva mundial de pirocloro com cerca de 10.565.750 toneladas,
seguido de Canadá e Austrália. As reservas brasileiras estam distribuídas nos estados de
Minas Gerais (Araxá), Goiás, Amazonas, Rondônia e Paraíba. No ano de 2012, a Companhia
Brasileira de Metalurgia (CBMM), Mineração Anglo American Brasil Ltda. e Mineração
Taboca (LIMA, 2010), responsáveis pela produção de pirocloro, totalizaram 95,52 % da
produção mundial do mesmo, equivalente, a 82.214 toneladas de nióbio (PEREIRA JÚNIOR,
2013).
O elemento químico nióbio tem se destacado na forma de óxido, em especial nas
pesquisas científicas na área de catálise heterogênea oxidativa, como poderá ser visto
posteriormente. A nióbia, pentóxido de nióbio ou óxido de nióbio desidratado (Nb2O5) é um
material multifuncional, estável termodinamicamente, que apresenta um alto ponto de fusão
(1512 °C), além disso é um óxido anfótero (adsorve cátions em meio básico e ânions em meio
metálico é insolúvel em água podendo ser dissolvido por ácido fluorídrico e alcalino fundido
(ZIOLEK, 2003; NOWAK; ZIOLEK, 1999).
O Nb2O5 exibe normalmente uma considerável área especifica, alta atividade e
seletividade catalítica em virtude da presença de sítios ácidos fortes na sua superfície
(ANDRADE, 2014), onde essa acidez advém da presença de distorções nos poliedros que
constituem a nióbia, NbO6, NbO7, e NbO8 (LEITE et al., 2006). Por isso, tem sido utilizado
com êxito como catalisador em reações de alquilação (YAMASHITA et al., 2006),
desidratação (LIU et al., 2013), esterificação (BASSAN et al., 2013). Além do que, também
possui aplicação em dispositivos ópticos e eletrocrômicos (DHAWAN et al., 2014;RANI et
al., 2013) e na fotocatálise (SREETHAWONG et al., 2013).
Assim como a nióbia, o oxihidróxido de nióbio (NbO2OH) é insolúvel em meio aquoso,
porém é formado a partir da hidrólise de um complexo de nióbio solúvel em água gerando um
precipitado de coloração branca, possuindo uma elevada acidez, H0 -> 5,6 - 8,2 (KITANO et
al., 2014), sobretudo na sua forma hidratada Nb2O5.nH2O (ácido nióbico/pentóxido de nióbio
hidratado) (DURÃES et al., 2013; NOWAK; ZIOLEK, 1999).
O NbO2OH é um material amorfo dependendo da temperatura de aquecimento, que
apresenta algumas estruturas octaédricos NbO6 com elevadas distorções, diretamente
relacionados a acidez de Lewis por possuírem ligações Nb=O (LADERA, 2012; BARROS et
al., 2008; NOWAK; ZIOLEK, 1999). O aparecimento destas distorções e a localização das
mesmas, de acordo com Barros (2008), dependerá do conteúdo de nióbio, das propriedades do
suporte e da química do grupo hidroxila. Normalmente, quando esse material é incorporado
em suportes que apresentam superfícies básicas apresentará apenas sítios NbO6. No entanto,
os que possuem superfícies ácidas, como as zeólitas, existirá tanto o NbO6 quanto as espécies
NbO7 e NbO8 com pouca distorção, onde essas espécies possuem ligações Nb-O associadas a
sítios ácidos de Brönsted (LADERA et al., 2012; NOWAK; ZIOLEK, 1999; JEHNG;
WACHS, 1990).
A acidez do óxido de nióbio hidratado ao ser submetido a aquecimento de até 300 °C,
equivale a 70 % da acidez do ácido sulfúrico. No entanto, ao ser calcinado a mais de 500 ºC
suas propriedades de ácido forte desaparecem, diferentemente de outros óxidos metálicos que
aumentam sua acidez com a eliminação de água superficial (KITANO et al.,2014; NOWAK;
ZIOLEK, 1999; TANABE,1987; TANABE, 2003). Essa mudança de acidez está inteiramente
associada com mudanças de fases, ou seja, polimorfismos decorrentes do seu complexo
esqueleto estrutural que sofre cristalização conforme a variação da sua temperatura de
influenciado pelos materiais de partida, impurezas e interações com outros componentes.
Essas interações afetam tanto a mobilidade quanto as propriedades dos sistemas contendo
pentóxido de nióbio (acidez e redutibilidade).
Tabela 2 – Estruturas e Fases do oxihidróxido de nióbio em diferentes temperaturas.
Fonte: Adaptado de Ko (1990).
3.3.1 Aplicações do Oxihidróxido de Nióbio.
Os compostos de nióbio, em especial óxido de nióbio hidratado, têm sido aplicados em
processos de adsorção e vêm apresentando um bom desempenho por possuírem capacidade de
troca iônica, seletividade, ser de fácil preparação. Por outro lado, a rigidez da sua estrutura faz
com que o mesmo sofra pouca dilatação e compressão quando está em solução aquosa
(RODRIGUES; SILVA, 2009). Tagliaferro (2011) sintetizou o óxido de nióbio hidratado por
precipitação em solução homogênea (PSH), aplicou o mesmo na adsorção de metais pesados
(Pb2+, Ag+ e Cd2+). A partir disso, constatou que o óxido de nióbio apresentou as seguintes
capacidades de adsorção 452,5, 188,68 e 8,85 mg g-1 para os íons Pb2+, Ag+ e Cd+2
respectivamente. Essa diferença entre a capacidade de adsorção indicou que o óxido de nióbio
(V) hidratado é altamente seletivo entre os íons estudados.
Na catálise heterogênea os compostos de nióbio podem ser empregados como fase ativa
ou como suporte para outros óxidos metálicos. A literatura vem relatando o êxito desses
compostos na degradação de poluentes orgânicos, principalmente por poderem ter suas
propriedades alteradas pela geração de grupos oxidantes ao entrarem em contato com
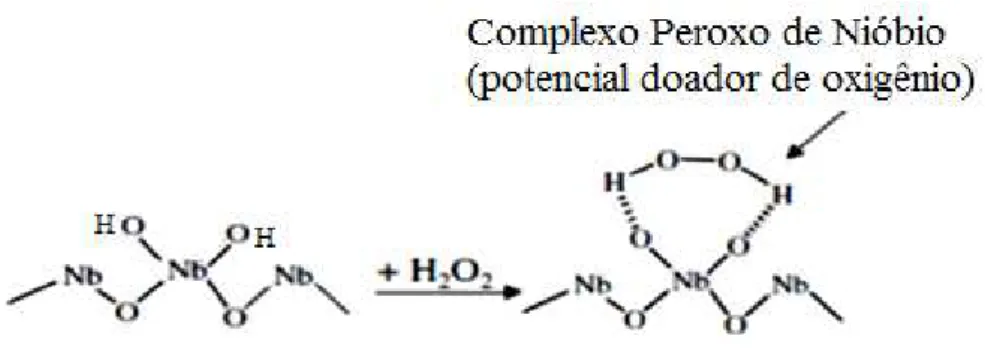
peróxido de hidrogênio, conhecidos como complexo peroxo de nióbio (Figura 9).
Temperatura (°C) Estrutura Fase
100-300 - Amorfa
400-500 Hexagonal TT
500-600 Ortorrômbica T
600-800 Monoclínica M-B
Figura 9 – Esquema da geração do complexo peroxo de nióbio na superfície do oxihidróxido de nióbio.
Fonte: Adaptado de Esteves (2008).
Esse complexo possui a capacidade de liberar oxigênio, causando oxidações de
diferentes substratos orgânicos e/ou inorgânicos em fase líquida (CHAGAS et al., 2013;
ESTEVES et al., 2008). Além disso, os compostos de nióbio também apresentam capacidade
fotocatalíticas (ANDRADE, 2014). Oliveira (2014) modificou o oxihidróxido de nióbio,
NbO2OH, com um surfactante para aplicação do mesmo na dessulfurização oxidativa. O
material foi tratado com peróxido de hidrogênio para gerar espécies peroxo sobre a superfície
e foi capaz de remover eficazmente um composto sulfuroso sob condições suaves. Lopes
(2014) avaliou a eficiência do óxido de nióbio hidratado como fotocatalisador com relação ao
TiO2 usando o corante rodamina B (RhB) sob a radiação UV. Com isso, foi notado que a
constante de velocidade da reação de fotodegradação do corante foi aproximadamente cinco
vezes maior quando catalisada por amostras de Nb2O5 do que com fotólise direta, e cerca de
duas vezes maior quando catalisada pelo TiO2. Isso pode estar relacionado ao band gap desse
material variar entre 3,1 a 4,0 eV e aos grupos hidroxilas presentes na sua superfície.
Com intuito de conhecer a eficiência de catalisadores heterogêneos, alguns métodos
para remoção de poluentes orgânicos podem ser usados tais como adsorção e os processos
3.4 ADSORÇÃO
Devido a simplicidade de operação, baixo custo e a não geração de substâncias químicas
que prejudicam o ecossistema e a saúde dos seres humanos, a adsorção, é um método
utilizado na descontaminação de águas poluídas por corantes e/ou pesticidas e na remoção de
gases poluentes como o CH4, (YAGUB et al., 2014; LI et al., 2013; RAFATULLAH et al.,
2010).
A Figura 10 ilustra o processo de adsorção entre adsorbato (gás) e adsorvente (sólido),
como pode ser visto, ocorre uma aglomeração do adsorbato sobre a superfície do adsorvente.
A eficiência desse processo dependerá da interação adsorbato-adsorvente, da área específica
do adsorvente, da quantidade de adsorvente e de adsorbato, do tamanho das partículas do
adsorvente, da temperatura e pH do meio e do tempo de contato entre adsorbato e adsorvente
(YAGUB et al., 2014).
Figura 10 - Elucidação do fenômeno da adsorção na fase gás-sólido.
Fonte: Mimura (2010).
O modo como moléculas e íons adsorvem na interface sólida de um adsorvente pode ser
de forma química ou física, sendo então o processo de adsorção classificado em dois tipos:
adsorção química (quimissorção) e adsorção física (fisissorção).
A quimissorção é caracterizada pela ocorrência de fortes ligações químicas entre o
adsorbato e a superfície do adsorvente. Normalmente essas ligações são do tipo covalente,
mas também podem ocorrer ligações por troca de elétrons, em virtude disso esse tipo de
adsorção é irreversível, ocorre de forma lenta, apresenta entalpia na faixa de 200 kJ/mol e
fisissorção ocorrem interações fracas entre adsorbato-adsorvente chamadas de forças
intermoleculares do tipo Van der Waals, de forma que esse processo pode ser reversível,
resulta em multicamadas do adsorbato sobre o adsorvente e apresenta entalpia na faixa de 20
kJ/mol (YAGUB et al., 2014; MIMURA et al., 2010).
O carvão ativado, resíduos industriais, as argilas naturais, zeólitas, óxidos metálicos
hidratados e os compósitos (junção de dois materiais com características físico-químicas
diferentes), são exemplos de materiais adsorventes. Alguns deles serão comentados a seguir:
(a) Carvão Ativado (Figura 11a): é o adsorvente mais utilizado na remoção de
poluentes, formado por uma mistura de materiais carbonáceos e minerais. Normalmente
encontrado comercialmente ou obtido a partir da queima de materiais naturais, como
biomassa, hulha e cascas de amendoim, o que faz com que seu custo seja reduzido.
(RAFATULLAH et al., 2010).
(b) Bioadsorventes: São materiais biológicos como a quitina, quitosana, turfa,
leveduras, fungos ou biomassa bacteriana, que têm sido aplicados na remoção de poluentes do
ecossistema (AHMARUZZAMAN, 2008). Comparados com o carvão ativado, os
bioadsorventes têm maior seletividade, menor custo e pode chegar a reduzir a concentração de
corante para níveis de ppb (RAFATULLAH et al., 2010). A Figura 11b mostra um exemplo
de biossorventes, a casca de nozes.
(c) Resíduos Industriais e Agrícolas: Esses adsorventes são de baixo custo, abundantes
na natureza e possuem boas características físico-químicas. Podem ser citados como exemplos
desse tipo de adsorvente: as folhas, fibras, cascas de frutas, sementes, serragem, casca, cinzas
(Figura 11c) e lama vermelha (RAFATULLAH et al., 2010; YAGUB et al., 2014).
Figura 11 – Exemplos de adsorventes (a) carvão ativado, (b) biossorventes (cascas de nozes) e (c) resíduo industrial (cinzas).
3.5 PROCESSOS OXIDATIVOS AVANÇADOS (POAs).
Os processos oxidativos avançados (POAs) são vistos como um método propício para
realizar degradação de moléculas biologicamente e quimicamente estáveis (CERNIGOJ et al.,
2007). Diferentemente da precipitação química, adsorção e volatilização, os POAs não
transferem poluentes de uma fase para outra e nem produzem um quantidade elevada de lodo.
Por isso, é considerado um processo químico vantajoso e conhecido como “amigos do
ambiente” (AYOUB et al., 2010).
Segundo Arruda (2007) os processos oxidativos avançados (POAs), envolvem a geração
de radicais altamente reativos como o radical hidroxila (·OH), capazes de oxidar
contaminantes orgânicos, gerando substâncias sem toxidade (sais inorgânicos, H2O, CO2). O
radical hidroxila produzido é um agente oxidante forte (E° = 2,81 eV) comparado a outros
oxidantes e só existem durante o processo de oxidação, sendo reduzido a hidróxido ou
produzindo água a partir da combinação com íons H+ (AYOUB et al., 2010). O que diferencia
o radical hidroxila dos outros é a não seletividade, devido a isso ele normalmente ataca grupos
orgânicos convertendo-os a produtos com baixa complexidade e menos prejudiciais, sendo
possível mineralizar o composto orgânico poluente dependendo das condições utilizadas
(AYOUB et al., 2010).
A oxidação de substâncias orgânicas através do radical hidroxila pode ser realizada a
partir de três mecanismos, Figura 12, utilizados em reações químicas simples: adição
eletrofílica radicalar, transferência eletrônica e abstração de hidrogênio (BRITO; SILVA,
2012).
Figura 12 - Mecanismos utilizados na oxidação de substâncias orgânicas (a) adição eletrofílica radicalar, (b) transferência eletrônica, (c) abstração de hidrogênio.
Os processos oxidativos avançados são realizados por via, homogênea ou heterogênea,
onde o radical hidroxila está presente em todos eles, e podem acontecer estando ou não sob
irradiação. Como exemplos de POAs, podem ser citados: H2O2/catalisador, O3/catalisador
O3/H2O2, ozônio (O3), sistema Fenton homogêneo e heterogêneo, oxidação fotocatalítica
(H2-O2/UV, H2O2/catalisador/UV, UV/catalisador, ozônio/UV, foto-Fenton) entre outros (LAFI et
al., 2006; AMORIM et al., 2009).
3.5.1 Fotocatálise
A fotocatálise ocorre em presença de luz UV, necessária para ativar o catalisador. A
fotocatálise homogênea faz uso de materiais que podem ser dissolvidos em solução como O3,
H2O2, possuindo normalmente eficiência baixa. A fotocatálise heterogênea ocorre na presença
de materiais sólidos semicondutores juntamente com a irradiação UV ou na presença dos dois
anteriores mais um agente oxidante como o H2O2 (YUN et al., 2013).
Os materiais semicondutores utilizados na fotocatálise constituem-se por bandas de
valência (BV) e condução (BC). Esses materiais apresentam uma região energética entre a BV
e a BC chamada de “band-gap”, como exemplos desse tipo de materiais, podem ser citados o
TiO2, Fe2O3, Nb2O5, ZnO, CdS, entre outros (JIN; DAI, 2012).
A fotocatálise heterogênea começou a ser estudada na década de 70 e tem como
princípio empregar a luz solar ou artificial para a ativação de um material semicondutor
(NOGUEIRA; JARDIM, 1998). A luz solar apresenta desvantagens como possuir incidência
apenas uma parte do dia e emitir uma pequena quantidade de radiação UV (cerca de 7 %).
Porém, destaca-se por não apresentar gastos com energia elétrica, consequentemente,
abaixando o custo operacional do processo (HU et al., 2014; PERA-TITUS et al., 2004), por
isso, a luz solar foi usada para a ativação dos catalisadores no presente trabalho.
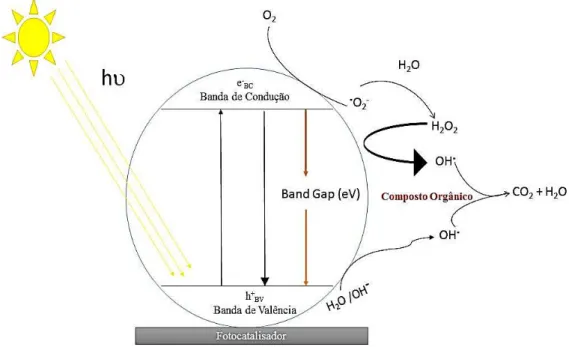
O processo fotocatalítico (Figura 13) pode ser explicado da seguinte maneira:
primeiramente fótons (h) proveniente da luz UV são incididos na superfície do
fotocatalisador. Os fótons com energia superior à energia de band-gap são absorvidos pelo
fotocatalisador fazendo com que ocorra transição eletrônica da banda de valência do material
para a banda de condução, acarretando a geração de buracos na banda de valência (h+BV) e
elétrons na banda de condução (e-BC), formando um par elétron/lacuna (YUN et al., 2013). Na
banda de valência são gerados radicais hidroxila (OH.) em decorrência da lacuna formada ser
semicondutor. As espécies receptoras de elétrons (O2) reagem com e-BC para formar ânions
superóxidos, em seguida originando o radical hidroxila. Por fim, os radicais hidroxilas que
são formandos tanto na BC como na BV reagem com moléculas orgânicas degradando a
mesma e gerando, normalmente, produtos como água e CO2. Como pôde ser
notado, a fotocatálise é fundamentada na geração de radicais hidroxila, por isso ela faz parte
da classe dos POAs (YUN et al., 2013; BRITO; SILVA, 2012; NOGUEIRA; JARDIM, 1998;
BAHNEMANN, 2004).
Figura 13 – Diagrama de um processo fotocatalítico sobre a superfície de um fotocatalisador.
Fonte: Adaptado de Yun (2013); Murakami (2010).
A literatura tem mostrado que o TiO2 é um material favorável para ser empregado em
processos fotocatalíticos por apresentar algumas vantagens como não ser tóxico,
insolubilidade em água, fácil disponibilidade, baixo custo, fotoestabilidade (YUN et al.,
2013). Entretanto, o dióxido de titânio apresenta um band-gap muito grande (3,2 eV), o que
demanda maior energia para sua ativação, sendo possível usar como substituto favorável a
esse material, o óxido de nióbio, por apresentar um band gap próximo ao do TiO2. Além
disso, o óxido de nióbio apresenta a possibilidade de diminuir o seu band-gap após
modificações (ESTEVES et al., 2008; LOPES et al., 2014).
Apesar da potencialidade da fotocatálise, alguns pontos ainda precisam ser
aperfeiçoados, como a preparação de novos fotocatalisadores que possuam um menor
fotoatividade e consigam absorver uma maior quantidade de luz solar para que melhore seu
rendimento (NOGUEIRA; JARDIM, 1998).
3.6 CORANTES
Os corantes são compostos químicos na grande maioria orgânicos de estruturas
aromáticas complexas, coloridos e resistentes em especial a detergentes. Esses materiais são
usados basicamente para conferir cor a diversos tipos de materiais produzidos pelas indústrias
têxtil (GUARATINI; ZANONI, 2000), de papel, de couro, de cosméticos etc. (YAGUB et al.,
2014; ZHANG et al., 2013).
Historicamente, os corantes vêm sendo empregados pela humanidade desde da
antiguidade, sendo obtidos através de matéria-prima animal ou vegetal. O pau-brasil, por
exemplo, é uma planta característica do Brasil, empregada para extrair um corante vermelho e
por causa disso foi bastante exportada pelos portugueses após o descobrimento do país
(século XV).
Os corante orgânicos de origem sintética surgiram em 1856 quando William Perkin
sintetizou o primeiro, chamado de “Púrpura de Tiro” (Figura 14), substância de cor púrpura
forte, resistente a luz e a lavagem. Essa descoberta despertou o interesse de químicos do
mundo inteiro a sintetizar outros tipos de corantes orgânicos, surgindo corantes como
alizarina, índigo, entre outros. Com isso, no final do século XIX a extração dos corantes a
partir de fontes naturais foi substituída pelas indústrias dos corantes que possuíam a sua
disposição cerca de 2.000 corantes sintéticos (MENDA et al., 2011).
Figura 14 – Estrutura do corante Púrpura de Tiro.
Fonte: Yúfera (1996).
Nos dias atuais, mais de 100.000 corantes comerciais são conhecidos e possuem uma