UNIVERSIDADE ESTADUAL PAULISTA - UNESP
CAMPUS DE JABOTICABAL
TOXICIDADE E EFEITOS SUBLETAIS DE TOXINAS Cry DE
Bacillus thuringiensis
BERLINER EM DIFERENTES POPULAÇÕES
DE
Plutella xylostella
(L.) (LEPIDOPTERA: PLUTELLIDAE) EM
LABORATÓRIO
Caroline Placidi De Bortoli
Médica VeterináriaUNIVERSIDADE ESTADUAL PAULISTA - UNESP
CAMPUS DE JABOTICABAL
TOXICIDADE E EFEITOS SUBLETAIS DE TOXINAS Cry DE
Bacillus thuringiensis
BERLINER EM DIFERENTES POPULAÇÕES
DE
Plutella xylostella
(L.) (LEPIDOPTERA: PLUTELLIDAE) EM
LABORATÓRIO
Caroline Placidi De Bortoli
Orientador: Prof. Dr. Ricardo Antonio Polanczyk
Dissertação apresentada a Faculdade de Ciências Agrárias e Veterinárias – Unesp, Campus de Jaboticabal, como parte das exigências para a obtenção do título de Mestre em Agronomia (Entomologia Agrícola)
Ficha catalográfica elaborada pela Seção Técnica de Aquisição e Tratamento da Informação - Serviço Técnico de Biblioteca e Documentação – UNESP, Campus de Jaboticabal.
e-mail: carubortoli@yahoo.com.br
De Bortoli, Caroline Placidi
D287t Toxicidade e efeitos subletais de toxinas Cry de Bacillus thuringiensis Berliner em diferentes populações de Plutella xylostella (L.) (Lepidoptera: Plutellidae) em laboratório. Caroline
Placidi De Bortoli – Jaboticabal, 2014
ix, 95 p.; 28 cm
Dissertação de Mestrado – Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, 2014
Orientador: Ricardo Antonio Polanczyk
Banca examinadora: Ricardo Antonio Polanczyk, Manoel Victor Franco Lemos, Moisés João Zotti
Bibliografia
1. Resistência. 2. Suscetibilidade. 3. Virulência.
4. Traça-das-crucíferas. 5. Modo de ação. 6. Concentração Letal 50 (CL50). I. Título. II. Jaboticabal-Faculdade de Ciências Agrárias e
Veterinárias.
DADOS CURRICULARES DA AUTORA
“Que os vossos esforços desafiem as impossibilidades, lembrai-vos de que as grandes coisas do homem foram conquistadas do que parecia impossível.”
Aos meus pais, Mariângela e Sergio, e ao meu namorado, Rafael, pelo
incentivo, companheirismo, carinho e amor incondicional. Sempre me apoiando e
presentes na minha vida.
AGRADECIMENTOS
A Deus pelo dom da vida.
À Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, Campus de Jaboticabal, e ao Departamento de Fitossanidade pela oportunidade de realização do curso de pós-graduação.
À Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) pela concessão da bolsa de estudos.
Ao Prof. Dr. Ricardo Antonio Polanczyk, pela orientação e ajuda na realização deste trabalho.
Ao Prof. Dr. Neil Crickmore, pela orientação, paciência, oportunidade, ajuda e ensinamentos.
Ao Prof. Dr. e pai Sergio Antonio De Bortoli, pela paciência, ajuda, ensinamentos e carinho.
Ao colega de pós-graduação e namorado Rafael Ferreira dos Santos, pelo amor, companheirismo, paciência, grande ajuda, por estar sempre ao meu lado e por saber que sempre posso contar com ele.
À Dra. Alessandra Marieli Vacari, pós-doutoranda do Laboratório de Biologia e Criação de Insetos (LBCI), amiga e irmã “postiça”, pela paciência, apoio e auxílio em todas as etapas deste trabalho.
À equipe do LBCI (Vanessa Fabíola Pereira de Carvalho, Maíra Trevisan, Natália Fernanda Vieira, Wanderley Dibelli, Gustavo Oliveira de Magalhães, Rogério Teixeira Duarte e Sergio Leandro Placidi De Bortoli), pelo apoio e amizade, sem contar a ajuda durante a realização dos experimentos. Em especial às pós-graduandas Ana Carolina Pires Veiga, Valéria Lucas de Laurentis e Dagmara Gomes Ramalho pela amizade e ajuda inestimável.
Aos professores e funcionários do Departamento de Fitossanidade, pela convivência e auxílio sempre que necessário.
SUMÁRIO
Página
LISTA DE TABELAS... iii
LISTA DE FIGURAS... v
RESUMO... vi
ABSTRACT... viii
1.INTRODUÇÃO ... 2. REVISÃO DE LITERATURA... 1 3 2.1. Plutella xylostella... 3
2.1.1. Ocorrência e distribuição... 3
2.1.2. Descrição e biologia... 3
2.1.3. Danos... 4
2.1.4. Controle... 6
2.2. Bacillus thuringiensis... 8
2.2.1. Histórico... 8
2.2.2. Aspectos gerais... 9
2.2.3. As toxinas e a atividade inseticida... 12
2.2.3.1. -endotoxina... 13
2.2.4. Modo de ação... 14
2.2.5. Resistência... 17
3. MATERIAL E MÉTODOS... 21
3.1. Populações de Plutella xylostella... 21
3.2. Criação dos insetos... 22
3.3. Bioensaios com Plutella xylostella e toxinas Bt... 23
3.3.1. Bioensaios de patogenicidade... 3.3.2. Testes para a estimativa da concentração letal 50 (CL50)... 23 24 3.3.3. Efeitos subletais... 25
3.3.4. Análise estatística... 26 3.4. Ensaios enzimáticos com intestinos de Plutella xylostella...
3.4.1. Preparação dos intestinos...
3.4.2. Proteína total... 27
3.4.3. Gel de esterases... 27
3.4.4. Digestão da toxina... 27
3.4.5. Atividade total de proteases... 28
3.5. Estudos moleculares... 29
3.5.1. Extração do DNA... 29
3.5.2. Reação em cadeia de polimerase (PCR), com base no DNA do gene 16S r RNA bacteriano... 29
3.5.3. Reação em cadeia de polimerase (PCR), com base no gee ABCC2 – Exon... 29
3.5.4. Reação em cadeia de polimerase (PCR), com base no gene ABCC2 – Intron... 30
3.5.5. Eletroforese do DNA em gel de agarose... 30
3.5.6. Extração de amplímeros do gel de agarose... 31
3.5.7. Sequenciamento... 31
4. RESULTADOS E DISCUSSÃO... 32
4.1. Bioensaios com Plutella xylostella e toxinas Bt... 32
4.1.1. Bioensaios de patogenicidade... 4.1.2. Estimativa da Concentração Letal 50 (CL50)... 32 34 4.1.3. Efeitos subletais... 35
4.2. Ensaios enzimáticos e moleculares... 42
4.2.1. Proteína total... 42
4.2.2. Atividade total de proteases... 44
4.2.3. Digestão da toxina... 47
4.2.4. Gel de esterases... 48
4.2.5. Análise da bactéria intestinal... 50
4.2.6. Análise do Exon... 52
5. CONCLUSÕES... 54
6. REFERÊNCIAS BIBLIOGRÁFICAS... 55
LISTA DE TABELAS
Página Tabela 1. Mortalidade (%) de lagartas de terceiro ínstar de diferentes
populações de Plutella xylostella pela proteína Cry2Aa de Bacillus
thuringiensis...
Tabela 2. Mortalidade (%) de lagartas de terceiro ínstar de diferentes populações de Plutella xylostella pela proteína Cry1Ie de Bacillus
thuringiensis...
Tabela 3. Mortalidade (%) de lagartas de terceiro ínstar de diferentes populações de Plutella xylostella pela proteína Cry1Ac de Bacillus
thuringiensis...
Tabela 4. Respostas de concentração-mortalidade de lagartas de terceiro ínstar de diferentes populações de Plutella xylostella em relação à proteína Cry1Ac de Bacillus thuringiensis...
32
33
34
35
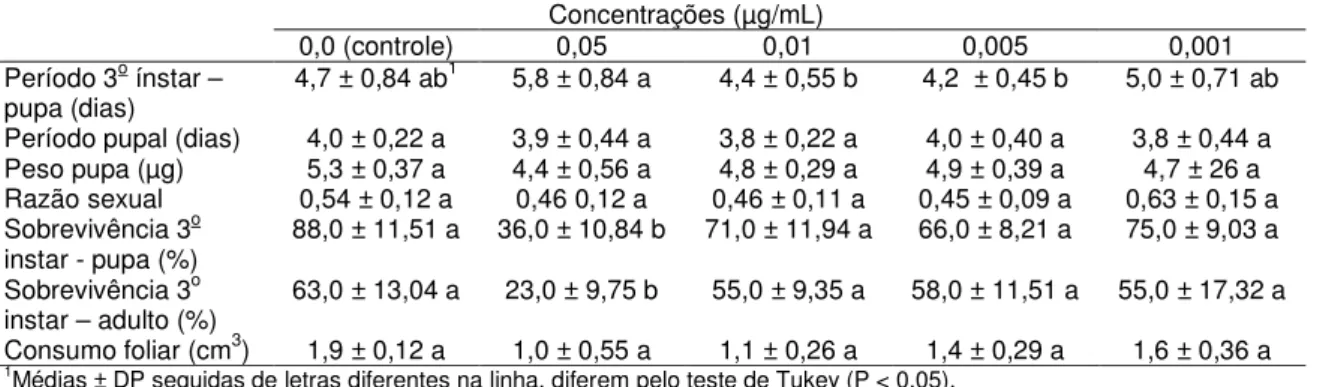
Tabela 5. Características biológicas de indivíduos da população Bt de Plutella xylostella após a exposição de lagartas a diferentes
concentrações da proteína Cry1Ac de Bacillus thuringiensis……….... 37
Tabela 6. Características biológicas de indivíduos da população PA de Plutella xylostella após a exposição de lagartas a diferentes
concentrações da proteína Cry1Ac de Bacillus thuringiensis……….... 38
Tabela 7. Características biológicas de indivíduos da população PC de Plutella xylostella após a exposição de lagartas a diferentes
concentrações da proteína Cry1Ac de Bacillus thuringiensis……….... 39
Tabela 8. Características biológicas de indivíduos da população SBT de Plutella xylostella após a exposição de lagartas a diferentes
concentrações da proteína Cry1Ac de Bacillus thuringiensis……….... 40
Tabela 9. Características biológicas de indivíduos da população PX de Plutella xylostella após a exposição de lagartas a diferentes
concentrações da proteína Cry1Ac de Bacillus thuringiensis……….... 41
solução dos intestinos das populações SBT, PX, Bt, PA, PC e UK e suas
réplicas... 44
Tabela 11. Absorbância da protease total (repetido 3 vezes) e a média da solução dos intestinos das populações SBT, PX, Bt, PA, PC e UK e
suas réplicas... 45
Tabela 12. Atividade específica de enzimas da solução dos intestinos
LISTA DE FIGURAS
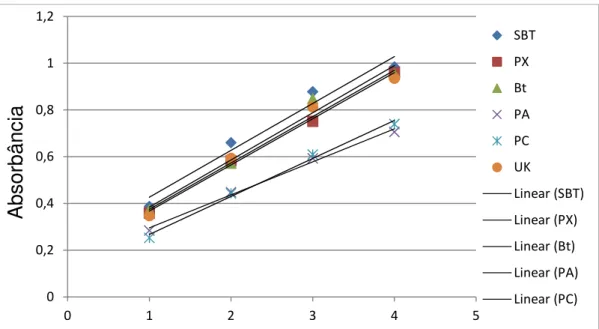
Página Figura 1. Comparação da absorbância da proteína total da solução de
intestino das populações SBT, PX, Bt, PA, PC e UK em quantidades diferentes (2,5µL, 5,0 µL, 7,5 µL and 10 µl), estabelecendo uma reta
padrão... 43
Figura 2. PAGE Mini-Gel representando a digestão da toxina (Cry1Ac) pelas enzimas intestinais das populações SBT, PA e PX. Os números
associados com a população representam as réplicas... 47
Figura 3. PAGE Mini-Gel representando a digestão da toxina (Cry1Ac) pelas enzimas intestinais das populações PC, BT e UK. Os números
associados com a população representam as réplicas... 48
Figura 4. PAGE Mini-Gel da atividade da esterase do intestino das
populações Bt, PX, PA, PC, SBT e UK... 49
Figura 5. PAGE Mini-Gel da atividade da esterase do intestino das
TOXICIDADE E EFEITOS SUBLETAIS DE TOXINAS Cry DE Bacillus thuringiensis BERLINER EM DIFERENTES POPULAÇÕES DE Plutella
xylostella (L.) (LEPIDOPTERA: PLUTELLIDAE) EM LABORATÓRIO
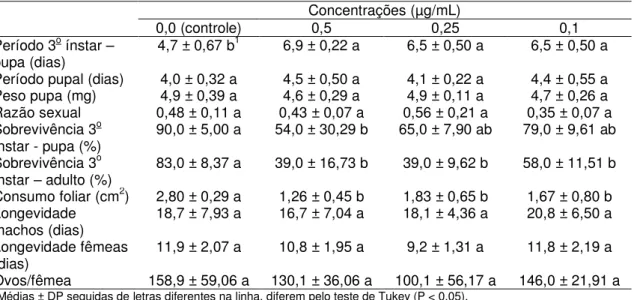
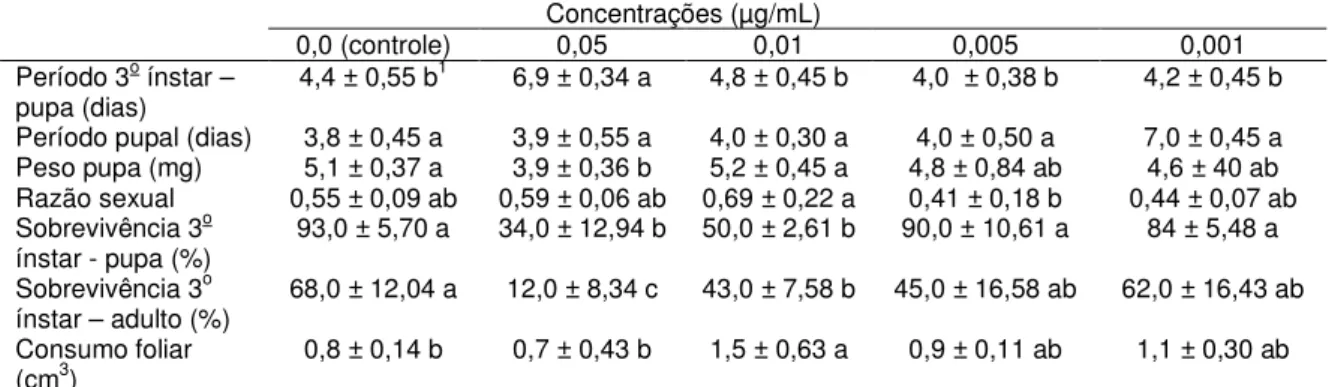
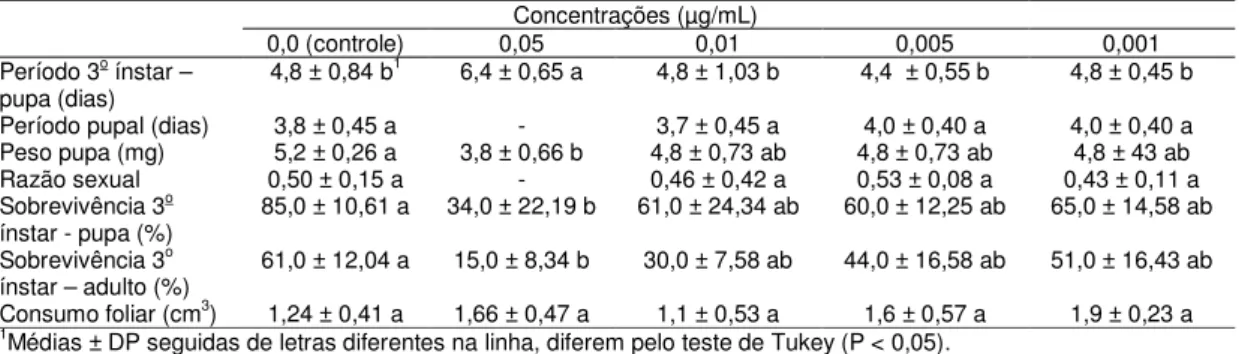
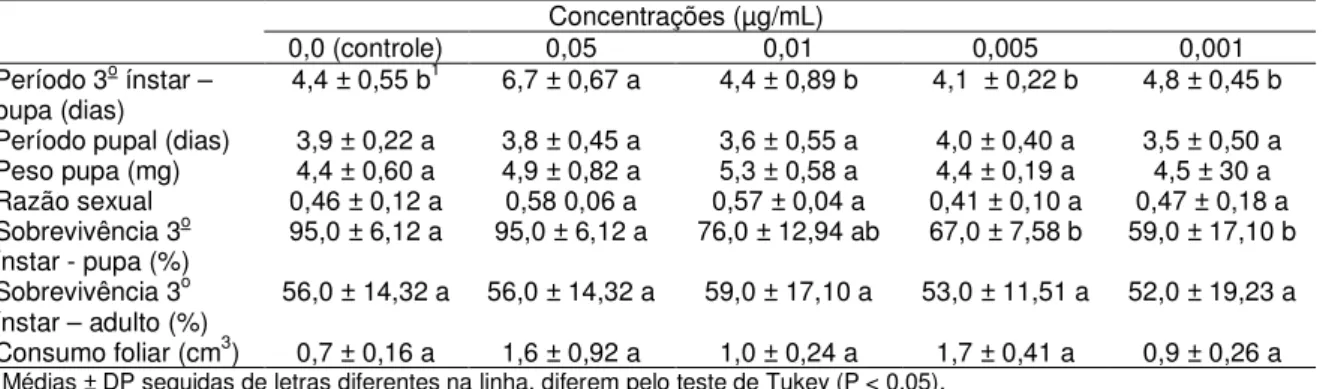
RESUMO - Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae), a traça-das-crucíferas, é um dos principais insetos-praga de crucíferas (Brassicaceae) no Brasil e em todo o mundo. Embora possa ser controlada tanto com inseticidas sintéticos como biológicos, populações de P. xylostella podem ser selecionadas rapidamente para a resistência a vários inseticidas químicos ou biológicos. Além disso, diferentes populações de P. xylostella podem surgir devido ao isolamento geográfico, resultando em isolamento reprodutivo e em populações fisiologicamente distintas, com diferentes sensibilidades a várias táticas de controle. Tal variação requer sistemas de gestão adaptados às populações em particular. Os bioinseticidas mais comuns utilizados para controlar P. xylostella baseiam-se na bactéria entomopatogênica Bacillus thuringiensis (Bacillaceae) (Bt). Apesar de muitos estudos focarem a ação do Bt em diversas pragas agrícolas, como P. xylostella, por exemplo, muitas dúvidas ainda persistem particularmente quanto aos seus efeitos subletais, mecanismo de ação e toxicidade das proteínas Bt. Assim, o objetivo desta pesquisa foi analisar a virulência e os efeitos subletais de proteínas Cry, bem como investigar fatores que afetam a suscetibilidade de insetos ao Bt (níveis de proteína, bactérias do intestino médio e mutações no gene ABCC2) em cinco populações brasileiras e uma da Inglaterra de P. xylostella. Foram realizados bioensaios de suscetibilidade com 5 populações brasileiras (PC, PA, Px, SBT e Bt) e uma da Inglaterra (UK) de P.xylostella e as proteínas Cry1Ac, Cry2Aa e Cry1IE de B. thuringiensis, estimando-se a virulência e avaliando os efeitos subletais das toxinas. Como as toxinas Cry2Aa e Cry1IE não causaram mortalidade nas lagartas de todas as populações, os testes foram realizados apenas com Cry1AC. Também foram conduzidos experimentos enzimáticos e moleculares com intestinos de lagartas das populações mencionadas para investigar fatores que afetam a suscetibilidade dos insetos às toxinas produzidas pelo Bt, analisando-se proteína total, protease total, atividade da protease, níveis de esterase, bactérias intestinais e análise de exon. O periodo de vida do 3o ínstar até pupa, periodo pupal, peso de pupas, razão sexual, sobrevivência do 3o ínstar a fase pupal, sobrevivência do 3o ínstar até a fase adulta e consumo foliar pela
lagarta foram os parâmetros avaliados nos efeitos subletais. As populações PC, PA, PX, SBT e Bt de P. xylostella apresentam diferentes níveis de suscetibilidade à toxina Cry1Ac, sendo a CL50 estimada para a população Bt 0,78 µg/mL,
enquanto que para a PX a CL50 estimada é de 0,01 µg/mL. Para as outras toxinas
efeitos subletais mais significativos foram verificados também no prolongamento do periodo larval e na emergência dos adultos. Em relação ao consumo foliar, não houve influência no consumo das lagartas pela presença da toxina Cry1Ac nas folhas, nas concentrações testadas, uma vez que a área foliar ingerida pelas larvas foi semelhante nos tratamentos, exceto com a população Bt, onde, na concentração de 0,05 µg/mL de toxina, o consumo foi significativamente menor. Os testes efetuados, tanto enzimáticos como moleculares, não foram conclusivos quanto os fatores que podem influenciar a suscetibilidade de P. xylostella às toxinas de Bt e estudos posteriores devem ser realizados para elucidar estes fatores.
TOXICITY AND SUBLETHAL EFFECTS OF Cry TOXINS from Bacillus thuringiensis BERLINER TO DIFFERENT POPULATIONS OF Plutella xylostella ( L. ) (LEPIDOPTERA : PLUTELLIDAE) IN LABORATORY
promote consumption significantly lower. The tests performed, both enzymatic and molecular, were inconclusive about the factors that may influence the susceptibility of P. xylostella to Bt toxins, and further studies should be conducted to elucidate these factors.
1. INTRODUÇÃO
Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae), a traça-das-crucíferas, é um dos principais insetos-praga de crucíferas (Brassicaceae) no Brasil e em todo o mundo (TALEKAR; SHELTON, 1993; SARFRAZ; DOSDALL; KEDDIE, 2006). Embora possa ser controlada tanto com inseticidas sintéticos como biológicos, populações de P. xylostella podem ser selecionadas rapidamente para a resistência a vários inseticidas (SAYYED et al., 2008). Além disso, diferentes populações de P. xylostella podem surgir devido ao isolamento geográfico, resultando em isolamento reprodutivo e em populações fisiologicamente distintas, com diferentes sensibilidades a várias táticas de controle. Tal variação requer sistemas de gestão adaptados às populações em particular.
Os bioinseticidas mais comuns utilizados para controlar P. xylostella baseiam-se na bactéria entomopatogênica Bacillus thuringiensis (Bacillaceae) Berliner (Bt) (VAN FRANKENHUYZEN, 2009; JURAT-FUENTES; JACKSON, 2012). Variações de suscetibilidade ao Bt em diferentes populações de P.
xylostella, bem como a outras pragas, como Spodoptera frugiperda (J.E. Smith, 1797) (Lepidoptera: Noctuidae), obtidas em países da América Latina e Europa, têm sido relatados na literatura (GONZALEZ-CABRERA et al., 2001; MONNERAT et al., 2006; POLANCZYK; ALVES; PADULLA, 2005).
Roux et al. (2007) utilizaram uma técnica de ISSR-PCR (Inter-Simple Sequence Repeat Polymerase Chain Reaction) para diferenciar 19 populações de
P. xylostella de vários países, ressaltando que nos trópicos o elevado número de gerações por ano pode favorecer o surgimento de mutações e, portanto, aumenta a diversidade entre os indivíduos, sendo que a alta pressão de seleção causada pela aplicação indiscriminada de agrotóxicos também favorece o surgimento de populações tolerantes ou resistentes aos agrotóxicos.
SHELTON, 1997; WRIGHT et al., 1997; DÍAZ-GOMEZ et al., 2000; ZHAO et al., 2000; SAYYED et al., 2005; MONNERAT et al., 2007; GONG et al., 2010; DE BORTOLI et al., 2012).
O modo de ação das toxinas do Bt, também denominadas -endotoxinas, envolve diversas etapas, como: ingestão do complexo esporo-cristal pela larva, solubilização e processamento da toxina, ligação ao receptor, inserção na membrana, formação do poro e citólise. As proteínas Cry apresentam–se na forma de pró–toxinas e precisam ser ativadas por proteases para liberarem fragmentos tóxicos (SCHNEPF et al.,1998; MONNERAT; BRAVO, 2000).
2. REVISÃO DE LITERATURA
2.1. Plutella xylostella
2.1.1. Ocorrência e distribuição
A traça das crucíferas, P. xylostella, é, provavelmente, originária da Europa Mediterrânea, local de origem das brassicáceas, e considerada praga cosmopolita, encontrada em diversas regiões produtoras do mundo, independente das condições climáticas (DIAS; SOARES; MONNERAT, 2004; MAU; KESSING, 2007). Além disso, tem a capacidade de migrar para diferentes zonas climáticas (CHAPMAN et al., 2002; COULSON et al., 2002).
2.1.2. Descrição e biologia
P. xylostella é um inseto de ciclo curto, em que a temperatura é fator determinante, pois em condições mais quentes o ciclo pode ser de apenas 12 dias, enquanto em regiões de temperaturas mais amenas é prolongado totalizando 20-25 dias. O número de gerações varia de 5 a 10 por ano, dependendo das condições climáticas e da disponibilidade de alimento, sendo que a densidade populacional da praga pode variar muito de um ano para o outro (DIAS; SOARES; MONNERAT, 2004).
A fêmea oviposita na face abaxial das folhas, geralmente acompanhando as nervuras, de forma isolada ou agrupada (THULER, 2009); são bastante férteis, ovipositando até 350 ovos durante o seu ciclo de vida. Os ovos são amarelos, pequenos, elípticos, aplanados e com relevos ondulados. São depositados isoladamente ou em grupos de 2 ou 3, sendo o período de incubação de 2 a 4 dias (GALLO et al., 2002).
A lagarta é inicialmente esbranquiçada, adquirindo pouco depois coloração verde-clara com cabeça parda; sobre o corpo notam-se pequenos “pelos” escuros e esparsos. Apresenta quatro ínstares, começando no quarto a confecção do casulo (MONNERAT, 1995). Alcançam o máximo de desenvolvimento após 9 a 10 dias da eclosão, atingindo 8 a 10 mm de comprimento (GALLO et al., 2002).
A pupa é facilmente reconhecida no interior de um casulo de seda, tecido com fios entrelaçados, que ajuda na fixação à planta, normalmente na face inferior das folhas. Cerca de 4 dias depois de formada a pupa, emerge o adulto (GALLO et al., 2002).
Os adultos têm hábito noturno e durante o dia se abrigam por entre as folhas. Nos machos, a margem posterior das asas anteriores é branca e em repouso forma uma mancha característica (formato de diamante) sobre a face dorsal (GALLO et al., 2002). Os adultos apresentam dimorfismo sexual, distinguindo machos e fêmeas observando-se a parte ventral do inseto: o macho apresenta uma “fenda” no final do abdome, enquanto a fêmea mostra duas manchas circulares escuras.
As características biológicas dessa praga variam de acordo com o tipo de Brassicaceae em que o inseto se alimenta (DE BORTOLI et al., 2013). O substrato também afeta a preferência para oviposição e para alimentação, como verificado por De Bortoli et al. (2011). Estudos realizados apontam o repolho ‘Midori’ como o mais indicado para o plantio, dentre o material testado, pois apresenta menor suscetibilidade, prejudicando o crescimento populacional da praga (DE BORTOLI et al., 2011).
2.1.3. Danos
Quando em baixas populações, as larvas preferem folhas mais jovens e, em altas populações, os insetos se distribuem por toda a planta. Normalmente os locais da planta onde a traça se encontra fornecem proteção contra os predadores, os parasitoides e até contra inseticidas. Em plantas de repolho, larvas e pupas são encontradas na parte inferior das folhas que circundam as cabeças. Quando localizadas em folhas externas, larvas e pupas são encontradas na parte inferior das folhas (CASTELO BRANCO; FRANCA; VILLAS BOAS, 1997).
Em repolho, as larvas consomem as folhas, que ficam com aspecto rendado, e nas cabeças causam furos, reduzindo o valor quantitativo, como também o comercial do produto (FREITAS LUZ; SABOYA; SILVA-PEREIRA, 2002). As larvas não se alimentam apenas das folhas: em brócolis e couve-flor podem consumir inflorescências e, em couve-de-bruxelas, os rebentos (TIBA, 2008).
O repolho é atacado desde a formação da cabeça até a colheita, com nível de dano próximo a 20% de plantas infestadas (VACARI et al., 2008). Os danos causados na cultura de couve podem ser de até 95%, dependendo da região de cultivo e da época de plantio (CZEPAK et al., 2005).
No Estado de São Paulo, P. xylostella causa danos variáveis, reduzindo em até 60% a produção de repolho (IMENES et al., 2002). Ataques severos, causados principalmente durante os períodos mais secos do ano, podem ocasionar perdas totais nos campos de produção (MEDEIROS et al., 2003). Os danos acarretam também depreciação do produto, atraso no crescimento da planta e, inclusive, a morte de plantas.
também ocorre anualmente em brassicáceas, e, em anos de surtos elevados da praga, tem-se perdas substanciais nas colheitas (DOSDALL et al., 2001).
2.1.4. Controle
O controle da traça-das-crucíferas, desde meados do século XX, é feito basicamente por meio de inseticidas químicos, devido sua suposta eficácia e facilidade de aplicação (TIBA, 2008). Uma das dificuldades no controle desta praga está relacionada às áreas de cultivo que são mantidas durante todo o ano, com plantas em idades diferentes, proporcionando ao inseto quantidade abundante e contínua de alimento (IMENES et al., 2002).
O uso intensivo de produtos químicos selecionou populações resistentes, sendo que nestas situações o agricultor geralmente aumenta a frequência de aplicações e as dosagens, na maioria das vezes, sem sucesso. Em geral, utiliza-se grande número de aplicações por ciclo da cultura, podendo chegar a 15 ou 20, independente da presença da praga (aplicações pré-estabelecidas) (GUAN-SOON, 1990; CARBALLO, 1992; SAMPSON, 1992). No Brasil, observa-se que o número de aplicações pode variar de uma a quatro por semana, sendo que, além disso, o alto potencial biótico do inseto favorece a manifestação da resistência, o que dificulta o manejo da praga (CASTELO BRANCO et al., 2001; THULER, 2006).
A resistência pode se desenvolver por meio de diferentes mecanismos fisiológicos. Para produtos químicos pode ocorrer redução na penetração pela cutícula (NOPPUN; SAITO; MIATA, 1989), alteração no local alvo para organofosforados e carbamatos (LIU; TZENG; SUN, 1982; YU; NGUYEN, 1999; MAA et al., 1996), diminuição da sensibilidade nervosa (HAMA; KONO; SATO, 1987) e degradação do metabolismo envolvendo enzimas como a glutationa S-transferase para paratiom (KAO; HUNG; SUN, 1989), microsomal P-450 monooxigenase para piretroides (YAO; HUNG; SUN, 1988; HUNG; SUN, 1989) e carboxilesterase para malatiom (MAA; LIAO, 2000). E a resistência de P. xylostella à Bt pode ser devida a diversos fatores, entre eles bactérias do intestino, que podem influenciar a suscetibilidade dos insetos ao Bt; presença esterases, que têm a capacidade de promover a desintoxicação e mutações no gene ABBC2 (GUNNING et al., 2005; JOHNSTON; CRICKMORE, 2009; BAXTER, 2011).
Além disso, aplicações frequentes de grandes quantidades de agrotóxicos, sem os devidos cuidados, causam sérios impactos, tanto ambientais quanto para a saúde de animais e do próprio homem. No ambiente, esses produtos se acumulam e muitas vezes não atingem somente o local alvo da aplicação, se espalhando e contaminando fontes de água e outros biomas, provocando desequilíbrio ecológico. Em relação à saúde humana, pode ocorrer intoxicação por contato direto com os produtos ou em função dos resíduos nos alimentos consumidos, na maioria das vezes “in natura”.
A utilização de entomopatógenos no controle de pragas é vantajosa por evitar desequilíbrios ecológicos no agroecossistema, pois muitos são específicos aos insetos-alvo e seletivos aos inimigos naturais. Além de causar mortalidade direta, os patógenos podem afetar as características biológicas e reprodutivas dos insetos; podem ser associados a outros métodos de controle compatíveis; reduzir os custos da produção agrícola; não poluem o ambiente e não são tóxicos aos homens e outros animais, desde que selecionados e manuseados corretamente (ALVES, 1998).
Dentre esses microrganismos, o mais utilizado e estudado para a maioria das pragas agrícolas, como P. xylostella, é a bactéria B. thuringiensis (MONNERAT et al., 1999; CASTELO BRANCO et al., 2003; MEDEIROS et al., 2005).
2.2. Bacillus thuringiensis
2.2.1. Histórico
Em 1901, um pesquisador japonês chamado Ishiwata isolou um bacilo patogênico de larvas de Bombyx mori Linnaeus, 1758 (Lepidoptera: Bombycidae) e deu o nome de “sotto disease bacillus”. Em 1911, Berliner isolou o bacilo que causava morte de larvas de Anagasta kuehniella (Zeller, 1879) (Lepidoptera: Pyralidae) e, em 1915, o mesmo cientista descreveu e denominou a bactéria B.
thuringiensis, em homenagem a província de Thuringia, na Alemanha, onde foi encontrado o primeiro inseto infectado (HABIB; ANDRADE, 1998; GLARE; O’CALLAGHAM, 2000).
de uma substância tóxica que causava a morte dos insetos, o que foi comprovado por Angus (1968) (HABIB; ANDRADE, 1998).
O primeiro produto comercial a base da bactéria B. thuringiensis, Sporeine, foi desenvolvido e comercializado na França, na década de 1930, para o controle de lagartas da traça da farinha, A. kuehniella (LAMBERT; PEFEROEN, 1992; RAMOS, 2008).
A utilização do entomopatógeno aumentou no início de 1950, nos Estados Unidos, principalmente para o controle de lepidópteros (BEEGLE; YAMAMOTO, 1992). No início da década de 1970, já havia vários produtos para o controle de lepidópteros, tendo também sido descoberto o B. thuringiensis var. israelenses, ativo contra dípteros e utilizado no controle de insetos vetores de doenças, principalmente dos gêneros Aedes, Culex, Anopheles e Simulium. Em 1983, foi descoberto o B. thuringiensis var. tenebrionis, utilizado para controlar larvas de coleópteros (GLARE; O´CALLAGHAM, 2000). Entre as toxinas Cry de B.
thuringiensis identificadas como promissoras para o controle de insetos, 59 foram testadas contra 71 espécies de lepidópteros e 43 foram testadas para P. xylostella (VAN FRANKENHUYZEN, 2009).
2.2.2. Aspectos gerais
EL-SADAWY et al., 2008; FEILTEISON, 1994; GUTIÉRREZ; GONÇALVES, 2006; SILVEIRA et al., 2007).
B. thuringiensis é uma bactéria da família Bacillaceae, gram e catalase positiva, aeróbia, podendo também crescer em anaerobiose entre 10 e 45°C (GLARE; O´CALLAGHAM, 2000); quimioheterotrófica, cuja temperatura ideal de crescimento é em torno de 30 ± 2°C (MORAES; CAPALBO, 1986). Suas células vegetativas, como mencionado, possuem forma de bastonete, medindo cerca de 1,0 a 2,0 µm de largura por 3,0 a 5,0 µm de comprimento. Ocorre a formação de esporos entre elípticos e cilíndricos, em posição central, com um esporângio não nitidamente estendido (HABIB; ANDRADE, 1998; GLARE; O´CALLAGHAM, 2000). O Bt pode ser encontrado em diferentes regiões do mundo e em diversos substratos como solo, água, insetos mortos e superfície de algumas plantas (HÖFTE; WHITELEY, 1989).
O ciclo de vida deste entomopatógeno pode ser dividido em duas fases principais, sendo uma de crescimento vegetativo, na qual a bactéria se multiplica por bipartição, e outra de esporulação, que consiste na diferenciação da bactéria em esporos. Quando o esporo se encontra em um ambiente favorável ao seu crescimento, com nutrientes e temperatura adequados, pode germinar e iniciar o crescimento vegetativo (MONNERAT; PRAÇA, 2006).
Esta bactéria, que se diferencia das demais por produzir durante o processo de esporulação uma inclusão proteica chamada de cristal e composta por subunidades com poder tóxico, as proteínas Cry, as quais conferem atividade entomopatogênica contra mais de 300 espécies de insetos e ácaros (GLARE; O’CALLAGHAM, 2000; MONNERAT; BRAVO, 2000; VAN FRANKENYUZEN, 2009; VAN FRANKENYUZEN, 2013).
Inseticidas à base de Bt têm uma longa história de uso bem sucedido no controle biológico de insetos-praga na agricultura e silvicultura, bem como contra vetores de doenças (BRAVO et al., 2011; CAB, 2010; JURAT-FUENTES; JACKSON, 2012; SANCHIS, 2011; VACHON; LAPRADE; SCHWARTZ, 2012). Mais de 300 biopesticidas à base de Bt (70% deles com B. thuringiensis var.
gerando cerca de US$120-140.000.000 por ano. As Américas são responsáveis por quase 50% deste consumo, particularmente os EUA e o Canadá, com a América Latina representando apenas 8-10% do consumo total (CAB, 2010; POLANCZYK; DE BORTOLI; DE BORTOLI, 2012). Além disso, várias plantas transgênicas, que expressam toxinas Bt, são cultivadas em uma área em franco crescimento (JAMES, 2011; JURAT-FUENTES; JACKSON, 2012).
Cepas de Bt são isoladas a partir de amostras de solo, rios, plantas de superfície, restos de plantas, insetos mortos e pequenos mamíferos, teias de aranha, grãos armazenados e lugares desabitados (BIZZARRI; BISHOP, 2007; BRAVO et al., 1998; FORSYTH; LOGAN, 2000; KONECKA; KAZNOWSKI;
ZIEMNICKA, 2007; SWIECICKA; FIEDORUK; BEDNARZ, 2002;
THAMMASITTIRONG; ATTATHOM, 2008). Vários e extensos projetos de triagem de Bt têm relatado que os ambientes mais prolíficos para o isolamento de cepas é a poeira e materiais associados com armazenamento de grãos (BERNHARD; JARRET; MEADOWS, 1997).
Esta bactéria se desenvolve com facilidade em meios artificiais em condições aeróbicas. Com a limitação de nutrientes ou o acúmulo de metabólitos indesejáveis, o Bt entra no processo de esporulação e sintetiza a(s) proteína(s)-toxica(s) que contém o cristal (JURAT-FUENTES; JACKSON, 2012; YAMAMOTO; DEAN, 2000). O cristal pode ser responsável por mais de 25% do peso seco da célula. A quantidade de toxina produzida no laboratório (aproximadamente 0,5 mg protein.mL-1 de meio de cultura) e o tamanho do cristal indicam que cada célula tem de sintetizar moléculas de 2x106 δ-endotoxina para formar um cristal
(AGAISSE; LERECLUS, 1995). Estas toxinas são codificadas por genes cry e diferentes genes cry em uma cepa podem direcionar a síntese de proteínas, podendo ser armazenadas em forma de um único cristal ou de vários cristais de formas distintas (JURAT-FUENTES; JACKSON, 2012).
formadoras de cristais e a clonagem e sequenciamento de genes de proteínas cristalinas (GLARE; O’CALLAGHAM, 2000). Surgiu um problema relacionado à falta de uma nomenclatura uniforme para esses genes, fazendo com que a literatura inicial se tornasse bastante confusa. Hofte e Whiteley (1989) apresentaram uma classificação Cry com base em sequências de aminoácidos e espectro de ação das toxinas. Nessa classificação toxinas Cry I mostraram atividade contra insetos da ordem Lepidoptera, Cry II contra Lepidoptera e Diptera, Cry III contra Coleoptera e Cry IV contra Diptera, sendo a classe Cyt definida e separada, pois não mostrou homologia com as toxinas Cry e cujos membros demonstraram uma atividade citolítica geral “in vivo”. Depois de algum tempo percebeu-se que esta classificação não era adequada, já que toxinas semelhantes possuíam especificidades diferentes, e novas toxinas com dupla atividade contra larvas de Lepidoptera e Coleoptera foram descobertas e chamadas de Cry V, criando, assim, grande confusão na nomenclatura (TAYLOR; TIPPET; GIBB, 1992). Devido a isto, em 1994, um Comitê Internacional foi criado e propôs uma classificação baseada unicamente em sequências de aminoácidos. Na nova classificação, algarismos romanos foram substituídos por algarismos arábicos e quatro níveis foram definidos (CRICKMORE et al., 1998). A constante atualização
desses dados pode ser visualizada na Internet em:
http://www.lifesci.sussex.ac.uk/home/NeilCrickmore/Bt/.
2.2.3. As toxinas e a atividade inseticida
A atividade entomopatogênica de B. thuringiensis está relacionada, principalmente, com a produção de inclusões cristalinas denominadas – endotoxinas ou proteínas Cry, na fase estacionária, e que são acumuladas na célula mãe durante a esporulação (AGAISSE; LERECLUS, 1995; YAMAMOTO; DEAN, 2000). Estas inclusões cristalinas podem conter uma ou mais proteínas Cry e cada toxina é codificada por um gene cry específico (LI et al., 1991).
–exotoxina, –exotoxina, hemolisinas, exoenzimas e proteínas inseticidas vegetativas (VIPs) (HABIB; ANDRADE, 1998). Os esporos, que causam a septicemia, também podem contribuir com a virulência da bactéria por meio da ação sinérgica desempenhada junto com as proteínas Cry (JOHNSON; MCGAUGHEY, 1996).
2.2.3.1. –endotoxina
Em condições nutricionais desfavoráveis, B. thuringiensis interrompe a divisão celular e dá inicio ao processo de esporulação. Durante a fase de esporulação ocorre a produção das –endotoxinas ou proteínas Cry. As – endotoxinas se acumulam no compartimento da célula–mãe e, no final da esporulação, um cristal é liberado juntamente com o esporo. Existem dois tipos de –endotoxinas: as proteínas Cry e as Cyt. O espectro de ação das –endotoxinas é normalmente restrito a determinadas ordens de insetos, como Lepidoptera, Coleoptera, Hymenoptera, Diptera ou nematoides e ácaros (HABIB; ANDRADE, 1998; SCHNEPF et al., 1998).
B. thuringiensis pode produzir uma ou mais proteínas Cry com massa molecular variando de 40 a 140 kDa (SERAFINI; BARROS; AZEVEDO, 2002). A forma do cristal é determinada pela composição e estrutura das –endotoxinas presentes, podendo variar de bipiramidal a cuboide, ovoide, romboide e esférica, ou até mesmo não possuir forma definida (HABIB; ANDRADE, 1998; POLANCZYK; ALVES, 2003).
As proteínas Cry estão classificadas em 70 grupos e diferentes subgrupos, em função do grau de similaridade de seus aminoácidos. Essas proteínas são codificadas por mais de 665 genes cry já sequenciados (CRICKMORE,2013).
Cyt2Bb, Cyt2Bc e Cyt2Ca. Apresentam massa molecular de 27 – 30 kDa e toxicidade para insetos da ordem Diptera. Além disso, a proteína Cyt2Ca apresenta também atividade contra coleópteros (CRICKMORE et al., 1998).
2.2.4. Modo de ação
O modo de ação das proteínas Cry envolve diversas etapas, como: ingestão do complexo esporo-cristal pela larva suscetível, solubilização e processamento da toxina, ligação ao receptor, inserção na membrana, formação do poro e citólise. As proteínas Cry apresentam–se na forma de pró–toxinas e precisam ser ativadas por proteases para liberarem fragmentos tóxicos (SCHNEPF et al.,1998; MONNERAT; BRAVO, 2000).
Para que ocorra a solubilização da pró–toxina, ela deve entrar em contato com o pH alcalino do intestino médio das larvas de insetos alvo (KNOWLES, 1994). Diferenças na solubilização podem contribuir para determinar as alterações no grau de toxicidade entre as proteínas Cry (ARONSON et al., 1991). Após a solubilização é necessário o processamento das pró–toxinas por proteases especiais presentes no intestino médio do inseto, para que ocorra a liberação do fragmento tóxico (TOJO; AIZAWA, 1983). A clivagem proteolítica é um fator importante que pode contribuir para determinar a especificidade; o principal tipo de protease digestiva em insetos das ordens Lepidoptera e Diptera é o tipo serino– protease, enquanto que para Coleoptera são, principalmente, cisteíno e aspártico– proteases (DE MAAGD; BRAVO; CRICKMORE, 2001).
Após serem ativadas, as proteínas Cry passam através da membrana peritrófica do intestino médio, um revestimento de proteção, e chegam ao local-alvo e se unem a receptores específicos presentes nas microvilosidades das células colunares do intestino médio das larvas dos insetos suscetíveis (ZHANG et al., 2012). As toxinas Cry interagem com receptores específicos, sendo um fator importante para a toxicidade e especificidade, determinando o espectro de ação
das -endotoxinas (MONNERAT; BRAVO, 2000; DE MAAGD; BRAVO;
de poros que conduzem a lise celular e o extravasamento do conteúdo intestinal para a hemocele (COPPING; MENN, 2000; PRAÇA et al., 2004). Alternativamente, a ligação das toxinas Cry com a proteína caderina no intestino médio poderia ser ativada por uma via de sinalização celular, levando a morte da célula (ZHANG et al., 2005; ZHANG et al., 2006).
Os sintomas de intoxicação nos insetos são: paralização na alimentação, paralisia do intestino, vômito, diarreia, paralisia total e posterior septicemia, levando o inseto à morte (GUPTA et al., 1985; BRAVO; JANSENS; PEFEROEN, 1992; MONNERAT; BRAVO, 2000).
Embora muitos insetos sejam suscetíveis às toxinas Cry, o modo de ação do Bt ainda não está bem definido. Após a ingestão de esporos/cristais pelo inseto, os cristais são dissolvidos e, em seguida, em maior ou menor grau, são clivados por proteases digestivas e transformados em toxinas ativas. Estas toxinas passam através da membrana peritrófica, ligando-se a receptores específicos localizados na membrana apical das células colunares do intestino médio, formando poros na membrana. A formação desses poros acarreta na interferência da fisiologia da célula, mediante a supressão dos gradientes iônicos trans-membrânicos, o que pode levar à lise coloido-osmótica das células devido a um influxo massivo de solutos no lúmen do intestino médio. Por sua vez, a destruição das células resulta em grande dano para o tecido epitelial do intestino médio e morte das larvas intoxicadas. Os insetos também podem sofrer por inanição, já que, logo após a ingestão da toxina, o inseto deixa de se alimentar (COPPING; MENN, 2000; CRICKMORE, 2006; JURAT-FUENTES; JACKSON, 2012; VACHON; LAPRADE; SCHWARTZ, 2012).
apontaram que as informações disponíveis ainda apoiam a ideia de que as toxinas Bt agem por meio da formação de poros, mas a maioria dos eventos que levam à sua formação, após a ligação das toxinas ativas nos receptores, permanecem pouco conhecidos.
Por outro lado, a resistência dos insetos à ação das proteínas Cry tornou-se mais complexa, pois mutações no gene que codifica um transportador do gene ABCC2 são responsáveis pela resistência às toxinas Bt em quatro espécies de insetos (HERNANDEZ-MARTINEZ et al., 2012; HECKEL, 2012).
A superfamília de proteínas ABC leva o seu nome a partir da ligação com o ATP, um domínio intracelular que se liga e hidrolisa ATP em um ciclo que leva o transporte de moléculas através de uma membrana de bicamada lipídica. O transportador funcional consiste em dois domínios de ligação nucleotídeo citosólico (NBDs) que se ligam e hidrolisam ATP e dois domínios trans-membrânicos integrais (HECKEL, 2012). A função biológica do gene ABCC2 é desconhecida, mas sua semelhança com proteínas de resistência a múltiplas drogas sugere que poderia exportar pequenas toxinas hidrofóbicas, a partir de células epiteliais do intestino médio, para a eventual eliminação nas fezes.
Em dois estudos controversos, Broderick, Raffa e Handelsman (2006 e 2009) sugeriram que Bt é incapaz de matar Lymantria dispar (Linnaeus, 1758) (Lepidoptera: Lymantriidae), Manduca sexta Linnaeus, 1763 (Lepidoptera: Sphingidae), Pieris rapae (Linnaeus, 1758) (Lepidoptera: Pieridae) e Vanessa
cardui (Linnaeus, 1758) (Lepidoptera: Nymphalidae) na ausência de bactérias intestinais. A exposição prévia de larvas a uma combinação de quatro antibióticos para eliminar as bactérias do intestino reduziu severamente a toxicidade de uma preparação comercial de Bt. A reinfecção de larvas com um isolado de
Enterobacter sp. resgatou a toxicidade do Dipel®. Um estudo subsequente de Johnston e Crickmore (2009) mostrou que a perda da atividade do produto foi resultado do efeito direto dos antibióticos residuais nas larvas e nas bactérias vivas presentes no produto Dipel®. Eles não só concluíram que as bactérias nativas do intestino não eram necessárias para a toxicidade de Bt, mas de fato, mostraram que a presença de bactérias intestinais nativas ajudou a proteger o inseto contra o Bt. Ao resumir esses dados, Raymond et al. (2010) concluiram que o Bt é, principalmente, um agente patogênico para insetos, e que o seu principal meio de reprodução é por cadáver de insetos, e que não requer a ajuda de outros microrganismos para expressar sua patogenicidade.
2.2.5. Resistência
Apesar de B. thuringiensis ter sido utilizado em pulverizações foliares por mais de 30 anos, a comercialização em 1996 das primeiras plantas geneticamente modificadas protegidas contra insetos (plantas Bt) aumentou a importância de B.
thuringiensis como uma fonte de proteínas inseticidas para o controle de insetos-praga (HERNÁNDEZ-MARTÍNEZ et al., 2012). O uso excessivo de proteínas de B.
primeiras colônias resistentes foi derivada de uma população havaiana que tinha selecionado para resistência ao Dipel® no campo e que foi adicionalmente selecionada no laboratório para a resistência ao mesmo produto (TABASHNIK; FINSON; JOHNSON, 1991). Insetos dessa população apresentaram resistência “modo 1”, o que implica em forte resistência a pelo menos uma proteína Cry1A (neste caso Cry1Aa, Cry1Ab, Cry1Ac, as três encontradas no Dipel®), pouco ou nada resistência cruzada a Cry1C, herança recessiva e reduzida ligação a pelo menos uma proteína Cry1A (TABASHNIK et al., 1998). Outras caracterizações mostraram que os insetos resistentes apresentaram resistência cruzada a Cry1F e Cry1J (TABASHNIK et al., 1994; TABASHNIK et al., 1996). Estudos genéticos indicaram que a resistência às proteínas Cry1A e Cry1F foi determinada por um único “locus” autossômico (TABASHNIK et al., 1997a), e que em descendentes dessa população o gene da resistência a Cry1Ac foi geneticamente ligado a um gene transportador de membrana (gene ABCC2) (BAXTER et al., 2011).
Qualquer alteração no complexo caminho da patogênese de B.
A caderina no intestino médio de Lepidoptera mostrou ser o receptor funcional para a toxina Cry1A pela demonstração da sensibilidade adquirida de células em cultura após introdução e expressão de um gene da caderina (NAGAMATSU et al., 1999; GOMEZ et al., 2001; DORSCH et al., 2002; HUA; JURAT-FUENTES; ADANG, 2004; FLANNAGAN et al., 2005; XIE et al., 2005; ZHANG et al., 2005). Resultados obtidos por Zhang et al. (2012) indicaram que não ocorreu alteração da quantidade de caderina em Trichoplusia ni (Huebner, 1802) (Lepidoptera: Noctuidae) resistente a Cry1Ac e, ensaio de ligação “in vitro” pela sobreposição da toxina em análise não se mostrou diferente para indivíduos suscetíveis. Assim, o papel da caderina na ligação de toxinas Cry no intestino médio de insetos é complexo e ainda precisa ser melhor compreendido.
Para P. xylostella suscetível foi proposto um modelo integrado para os sítios de ligação de proteínas Cry1A e Cry1Fa (BALLESTER et al., 1999). Nesse modelo, pelo menos dois locais de ligação são envolvidos: um que é partilhado por Cry1Aa, Cry1Ab, Cry1Ac e Cry1Fa, e um segundo que é específico para Cry1Aa e, aparentemente, não contribui para sua toxicidade. Outro estudo com lagartas resistentes mostrou ligação extremamente reduzida a Cry1Ab e Cry1Ac, mas não a Cry1Aa (TABASHNIK et al., 1997b). Por isso foi proposto que a resistência dos indivíduos dessa população foi devido a uma mutação que alterou o sítio de ligação comum para Cry1Aa, Cry1Ab, Cry1Ac e Cry1F.
3. MATERIAL E MÉTODOS
As criações dos insetos e os bioensaios foram conduzidos no Laboratório de Biologia e Criação de Insetos (LBCI) (Departamento de Fitossanidade -FCAV/Unesp, Campus de Jaboticabal), enquanto os estudos moleculares e enzimáticos foram realizados no Laboratório do Dr. Neil Crickmore, na Universidade de Sussex, Brighton, Inglaterra. As toxinas Bt (Cry1Ac, Cry2Aa e Cry1IE) foram fornecidas pelo Dr. Neil Crickmore.
3.1.Populações de Plutella xylostella
Todas as populações foram coletadas em áreas sem histórico de aplicação de inseticidas. Para a criação dos insetos foi utilizada a metodologia descrita por Barros (1998) e Barros & Vendramim (1999), adaptada para as condições do Laboratório de Criação e Biologia de Insetos, UNESP, Jaboticabal, Brasil, por De Bortoli et al. (2012). Larvas de cinco populações nativas brasileiras selecionadas e uma população da Inglaterra foram usadas no trabalho. As populações foram mantidas isoladas reprodutivamente e sem a introdução de novos espécimes.
População 1 (PC) - Data de coleta: 19 de maio de 2008 - A coleta foi realizada em plantas de repolho, na cidade de Alegre, ES (Brasil), com 68 gerações em laboratório.
População 2 (PA) - Data de coleta: 22 de julho de 2008 – A coleta foi realizada em de plantas de repolho, na cidade de Alegre, ES (Brasil), com 65 gerações em laboratório.
População 3 (PX) - Data de coleta: 15 de janeiro de 2007 - A coleta foi realizada em de plantas de repolho, na cidade de Recife, PE (Brasil), com 98 gerações em laboratório.
População 5 (Bt) - Data de coleta: 19 de maio de 2008 - A coleta foi realizada em plantas de repolho, na cidade de Alegre, ES (Brasil), com 58 gerações em laboratório. Selecionado a cada geração com linhagem B.
thuringiensis var. kurstaki HD-1 (Lepidoptera-específico).
População 6 (UK) - A população é conhecida como NO-QA, oriunda da Alemanha, coletada a cerca de 3-4 anos, com cerca de 50 gerações em laboratório, Brighton, Inglaterra. É uma população altamente resistentea Cry1Ac.
3.2.Criação dos insetos
Os insetos foram criados no LBCI, em sala climatizada com temperatura de 25 ± 1°C, fotoperíodo de 14L:10E e umidade relativa de 70 ± 10%.
O substrato utilizado para alimentação e oviposição de P. xylostella foi couve (Brassica oleracea var. acephala, cv. Manteiga), cultivada em área experimental da FCAV-UNESP, Campus de Jaboticabal (campo e casa de vegetação).
Adultos recém-emergidos foram transferidos para gaiolas plásticas circulares transparentes, medindo 13 cm de diâmetro e 15 cm de altura, com uma abertura lateral de 10 × 5 cm, coberta por tecido tipo “voile” para aeração, e outra
de 10 × 2 cm para troca dos discos foliares e fechada com filme plástico de PVC.
Os adultos foram alimentados com solução de mel a 10%, embebida em esponja presa na parte superior da gaiola.
oferecidas para alimentação. A troca das folhas dentro do recipiente foi feita diariamente até os insetos atingirem a fase pupal.
As pupas foram coletadas com o auxílio de pincel ou pinça e acondicionadas em tubos de vidro de fundo chato (8,5 × 2,4 cm) vedados com filme plástico de PVC com pequenos furos para aeração, sendo colocadas de 20 a 30 pupas por tubo.
3.3. Bioensaios com Plutella xylostella e toxinas Bt
3.3.1. Bioensaios de patogenicidade
Para a condução dos bioensaios, discos foliares de couve (Brassica
oleracea var. acephala cv. Manteiga) de 8 cm de diâmetro foram mergulhados em 50 mL das suspensões das toxinas (Cry1Ac, Cry1Ie e Cry2Aa) em água deionizada autoclavada com 50 µg/mL Triton-X100®, por 30 segundos, sendo a testemunha tratada apenas com a solução de água deionizada autoclavada e 50 µg/mL Triton-X100®. Após a secagem em condição ambiente por 30 minutos, os
discos foram colocados individualmente em placas de Petri (9,5 cm de diâmetro × 2,0 cm de altura) sobre papel filtro umedecido com água deionizada. Foram colocadas sobre cada disco foliar 20 lagartas de P. xylostella de terceiro ínstar, sendo cada disco considerado uma repetição e observadas cinco repetições por tratamento, o que se repetiu para as cinco diferentes populações brasileiras de P.
xylostella (PX, PA, PC, SBT e Bt).
µg/mL, 0,5 µg/mL, 0,55 µg/mL, 0,6 µg/mL, 0,7 µg/mL, 0,8 µg/mL, 0,9 µg/mL, 1,0 µg/mL, 1,1 µg/mL, 1,2 µg/mL, 1,3 µg/mL e 1,4 µg/mL).
As placas foram envolvidas com filme plástico de PVC e mantidas em sala climatizada com temperatura de 25 ± 1°C, umidade relativa de 70 ± 10% e fotoperíodo de 12L:12E h. Após cinco dias foram realizadas as avaliações e registrado o número de lagartas mortas em cada tratamento. Foram consideradas mortas aquelas lagartas que não se moviam quando tocadas com um pincel de cerdas finas.
3.3.2. Testes para estimativa da Concentração Letal (CL50)
A proteína Cry1Ac de B. thuringiensis, que foi ativa para populações brasileiras de P. xylostella, foi incluída em bioensaios para a estimativa da concentração letal média (CL50).
Para os testes a amplitude das concentrações testadas foi pré-estabelecida em ensaios preliminares, até a obtenção das concentrações-teste. Foram utilizadas 7 concentrações variando de 1,0 a 0,001 µg/mL para as populações PA, PC, PX e SBT e de 2,5 a 0,1 µg/mL para a população Bt. Foram realizadas 5 repetições, sendo cada placa uma repetição contendo 20 lagartas, totalizando 100 insetos por concentração em cada população.
Os discos de couve foram mergulhados em 50 mL de suspensão por 30 segundos e a testemunha em solução de água deionizada autoclavada e 50 µg/mL Triton-X100®. Após a secagem em condição ambiente por 30 minutos, os discos foram colocados individualmente em placas de Petri (9,5 cm de diâmetro × 2,0 cm de altura) sobre papel filtro umedecido. Foram colocadas sobre o cada disco foliar 20 lagartas de P. xylostella de terceiro ínstar, o que se repetiu para as cinco populações com cada uma das concentrações da proteína.
A mortalidade das lagartas foi avaliada 5 dias após a aplicação das concentrações da proteína. A lagarta morta foi caracterizada como aquela com total imobilidade quando tocada com um pincel de cerdas finas. Não foi necessária a correção da taxa de mortalidade pela fórmula de Abbott, devido à baixa mortalidade da testemunha (< 5%).
3.3.3. Efeitos subletais
Para a condução dos estudos sobre os efeitos subletais subsequentes aos tratamentos com proteina Cry1Ac em lagartas de P. xylostella, foram utilizadas as concentrações 0,5; 0,25 e 0,1 µg/mL para a população Bt e 0,05; 0,01; 0,005 e 0,001 µg/mL para as populações PA, PX, PC e SBT. Como tratamento controle foi utilizado água deionizada autoclavada e 50 µg/mL Triton-X100®. Os bioensaios foram conduzidos de acordo com a descrição do item 3.3.1.
longevidade de machos e de fêmeas. Cada recipiente foi considerado uma repetição, sendo observadas 5 repetições por tratamento.
As avaliações dos efeitos subletais da proteína Cry1Ac nos indivíduos da população Bt de P. xylostella foram realizadas até a morte dos adultos. Nas demais populações (PX, PA, PC e SBT), as avaliações foram conduzidas até a emergência dos adultos.
3.3.4. Análise estatística
O delineamento experimental utilizado foi o inteiramente casualizado. Os dados obtidos nos testes de virulência e efeitos subletais, foram submetidos aos testes de normalidade (teste de Kolmogorov) e de homogeneidade da variância (teste de Bartlett) e, sempre que necessário, transformados, para atender os requisitos da análise de variância (ANOVA). Em seguida, os dados foram submetidos à ANOVA, e quando significativas, as médias foram comparadas pelo teste de Tukey a 5% de probabilidade. Todas as análises foram conduzidas empregando o software SAS (SAS INSTITUTE, 2002).
Os dados de concentração-mortalidade foram submetidos à análise de regressão de Probit (FINNEY, 1971) e obtidos os valores de concentração letal média (CL50) utilizando o software SAS (SAS INSTITUTE, 2002). Diferenças entre
os valores de CL50 foram significativas quando 95% de limite de confiança de um
tratamento não se se sobrepõem com o limite de confiança de outro tratamento.
3.4. Ensaios enzimáticos com intestinos de Plutella xylostella
3.4.1. Preparação dos intestinos
enzimas, e o sedimento foi ressuspendido em 1 mL de água estéril e armazenado congelado para os ensaios de DNA. Este processo foi repetido para cada população, de acordo com a quantidade de intestinos (1- Inglaterra, 3- SBT, PX, PC e PA ou 4- Bt).
3.4.2. Proteína total
O reagente de ensaio de proteína Bio-Rad foi usado de acordo com as instruções do fabricante para a estimativa da concentração de proteína. Alíquotas (10 µL) do extrato de intestino foram adicionados a 1 mL de corante (1 em 4 de diluição em água) e, após 5 minutos de incubação à temperatura ambiente, a absorbância foi medida a 595nm.
3.4.3. Gel de esterases
Os extratos de intestinos foram misturados a 1:1 com tampão de amostra 2x (sem SDS) e fervido durante 4 minutos, sendo carregado no PAGE Mini-Gel. A eletroforese foi realizada a 200 V durante 40 minutos, em uma célula de Mini-PROTEAN II ® eletroforese (Bio-Rad), utilizando um tampão de Tris-glicina (25 mM Tris, 190 mM de glicina), seguido por coloração no escuro durante 10 minutos com 10 mL de uma solução contendo 50 mg de sal Fast Blue RR em tampão fosfato 25 mL 200 mM (pH 6,0) e com 200 µL de 18,6 mg de acetato de 1-naftilo em 1mL de acetona. Na sequência o gel foi fixado com ácido acético a 5%. Os resultados foram visualizados e analisados por meio de Gel DocTM EZ Imager (Bio-Rad ®) acoplado ao software de análise de imagem LabTM Imagem - versão 4.0.
3.4.4. Digestão da toxina
de tampão carbonato bicarbonato (pH 10,5), sendo adicionados 1 ul de 0,1 M de DTT e 1 µL de extrato de intestino diluído (1:10). As amostras foram incubadas durante 1 hora a 37 oC. Cinco microlitros das amostras foram misturados a 5 µL de
tampão (95 µL de amostra tampão 2x SDS e 5 µL de 2-mercaptoetanol), fervidos durante 4 minutos e carregando-se no Mini-Gel SDS-PAGE. A eletroforese foi realizada a 200 V durante 40 minutos, em Mini-PROTEAN II ® Electrophoresis Cell ( Bio - Rad ), utilizando tampão de Tris-glicina (25 mM Tris, 190 mM de glicina e 3,5 mM de SDS), seguido por coloração com azul de Coomassie (45 % [v/v] metanol), 10% [v/v] de ácido acético, 0,25 % [p/v] de azul brilhante de Coomassie R) durante 30 minutos. Em seguida, os géis foram descorados com 30mL de solução de descora (45 % [v/v] metanol, 10 % [v/v] de ácido acético, 0,25% [p/v]). Os resultados foram visualizados e analisados por meio de Gel DocTM EZ Imager (Bio-Rad ®) acoplado ao software de análise de imagem LabTM Imagem - versão 4.0.
3.4.5. Atividade total de proteases
3.5. Estudos moleculares
3.5.1. Extração do DNA
A purificação do DNA total a partir de tecidos animal (Spin-Column Protocol em bactérias Gram-positivas) foi realizado com o DNeasy Blood & Tissue Kit (Qiagen ®), de acordo com as recomendações do fabricante.
3.5.2. Reação em cadeia da polimerase (PCR), com base no DNA do gene 16S rRNA bacteriano
Os genes bacterianos 16S rRNA foram amplificados empregando os
oligonucleotídeos iniciadores (primers) universais 27f
(5'-GTGCTGCAGAGAGTTTGATCCTGGCTCAG-3') e 1492R
(5'-CACGGATCCTACGGGTACCTTGTTACGACTT-3') (LANE, 1991). A reação de amplificação foi realizada utilizando uma reação de volume total final de 50 L contendo uma mistura de 0,5 µL de 100 pmol/ L de cada oligonucleotídeo iniciador, 25 mL de Go Taq ® Green Master Mix (Promega ®), 0,5 µL da amostra do DNA bacteriano e água ultra-pura estéril q.s.p. para 50µL. A sequência térmica e de tempo de amplificação foram de: desnaturação inicial a 94°C por 2 minutos, seguido por uma segunda etapa de 35 ciclos contendo desnaturação a 94°C durante 30 segundos; anelamento ou hibridização a 58°C por 30 segundos e extensão a 72°C por 45 segundos, e uma extensão final a 72°C por 5 minutos.
3.5.3. Reação em cadeia da polimerase (PCR), com base no gene ABCC2 – Exon
µL de 100 pmol/ L de cada oligonucleotídeo iniciador, 25 mL de Go Taq ® Green Master Mix (Promega ®), 0,5 µLda amostra do DNA bacteriano e água ultra-pura estéril q.s.p. para 50 µL. A sequência térmica e de tempo de amplificação foram de: desnaturação inicial a 94°C por 2 minutos, seguida por uma segunda etapa de 35 ciclos contendo desnaturação a 94°C por 30 segundos; anelamento ou hibridização a 58°C por 30 segundos, extensão a 72°C por 45 segundos, e uma extensão final a 72°C por 5 min.
3.5.4. Reação em cadeia da polimerase (PCR), com base no gene ABCC2 – Intron
Outra tentativa de amplificar o gene ABCC2 foi utilizando os
oligonucleotídeos iniciadores desenhados, IntronF
(5'-GACGTAGCAACAAGGGGGCAACAT-3') e IntronR
(5'-GCTCCACGGCGGTCATCTG-3'). A reação de amplificação foi realizada utilizando uma reação de volume total final de 50 µL, contendo uma mistura de 0,5 µL de 100 pmol/ L de cada oligonucleotídeo iniciador, 25 mL de Go Taq ® Green Master Mix (Promega ®), 0,5 µLda amostra do DNA bacteriano e água ultra-pura estéril q.s.p. para 50µL. A sequência térmica e de tempo de amplificação foram de: desnaturação inicial a 94°C por 2 minutos, seguida por uma segunda etapa de 35 ciclos contendo desnaturação a 94°C por 30 segundos; anelamento ou hibridização a 58°C por 30 segundos, extensão a 72°C durante 45 segundos, e uma extensão final a 72°C por 5 minutos.
3.5.5. Eletroforese de DNA em gel de agarose
molecular (escada de 1 Kb de DNA, Invitrogen®). Os resultados foram visualizados e analisados em um transiluminador ultravioleta em Gel DocTM EZ Imager (Bio-Rad®), acoplado ao software de análise de imagem Image LabTM -
versão 4.0).
3.5.6. Extração de amplicons do gel de agarose
Após a reação de PCR, as bandas correspondentes ao fragmento amplificado foram cortadas do gel de agarose com um bisturi, e colocadas em tubos eppendorfs® devidamente identificados. Em seguida, a extração do produto de PCR a partir do gel de agarose foi realizado utilizando o kit QIAquick® Gel Extraction (250) (Qiagen®), de acordo com as recomendações do fabricante.
3.5.7. Sequenciamento
4. RESULTADOS E DISCUSÃO
4.1. Bioensaios com Plutella xylostella e toxinas Bt
4.1.1. Bioensaios de patogenicidade
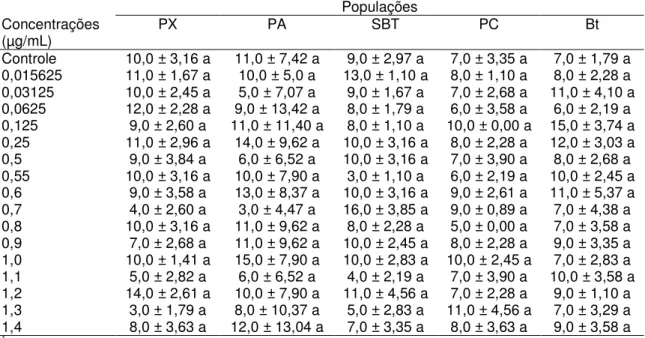
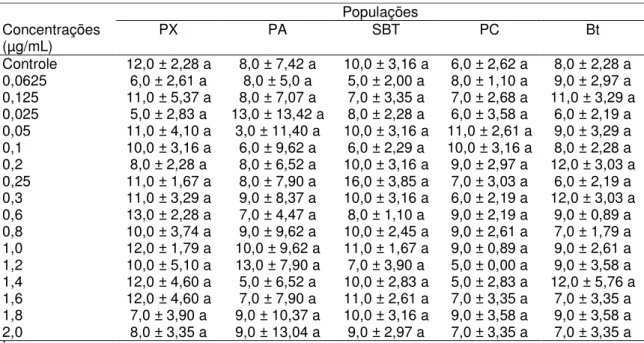
Todas as concentrações testadas das proteínas Cry2Aa e Cry1Ie de B.
thuringiensis apresentaram mortalidade semelhante à testemunha para lagartas de terceiro ínstar das cinco populações de P. xylostella (Cry2Aa: PX, F16,68=0,81,
P=0,664; PA, F16,68=6,56; P=0,826; SBT, F16,68=1,05; P=0,415; PC, F16,68=0,26;
P=0,998; Bt, F16,68=0,40; P=0,978; Cry1Ie: PX, F16,68=0,35; P=0,989; PA,
F16,68=0,64; P=0,836; SBT, F16,68=0,57; P=0,894; PC, F16,68=0,35; P=0,989; Bt,
F16,68=0,33; P=0,992). A porcentagem de mortalidade variou entre 3,0 a 16,0%
para a proteina Cry2Aa e 3,0 a 13,0% para a proteína Cry1Ie (Tabelas 1 e 2).
Tabela 1. Mortalidade (%) de lagartas de terceiro ínstar de diferentes populações de Plutella xylostella pela proteína Cry2Aa de Bacillus thuringiensis.
Populações Concentrações
(µg/mL) PX PA SBT PC Bt
Controle 10,0 ± 3,16 a 11,0 ± 7,42 a 9,0 ± 2,97 a 7,0 ± 3,35 a 7,0 ± 1,79 a
0,015625 11,0 ± 1,67 a 10,0 ± 5,0 a 13,0 ± 1,10 a 8,0 ± 1,10 a 8,0 ± 2,28 a
0,03125 10,0 ± 2,45 a 5,0 ± 7,07 a 9,0 ± 1,67 a 7,0 ± 2,68 a 11,0 ± 4,10 a
0,0625 12,0 ± 2,28 a 9,0 ± 13,42 a 8,0 ± 1,79 a 6,0 ± 3,58 a 6,0 ± 2,19 a
0,125 9,0 ± 2,60 a 11,0 ± 11,40 a 8,0 ± 1,10 a 10,0 ± 0,00 a 15,0 ± 3,74 a
0,25 11,0 ± 2,96 a 14,0 ± 9,62 a 10,0 ± 3,16 a 8,0 ± 2,28 a 12,0 ± 3,03 a
0,5 9,0 ± 3,84 a 6,0 ± 6,52 a 10,0 ± 3,16 a 7,0 ± 3,90 a 8,0 ± 2,68 a
0,55 10,0 ± 3,16 a 10,0 ± 7,90 a 3,0 ± 1,10 a 6,0 ± 2,19 a 10,0 ± 2,45 a
0,6 9,0 ± 3,58 a 13,0 ± 8,37 a 10,0 ± 3,16 a 9,0 ± 2,61 a 11,0 ± 5,37 a
0,7 4,0 ± 2,60 a 3,0 ± 4,47 a 16,0 ± 3,85 a 9,0 ± 0,89 a 7,0 ± 4,38 a
0,8 10,0 ± 3,16 a 11,0 ± 9,62 a 8,0 ± 2,28 a 5,0 ± 0,00 a 7,0 ± 3,58 a
0,9 7,0 ± 2,68 a 11,0 ± 9,62 a 10,0 ± 2,45 a 8,0 ± 2,28 a 9,0 ± 3,35 a
1,0 10,0 ± 1,41 a 15,0 ± 7,90 a 10,0 ± 2,83 a 10,0 ± 2,45 a 7,0 ± 2,83 a
1,1 5,0 ± 2,82 a 6,0 ± 6,52 a 4,0 ± 2,19 a 7,0 ± 3,90 a 10,0 ± 3,58 a
1,2 14,0 ± 2,61 a 10,0 ± 7,90 a 11,0 ± 4,56 a 7,0 ± 2,28 a 9,0 ± 1,10 a
1,3 3,0 ± 1,79 a 8,0 ± 10,37 a 5,0 ± 2,83 a 11,0 ± 4,56 a 7,0 ± 3,29 a
1,4 8,0 ± 3,63 a 12,0 ± 13,04 a 7,0 ± 3,35 a 8,0 ± 3,63 a 9,0 ± 3,58 a
Tabela 2. Mortalidade (%) de lagartas de terceiro ínstar de diferentes populações de Plutella
xylostella pela proteína Cry1Ie de Bacillus thuringiensis.
Populações Concentrações
(µg/mL) PX PA SBT PC Bt
Controle 12,0 ± 2,28 a 8,0 ± 7,42 a 10,0 ± 3,16 a 6,0 ± 2,62 a 8,0 ± 2,28 a
0,0625 6,0 ± 2,61 a 8,0 ± 5,0 a 5,0 ± 2,00 a 8,0 ± 1,10 a 9,0 ± 2,97 a
0,125 11,0 ± 5,37 a 8,0 ± 7,07 a 7,0 ± 3,35 a 7,0 ± 2,68 a 11,0 ± 3,29 a
0,025 5,0 ± 2,83 a 13,0 ± 13,42 a 8,0 ± 2,28 a 6,0 ± 3,58 a 6,0 ± 2,19 a
0,05 11,0 ± 4,10 a 3,0 ± 11,40 a 10,0 ± 3,16 a 11,0 ± 2,61 a 9,0 ± 3,29 a
0,1 10,0 ± 3,16 a 6,0 ± 9,62 a 6,0 ± 2,29 a 10,0 ± 3,16 a 8,0 ± 2,28 a
0,2 8,0 ± 2,28 a 8,0 ± 6,52 a 10,0 ± 3,16 a 9,0 ± 2,97 a 12,0 ± 3,03 a
0,25 11,0 ± 1,67 a 8,0 ± 7,90 a 16,0 ± 3,85 a 7,0 ± 3,03 a 6,0 ± 2,19 a
0,3 11,0 ± 3,29 a 9,0 ± 8,37 a 10,0 ± 3,16 a 6,0 ± 2,19 a 12,0 ± 3,03 a
0,6 13,0 ± 2,28 a 7,0 ± 4,47 a 8,0 ± 1,10 a 9,0 ± 2,19 a 9,0 ± 0,89 a
0,8 10,0 ± 3,74 a 9,0 ± 9,62 a 10,0 ± 2,45 a 9,0 ± 2,61 a 7,0 ± 1,79 a
1,0 12,0 ± 1,79 a 10,0 ± 9,62 a 11,0 ± 1,67 a 9,0 ± 0,89 a 9,0 ± 2,61 a
1,2 10,0 ± 5,10 a 13,0 ± 7,90 a 7,0 ± 3,90 a 5,0 ± 0,00 a 9,0 ± 3,58 a
1,4 12,0 ± 4,60 a 5,0 ± 6,52 a 10,0 ± 2,83 a 5,0 ± 2,83 a 12,0 ± 5,76 a
1,6 12,0 ± 4,60 a 7,0 ± 7,90 a 11,0 ± 2,61 a 7,0 ± 3,35 a 7,0 ± 3,35 a
1,8 7,0 ± 3,90 a 9,0 ± 10,37 a 10,0 ± 3,16 a 9,0 ± 3,58 a 9,0 ± 3,58 a
2,0 8,0 ± 3,35 a 9,0 ± 13,04 a 9,0 ± 2,97 a 7,0 ± 3,35 a 7,0 ± 3,35 a
1Médias ± EP seguidas de letra diferentes na coluna diferem pelo teste de Tukey (P < 0,05).
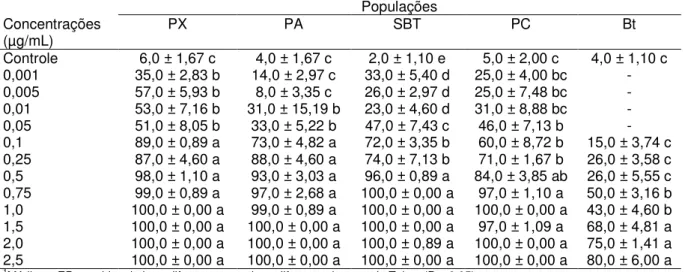
Porém, as concentrações 0,5 a 2,5 µg/mL da proteina Cry1Ac de B.
thuringiensis provocaram alta mortalidade em relação ao grupo controle, de lagartas de terceiro ínstar de P. xylostella para as populações PX (F12,52=54,47;
P<0,0001), PA (F12,52=48,04; P<0,0001), PC (F12,52=41,55; P<0,0001) e SBT
(F12,52=75,0; P<0,0001), que variou entre 84,0 a 100,0% de mortalidade. As
menores concentrações testadas da proteína Cry1Ac (0,001 e 0,005 µg/mL) causaram mortalidade que variou entre 8,0 a 57,0% (Tabela 3).
Os indivíduos de P. xylostella da população Bt apresentaram comportamento diferente em relação à mortalidade provocada pela proteína Cry1Ac. As concentrações 1,5 a 2,5 µg/mL provacaram mortalidade que variou entre 68,0 a 80% (F12,52=34,65; P<0,0001). A menor concentração da proteína
Tabela 3. Mortalidade (%) de lagartas de terceiro ínstar de diferentes populações de Plutella xylostella pela proteína Cry1Ac de Bacillus thuringiensis.
Populações Concentrações
(µg/mL) PX PA SBT PC Bt
Controle 6,0 ± 1,67 c 4,0 ± 1,67 c 2,0 ± 1,10 e 5,0 ± 2,00 c 4,0 ± 1,10 c
0,001 35,0 ± 2,83 b 14,0 ± 2,97 c 33,0 ± 5,40 d 25,0 ± 4,00 bc -
0,005 57,0 ± 5,93 b 8,0 ± 3,35 c 26,0 ± 2,97 d 25,0 ± 7,48 bc -
0,01 53,0 ± 7,16 b 31,0 ± 15,19 b 23,0 ± 4,60 d 31,0 ± 8,88 bc -
0,05 51,0 ± 8,05 b 33,0 ± 5,22 b 47,0 ± 7,43 c 46,0 ± 7,13 b -
0,1 89,0 ± 0,89 a 73,0 ± 4,82 a 72,0 ± 3,35 b 60,0 ± 8,72 b 15,0 ± 3,74 c
0,25 87,0 ± 4,60 a 88,0 ± 4,60 a 74,0 ± 7,13 b 71,0 ± 1,67 b 26,0 ± 3,58 c
0,5 98,0 ± 1,10 a 93,0 ± 3,03 a 96,0 ± 0,89 a 84,0 ± 3,85 ab 26,0 ± 5,55 c
0,75 99,0 ± 0,89 a 97,0 ± 2,68 a 100,0 ± 0,00 a 97,0 ± 1,10 a 50,0 ± 3,16 b
1,0 100,0 ± 0,00 a 99,0 ± 0,89 a 100,0 ± 0,00 a 100,0 ± 0,00 a 43,0 ± 4,60 b
1,5 100,0 ± 0,00 a 100,0 ± 0,00 a 100,0 ± 0,00 a 97,0 ± 1,09 a 68,0 ± 4,81 a
2,0 100,0 ± 0,00 a 100,0 ± 0,00 a 100,0 ± 0,89 a 100,0 ± 0,00 a 75,0 ± 1,41 a
2,5 100,0 ± 0,00 a 100,0 ± 0,00 a 100,0 ± 0,00 a 100,0 ± 0,00 a 80,0 ± 6,00 a
1Médias ± EP seguidas de letra diferentes na coluna diferem pelo teste de Tukey (P < 0,05).
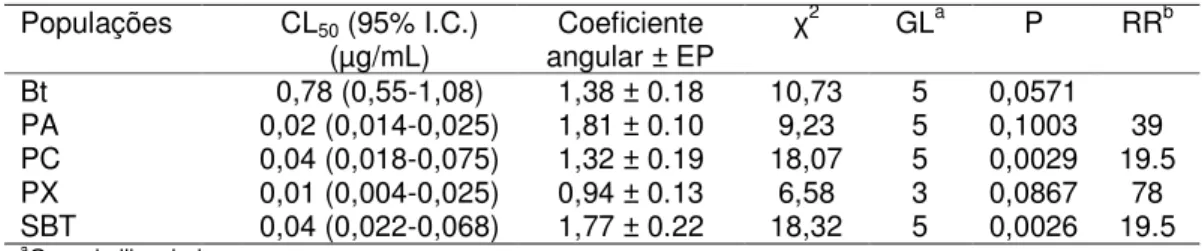
4.1.2. Estimativa da Concentração Letal 50 (CL50)
A toxicidade relativa da proteína Cry1Ac de B. thuringiensis apresentou ação diferente para as populações de P. xylostella utilizadas, sendo mais efetiva para as populações PA, PC, PX e SBT, o que é demonstrado pelos menores valores encontrados para CL50 (0,02; 0,04; 0,01 e 0,04 µg/mL, respectivamente)
(Tabela 4). A toxicidade para a população Bt foi significativamente diferente das demais, fato este indicado pela não sobreposição do limite de confiança a 95% dos parâmetros estimados. O valor estimado de CL50 para a população Bt foi 78
vezes maior do que a CL50 estimada para a população PX (Tabela 4).