Universidade Federal do Rio Grande do Norte Centro de Tecnologia
Departamento de Engenharia Química
Programa de Pós-Graduação em Engenharia Química
TESE DE DOUTORADO
DESENVOLVIMENTO DE UMA ROTA QUÍMICA
ALTERNATIVA DE SÍNTESE DE SrCo
0,8Fe
0,2O
3-δδδδe
LaNi
0,3Co
0,7O
3-δδδδPARA APLICAÇÃO NA REAÇÃO DE
OXIDAÇÃO DO CO
ANDARAIR GOMES DOS SANTOS
Orientador: Prof. Dr. Carlson Pereira de Souza
Co-orientador: Prof. Dr. João Fernandes de Sousa
ii
ANDARAIR GOMES DOS SANTOS
DESENVOLVIMENTO DE UMA ROTA QUÍMICA
ALTERNATIVA DE SÍNTESE DE SrCo
0,8Fe
0,2O
3-δδδδe
LaNi
0,3Co
0,7O
3-δδδδPARA APLICAÇÃO NA REAÇÃO DE
OXIDAÇÃO DO CO
Tese de doutorado apresentada ao Programa de Pós-graduação em Engenharia Química da Universidade Federal do Rio Grande do Norte, como requisito necessário para obtenção do título de doutora em Engenharia Química, sob a orientação do Prof. Dr. Carlson Pereira de Souza e co-orientação do Prof. Dr. João Fernandes de Sousa.
iii Catalogação da Publicação na Fonte
UFRN / Centro de Tecnologia
Biblioteca Setorial “Professor Horácio Nicolas Solimo”.
Santos, Andarair Gomes dos.
Desenvolvimento de uma rota química alternativa de síntese de e LaNi0,3Co0,7O3- para aplicação na reação de oxidação do CO./ Andarair Gomes dos Santos. – Natal, 2010.
143 f. : il.
Orientador: Carlson Pereira de Souza Co-Orientador: João Fernandes de Sousa
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Tecnologia. Departamento de Engenharia Química. Programa de Pós-Graduação em Engenharia Química.
1. Cerâmica (Tecnologia) – Tese. 2. Cerâmica - Materiais – Tese. 3. Reações Químicas – Tese. 4. Agentes Oxidantes – Tese. 4. Catalisadores – Tese. I. Souza, Carlson Pereira de. II. . Sousa, João Fernandes de. III. Universidade Federal do Rio Grande do Norte. IV. Título.
iv
SANTOS, Andarair Gomes dos - Desenvolvimento de uma rota química alternativa de síntese de SrCo0,8Fe0,2O3-δ e LaNi0,3Co0,7O3-δ para aplicação na reação de oxidação do
CO. Tese de doutorado, UFRN, Programa de Pós-Graduação em Engenharia Química, Natal, RN, Brasil.
Orientador: Dr. Carlson Pereira de Souza Co-orientador: Dr. João Fernandes de Sousa
RESUMO
-
Esta tese enfoca o método de síntese de coprecipitação para preparação de materiais cerâmicos com estrutura perovsquita, suas caracterizações e aplicação como material catalítico na reação de conversão de CO a CO2 desenvolvendo uma rota metodológica alternativa de síntese a partir da coprecipitação via meio oxalato do material SrCo0,8Fe0,2O3-δ. No intuito de verificar a influência desse método o mesmo foisintetizado também com base no método de complexação combinando EDTA - Citrato. O material foi caracterizado por: difratometria de raios-X (DRX), refinamento pelo método Rietveld, termogravimetria e termodiferencial (TG/DTA), Microscopia Eletrônica de Varredura (MEV) e de transmissão (MET), distribuição granulométrica e analise superficial pelo método BET. Ambos os métodos de síntese permitiram obter pós monofásicos, tendo o pH como um parâmetro relevante. A síntese com base no método via coprecipitação em meio oxalato permitiu obter tamanho de partículas na mesma ordem de grandeza que os obtidos a partir do método de complexação combinando EDTA - Citrato, nas mesmas condições de tratamento térmico. A natureza do reagente utilizado no método via coprecipitação em meio oxalato produziu um material com aproximadamente 80 % menor em relação ao tamanho médio de cristalito. Além disso, o método via coprecipitação em meio oxalato obteve precursores em estado sólido, em baixa temperatura (~26 oC), menor tempo de síntese, maior estabilidade térmica e um rendimento maior da ordem 90 a 95 %, mantendo na mesma ordem de grandeza o tamanho médio de cristalito que o método de complexação combinando EDTA - Citrato. Para fins comparativo das propriedades catalíticas do material, a perovsquita LaNi0,3Co0,7O3-δ foi também sintetizada pelo método de complexação
combinando EDTA – Citrato. A avaliação catalítica dos materiais SrCo0,8Fe0,2O3-δ e
LaNi0,3Co0,7O3-δ, foi acompanhada na reação de oxidação do CO a CO2 utilizando um reator tubular de aço inoxidável na faixa de temperatura de 75 – 300 oC. A conversão foi avaliada cujos resultados mostraram que para ambos os materiais o CO foi completamente convertido porém em menor tempo para o material LaNi0,3Co0,7O3-δ.
vi
ABSTRACT
This thesis focuses on the coprecipitation synthesis method for preparation of ceramic materials with perovskite structure, their characterization and application as catalytic material in the reaction of converting CO to CO2 developing a methodological alternative route of synthesis from the middle via oxalate coprecipitation material SrCo0,8Fe0,2O3-δ. In order to check the influence of this method, it was also synthesized
using a combined citrate - EDTA complexing method. The material was characterized by: X-ray diffraction (XRD), Rietveld refinement method, thermogravimetry and differential thermo analysis (TG / DTA), scanning (SEM) and transmission (TEM) electron microscopy, particle size distribution and surface analysis method BET. Both methods led to post-phase synthesis, with pH as a relevant parameter. The synthesis based on the method via oxalate coprecipitation among particles led to the crystalline phase as those obtained using a combined citrate - EDTA complexing method under the same conditions of heat treatment. The nature of the reagent used via oxalate coprecipitation method produced a material with approximately 80 % lower than the average size of crystallites. Moreover, the via oxalate coprecipitation method precursors obtained in the solid state at low temperature (~ 26 oC), shorter synthesis, greater thermal stability and a higher yield of around 90-95 %, maintaining the same order of magnitude the crystallite size that the combined citrate - EDTA complexing method. For purposes of comparing the catalytic properties of the material was also synthesized by the using a combined citrate - EDTA complexing method. The evaluation of catalytic materials SrCo0,8Fe0,2O3-δ LaNi0,3Co0,7O3-δ was accompanied on the oxidation of CO to
CO2 using a stainless steel tubular reactor in the temperature range of 75-300 oC. The conversion CO gas was evaluated in both materials on the results shaved that the firm conversion was loves for the material LaNi0,3Co0,7O3-δ.
vii
DEDICATÓRIA
viii
AGRADECIMENTOS
Primeiro e especialmente a DEUS, por ter me dado forças e perseverança para realizar este trabalho.
A minha FAMÍLIA, pelo apoio e incentivo durante toda a caminhada. Em especial, meu irmão Klebson.
Aos meus orientadores Prof. Dr. João Fernandes de Sousa e Prof. Dr. Carlson P. de Souza.
Ao professor Paskoscimas do PPGCEM da Universidade Federal do Rio Grande do Norte, pelos esclarecimentos teórico/prático, pela sua total disponibilidade e principalmente pela sua gentileza.
Aos meus bolsistas e voluntários, em especial a Thalles Diógenes, pelo suporte me prestado durante a pesquisa.
Aos colegas do LTR, especialmente a Wendell, Bruna e Heloísa.
A minha colega de doutorado Janine, pelas inúmeras conversas e desabafos durante a longa caminhada.
Aos professores Edson (PPGEQ) e Lucio (DEM), por toda simpatia, incentivo e apoio ao meu trabalho.
A todos os técnicos e laboratoristas responsáveis pelos equipamentos de análises (EDX/UFRN, DRX/BET/UFC, Distribuição granulométrica/UFRN), em especial a Erico e Artejose (técnicos/DRX/MEV/EDS) do NEPGN/UFRN, e ao prof. Dr. Pierre Satre e Dr. Madjid Arad da Université de Sud Toulon - Var /France, IM2NP - UMR CNRS 6242, (TG-DTA/MET/EDX/testes reacionais).
Aos profesores Lúcio e Fontes pelo suporte técnico / segurança.
Ao Programa de pós-graduação em engenharia química (PPGEQ) em especial a Mazinha pelo apoio e ajuda constante ao longo deste trabalho, ao Conselho Nacional de desenvolvimento científico e tecnológico (CNPq) e aos programas CTPetro / CNPq e CTEnerg / CNPq pelo suporte financeiro.
ix Na vida nada é para ser temido, é apenas para ser compreendido.
x CONTEÚDO
CAPÍTULO 1 ... 1
1. Introdução geral ... 2
CAPÍTULO 2 ... 5
2. Aspectos teóricos ... 6
2.1 Os materiais cerâmicos ... 6
2.1.1 Classificação dos materiais ... 7
2.1.2 Sistemas cristalinos ... 7
2.1.3 Sistemas de cristalização ... 8
2.1.4. Defeitos estruturais ... 9
2.2 Membranas cerâmicas ... 10
2.2.1 A perovsquita ... 10
2.3 Métodos de síntese ... 12
2.3.1 Método cerâmico convencional ... 13
2.3.2 Método sol-Gel ... 14
2.3.3 Método dos precursores poliméricos ... 14
2.3.4 Método de coprecipitação ... 15
2.4. Os materiais cerâmicos e suas aplicações... 15
2.4.1 Reações de reforma ... 16
2.4.1.1. Reforma a vapor (Steam Reforming) ... 16
2.4.1.2. Reforma a seco (Dry Reforming) ... 18
2.4.1.3. Reforma pela oxidação parcial ... 19
2.4.1.4 Reforma autotérmica ... 19
2.4.1.5 Reforma combinada ... 20
2.5 Os materiais cerâmicos e suas propriedades catalíticas... 20
CAPÍTULO 3 ... 23
3.1 Introdução ... 24
3.2. Experimental ... 26
3.2.1. Reagentes utilizados ... 26
3.2.2 Metodologia de síntese ... 26
3.2.3. Processo de moagem dos pós ... 29
3.2.4.1 Difração de Raios –X (DRX) ... 30
3.2.4.2. Microscopia Eletrônica de Varredura (MEV) ... 31
3.2.4.3. Microscopia Eletrônica de Transmissão (MET) ... 31
3.2.4.4. Distribuição granulométrica ... 31
3.2.4.5 Adsorção Física de Nitrogênio (Método de BET) ... 32
3.3. Resultados e Discussão ... 33
3.3.1. Estudos preliminares da síntese da fase SrCo0,8Fe0,2O3-δ com base no método de complexação combinando EDTA – Citrato... 33
3.3.2. Caracterização dos pós ... 35
3.3.2.1. Difração de raios-X (DRX) ... 35
3.3.2.2. Microscopia eletrônica de varredura (MEV) ... 42
3.3.2.3. Microscopia eletrônica de transmissão (MET) ... 52
3.3.2.4. Energia dispersiva de raios-X (EDX) ... 54
3.3.2.5. Distribuição granulométrica ... 54
3.3.2.6. Adsorção Física de Nitrogênio (Método de BET) ... 57
3.4. Conclusões parciais ... 61
CAPÍTULO 4 ... 63
xi
4.1.3 Procedimento experimental ... 71
4.2 Experimental ... 68
4.2.1 Espectroscopia de Infravermelho Transformada de Fourier (FTIR) ... 68
4.2.2Testes catalíticos ... 69
4.3. Resultados e discussões ... 73
4.3.1 Atividade catalítica ... 73
4.4 Conclusões parciais ... 79
CAPÍTULO 5 ... 80
5.1. Introdução ... 81
5.2. Experimental ... 83
5.2.1 Reagentes utilizados ... 83
5.2.2 Procedimento experimental ... 84
5.2.2.1 Preparação das soluções ... 84
5.2.2.2 Metodologia de síntese ... 84
5.3 Resultados e Discussões ... 88
5.3.1 Análises termogravimétrica e termodiferencial (TG/DTA) ... 88
5.3.2 Difração de Raios - X ... 90
5.3.3 Microscopia Eletrônica de Varredura (MEV) ... 95
5.4. Conclusões parciais ... 97
CONCLUSÕES GERAIS ... 98, 99 PROPOSTAS PARA TRABALHOS FUTUROS ... 102
REFERÊNCIAS ... 104
ANEXOS ... 105
Anexo I ... 116
Anexo II ... 122
Anexo III ... 130
Anexo IV ... 134
xii
LISTA DE FIGURAS
Figura 2.1 - Célula unitária de um cristal de sal (NaCl) ... 7 Figura 2.2 - Diagrama explicativo da forma como cada célula unitária determina a estrutura do cristal. ... 8 Figura 2.3 - Estrutura de uma perovsquita, ABO3. ... 11
Figura 3.1 - Rota metodológica proposta para síntese dos materiais com base no método de complexação combinando EDTA - Citrato. ... 27 Figura 3.2 - Difratogramas de raios-X do material SrCo0,8Fe0,2O3-δδδδ. ... 34
Figura 3.3 - Difratogramas do material SrCo0,8Fe0,2O3-δδδδ referente a influencia do pH da
solução sob as características do material obtido. (A) pH~ 6, (B) pH ~ 9 e (C) pH ~ 11. ... 37 Figura 3.4- Difratogramas do material SrCo0,8Fe0,2O3-δδδδ referente ao estudo das
condições de calcinação. pH 11, Taxa de aquecimento: 10 oCmin-1. Pré-calcinação: 230 oC por: (A) 180 min e (B) 300 min. ... 39 Figura 3.5 – Difratograma de raio-X do material LaNi0,3Co0,7O3-δδδδ. ... 42 Figura 3.6 – Microscopia eletrônica de varredura da amostra SrCo0,8Fe0,2O3-δδδδ obtida a
partir da condição de síntese (1) (pH ~6) com base no método de complexação
combinando EDTA - Citrato. Ampliação (A) 5000x e (B) 15000x. ... 44 Figura 3.7 – Mapeamento de dois pontos aleatórios na amostra SrCo0,8Fe0,2O3-δδδδ obtida a
partir da condição de síntese (1) (pH ~6) com base no método de complexação
combinando EDTA - Citrato. Ampliação (A) 350 x e (B) 3000 x. ... 45 Figura 3.8 – Análise por espectroscopia dispersiva de raios-X da amostra
SrCo0,8Fe0,2O3-δδδδ obtida a partir da condição de síntese (1) (pH ~6) com base no método
de complexação combinando EDTA - Citrato. (A) ponto A e (B) ponto B. ... 45 Figura 3. 9 – Microscopia eletrônica de varredura da amostra SrCo0,8Fe0,2O3-δδδδ obtida a
partir da condição de síntese (5) (pH ~ 9) com base no método de complexação
combinando EDTA - Citrato. Ampliação (A) 5000 x e (B) 15000 x. ... 46 Figura 3.10 – Mapeamento de dois pontos aleatórios na amostra SrCo0,8Fe0,2O3-δδδδ obtida
a partir da condição de síntese (5) (pH ~9) com base no método de complexação
combinando EDTA - Citrato. Ampliação (A) 350 x e (B) 3000 x. ... 47 Figura 3.11 – Análise de espectroscopia dispersiva de raios-X da amostra
SrCo0,8Fe0,2O3-δδδδ obtida a partir da condição de síntese (5) (pH ~9) com base no método
de complexação combinando EDTA-Citrato. (A) ponto A e (B) ponto B. ... 47 Figura 3.12 – Microscopia eletrônica de varredura da amostra SrCo0,8Fe0,2O3-δδδδ obtida a
partir da condição de síntese (6) (pH ~ 11) com base no método de complexação
combinando EDTA - Citrato. Ampliação (A) 5000x e (B) 15000x. ... 48 Figura 3. 13 – Mapeamento de dois pontos aleatórios na amostra SrCo0,8Fe0,2O3-δδδδ obtida
a partir da condição de síntese (6) (pH ~ 11) com base no método de complexação combinando EDTA - Citrato. (A) 350 x e (B) 3000 x. ... 49 Figura 3.14 - Análise dispersiva de raios-X da amostra SrCo0,8Fe0,2O3-δδδδ obtida a partir
da condição de síntese (6) (pH ~ 11) com base no método de complexação combinando EDTA - Citrato. (A) ponto A e (B) ponto B. ... 49 Figura 3.15 – Microscopia eletrônica de varredura da amostra SrCo0,8Fe0,2O3-δδδδ obtida a
xiii Figura 3.16 – Microscopia eletrônica de varredura da amostra (A) LaNi0,3Co0,7O3-δδδδ
obtida com base no método de complexação combinando EDTA-Citrato. Ampliacao: (A)15000 x e (B) 30000x. ... 52 Figura 3. 17 – Análise espectroscopia dispersiva de raios-X da perovsquita
LaNi0,3Co0,7O3-δδδδ obtida com base no método de complexação combinando EDTA -
Citrato. Pontos aleatorios na amostra: (A) ponto A e (B) ponto B. ... 53 Figura 3.18 – Microscopia eletrônica de transmissão da molecular cristalina da partícula do pó SrCo0,8Fe0,2O3 - δδδδ... 53
Figura 3.19 - Curva de distribuição granulométrica do material SrCo0,8Fe0,2O3-δδδδ. ... 56
Figura 3.20 - Curva de distribuição granulométrica dos materiais LaNi0,3Co0,7O3-δδδδ e
SrCo0,8Fe0,2O3-δδδδ. ... 57
Figura 3. 21 - Isoterma de adsorção/dessorção de nitrogênio das perovsquita: (A) SrCo0,8Fe0,2O3-δδδδ e (B) LaNi0,3Co0,7O3-δδδδ. ... 60
Figura 4.1 – Sistema reacional acoplado ao FTIR para medições catalíticos. ... 70 Figura 4.2 - Análise de espectros FTIR: (A) LaNi0,3Co0,7O3-δδδδe (B) SrCo0,8Fe0,2O3-δδδδ. ... 74
Figura 4.3 - Atividade Catalítica em diferentes temperaturas dos materiais:
LaNi0,3Co0,7O3-δδδδ (LaNiCoO) e SrCo0,8Fe0,2O3-δδδδ(SrCoFeO). ... 76
Figura 4.4 - Conversão da taxa das amostras LaNi0,3Co0,7O3-δδδδ (LaNiCoO) e
SrCo0,8Fe0,2O3-δδδδ(SrCoFeO) versus temperatura maxima. ... 78
Figura 5. 1 - Reator de mistura com agitação controlada para síntese dos precursores da fase a partir do método via coprecipitação de oxalato... 86 Figura 5.2 – Fluxograma o processo de síntese adotado para obtenção dos precursores da fase a partir do método via coprecipitação em meio oxalato. ... 88 Figura 5. 3 – Análise termogravimetrica(TG) - (A) e análise temodiferencial (DTA) - (B) das amostras do precursor óxido SrCo0,8Fe0,2O3-δδδδ referente as condições de síntese:
amostras (1 – 4). Taxa de aquecimento e resfriamento: 5 oCmin-1... 89 Figura 5.4 – Difratogramas referente à síntese do material cerâmico das condições de síntese: (A) Amostra 1, (B) Amostra 2, (C) Amostra 3 e (D) Amostra 4... 93 Figura 5.5 - Microscopia eletrônica de varredura do material (SrCo0,8Fe0,2O3-δδδδ) obtida a
xiv
LISTA DE TABELAS
Tabela 2.1 - Análise geométrica dos sistemas de cristalização. ... 9 Tabela 3.1 - Lista de reagentes químicos utilizados na síntese dos pós cerâmicos
(SrCo0,8Fe0,2O3-δδδδ) com base no método de complexação combinando EDTA - Citrato. 26
Tabela 3.2 – Condições experimentais de síntese para obtenção do material cerâmico do tipo perovsquita de composição SrCo0,8Fe0,2O3-δδδδ a partir da rota metodológica proposta.
... 28 Tabela 3.3 – Parâmetros cristalográficos do material obtidos a partir do refinamento Rietveld. ... 40 Tabela 3.4 - Dados cristalográficos dos materiais obtidos a partir do refinamento
Rietveld. ... 43 Tabela 3. 5 – Proporções estequiométricas da perovsquita obtidas a partir do MET... 54 Tabela 3.6 – Composição química dos pós (SrCo0,8Fe0,2O3-δδδδ) (% atômica). ... 55
Tabela 3.7 – Comparação da distribuição granulométrica do diâmetro de partícula de acordo com a massa acumulativo (%). ... 58 Tabela 3.8 – Propriedades texturais das perovsquitas (SrCo0,8Fe0,2O3-δδδδ e LaNi0,3Co0,7O3-δ
δδ
δ)... 59
Tabela 4.1 - Modos de vibração especifica dos gases CO e CO2. ... 72 Tabela 5.2 - Lista de reagentes químicos utilizados na síntese dos pós cerâmicos
(SrCo0,8Fe0,2O3-δδδδ) com base no método de coprecipitação em meio oxalato. ... 84
Tabela 5. 3 - Condições experimentais adotadas para síntese dos precursores utilizando diferentes reagentes e agentes precipitantes com base no método via coprecipitação em meio oxalato. ... 87 Tabela 5.4 - Dados das curvas de analise térmica do precursor de SrCo0,8Fe0,2O3-δδδδ ... 90
xv
LISTA DE SIMBOLOS E ABREVIAÇOES
% - percentagem
% A – percentagem atômica
θ - ângulo de Bragg
λ - comprimento de onda da radiação
β - largura total a meia altura (FWHM) de um pico ε - microdeformação da rede
δ - oxigênio não–estequiométrico / vacância
D - tamanho médio dos cristalitos
µm – micrometro (unidade de comprimento)
BET - Brunauer-Emmet-Teller
CILAS – granulometria de espalhamento com feixe de laser CO – monóxido de carbono
CO + H2 - gás de síntese
Co –cobalto (elemento químico) CO2 – dióxido de carbono
CPO - Oxidação Parcial Catalítica Cukα - radiação de cobre
C - espécies de carbono altamente reativas C - espécie menos ativa
DBWS – programa para refinamento com base no método Rietveld DRX - Difração de Raios-X
DTA - Análise Térmica Diferencial
EDS – energia por espectroscopia dispersiva EDTA – ácido etilenodiamino tetra-acético EDX – Energia dispersiva de raios-X Fe – Fe (elemento químico)
Fe2O4 – oxido de ferro II
FWHM - Full Width at Half Maximum G – grama
xvi GNL - tecnologia GTL convencional (gas-to liquid) (transformação do gás natural em combustíveis líquidos).
H2 – hidrogênio (elemento químico)
[H2]/[CO] – razão hidrogênio/monóxido de carbono Ir – Irídio (elemento químico)
JCPDS - Joint Committee on Powder Diffraction Standards K - fator dos particulados
MEV - Microscopia eletrônica de varredura mg – miligrama (unidade de massa)
MgO – oxido de magnésio
MIEC - condutores de mistura iônica e elétrica min – minuto (unidade de tempo)
mL – mililitro (unidade volumétrica) N2 – nitrogênio (elemento químico) NaCl – cloreto de sódio
NH4OH – hidróxido de amônio
Ni/Al2O3 - níquel suportado em alumina nm – nanômetro (unidade de comprimento) NO – oxido nítrico
o C – graus Celsius
o Cmin-1 – graus Celsius por minuto oC – graus Celsius
OH- - grupo hidroxila
Pd – praseodmio (elemento químico)
PEMFC - membranas trocadoras de prótons em células a combustível pH – pHmetro
POM - Oxidação Parcial de Metano Pt – platina (elemento químico) r/a - (raio do neck/raio de partícula) Rh – ródio (elemento químico) Ru – rutênio (elemento químico) S – parâmetro residual
xvii T - temperatura
TG - Termogravimétrica H0
CAPÍTULO 1
1. Introdução geral
O estudo da produçã tem sido um dos temas mai décadas, devido à possibi materiais nanoestruturados processos convencionais.
Várias pesquisas no com as normas ambientais material tem sido redesco diversidade que uma gam aplicação, devido à grande acomodar além de ser r flexibilidade de sua estrutu Doggali et al., 2010).
As perovsquitas sã elétrica e iônica, com e temperatura. Sendo materia et al., 2006) e sensores de g As membranas troc sido amplamente investigad em comparação a fontes hidrogênio do gás de síntes células combustíveis. Des prejudicial à célula, tendo e desempenho, inviabilizand completamente o monóxido Para remoção de CO da primeira, através da reaçã formando CO2 e H2, e a se reação de oxidação. Todavi
ção e caracterização de materiais nanoestrutura ais almejados na pesquisa tecnológica fundame ibilidade de melhorar um número de propr os podem exibir, em comparação aos materi
no campo de detecção e de transformação de ais, foram realizadas com materiais do tipo p
coberto como uma família de catalisadores ma de pesquisas científicas tem sido exercid e variedade de íons e valências que esta estrutu relativamente simples de sintetizar em c
tura química (Chang et al., 2007; Worayingyo
são de especial interesse devido apresentar excelente estabilidade química em uma a riais em potencial com membranas permeáveis
gases (Fagg et al., 2007).
ocadoras de prótons em células a combustíve gadas, devido à sua maior eficiência de conve tes convencionais de energia de combustív tese obtido pela reforma do gás natural pode
esta forma, o monóxido de carbono obtid o em vista reduzir o processo de adsorção do h ndo o processo. Desta forma, se faz nece ido da corrente de alimentação gasosa da célu a corrente rica de H2 existem duas possibil
ção gás de “shift”, onde o vapor de água segunda, consiste em eliminar o CO do refor avia, a remoção de CO não é completa utilizan
2 urados e ultrafinos mental nas últimas priedades que os eriais obtidos por
de gás, de acordo perovsquita. Este es de tão grande cida em estudo e utura simples pode conseqüência da yong et al., 2008;
tar condutividade ampla faixa de is de oxigênio (Lu
3 de “shift”, permanecendo ainda cerca de 1% de CO na corrente rica em H2 (Sirichaiprasert et al, 2008).
Contudo, para a aplicação da membrana de troca de prótons em células a combustível (PEMFC), faz-se necessário a remoção total de CO do fluxo reformado rico de H2 com o mínimo de consumo possível de H2, sendo uma alternativa viável a utilização da rota de oxidação. Os catalisadores a base de metais nobre são utilizados para remoção de CO devido serem ativos e estáveis. Todavia, grande atenção tem sido dada aos catalisadores a base de óxidos metálicos, devido os catalisadores a base de metais nobres serem caros e também raros.
Somente uma pequena fração de materiais com estrutura perovsquita tem sido explorada como catalisadores. Espera-se que uma investigação mais aprofundada explore o uso das perovsquitas como material catalítico, visando alcançar uma maior compreensão na área de catálise, e conseqüentemente, contribuírem para o desenvolvimento de processos catalíticos industrialmente viáveis.
Como observado na literatura, os pós cerâmicos podem ser obtidos através de distintos métodos de síntese (Courty e Marcilly, 1983; Segal, 1997; Pechini, 1967). Uma vez que, as propriedades dos materiais são fundamentalmente influenciadas pela qualidade das matérias-primas a partir das quais as mesmas são fabricadas e pela microestrutura final, qualquer tentativa de controle das propriedades de um produto deve passar pelo entendimento das propriedades básicas dos materiais, bem como pelo processo de fabricação durante o qual a microestrutura final se desenvolve.
No presente trabalho de tese é proposta uma rota tecnológica alternativa de síntese via coprecipitação em meio oxalato para produção de materiais cerâmicos a base de óxidos mistos (SrCo0,8Fe0,2O3-δ). Para esse método, um reator de mistura com
4 LaNi0,3Co0,7O3-δ) e sua aplicação como material catalítico na reação de oxidação do
monóxido de carbono a CO2.
No capítulo 2 é feita uma abordagem de temas relevantes relacionados ao tema principal da tese. O capítulo 3 apresenta um estudo do método de síntese para produção dos materiais cerâmicos (SrCo0,8Fe0,2O3-δ) com base no método de complexação
combinando EDTA - Citrato. Relevantes parâmetros tais como: pH e tratamento térmico (taxa de aquecimento e tempo de permanência no patamar) foram investigados. No capítulo 4 apresenta o estudo das propriedades e avaliação catalíticas dos materiais cerâmicos a partir da reação de conversão de CO a CO2. Finalmente, o capítulo 5 descreve a metodologia de síntese alternativa do material cerâmico SrCo0,8Fe0,2O3-δ
CAPÍTULO 2
6
2. Aspectos teóricos
2.1 Os materiais cerâmicos
O sinergismo entre o desenvolvimento tecnológico, necessidades econômicas e fatores ambientais vem causando uma grande mudança na utilização de materiais. Esta mudança é no sentido de se substituir materiais tradicionais da indústria, principalmente os metais, por outros que tenham um desempenho melhor a um custo menor. Os materiais candidatos para esta substituição são plásticos, cerâmicos e os seus compósitos.
Em função das características intrínsecas dos materiais cerâmicos, como baixa densidade, baixa condutividade térmica, alta resistência à corrosão e à abrasão sem se deformarem, sua utilização tem crescido de forma surpreendente em uma infinidade de aplicações nas mais diversas áreas do conhecimento humano.
As propriedades das cerâmicas especiais, bem como dos demais materiais, são fundamentalmente influenciadas pela qualidade das matérias-primas a partir das quais as mesmas são fabricadas e pela microestrutura final. Assim sendo, qualquer tentativa de controle das propriedades de um produto deve passar pelo entendimento das propriedades básicas dos materiais, bem como pelo processo de fabricação durante o qual a microestrutura final se desenvolve.
Novos processos de obtenção de pós, conformação e sinterização, bem como novas técnicas de caracterização das propriedades, vêm sendo bastante estudados tanto sob o ponto de vista científico quanto tecnológico.
7
2.1.1 Classificação dos materiais
Os inúmeros elementos e substâncias conhecidos podem ser classificados de várias formas distintas. Uma classificação importante em termos de propriedades elétricas é a de metais, isolantes e semicondutores. Além desta classificação, há também uma outra classificação no que diz respeito ao modo como os átomos ou moléculas estão arranjados ou distribuídos no material.
Materiais nos quais os átomos ou moléculas distribuem-se de forma organizada e regular por todo o material são classificados como materiais cristalinos ou simplesmente cristais, ou ainda sólidos1. Esta organização interna dos átomos em um cristal é responsável por uma série de propriedades importantes em aplicações industriais. Os materiais sem organização atômica interna definida são chamados amorfos. Os semicondutores, além de suas propriedades elétricas dependentes das condições de operação, também são materiais cristalinos. Estas duas características combinadas conferem a estes materiais uma grande importância tecnológica.
2.1.2 Sistemas cristalinos
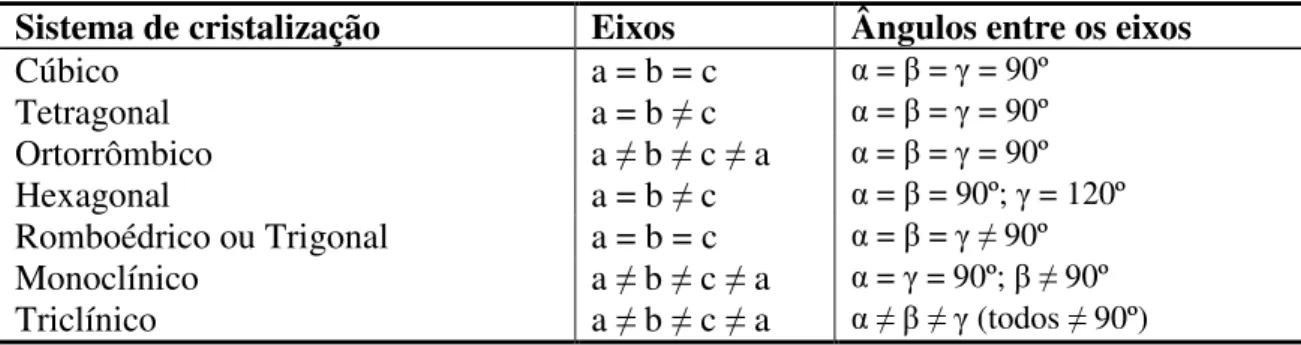
A existência da estrutura cristalina resulta dos sólidos cristalinos serem construídos a partir da repetição no espaço de uma estrutura elementar paralelepipédica denominada célula unitária, por exemplo: a célula unitária de um cristal de sal (NaCl), conforme Figura 2.1.
Figura 2.1 - Célula unitária de um cristal de sal (NaCl) (Fonte: Callister, 2002).
1
8 A forma e tamanho da célula unitária de cada cristal depende das dimensões, valência química e estado de ionização dos átomos ou moléculas que o compõem e das condições em que o cristal se formou. A mesma substância, sob condições de pressão e temperatura distintas, pode formar cristais com células unitárias totalmente diferentes.
A partir das células unitárias, e levando em conta os eixos de simetria e a posição do centro geométrico de cada elemento do cristal, é possível descrever qualquer cristal com base em diagramas designados por redes de Bravais, nome que homenageia Auguste Bravais (1811-1863), um dos pioneiros do seu estudo.
A Figura 2.2 apresenta o diagrama explicativo da forma como cada célula unitária determina a estrutura do cristal. Na realidade, cada cristal é constituído pela repetição de milhões de milhões de células unitárias semelhantes, agrupadas de forma regular, que, funciona como autênticos blocos construtivos do cristal, e acabam por determinar a sua macro-estrutura.
Figura 2.2 - Diagrama explicativo da forma como cada célula unitária determina a estrutura do cristal.
(Fonte: Callister, 2002).
2.1.3 Sistemas de cristalização
9 análise geométrica dos sistemas de cristalização permite concluir que existem sete sistemas distintos, conforme a Tabela 2.1.
Tabela 2.1 - Análise geométrica dos sistemas de cristalização.
Sistema de cristalização Eixos Ângulos entre os eixos
Cúbico a = b = c = = = 90º
Tetragonal a = b c = = = 90º
Ortorrômbico a b c a = = = 90º
Hexagonal a = b c = = 90º; = 120º
Romboédrico ou Trigonal a = b = c = = 90º
Monoclínico a b c a = = 90º; 90º
Triclínico a b c a (todos 90º)
Uma análise do grau de simetria de cada um dos sistemas acima apontados permite concluir que o mais simples, e o mais simétrico, é o cúbico, já que apresenta a simetria do cubo, beneficiado da isometria das suas faces. Os restantes seis sistemas ordenam-se de acordo com a seguintes sequência decrescente de simetria: hexagonal, tetragonal, romboédrico, ortorrômbico, monoclínico e triclínico.
2.1.4 Defeitos estruturais
Várias propriedades dos materiais são fortemente influenciadas através da ocorrência de defeitos na rede cristalina, podendo-se citar, os defeitos pontuais (lacunas e auto-intersticiais), impurezas (substitucional e intersticial), defeitos lineares (discordância aresta, discordância espiral e discordância mista) e defeitos interfaciais (superfície externa, contornos de grão, contornos de macla). Todavia, existem outros tipos de defeitos presentes em todos os materiais sólidos que são muito maiores. Estes incluem poros, trincas, e outras fases e, são introduzidos normalmente durante as etapas de processamento e fabricação (Callister, 2002).
10
2.2Membranas cerâmicas
Durante as últimas décadas, as membranas cerâmicas inorgânicas têm recebido maiores atenções em pesquisas e desenvolvimento devido às suas características, tais como: alta estabilidade química, térmica e mecânica. As membranas inorgânicas podem ser convenientemente classificadas em geral em dois tipos: membranas porosas e membranas densas. As membranas porosas têm a vantagem de alta permeabilidade, mas sua permeseletividade é relativamente baixa. Já as membranas densas apresentam alta permeseletividade em relação às espécies especiais, enquanto a permeabilidade é usualmente muito baixa.
Na década de 80, um novo tipo de membranas inorgânicas recebeu grande atenção, devido possuírem maior sensibilidade ao transporte de oxigênio. Além disso, algumas membranas com a estrutura perovsquita possuem maior fluxo de permeação (Teraoka et al., 1985). Desde então, extensivos esforços são direcionados ao uso de membranas condutoras iônicas e elétricas (MIEC) para melhorar o desempenho de processos de conversão de metano, combinando separação de ar e oxidação parcial catalítica (CPO) em alta temperatura numa única etapa. Estas membranas são materiais promissores para uso em muitos processos industriais que requerem um fornecimento contínuo de oxigênio puro.
2.2.1 A perovsquita
11 Figura 2.3 - Estrutura de uma perovsquita, ABO3.
(Fonte: Callister, 2002).
Um aspecto interessante da estrutura perovsquita é a possibilidade de modificações na rede cristalina, que de modo geral são realizadas pela dopagem nos sítios da estrutura, assumindo então a fórmula estrutural AxA1-xByB1-yO3.
Materiais com estrutura perovsquita podem ser também condutores de mistura iônica e elétrica (MIEC). Esses materiais são geralmente usados como membrana para separação de oxigênio. A característica de interesse neste caso é o oxigênio não– estequiométrico, δ, que é função da composição da membrana, temperatura e pressão
parcial de oxigênio no reator. Estes fenômenos de vacância podem ser gerados introduzindo-se um elemento adicional (dopante) na estrutura da perovsquita. Em baixa temperatura as vacâncias de oxigênio permanecem ordenadas na rede, mas em temperatura elevada, tipicamente T > 600 oC, elas tornam-se disponíveis para o transporte, promovendo migração de uma parte dos ânions de oxigênio de um lado da membrana para o outro. Um contra-balanceamento de fluxo de carga elétrica é apresentado temporariamente no material até se obter a neutralização (Bouweester et al., 2003, in Mertins, 2005).
12 zircônia estabilizada convencional e tem potencial a ser utilizado como membranas permeáveis a oxigênio para separação (Teraoka et al., 1985).
Teraoka et al., (1985), foram os pioneiros em estudos de permeação de oxigênio em uma série de misturas condutoras de óxidos tipo perovsquita (La, Sr)(Co, Fe) La 1-xAxFeyB1-xO3-δ (A: Ca, Sr, Ba e B: Co, Fe, Ni, Cu) e muitas pesquisas vêm direcionando
os estudos a membranas cerâmicas densas para separação de oxigênio em reatores de membrana.
2.3Métodos de síntese
Os materiais cerâmicos como os óxidos, são geralmente preparados a partir da purificação de minerais ou por métodos convencionais de preparação a partir de misturas de constituintes óxidos, hidróxidos e/ou carbonatos.
Estes materiais freqüentemente possuem grande tamanho de partículas requerendo, para gerar um material homogêneo e constituído por uma única fase, procedimentos de preparação que fazem uso de repetidas misturas, aquecimentos prolongados e elevadas temperaturas. Desvantagens como, baixa área superficial e controle limitado da microestrutura inerente aos processos a altas temperaturas tendem a ser superadas através da preparação destes materiais.
Os materiais cerâmicos podem ser obtidos por diferentes métodos de síntese através do preparo por reações em estado sólido ou preparação por via úmida. A maioria das sínteses industriais de pós para aplicação em cerâmicas tem sido realizadas por meio do método cerâmico tradicional (reação em estado sólido), também chamada de mistura de óxidos. Dentre os métodos de síntese por via úmida, destacam-se coprecipitação, Pechini e Sol-Gel. Devido às características dos pós, não só influenciam fortemente o processamento como também as reações que ocorrem durante a queima, e determinam as propriedades finais do produto, o conhecimento e o domínio da técnica a ser empregada para a síntese dos pós é de fundamental importância.
13 preparação. Segundo os autores, o método de preparação da membrana influencia as características físico-químicas da membrana resultante, como: a microestrutura e a cristalinidade, e na uniformidade da composição local, possivelmente, melhorando a propriedade de permeabilidade de oxigênio.
Kharton et al.,(2001) e Qiu et al., (2000) relataram que as membranas feitas com pó preparado por vários métodos exibiram permeabilidade de oxigênio diferente. Os autores sintetizaram pós de SrFeCo0,5Ox por três diferentes métodos: método de reação em estado-sólido, método de evaporação-a-seco, e método de complexação combinando EDTA - Citrato. Os fluxos de oxigênio através destas membranas foram comparados e foi verificada ainda a influência das condições de preparação do pó como: moagem, calcinação, e sinterização (Ikeguche et al. 2003).
A seguir é apresentada uma descrição suscita de alguns dos métodos de síntese de pós cerâmicos.
2.3.1 Método cerâmico convencional (reação no estado sólido)
O método cerâmico convencional baseia-se na mistura de óxidos e tratamento térmico, geralmente, em temperaturas elevadas. É um processo simples, relativamente barato e é o método mais utilizado industrialmente.
O método cerâmico ou ainda mistura de óxidos, embora apresente a nomenclatura mistura de óxidos, utiliza como reagentes de partida, óxidos metálicos, carbonatos ou ainda outros sais adequados.
Os reagentes iniciais são misturados e moídos em um moinho para reduzir o tamanho de suas partículas, aumentando-se as áreas superficiais específicas. A mistura é então calcinada em temperaturas elevadas para permitir a interdifusão dos cátions.
14 estequiometria devido à volatilização dos reagentes em temperaturas elevadas, dificultando assim, a reprodutibilidade do método.
2.3.2 Método Sol-Gel
O método Sol-Gel tem sido definido como uma maneira de sintetizar óxidos (Segal, 1997) inorgânicos através da preparação do sol (dispersão de partículas coloidais em um líquido); gelação do sol (formação do gel pelo estabelecimento de ligações entre as partículas do sol, formando uma estrutura rígida que imobiliza a fase líquida nos seus poros); remoção do solvente (o líquido remanescente evapora e é removido por difusão do seu vapor para a superfície). O tempo no qual a solução parece solidificar é chamado de ponto de gel (Brinker e Shere, 1990).
Pelo emprego do método Sol-Gel são obtidos géis, baseados tipicamente em alcóxidos, produzidos segundo reações de hidrólise e policondensação em baixa temperatura, convertidos a pó por tratamento térmico em temperaturas relativamente baixa. Este processo reduz o consumo de energia decorrente do processo de moagem e permite controle da morfologia dos pós. No entanto é considerado um processo caro devido ao alto custo dos reagentes utilizados.
2.3.3 Método dos precursores poliméricos (método Pechini)
Este método é utilizado na síntese de diversos óxidos policatiônicos. Baseia-se na formação de quelatos entre os cátions metálicos (na forma de sais em solução aquosa) com um ácido hidrocarboxílico. Posteriormente, é adicionado um polialcool, como o etilenoglicol, para promover a polimerização pela reação de poliesterificação entre o citrato do íon metálico e o etilenoglicol (Pechini, 1967).
15 Para a obtenção dos pós, essa matriz polimérica é decomposta por tratamentos térmicos com o propósito de eliminar o material orgânico e sintetizar a fase desejada. O método promove a formação de pós com boa homogeneidade, baixo tamanho de partícula, alta pureza, baixo custo e temperatura de processamento relativamente baixa.
2.3.4 Método de coprecipitação
Baseia-se na preparação de soluções homogêneas contendo os cátions desejados e na precipitação simultânea e estequiométrica desses cátions em solução, na forma de hidróxidos, oxalatos, etc. Os princípios gerais que norteiam a coprecipitação foram descritos por Courty e Marcilly (1983).
No processo de precipitação, um sólido insolúvel é formado a partir de uma solução. A precipitação de um sistema multicomponente origina os óxidos mistos. O precipitado gerado deve ser filtrado, lavado e calcinado.
Para obtenção de produtos de alta qualidade, efetua-se um rígido controle de pH, temperatura, tipo e concentração de reagentes. Mudanças do pH, do solvente ou a adição de um anion formador de sal insolúvel favorece a precipitação simultânea.
O Método de coprecipitação possibilita a lavagem das impurezas solúveis antes da etapa de calcinação e a obtenção de pós estequiométricos, reativos e homogêneos. No entanto, algumas devantagens desse processo são a baixa homogeneidade quando mais de uma espécie é precipitada e a dificuldade de obtenção de um material compostos com dopantes em baixas concentrações.
2.4 Os materiais cerâmicos e suas aplicações
16 São mais de 50 milhões de barris de petróleo processados ao dia nas refinarias em todo mundo, para atender à demanda de combustíveis líquidos, como a gasolina, os óleos lubrificantes, naftas entre outros. Todavia, o consumo elevado de petróleo ocasiona também um aumento de emissão de gases poluentes à atmosfera, tais como: dióxido de carbono, monóxidos, óxidos de nitrogênio e hidrocarbonetos, todos nocivos ao meio ambiente (Akansua et al., 2004).
O gás natural, por tratar-se de uma fonte de energia livre de poluentes, apresenta-se como uma alternativa promissora para atender a demanda do mercado consumidor de modo geral como também aos órgãos ambientais especializados. Todavia, o maior desafio é a busca de uma tecnologia que viabilize o processo, uma vez que as grandes reservas de gás natural encontram–se em regiões remotas, distantes dos grandes centros consumidores (Hall et al, 2005), sendo necessário o seu transporte através de gasodutos ou através da liquefação (Akansua et al., 2004). Uma alternativa de baratear os custos do produto final esta em transformar o gás natural em produtos de maior valor agregado, por exemplo, a transformação do gás natural em combustíveis líquidos, conhecida como a tecnologia GTL convencional “gas-to-liquid”. Essa transformação ocorre em três etapas: (1) a transformação do gás natural a gás de síntese (H2+CO), (2) formação dos hidrocarbonetos pela síntese de Fischer-Trospch e (3) formação dos combustíveis líquidos obtidos através da reação de hidrocraqueamento (Petesem et al, 2001; Choudttary et al, 2002; Wilhelm et al., 2001; Nielsen et al., 2002; Dyer et al., 2000; Song et al., 2006).
Os três principais processos catalíticos para transformação de gás natural em gás de síntese são: (1) a reforma a vapor do gás natural, (2) a oxidação parcial do gás natural e (3) a reforma autotérmica do gás natural.
2.4.1 Reações de reforma
2.4.1.1Reforma a vapor (Steam Reforming)
17 promotores é o catalisador comercial, comumente utilizado, mas também são utilizados catalisadores a base de metais nobres, porém são catalisadores caros e raros.
A reforma a vapor é uma reação química entre vapor d’água e hidrocarbonetos (gás natural ou naftas) que forma uma mistura de hidrogênio (H2), monóxido de carbono (CO) e dióxido de carbono (CO2).
Na reforma a vapor de hidrocarbonetos mais pesados que o metano, o principal curso da reação é a conversão dos mesmos em CO e H2, conforme a Reação (2.1) e entalpia de reação padrão (∆Hof). De acordo com Satterfield, (1993) e Trimm, (1997), a
reação de deslocamento gás-água, ou reação shift também ocorre, Reação (2.3):
CnH2n+2 + nH2O → nCO + (2n+1)H2 H0f >0 Reação (2.1)
CH4 + H2O → CO + 3H2 H0f = 206 kJ/mol Reação (2.2)
CO + H2O → CO2 + H2 H0
f = - 41,2 kJ/mol Reação (2.3)
As principais reações que ocorrem no processo de reforma a vapor de metano são as Reações (2.2) e (2.3): conversão do metano em monóxido de carbono e hidrogênio e a reação de deslocamento (shift) gás-água, respectivamente. Sendo a Reação (2.2) endotérmica e favorecida pela alta temperatura e reduzidas pressões. Em contraste, a Reação (2.3) é levemente exotérmica e favorecida por baixas temperaturas (Nielsen, 1984).
O catalisador utilizado no processo é particularmente importante, já que este pode causar obstrução dos poros e destruição do catalisador como mostrado por Trimm, (1999) e Borowiecki et al., (1999), e assim evitar condições que conduzam à deposição de carbono e promova a diminuição da sua vida útil e posterior desativação.
18 Segundo Satterfield, (1993) e Trimm, (1997), quatro reações podem estar envolvidas na formação de carbono, são elas:
2CO → C + CO2 Reação (2.4)
CH4 → C +2H2 Reação (2.5)
CO + H2→ C + H2O Reação (2.6)
CnH2n+2 → nC + (n+1)H2 Reação (2.7)
A formação de coque sobre a superfície do catalisador ocorre conforme descrito a seguir: os hidrocarbonetos se dissociam sobre esta superfície, produzindo espécies de carbono altamente reativas (C ). Muitos são gaseificados, mas alguns convertem-se numa espécie menos ativa, C , provavelmente por polimerização ou rearranjo do C . Este pode ser gaseificado ou pode se dissolver nos cristais do catalisador. O carbono dissolvido permeia através do catalisador para o meio e precipita-se na interface suporte-catalisador. Este processo contínuo conduz à formação de carbonos filamentosos “whiskers”, resultando inicialmente em uma maior exposição dos sítios ativos. Todavia, o contínuo crescimento dos filamentos tem como conseqüência a sua fragmentação com perda de fase ativa e entupimento do leito reacional (Trimm, 1997).
2.4.1.2Reforma a seco (“Dry Reforming”)
A reforma a seco do metano não tem nenhuma aplicação comercial. Entretanto, a reforma a seco com CO2 combinada com a reforma a vapor foi aplicada com sucesso na indústria por muitos anos. A reforma a seco do metano é descrito de acordo com as seguintes reações e suas respectivas entalpias de formação padrão:
CH4 + CO2→ 2CO + 2H2 H0f = 247 kJ/mol Reação (2.8)
CO + H2O → CO2 + H2 H0f = - 41,2 kJ/mol Reação (2.9)
CH4 → C + 2H2 H0
f = 75 kJ/mol Reação (2.10)
19 Todavia, quando se tem interesse em obter produtos oxigenados à reforma a seco apresenta vantagens relacionadas à possibilidade de produzir diretamente um gás de síntese com uma relação baixa de [H2]/[CO] (1:1).
2.4.1.3Reforma pela oxidação parcial
No processo de reforma pela oxidação parcial, o combustível (por exemplo: gás natural) reage com uma quantidade limitada de oxigênio para produzir o hidrogênio, que depois é purificado. A oxidação parcial pode ser aplicada em diferentes tipos de hidrocarbonetos, incluindo combustíveis pesados e hidrocarbonetos sólidos.
Neste processo, o combustível é normalmente aquecido até uma temperatura de aproximadamente 1400 °C na presença de ar ou oxigênio, causando a decomposição do combustível e produzindo hidrogênio, monóxido de carbono e resíduos. Este processo é seguido pela reação de “shift”.
CH4 + ½ O2→ CO + 2H2 H0f = -38 kJ/mol Reação (2.12)
A reação é exotérmica e pode ser catalítica ou não-catalítica. Provavelmente, o maior problema da oxidação parcial é que na maioria das vezes precisa-se de oxigênio altamente puro para as reações, assim como elevada temperatura de operação.
2.4.1.4Reforma autotérmica
As reações químicas que ocorrem nesse processo são uma combinação das ocorridas no processo de reforma a vapor e da oxidação parcial.
20
2.4.1.5Reforma combinada
Este processo consiste em um reator composto por duas secções. Normalmente a reforma a vapor ocorre na zona superior na presença de um catalisador. O gás de síntese produzido e o metano que não foi convertido reagem com o oxigênio na zona inferior do reator.
Claridge et al., (1998) estudaram a reforma combinada, a partir da combinação da reforma a vapor e reforma seca. A mistura gasosa inicialmente utilizada foi metano, oxigênio e nitrogênio sobre um catalisador de platina numa temperatura de 300 ºC, para converter todo o oxigênio e metano em dióxido de carbono, água e metano não convertido, que foram submetidos a reforma combinada sobre carbetos de molibdênio suportados e não suportados para obter gás de síntese, de acordo com a Reação (2.13).
3CH4 + CO2 + 2H2O → 4CO + 8H2 Reação (2.13)
2.5
Os materiais cerâmicos e suas propriedades catalíticas
O estudo da produção e caracterização de materiais ultrafinos e nanoestruturados tem sido um dos temas mais atraentes da pesquisa fundamental e tecnológica nas últimas décadas, isso devido às possibilidades de melhoria das diversas propriedades que os materiais nanoestruturados podem ter em comparação aos materiais obtidos pelos processos convencionais.
Cerca de 90% dos produtos de transformação da indústria química utilizam catalisadores em alguma etapa de sua produção (Cardoso, 1987), sendo ainda maior quando se consideram as reações de controle ambiental (Rangel, 2007). Isso devido à necessidade crescente de aprimorar os processos de produção industrial, racionalizar as formas de utilização de energia e desenvolvimento de métodos de obtenção de produtos com menor impacto ao meio ambiente.
21 foram estudados para reação de reforma do metano com dióxido de carbono para produção de gás de síntese, por exemplo. Dentre eles, catalisadores baseados em níquel (Rivas et al., 2008; Ouaguenouni et al., 2009) e metais nobres (Rh, Ru, Ir, Pd e Pt) (Znak et al., 2008; Minoso, 2009) tem mostrado desempenho catalítico, em termos de atividade e seletividade, promissores para gás de síntese. Dentre estes materiais, os metais nobres se destacam mostrando-se melhores quando comparados ao níquel, pois este se desativa rapidamente devido à deposição de carbono. No entanto, o alto custo dos metais nobres torna atrativo o desenvolvimento de catalisadores de níquel para utilização industrial. Um dos desafios consiste em torná-lo mais resistente a deposição de carbono. Tem sido relatado que a adição de óxidos de metais alcalinos ou alcalinos terrosos e de lantanídeos (Cao et al., 2003) ou a utilização de espécies metálicas altamente dispersas sobre o suporte contribuem para a redução da formação de carbono, aumentando a estabilidade catalítica.
Uma opção particularmente atrativa para uma reação de alta temperatura, como a reforma seca de metano, é o uso de precursores com estrutura perovsquita, que pode apresentar alta estabilidade térmica, podendo ser talvez, a solução aos problemas relacionados a desativação. Em 1972, Voorhoeve et al, relataram que os óxidos tipo perovsquita (ABO3) apresentam alta atividade catalítica comparável à de um catalisador de platina utilizado na exaustão automotiva.
Nos óxidos tipo perovsquita, a substituição dos cátions nos sítios A e B por cátions metálicos provocam alteração das propriedades catalíticas. Assim como, foi considerado que diferentes procedimentos de preparação introduzem diferentes características físico-química dos materiais, por exemplo, área específica, cristalinidade e composição da superfície. Em relação aos catalisadores de metais nobres, as perovsquitas são menos dispendiosas, termicamente mais estável e que apresenta oxidação catalítica de comparável atividade. Uma das restrições técnicas ao uso de perovsquita como catalisadores é a incapacidade de produzir materiais de área superficial elevada.
22 produção de energia (Cheng et al., 2009). Na catálise, vários trabalhos têm demonstrado a versatilidade das perovsquitas. Assim, as perovsquitas têm sido aplicadas na redução de NO com CO2 ou hidrogênio para produzir CO2 e N2 (Stathapoulos et al., 2009), na oxidação total de etanol (Soares et al., 2007), na conversão do metano a gás de síntese pela reforma com CO2 (Lima et al., 2007), entre outras aplicações, tais como acoplamento oxidativo de alcanos, hidrogenação e hidrogenólise de hidrocarbonetos e oxidação da amônia (Silva et al., 2004), evidenciam a importância dos óxidos do tipo perovsquita.
A larga diversidade das propriedades que esses materiais exibem deve-se a possibilidade de síntese dos óxidos tipo perovsquita pela substituição parcial de cátions na posição A e B da estrutura, originando compostos substituídos que seguem a fórmula A1-xAxB1-yByO3-δ. Essas características são responsáveis pela grande variedade de
CAPÍTULO 3
Estudo da influência dos parâmetros de síntese no
tamanho médio de cristalito usando o método de
24
3.1 Introdução
De modo geral, o domínio do método empregado para síntese dos materiais é de grande importância, devido às características dos materiais serem influenciadas durante o processo e as reações que ocorrem durante a queima, influenciando suas propriedades finais. Para a maioria das aplicações, a síntese controlada de alta pureza se faz necessária, para obter propriedades reprodutíveis dos materiais. Sendo a escolha do método de fundamental importância para um melhor controle da área superficial, tamanho de partículas e baixo grau de aglomeração. Todavia, todas estas técnicas têm suas vantagens e desvantagens, devido à diferença do princípio químico envolvido em cada tecnologia.
A membrana cerâmica ternária de composição SrCo0,8Fe0,2O3-δ e estrutura do
tipo perovsquita foi sintetizado pelo método de reação em estado-sólido (Teraoka et al., 1985) e pelo método de complexação combinando EDTA - Citrato (Mcintosh et al., 2006) e é bem discutida na literatura (Teraoka et al., 1985; Qui et al., 1995; Liu et al., 1996; Lee et al., 1997; Zhang et al., 1999; Shao et al., 2001; Tong et al., 2002; Fan et al., 2004; Minishige et al., 2005; Mcintosh et al., 2006), apresentando partículas na faixa de 38 - 200 µm e alto fluxo de permeação de oxigênio (3,1 cm3cm-2min-1 a 850
oC). Todavia, poucas informações são encontradas da abordagem do método de síntese e principalmente caracterizações dos pós.
Com base nestas informações decidiu-se partir da síntese desse material (SrCo0,8Fe0,2O3-δ) para realizar um estudo do método de síntese com base no método de
complexação combinando EDTA - Citrato (Young et al., 1995; Shao et al., 2000; Dong et al., 2001; Shao et al., 2001; Tong et al., 2002; Rebeilleau et al., 2005; Lu et al., 2006), uma vez que são encontradas diversas variações na metodologia de síntese apresentadas na literatura, com o objetivo de conhecer e controlar as condições adequadas ao processo de síntese. Os parâmetros pH e tratamento térmico foram avaliados, determinando as condições experimentais que garantam a preparação da fase perovsquita com baixo grau de impurezas e menor tamanho de cristalito.
25 destes materiais, sendo assim, um dos principais motivos para escolha como sendo o método de síntese para reprodução dos pós cerâmicos (SrCo0,8Fe0,2O3-δ).
Com o objetivo de investigar e reproduzir a metodologia de síntese com base no método de complexação combinando EDTA - Citrato, utilizou-se o material cerâmica de composição SrCo0,8Fe0,2O3-δ do tipo perovsquita e, a partir de rotas e parâmetros
controlados apresentados no método (Shao et al., 2000; Tong et al, 2002; Ikeguche et al., 2005) definir uma rota modificada que apresente facilidade de processamento, reprodutibilidade e confiabilidade de produção dos pós cerâmicos.
Para fins comparativo, das propriedades catalíticas do material, a perovsquita LaNi0,3Co0,7O3-δ foi também sintetizado pelo método de complexação combinando
26
3.2
Experimental
3.2.1 Reagentes utilizados
A síntese dos materiais cerâmicos de estrutura perovsquita de composição SrCo0,8Fe0,2O3-δ e LaNi0,3Co0,7O3-δ foi realizada com base no método de complexação
combinando EDTA - Citrato e os reagentes utilizados para síntese são resumidos na Tabela 3.1. Os cálculos estequiométricos encontram-se no Anexo I.
Tabela 3.1 - Lista de reagentes químicos utilizados na síntese dos pós cerâmicos (SrCo0,8Fe0,2O3-δ) com base no método de complexação combinando EDTA - Citrato.
Reagente Fórmula química Pureza, % Fabricante
EDTA ácido C10H16N2O8 99,99 Sigma/Aldrick
Nitrato de estrôncio Sr(NO3)2 99 Sigma/Aldrick
Nitrato de cobalto II hexahidratado
Co(NO3)26H2O 98 Sigma/Aldrick Nitrato de níquel
Hexahidratado
Ni(NO3)26H2O 98 Sigma/Aldrick Nitrato de ferro III
nanohidratado
Fe(NO3)39H2O 98 Sigma/Aldrick
Hidróxido de amônia NH4OH 25 Fluka
Ácido cítrico C6H8O7 99 Sigma/Aldrick
3.2.2. Metodologia de síntese
Os pós de composição SrCo0,8Fe0,2O3-δ foram reproduzidos com base no método
de complexação combinando EDTA - Citrato, onde foram investidas e reproduzidas metodologias abordadas na literatura (Shao et al., 2002; Tong et al., 2002; Ikeguche et al., 2003). A partir daí foi elaborada uma nova metodologia com a finalidade de dominar o método de síntese para preparação do pó e conhecer as características finais dos pós.
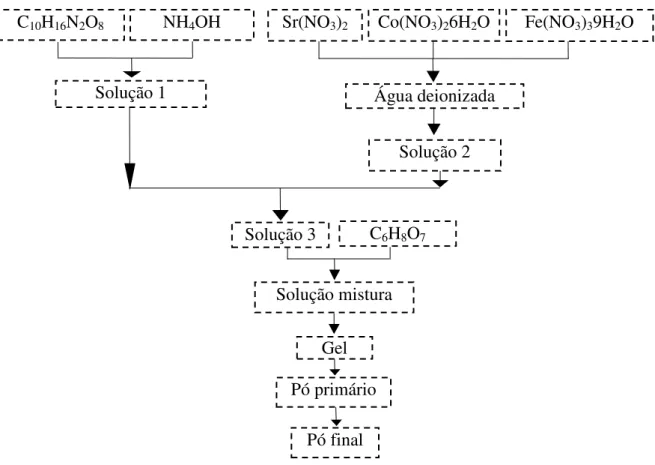
27 A metodologia de síntese proposta com base no método de complexação combinando EDTA - Citrato é descrita a seguir: quantidade apropriada de EDTA ácido foi diluída em hidróxido de amônia numa razão 1 g:10 mL e mantida sob agitação e aquecimento (30 - 40 oC) até obtenção de uma solução límpida (solução 1), em seguida a solução 2, à base dos elementos (Sr, Co e Fe) e em proporções definidas estequiometricamente (Anexo I) foi adicionada a solução 1, por fim, o ácido cítrico foi adicionado (solução 3) e a temperatura controlada em cerca de 80 oC e o pH até a formação do gel. Uma razão molar de EDTA ácido (C10H16N2O8), ácido cítrico (C6H8O7) e íons metálicos totais de 1:1,5:1 foi adotada para obtenção do material cerâmico do tipo perovsquita. Em caso de precipitação, o pH da solução foi corrigido com adição de NH4OH 25 %.
Para ilustração da metodologia de síntese, a Figura 3.1 mostra a rota metodológica proposta como procedimento experimental para síntese do material cerâmico (SrCo0,8Fe0,2O3-δ) com base no método de complexação combinando EDTA -
Citrato.
Figura 3.1 - Rota metodológica proposta para síntese dos materiais com base no método de complexação combinando EDTA - Citrato.
Solução 3 C6H8O7
C10H16N2O8 NH4OH Sr(NO3)2 Co(NO3)26H2O Fe(NO3)39H2O
Solução 2
Solução mistura
Pó final Pó primário
Gel
28 Cada um dos parâmetros que compõem a rota metodológica proposta, como: temperatura de cada etapa, tempo decorrente entre uma etapa e outra para a adição de reagente até a formação do gel foram inicialmente verificados.
Após estudo realizado para montagem da rota metodológica da síntese dos materiais com base no método de complexação combinando EDTA – Citrato foram realizados experimentos modificando alguns parâmetros relevantes da síntese, como por exemplo: pH (6 - 11) e condições de calcinação (taxa de aquecimento e tempo de permanência no patamar), no intuito de produzir um material monofásico, com o menor teor de impurezas (enxofre, carbono residual, entre outros) e menor tamanho médio de cristalito e para verificar a influência desses parâmetros no tamanho médio de cristalito do material (algumas análises encontram-se no Anexo II). A razão molar de EDTA ácido, ácido cítrico e íons metálicos totais de 1:1,5:1 não foi verificada, por trata-se de um parâmetro que não apresentou alteração nos diversos trabalhos encontrados na literatura, tais como os apresentados por: Shao et al., (2001); Shao et al., (2002); Tong et al., (2002); Ikeguche et al., (2003); Dong et al., (2001); Rebeilleau et al., (2005); Lu et al., (2006). A Tabela 3.2 resume algumas das condições experimentais adotadas para as sínteses, as demais estão no Anexo II.
Tabela 3.2 – Condições experimentais de síntese para obtenção do material cerâmico do tipo perovsquita de composição SrCo0,8Fe0,2O3-δ a partir da rota metodológica proposta.
Experimento Codificação
das amostras pH Pré-calcinação Condições experimentais de síntese (oC) / patamar (h)
Taxa, (oCmin-1)
Calcinação (oC)/ Patamar (h)
1 TpH6 6 230/3 2 950/5
5 TpH9 9 230/3 2 950/5
6 TpH11 11 230/3 2 950/5
13 (4)a 11 230/3 10 950/5
15 (5)a 11 230/5 10 950/5
Após os testes realizados com os parâmetros de síntese e metodologias para obtenção de pós monofásicos de composição SrCo0,8Fe0,2O3-δ, a perovsquita de
composição LaNi0,3Co0,7O3-δ foi reproduzida a partir da rota metodológica proposta. As
29 igual a 800 oC, com taxa de aquecimento de 10 oC durante 300 min (Lima e Assaf, 2007).
3.2.3. Processo de moagem dos pós
Após realizar o estudo dos parâmetros de síntese a partir da rota metodológica proposta para obtenção de pós (SrCo0,8Fe0,2O3-δ) foi realizada moagem dos materiais
utilizando um moinho de bolas. O procedimento adotado para moagem dos pós usando o moinho de bolas é descrito a seguir.
1- Pesagem da amostra (pó)
2- Lavagem do recipiente e bolas de zircônia. Primeiro com água e em seguida como o líquido utilizado na moagem do pó (no caso, acetona). A quantidade de bolas utilizadas na moagem foi de cerca de 55 % do volume do recipiente.
3- No recipiente contendo as bolas de zircônia introduziu-se o pó e posteriormente o volume de líquido para moagem. Neste caso, utilizou-se aproximadamente 40 mL de acetona.
4- Manualmente fez-se uma agitação previa no recipiente já contendo o pó, bolas de zircônio e a acetona.
5- O recipiente foi colocado no moinho sob agitação durante um tempo pré-estabelecido. Após esse tempo o moinho foi desligado e então, retirado o recipiente contendo o pó.
Após o processo de moagem, o pó foi recuperado a partir da evaporação da acetona e em seguida passado numa peneira (100 mesh) para sua desaglomeração.
3.2.4 Caracterização dos pós
As técnicas a seguir foram utilizadas para caracterização dos pós cerâmicos (SrCo0,8Fe0,2O3-δ) sintetizados a partir da rota metodológica proposta.
30 - Estudo morfológico e de composição química por Microscopia Eletrônica de Varredura (MEV/EDS) e de Transmissão (MET);
- Distribuição Granulométrica do tamanho de partículas por espalhamento por feixe de laser (CILAS);
- Determinação da área superficial a partir do método BET (Brunauer-Emmet-Teller).
3.2.4.1 Difração de Raios – X (DRX)
Os pós cerâmicos obtidos foram caracterizados por Difração de Raios-X (DRX) pelo método do pó (Difratômetro de Raios-X Shimadzu DRX - 6000), utilizando radiação CuK e comprimento de onda igual a 1,5406 Å, a fim de identificar as fases cristalinas. Os difratogramas foram obtidos na faixa 2θ de 20 a 80 graus em passos de
0,02 o e tempo de passo de 1 segundo na temperatura ambiente de 25 oC. A partir dos difratogramas foi realizado um refinamento pelo método Rietveld para determinação do tamanho médio de cristalito e outros parâmetros cristalográficos dos materiais obtidos a partir das alterações nos parâmetros de síntese. Os difratogramas de Raios-X foram comparados com os padrões (n°: 150874-ICSD e 79022-ICSD, LaNi0,3Co0,7O3-δ e
SrCo0,8Fe0,2O3-δ, respectivamente).
O método de Rietveld (Wilson, 1995) é um método de análise de refinamento de estruturas cristalinas nos quais todos os fatores de contribuições para as intensidades medidas podem ser simultaneamente refinadas até que a diferença entre as amostras experimentais e calculadas (Residual) seja minimizada (Gualtieri, 2006; Martinez, 2006). O programa DBWS Tools versão 2.16 usa o algoritmo Newton - Raphson para refinar e quantificar essas intensidades medidas. O ajuste dos picos do difratograma é realizado com o perfil da função Pseudo - Voigt modificada, contendo as contribuições Lorentziana e Gaussiana (Wilson, 1995).
31 entendido como o tamanho médio dos cristalitos na direção perpendicular para o plano {hkl}. A Equação 3.2 apresenta o modelo de Scherrer (Azároff, 1968; Young, 2002; Jenkins e Snyder, 1996):
2 2
std
obs β
β
β= − (3.1)
θ
β
λ
cos
K
D= [Å] (3.2)
onde,
λ
é o comprimento de onda da radiação do material usado no difratômetro para o CuKα; λCu,kα1 = 1,54056Å, β é a largura total a meia altura (FWHM) de um pico de difração de raio-X, θ é o ângulo de Bragg, K é um fator dos particulados e ε é amicrodeformação da rede.
O tamanho médio de cristalino dos pós apresentados foram calculados a partir de uma média aritmética dos resultados obtidos pelo refinamento Rietveld e o programa DBWS Tools versão 2.16.
3.2.4.2 Microscopia Eletrônica de Varredura (MEV)
A morfologia dos pós foi observada a partir da microscopia eletrônica de varredura (MEV) no microscópio Philips XL 30 ESEM e análises de Energia Dispersiva de Raios-X foram realizadas para determinação semi-quantitativa dos elementos presentes nos pós cerâmicos.
3.2.4.3Microscopia Eletrônica de Transmissão (MET)