“JÚLIO DE MESQUITA FILHO”
FACULDADE DE MEDICINA VETERINÁRIA CAMPUS DE ARAÇATUBA
AVALIAÇÃO DA MATURIDADE PULMONAR DE
CORDEIROS NASCIDOS A TERMO E PREMATUROS
PELA ANÁLISE CITOLÓGICA, TESTE DE CLEMENTS E
CONTAGEM DE CORPOS LAMELARES DO LÍQUIDO
AMNIÓTICO
Natália Cristina de Souza
Médica Veterinária
UNIVERSIDADE ESTADUAL PAULISTA
“JÚLIO DE MESQUITA FILHO”FACULDADE DE MEDICINA VETERINÁRIA CAMPUS DE ARAÇATUBA
AVALIAÇÃO DA MATURIDADE PULMONAR DE
CORDEIROS NASCIDOS A TERMO E PREMATUROS
PELA ANÁLISE CITOLÓGICA, TESTE DE CLEMENTS E
CONTAGEM DE CORPOS LAMELARES DO LÍQUIDO
AMNIÓTICO
Natália Cristina de Souza
Orientador: Prof. Adjunto Francisco Leydson F. Feitosa
Dissertação apresentada à Faculdade de Medicina Veterinária – Unesp, Câmpus de Araçatuba, como parte das exigências para obtenção do título de Mestre em Ciência Animal (Fisiopatologia Médica e Cirúrgica de Pequenos Animais)
Catalogação na Publicação(CIP)
Serviço Técnico de Biblioteca e Documentação – FMVA/UNESP Souza, Natalia Cristina de
S729a Avaliação da maturidade pulmonar de cordeiros nascidos a termo e prematuros pela análise citológica, teste de clements e contagem de corpos lamelares do líquido amniótico / Natalia Cristina de Souza. --Araçatuba: [s.n], 2014.
109 f. il.; + CD-ROM
Dissertação (Mestrado) – Universidade Estadual Paulista, Faculdade de Medicina Veterinária, 2014.
Orientador: Prof. Adj. Francisco Leydson Formiga Feitosa
1. Maturidade dos órgãos fetais. 2. Técnicas e procedimentos diagnósticos. 3. Neonatologia. 4.Ovinos I. T.
DADOS CURRICULARES DA AUTORA
NATÁLIA CRISTINA DE SOUZA – Nascida em Araçatuba no dia 2 de Outubro de 1984. Iniciou e concluiu o curso de graduação em Medicina Veterinária na FAI – Faculdades Adamantinenses Integradas (2005-.2009) Ingressou no Programa de Residência Médico Veterinária na área de Fisiopatologia da Reprodução e Obstetrícia Veterinária da Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP, Araçatuba, São Paulo
“Vencedor não é apenas quem conquista algo. Vencedor é quem conquista, não
perde sua essência e jamais esquece de onde veio e de quem o ajudou no caminho.”
Dedicatória
Dedico à minha filha e alma gêmea Maria Eduarda de Souza Faleiros, por me lembrar todos os dias, que eu tenho um grande motivo para ser feliz e
À FAPESP, pela concessão da bolsa de mestrado (2011/14933-3) e pelo apoio financeiro (2011/20219-1).
Ao meu orientador, Francisco Leydson Formiga Feitosa pela oportunidade, confiança e pela compreensão durante esses anos de convivência.
Aos meus pais, Sandra Aparecida e Gerson Ângelo, razões da minha vida, por todo esforço e preocupação em me tornar uma pessoa melhor, responsável e trabalhadora.
Aos meus avós, alicerces da minha vida e toda minha família que sempre me mandaram força para eu seguir em frente.
À minha mãe Sandra Aparecida, minha irmã, Aline Esther e minha tia Rosemary de Freitas, pela ajuda nos cuidados com minha filha, enquanto concluía este projeto.
Aos meus colegas de trabalho Gabriel Isola , Fernanda Bovino, Larissa Gabriela, Jefferson Alcindo, Maurício Desck, Daniela Denadai, Renata Nogueira, Luis Gustavo Narciso, Fernanda Fink, Eduardo Panelli, Arthur Araújo, Eduardo Tadeu (Duzão), Thomas, Guto, Janete, Diogo Gaubeur, Guilherme, em especial à minha amiga Juliane Teramachi pela força e ajuda.
Aos professores Paulo Ciarlini e Sueli Mogami Bomfim, pela autorização da utilização de seus laboratórios.
PÁGINA
1 INTRODUÇÂO... 11
2 REVISÃO DE LITERATURA... 13
2.1 O líquido aminiótico... 15
2.2 Colheita do líquido aminiótico... 17
2.3 Avaliação da maturidade pulmonar e fetal ... 18
2.4Testes propostos para avaliação da maturidade pulmonar e fetalError 19 2.4.1 Método citológico ... 19
2.4.2 Teste de Clements... 20
2.4.3 Contagem de corpos lamelares ... 21
2.5 Análise hematológica dos neonatos... 22
2.5.1 Glicemia... 22
2.5.2 Lactato ... 23
2.5.3 Hemogasometria... 23
2.5.4 Hemograma... 25
2.6 Objetivos... 26
2.6.1 Objetivo geral... 26
2.6.2 Objetivos especificos... 26
3 MATERIAIS E MÉTODOS... 27
3.1 Características dos animais e grupos experimentais ... 27
3.2 Instalações e manejo... 28
3.3 Anestesia e procedimento cirúrgico ... 28
3.5.1 Coloração de azul de Nilo a 0,1%... 32
3.5.2 Coloração Hematoxilina Shorr... 33
3.5.3Teste de Clements... 33
3.5.4 Teste de Clements por Barreto (2006)... 34
3.5.5 Contagem de Corpos Lamelares... 35
3.6 Avaliação dos recém nascidos... 35
3.6.1 Colheitas e preparação das amostras ... 37
3.6.1.1 Glicemia e Lactato... 37
3.6.1.2 Hemogasometria... 37
3.6.4 Hemograma... 38
3.6.5 Exame Radiográfico... 39
3.7 Análise Estatítica... 39
4 RESULTADOS E DISCUSSÃO... 40
4.1 Análise do líquido amniótico ... 40
4.1.1 Método citológico- Coloração de Azul de Nilo 0,1%... 43
4.1.2 Método Citológico - Coloração Hematoxilina Shorr... 46
4.1.3 Teste de Clements (1972)... 49
4.1.4 Teste de Clements Modificado por Barreto... 53
4.1.5 Contagem de corpos lamelares... 53
4.2 Avaliação dos recém-nascidos ... 58
4.2.1 APGAR ... 59
4.2.2 Frequência cardíaca ... 62
4.2.3 Frequência Respiratória ... 64
4.2.4 Temperatura Retal ... 67
4.2.5. Exame das mucosas... 70
4.2.8. Hemogasometria ... 78
4.2.8.1. pH... 79
4.2.8.2. PCO2... 80
4.2.8.3. Bicarbonato HCO3... 80
4.2.8.4. Déficit e ou excesso de base (BE)... 81
4.2.9. Hemograma... 82
4.2.9.1. Hematócrito (Ht)... 82
4.2.9.2. Hemoglobina... 83
4.2.9.3. Proteína Total... 84
4.2.9.4. Fibrinogênio... 85
4.2.9.5. Leucócitos Totais... 86
4.2.9.6. Neutrófilos segmentados... 87
4.2.9.7. Linfócitos... 87
4.2.9.8. Monócitos... 88
4.2.10. Avaliação Radiográfica pulmonar dos recém-nascidos... 89
5. CONCLUSÃO... 94
NASCIDOS A TERMO E PREMATUROS PELA ANÁLISE CITOLÓGICA, TESTE DE CLEMENTS E CONTAGEM DE CORPOS LAMELARES DO
LÍQUIDO AMNIÓTICO
RESUMO - O objetivo deste estudo foi avaliar a maturidade pulmonar de cordeiros, por meio do teste de Clements, da análise citológica pela coloração de Azul de Nilo e Shorr, e da contagem de corpos lamelares no líquido amniótico de ovelhas. Para tanto, foram utilizados 56 animais (24 ovelhas e 32 cordeiros), divididos em três grupos, a saber : Grupo I: constituído por oito ovelhas, com gestação em torno de 145 dias, e por 10 cordeiros nascidos de partos normais; grupo II: composto por oito ovelhas, com 138 dias de gestação, e por onze cordeiros nascidos de cesarianas; e, grupo III : constituído por oito ovelhas com 138 dias de gestação e que receberam 16mg/ovelha de dexametasona, por via intramuscular, 36 horas antes da cirurgia eletiva, e por 11 cordeiros delas nascidos. Na coloração de azul de Nilo observou-se diferença significativa entre os grupos I e III, porém esta técnica não foi satisfatória. Entretanto, a citologia utilizando a coloração de Hematoxilina-Shorr mostrou-se confiável, onde o grupo I diferiu estatisticamente do grupo III. Cerca de 20% dos cordeiros do grupo I possuíam maturidade pulmonar pelo teste de Clements. Contudo, o grupo II foi o que apresentou menor quantidade de bolhas (9,1%). O grupo III teve maior porcentagem de animais com maturidade pulmonar (36,4%), quando comparados aos grupos I e II. Os corpos lamenares apresentavam tamanhos variando entre 0,019 a 0,590 micrometros. A avaliação da maturidade pulmonar e fetal na neonatologia veterinária visa determinar o nascimento de paciente com alto risco, bem como o imediato estabelecimento de terapia de suporte ao recém-nascido, minimizando possíveis complicações e melhorando as taxas de sobrevivência.
Palavras-chave: maturidade dos órgãos fetais, técnicas de diagnósticos,
PREMATURE LAMBS, USING CYTOLOGICAL ANALYSIS, CLEMENTS TEST AND LAMELLAR BODIES COUNT IN THE AMNIOTIC FLUID
SUMMARY – The aim of this study was to determine pulmonary and fetal
maturity of lambs by means of cytological tests using Nile Blue and Hematoxilin-Shorr staining, Clements’ test and amniotic fluid lamellar body count. Amniotic fluid samples were collected from 24 sheep in order to evaluate pulmonary and fetal maturity of their 32 lambs, which were divided into three groups: Normal group included 10 lambs born at term, after 145 days of gestation; Caesarean group included 11 lambs delivered by caesarean section, after 138 days of gestation; and Caesarean+Dexamethasone group included 11 lambs born from sheep submitted to caesarean section, after 138 days of gestation, and dexamethasone 16 mg/animal (IM) administration two days prior to the surgical procedure.. A significant difference was observed between Normal and Caesarean+Dexametasone groups using Nile Blue staining. However, this technique was not effective. Hematoxilin-Shorr staining was reliable and it was possible to verify that the Normal group differed statistically from the group submitted to Caesarean+Dexamethasone. In Clements’ test, aiming to observe the presence of surfactant, which is characterized by the formation of bubble rings, approximately 20% of animals in the Normal group presented pulmonary maturity. However, the Caesarean group showed the least amount of bubbles (9.1%). The Caesarean+Dexamethasone group showed higher percentage of animals with pulmonary maturity (36.4%) when compared to the Normal and Caesarean groups The lamellar bodies were then measured to verify their size, which varied between 0.019 and 0.590 micrometers.
Key-words: fetal organ maturity, diagnostic techniques and procedures,
1 INTRODUÇÃO
A abordagem emergencial dos neonatos difere marcadamente do paciente crítico adulto pela fisiologia e pelos parâmetros hemodinâmicos particulares. Após o nascimento, inicia-se um período crítico chamado de “período de transição”, que engloba a adaptação do neonato da vida intrauterina para a extrauterina. Nesta fase, os sistemas corporais promovem ajustes fisiológicos considerados cruciais para o neonato. Sob condições não fisiológicas, relacionadas, em especial, aos partos distócicos e ao nascimento prematuro, estabelecem-se os quadros de asfixia precoce e tardia. A vulnerabilidade do neonato às condições adversas do meio relacionadas à imaturidade dos sistemas compensatórios e regulatórios orgânicos, bem como a ineficácia dos mecanismos de defesa intrínsecos ao período inicial do desenvolvimento, faz dessa categoria animal tópico especial na terapêutica veterinária. Neste prisma, pode-se pressupor que a adaptação e a vulnerabilidade ao meio externo são, indubitavelmente, ainda mais instáveis e desafiadores em animais prematuros.
2 REVISÃO DE LITERATURA
O período do periparto é fase de alto risco para o feto e a mãe. Cerca de 5 a 10% dos bezerros e 15 a 20% dos cordeiros nascidos por ano nos Estados Unidos morrem antes de mamar (VAALA; HOUSE, 2006). Entre 50 e 70% da mortalidade neonatal ocorrem nos primeiros três dias de vida (DWYER, 2008; SAWALHA et al., 2007), sendo a distocia, a inanição e a hipotermia, responsáveis por 50 a 60% dessas perdas (VAALA; HOUSE, 2006).
Grande parte dos avanços ocorridos nas últimas décadas, com relação à assistência perinatal e neonatal, relacionam-se com a função respiratória, visto que a capacidade funcional pulmonar é imprescindível para a sobrevivência do neonato. A maturidade fetal pode ser clinicamente caracterizada, entre outros fatores, pela insuficiência respiratória. Dentro deste contexto é de grande importância para o clínico avaliar o grau de maturidade pulmonar fetal, levando-se em consideração que qualquer problema na formação de algum componente pulmonar ou o nascimento prematuro pode acarretar problemas respiratórios ao neonato, como a síndrome da angústia respiratória (SAR) e outras. Evitar o nascimento prematuro constitui a principal medida preventiva para reduzir os riscos e sequelas da morbidade respiratória neonatal (LOBATO, 2011;TABORDA et al.,1998).
O surfactante é estocado pelos corpos lamelares, os quais são estruturas carreadas para o espaço alveolar através dos movimentos respiratórios fetais e exsudação de líquido, sendo facilmente demonstradas no líquido amniótico (LA) por meio da microscopia eletrônica. Vários estudos têm demonstrado que os corpos lamelares aumentam com o progredir da gestação e a sua determinação no LA tem boa correlação com outros indicadores de maturidade pulmonar fetal (LEE, et al., 1996).
As consequências clínicas da ausência desse líquido pulmonar (surfactante pulmonar) podem ser observadas em várias situações. Em humanos, neonatos prematuros que não possuem surfactante apresentam grande dificuldade para insuflar os pulmões, especialmente nas primeiras respirações. Mesmo quando seus alvéolos são insuflados artificialmente, é grande a tendência ao colapso espontâneo, por seus alvéolos serem menos estáveis sem surfactante pulmonar. Por essa razão, a ausência dessa substância ou alterações na quantidade ou qualidade dos fosfolipídios que o compõem, em um neonato prematuro, podem ser fatores importantes para desenvolvimento de síndrome da angustia respiratória (SAR) neonatal, também conhecida como síndrome da membrana hialina. Como consequência poderá ocorrer atelectasia progressiva, edema, alteração da relação ventilação/perfusão, levando à hipóxia tecidual; (DUBIN et al., 2000; GRENACHE ; GRONOWSKI, 2006; LOBATO, 2011; WIJNBERGER et al., 2009)
contagem de corpos lamelares (CL) e teste de Clements (COSTA et al., 2001; TABORDA et al., 2000).
2.1 O líquido amniótico
O LA desempenha importante papel no crescimento e desenvolvimento fetal. Circunda e protege o feto na cavidade amniótica, proporcionando um coxim contra os limites constritivos do útero gravídico, permitindo-lhe espaço para movimento e crescimento, e protegendo-o de traumatismos externos. Este espaço ao redor do feto é importante para o desenvolvimento e maturação de seus pulmões. Além disso, tem como funções manter a temperatura corporal, proteger contra desidratação, prevenir a aderência entre o feto e o âmnio, promover a dilatação da cérvix, vagina e vulva durante o parto, facilitando a passagem do feto, além de inibir o crescimento bacteriano e participar da homeostasia de líquidos e eletrólitos (JAINUDEEN; HAFEZ, 2004; MOURA et al., 2009).
Os animais domésticos possuem os líquidos alantoideano e amniótico nas respectivas bolsas, diferenciando-se, assim, da mulher, que apresenta, como único líquido fetal, o fluido amniótico (GRUNERT; BIRGEL, 1984).
muito acelerado chegando a 485 mL, enquanto que o LA apresenta pouco aumento. Durante o último mês de gestação (quinto), o fluído alantóide quase duplica o seu volume para 834 mL, mas o volume de LA diminui para 369 mL. Quando há presença de gêmeos a totalidade de líquidos é de, aproximadamente, o dobro.
Olíquido alantoideano tem coloração amarela clara a âmbar, aspecto transparente, consistência aquosa e volume variando de 100 a 2000 mL (TONIOLLO; VICENTE, 1995). De acordo com Souza et al. (2000a), o aspecto do fluido amniótico em ovelhas varia do amarelo claro ao límpido viscoso, sendo visto nos últimos dias da gestação. Com o evoluir da gestação, o fluido amniótico vai se enriquecendo de células fetais originárias da pele fetal, do folheto amniótico e dos tratos respiratório, urinário e digestório (SOUZA et al., 2000b).
A cavidade amniótica é formada entre 13 a 16 dias após a concepção em ovelhas e apresenta-se como um saco de camada dupla repleto de líquido e em íntimo contato com o feto (ROBERTS, 1998). A origem dos fluidos fetais (amniótico e alantoideano) e as secreções que para ele contribuem são complexas. Existem, pelo menos, quatro locais em que podem ocorrer a absorção e a secreção: sistema respiratório, urinário, digestivo e a pele (JAINUDEEN; HAFEZ, 2004).
No feto ovino, a urina formada nos mesonéfrons passa para dentro da cavidade alantoideana por meio do úraco até os 90 dias de gestação. Depois disso, a urina migra em quantidades crescentes para a cavidade amniótica devido à oclusão do úraco e à abertura da uretra. Deste modo, a urina fetal forma a maior fonte de fluido amniótico na última fase da gestação em ovinos (JAINUDEEN; HAFEZ, 2004).
2.2 Colheita do líquido amniótico
Para obtenção de fluidos fetais, o método eleito é o da amniocentese transabdominal, sendo procedimento seguro, que pode ser realizado no ambulatório humano. Em ovinos, Mellor e Slater (1972) indicaram a cateterização para a colheita de LA.
Em estudos com amniocentese, Bongso e Basrur (1975) afirmaram que a técnica tem realização limitada, devido à anatomia do útero gravídico, dos sacos e fluidos fetais. Os primeiros estudos em medicina veterinária para analisar a fisiologia e o comportamento bioquímico do LA, obtido por amniocentese, foram realizados em ovinos (ALEXANDER et al., 1958; McDOUGALL, 1949; MELLOR e SLATER, 1972), em bovinos (LEIBO; RALL, 1990), em caprinos (AIDANASI; CHAUMAN, 1992), e em equinos (SCHMIDT et al., 1991).
No entanto, Prestes et al. (2001) obtiveram o LA aos 70, 100 e 145 dias de gestação em ovelhas, para determinação bioquímica, por meio de laparotomia e punção direta do útero, sendo relatado que não houve problemas posteriores, como por exemplo, aborto ou morte dos fetos. Já em caprinos, Lovell et al. (1995) recomendaram a ultrassonografia como guia da
2.3 Avaliação da maturidade pulmonar e fetal por meio do líquido amniótico O LA é fonte importante para avaliação das condições fetais. Uma variedade de métodos bioquímicos, citológicos, biofísicos e imunológicos permitem a determinação do grau de maturação pulmonar, renal e epidérmica fetais, além de anormalidades genéticas e outras afecções (KJELDSBERG; KNIGHT, 1998).
Para análise do LA, os métodos diretos geralmente são mais eficazes, por analisarem os componentes específicos do surfactante pulmonar, incluindo a medida da relação lecitina/esfingomielina (L/E), dosagem do fosfatidilglicerol (PG), teste de Clements, contagem de corpos lamelares (CL), relação surfactante/albumina (S/A), determinação da absorbância do LA a 650nm, além da citologia do LA (COSTA et al., 2001; DALENCE et al., 1995).
A medida da relação surfactante/albumina (S/A), por polarização de fluorescência, é método de avaliação quantitativa da maturidade pulmonar fetal bastante utilizado na medicina humana de países desenvolvidos. Baseia-se na ligação competitiva de uma sonda fluorescente à albumina e ao surfactante no líquido amniótico. A polarização é alta quando a sonda está ligada à albumina e baixa quando ligada ao surfactante (GRENACHE; GRONOWSKI, 2006).
A medida da relação L/E, descrita por Gluck et al. (1971), é uma das provas laboratoriais mais utilizadas na identificação de conceptos com pulmões imaturos em humanos, visto que vários estudos comprovaram a segurança da técnica. (COSTA et al., 2001; BERTINI et al., 1992). Esta medida é considerada o teste padrão ouro para maturidade pulmonar; no entanto, apresenta aspectos negativos, pois é técnica dispendiosa, laboriosa, devendo ser realizada em laboratório capacitado (DUBIN et al., 2000).
A identificação de fosfatidilglicerol (PG) no LA oferece garantia de maturidade pulmonar ao nascimento, mas também é um método extremamente caro e demorado (BERTINI et al., 1992; TABORDA et al., 2000).
profissionais especializados, rapidamente reproduzível, clinicamente confiável e, finalmente, aplicável na maioria das gestações (FIELD, 1997).
2.4 Testes propostos para avaliação da maturidade pulmonar e fetal 2.4.1 Método citológico
Mediante o estudo citológico do LA e suas modificações em relação ao período gestacional, pode ser factível a determinação da maturidade do concepto. Para a visualização das células do LA, uma das técnicas empregadas é a coloração por Sulfato de Azul do Nilo. Estabeleceu-se, em humanos, a proporção de células lipídicas coradas por esta técnica, que se apresentam alaranjadas, possibilitando, portanto, a avaliação da maturidade fetal. A presença de grande quantidade de células orangeofílicas no fluido amniótico é indicativa da maturidade das glândulas sebáceas, e a porcentagem dessas células está diretamente relacionada à maturidade fetal (KJELDSBERG; KNIGHT, 1998).
Em ovinos, essas células alaranjadas praticamente inexistem no início da gestação, aparecendo em pequena proporção no terço médio e se proliferam até o momento do parto, representando cerca de 50 a 95% da população celular encontrada no LA, com maiores valores encontrados nos fetos mais velhos, revelando que a análise citológica é um bom meio para predizer a idade fetal (SOUZA et al., 2000b).
A técnica de citologia de Azul de Nilo (0,1%) ou índice cito-lipídico consiste na mistura de uma gota de LA com uma gota de corante, homogeneização e posterior leitura em microscopia óptica (NOMURA et al., 2001). Esta técnica permite a classificação celular quanto ao grau de maturidade, pois quanto mais vermelho-amarelado, mais maduro (CAMPANA et al., 2003).
analisar a citologia do LA. Dentre elas destacam-se o método Hematoxilina– Shorr, Lugol forte, Giemsa, entre outras.
Martins (2003) realizou ensaio sobre a citologia do LA de cadelas, onde comparou os métodos de colorações de Hematoxilina Shorr, Giemsa e Diff- Quick, e concluiu que apesar da coloração pelo método de Hematoxilina-Shorr ser trabalhosa e, portanto, mais lenta, permite melhor avaliação da morfologia e determina com mais exatidão o estágio de maturação fetal, em virtude de suas características tintoriais.
2.4.2 – Teste de Clements
O teste de Clements, proposto por Clements et al. (1972), constitui-se prova rápida, simples, econômica e segura, que se baseia na propriedade biofísica do surfactante de manter a superfície de tensão na interface ar-líquido, representada pela formação de um halo estável de bolhas, pela reação com o álcool (esterificação). Em humanos, a acurácia desse teste não apresenta resultados falso-positivos, variando de 1 a 3%. No entanto, os falso-negativos são mais frequentes, variando de 8 a 40%. Cita-se que o teste de Clements deve ser utilizado como triagem para a presença de maturidade pulmonar, acreditando-se nos resultados positivos e submetendo, contudo, os resultados negativos a exames mais sensíveis (AMORIM et al., 1998). Em cães, o teste de Clements modificado pode ser empregado para a avaliação da viabilidade fetal e maturidade pulmonar (BARRETO, 2002).
2.4.3 Contagem de corpos lamelares
um teste rápido, de baixo custo, requerendo pequeno volume de amostra, podendo ser facilmente quantificado por aparelhos habitualmente usados para realização de hemogramas (DALENCE et al., 1995), já que seu tamanho (1 a 5 µm) é muito semelhante ao das plaquetas (1-3 µm) de humanos (DUBIN, 1998).
O surfactante pulmonar, produzido principalmente nos pneumócitos tipo II dos alvéolos, é “empacotado” em estruturas chamadas corpos lamelares, cujo diâmetro é de 1 – 5 µm, semelhante ao das plaquetas. Os corpos lamelares servem, aparentemente, de reservatórios intracelulares, que vão sendo secretados para a superfície alveolar por exocitose. Acredita-se que o estiramento do alvéolo pela insuflação de ar pode ser estímulo fisiológico relevante para secreção dessas organelas. Uma vez fora da célula, os corpos lamelares desenrolam-se para tomar a forma de mielina tubular, responsável pela diminuição da tensão superficial dos alvéolos (STEIBEL, 2008).
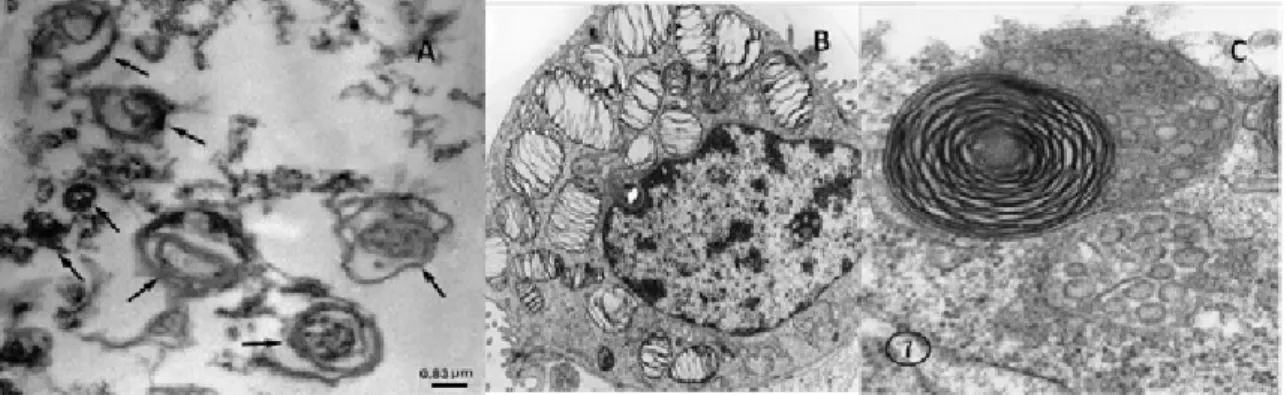
FIGURA 1 – A) Microscopia eletrônica evidenciando corpo lamelar em líquido oriundo da espécie equina medindo 0,83 µm, (CASTAGNETTI, 2007); B) Microscopia eletrônica de corpo lamelar humano (WONG et al.,1998); C) Microscopia eletrônica evidenciando corpo lamelar de rato (STAHLMAN, et al., 2000).
2.5 Análises Hematológicas dos neonatos 2.5.1 Glicemia
sistemas, além da adaptação nutricional decorrente da ruptura do cordão umbilical no parto e interrupção do transporte de nutrientes materno-fetal. Portanto, a necessidade energética para suportar a termorregulação, respiração e atividade muscular, encontra-se aumentada.
A glicose sanguínea, um dos substratos energéticos primários disponíveis ao ruminante neonato, é baixa no recém-nascido até a primeira ingestão de colostro (YANAKA et. al.,2012).
Os teores de glicose em bezerros logo ao nascimento, na ausência da ingestão de colostro, estão relacionados ao metabolismo hepático e de glicogênio muscular, os quais respondem principalmente à ação de catecolaminas, como a noradrenalina e adrenalina (CHAN et.al., 1993).
A maioria dos neonatos debilitados também são hipoglicêmicos, principalmente devido à depleção dos estoques de glicogênio e imaturidade hepática (MACINTIRE, 1999). Salhab et. al. (2004) observaram que a hipoglicemia é um fator de risco adicional à injúria cerebral, principalmente em neonatos deprimidos por hipóxia, isquemia e asfixia, ou submetidos à manobras de ressuscitação. Assim sendo, a determinação da glicemia, torna-se estorna-sencial na neonatologia veterinária, podendo auxiliar no tratamento suporte do neonato.
2.5.2 Lactato
A mensuração da concentração de lactato é uma técnica minimamente invasiva que pode ser realizada com amostras de sangue venoso (McMICHAEL et al., 2005).
Em humanos, os níveis de lactato têm se mostrado uma ferramenta útil para diagnóstico, monitoração e prognóstico de uma ampla gama de síndromes clínicas (BUENO et al., 2012).
Segundo Koliski et al. (2005), em estudo sobre a utilização de lactato sérico como marcador prognóstico em crianças gravemente doentes, na maioria dos pacientes com concentrações de lactato acima de 2mmol/L evidenciou sinais clínicos de hipoperfusão. A normalização ou diminuição da concentração, a partir de 24 horas de internação, esteve significativamente relacionada com a maior probabilidade de sobrevivência (BARROSO et. al.,2006).
2.5.3 Hemogasometria
Durante a fase gestacional, e durante o nascimento, o animal está sujeito a baixo suprimento de oxigênio. Os neonatos saudáveis sofrem de acidose discreta, sendo que os animais nascidos de partos laboriosos apresentam, invariavelmente, níveis significativamente mais baixos de pH sanguíneo (GARDINER, 1980; WILSON et al., 1976).
acúmulo, à produção de ácido carbônico e, consequentemente, à diminuição do pH (PICCIONE et al., 2006).
Para combater os desequilíbrios ácido-básicos o organismo se utiliza de três mecanismos principais, a saber: tamponamento químico pelo bicarbonato, ajuste respiratório e excreção de íons hidrogênio pelos rins. Os sistemas tampões e respiratório atuam em poucos minutos, ao contrário dos rins, que respondem mais tardiamente ao excesso de ácido ou de base (GUYTON; HALL, 2006; HOUPT, 2006).
Em bezerros é descrito que os desequilíbrios ácido-básicos fisiológicos, presentes logo após o nascimento, são solucionados em torno de duas horas no caso da acidose respiratória e em torno de 24 a 48 horas para a acidose metabólica (VARGA et al., 1998; UYSTEPRUYST, 2006).
Tal condição pode ser devida à reversão fisiológica da acidemia sofrida durante o parto, em virtude do início da atividade respiratória e do mecanismo de filtração renal, obedecendo ao novo padrão circulatório e respiratório estabelecido pelo organismo (BENESI, 1993; HASKINS, 1977).
Em bezerros recém-nascidos observou-se a influência etária nos valores hemogasométricos e do balanço ácido-básico em suas primeiras 24 horas de vida, tanto no sangue venoso quanto no arterial (VARGA et al., 1998; LISBÔA et al., 2002; GASPARELLI, 2007).
Yanaka (2009) observou que caprinos recém-nascidos possuíam valores mais baixos de pH sanguíneo, e valores de pCO2 aumentados, caracterizando,
assim, acidose respiratória. Entretanto, às 48 horas de vida, estes valores apresentavam-se normalizados. Camargo (2010) descreveu a ocorrência de discreta acidose, para os cabritos nascidos de partos normais, e de acidose mais severa para os nascidos de cesarianas, os quais, às 24 horas de vida, já se encontravam bem próximos aos valores de referência.
fisiológicos que alteram a resposta da paciente e do feto em relação aos anestésicos (MASSONE, 2008).
Os agentes anestésicos que afetam o sistema nervoso central materno produzirão os mesmos efeitos no feto, que são caracterizados, geralmente, por depressão e viabilidade diminuída (RAFFE; CARPENTER, 2007). A oxigenação uterina é diretamente proporcional à pressão de perfusão e indiretamente proporcional à resistência vascular uterina, ou seja, como na gestante anestesiada há diminuição na circulação uterina, pode haver redução na viabilidade fetal (GAIDO, 1997).
2.5.4 Hemograma
A avaliação hematológica neonatal representa um recurso diagnóstico de grande valia. Mohri et al. (2007) afirmam haver relação entre à disponibilidade de ferro para os neonatos e à concentração de hemoglobina e o hematócrito. A hemoglobina fetal tende a desaparecer e ser substituída pela adulta logo ao nascimento. Os eritrócitos adultos são de menor tamanho e necessitam de menores quantidades de hemoglobina, sem necessariamente relacionar-se aos níveis sanguíneos de ferro.
No período neonatal, o recém-nascido está mais susceptível às doenças (RADOSTITIS, 2002) e a mortalidade de neonatos constitui um relevante problema na criação da espécie ovina (CHRISTLEY et al., 2003) sendo importante, portanto, a realização dos estudos que auxiliem a compreensão dos mecanismos fisiológicos e esclareçam as causas das afecções para minimizar os prejuízos. Dentre os processos patológicos que comprometem a saúde dos pequenos ruminantes, destacam-se aqueles que, em sua evolução clínica, determinam o aparecimento de quadros de anemia (KANEKO; MILLES, 1970).
de avaliação de diagnóstico e prognóstico de enfermidades (GAMA et al., 2008). Neste estudo, foram utilizados os valores de referência de acordo Jain (1993) e Meyer (1995).
2.6 Objetivos 2.6.1 Objetivo geral
Avaliar a maturidade pulmonar de cordeiros nascidos a termo e prematuros, pela análise do líquido amniótico, por meio de citologia, do teste de Clements e contagem de corpos lamelares.
2.6.2 Objetivos específicos
● Determinar, avaliar e comparar a vitalidade, a coloração de mucosas, a temperatura retal, a frequência cardíaca e função respiratória (frequência e padrão respiratório) de cordeiros nascidos a termo e prematuros, ao longo das 48 horas de vida;
● Determinar, avaliar e comparar os valores do hemograma completo, incluindo volume globular (VG) e hemoglobina (Hb), ao longo das 48 horas de vida;
● Determinar, avaliar e comparar os valores de pH, PCO2, HCO3 e BE
de amostras de sangue venoso de cordeiros nascidos a termo e prematuros, ao longo das 48 horas de vida;
●Determinar, avaliar e comparar os níveis séricos de glicose e lactato em cordeiros nascidos a termo e prematuros, ao longo das 48 horas de vida;
●Determinar, avaliar e comparar as taxas de morbimortalidade de
●Determinar e avaliar a utilização dos testes de Clements, contagem de corpos lamelares e as características citologias, visando à avaliação da maturidade pulmonar em cordeiros prematuros e a termo.
3 MATERIAL E MÉTODOS
3.1 Característica dos animais e grupos experimentais
Para atingir os objetivos propostos, foram utilizados, no total, 56 animais (24 ovelhas e 32 cordeiros) da espécie ovina, mestiços de Suffolk, provenientes de rebanho da região de Araçatuba/SP, distribuídos em três Grupos experimentais, a saber:
GRUPOS ANIMAISANIMAIS
GRUPO I
Constituído por oito ovelhas, com gestação em torno de 145 dias, e por 10 cordeiros nascidos de partos normais.
GRUPO II
Composto por oito ovelhas, com 138 dias de gestação, e por oito cordeiros nascidos de cesarianas.
GRUPO III
Constituído por oito ovelhas com 138 dias de gestação e que receberam 16mg/ovelha de dexametasona1, por via intramuscular, 36 horas antes da cirurgia eletiva, e por 11 cordeiros.
3.2 Instalações e Manejo
Os animais foram mantidos a pasto e suplementados com silagem e ração comercial, indicada para a espécie ovina. Próximo à data prevista do parto e/ou da realização da cesariana, transferiu-se os animais para a baia, para facilitar a observação do parto. As ovelhas pertencentes ao grupo I foram monitoradas durante as 24 horas do dia, para que houvesse adequado acompanhamento, caso entrassem em trabalho de parto.
A fim de concentrar as parições e facilitar o manejo, adotou-se um protocolo de sincronização de estro com esponjas vaginais de progesteronab, seguidas da administração de 0,4 mL de prostaglandina (PGF2α) via intramuscular no dia zero (D0), e, no sétimo dia (D7), aplicou-se 5.000 UI de gonadotrofina coriônica equina (ECG)c e 0,4 mL de prostaglandinad por via intramuscular. O carneiro utilizado como reprodutor era marcado na região peitoral com tinta a cada 36 horas, sendo a sua cor alterada a intervalos de 15 dias. Com as datas de cobertura das ovelhas conhecidas, realizou-se exame ultrassonográfico (DP 2200 Vet, Mindray) abdominal para confirmação da gestação entre 45 e 60 dias após a última data de cobertura.
3.3 Anestesia e procedimento cirúrgico
Para o procedimento anestésico adotado nas cirurgias cesarianas empregou-se a anestesia local com bloqueio paravertebral proximal nos ramos nervosos das vértebras T13, L1 e L2, utilizando-se cloridrato de lidocaína (Xylestesin® 2%, Cristália), no volume de 5 mL em cada ponto dorsal e ventral aos processos transversos. Associou-se à anestesia peridural lombossacra (L6- S1), sulfato de morfina (Dimorf®, Cristália) na dose de 0,1 mg/kg diluída em 5 mL de solução fisiológica. Nos casos em que a anestesia paravertebral não foi eficiente, realizou-se bloqueio infiltrativo no local da incisão com cloridrato de lidocaína. Após a retirada do feto, quando necessário, as ovelhas recebiam sedação com maleato de midazolam (Dormonid®, Roche) na dose de 0,2 mg/kg. O procedimento cirúrgico foi feito com as ovelhas colocadas em decúbito lateral direito, para incisão em região do flanco esquerdo, conforme técnica descrita por Tibary e Van Metre (2004).
3.4 Colheita e preparação das amostras de líquido amniótico
permanecia na mesa cirúrgica onde realizava-se a incisão em região do flanco esquerdo. O útero era localizado e exteriorizado, verificando-se a melhor região para a realização da incisão uterina, a fim de se evitar hemorragia excessiva e a contaminação da amostra com sangue. Após a exposição placentária rompia-se delicadamente a membrana corioalantóideana e amniótica, e com uma seringa de 20 mL e agulha 40x12 retirava-se a maior quantidade de LA possível. Nas ovelhas que pariram normalmente (Grupo I), o método de colheita do LA era feito após a expulsão da bolsa amniótica; caso a mesma permanecesse intacta, colhia-se com a utilização de uma agulha 40x12 acoplada a uma seringa de 20 mL. Caso rompesse, o mesmo era obtido por meio da colocação de um tubo “falcon” apoiado à vulva da fêmea.
FIGURA 2- A) Obtenção do LA do grupo I (Parto normal), B) evidenciando a colheita do fluído amniótico pelo método de escoamento durante as contrações uterinas para o interior do tubo e/ou seringa descartável (20 mL), apoiando-se à vulva da fêmea.
3.5 Avaliação do líquido amniótico
O LA foi avaliado em sua totalidade, incluindo os testes para avaliação da maturidade fetal e pulmonar propostos neste trabalho (Teste de Clements, contagem de corpos lamelares e citologia com azul de Nilo a 0,1 %), bem como a avaliação macroscópica (aspecto, viscosidade, coloração, volume e possíveis contaminações), além de sua morfologia celular. Além da técnica de azul de Nilo, realizou-se, concomitantemente, o método de Hematoxilina– Shorr, utilizada por Moya (2005), como método alternativo. Da mesma forma, realizou-se, além do teste de Clements et al (1972), o teste modificado como sugerido por Barreto (2006). Todos os dados obtidos foram anotados em fichas individuais (Figura 5).
3.5.1 Método citológico - Coloração de azul de Nilo a 0,1%
Uma gota (50uL) de LA foi colocada sobre uma lâmina de vidro e diluída em uma gota (50uL) de corante Azul de Nilo a 0,1%. Posteriormente, esta lâmina era coberta por uma lamínula (Figura 5) e observada à microscopia óptica com objetiva de 40 vezes, para facilitar a visualização do campo para a contagem, e em outra objetiva de 100 vezes, para evidenciar as nuances celulares. As porcentagens de células orangeofílicas (alaranjadas) foram relacionadas com às cianofílicas (azuladas). A observação de proporção superior a 10% foi considerada significativa para a maturidade fetal.
3.5.2 Método citológico : coloração de Hematoxilina-Shorr
Nos casos em que a amostra era acompanhada pela presença de muco, procedia-se nova centrifugação a 3.000 rpm por três minutos, para que não ocorresse lise das células. Posteriormente, era submetida à citocentrífugação. As amostras que não tinham muco eram imediatamente citocentrifugadas. Após a secagem da lâmina, procedia-se a coloração de Hematoxilina-Shorr. Moya (2005) relatou que devido à pequena quantidade de células nos fluídos fetais, as amostras necessitavam de nova centrifugação a 4000 rpm, durante seis minutos. Porém, o tempo de seis minutos foi mantido neste trabalho, mesmo realizando-se a centrifugação a 1000 rpm, já que tal velocidade mostrou-se adequada para a separação celular. As lâminas passaram por 19 fases de coloração, seguindo as recomendações de Oliveira, et.al. (2000).
3.5.3 Teste de Clements
Clements et al. (1972) propuseram a prova com cinco diluições diferentes de LA (Quadro 1) em tubos de vidro de 14x100 mm, quimicamente limpos com éter e previamente numerados, nos quais eram distribuídos os
volumes de LA, solução salina a 0,9% (SF) e etanol a 95% (E). Os tubos,
QUADRO 1. Diluições utilizadas para a realização do teste de Clements et al.
(1972).
1°. Tubo 1,0 mL LA + 1,0 mL Etanol 95%
2°. Tubo 0,75 mL LA + 0,25 mL SF + 1,0 mL Etanol 95%
3°. Tubo 0,50 mL LA + 0,5 mL SF + 1,0 mL Etanol 95%
4°. Tubo 0,25 mL LA + 0,75 mL SF + 1,0 mL Etanol 95%
5°. Tubo 0,20 mL LA + 0,8 mL SF + 1,0 mL Etanol 95%
Caso ocorressem problemas, como os verificados por Barreto (2006), que ao realizar a técnica proposta por Clements não se constatou halo de espuma em nenhum dos tubos, optava-se pela não diluição das amostras com solução fisiológica (teste de Clements modificado) conforme realizado por Barreto (2006).
3.5.4 Teste de Clements modificado por Barreto (2006)
O teste de Clements modificado por Barreto (2006) tem como base a reação de saponificação dos surfactantes presentes. Realizaram-se diluições gradativas dos fluídos com etanol a 95%, observando-se possíveis halos de espuma nos tubos de ensaio. O halo recebeu valores de 0 a 4 de acordo com a sua intensidade. Optou-se pela exclusão da diluição com um (1) mL de solução fisiológica como preconiza o teste, pois não propiciou a formação de bolha. Excluiu-se, também, a maior (1mL) e menor (0,5 mL) diluições, em virtude do volume colhido (BARRETO, 2006).
QUADRO 2- Teste de Clements modificado, proposto por Barreto (2006).
3.5.5 Contagem de corpos lamelares
A contagem de CCL foi realizada no canal de plaquetas em analisadores
hematológicos, necessitando-se de 0,5 mL de LA por amostra. O equipamento
era calibrado com os parâmetros utilizados para a contagem de plaquetas entre
25 a 35 fL ovinos. As amostras foram filtradas, colocadas em tubos medindo 12
x 75 mm, sendo o sobrenadante testado por meio de sistema automatizado
Coulter STKS®, no canal de plaquetas, por medida volumétrica e por meio da
distribuição de tamanho, comparando-se a curva logarítmica (tecnologia de
fluxo de arraste (FAKHOURY et al., 1994; LEWIS et al., 1999; CARRILLO et
al., 1997).Caso a técnica proposta não se mostrasse satisfatória, uma alíquota
de LA (com 2 mL, aproximadamente) de cada amostra era encaminhada ao Laboratório de Microscopia Eletrônica (Biocell) da Universidade Estadual Paulista – USP de Ribeirão Preto, para processamento e posterior análise por meio da microscopia eletrônica (MET JEOL JEM 100 CX II), com intuito de se avaliar a presença de corpos lamelares.
3.6 Avaliação dos recém-nascidos
Com o objetivo de estudar as alterações dos parâmetros vitais e das características cardiorrespiratórias de cordeiros nascidos a termo e prematuros, todos os animais dos diferentes grupos foram submetidos à aferição da temperatura retal, frequência cardíaca, frequência respiratória e à avaliação das características respiratórias, ao nascimento, aos 15 e 60 minutos, bem como às seis, 12, 24 e 48 horas de vida.
imperceptível; um - lenta e irregular; dois – rítmica e profundidade normal); e d) coloração das mucosas visíveis (zero – branco-azulada; um – azul e dois – róseo-avermelhada), com pontuação interpretada da seguinte forma: sete a oito representam boa vitalidade; quatro a seis caracterizam animal com moderada vitalidade, e pontuação entre zero a três é sugestiva de que o recém-nascido encontra-se com baixa vitalidade (deprimido).
Os cuidados referentes à manutenção de temperatura e suporte ventilatório, quando do desenvolvimento de hipotermia e hipóxia, foram feitos mantendo os neonatos em incubadora apropriada e ventilação com auxílio de ambu, respectivamente. Outros procedimentos terapêuticos eram realizados, caso houvesse necessidade, levando-se em consideração a manifestação clínicaapresentada (hipoglicemia, hipovolemia), na tentativa de mantê-los vivos e saudáveis ao longo das avaliações.
3.6.1 Colheitas e preparação de amostras de sangue
3.6.1.1 Determinação da glicemia e do lactato
As mensurações da glicemia e da concentração plasmática de lactato foram realizadas imediatamente após a colheita de sangue em cada momento, em glicosímetro (One Touch Ultra II®, Johnson & Johnson) e lactímetro (Accutrend Plus®, Roche), respectivamente, seguindo-se as recomendações dos fabricantes.
3.6.1.2 Hemogasometria
Para a realização da colheita foram utilizadas seringas de plástico2, contendo heparina lítio cálcio (80 UI de heparina), para volume de 1,6 mL, acoplada à agulha hipodérmica 25 x 0,7 mm. Quando presentes, o ar residual e as bolhas foram desprezados, e as seringas mantidas seladas e armazenadas em recipiente térmico contendo água e gelo reciclável, até o seu processamento, sem contato direto, sendo as amostras processadas, invariavelmente, em até 15 minutos após a colheita, como recomendado por Lisboa et al. (2002). Efetuou-se a determinação dos valores de pH, pressão parcial de gás carbônico (pCO2), bicarbonato (HCO3) e excesso/déficit de
base (BE) em analisador clínico eletrônico portátil (i-Stat® Portable Clinical Analyzer), utilizando-se cartuchos específicos (EG7+ Cartridge) de acordo com as recomendações do fabricante, sendo calibrado automaticamente antes do processamento das amostras. Adicionalmente, como controle de qualidade, foi utilizado o simulador eletrônico (i-Stat® Electronic Simulator) para verificar o funcionamento correto do equipamento antes do processamento. Os valores de pH e pCO2 foram ajustados pelo aparelho, de
acordo com a temperatura retal de cada animal, aferida com termômetro clínico digital.
3.6.1.3 Hemograma
Amostras de sangue venoso foram colhidas logo após o nascimento (M0h), aos 15 minutos (M15min), aos 60 minutos (M60min), às 24 horas (M24h) e às 48 horas de vida (M48h). Para a colheita das amostras de sangue realizou-se assepsia local, seguida por punção da veia jugular, utilizando-se agulhas 25 x 0,7 mm acopladas a tubos com anticoagulante ácido etilenodiamino tetracético3 (EDTA), para volume de cinco (5) mL, e tubos siliconizados sem anticoagulante4, para volume de 10 mL. O sangue recolhido para obtenção do soro era mantido em temperatura ambiente, ao abrigo da luz, até a coagulação e retração do coágulo. Em seguida, centrifugado a 3.000 r.p.m., durante cinco minutos, para melhor separação do soro, sendo, então, transferido para eppendorfs apropriados, divididos em três alíquotas, e congelado imediatamente a -20o C, até o momento do seu processamento. O teor de hemoglobina foi mensurado em espectrofotômetro semiautomático (Labquest, Labtest, Belo Horizonte, Minas Gerais), empregando-se o reativo comercial de cianometahemoglobina. O volume globular foi obtido com a utilização de tubos capilares e centrífuga para microhematócrito, sendo as amostras de sangue com EDTA centrifugadas a 13.000 x G, durante cinco minutos.
A concentração plasmática de proteína total foi determinada utilizando-se refratômetro clínico (Master-SUR/NM, ATAGO, Tóquio, Japão) e o teor plasmático de fibrinogênio realizado pelo método de precipitação pelo calor com posterior leitura em refratômetro (MILLAR et al., 1971).
Alemanha). Para cada amostra colhida preparou-se esfregaço sanguíneo corado, para a contagem de 100 células, com corante Panótico Rápido (LaborClin) visando a contagem diferencial de leucócitos (GARCIA-NAVARRO, 1994).
3.6.2 Exame Radiográfico
Realizou- se o exame radiográfico pulmonar no momento do nascimento dos cordeiros (M0), às 24 e às 48 horas de vida (M24 e M48), por meio do aparelho5 de Raio-X fixo, posicionando-se os animais em decúbito látero-lateral.
3.7 Análise Estatística
Os dados foram submetidos à análise de variância com medidas repetidas, por meio do procedimento MIXED do SAS (Statistical Analysis Sistem) e estrutura de covariância utilizada definida pelo critério de informação de Akaike. As comparações múltiplas das médias foram realizadas com o LSMEANS (Least Squares Means), ajustado para Tukey. Os valores das variáveis (tabelas com as medianas) foram analisados usando o teste de Kruskal Wallis para comparar os grupos em cada momento e teste de Friedman para comparar os momentos para cada grupo, seguido do teste de comparações múltiplas de Dunn. Os valores das variáveis, coloração da mucosa e do Teste de Clements utilizando o líquido amniótico, foram analisados usando o teste exato de Fisher. O nível de significância adotado foi de 5%.
4 RESULTADOS E DISCUSSÃO
4.1 Análise do líquido amniótico
Por maturidade fetal entende-se que determinados órgãos fetais em determinada categoria gestacional apresentam grau de desenvolvimento funcional semelhante ao encontrado em recém-nascido nascidos a termo. (NEME, 1988). Na medicina humana muitas técnicas são empregadas para avaliação tanto da maturidade fetal quanto da maturidade pulmonar, porém, na medicina veterinária, algumas técnicas utilizadas em humanos e denominadas como técnicas “padrão ouro”, são muito caras e difíceis de serem realizadas na rotina clínica.
Na literatura são poucos os trabalhos desenvolvidos com a análise do LA e sua relação com a maturidade fetal e pulmonar em ovinos. Portanto, a maioria dos trabalhos propostos é baseada em trabalhos feitos em humanos.
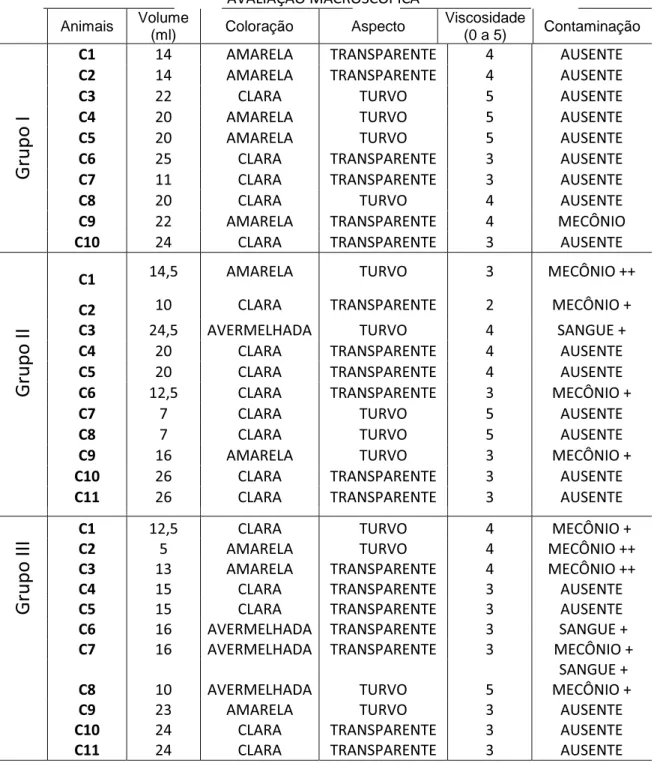
O LA é considerado como produto oriundo de secreções das paredes ou folhetos amnióticos, bem como pela saliva, secreção do trato respiratório do feto e, temporariamente, pela urina. Considerando que esse líquido envolve diretamente o feto, nele pode ser encontrado pêlos, células epiteliais, restos de escamações cutâneas e, em casos de sofrimento fetal, mecônio. (PRESTES, 2012). Portanto, antes de se realizar as análises para avaliação da maturidade fetal e pulmonar, foi preciso observar macroscopicamente o aspecto deste fluído amniótico após a colheita. Ressalta-se, que, por serem as ovelhas também submetidas à cesariana, existia a possibilidade de ocorrer sangramento e contaminação das amostras com sangue. As características macroscópicas verificadas no LA dos animais dos grupos I (Parto Normal), II (Cesárea) e III (Cesárea + Dexa) estão dispostas na Tabela 1. A classificação utilizada, no presente trabalho, para a avaliação macroscópica do LA foi:
Coloração: CLARA (C), AMARELA (A) e VERMELHA (V); Aspecto: TURVO
Tabela 1- Dados individuais das características do LA pertencente aos grupos
I (Parto Normal), II (Cesárea) e III (Cesárea + Dexametasona). Araçatuba- SP, 2014.
De maneira geral, o mínimo de 20 mL e o máximo de 40 mL de LA foi colhido das ovelhas que compuseram os diferentes grupos. As amostras de
AVALIAÇÃO MACROSCÓPICA
Animais Volume
(ml) Coloração Aspecto
Viscosidade
(0 a 5) Contaminação
Grupo I
C1 14 AMARELA TRANSPARENTE 4 AUSENTE C2 14 AMARELA TRANSPARENTE 4 AUSENTE
C3 22 CLARA TURVO 5 AUSENTE
C4 20 AMARELA TURVO 5 AUSENTE
C5 20 AMARELA TURVO 5 AUSENTE
C6 25 CLARA TRANSPARENTE 3 AUSENTE C7 11 CLARA TRANSPARENTE 3 AUSENTE
C8 20 CLARA TURVO 4 AUSENTE
C9 22 AMARELA TRANSPARENTE 4 MECÔNIO C10 24 CLARA TRANSPARENTE 3 AUSENTE
C1 14,5 AMARELA TURVO 3 MECÔNIO ++ C2 10 CLARA TRANSPARENTE 2 MECÔNIO +
Grupo II
C3 24,5 AVERMELHADA TURVO 4 SANGUE + C4 20 CLARA TRANSPARENTE 4 AUSENTE C5 20 CLARA TRANSPARENTE 4 AUSENTE C6 12,5 CLARA TRANSPARENTE 3 MECÔNIO +
C7 7 CLARA TURVO 5 AUSENTE
C8 7 CLARA TURVO 5 AUSENTE
C9 16 AMARELA TURVO 3 MECÔNIO +
C10 26 CLARA TRANSPARENTE 3 AUSENTE C11 26 CLARA TRANSPARENTE 3 AUSENTE
Grupo III
C1 12,5 CLARA TURVO 4 MECÔNIO +
C2 5 AMARELA TURVO 4 MECÔNIO ++
C3 13 AMARELA TRANSPARENTE 4 MECÔNIO ++ C4 15 CLARA TRANSPARENTE 3 AUSENTE C5 15 CLARA TRANSPARENTE 3 AUSENTE C6 16 AVERMELHADA TRANSPARENTE 3 SANGUE + C7 16 AVERMELHADA TRANSPARENTE 3 MECÔNIO + C8 10 AVERMELHADA TURVO 5
SANGUE + MECÔNIO +
C9 23 AMARELA TURVO 3 AUSENTE
líquido amniótico das ovelhas do grupo I apresentaram menor contaminação e maior viscosidade quando comparadas às dos outros grupos (II e III). Naquelas obtidas do grupo III constatou-se maior contaminação, principalmente por mecônio, quando comparado aos dois grupos restantes (I e II).
4.1.1 Método citológico – Coloração de azul de Nilo 0,1%
amniótico de cordeiros oriundos de cirurgia eletiva sem a indução por este fármaco.
Tabela 2 – Medianas (Md), mínimo e máximo das porcentagens de células cianofílicas (células azuis) e orangeofílicas (células alaranjadas) encontradas no líquido amniótico, utilizando a técnica de Azul de Nilo (0,1%), de ovelhas oriundas de parto normal( Grupo I), cesariana (Grupo II) e cesariana + dexametasona(Grupo III) – Araçatuba, SP – 2013.
Citologia Azul de Nilo
NORMAL CESARIANA CESARIANA +
DEXAMETASONA
n Md Min - Max n Md Min - Max n Md Min - Max
Cianofílicas 10 96,1 A 84,0 - 98,0 11 90,5 AB 73,0 - 96,3 11 87,0 B 80,8 - 96,9
Orangeofílicas 10 4,0 A 2,0 - 16,0 11 9,5 AB 3,7 - 27,0 11 13,0 B 3,1 - 19,3
A,
Medianas seguidas de letras diferentes na linha, diferem entre si pelo teste de Dunn (p < 0,05).
Tabela 3 – Medianas (Md), mínimo e máximo das porcentagens da morfologia celular encontrada no líquido amniótico, coradas pela técnica de Azul de Nilo (0,1%), classificadas de acordo com Moya ( 2005), como: CIP(Células Intermediárias pequenas), CIG ( Células Intermediárias Grandes), CSN (Células superficiais nucleadas e CSA (Células Superficiais Anucleadas) de cordeiros pertencentes aos grupos de parto normal (Grupo I), cesariana (Grupo II) e cesariana + dexametasona (Grupo III) – Araçatuba, SP – 2014.
Morfologia celular Azul
de Nilo
NORMAL CESARIANA CESARIANA +
DEXAMETASONA
n Md Min-Max n Md Min-Max n Md Min-Max
CIP % 5 3,8 AB 2,0 - 7,9 11 12,0 A 0,0 - 43,0 11 3,1 B 0,0 - 11,2
CIG % 4 2,0 AB 1,4 - 3,0 11 6,0 A 0,0 - 14,1 11 1,5 B 0,0 - 5,1
CSN % 10 19,3 8,0 - 76,0 11 33,3 2,5 - 69,4 11 34,0 14,5 - 81,3
CSA % 10 79,8 19,0 - 92,0 11 40,5 23,1 - 74,6 11 59,7 12,0 -84,1
A,
Medianas seguidas de letras diferentes na linha, diferem entre si pelo teste de Dunn (p < 0,05).
Observando-se os resultados, ressalta-se, na Tabela 3, que as variáveis CIP (Célula Intermediária Pequena) e CIG (Células Intermediária Grande), diferiram entre os grupos II (Cesariana) e III (Cesariana+Dexametasona), porém, com relação as CSN (Células Superficiais Nucleadas) e CSA (Células Superficiais Anucleadas) não se denotou o mesmo comportamento entre os diferentes grupos (I, II e III).
Visualizou-se (Tabela 3), também, maior quantidade de células superficiais, chegando ao máximo de 92% para o grupo I (Parto Normal), de 74,6% para o grupo II (Cesariana) e de 84,1% no grupo III (Cesariana+Dexametasona).
que afirmou que a realização da técnica de coloração azul de Nilo visando à avaliação da maturidade fetal não apresenta resultados satisfatórios.
Desta forma, devido aos resultados insatisfatórios obtidos na presente pesquisa, propôs-se realizar-se, concomitantemente, a citologia de Hematoxilina–Shorr, proposta por Moya (2005), para avaliação e comparação dos resultados obtidos entre ambas as técnicas, apesar de não fazer parte do delineamento experimental inicial deste trabalho.
FIGURA 7- Lâmina corada com Azul de Nilo a 0,1%, em aumento de 400
vezes/campo, evidenciando maior quantidade de células cianofílicas e superficiais nucleadas.
4.1.2 Método citológico – Coloração Hematoxilina Shorr
representando cerca de 50 a 95% da população celular encontrada no LA, com maiores valores verificados nos fetos mais velhos, servindo, desta forma, como indicadoras da idade fetal.
Tabela 4- Medianas (Md), mínimo e máximo das porcentagens de células
cianofílicas (células azuis) e orangeofílicas (células alaranjadas) encontradas no líquido amniótico,utilizando o método de Hematoxilina Shorr, de cordeiros pertencentes aos grupos de parto normal (Grupo I), cesariana (Grupo II) e cesariana + dexametasona
(Grupo III) – Araçatuba, SP – 2014.
Citologia Hematoxilina
Shoor
NORMAL CESARIANA CESARIANA +
DEXAMETASONA n Md Min - Max n Md Min - Max n Md Min - Max
Cianofílicas 10 21,0 A 8,0 - 42,7 11 40,0 AB 19,8 - 66,7 11 45,6 B 32,0 - 64,9
Orangeofílicas 10 79,0 A 57,3 - 92,0 11 60,0 AB 33,3 - 80,2 11 54,4 B 35,1 - 68,0
A,
Medianas seguidas de letras diferentes na linha, diferem entre si pelo teste de Dunn (p < 0,05).
Tabela 5 – Medianas (Md), mínimo e máximo das porcentagens da morfologia
celular encontrada no líquido amniótico, coradas pelo método Hematoxilina Shorr, classificadas de acordo com Moya (2005), de cordeiros pertencentes aos grupos de parto normal (Grupo I), cesariana (Grupo II) e cesariana + dexametasona (Grupo III) – Araçatuba, SP – 2014.
Morfologia coloração
de Shoor
NORMAL CESARIANA CESARIANA +
DEXAMETASONA
n Md Min-Max n Md Min-Max n Md Min-Max
CIP % 5 3,2 1,2 - 9,4 11 10,3 0,0 - 54,6 11 4,7 0,0 - 13,0
CIG % 4 4,4 3,2 - 4,4 11 1,5 0,0 - 13,3 11 1,9 0,0 - 7,3
CSN % 10 38,8 24,4 - 70,6 11 29,0 15,8 - 62,3 11 30,8 14,5 - 81,3
CSA % 10 55,8 27,9 - 74,4 11 62,7 16,4 - 71,0 11 61,5 12,0 - 84,1
CIP (Células Intermediárias pequenas), CIG (Células Intermediárias Grandes), CSN (Células superficiais nucleadas e CSA (Células Superficiais Anucleadas) A,Medianas seguidas de letras diferentes na linha, diferem entre si pelo teste de Dunn (p < 0,05).
considerado normal para a espécie em referência. Na tabela 5, foi possível verificar maior ocorrência de células superficiais anucleadas (CSA), atingindo os valores máximos no grupo I (Parto Normal) de 74,4. Nas amostras de LA dos animais do grupo II (Cesariana) constatou-se em torno de 71% no grupo III (Cesariana+ Dexametasona), chegando a equiparar-se com as células superficiais nucleadas (81,3).
Nos grupos II e III (Tabela 4), observou-se que quando a porcentagem das células orangeofílicas (maduras) diminuía, apresentando valor mínimo de 33,3%, a quantidade de células cianofílicas (imaturas) aumentava (valor máximo de 66,7%), resultados indicativos de imaturidade fetal. De forma semelhante, quando a porcentagem das células orangeofílicas aumentava (valor máximo de 92 %), a quantidade de cianofílicas diminuía (valor mínimo 42,7%), caracterizando a ocorrência de maturidade fetal.
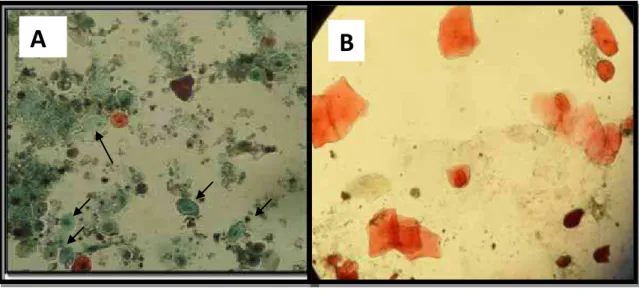
FIGURA 8 - A) Lâmina corada pelo método de Hematoxilina - Shorr pertencente ao Grupo II (Cesariana), em aumento de 400 vezes/campo, evidenciando maior quantidade de células cianofílicas (verde- azuladas),com relação às células orangeofílicas. B) Lâmina pertencente ao Grupo I (Parto Normal), em aumento de 400 vezes/campo, demonstrando maior presença de células orangeofílicas. Nesta figura a maior incidência são células superficiais anucleadas
4.1.3 Teste de Clements (1972)
Diante da prematuridade, o fator limitante à sobrevida do recém-nascido é, indubitavelmente, o sistema respiratório. Havendo a funcionalidade do pulmão fetal, o recém-nascido prematuro com assistência neonatal adequada terá boas possibilidades de sobreviver.
O teste de Clements é um método físico para determinar a presença de surfactante pulmonar no líquido amniótico. Descrito por Clements et al. (1972), o complexo surfactante diminui a tensão superficial da solução na qual se encontra diluído. Portanto, ao se acrescentar uma substância surfactante em qualquer líquido e agitá-lo, formar-se-ão bolhas na interface líquido-âmnio. As bolhas serão tão mais estáveis quanto maior a quantidade de substância surfactante existir na solução (NEME, 1988).
Com relação ao teste de Clements, foi possível observar que o LA de duas ovelhas do grupo I apresentava-se positivo, confirmando-se, contudo, a
presença de bolhas somente até o 1° tubo, e ausência nos demais, sem evidenciar, no entanto, sem diferenças estatísticas entre eles (Tabela 6).
Tabela 6 – Número (n) e porcentagem (%) do teste de Clements realizado com líquido amniótico, de cordeiros pertencentes aos grupos de parto normal (Grupo I), cesariana (Grupo II) e cesariana + dexametasona (Grupo III), sendo classificado como Positivo ( presença de bolhas) indicando maturidade pulmonar fetal e Negativo (ausência de bolhas), indicando imaturidade fetal – Araçatuba, SP – 2014.
TUBO
S LA Clements
GRUPO I GRUPO II GRUPO III
P(1)
n % n % n %
1° Positivo 2 20,0 1 9,1 4 36,4 0,3313
Negativo 8 80,0 10 90,9 7 63,6
2° Positivo - - 1 9,1 2 18,2 0,7560
Negativo 10 100,0 10 90,9 9 81,8
3° Positivo - - 1 9,1 - - 1,0000
Negativo 10 100,0 10 90,9 11 100,0
4° Negativo 10 100,0 11 100,0 11 100,0 -
5° Negativo 10 100,0 11 100,0 11 100,0 -
(1) teste exato de Fisher
Constatou-se presença de bolhas até o 3° tubo e ausência nos demais (4° e 5° tubos) no LA de um cordeiro pertencente ao grupo II. Todavia, os líquidos amnióticos obtidos de quatro cordeiros do grupo III (36,4% em um total de 11 animais) apresentavam-se com bolhas, porém os fluídos analisados de dois cordeiros demonstraram a presença de bolhas somente no 1° tubo e até o 2° tubo dos outros dois animais, com ausência de bolhas, entretanto, nos demais (3°, 4° e 5° tubos).
Como o fluído amniótico pertencente aos grupos II (Cesariana) e III (Cesariana + Dexametasona) refere-se ao de ovelhas que foram submetidas à cesariana aos 138 dias de gestação, os resultados negativos são compatíveis com as características de animais prematuros, que, sabidamente, têm menor quantidade de surfactante no líquido amniótico. O LA destes dois grupos (II e III) apresentou halo de bolhas. Contudo, observou-se bolhas até o 3° tubo, naqueles das ovelhas do grupo II (cesariana), como demonstrado na Figura 8, provavelmente pelo fato de seus rebentos possuírem maior maturidade fetal e pulmonar quando comparado aos demais cordeiros que obtiveram resultados negativos. No caso do grupo III (Cesariana + Dexametasona) o LA analisado de quatro ovelhas também apresentava bolhas. Acredita-se, neste caso, que a maior quantidade de LA com bolhas foi devido à administração de dexametasona, levando a maior maturação pulmonar em alguns dos cordeiros pertencentes a este grupo. Isto pode ser confirmado quando se associa o teste de Clements com o teste citológico de Hematoxilina-Shorr (Tabela 4), o qual demonstrou maiores índices de células orangeofílicas, e que também obteve classificação positiva ao teste de Clements, com resultados indicativos de maturidade fetal. O fato de as bolhas ocorrerem até o terceiro tubo é devido à quantidade decrescente de LA pipetada, levando-se a concluir, que, quanto maior o volume de LA, maior a possibilidade da presença de bolhas. A ocorrência, por exemplo, de bolhas no tubo de número cinco, por possuir menor quantidade de LA (0,20 mL) e maior diluição com solução fisiológica (0,80 mL) e etanol (1 mL), dever-se-ia ser interpretada como indicadora de maturidade pulmonar.
Neste estudo, esperava-se maior presença de halos de bolhas no LA de cordeiros pertencentes ao grupo I, o que não ocorreu. Fernandes et al. (2006) asseguraram que existe maturidade pulmonar fetal quando o teste for “maduro”, porém sua especificidade e seu valor preditivo positivo são baixos, o
FIGURA 9 – Teste de Clements do LAobtido do animal C3, pertencente ao grupo II (Prematuro) : A) observar a presença de halo de bolhas até o 3° tubo; B) imagem evidenciando a presença de bolhas nos três tubos.
Araçatuba –SP, 2014.
4.1.4 Teste de Clements modificado por Barreto (2006)
Não se observou a presença de halo de bolhas em qualquer LA obtido das ovelhas pertencentes aos diferentes grupos estudados, incluindo-se aqueles que se mostraram positivos ao teste de Clements (1972), o que impossibilitou a realização estatística prevista. Tal constatação demonstra que há a necessidade de se ajustar a diluição para melhor avaliação do LA de fêmeas da espécie ovina em futuros trabalhos que visem estudar o referido tema.
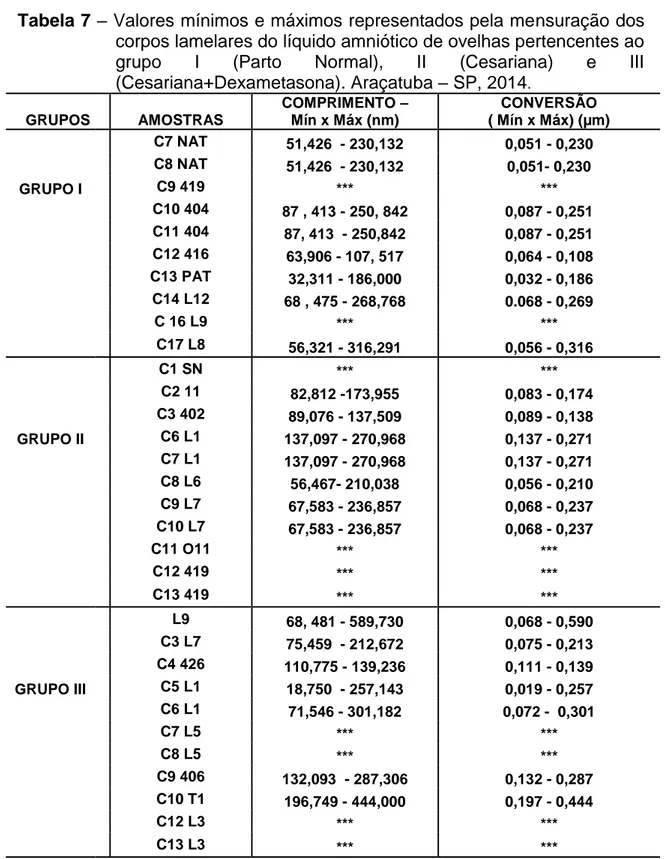
4.1.5 Contagem de corpos lamelares
A contagem de corpos lamelares (CCL), método originalmente descrito em 1989, vem ganhando destaque na literatura mundial devido a sua precisão, simplicidade e baixo custo. Diversos estudos indicam que a CCL tem desempenho igual ou superior aos testes tidos como preferenciais, com a vantagem de ser um método de baixo custo (FERNANDES et al., 2006).
lamelares podem ser facilmente quantificados por contadores hematológicos, habitualmente utilizados para a realização de hemogramas, sendo o número impresso obtido como correspondente ao total de plaquetas que deve ser considerado como a totalidade numérica de corpos lamelares.
Ao pesquisar trabalhos sobre a avaliação da maturidade pulmonar fetal pelo método de contagem de corpos lamelares presentes no líquido amniótico, foram encontrados somente trabalhos voltados para humanos e apenas um artigo da área veterinária direcionado à espécie equina.
Todavia, não foi possível a contagem de corpos lamelares na microscopia eletrônica, devido ao fato, de que, para visualizar estas estruturas no microscópio eletrônico, são processadas “grades” das diferentes amostras, e, dependendo do corte realizado, poucos corpos lamelares são encontrados. A ausência de material (Tabela 7) em algumas amostras dificultou a contagem. Apesar da impossibilidade da realização da contagem de corpos lamelares em microscopia eletrônica, foi possível mensurar estas estruturas através de um programa editor de imagem denominado Image J ® (Figura 9). Foram mensurados os corpos lamelares dos grupos I (Parto Normal), II (Cesariana) e III (Parto Normal), sendo os resultados representados pela unidade de medida em nm (nanometros), o que significa ser equivalente a um milionésimo de milímetros, ou seja bem menor quando comparada a um micrômetro (µm). Contudo, como nos trabalhos estudados as unidades de medidas descritas são sempre em µm (micrômetro), os resultados em nanometros foram convertidos em micrômetros (Tabela 7), com o objetivo de demonstrar o quão pequenas são estas estruturas pertencentes à espécie ovina, quando comparadas às pesquisas realizadas em humanos e neonatos equinos. Para a conversão das unidades de medidas foi utilizado um site de conversão de unidades, colocando os resultados em nanômetros, sendo, por fim, transformados em micrometros.