Maiara Barbosa Ferreira
Aplicação da oxidação eletroquímica no tratamento de efluentes
contendo corantes reativos utilizando Ti/Pt E Ti/Pt-SnSb
_______________________________________
Dissertação de Mestrado
Natal/RN, maio de 2015
Maiara Barbosa Ferreira
APLICAÇÃO DA OXIDAÇÃO ELETROQUÍMICA NO TRATAMENTO DE
EFLUENTES CONTENDO CORANTES REATIVOS UTILIZANDO Ti/Pt E
Ti/Pt-SnSb
Dissertação apresentada ao Programa da Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte como parte dos requisitos para a obtenção do título de Mestre em Química.
Orientador: Prof. Dr. Carlos Alberto Martinez Huitle
Co-orientador: Prof. Dr. José Heriberto Oliveira Nascimento
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Ferreira, Maiara Barbosa.
Aplicação da oxidação eletroquímica no tratamento de efluentes contendo corantes reativos utilizando Ti/Pt E Ti/Pt-SnSb/Maiara Barbosa Ferreira. – Natal, RN, 2015.
88 f. : il.
Orientador: Carlos Alberto Martinez Huitle. Co-orientador: José Heriberto Oliveira Nascimento
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Eletroquimica – Dissertação. 2. Elevada toxicidade – Dissertação. 3. Tratamento eletroquímico– Dissertação. 4. Corantes. Material – Dissertação. 5. eletrocatalítico – Dissertação. I. Huitle, Carlos Alberto Martinez. II. Nascimento, José Heriberto Oliveira. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
A Deus que representa todo o meu sustento e coragem para que eu pudesse enfrentar, de maneira digna todos os obstáculos durante esta minha caminhada.
A minha família por sempre acreditarem no meu sucesso e por não medirem esforços para que eu pudesse realizar meus sonhos. Mãe, seu cuidado e cumplicidade a coragem para seguir em frente. Pai, a sua serenidade sempre foi um espelho para minhas ações nesta difícil caminhada. Ao meu irmão Inhanduí, o meu Dudu, que é o meu parceiro para todas as horas.
Ao Prof. Dr. Carlos Alberto Martínez Huiltle, que no papel de orientador me transferiu de forma singular todos os conhecimentos necessários para a realização deste e muitos outros trabalhos. E, como amigo, sempre foi capaz de incentivar e estimular meu desenvolvimento acadêmico e pessoal.
Aos velhos e novos amigos do Laboratório de Eletroquímica Ambiental e Aplicada, por todos os momentos agradáveis e de companheirismo que partilhamos no nosso dia a dia. Em especial àquelas que se tornaram muito mais que amigas ao longo destes anos de trabalho por quem eu carrego um imenso carinho e gratidão: em especial à Jéssica Horacina, Chrystiane do Nascimento, Elaine Moura, Maria Maésia, Marina Avelino e Aline Sales. Agradeço também à Max e Lamark que me ajudaram no desenvolvimento de alguns experimentos.
Aos meus amigos Fábio de Melo, Paula Lopes, Yago Guimarães, Jullyani Queirós, Dennys Salvino, Raquel Azevedo, por todo o incentivo e compreensão necessários aos momentos de dedicação e evolução pessoal.
As minhas amigas de infância, Jayna Dionísio, Sarine Nobrega e Lorena Rosa agradeço por todos os momentos que estiveram me apoiando em silêncio, ou até mesmo com palavras certas que chegaram até mim como um combustível de amor.
Ao Laboratório de Processos Químicos Têxteis, em especial ao Prof. Dr. José Heriberto e aos alunos Felipe e Uala pelo fornecimento das amostras e conhecimentos necessários ao desenvolvimento deste trabalho.
Ao CNPQ pelo suporte financeiro concedido. E à indústria DeNora pelo fornecimento dos materiais anódicos.
RESUMO
Os efluentes têxteis são uma mistura complexa de muitos poluentes que contêm altas cargas orgânicas, cor intensa e compostos tóxicos. A elevada toxicidade do efluente pode ocasionar o aumento da demanda química (DQO) e bioquímica (DBO) de oxigênio, elevada temperatura, acidez ou alcalinidade, causando danos e problemas ambientais. Além de representar uma séria ameaça para a saúde humana este tipo de efluente também é bastante tóxico para a maioria dos organismos aquáticos. E por esta razão, devem-se cumprir os limites de concentração para fontes de emissão e sistema de esgoto. O presente estudo teve como objetivo investigar o desempenho do tratamento eletroquímico de um efluente têxtil para a remoção da cor e matéria orgânica dissolvida investigando a influência dos parâmetros experimentais, tais como o material eletrocatalítico (Ti/Pt e Ti/Pt- SnSb) e densidade de corrente, a fim de comparar a sua eficiência, consumo de energia e custo. O corante Novracon Blue CD (NB) foi empregado em solução sintética, enquanto que os corantes Remazol Yellow 3RS (RY 3RS), Remazol Red RR Gran (RR-RR Gran) e Navy Blue CL-R (NB CL-R) foram utilizados para geração de efluente têxtil proveniente de um tingimento denominada tricromia. Os resultados mostraram que a aplicação do processo de oxidação eletroquímica favorece a eliminação da cor de forma eficiente indepente do material eletrocatalítico e a corrente utilizada, bem como o efluente tratado. Entretanto, a influência do material eletrocatalítico na eficiência de redução da matéria orgânica foi determinante para o processo em todos os casos.
Palavras-chave: Elevada toxicidade. Tratamento eletroquímico. Corantes. Material
ABSTRACT
The textile effluents are a complex mixture of many pollutants that contain high organic loads, severe color and toxic compounds. The high concentration of the textile effluent may cause increased chemical demand (COD) and biochemical (BOD) of oxygen, elevated temperature, acidity or alkalinity, causing damage and environmental problems. In addition to representing a serious threat to human health such effluent is also quite toxic to most aquatic organisms. And for this reason, one must meet the concentration limits for emission sources and sewage system. This study aimed to investigate the performance of electrochemical treatment of a textile effluent for the removal of color, turbidity, dissolved oxygen (DO) and dissolved organic matter by investigating the influence of experimental parameters such as the electrocatalyst materials (Ti/Pt and Ti/Pt-SnSb) and current density in order to compare their efficiency, energy consumption and cost. The dye Novacron Blue CD (NB) was employed in synthetic solution, while the dyes Remazol Yellow 3RS (RY 3RS) Remazol Red RR Gran (RR-RR Gran) and Navy Blue CL-R (NB CL-R) were used to generate simulated textile effluent laboratory. The results showed that the application of electrochemical oxidation process favors the elimination of color effectively independent the electrocatalytic material and current used, as well as treated effluent. However, the influence of electrocatalytic material was crucial to reduction of the organic matter in all cases.
LISTA DE FIGURAS
Figura 2.1 - Distribuição da água doce no planeta... 15
Figura 2.2 - Estrutura química típica de um azo corante... 20
Figura 2.3 - Representação esquemática da oxidação eletroquímica de orgânicos sobre ânodos de óxidos metálicos (MOx), formando superóxidos
(MOx+1). descarga de H2O; formação do superóxido;
oxidação do composto orgânico e desprendimento de O2 ... 28
Figura 3.1 - Chemical structure of NB dye.....……… 41
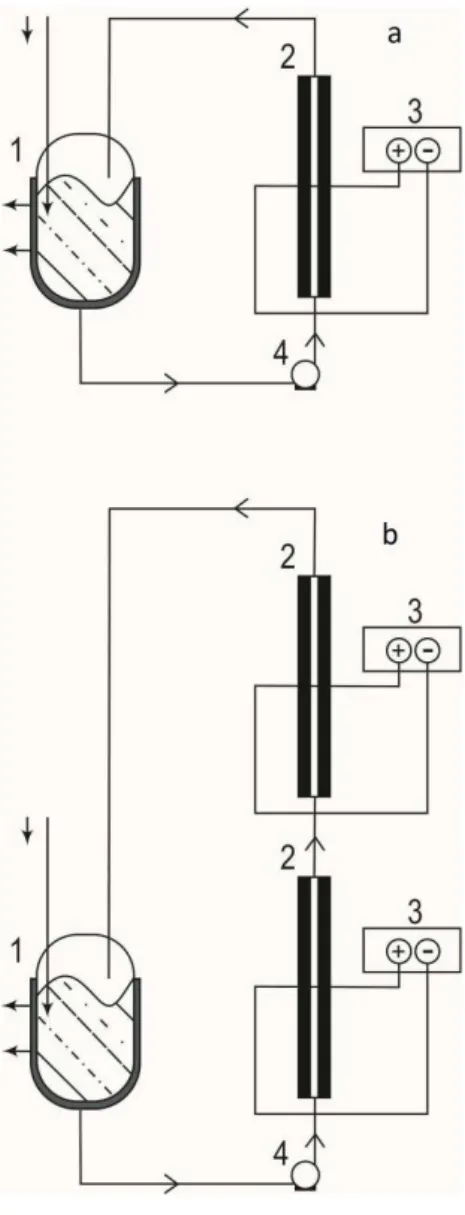
Figura 3.2 - Electrochemical flow cells configurations for the oxidation of dyes at Ti/Pt and Ti/Pt–SbSn anodes. a Setup used for SFCTi/Pt or
SFCTi/Pt–SbSn (1) thermoregulated reservoir; (2) electrochemical flow
cell; (3) power supply and (4) pump; and b Setup used for DFCTi/Pt+Ti/Pt–SbSn (1) thermoregulated reservoir; (2) electrochemical
flow cells (first: SFCTi/Pt and second: SFCTi/Pt–SbSn); (3) power
supply and (4) pump……… 43
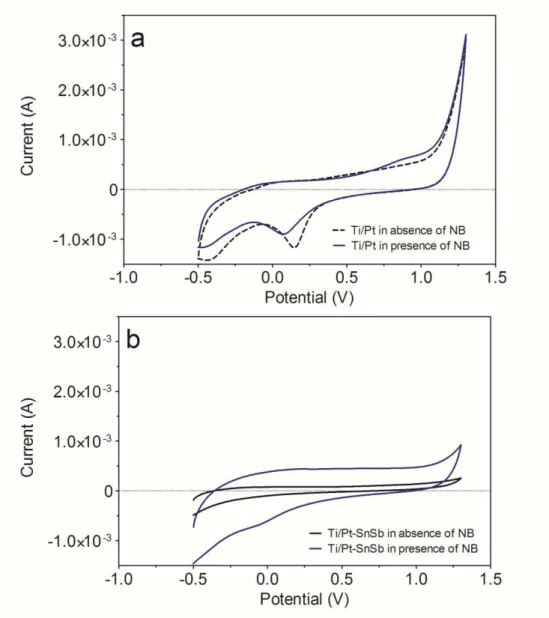
Figura 3.3 - Cyclic voltammograms recorded at (a) Ti/Pt and (b) Ti/Pt-SbSn in absence (Na2SO4 0.25 mol L−1) and in presence of NB dye in
solution. Scan rate = 50 mV s−1 and 250 mg L−1 of NB... 45
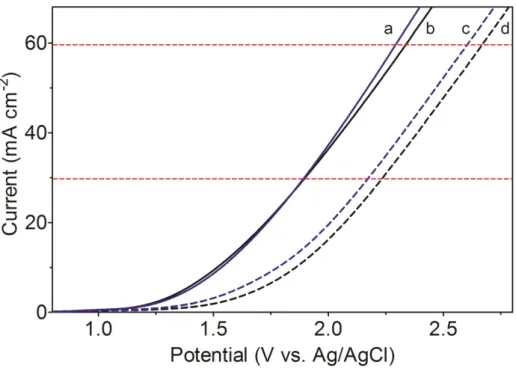
Figura 3.4 – Polarization curves obtained at Ti/Pt and Ti/Pt-SbSn in presence (curves a and c) and in absence (curves b and d (e.g.: Na2SO4 0.25
mol L−1)) of NB dye in solution. Scan rate = 10 mV s−1 and 250 mg
L−1 of NB……… 46
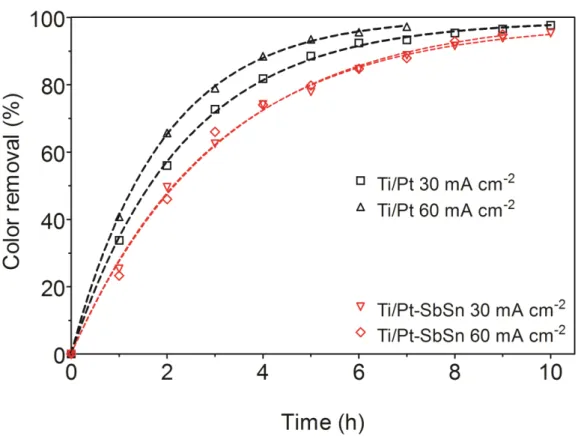
Figura 3.5 - Evolution with time of absorbance band for NB employing SFCTi/Pt: a 30 mA cm−2; b 60 mA cm−2; and SFCTi/Pt–SbSn: c 30 mA cm−2; d
60 mA cm−2, during anodic oxidation. Operating conditions: Electrolyte: 0.25 M Na2SO4... 48 Figura 3.6 - Effect of applied current density and electrocatalytic material on the
evolution of the percentage color removal, as a function of time, during degradation of NB using SFC systems……… 49
Figura 3.7 - Evolution with time of absorbance band for NB during degradation using DFCTi/Pt+Ti/Pt–SbSn: a NB (60+30 mA cm−2) and b NB (60+60
°C………... 51
Figura 3.8 - Effect of applied current density and electrocatalytic material on the evolution of the percentage color removal, as a function of time, during degradation of NB using DFC systems………... 52
Figura 3.9 - Comparison on the energy consumption for the EO of NB by using SFC or DFC systems. a: SFCTi/Pt (60 mA cm−2); SFCTi/Pt–SbSn (30
mA cm−2); DFCTi/Pt+Ti/Pt–SbSn (60+ 30 mA cm−2) and last column is
the sum of power consumption for the EO using SFC (SFCTi/Pt +
SFCTi/Pt–SbSn). b: SFCTi/Pt (60 mA cm−2); SFCTi/Pt–SbSn (60 mA cm−2);
DFCTi/Pt+Ti/Pt–SbSn (60+60 mA cm−2) and last column is the sum of
power consumption for the EO using SFC (SFCTi/Pt + SFCTi/Pt–
SbSn)……….. 55
Figura 4.1 - Electrochemical flow cells configurations for the oxidation of dyes at Ti/Pt and Ti/Pt–SbSn anodes. Setup used for SFC Ti/Pt or SFC Ti/Pt–SbSn (1) thermoregulated reservoir; (2) electrochemical flow cell; (3) power supply and (4) pump……….. 66
Figura 4.2 - Evolution with time of absorbance band for NB CL-R employing Ti/Pt : a 30mA cm-2; b 60mA cm-2; and Ti/Pt–SbSn: c 30mA cm-2;
d 60mA cm-2, during anodic oxidation……….…….. 68
Figura 4.3 - Evolution with time of absorbance band for RR RR Gran employing Ti/Pt : a 30mA cm-2; b 60mA cm-2; and Ti/Pt–SbSn: c 30mA cm-2; d 60mA cm-2, during anodic oxidation………... 69
Figura 4.4 – Evolution with time of absorbance band for trichromy employing Ti/Pt : a 30mA cm-2; b 60mA cm-2; and Ti/Pt–SbSn: c 30mA cm-2;
d 60mA cm-2, during anodic oxidation………... 70
Figura 4.5 - Evolution with time of absorbance band for RY 3RS employing Ti/Pt: a 30mA cm-2; b 60mA cm-2; and Ti/Pt–SbSn: c 30mA cm-2;
d 60mA cm-2, during anodic oxidation………... 71
Figura 4.6 - The influence of current density and electrocatalytic material in the color removal percentage versus time textile effluents containing the dye NB CL-R by performing electrolysis with the anode Ti/Pt and Ti/Pt-SnSb, at current densities of 30 and 60 mA cm-2 ………... 72
color removal percentage versus time textile effluents containing the dye RY 3RS by performing electrolysis with the anode Ti/Pt and Ti/Pt-SnSb, at current densities of 30 and 60 mA cm-2…...….… 73
Figura 4.8 - The influence of current density and electrocatalytic material in the color removal percentage versus time textile effluents containing the dye RR RR Gran by performing electrolysis with the anode Ti/Pt and Ti/Pt-SnSb, at current densities of 30 and 60 mA cm-2…... 73
Figura 4.9 - The influence of current density and electrocatalytic material in the color reoval percentage versus time textile effluents containing the Trichromy by performing electrolysis with the anode Ti/Pt and Ti/Pt-SnSb, at current densities of 30 and 60 mA .cm-2……..……... 74
Figura 4.10 - Removal of COD as a function of electrocatalytic material used (Ti/Pt or Ti/Pt-SnSb) in the electrolysis of wastewater containing NB CL-R (a), 3RS RY (b) RR RR Gran (c) and Trichromy (d), at current densities of 30 and 60 mA cm-2…....……….………. 75
Figura 4.11 - Potential applied as a function of electrocatalytic material used (Ti/Pt or Ti/Pt-SnSb) in the electrolysis of wastewater containing a NB CL-R; b RY 3RS, c RR RR Gran;and d Trichromy, at 30 and 60 mA cm-2 and 240 min of electrolysis...….. 76
Figura 4.12 - Comparison on the energy consumption for 240 min of oxidation of the: a NB CL-R for 1- Ti/Pt (30 mA cm-2); 2- Ti/Pt (60 mA cm-2); 3- Ti/Pt-SnSb (30 mA cm-2); 4- Ti/Pt-SnSb (60 mA cm-2). b RY 3RS for 1- Ti/Pt (30 mA cm-2); 2- Ti/Pt (60 mA cm-2); 3- Ti/Pt-SnSb (30 mA cm-2); 4- Ti/Pt-SnSb (60 mA cm-2). c RR RR Gran for 1- Ti/Pt (30 mA cm-2); 2- Ti/Pt (60 mA cm-2); 3- Ti/Pt-SnSb (30 mA cm-2); 4- Ti/Pt-SnSb (60 mA cm-2). d Trichromy for 1- Ti/Pt (30 mA cm-2); 2- Ti/Pt (60 mA cm-2); 3- Ti/Pt-SnSb (30 mA cm-2);
LISTA DE TABELAS
Tabela 2.1 - Consumo de água nas indústrias... 16
Tabela 2.2 - Valores estimados para a percentagem de corante fixado e perda de corante para o efluente de acordo com a sua classe e o tipo de fibra... 18
Tabela 2.3 - Estudos eletroquímicos realizados na última década para a degradação de efluentes têxteis contendo corantes reativos... 27
Tabela 3.1 - Influence of current density on the percentage of color and COD removal after 5 h of electrolysis using Ti/Pt and Ti/Pt-SnSb in
DFC………. 53
Tabela 3.2 - Energy consumption estimated from Eq. 10, per volume of treated effluent during anodic oxidation of NB for different applied current densities using SFC and DFC systems. [NB]0=250 mg L-1,
Electrolyte: 0.25 M Na2SO4……… 54
Tabela 4.1 - Fuctions of auxiliaries agents and the addition time………... 65
Tabela 4.2 - Relation between dissolved oxygen and the percentage of COD removal, after 4 h of electrolysis using Ti/Pt and Ti/Pt-SnSb……… 78
Tabela 4.3 - Relation between turbidity and the percentage of color removal, after 4 h of electrolysis using Ti/Pt and Ti/Pt-SnSb ..………. 79
SUMÁRIO
1 INTRODUÇÃO... 13
2 FUNDAMENTAÇÃO TEÓRICA... 15
2.1 ÁGUA... 15
2.2 DANOS AMBIENTAIS... 17
2.3 CARACTERÍSTICAS DOS EFLUENTES TÊXTEIS... 18
2.4 CORANTES... 19
2.4.1 Corantes Reativos... 21
2.4.2 Fixação do corante à fibra... 21
2.5 TRATAMENTO DE EFLUENTES... 22
2.5.1 Tratamento Físico-Químico... 23
2.5.2 Tratamento Biológico... 24
2.5.3 Tratamento Químico... 24
2.6 TECNOLOGIA ELETROQUÍMICA... 25
2.6.1 Oxidação Eletroquímica... 27
2.6.2 Material Eletrocatalítico... 29
2.6.2.1 Eletrodo de Platina... 30
2.6.2.2 Eletrodo de Ti/Pt-SnSb... 32
REFERÊNCIAS... 33
3 APPLICATION OF ELECTROCHEMICAL OXIDATION PROCESS TO THE DEGRADATION OF THE NOVACRON BLUE DYE USING SINGLE AND DUAL FLOW CELLS……... 39
3.1 INTRODUCTION……… 40
3.2 EXPERIMENTAL………... 42
3.2.1 Chemicals………….……….. 42
3.2.2 Electrochemical measurements……… 42
3.2.3 Analysis……….. 43
3.3 RESULTS AND DISCUSSION………... 44
3.3.1 Potendiodynamic measurements……….. 44
Ti/Pt-SbSn……….. 48
3.3.4 Color Removal and Influence on applied current density using DFCTi/Pt+Ti/Pt-SbSn……….……. 50
3.3.5 By-products formation………... 53
3.3.6 Electrical energy requirements and cost……….. 54
3.4 CONCLUSIONS……….... 56
REFERENCES………...... 57
4 ELECTROCHEMICAL OXIDATION OF A TRICHROMY OF DYES BY USING FLOW REACTORS……… 62
4.1 INTRODUCTION……… 63
4.2 EXPERIMENTAL………. 64
4.2.1 Material and Methods………. 64
4.2.2 Analytical Methods……….. 66
4.3 RESULTS AND DISCUSSION………... 67
4.3.1 Color Removal……….. 67
4.3.2 Influence on applied current density using SFC Ti/Pt and SFC Ti/Pt-SbSn………...... 71
4.3.3 COD Removal……….. 74
4.3.4 Chemical and Physical Parameters……… 77
4.3.5 Energy Consumption and Cost……….. 79
4.4 CONCLUSIONS………... 81
REFERENCES………. 82
5 CONSIDERAÇÕES FINAIS... 84
1 INTRODUÇÃO
A contaminação de solos e lençóis freáticos por compostos orgânicos pouco ou não biodegradáveis tem sido assunto de grande atenção no mundo acadêmico e industrial. Na indústria têxtil a geração de resíduos é inevitável, destacando a quantidade de águas residuais gerada em todas as etapas do processo de produção. O seu tratamento tem sido um desafio em função da complexidade, da quantidade do resíduo gerado e do impacto ambiental ocasionado devido a sua complexa composição química. Além disto, o tratamento deste tipo de efluente requer um alto custo.
Os tratamentos ditos convencionais - como os processos biológicos ou químicos - são frequentemente empregados e apresentam-se eficientes no que tange ao cumprimento da legislação pertinente. Mas atualmente, este requisito não é mais suficiente, uma vez que considerações ambientais estão permanentemente na pauta. Visto que se por um lado, o tratamento químico de águas residuais demanda transporte, estocagem e manuseio de produtos químicos perigosos, além de proporcionar a geração de lamas tóxicas. Por outro lado, os processos biológicos são lentos e demandam grandes áreas físicas, além de gerar produtos biodegradáveis solúveis e resíduos celulares. Adicionalmente, compostos orgânicos com alto peso molecular, presentes em alguns tipos de efluentes industriais aquosos, tendem a serem resistentes à biodegradação. Diante deste quadro, a pesquisa e o desenvolvimento de novas tecnologias de tratamento de efluentes que sejam ambientalmente orientadas são cada vez mais estimuladas. Neste contexto, a Tecnologia Eletroquímica pode ser considerada uma alternativa atrativa para o tratamento de efluentes contendo compostos orgânicos via eletroxidação na superfície do ânodo, apresentando resultados competitivos frente aos tratamentos convencionais no tratamento de efluentes (PELEGRINO et al., 2002; MARTÍNEZ-HUITLE; FERRO, 2006, MARTÍNEZ-HUITLE; BRILLAS, 2009).
eletroquímica direta ocorre a transferência dos elétrons entre os elétrodos e, então, as espécies se decompõem; na oxidação indireta utiliza-se, principalmente, espécies oxidantes como mediadoras para a destruição de compostos orgânicos.
O principal desafio para um emprego efetivo da tecnologia eletroquímica para a eletroxidação de poluentes orgânicos consiste na redução da carga orgânica nos efluentes e consumo energético do processo de maneira a diminuir seu custo operacional para torná-lo competitivo com o tratamento biológico atualmente usado.
Diante deste quadro, esta dissertação apresenta uma fundamentação teórica, que remete a problemática apresentada nesta introdução, abordando tópicos sobre os problemas ambientais relacionados à contaminação industrial e o mau uso da água no planeta, além dos conceitos sobre a toxicidade dos efluentes têxteis, os corantes e suas características, os tipos de tratamento existentes, e uma abordagem geral sobre a Tecnologia Eletroquímica com um enfoque na Oxidação Eletroquímica (OE), e artigos que expõe o desenvolvimento destes estudos.
O artigo intitulado de “Application of electrochemical advanced oxidation process to the degradation of the Novacron Blue dye using single and dual flow cells” apresenta
os resultados desta investigação, utilizando células de fluxo simples, e duplo, com os ânodos de Ti/Pt e Ti/Pt-SnSb no tratamento do corante sintético Novacron Blue CD (NB). Analisou-se a eficiência do método e a influência dos materiais eletrocatalíticos, densidade de corrente e a estrutura do corante na remoção da cor e Demanda Químico de Oxigênio (DQO). Os resultados oriundos deste estudo foram submetidos na forma de artigo na revista Journal of Solid State Electrochemistry.
A fim de avaliar a eficiência dos materiais eletrocatalíticos na remoção de efluentes têxteis reais, provenientes de um processo de tingimento laboratorial, o artigo intitulado de
“Electrochemical oxidation of a trichromy of dyes by using flow reactors” apresentou os
resultados da utilização das células de fluxo de simples com ânodos de Ti/Pt e Ti/Pt-SnSb aplicando densidades de correntes de 30 e 60 mA cm-2 no tratamento de efluentes têxteis contendo os corantes Azul Marinho CL-R (NB CL-R), Amarelo Remazol 3RS (RY 3RS), Vermelho Remazol RR Gran (RR RR Gran) e uma tricromia dos três corantes anteriores. Os resultados oriundos deste estudo geraram um artigo que foi submetido à publicação na revista Water Resources Research.
2 FUNDAMENTAÇÃO TEÓRICA
2.1 ÁGUA
A água é a molécula mais abundante do planeta Terra, ao exemplo disto sabemos que cerca de 70% da superfície terrestre é coberta por água na sua forma líquida, o que representa aproximadamente 360 milhões de km2 de um total de 510 milhões. Entretanto, 97% da água disponível no planeta encontram-se nos oceanos, sendo salgada e não potável; aproximadamente 2% de água estão nas geleiras, e não se encontram disponíveis ao consumo humano. E apenas 1% da água doce existente é encontrada no subsolo. Os rios e lagos, principais fontes de água potável do mundo são responsáveis por menos de 0,01% do total de água da Terra (GIRARD, 2013).
A disponibilidade de água não é a mesma em todas as regiões do mundo. Dez países detêm 60% de toda água doce disponível, entre eles estima-se que o Brasil detenha cerca de 12% desses recursos A disponibilidade de água não é a mesma em todas as regiões do mundo. Dez países detêm 60% de toda água doce disponível, entre eles estima-se que o Brasil detenha cerca de 12% desses recursos dos quais distribuem-se da seguinte maneira: 68,5% encontram-se na região norte do Brasil para 7% da população brasileira; as regiões sul e centro-oeste, juntas, contém 22% da água doce e abrigam 21,5% da população; e, somados sudeste e nordeste possuem 9,5% dos recursos hídricos compartilhados entre 72% da população que vive nestas duas regiões (DOS SANTOS, 2014).
Figura 2.1 – Distribuição da água doce no planeta.
Fonte: GEO BRASIL, 2007.
para fins domésticos, industriais e agrícola, aliados ao despejo de efluentes sem tratamento adequado às reservas aquáticas e o uso de adubos químicos e agrotóxicos podem afetar a qualidade e a demanda dos recursos hídricos nacionais. Essas tendências atuais de exploração, degradação e poluição dos recursos hídricos já alcançaram proporções alarmantes, de forma que a intervenção dos órgãos competentes no quesito preservação e conservação ambiental são realizadas de forma rigorosa a fim de punir e orientar para o descarte e uso adequado dos mananciais.
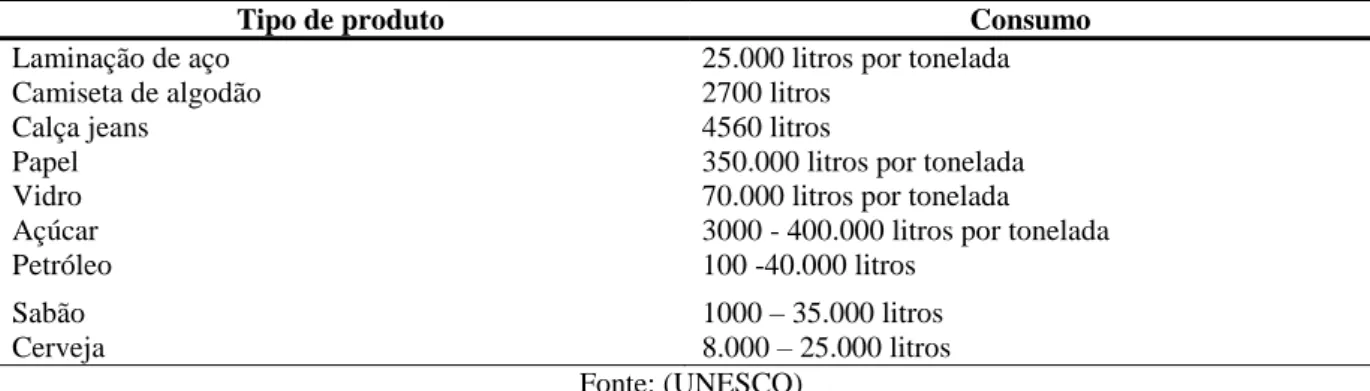
No mundo, a distribuição de água passível ao consumo ocorre de forma diferente para os setores agrícola, industrial e doméstico. Sendo o setor agrícola aquele com o maior nível de consumo atingindo 70% da água disponível para o consumo humano, em contrapartida o consumo doméstico só arrecada 10% dos recursos, e dentre estes recursos cerca de 3% são de perdas. Para o setor industrial estão disponíveis 20%, e o uso da água depende do ramo e da tecnologia utilizada podendo englobar a água desde a lavagem de materiais, equipamentos e instalações, até a utilização em sistemas de refrigeração e geração de vapor (FAO, 2012). E estima-se que até 2025 a indústria consuma cerca de 24% da água disponível no planeta. Dentre este contexto, a indústria têxtil consume atualmente 15% do total reservado à indústria, pois a água pode ser utilizada como meio de transporte para os produtos químicos que entram no processo, e para a remoção do excesso dos produtos considerados indesejáveis, consumindo assim 1000m3 de água por cada tonelada de tecido.
Tabela 2.1 – Consumo de água nas indústrias
Tipo de produto Consumo
Laminação de aço 25.000 litros por tonelada
Camiseta de algodão 2700 litros
Calça jeans 4560 litros
Papel 350.000 litros por tonelada
Vidro 70.000 litros por tonelada
Açúcar 3000 - 400.000 litros por tonelada
Petróleo 100 -40.000 litros
Sabão 1000 – 35.000 litros
Cerveja 8.000 – 25.000 litros
Fonte: (UNESCO)
pesticidas baseados em organocloro, corantes não fixados à fibra durante o processo de tingimento, até metais pesados associados com corantes ou no processo de tingimento (CORREIA et al., 1994; FORGIARINI, 2006; LACERDA, 2004).
2.2 DANOS AMBIENTAIS
Segundo o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA, 2000), as indústrias têxteis de vestuário e de artefatos de tecidos desenvolvem atividades potencialmente poluidoras (emissão de gases e efluentes sólidos e líquidos) e/ou utilizam-se de recursos ambientais (uso de água) em seus processos produtivos.
A poluição hídrica pode ser definida como qualquer alteração física, química ou biológica da qualidade de um corpo hídrico, capaz de ultrapassar os padrões estabelecidos para a classe (GIORDANO, 2004). O despejo dos efluentes em corpos hídricos é regido segundo as normas do CONAMA (Resolução 430/2011) que dispõem de condições, parâmetros, padrões e diretrizes para a gestão destes efluentes, devido aos sérios riscos ambientais e à saúde, que estes podem causar. Além da poluição visual, os rejeitos têxteis proporcionam alterações nos ciclos biológicos afetando principalmente os processos de fotossíntese visto que os corantes contidos nas águas residuais impedem a penetração da luz nos corpos hídricos (KUNZ et al., 2002; GUPTA et al., 2012).
A alta complexidade dos efluentes têxteis altera consideravelmente as propriedades físicas e químicas do corpo de água receptor. As altas concentrações de álcalis, sais, carboidratos, proteínas, além de corantes contendo metais pesado, que em grandes concentrações possuem ação tóxica sobre os microrganismos, e o consequente aumento das concentrações de matéria orgânica biodegradável são responsáveis pela interferência na capacidade autodepurativa dos corpos aquáticos, ocasionando a depleção do oxigênio dissolvido (OD) (ANDRADE et al, 1998; GONÇALVES et al., 2012).
representa um lançamento de cerca de 2-20% são descartados como efluentes aquosos em diferentes corpos hídricos.
As legislações dos países desenvolvidos estão cada vez mais rigorosas em relação à remoção de corantes provenientes de efluentes têxteis, o despejo inadequado destes resíduos têm se tornado um problema constante na indústria têxtil. As agências de proteção ambiental na Europa estão promovendo a prevenção contra a transferência dos problemas de poluição de um ambiente para o outro. Isto significa que a maioria das indústrias têxteis está desenvolvendo no local, ou em plantas de instalações, o tratamento de seus efluentes antes da descarga nos mananciais. Nos Estados Unidos, agências estadual e federal exigem menores limites de cor para os efluentes (BANAT et al., 1996).
2.3 CARACTERÍSTICAS DOS EFLUENTES TÊXTEIS
O efluente gerado depende exclusivamente do método utilizado, e dos reagentes químicos adicionados ao decorrer do processo têxtil. A sua principal característica é a forte coloração que ele acarreta nos corpos receptores, devido à presença dos corantes que não foram fixados à fibra durante a etapa do tingimento.
Tabela 2.2. Valores estimados para a percentagem de corante fixado e perda de corante para o efluente de
acordo com a sua classe e o tipo de fibra.
Classe do corante Tipo de fibra Fixação (%) Perdas (%)
Ácidos Poliamida 89-95 5-20
Diretos Celulose 70-95 5-30
Dispersos Poliéster 90-100 0-10
Reativos Celulose 60-70 10-50
Sulfurosos Celulose 60-90 10-40
Fonte: SOUSA, 2010.
A elevação da temperatura pode afetar os limites de tolerância térmica que os organismos aquáticos possuem para crescimento, migração, desova e incubação de ovos. Do mesmo modo que a alta turbidez reduz a fotossíntese da vegetação e algas presentes nos ambientes aquáticos, que por sua vez reduz a produtividade dos peixes (CETESB, 2009).
A carga orgânica presente nestas águas residuárias pode atingir valores superiores a 1500 mg/L, e a sua decomposição acarreta em um consumo elevado de oxigênio afetando por sua vez os organismos vivos aeróbicos do meio aquático. A DQO e a quantidade de OD são parâmetros indispensáveis para a caracterização dos efluentes industriais, além de serem indicadores da qualidade da vida aquática.
A cor de uma amostra de água está associada ao grau de redução de intensidade que a luz sofre ao atravessá-la devido à presença de sólidos dissolvidos, principalmente de material em estado coloidal orgânico e inorgânico (FUNASA, 2014). Segundo Martínez-Huitle e Brillas (2009), a presença de apenas 1 mg dm-3 de um corante é capaz de alterar visivelmente a coloração da água, ou a sua clareza. Estima-se que ocorra a perda de 1-2% de corantes na produção e 1-10% em uso, e no caso dos corantes reativos a sua perda pode ser de cerca de 4% (FORGACS et al., 2004).
2.4 CORANTES
Acredita-se que a arte de tingimento começou a ser praticada no ano 3000 A.C. na China, Índia e Egito. Até a metade do século XVIII todos os corantes eram obtidos de fontes naturais, usualmente plantas, embora alguns fossem de origem animal ou mineral. Usados na Índia desde tempos remotos, documentados na história, quase todos os corantes de origem natural não são capazes de produzir sozinhos, cores permanentes nos têxteis. Por isso, a impregnação deve ser realizada via substâncias metálicas, tais como alumínio, e ferro para que o corante possa fixar-se no material têxtil final. Essas substâncias são conhecidas como mordentes (LADCHUMANANANDASIVAM, 2008).
Corantes têxteis são compostos orgânicos cuja finalidade é conferir coloração à uma determinada fibra (substrato), de forma relativamente sólida à luz e a tratamentos úmidos, e possuir resistência à exposição a luz solar, ao tempo, água e sabão. Os corantes contêm dois grupos responsáveis pelas suas características intrínsecas, são eles os grupos cromóforos e os auxocromos. Os cromóforos são a parte não saturada da molécula e responsáveis pela cor, já os auxocromos são grupos doadores ou receptores de elétrons, e responsáveis por conferir uma melhor cor. É importante ressaltar que os auxocromos e cromóforos são ligados entre si por um sistema conjugado. As principais estruturas químicas cromóforas presentes nos corantes são compostas por grupos como azo,triazina e ftalocianinas, antraquinona e metano.
A classificação dos corantes ocorre de acordo com sua estrutura química ou com o método pelo qual são fixados à fibra têxtil. Eles podem ser do tipo azos, dispersos, reativos, ácidos, pré-metalizados, diretos, e etc. (ALCÂNTARA; DALTIN, 1996). Sendo 60%, dos corantes utilizados em indústrias têxteis do tipo azo que são caracterizados pelo grupo -N=N- ligado a sistemas aromáticos, no qual a função azo inclui os principais tipos de corantes reativos.
Figura 2.2. Estrutura química típica de um azo corante.
Fonte: KUNZ et al, 2002.
O mecanismo de fixação de cada corante é condicionado pelas características dos grupos funcionais, da estrutura dos corantes e das propriedades químicas e físicas da fibra a ser tingida. A impregnação dos corantes às fibras de um substrato têxtil ocorre na etapa de fixação e pode ocorrer via quatro diferentes tipos de forças de atração (ligação iônica, ponte de hidrogênio, ligação covalente, ou força de Van der Walls) e estas, por sua vez, dependem da interação entre o grupo cromóforo do corante e o grupo ligante do substrato (fibra).
quer atingir em matérias de solidez como, por exemplo, à luz, à fricção, ao suor, etc. A utilização de corantes no Brasil concentra-se, principalmente, nos corantes reativos para fibras celulósicas, que hoje respondem por 57% do mercado, seguidos pelos corantes dispersos, com 35%, poliamida, com 3% e acrílico, com 2 % (ABIQUIM, 2012).
2.4.1 Corantes Reativos
Os corantes reativos são retidos na fibra por um princípio diferente daquele que controla o tingimento da maior parte dos outros tipos de fibras; esta classe de corantes é capaz de formar uma ligação química covalente com as moléculas da fibra. Isto acontece devido à reação entre um grupo eletrofílico (reativo) na molécula do corante e os grupos hidroxila das fibras celulósicas; com grupos amino, hidroxila e tióis das fibras proteicas; e também com grupos amino das poliamidas (KUNZ et al., 2002; LADCHUMANANANDASIVAM, 2008).
Este tipo de ligação confere maior estabilidade e solidez na cor do tecido tingido quando comparada a outros tipos de corantes em que o processo de coloração se opera através de ligações de menor intensidade. A sua fixação se efetua através da adição de um eletrólito ou na presença de um meio alcalino.
Desde o seu aparecimento no mercado, a sua aplicação tem sido crescente, e atualmente se dá na estamparia de fibras celulósicas como o algodão, viscose, linho, lã e seda. Isto se dá em razão às características muito favoráveis para sua implementação, tais como: rapidez na reação de tingimento, solidez, estabilidade química, facilidade de operação e baixo consumo de energia na aplicação, além da grande variedade de cores.
2.4.2 Fixação do corantes à fibra
Uma característica interessante da molécula do corante na etapa de fixação é que apesar de possuir uma estrutura alargada, o que não lhe permite passar entre as moléculas das fibras, pode-se constatar que o corante consegue atingir todas as partes da fibra, sendo assim é relevante afirmar que as moléculas do corante conseguem passar através dos poros das fibras têxteis.
acessíveis para o corante; o tipo de concentração e grau de ionização dos grupos ionizáveis da fibra e do corante; e as interações moleculares entre todas as espécies presentes durante a fixação (LADCHUMANANANDASIVAM, 2008). A facilidade com que os corantes penetram numa determinada estrutura de fibra também depende da integração da fibra com o ambiente do solvente, particularmente da água.
No mundo, a fibra têxtil mais utilizada é o poliéster Brasil, apesar dos diversos tipos de fibras existentes, o algodão continua a ser o substrato mais utilizado nos processos têxteis. O algodão é uma fibra natural, e sua composição química é formada por celulose, água, compostos minerais, compostos nitrogenados, ceras, material péctico, resíduo de cascas e parafina. O tratamento sobre este tipo de fibra ocorre em soluções alcalinas.
Para cada tipo de fibra existe uma determinada categoria de corante. Nas fibras celulósicas, como o algodão e o rayon, são aplicados os corantes reativos, diretos, azos, à tina e sulfurosos. No caso das fibras sintéticas, deve-se distinguir entre as fibras e os corantes aplicados, principalmente no caso de: Poliéster – corantes dispersos; Acrílicos – corantes básicos; e Nylon (poliamida) – corantes ácidos. Restam, ainda, fibras menos importantes no mercado brasileiro como a seda, para a qual são aplicados corantes reativos, e a lã, que recebe corantes ácidos e reativos (ABIQUIM,2012).
2.5 TRATAMENTO DE EFLUENTES
No Brasil, o descarte dos efluentes têxteis deve obedecer às recomendações do Conselho Nacional do Meio Ambiente (Resolução 430/2011) visando que mesmo os efluentes tratados, não possam causar poluição ou contaminação das águas. Porém, a grande maioria destes compostos não são degradáveis em estações de tratamento de águas residuais convencionais, e o alto grau de toxidade destes compostos fenólicos faz com que os limites de concentração para emissão em mananciais e redes de esgoto, sejam de 0,5 ppm e 10,0 ppm, respectivamente. Isto implica que as indústrias devem desenvolver um tratamento para seus efluentes antes do despejo nos corpos receptores. Os padrões de qualidade da água devem possuir OD não inferior a 6 mg/L O2; ausência de corantes provenientes de fontes antrópicas
que não sejam removíveis por processo de coagulação, sedimentação e filtração convencionais; turbidez até 40 unidades nefelométrica de turbidez (UNT); e DBO até 5 mg/L O2.
mais convencionais no tratamento das águas residuais são os físico-químicos, químicos e biológicos. Os métodos físico-químicos utilizam tratamentos como a adsorção (por suportes inorgânicos ou orgânicos), coagulação, filtração e a permuta iônica, apresentando eficiência na descoloração dos rejeitos, mas em contrapartida a formação de lodo a ser descartado torna-se uma grande desvantagem para a maioria destes métodos. Os métodos químicos, como a ozonização ou a utilização de íons oxidantes, também se mostram eficientes na descoloração dos efluentes têxteis, mas em contrapartida, estes métodos necessitam do transporte, estocagem e manuseamento de produtos químicos perigosos. Já os processos biológicos são lentos e demandam grandes áreas físicas, além de gerar produtos biodegradáveis solúveis e resíduos celulares. E, adicionalmente, a existência de compostos orgânicos com alto peso molecular, presentes em alguns tipos de efluentes industriais aquosos, tendem a ser resistentes à biodegradação (MARTÍNEZ-HUITLE; BRILLAS, 2009).
A tecnologia eletroquímica destaca-se como uma alternativa inovadora por se tratar de tecnologias que oferecem prevenção ou remediação ambiental, e inclui vantagens por possuir alta eficiência energética, simples manuseio, segurança e versatilidade (BRILLAS; MARTÍNEZ-HUITLE, 2015).
2.5.1 Tratamento Físico-Químico
Os corantes são substâncias extremamente coloidais e presentes em quantidade significativa nos efluentes têxteis. Sua remoção pode ser realizada através da associação de alguns processos unitários físicos e químicos que, conjuntamente, exploram as propriedades macroscópicas dos produtos presente nos efluentes, e por isso o tratamento é qualificado como físico-químico (CARREIRA, 2006).
lamas. No entanto, o alto custo das membranas e do equipamento, reduz a produtividade com o tempo, devido à obstrução da membrana e do escoamento dos concentrados (CARREIRA, 2006; BRILLAS; MARTÍNEZ-HUITLE, 2015).
2.5.2 Tratamento Biológico
Os processos biológicos podem ser divididos em aeróbios e anaeróbios. Nos processos aeróbios, o receptor de elétrons é o oxigênio molecular e os principais produtos finais são CO2 e H2O. Nos processos anaeróbios, que degradam os compostos orgânicos
tóxicos principalmente a CO2e CH4, o oxigênio está ausente, sendo que algumas formas de
carbono, enxofre e nitrogênio participam como receptores de elétrons.
Alguns microrganismos, tais como algas, fungos, bactérias e leveduras são capazes de degradar certo tipo de corantes. É crescente o número de estudos em biodegradação a fim de encontrar microrganismos versáteis, capazes de degradar de maneira eficiente um grande número de poluentes e à um baixo custo operacional. Na prática sabe-se que isto é muito difícil, principalmente em função da diversidade, concentração e composição de espécies químicas presentes em cada efluente (KUNZ et al., 2002).
Os métodos biológicos são ecologicamente corretos, produzem menos lodo que os sistemas físico-químicos e são relativamente baratos. No entanto, a sua aplicação é limitada, uma vez que o tratamento biológico demanda uma grande área física, possui sensibilidade à toxicidade de certos produtos químicos e o tempo de tratamento é muito alto. Além disso, alguns corantes são geralmente tóxicos e não são facilmente biodegradados, e a disposição final das fases sólidas continua sendo um problema sem solução para estes processos (FORGIARINI, 2006).
2.5.3 Tratamento Químico
Os processos químicos são assim denominados por utilizarem reagentes químicos, tais como agente de coagulação e oxidantes. Métodos químicos tais como a ozonização e oxidação através do íon hipoclorito, bem como os Processos Oxidativos Avançados (POAs), tais como o reagente Fenton e os sistemas fotocatalíticos como o sistemas de reagentes e fotocatalíticas como TiO2/UV, H2O2/UV e O3/UV, fornecem uma rápida descoloração e
Os POAs são métodos ambientalmente corretos e que envolvem a geração in-situ de espécies de oxigênio altamente reativas, como os radicais hidroxila (OH•) que controlam o mecanismo de degradação.Estas espécies possuem um potencial padrão de redução de 2,8V, muito superior ao dos oxidantes convencionais, por isto reagem com as moléculas orgânicas de forma rápida e indiscriminada, seja por adição à dupla ligação ou por abstração do átomo de hidrogênio em moléculas orgânicas alifáticas. Em alguns casos, a ação de agentes intermediários, como o hipoclorito ou OH•, representa a única maneira de se degradar o poluente orgânico e mineralizá-lo (completa oxidação do composto orgânico gerando como produto final dióxido de carbono e água). Dependendo da composição química, níveis de concentração e força iônica da água residuária, POA’s, como a oxidação Fenton, oxidação fotoquímica ou eletroxidação indireta, através de OH• produzido pela decomposição da água (PANIZZA; CERISOLA, 2007, HUITLE; FERRO, 2006; MARTÍNEZ-HUITLE; BRILLAS, 2009), podem ser usados com sucesso para a remoção de poluentes orgânicos (POLCARO et al., 2000 ).
No entanto, a utilização destes métodos, atualmente, não é bem aceito devido aos altos custos para o desenvolvimento destes processos. E outro inconveniente muitas vezes encontrado nestes estudos é o aumento da toxicidade de alguns intermediários de reação, o que torna necessário o acompanhamento do processo através de testes de toxicidade.
2.6 TECNOLOGIA ELETROQUÍMICA
O método eletroquímico consiste basicamente na eletrólise do efluente, com um potencial capaz de oxidar ou reduzir os compostos de interesse, transformando-os em substâncias mais simples, ou a completa mineralização. Estes processos ocorrem via condições controladas de potencial e densidade de corrente aplicadas a um sistema que possui um determinado material eletrocatalítico que por sua vez é determinado de acordo com a espécie a ser estudada, levando em consideração a eletroafinidade entre eles. A adição de reagentes neste método é limitada às substâncias responsáveis pelo aumento da condutividade do meio, e estas substâncias são chamadas de eletrólitos.
Dentre as vantagens da utilização destas tecnologias destacam-se: a alta eficiência energética; os processos operam em condições brandas (temperatura ambiente e pressão), diminuindo os riscos de corrosão, de falha material e liberação acidental; os potenciais são controlados, fator determinante na eficiência energética do sistema; os eletródos e as células eletroquímicas são projetados para minimizar as perdas energéticas frente à mà distribuição de corrente, quedas de correntes e reações laterais, além de serem equipamentos de fácil manuseio e automação; e alta seletividade, evitando a formação de subprodutos indesejáveis. As tecnologias eletroquímicas quando comparadas a outros métodos convencionais de tratamento de efluentes apresentam também as vantagens de realizar oxidação, direta ou indireta, redução, ou separação de fases em diversos poluentes (JUTTNER et al., 2000; BRILLAS; MARTÍNEZ-HUITLE, 2015).
A diminuição do consumo energético em um processo eletroquímico é o grande desafio deste método, pois se faz necessário aumentar seu rendimento elétrico e reduzir o potencial elétrico a ser aplicado de maneira a atingir a densidade de corrente elétrica desejada. O potencial é dependente, principalmente, da distância entre os eletrodos para uma dada condição de trabalho. A diminuição da distância entre os eletrodos acarreta em uma diminuição da queda ôhmica e um decréscimo equivalente na queda de voltagem na célula e no consumo energético. O rendimento elétrico, por sua vez, pode ser melhorado de duas maneiras, onde a primeira consiste em se utilizar as reações anódica e catódica para a reação de interesse, e a segunda baseia-se na utilização de eletrodos com uma grande área superficial (FOCKEDEY; LIERDE, 2002).
Na literatura existem diversos estudos sobre os métodos eletroquímicos e sua aplicabilidade na degradação dos poluentes orgânicos. O método mais estudado é a oxidação eletroquímica, porém existem outros métodos como a eletrocoagulação, redução eletroquímica, eletro-oxidação indireta com fortes oxidantes (como o cloro ativo, e o eletrofenton), e a eletroquímica foto-assistida que também mostraram-se bastante eficazes para o tratamento de efluentes.
Florenza et al. (2014) realizou um estudo comparativo, para a degradação do corante Acid Red 1, entre a oxidação anódica através do H2O2 eletrogerado, o eletro-Fenton, e o
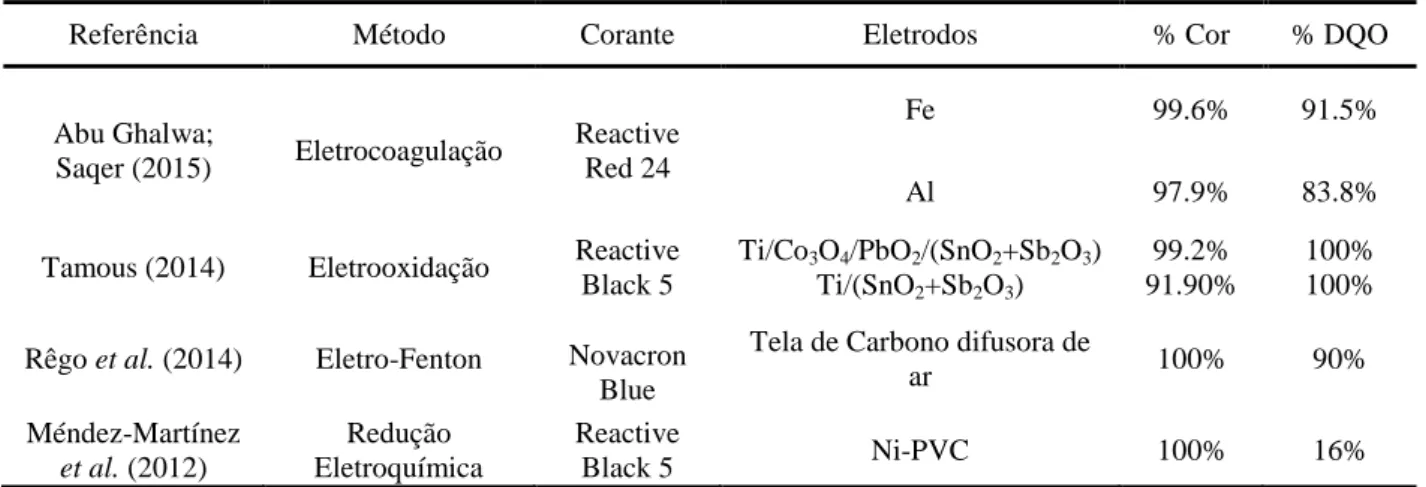
A tabela 2.3 expõe uma breve revisão dos estudos eletroquímicos empregados na última década na degradação de efluentes têxteis contendo corantes reativos, listando os autores, corantes, densidade de corrente aplicada, bem como os resultados obtidos para remoção da carga orgânica e coloração.
Tabela 2.3 Estudos eletroquímicos realizados na última década para a degradação de efluentes têxteis
contendo corantes reativos
Referência Método Corante Eletrodos % Cor % DQO
Abu Ghalwa;
Saqer (2015) Eletrocoagulação
Reactive Red 24
Fe 99.6% 91.5%
Al 97.9% 83.8%
Tamous (2014) Eletrooxidação Reactive Black 5
Ti/Co3O4/PbO2/(SnO2+Sb2O3) 99.2% 100%
Ti/(SnO2+Sb2O3) 91.90% 100%
Rêgo et al. (2014) Eletro-Fenton Novacron Blue
Tela de Carbono difusora de
ar 100% 90%
Méndez-Martínez et al. (2012)
Redução Eletroquímica
Reactive
Black 5 Ni-PVC 100% 16%
2.6.1 Oxidação eletroquímica
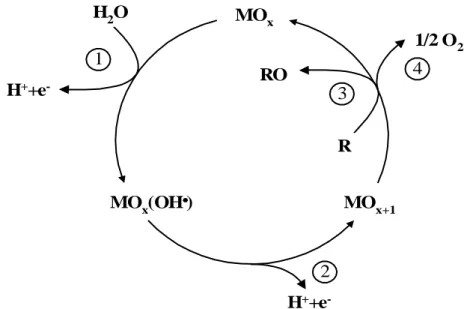
Figura 2.3. Representação esquemática da oxidação eletroquímica de orgânicos sobre ânodos de óxidos
metálicos (MOx), formando superóxidos (MOx+1). descarga de H2O; formação do superóxido; oxidação
do composto orgânico e desprendimento de O2.
MOx
MOx+1 MOx(OH )
H2O
H++e
-1
H++e
-R RO
1/2 O2
2 3
4
Fonte: SIMOND et al., 1997; MARTÍNEZ-HUITLE; FERRO 2006.
A figura 2.3 demonstra o mecanismo de oxidação eletroquímica de compostos em soluções aquosas, levando em consideração a natureza do material eletrocatalítico e a oxidação das substâncias orgânicas ocorrendo de forma simultânea com a reação de desprendimento de oxigênio.
O primeiro passo consiste na descarga da água (eletrólise anódica), conforme a Equação 1, formando radicais hidroxila (OH•) adsorvidos sobre a superfície do eletrodo. O MOx é o óxido em seu estado normal, e o potencial de redução padrão do OH• é de 2,8 V,
sendo maior do que o potencial de redução padrão do ozônio (2, 07 V), por exemplo, tornando-o um forte agente oxidante.
MOx + H2O→ MOx (OH•) + H+ + e- (1)
Os radicais hidroxilas irão reagir e formar os superóxidos MOx+1 sobre os sítios ativos
do óxido MOx, de acordo com a equação 2:
MOx(OH•) → MOx+1 + H+ + e- (2)
MOx+1+ R → MOx + RO (3)
A espécie MOx+1 também será responsável pela formação da reação de
desprendimento de oxigênio, num processo competitivo:
MOx+1→ MOx + ½ O2 (4)
Um segundo caminho para a reação, em que o composto orgânico é mineralizado, deve também ser considerado:
MOx (OH•)y+ R→ y/2 CO2 + yH+ + ye- + MOx (5)
A reação de combustão, representada na Equação 5, é mais provável que ocorra em condições de altos sobrepotenciais para a reação de desprendimento de oxigênio em superfícies de PbO2, SnO2 ou Sb2O5 (eletrodos não ativos). Nestas condições, também será
formado oxigênio (Equação 6):
MOx (OH•)→ MOx + ½ O2 + H+ + e- (6)
Durante a eletroxidação de moléculas orgânicas, é provável que todas as reações exerçam influência sobre o processo total.
2.6.2 Material eletrocatalítico
Os ânodos podem ser divididos em duas classes: ativos e não ativos. Os considerados “ativos” são aqueles que possuem baixos sobrepotenciais de O2, onde o quimissorvido
"oxigênio ativo" mostra-se como principal agente oxidante favorecendo a conversão eletroquímica de compostos orgânicos em ácidos carboxílicos. Nos ânodos “não ativos” com elevados de sobrepotencias de O2, a combustão eletroquímica dos orgânicos vai até a
mineralização à CO2, sob a ação dos radicais M(OH•).
Além desta classificação, os ânodos também são divididos em duas categorias (MARTÍNEZ-HUILTLE; BRILLAS, 2009):
b. Pobres eletrocatalisadores da RDO. Nesta classe estão os ânodos de PbO2 e SnO2.
A primeira categoria de ânodos é geralmente utilizada em aplicações em que a reação de desprendimento de oxigênio é de interesse primordial. A oxidação de compostos orgânicos utilizando esta classe de ânodos não tem se mostrado adequada por apresentarem baixas eficiências e um alto consumo energético. O mecanismo predominante para esta classe de eletrocatalisadores é a eletroxidação direta. Já os eletrocatalisadores da segunda categoria são relatados como os mais adequados para a oxidação de orgânicos por apresentarem as melhores eficiências. Para os óxidos desta classe de eletrocatalisadores prevalece o mecanismo da oxidação indireta.
Dentre os óxidos da segunda categoria, tem destaque os ânodo de PbO2, Pt e Diamante
dopado com Boro (DDB). Diversos autores que dedicaram seus estudos somente à comparação entre os diferentes materiais de ânodo concluíram que estes apresentam o melhor desempenho na oxidação de compostos orgânicos em termos de eficiência, tempo de processo e consumo energético (KÖTZ et al., 1991; STUCKI et al., 1991; GRIMM et al., 1998; POLCARO et al., 1999, MARTÍNEZ-HUITLE; BRILLAS, 2009).
2.6.2.1 Eletrodo de Platina
Os eletrodos de Platina são materiais com excelentes características, porém apresentam um alto custo, o que torna a sua aplicação industrial algo impraticável. Logo, os ânodos de Pt dopada com materiais de diferentes composições tem sido testadas. Esta dopagem pode diminuir os custos desse material e desta forma a sua aplicação é utilizada com eficácia similar e estabilidade.
Estes eletrodos apresentam uma alta eficiência na descoloração de efluentes, porém possuem baixas taxas de descontaminação. Isto ocorre devido a natureza eletrocatalítica do eletrodo de platina, que é um ânodo ativo com baixos sobrepotenciais de O2 e por este motivo,
A formação do Pt(OH•) ocorre através das etapas (7 e 8):
Pt + H2O → Pt (OH•) + H+ + e- (7)
Pt (OH•) → PtO + H+ + e- (8)
Diante deste contexto alguns resultados para a degradação de corantes usando o eletrodo de Ti/Pt foram publicados (ROCHA et al.,2014; TAVARES et al., 2012). Por exemplo, Rocha et al.(2014), avaliaram o processo de degradação eletroquímica do corante têxtil, Novacron Yellow C-RG (NY), dissolvido em águas residuais sintéticas, através da oxidação direta e indireta avaliando a remoção da cor e Carga Orgânica Total (COT), influência do material eletrocatalítico (DDB e Ti/Pt) e do eletrólito NaCl. A remoção da cor é relativamente semelhante para ambos os ânodos. Porém, o ânodo de Ti/Pt favoreceu preferencialmente a remoção da cor por oxidação direta e indireta atingindo 100% de remoção de cor, devido à fragmentação do grupo corante azo; enquanto que o ânodo de DDB favoreceu as remoções de cor e carga orgânicas (95% e até 87%, respectivamente), em ambos os processos devido à ruptura de corante em diferentes partes da sua estrutura química. Na ausência de NaCl, apenas uma lenta redução de COT utilizando ânodo de Ti/Pt foi obtida enquanto que uma maior eficiência foi registrado para o ânodo de DDB (acima de 85%).
Tavares et al. (2012) investigaram a oxidação eletroquímica do efluente têxtil sintético contendo o corante Methyl Red (100 mg dm3) dissolvido em água destilada contendo 0.25 M H2SO4, utilizando os ânodos de Ti/Ru0.3Ti0.7O2 e Ti/Pt ambos com área de 24 cm2 e
considerados ânodos ativos. Variou-se parâmetros como densidade de corrente (20, 40 e 60 mA.cm-2) e concentração do eletrólito NaCl (0.0, 0.2, 0.4, e 0.8g em 0.4L de solução contendo o corante MR). Avaliando a eficiência na remoção da cor, para ambos os eletrodos de Ti/Ru0.3Ti0.7O2 e Ti/Pt, a intensidade da banda visível diminuiu continuamente até o
completo desaparecimento depois de cerca de 300 e 150 minutos de eletrólise, respectivamente. Já percentual de decaimento da COT para Ti/Pt e Ti/Ru0.3Ti0.7O2 foi de 50 e
2.6.2.2 Eletrodo de Ti/Pt-SnSb
Trata-se de um eletrodo do tipo ADE (Ânodo Dimensionalmente Estável), constituído por um suporte metálico (no caso, o Titânio) sobre o qual é depositada uma mistura de óxidos metálicos. A composição e a natureza do óxido revestido podem afetar fortemente a estabilidade e atividade eletroquímica destes eletrodos ADEs. Devido ao seu alto sobrepotencial da reação de evolução de oxigênio, baixo custo e caráter inofensivo, os eletrodos de Sb dopado com SnO2 estão sendo utilizados como alternativas promissoras para
o mais caro e frágil DDB, e o mais prejudicial, eletrodos baseados com o PbO2.
O eletrodo de Ti/Pt-SnSb combinam três aspectos importantes: apresentam alta estabilidade química e eletroquímica, como consequência da diferença da banda gap (cerca de 3,5 eV), alta condutividade elétrica do SnO2 dopado e, por fim, esses eletrodos mostram alto
sobrepotencial de evolução de oxigênio (ηO2 ).Além destes aspectos, a presença de pequenas
quantidades de platina (que realiza o revestimento) gera um aumento de várias ordens de grandeza no tempo de vida deste tipo de eletrodos (DEL RÍO et al., 2012).
Em geral, para os ADEs, a combinação de eletrodos de SnO2 com espécies ativas (Pt,
Ir, Ru) aumenta a sua estabilidade, porém, aumenta simultaneamente a atividade catalítica para a reação de evolução de oxigênio. Além de aumentar os custos com o material eletrocatalítico, visto que a otimização do método com certa quantidade do metal ativo pode aumentar significativamente os custos do processo (BERENGUER et al., 2014).
Zhang et al.(2014), realizaram a preparação de um eletrodo de Ti/SnO2-Sb modificado
com Nano Tubos de Carbonos (NTC) a fim de realizar a oxidação anódica do efluente têxtil contendo 1.0g L-1 do corante Acid Red 73 e Na2SO4 0.25M, investigando, deste modo, a
eficiência dos eletrodos de Ti/SnO2-Sb e o eletrodo modificado com nano tubo de carbono
(Ti/SnO2-Sb-NTC). Após 3h de eletrólises, o corante AR 73 foi quase completamente
degradado quando utilizado o Ti/SnO2-Sb-NTC, e os valores de remoção de DQO e COT
foram de 80.12% e 46.01%, respectivamente. Enquanto que os valores para Ti/SnO2-Sb foram
de apenas 62.97% e 36.59%. Além disto, os consumos energéticos e eficiência de corrente de mineralização são superiores as do eletrodo de Ti/SnO2-Sb (121.15 KWh, 11.95% versus
REFERÊNCIAS
ABU GHALWA, N. M.; SAQER, A. M. Removal of Reactive Red 24 Dye by Clean Electrocoagulation Process Using Iron and Aluminum Electrodes. Journal of Applicable
Chemistry, v. 4, n. 1, p. 232-243, 2015. Disponível em:
http://www.joac.info/ContentPaper/2015/15.pdf Acesso em: 15 de maio de 2015.
ALCÂNTARA, M. R.; DALTIN, D. A Química do Processamento Têxtil. Química Nova. v 19, n 3, p. 320-330, 1996. Disponível em: http://www.scielo.br/pdf/qn/v25n1/10428.pdf Acesso em: 06 de fevereiro de 2015.
ANDRADE, R. C. B.; SOUZA, M. F. L.; COUTO, E. C. G.. Influência de Efluentes Têxteis e Alimentícios sobre o Metabolismo e Propriedades Físicas e Químicas do rio Piauitinga
(Sergipe). Química Nova, v. 21, n. 4, p. 424, 1998. Disponível em:
http://www.scielo.br/pdf/qn/v21n4/3186.pdf Acesso em: 04 de fevereiro de 2015.
ASSOCIAÇÃO BRASILEIRA DA INDÚSTRIA QUÍMICA (ABIQUIM). Aplicações – Uso de corantes, pigmentos e branqueadores ópticos. São Paulo, 2012. Disponível em:
http://abiquim.org.br/corantes/cor_aplicacoes.asp Acesso em: 06 de fevereiro de 2015.
BANAT, I. M.; NIGAM, P.; SINGH, D.; MARCHANT, R. Microbial Decolorization of Textile Dye Containing Effluents: A Review. Bioresource Technology, v. 58, n. 3, p. 217-227, 1996. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0960852496001137 Acesso em: 07 de fevereiro de 2015.
BARTH, F. T. Modelos para gerenciamento de recursos hídricos. Editora Nobel, p. 526, São Paulo, 1987. Acesso em: 04 de fevereiro de 2015.
BERENGUER, R.; SIEBEN, J. M.; QUIJADA, C.; MORALLÓN, E. Pt- and Ru-Doped SnO2−Sb Anodes with High Stability in Alkaline Medium. ACS Appl. Mater. Interfaces, v. 6, p. 22778−22789, 2014. Disponível em: http://pubs.acs.org/doi/ipdf/10.1021/am506958k Acesso em: 09 de fevereiro de 2015.
BRASIL. MINISTÉRIO DO MEIO AMBIENTE. CONSELHO NACIONAL DO MEIO AMBIENTE: CONAMA. Resolução n° 357, de 17 de março de 2005. Disponível em: http://www.mma.gov.br/port/conama/res/res05/res35705.pdf Acesso em: 05 de fevereiro de 2015.
BRASIL. MINISTÉRIO DO MEIO AMBIENTE. CONSELHO NACIONAL DO MEIO AMBIENTE: CONAMA. Resolução 430, 13 de maio de 2011. Disponível em:
http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=646 Acesso em: 02 de fevereiro de 2015.
BRILLAS, E. MARTÍNEZ-HUITLE, C. A. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods. An updated review. Applied Catalysis
B: Environmental, v. 166 – 167, p. 603-643, 2015.Disponível em:
CARMEN, Z., DANIELA, S. Textile organic dyes–characteristics, polluting effects and separation/elimination procedures from industrial effluents–a critical overview. Organic
Pollutants Ten Years After the Stockholm Convention-Environmental and Analytical Update, pp. 55-81, 2012. Disponível em: http://cdn.intechopen.com/pdfs/29369/InTech-Textile_organic_dyes_characteristics_polluting_effects_and_separation_elimination_procedu res_from_industrial_effluents_a_critical_overview.pdf Acesso em: 15 de maio de 2015.
CARREIRA, M. F. Sistemas de tratamento de efluentes têxteis : Análise comparativa entre as tecnologias usadas no Brasil e na Península Ibérica. Tese (doutorado) - Universidade Federal de Santa Catarina. Programa de Pós-graduação em Engenharia de Produção, 2006. Disponível em:
https://repositorio.ufsc.br/bitstream/handle/123456789/89469/225503.pdf?sequence=1&isAll owed=y Acesso em: 07 de fevereiro de 2015.
COMNINELLIS, CH., PULGARIN, C. Electrochemical oxidation of phenol for wastewater treatment using SnO2 anodes. J. Appl. Electrochem., v. 23, p. 108-112, 1993. Disponível
em:
http://www.researchgate.net/profile/Cesar_Pulgarin/publication/37410478_Comparison_of_th e_chemical_and_electrochemical_oxidation_of_phenol_for_waste_water_treatment/links/00b 7d51e6ba8a0ab42000000.pdf Acesso em: 09 de fevereiro de 2015.
COMPANHIA DE TECNOLOGIA DE SANEAMENTO AMBIENTAL (CETESB). Qualidade das Águas Interiores no Estado de São Paulo, 2009.Disponível em:
http://www.cetesb.sp.gov.br/userfiles/file/agua/aguas-superficiais/variaveis.pdf Acesso em: 05 de fevereiro de 2015.
CORREIA, V.M.; STEPHENSON, T.; JUDD, S.J.. Characterization of textile wastewaters: a review. Environmental Technology, 15, p. 917–919, 1994. Disponível em:
http://www.tandfonline.com/doi/abs/10.1080/09593339409385500 Acesso em: 04 de fevereiro de 2015.
DEL RÍO, A.I.; BENIMELI, M.J.; MOLINA, J.; BONASTRE, J.; CASES, F.
Electrochemical Treatment of C.I. Reactive Black 5 Solutions on Stabilized Doped Ti/SnO2
Electrodes. Int. J. Electrochem. Sci.,v.7 , p.13074-13092, 2012. Disponível em:
http://www.electrochemsci.org/papers/vol7/71213074.pdf Acesso em: 09 de fevereiro de 2015.
DOS SANTOS, A. L. Os principais desafios e o papel do economista no século XXI. Revista
Conteúdo, Capivari, v. 6, n.1, p. 100, 2014. Disponível em:
http://www.conteudo.org.br/index.php/conteudo/article/view/111/97 Acesso em: 14 de maio de 2014.
FLORENZA, X.; SOLANO, A. M. S.; CENTELLAS, F.; MARTÍNEZ-HUITLE, C. A.; BRILLAS, E.; GARCIA-SEGURA, S. Degradation of the azo dye Acid Red 1 by anodic oxidation and indirect electrochemical processes based on Fenton’s reaction chemistry. Relationship between decolorization, mineralization, and products. Electrochimica Acta, v. 142, p. 276-288, 2014. Disponível em:
FOCKEDEY, E.; VAN LIERDE, A. Coupling of anodic and cathodic reactions for phenol electro-oxidation using three-dimensional electrodes. Water Research, v. 36, n. 16, p. 4169-4175, 2002. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0043135402001033 Acesso em:09 de fevereiro de 2015.
FORGACS, E.; CSERHÁTI, T.; OROS, G. Removal of synthetic dyes from wastewaters: A review, Environment International, v. 30, n. 7, p. 953-971, 2004. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0160412004000340 Acesso em: 05 de fevereiro de 2015.
FORGIARINI, E. Degradação de corantes e efluentes têxteis pela enzima Horseradish Peroxidase (HRP). Dissertação (Mestrado em Engenharia Química)-UFSC, Florianópolis, 2006. Disponível em:
http://repositorio.ufsc.br/bitstream/handle/123456789/88662/225365.pdf?sequence=1&isAllo wed=y Acesso em: 04 de fevereiro de 2015.
FUNASA. Manual de Controle da Qualidade da Água para Técnicos que Trabalham em ETAS, p. 21, Brasília, 2014. Disponível em:
http://www.funasa.gov.br/site/wp-content/files_mf/manualcont_quali_agua_tecnicos_trab_emetas.pdf Acesso em: 05 de fevereiro de 2015.
GALLA, U.; KRITZER, P.; BRINGMANN, J.; SCHMIEDER, H.Process for Total
Degradation of Organic Wastes by Mediated Electrooxidation. Chem. Eng. Technol., v. 23, p. 230-233, 2000. Disponível em: http://onlinelibrary.wiley.com/doi/10.1002/(SICI)1521-4125(200003)23:3%3C230::AID-CEAT230%3E3.0.CO;2-3/epdf Acesso em: 09 de fevereiro de 2015.
GIRARD, J. E. Princípios de Química Ambiental. LTC, Rio de Janeiro, 2013.
GIORDANO, Gandhi. Tratamento e controle de efluentes industriais, 2004.Disponível em: http://www.ufmt.br/esa/Modulo_II_Efluentes_Industriais/Apost_EI_2004_1ABES_Mato_Gro sso_UFMT2.pdf Acesso em: 04.de fevereiro de 2015.
GONÇALVES, J. C. S. I; SARDINHA, D. S.; SOUZA, A. D. G.; DIBIAZI, A. L. B.; GODOY, L. H.; CONCEIÇÃO, F. T. Avaliação espaço -temporal da qualidade da água e simulação de autodepuração na bacia hidrográfica do córrego São Simão, SP. Revista
Ambiente & Água - An Interdisciplinary Journal of Applied Science: v. 7, n.3, 2012.
Disponível em: http://www.scielo.br/pdf/ambiagua/v7n3/v7n3a12.pdf Acesso em: 15 de maio de 2015.
GRIMM, J.; BESSARABOV, D.; MAIER, W.; STORCK, S.; SANDERSON, R.D. Sol-gel film-preparation of novel electrodes for the electrocatalytic oxidation of organic pollutants in water. Desalination, v. 115, n. 3, p. 295-302, 1998. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0011916498000484 Acesso em: 09 de fevereiro.
Hazardous Materials, v. 243, p. 179-186, 2012. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0304389412010230 Acesso em: 06 de fevereiro de 2015.
INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS (IBAMA). Relação das Atividades Potencialmente Poluidoras e/ou Utilizadoras de Recursos Ambientais, 2000. Disponível em:
https://servicos.ibama.gov.br/phocadownload/manual/tabela_de_atividades_do_ctf_app.pdf Acesso em: 06 de fevereiro de 2015.
JUTTNER, K.; GALLA, U.; SCHMIEDER, H. Electrochemical approaches to environmental problems in the process industry. Electrochimica Acta, v. 45, p. 2575 – 2594, 2000.
Disponível em:
http://www.ecaa.ntu.edu.tw/weifang/ebook/electrolysis/waste%20treatment/electrochemical% 20approaches%20to%20environmental%20problems%20in%20the%20process%20industry.p df Acesso em: 09 de fevereiro de 2015.
KÖTZ, R., STUCKI, S., CARCER, B. Electrochemical waste water treatment using high overvoltage anodes. Part I: Physical and electrochemical properties of SnO2 anodes. Journal
of Applied Electrochemistry, v. 21, p. 14-20, 1991. Disponível em:
http://link.springer.com/article/10.1007%2FBF01103823 Acesso em: 09 de fevereiro de 2015.
KUNZ, A.; ZAMORA, P.P.; MORAES, S.G.; DURÁN, N. Novas Tendências no Tratamento de Efluentes Têxteis. Química Nova, v. 25, n. 1, p. 78-82, 2002. Disponível em:
http://www.scielo.br/pdf/qn/v25n1/10428.pdf Acesso em: 02 de fevereiro de 2015.
LACERDA, J. P. Estudo do impacto ambiental nos cursos d’ água causado pelo lançamento de efluentes de indústrias do município de Itabirito/MG. 2004. 108 f. Dissertação (Mestrado em Engenharia Ambiental)-Universidade Federal de Ouro Preto, Ouro Preto, MG, 2004. Disponível em: http://www.repositorio.ufop.br/handle/123456789/2228 Acesso em: 04.de fevereiro de 2015.
LADCHUMANANANDASIVAM, R. Processos Químicos Têxteis. Tingimento Têxtil,v. 3, 2008. Disponível em:
http://www.academia.edu/5804371/PROCESSOS_QU%C3%8DMICOS_T%C3%8AXTEIS_
Tingimento_T%C3%AAxtil_Volume_III_-_UNIVERSIDADE_FEDERAL_DO_RIO_GRANDE_DO_NORTE_CENTRO_DE_TECNO LOGIA Acesso em: 06 de fevereiro de 2015.
MARTINEZ-HUITLE, C. A. e BRILLAS, E., Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: A general review. Applied Catalysis B:
Environmental, v. 87, n. 3-4, p. 105-145, 2009. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0926337308003718 Acesso em: 05 de fevereiro de 2015.
MARTÍNEZ-HUITLE, C.A. e FERRO, S. Electrochemical oxidation of organic pollutants for the wastewater treatment: Direct and indirect processes. Chemical Society Reviews, v. 35, n. 12, p. 1324-1340, 2006. Disponível em :