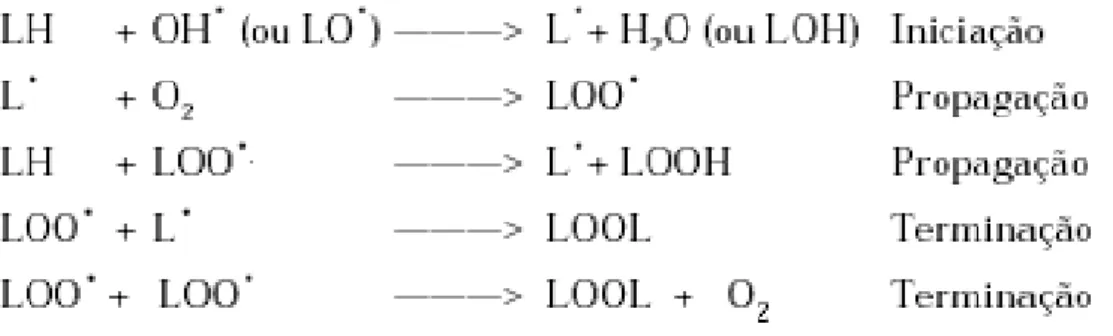DEPARTAMENTO DE BIOQUÍMICA
MICHELINE CRISTIANE ROCHA DE SOUZA
ATIVIDADE ANTIOXIDANTE DE FUCANAS E GALACTANAS
EXTRAÍDAS DE ALGAS MARINHAS
ATIVIDADE ANTIOXIDANTE DE FUCANAS E GALACTANAS
EXTRAÍDAS DE ALGAS MARINHAS
Dissertação Apresentada ao Programa de
Pós-Graduação em Bioquímica do Departamento de
Bioquímica da Universidade Federal do Rio
Grande do Norte como requisito parcial para a
obtenção do titulo de mestre em bioquímica.
Orientador: Profa. Dra. Edda Lisboa Leite
Souza, Micheline Cristiane Rocha de.
Atividade antioxidante de fucanas e galactanas extraídas de algas marinhas /Miceline Cristiane Rocha de. – Natal [RN], 2008. 66 f.
Orientador: Edda Lisboa Leite.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Departamento de Bioquímica. Programa de Pós-Graduação em Bioquímica.
1. Polissacarideos - Dissertação. 2. Algas - Dissertação. 3. Radicais livres - Dissertação. 4. Atividade antioxidante – Dissertação. I. Leite, Edda Lisboa. II. Universidade Federal do Rio Grande do Norte. III. Título.
incentivos e esforços para a realização desse sonho.
Aos meus irmãos, Gleydson e Givanaldo, pelo
companheirismo e compreensão.
Ao meu filho Arthur, razão da minha vida e
com quem tenho aprendido muito. Ao meu querido,
o À Deus, pela oportunidade de viver e realizar um sonho.
o A professora Edda, minha sincera admiração e agradecimento pela orientação, incentivo e apoio durante a realização deste trabalho.
o Aos professores do Departamento de Bioquímica: Elizeu Antunes, Maurício Sales, João Felipe, Suely Ferreira, Roberto Dimenstein, Jacira Maria, Hugo
Alexandre.
o À Professora Dra. Selma Jerônimo, coordenadora do programa de
pós-graduação em Bioquímica da UFRN.
o À profressora Dilma, minha primeira orientadora no departamento e por quem tenho profunda admiração.
o Às professoras Fernanda Wanderley e Luciana da Matta, pelas contribuições.
o Ao prof. Luiz Roberto Diz de Abreu e a profa. Patrícia Maria Guedes Paiva, por aceitarem fazer parte dessa banca examinadora.
o Aos colegas de laboratório: Celina, Cybelle, Fernando, Glória, Tarciana, Carol, Leonardo, Viviane, Leila, Lissandra, Marília, Maria Emília, Marcus, Monique,
o Aos funcionários do Departamento de Bioquímica da UFRN: Creuza, Eliene, Itamar, Jonas, Marcos, Margarita, Michelle e Rógerio
o À todos que direta ou indiretamente contribuíram para que um dia esse sonho se realizasse.
o Aos órgãos financiadores: Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior (CAPES) e a Pró-reitoria de Pesquisa e Pós-graduação da UFRN,
pequenas vitórias sobre nós mesmos”
apresentam atividades biológicas e farmacológicas importantes. Estes compostos apresentaram atividade “varredora” de radicais livres, os quais são importantes na mediação do processo inflamatório e na patologia de diversas doenças. Recentemente, essa propriedade “varredora” tem levado alguns pesquisadores a avaliar a capacidade antioxidante de diversos polissacarídeos. Considerando o reduzido número de pesquisas com estes compostos e sabendo-se de seu largo emprego pela indústria farmacêutica e alimentícia, objetivamos neste trabalho, verificar as ações de fucanas e galactanas como antioxidantes. As fucanas são encontradas em algas marrons e as galactanas (carragenanas) em algas vermelhas. As fucanas foram obtidas da alga Padina gymnospora (frações F0,5 e F1,1), comum
em nosso litoral, e uma outra fucana, o fucoidan, foi de origem comercial e extraído da alga Fucus vesiculosus. As carragenanas O, N e L também foram comerciais. A
atividade antioxidante foi testada em sistemas geradores de radicais superóxidos e hidroxilas, e pela inibição da peroxidação lipídica. Os resultados obtidos para inibição da formação de radicais superóxidos demonstraram que todos os polissacarídeos apresentaram atividade “varredora” de radicais superóxidos. O fucoidan, as frações F0,5 e F1,1 apresentaram IC50 de 0,058; 0,243 e 0,243 mg/mL,
respectivamente; enquanto o IC50 das carragenanas O, N e L foi de 0,046; 0,112 e
0,332 mg/mL, respectivamente. Os resultados para inibição da formação de radicais hidroxilas demonstraram que todas as amostras inibiram a formação destes radicais, exceto a F0,5. Para estes radicais o IC50 foi de 0,157 e 0,353 mg/mL para o fucoidan
e F1,1, e de 0,357; 0,335 e 0,281 mg/mL para carragenanas O, N e L, respectivamente. Todas as amostras foram capazes de inibir a peroxidação lipídica com IC50 de 1,250, 2,753 e 2,341 mg/mL para o fucoidan, F0,5 e F1,1,
respectivamente. Já as carragenanas O, N e L apresentaram o IC50 de 2,697, 0,323 e
present important biological and pharmacological activities. These composites had presented "scavenging" activity of free radicals, which is important in the mediation of the inflammatory process and in the pathology of diverse disease. Recently, this "scavenging" property has taken some researches to evaluate the antioxidant capacity from various polysaccharides. Considering the limited research with polysaccharides and knowing its largely employed by the pharmaceutical and foodstuffs industries, we have objective to verify the actions from fucans and galactans as antioxidants. The fucans are found in brown seaweed and the galactans (carrageenans) in red seaweed. The fucans were obtained from seaweed Padina gymnospora (F0.5 e F1.1 fractions), common to our coastline and one another fucan,
fucoidan, was of origin commercial and extracted from seaweed Fucus vesiculosus.
The O, N e L carrageenans were also of origin commercial. The antioxidant activities were tested in superoxide and hydroxyl systems to generated free radicals and for the inhibition of the lipid peroxidation. The results obtained to inhibition of formation the superoxide radicals demonstrated that all polysaccharides presented “scavenging” activity of superoxide radicals. The fucoidan, F0.5 and F1.1 fractions presented IC50 of 0.058; 0.243 and 0.243 mg/mL, respectively, while IC50 of the O, N
and L carrageenans were 0.046; 0.112 and 0.332 mg/mL, respectively. The results to inhibition of formation the hydroxyl radicals demonstrated that all sample had low effect in the inhibition of the formation of these radicals, except the F0.5. For these radicals the IC50 were 0.157 and 0.353 mg/mL to the fucoidan and F1.1, respectively
and 0.357; 0.335 and 0.281 mg/mL to O, N and L carrageenans, respectively. All the samples were capacity to inhibition the peroxidation, it present the IC50 of 1.250;
2.753 and 2.341 mg/mL to fucoidan, F0.5 and F1.1, respectively. Already the O, N
and L carrageenans presented the IC50 of 2.697; 0.323 and 0.830 mg/mL,
respectively. With these findings, we conclude that polysaccharides used in this study presented activity antioxidant, and that fucoidan and the O carrageenan show a significant "scavenging" activity for the radicals superoxide and the N carrageenan a significant inhibitory activity for the lipid peroxidation.
FIGURA 01 Estruturas propostas para fucanas de Fucus vesiculosus. 20
FIGURA 02 Estrutura das unidades dissacarídicas repetitivas dos três principais tipos de carragenanas:kappa(N), iota(L) e lambda (O).
22
FIGURA 03 Redução mitocondrial tetravalente do oxigênio molecular (O2) a água (H2O). 25
FIGURA 04 Geração do radical hidroxila pela reação não-enzimáttica de Fenton. 22
FIGURA 05 Geração do radical hidroxila pela reação não-enzimáttica de Haber-Weiss. 27
FIGURA 06 Iniciação, propagação e terminação da lipoperoxidação. 28
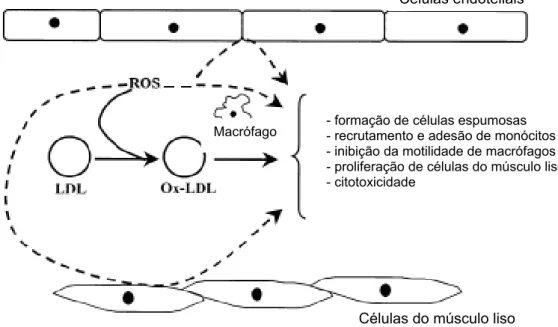
FIGURA 07 Interação de ROS com células-sinalizadoras e desenvolvimento da lesão aterosclerótica.
30
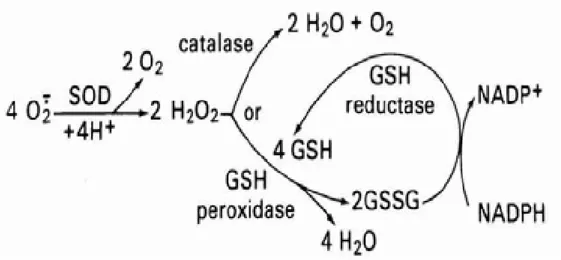
FIGURA 08 Enzimas da defesa antioxidante. 32
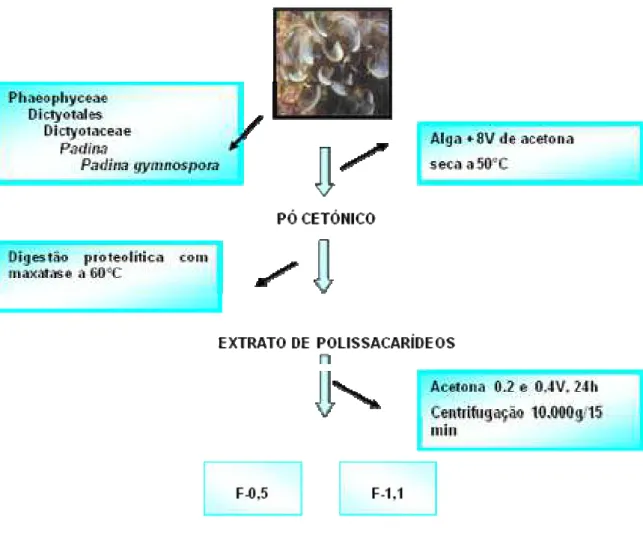
FIGURA 09 Extração de polissacarídeos de Padina gymnospora 36
FIGURA 10 Reação do MDA com TBA e estruturas tautoméricas correspondentes à formação do pigmento rosa.
41
FIGURA 11 Efeito inibitório de radicais superóxidos por fucanas de Padina gymnospora
(F0,5 e F1,1) e fucoidan.
43
FIGURA 12 Efeito inibitório de radicais superóxidos por carragenanas lambda (O), kappa
(N) e iota (L).
45
FIGURA 13 Efeito inibitório de radicais hidroxilas por fucanas de P. gymnospora (F0,5 e F1,1) e fucoidan
46
FIGURA 14 Efeito inibitório de radicais hidroxilas por carragenanas lambda (O), kappa (N) e
iota (L).
47
FIGURA 15 Inibição da peroxidação lipídica por fucanas de P. gymnospora (F0,5 e F1,1) e
fucoidan
48
FIGURA 16 Inibição da peroxidação lipídica por carragenanas lambda (O), kappa (N) e iota (L).
TABELA 01 Açúcares presentes em algas marrons 17
TABELA 02 Espécies reativas de oxigênio (ROS) 24
TABELA 03 Alguns estados patológicos associados a danos por radicais livres 31
TABELA 04 Componentes químicos dos polissacarídeos sulfatados (%) 42
TABELA 05 Valores dos IC50 dos radicais superóxidos (mg/mL) 44
TABELA 06 Valores dos IC50 dos radicais hidroxilas (mg/mL) 46
CAT Catalase
ERMO Espécies Reativas do Metabolismo do Oxigênio
GSH Glutationa Reduzida
GSH-Px Glutationa Peroxidase
GSH-Rd Glutationa Redutase
GSSG Glutationa Oxidada
H2O2 Peróxido de Hidrogênio
HO2. Radical Hidroxiperoxila
L. Radical Lipídico
LDL Lipoproteínas de Baixa Densidade
LH Cadeia lateral da molécula de lipídio
LO. Radical Alcoxila
LOO. Radical Peroxila
LOOH Hidroxiperóxidos Lipídicos
LOOL Produtos Finais e Estáveis da Peroxidação Lipídica
MDA Malonildialdeído
O2- Radical Superóxido
OH Radical Hidroxila
ROS Espécies Reativas do Oxigênio
-SH Grupamento Tiol
SOD- Superoxido Dismutase
-SS- Pontes Dissulfeto
TBA Ácido Tiobarbitúrico
Página
1- INTRODUÇÃO ... 14
1.1 - CONSIDERAÇÕES GERAIS... 14
1.2 – POLISSACARÍDEOS DE ALGAS... 14
1.2.1 – Fucanas de algas marrons... 15
1.2.2 – Galactanas de algas vermelhas (carragenanas)... 20
1.3 – RADICAIS LIVRES... 23
1.3.1 – Peroxidação lipídica... 27
1.3.2 – Ação patológicas dos radicaia livres... 31
1.3.3 – Sistema de defesa contra radicais livres... 29
2 - OBJETIVOS... 34
2.1 – OBJETIVO GERAL... 34
2.2 – OBJETIVOS ESPECÍFICOS... 34
3 – MATERIAIS E MÉTODOS... 35
3.1 - MATERIAL BIOLÓGICO... 35
3.1.1 - Algas... 35
3.1.2 – Animais... 36
3.2 - OUTROS MATERIAIS... 37
3.3 - APARELHOS... 37
3.4 - MÉTODOS... 38
3.4.1 - Análises químicas... 38
3.4.1.1 - Açúcares totais... 38
3.4.1.2 - Sulfato... 38
3.4.1.3 – Proteína... 38
3.4.2 - Determinação da atividade antioxidante... 39
3.4.2.5 – Determinação do IC50... 41
3.4.3 – Métodos estatísticos... 41
4 - RESULTADOS... 42
4.1 - Análises químicas... 42
4.2 - Atividade antioxidante... 43
4.2.1 - Radicais superóxidos... 43
4.2.2 - Radicais hidroxilas... 45
4.2.3 - Peroxidação lipídica... 47
5 – DISCUSSÃO... 50
6 - CONCLUSÕES... 55
REFERÊNCIAS... 56
1. INTRODUÇÃO
1.1 - Considerações gerais
As algas são seres vivos aquáticos e fotossintetizantes, encontradas no mar,
em águas estuárias, dulcíolas e superfícies úmidas e sua distribuição depende da
salinidade e temperatura da água, disponibilidade de luz solar, correntes dos
oceanos e das condições físicas e químicas afins (RAVEN, EVERT, & EICHHOM,
1996).
As macroalgas marinhas, usualmente possuem grandes quantidades de
carboidratos e proteínas (MABEAU et al, 1992; BENEVIDES et al, 1998; RAMOS et
al, 1998) sendo assim, consideradas como fonte potencial de nutrientes. A presença
desses componentes varia nas diferentes espécies, gêneros e sub-classes de algas
de acordo com o ambiente onde a alga se encontra, e também de acordo com seu
ciclo de vida da alga (PARKER, 1970).
As três principais divisões de algas marinhas são: Phaeophyta (algas
marrons), Chlorophyta (algas verdes) e Rhodophyta (algas vermelhas), que juntas
compreendem cerca de 7000 espécies (RORRER & CHENEY, 2004).
1.2 - Polissacarídeos de algas
Os polissacarídeos são compostos que apresentam de 2 a 10 diferentes tipos
de monossacarídeos com variações na composição e estrutura (LECACHEUX &
BRIGAND, 1988). Os polissacarídeos de algas, além de apresentarem em sua
estrutura açúcares bastante comuns, como a glicose, xilose e galactose, possuem
açúcares específicos e incomuns, aos encontrados em animais e vegetais terrestres
algas apresentam atividades biológicas de alto potencial medicinal (SOUZA,
MARQUES, DORE, SILVA, ROCHA, & LEITE, 2007) e isso tem atraído muito a
atenção dos cientistas. Várias atividades farmacológicas têm sido atribuídas a estes
compostos, tais como: ativação plaquetária (DURING et al., 1997; ALWAYN et al.,
2000), atividade anticoagulante (NISHINO et al., 1991; 1999; 2000; NARDELLA et
al., 1996), antitrombótica (NISHINO et al., 1994; MOURÃO & PEREIRA, 1999),
antitumoral (YAMAMOTO et al., 1980; 1982; ZHUANG et al., 1995; ELLOUALI et al.,
1993; Mc CAFFREY et al., 1996), antiproliferativa (LOGEART et al., 1997), antiviral
(HOSHIRO et al, 1998; IQBAL, 2000), ação sobre fatores de crescimento (SOEDA et
al., 1992; 2000); atividade antiinflamatória (LASKY, 1995) e atividade antioxidante
(SOUZA et al., 2007; ZHANG, YU, LI, ZHANG, XU, & LI, 2003).
1.2.1 – Fucanas de algas marrons
A parede celular de algas marrons é formada principalmente de microfibrilas
de celulose, embebida em uma matriz amorfa de polissacarídeos ácidos ligados uns
aos outros por proteínas (KLOAREG & QUATRANO, 1988). Esses polissacarídeos
ácidos apresentam uma grande variedade de açúcares constituintes e a presença de
grupos sulfato (tabela 01). Os principais polissacarídeos encontrados nessa algas
são os ácidos algínicos e as fucanas. A presença destes polissacarídeos sulfatados
e carboxilados na matriz extracelular destes vegetais confere uma grande
peculiaridade aos mesmos, uma vez que não são encontradas em plantas terrestres.
A estrutura química, propriedades físico-químicas e atividades biológicas desses
açúcares têm sido amplamente estudadas (ANDRADE et al, 2004).
Dentre os polissacarídeos encontrados na matriz mucilaginosa estão as
como principal característica a presença de uma grande quantidade de L-fucose e
grupos sulfato (YANG et al., 2006). Além de fucose, podemos encontrar no
polímero outros monossacarídeos, como xilose, galactose, ácidos urônicos,
D-manose e D-glicose. (LEITE, et al., 1998, DUARTE, CARDOSO, NOSEDA, &
CEREZO, 2001, ROCHA, 2002, PONCE, PUJOL, DAMONTE, & FLORES, 2003).
Após a extração das fucanas, podem ser encontrados nos extratos outros
polissacarídeos, como os ácidos algínicos, que são polissacarídeos lineares e
não-sulfatados que podem prejudicar a ação das fucanas durante os ensaios biológicos.
Esses açúcares ácidos são polímeros de ácido ȕ-D-manurônico e ácido Į
-L-glucurônico com ligações 1ĺ 4 (ALVES, 2000), solúveis em água e tornando-se
insolúveis na presença de cátions (como, por exemplo, cálcio, alumínio e ferro),
formando géis. Que podem servir para a liberação controlada de drogas em
sistemas vivos (FRANCHETTI & MARCONATO, 2006)
Tabela 01. Açúcares presentes em algas marrons
Açúcares constituintes das algas marinhas marrons
Constituintes Algas marrons
D-Galactose +
D-Glicose ++
D-Manose +
L-Galactose n.d.
D-Frutose n.d.
D-Xilose + L-Arabinose n.d. L-Glucurônico + L-Galacturônico n.d.
D-Manurônico + L-Gulurônico ++
L-Fucose ++
L-Ramnose (traços)
Manitol +
Éster sulfato ++
Adaptado de Percival & Mc Dowell, 1967
Legenda: ++ (freqüentemente encontrado) + (raramente encontrado) n.d (não detectado)
Acredita-se que por possuir um caráter altamente higroscópico as fucanas
estariam relacionadas com a proteção da alga contra desidratação quando esta é
submetida a longos períodos de exposição ao sol durante marés baixas. Além disso,
a natureza mucilaginosa das fucanas parece tornar a alga flexível o bastante para
crescer em ambiente líquido e rígida o suficiente para permanecer estendida, de
Os primeiros estudos sobre fucanas foram feitos por Kylin (1913) com as
algas Laminaria digitata, Fucus vesiculosus e Ascophyllum nodosum. Porém,
somente com os estudos feitos por Bird & Haas (1931) foi demonstrada a presença
de grupos sulfatos nos monômeros de fucose. Com relação à estrutura desses
polissacarídeos, relatos só foram feitos em 1950 através de pesquisas realizadas
por Conchie & Percival com a alga Fucus vesiculosus. Em 1970, Larsen, Haug &
Painter, estudando a alga Ascophyllum nodosum, obtiveram resultados que
indicavam a presença de polissacarídeos com diferentes graus de sulfatação.
Kloareg & Quatrano em 1988, levando em consideração a heterogeneidade
das fucanas, resolveram classificá-las com base nos seus açúcares constituintes em
homofucanas (por exemplo, o fucoidan extraído da alga marinha Fucus vesiculosus)
e heterofucanas (por exemplo, as frações de fucanas extraídas da alga marinha
Padina gymnospora). As primeiras são polímeros formados apenas por L-fucose
sulfatada e as do segundo grupo seus polímeros são constituídos de fucose e outros
açúcares.
Usov et al (1998) estudando fucanas de algas marinhas, observaram que
alguns destes polissacarídeos apresentavam ramificações simples localizadas na
posição 2 de alguns resíduos de fucose. Posteriormente, Bilan et al (2002) relataram
que a característica estrutural observada para estes polissacarídeos era resultante
de cadeias de carboidratos quase regulares com unidades de hexassacarídeos
repetitivas. Estes autores, também relataram que em fucanas nativas esta
regularidade poderia estar mascarada pelos grupamentos sulfato e acetil presentes
no polímero.
Conforme descrito por Grauffel et al (1989), a polidispersividade dos
conteúdos de ácidos urônicos e sulfato presente nas cadeias destes polímeros,
representam uma dificuldade adicional quanto ao fracionamento e caracterização
destes compostos. Outra dificuldade encontrada durante as investigações estruturais
das fucanas, refere-se aos diferentes métodos empregados para sua extração,
resultando, geralmente, em fucanas com diferenças estruturais consideravéis
(Figura 01).
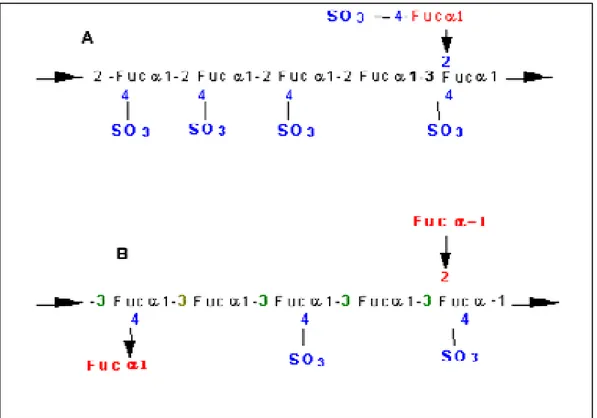
Apesar da complexidade estrutural das fucanas alguns relatos de estruturas
propostas para esses polissacarídeos sulfatados são encontrados nos estudos
realizados por Patankar et al (1993), que em estudos com fucanas (fucoidan)
extraídas da algas Fucus vesiculosus propuseram uma estrutura na qual resíduos de
fucopiranose estariam unidos por ligações 1ĺ 3, com a presença de ramificações
localizadas nas posições C2 ou C4, ficando determinado também alguns resíduos
sulfatados em C4 (figura 01B). Eles verificaram, a presença de um alto grau de
ramificação na molécula, sendo a fucose o açúcar terminal e não a fucose 4-sulfato
como proposto por Conchie & Percival (1950), (figura 01A). Ligações do tipo 1ĺ3
foram estabelecidas também por Usov et al (1998) em fucanas extraídas das algas
Ecklonia hurome e Laminaria saccharina.
Alguns estudos têm sido realizados na tentativa de determinar a estrutura
fina dessas fucanas, uma vez que, tamanho molecular, tipo de ligação,
monossacarídeos constituintes e posição do sulfato, são características que
parecem estar relacionadas com suas atividades biológicas. Estes estudos
proporcionariam conhecer o mecanismo pelo qual as fucanas exercem a sua
Figura 01. Estruturas propostas para fucanas de Fucus vesiculosus, (A) Modelo de CONCHIE &
PERCIVAL, 1950. (B) Modelo proposto por PATANKAR et al., 1993.
1.2.2 – Galactanas de algas vermelhas (carragenanas)
A parede celular das algas vermelhas consiste em uma trama de
polissacarídeos como celulose, xilano ou manano, coberta de mucilagens polímeras
de galactose, como o ágar e carrragenana, constituindo assim a matriz da parede
celular dessas algas (CRAIGIE, 1990; PAINTER, 1983).
As carragenanas são conhecidas desde o século XIX quando eram extraídas
da alga vermelha Chondrus crispus e utilizadas pela população da cidade irlandesa
de “Carrageen”, como agente emulsificante e gelsificante em alimentos caseiros
(NOSEDA, 1994).
Atualmente, o termo “carragenana” descreve uma classe de galactanas
celular de diversas espécies de algas marinhas vermelhas (TOJO & PRADO, 2003).
Juntamente com os alginatos e o ágar, as carragenanas formam um grupo de
substâncias biopoliméricas complexas chamadas ficocolóides, que são colóides, de
natureza principalmente hidrofílica (FERNÁNDEZ, RODRÍGUEZ-VÁRQUEZ, TOJO,
& ANDRADE, 2003).
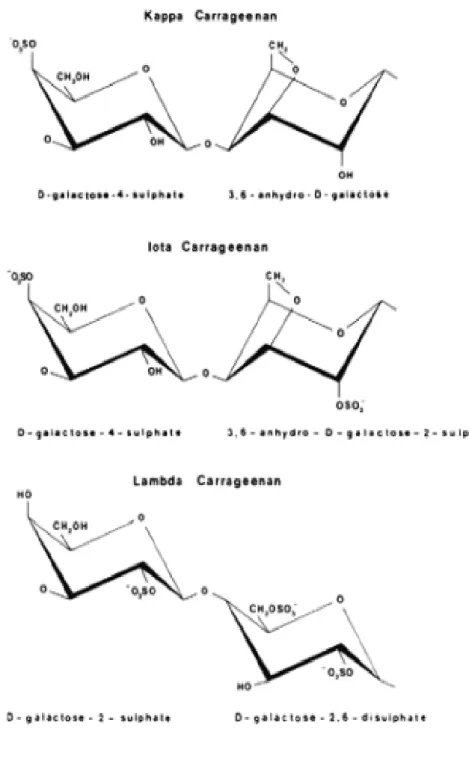
A unidade repetitiva dissacarídica das carragenanas é formada de (ĺ3)-ȕ
-D-galactopiranose (Unidades G) e (ĺ4)-Į-D-galactopiranose (Unidades D) ou (ĺ4)-3,6
anidro-Į-D-galactopiranose (Unidades DA). Além de galactose, outros resíduos de
carboidratos (como por exemplo xilose, glicose e ácidos urônicos) e substituintes
(como por exemplo sulfato, metil e piruvato) podem estar presentes em preparações
de carragenanas (VAN DE VELDE & RUITER, 2002).
As carragenanas naturais são uma mistura de polissacarídeos, fazendo com
que o termo unidade dissacarídica repetitiva passe a ser útopico (VAN VELDE,
PEREIRA, & ROLLEMA, 2004). Os três principais tipos de carragenanas são Iota(L),
Kappa (N) e Lambda (O) (Figura 02). As duas primeiras contêm unidades de 3,6
anidrogalactose e são polímeros formadores de gel e a última contém apenas
unidades de galactose e atua como um agente espessante. Essa diferença resulta
do fato de que as unidades DA da Iota (L) e Kappa (N) possuem conformação 1C4,
enquanto que as unidades D da Lambda (O) não possui essa conformação. A
conformação 1C4 das unidades 3,6-anidrogalactopiranosil nas carragenanas Iota(L)
e Kappa (N) forma uma estrutura secundária helicoidal, que é essencial para as
Figura 02. Estrutura das unidades dissacarídicas repetitivas dos três principais tipos de
carragenanas:Kappa(N), Iota(L) e Lambda (O).
1.3 - Radicais Livres
Os radicais livres são átomos ou moléculas altamente reativas, que contém
número ímpar de elétrons em sua última camada eletrônica. O não-emparelhamento
do elétron da última camada confere alta reatividade a esses átomos ou moléculas
(FERREIRA & MATSUBARA, 1997).
Os radicais livres são formados em sistemas biológicos por vários compostos
endógenos e exógenos em reações de óxido-redução (FUNG & ZHANG, 1990;
FERREIRA & MATSUBARA, 1997). A maioria deles é derivada do metabolismo do
oxigênio (BANERJEE et al., 2005) e são denominados de ERMOs (Espécies
Reativas do Metabolismo do Oxigênio) ou ROS (Espécies Reativa do Oxigênio, do
inglês Reactive Oxygen Species). As ERMOs estão sendo constantemente formadas
nas células, cerca de 3 a 5% do oxigênio consumido são convertidos em radicais
livres de oxigênio (Tabela 02). Alguns são produzidos como derivados acidentais de
reações enzimáticas normais que escapam do sitio ativo de enzimas que contêm
metais durante as reações de oxidação. Outros, como o peróxido de hidrogênio, são
produtos fisiológicos de oxidases nos peroxissomas. Na resposta inflamatória ocorre
a produção deliberada de radicais livres tóxicos. Alguns agentes externos, como
drogas, radiação natural, poluentes do ar e outras substâncias químicas, também
podem aumentar a formação de radicais livres na célula (SMITH, MARKS,
Tabela 02. Espécies reativas de oxigênio (ROS)*
Espécie Nome
O2•- ânion radical superóxido
H2O2 peróxido de hidrogênio
HO• radical hidroxila
LOO• radical peroxila derivado de lipídio LO• radical alcoxila derivado de lipídio
R• radical alquila
ROO• radical peroxila (poluentes/drogas) RO• radical alcoxila (poluentes/drogas)_
Ar• + cátion radical (poluentes/drogas aromática) Ar• - ânion radical (poluente/drogas aromáticas)
1O
2 oxigênio singlete (1¨gO2)
HClO ácido hipocloroso
*Adaptado de AUGUSTO, 2006
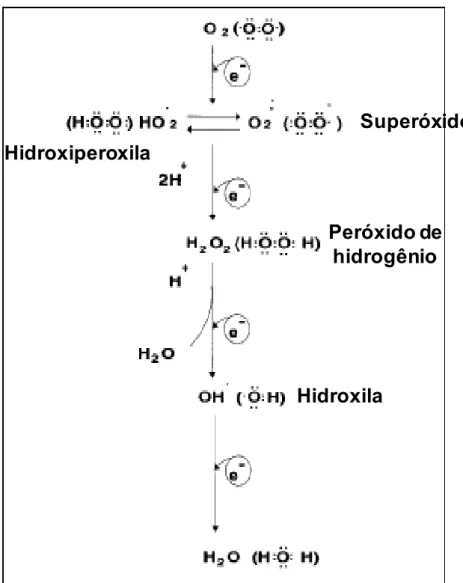
Em condições fisiológicas do metabolismo celular aeróbio, o O2 sofre redução
tetravalente devido ao recebimento de quatro elétrons, resultando na formação de
H2O conforme mostra a figura 03. Durante esse processo são formados
intermediários reativos, como os radicais superóxidos (O2-), hidroxiperoxila (HO2•) e
hidroxila (OH•) e o peróxido de hidrogênio (H2O2) (SMITH, MARKS, LIEBERMAM,
Superóxido
Hidroxila
Peróxido de
hidrogênio
Hidroxiperoxila
Figura 03 – Redução mitocondrial tetravalente do oxigênio molecular (O2) a água (H2O). (FERREIRA
& MATSUBARA, 1997).
O peróxido de hidrogênio (H2O2) apesar de não ser um radical livre por não
apresentar elétrons desemparelhados na última camada, é considerado um
metabólito do oxigênio extremamente deletério, pois participa da reação que produz
OH• (Figura 03) (FERREIRA & MATSUBARA, 1997). O H2O2 é lipossolúvel e pode
se difundir através das membranas e gerar radicais OH em locais que contenham
hidrogênio na reação não-enzimática de Fenton, como mostrado na figura 04
(SMITH, MARKS, LIEBERMAM, 2007).
H
2O
2Figura 04 – Geração do radical hidroxila pela reação não-enzimáttica de Fenton. As ERMOs estão
representadas em laranja. Adaptado de SMITH, MARKS, LIEBERMAM, 2007.
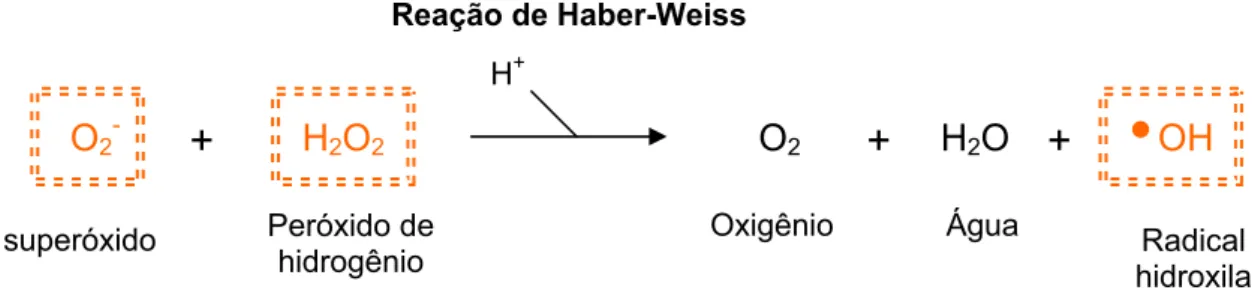
Os radicais superóxidos e hidroxilas são os dois mais representativos
radicais livres. Nas reações de oxidação celular o radical superóxido é normalmente
formado primeiro, pois ele resulta da primeira redução do O2 (FERREIRA &
MATSUBARA, 1997), seu efeito pode ser ampliado porque ele produz outros tipos
de radicais livres, que causam lesão celular e formam agentes oxidantes (ZHANG,
LI, ZHOU, LU, XU, & LI, 2003). Esse radical possui uma solubilidade limitada em
lipídeos e não pode se difundir para muito longe, entretanto, ele pode gerar os
radicais hidroxila e hidroperoxila mais reativos por reagir não-enzimaticamente com
o peróxido de hidrogênio na reação de Haber-Weiss, como demonstra a figura 05
(SMITH, MARKS, LIEBERMAM, 2007). Peróxido de
hidrogênio
Fe2+
HO
-OH
+
Íon hidroxila Radical
hidroxila
Reação de Fenton
Figura 05 – Geração do radical hidroxila pela reação não-enzimáttica de Haber-Weiss. As ERMOs
estão representadas em laranja. Adaptado de SMITH, MARKS, LIEBERMAM, 2007.
O radical hidroxila (OH•) é considerado a ERMO mais reativa em sistemas biológicos (CHEESEMAN &SLATER, 1993). A combinação extremamente rápida do
OH• com metais pesados ou outros radicais no próprio sítio onde foi produzido
confirma sua alta reatividade. O radical hidroxila pode ainda inativar várias proteínas
(como enzimas e proteínas da membrana celular) ao oxidar seus grupos sulfidrilas
(-SH) a pontes dissulfetos (S-S) (DAVIES, 1987; FERREIRA & MATSUBARA, 1997;
DUNCAN & HEALES, 2005) e iniciar reações em cadeia que formam peróxidos
lipídicos e radicais orgânicos que são adicionados diretamente aos compostos
(SMITH, MARKS, LIEBERMAM, 2007).
1.3.1 - Peroxidação Lipídica
Todos os componentes celulares são suscetíveis à ação das espécies
reativas do metabolismo do oxigênio, porém as membranas são as mais atingidas
pela peroxidação lipídica, que acarreta alterações em suas estrutura e
permeabilidade, levando a perda da seletividade na troca iônica e liberação do
conteúdo de organelas, formando produtos citotóxicos (como o malonildialdeído),
culminando com a morte celular (FERREIRA & MATSUBARA, 1997). H+
O2 H2O OH
O2- H2O2
superóxido Peróxido de hidrogênio
+
+
+
Oxigênio Água Radical hidroxila
Segundo Ferreira & Matsubara (1997), a lipoperoxidação é uma reação em
cadeia, representada pelas etapas de iniciação, propagação e terminação (figura
06). Ela é iniciada por algumas espécies químicas capazes de abstrair um átomo de
hidrogênio do carbono metileno na cadeia lateral, como o OH• ou LO• (radical alcoxila), deixando o átomo de carbono do lipídeo com um elétron desemparelhado,
resultando em radical lipídico (L•) (FERREIRA & MATSUBARA, 1997; GRAY, 1978). Na primeira etapa da propagação o radical lipídico (L•) formado na etapa de iniciação reage com o O2 formando o radical peroxila (LOO•), que, por sua vez, abstrai o
hidrogênio das cadeias dos ácidos graxos poliinsaturados adjacentes, numa
segunda etapa da propagação, formando novamente o radical lipídico (L•) e hidroxiperóxidos lipídicos (LOOH) (HALLIWELL & CHIRICO, 1993; FERREIRA &
MATSUBARA, 1997). O término da lipoperoxidação ocorre quando os radicais L. e LOO. produzidos nas etapas anteriores se propagam até destruírem a si próprios. (FERREIRA & MATSUBARA, 1997). Com o término das reações de propagação
ocasionado pelo esgotamento dos substratos, formam-se produtos finais estáveis e
não-reativos, os principais compreendem: derivados da decomposição de
hidroperóxidos, álcoois, aldeídos, cetonas, ésteres e outros hidrocarbonetos como
mostra as etapas de terminação da figura 06.
Figura 06 –Iniciação, propagação e terminação da lipoperoxidação. LO.: radical alcoxila, L.: radical
não-1.3.2 – Ação patológicas dos radicais livres
Os radicais oxigênios produzidos durante o estresse oxidativo podem induzir
alguns danos oxidativos para biomoléculas tais como, carboidratos, proteínas e
lipídios (KELLOG & FRIDOVICH, 1975; LAI & PIETTE, 1997; WISEMAN &
HALLIWELL, 1996; BANERJEE et al., 2005). Esse estresse é caracterizado pelo
desequilíbrio entre o consumo de glutationa reduzida (GSH) e a produção de
glutationa oxidada (GSSG). O excesso de GSSG resulta em um ambiente mais
oxidante, que favorece a formação de pontes dissulfeto (-SS-) nas proteínas
portadoras de grupamento tiol (-SH). Os radicais livres oxidam estas proteínas
aumentando o número de pontes dissulfeto, com prejuízo de suas funções
(FERREIRA & MATSUBARA, 1997). Segundo Lee & Shin (2003) os metais pesados
podem gerar radicais livres e espécies reativas do oxigênio (ROS) que podem
produzir estresse oxidativo.
Os radicais livres podem estar envolvidos no desenvolvimento de diversas
doenças (tabela 03). A aterosclerose é uma doença complexa multifatorial
(FERREIRA & MATSUBARA, 1997) que acredita-se ser inicializada pela
modificação, por radicais livres, das lipoproteínas de baixa densidade (LDL) na
parede do vaso sanguíneo resultando na formação da lesão aterosclerótica
(WADDINGTON, 2003). Esses radicais oxidam as LDLs e estimulam a internalização
destas nos macrófagos, que se convertem então em células espumosas,
contribuindo para a formação da placa de ateroma (FERREIRA & MATSUBARA,
1997) e induzindo uma reação inflamatória crônica na parede arterial, iniciada pelo
recrutamento de macrófagos, que é seguido pela estimulação de células T e B
(WITTENSTEIN et al., 2002) (figura 07). A diabetes é um termo geral que se refere
(OBERLEY, 1988), hiperglicemia (OBERLEY, 1988; VARVAROVSKÁ et al., 2004) e
aumento do estresse oxidativo (COLLINS et al., 1998). Em diabéticos, o aumento do
estresse oxidativo é observado pela elevada concentração de produtos da
peroxidação lipídica no plasma. Mudanças transitórias na atividade de enzimas
antioxidantes (como SOD, CAT e GSH-Px) são encontradas em conjunção com o
aumento dos níveis de glicose no plasma em casos onde o controle da diabetes é
deficiente, indicando que estas enzimas são inibidas pela hiperglicemia (COLLINS,
1998). Nos rins, a exposição a altas concentrações de oxalato resulta na produção
de radicais livres, que induz ao estresse oxidativo. Esses radicais produzidos
interagem com o epitélio danificando a membrana renal (VEENA et al., 2006).
Existem fortes evidências que a disfunção tubular ou os danos é o passo inicial
envolvido na formação dos cristais de oxalato de cálcio e subseqüente patologia
(VEENA et al., 2006; GRASES et al., 1998).
- formação de células espumosas - recrutamento e adesão de monócitos - inibição da motilidade de macrófagos - proliferação de células do músculo liso - citotoxicidade
Células do músculo liso Células endoteliais
Macrófago
Figura 07 – Interação de ROS com células-sinalizadoras e desenvolvimento da lesão aterosclerótica.
Tabela 03. Alguns Estados Patológicos Associados a Danos por Radicais Livres*.
Aterogênese Distúrbios cerebrovasculares Bronquite enfisematosa Dano por isquemia/reperfusão Distrofia muscular tipo-Duchenne Distúrbios neurodegenerativas
Gestação/ pré-eclampsia Esclerose lateral amiotrófica (Doença de Lou Gehrig) Câncer cervical Doença de Alzheimer
Doença hepática induzida por álcool Síndrome de Down
Hemodiálise Derrame seguido de dano por isquemia/reperfusão Diabetes Doenças de Oxphos (desordens do DNA mitocondrial)
Insuficiência renal aguda Esclerose múltipla Envelhecimento Doença de Parkinson Fibroplasia retrolental
*(SMITH, MARKS, LIEBERMAM, 2007)
Embora as espécies reativas de oxigênio possam ser mediadoras de
doenças, sua formação nem sempre é deletéria, como exemplo temos sua ação na
defesa contra a infecção. Os neutrófilos são estimulados a produzirem espécies
reativas com a finalidade de destruir o microorganismo (FERREIRA & MATSUBARA
1997). Esse estímulo provoca um rápido consumo de O2, chamado de explosão
respiratória, que é uma das principais fontes de superóxido, peróxido de hidrogênio,
radical hidroxila, dentre outros (SMITH, MARKS, LIEBERMAM, 2007). Segundo
Dore et al (2007) vários tipos de inflamação tecidual são mediadas por metabólitos
reativos do oxigênio. A mais provável fonte desses agentes oxidantes são os
leucócitos (como, neutrófilos, monócitos, macrófagos e eosinófilos) que invadem o
tecido. A produção enzimática de espécies reativas do oxigênio por células
inflamatórias pode contribuir para a patofisiologia de leucócitos dependentes do
processo inflamatório.
1.3.3 - Sistema de defesa contra radicais livres
Os radicais livres são muito agressivos, mas as células têm mecanismos de
defesa capazes de inativar, bloquear ou “varrer” esses agentes reativos. Em
redutores a célula possui um sistema de defesa que pode atuar em duas linhas.
Uma delas atua como detoxificadora do agente antes que ele cause lesão e é
constituída pela glutationa reduzida (GSH), superóxido dismutase (SOD), catalase
(CAT), glutationa peroxidase (GSH-Px) e vitamina E. A outra linha tem a função de
reparar a lesão ocorrida, sendo constituída pelo ácido ascórbico, pela glutationa
redutase (GSH-Rd) e pela GSH-Px, entre outros. A maior parte destes agentes
antioxidantes está no meio intracelular, com exceção da vitamina E que é um
antioxidante estrutural da membrana (FERREIRA & MATSUBARA, 1997). A SOD
catalisa a dismutação do superóxido e a catalase a conversão do peróxido de
hidrogênio a H2O e O2, enquanto a GSH peroxidase transfere elétrons da GSH para
reduzir o peróxido à água e GSSG. A glutationa oxidada produzida (GSSG) é
reduzida posteriormente a GSH pela glutationa redutase utilizando NADPH como
cofator, como mostra a figura 08.
Figura 08 – Enzimas da defesa antioxidante (PROCTOR & REYNOLDS, 1984).
Várias drogas inativadoras de radicais livres têm seu mecanismo de ação
bem conhecido. O alopurinol tem estrutura química semelhante à da superóxido
deferoxamina e o EDTA ligam-se ao ferro, impedindo que este participe da síntese
da hidroxila, e o manitol inativa a hidroxila (FU & JIAO, 1995). A eficácia dos
inativadores tem sido comprovada em certas circunstâncias, tanto em tratamentos
clínicos quanto cirúrgicos. A maioria das soluções preservadoras de órgãos para
transplantes contém um inativador de oxirradicais (HOWDEN & JABLONSKI, 2000).
Há várias décadas os cirurgiões cardíacos usam o manitol para preservar a
integridade dos rins durante o período em que a circulação sangüínea é mantida fora
do corpo (SCHANAIDER, A. 2000). Vale lembrar que o manitol é um açúcar derivado
a partir da manose. Hoje já se sabe que o manitol inativa o radical hidroxila, o que
leva a uma evolução pós-operatória mais favorável, expressada pela melhor
estabilidade da dinâmica circulatória (pressão, fluxo e outros fatores).
Recentemente, o potencial antioxidante dos polissacarídeos sulfatados
extraídos de algas vem sendo avaliado. Veena at al (2006; 2007), Zhang, et al
(2003), demonstraram o melhoramento de falhas renais crônicas em modelos
experimentais com o uso desses compostos. Em 1997, Anggadiredja et al
estudando as algas Sargassum polycystum (Phaeophyta) e Laurencia obtusa
(Rhodophyta) demonstraram que estas apresentavam uma potencial atividade
antioxidante in vitro. Nos estudos feitos por Zhang et al (2003) com polissacarídeos
sulfatados da alga Porphyra haitanesis foi observado um significante efeito
antioxidante in vitro. Qi et al em 2005 observaram forte atividade antioxidante de
polissacarídeos sulfatados extraídos da alga verde Ulva pertusa Kjellm. Devido aos
seus altos potenciais antioxidantes, os polissacarídeos sulfatados de algas poderão
ser usados no combate aos danos causados por radicais livres, bem como, nas
2. OBJETIVOS
2,1 – OBJETIVO GERAL:
9 Determinar o potencial antioxidante das fucanas de algas marinhas
marrons (Fucus vesiculosus e Padina gymnospora) e galactanas de
algas marinhas vermelhas (carragenanas O,N e L).
2.2 – OBJETIVOS ESPECÍFICOS:
9 Análise química dos polissacarídeos estudados;
9 Determinação in vitro da taxa de inibição por fucanas e galactanas
contra a formação dos radicais superóxidos e hidroxilas;
9 Determinação in vitro da taxa de inibição da peroxidação lipídica
3. MATERIAL E MÉTODOS
3.1 - Material Biológico
3.1.1 - Algas
Foram utilizados os seguintes polissacarídeos:
x Fucoidan da alga marinha marrom Fucus vesiculosus, comercialmente
adquirido (Sigma Aldrich, EUA).
x Carragenanas foram adquiridas da Sigma Aldrich, EUA, conforme
especificações abaixo:
Carragenana Iota (Tipo V, C-3799) - extraída da alga Eucheuma
spinosa;
Carragenana Kappa (Tipo III, C-1263) - extraída da alga Eucheuma
cottonii;
Carragenana Lambda (Tipo VI, C-3889) - extraída das algas Gigartina
acicularis e Gigartina pisillata.
x Frações de fucanas F0,5 e F1,1 foram extraídas e purificadas da alga marrom
Padina gymnospora por Silva et al., 2005. O esquema de extração está
Figura 09 - Esquema de extração de polissacarídeos de Padina gymnospora.
De acordo com Silva et al, 2005
3.1.2 - Animais
Quatro ratos da linhagem Wistar com três meses de idade obtidos no biotério
do Departamento de Bioquímica/UFRN foram utilizados na peroxidação lipídica e
mantidos em gaiolas individuais, com livre acesso à comida e água e em condições
3.2 - Outros materiais
¾ Ácido sulfúrico, Peróxido de hidrogênio a 30%, Fosfato de sódio monobásico
e dibásico, Fosfato de potássio adquiridos da Cromato Produtos Químicos LTDA
(Diadema, SP, Brasil).
¾ Bacto-gelatin adquirido da Difco Laboratories (Detroit, MI, USA).
¾ Cloreto de bário da Reagen Quimibrás Industrias Químicas S. A. (Rio de
Janeiro, RJ, Brasil).
¾ Nitroblue tetrazolium, Metasulfato de fenazina, NADH (forma reduzida),
Salicilato de sódio, Ácido ascórbico, Ácido tiobarbitúrico (TBA), da Sigma-Aldrich
(USA).
¾ Tris, Ácido tricloroacético (TCA), da Vetec Química Fina LTDA (Rio de
Janeiro, RJ, Brasil).
¾ Todos os demais reagentes utilizados foram da melhor qualidade disponível.
3.3 - Aparelhos
Além dos aparelhos habitualmente empregados em nosso laboratório
podemos citar:
¾ Agitador orbital, modelo 255, FANEM Ltda (São Paulo, SP, Brasil)
¾ Espectrofotômetro U 2000 da Hitachi (Tóquio, Japão)
¾ Medidor de pH, Orion Research model 701 A/ digital lonalyzer (Cambridge,
MA, EUA);
¾ Bomba Peristáltica Bio Rad Laboratories (Hercules, CA, EUA);
¾ Banho-maria, FANEM Ltda. (São Paulo, SP, Brasil);
¾ Centrífuga refrigerada CR21, Hitachi Koki Co. Ltda (Tóquio, Japão);
3.4 - Métodos
3.4.1 - Análise Química
3.4.1.1 - Açúcares totais
O conteúdo de açúcares totais foi determinado pelo método do fenol/ácido
sulfúrico de acordo com Dubois et al. (1956), usando como padrão L-fucose e
galactose, submetidas às mesmas condições das amostras em estudo. As leituras
foram realizadas a 490 nm.
3.4.1.2 - Sulfato
O teor de sulfato total foi determinado por turbidimetria após hidrólise ácida
dos polissacarídeos (HCl 6N, 6 horas, 100ºC) pelo método da gelatina-bário
(DODGSON & PRICE,1962). O sulfato de sódio (1 mg/mL) foi utilizado como padrão
sendo submetido às mesmas condições das amostras em estudo. As leituras foram
realizadas a 500 nm.
3.4.1.3 - Proteína
O conteúdo de proteína foi determinado utilizando-se o reagente Coomassie
brilliant blue, segundo o método de Spector (1978), utilizando albumina bovina como
3.4.2 - Determinação da atividade antioxidante
3.4.2.1 - Radicais Superóxidos
Os radicais superóxidos (ZHANG, YU, LI, ZHANG, XU, & LI, 2003) foram
gerados em 3 mL de Tris-HCl (16 mM, pH 8,0), que continha 78 PM de NADH (forma
reduzida), 50 PM de Nitroblue Tetrazolium, 10 PM de Metasulfato de fenazina e
concentrações variadas de polissacarídeos (0,067; 0,133; 0,2 e 0,267 mg/mL). A
reação de cor dos radicais superóxidos e Nitroblue Tetrazolium foi detectada por
monitoramento da absorbância a 560 nm. O controle não tinha NADH, e ele foi
substituído pelo tris-HCl.
3.4.2.2 - Radicais Hidroxilas
Os radicais hidroxilas (ZHANG, YU, LI, ZHANG, XU, & LI, 2003) foram
gerados por um método modificado de Smirnoff e Cumners (1989) em 3 mL de
fosfato de sódio (150 mM, pH 7,4), que continha 10 mM de FeSO4.7H2O, 10 mM de
EDTA, 2 mM de salicilato de sódio, 200 PL de H2O2 a 30 % e concentrações
variadas de polissacarídeos (0,067; 0,133; 0,2 e 0,267 mg/mL). A solução foi
incubada a 37°C por 1 h, e a atividade detectada por monitoramento da absorbância
à 510 nm. No tubo controle o H2O2 foi substituído pelo tampão fosfato.
3.4.2.3 - Peroxidação lipídica
A extração de microssomos hepáticos de ratos Wistar e os efeitos dos
polissacarídeos na peroxidação lipídica foram conduzidos de acordo com LIU et al.
(1997). Os fígados foram retirados e pesados após os animais serem sacrificados, e
centrifugada a 12000 x g durante 20 min a 4ºC. O precipitado foi descartado e o
sobrenadante foi submetido a uma segunda centrifugação a 105.000 x g durante 60
min a 4ºC. O precipitado foi lavado com solução de KCl 0,15 M gelada. Foi feita uma
solução de 300 Pg/mL, armazenada a -20ºC. Os microssomos (300 Pg/mL) foram
incubados a 37°C por 60 min com concentrações variadas de polissacarídeos
(0,286; 0,572; 0,858 e 1,144 mg/mL), 10 PM de FeSO4 e 0,1 mM de ácido ascórbico
em 1,0 mL de solução tampão de fosfato de potássio (0,2 M, pH 7,4). A reação foi
parada com 1,0 mL de ácido tricloroacético (TCA) a 20% (v/v) e 1,5 mL de ácido
2-tiobarbitúrico (TBA) a 0,67% (wt/vol) em sucessão, e a solução então aquecida a
100°C por 15 min. A cor da reação do complexo MDA-TBA foi detectada por
monitoramento da absorbância a 532 nm. No controle não foi adicionado FeSO4 e
ácido ascórbico e no padrão foi utilizado malonildialdeído, no lugar da amostra. In
vivo, o malonildialdeído (MDA) é um aldeído formado durante a quebra final do
peróxido proveniente da degradação da estrutura dos ácidos graxos insaturados
(DUAVY, 2002), e pode ser mensurado como sendo um indicador de oxidação
lipídica (SEVANIAN & HOUCHSTEIN, 1985), no qual o MDA reage com o ácido
tiobarbitúrico originando estruturas tautoméricas correspondentes a formação do
Figura 10 - Reação do MDA com TBA e estruturas tautoméricas correspondentes à formação do
pigmento rosa. (VALENZUELA, 1991).
3.4.2.4 - Taxa de inibição
A percentagem da atividade antioxidante das amostras foi avaliada de acordo
com a seguinte fórmula: Taxa de Inibição (%) = (A0 - A)/(A0 - Ae) x 100%, onde A0 é
a absorbância do sistema gerador de radicais livres, A é a absorbância da amostra
teste, Ae é a absorbância do controle (ZHANG, YU, LI, ZHANG, XU, & LI, 2003).
3.4.2.5 – Determinação do IC50
Os valores do IC50, que é a concentração de amostra necessária para “varrer”
(scavenger) 50% dos radicais livres ou prevenir a peroxidação lipídica foram
calculados por equações de regressão linear obtidas pelas concentrações das
amostras e a taxa de inibição de cada sistema.
3.4.3 Métodos Estatísticos
Todos os dados foram expressos com média ± desvio padrão de triplicatas, e
o teste ANOVA foi usado para a análise estatística. Os valores foram considerados
4. RESULTADOS
4.1 - Análises Químicas
Os percentuais de açúcares totais, sulfato e proteínas das frações contendo
os polissacarídeos analisados estão mostrados na tabela 04.
Os resultados dessas análises demonstraram baixa contaminação protéica no
fucoidan (0,80 %) e na fração F0,5 (0,90%), e também nas carragenanas kappa
(1,10 %) e iota (1,50 %), enquanto na F1,1 (2,56 %) e na carragenana lambda
(2,00%) essa contaminação foi maior. Para a dosagem de açúcares totais o fucoidan
(55,20 %), F0,5 (80,24 %) e F1,1 (70,10 %) apresentaram mais de 50% de açúcar na
amostra, o mesmo foi observado para as carragenanas lambda (64,26 %), kappa
(72,00 %) e iota (65,98 %). A concentração de sulfato determinada pelo método
turbidimétrico foi observada em maior quantidade para o fucoidan (44,10 %) e para a
carragenana lambda (33,38 %), seguidas da F1,1 (27,57 %) e da carragenana iota
(27,60 %). A F0,5 (18,40 %) e a carragenana kappa (17,90 %) apresentaram os
graus de sulfatações menores com relação às outras amostras.
Tabela 04. Componentes Químicos dos Polissacarídeos sulfatados (%)
Polissacarídeos Açúcares totaisa Sulfatob Proteínasc
Fucoidan 55,20±1,43 44,10±0,16 0,80±0,39
F 0,5 80,24±3.23 18,40±0,28 0,90±0,83
F 1,1 70,10±2,02 27,57±0,18 2,56±0,24
C-lambda 64,26±2,36 33,38±0,06 2,00±0,45
C-kappa 72,00±3,66 17,90±0,05 1.10±0,31
C-iota 65,98±0,52 27,60±0,12 1,50±0,55
a Dubois et al (1956)
4.2 - Atividade Antioxidante
4.2.1 - Radicais superóxidos
Os radicais superóxidos foram gerados em um sistema metasulfato de
fenazina-NADH. As figuras 11 e 12 mostram o efeito de “varredura” de radicais
superóxidos por polissacarídeos sulfatados e os seus IC50 estão demonstrados na
tabela 05. Todos eles mostraram atividade “varredora” de radicais superóxidos.
Dentre as fucanas, o fucoidan foi capaz de inibir a produção de radicais superóxidos
em quase 100% já na concentração de 0,133 mg/mL, apresentando uma significante
atividade “varredora” para esses radicais (p<0,001), seu IC50 foi atingindo em 0,058
mg/mL, enquanto nas frações F0,5 e F1,1 de P. gymnospora a taxa de inibição ficou
em aproximadamente 54 e 50 % na concentração de 0,267 mg/mL, respectivamente,
apresentando IC50 de aproximadamente 0,243 mg/mL para as duas frações (figura
11 e tabela 05).
Figura 11.Efeito Inibitório de Radicais Superóxidos por Fucanas de Padina gymnospora (F0,5 e
Tabela 05. Valores dos IC50 dos radicais superóxidos (mg/mL)
Polissacarídeos Radicais
Superóxidos
Fucoidana 0,058±0,011
F 0,5a 0,243±0,014
F 1,1a 0,243±0,013
C-lambdab 0,046±0,001
C-kappab 0,112±0,003
C-iotab 0,332±0,080
a Fucanas b Galactanas
Para as galactanas, a carragenana lambda apresentou melhor atividade,
atingindo a taxa de inibição de aproximadamente 100% na concentração de 0,133
mg/mL e o IC50de 0,046 mg/mL (p<0.001), enquanto a taxa máxima de inibição das
carragenanas kappa e iota foi de aproximadamente 93 e 62%, respectivamente, na
concentração de 0,267 mg/mL. Apesar da alta taxa de inibição da kappa o seu IC50
só foi atingindo na concentração de 0,112 mg/mL, já a iota apresentou um IC50 de
Figura 12.Efeito Inibitório de Radicais superóxidos por Carragenanas lambda (O), Kappa (N) e Iota (L)
4.2.2 - Radicais hidroxilas
Os radicais OH• Por apresentarem pequena capacidade de difusão, são os mais reativos na indução de lesões celulares e por isto merecem especial atenção.
Os resultados obtidos para a inibição da formação de radicais OH. (hidroxilas) demonstraram que todas as amostras analisadas tiveram um moderado efeito na
inibição da formação destes radicais (figuras 13 e 14), exceto a F0,5, que
apresentou uma curva descendente, possivelmente estimulando a formação desses
radicais e não a sua inibição (figura 13). Sugere-se que tal comportamento seja
decorrente da presença de ácidos algínicos contaminantes da fração, que são
polissacarídeos não sulfatados. Das fucanas, o fucoidan inibiu a formação de
radicais OH. (hidroxilas) em 55% na concentração de 0,267 mg/mL e o seu IC50 foi
concentração de 0,267 mg/mL, apresentando o IC50 de 0,353 mg/mL (Figura 13 e
tabela 06).
Figura 13. Efeito Inibitório de Radicais Hidroxilas por Fucanas de Padina gymnospora (F0,5 e F1,1) e
fucoidan
Tabela 06. Valores dos IC50 dos radicais hidroxilas (mg/mL)
Polissacarídeos Radicais
Hidroxilas
Fucoidana 0,157±0,005
F 0,5a n. d.
F 1,1a 0,353±0,036
C-lambdab 0,357±0,120
C-kappab 0,335±0,016
C-iotab 0,281±0,072
n. d. (não determinado)
Os resultados obtidos com carragenanas lambda, kappa e iota se
apresentaram de forma semelhante aos obtidos com fucanas. Suas taxa de inibição
foram de: 41, 36 e 36 % na concentração de 0,267 mg/mL e os IC50 de 0,357; 0,335
e 0,281 mg/mL, respectivamente (figura 14 e tabela 06).
Figura 14. Efeito Inibitório de Radicais Hidroxilas por Carragenanas lambda (O), Kappa (N) e Iota (L)
4.2.3 - Peroxidação lipídica
O ensaio da peroxidação lipídica foi feito em um sistema de Fe2+/vitamina C. A formação de radicais livres nesse sistema foi inibida por todas as amostras de
polissacarídeos (figuras 15 e 16). Para a taxa de inibição de fucanas, o fucoidan
apresentou uma melhor inibição da peroxidação lipídica (70 % na concentração de
0,572 mg/mL) e seu IC50 foi de 1,250 mg/mL (p<0,001). Já as frações F0,5 e F1,1 as
respectivamente, e seus IC50 2,753 e 2,341 mg/mL, respectivamente (figura 15 e
tabela 07).
Figura 15. Inibição da Peroxidação Lipídica de microssomos de fígados de ratos pelos
polissacarídeos de algas: fucoidan e as frações F 0,5 e F 1,1 de P. gymnospora
Tabela 07. Valores dos IC50 da peroxidação lipídica (mg/mL)
Polissacarídeos Peroxidação Lipídica
Fucoidana 1,250±0,174
F 0,5a 2,753±0,051
F 1,1a 2,341±5,975
C-lambdab 2,697±0,267
C-kappab 0,323±0,011
C-iotab 0,830±0,063
Para as galactanas a carragenana kappa apresentou melhor atividade,
atingindo a taxa de inibição de aproximadamente 100% na concentração de 0,572
mg/mL e o IC50de 0,323 mg/mL (p<0.001) Seguida da kappa, a iota apresentou uma
forte atividade inibitória apresentando uma taxa de 94 % de inibição na concentração
de 1,144 mg/mL e seu IC50 de 0,830 mg/mL. Já a lambda apresentou um taxa
máxima de inibição de 41 % na concentração de 1,144 mg/mL e o IC50 de 2,697
mg/mL (figura 16 e tabela 07).
Figura 16. Inibição da Peroxidação Lipídica de microssomos de fígados de ratos pelos
5. DISCUSSÃO
Nos últimos anos, diversos trabalhos têm dado ênfase ao isolamento e
identificação de compostos bioativos, em especial, aos polissacarídeos sulfatados,
que ocorrem em uma grande variedade de algas marinhas (ROGER, et al., 2002).
Muitos trabalhos sobre fucanas, que são polissacarideos extraídos de algas
marinhas, relatam que tais compostos apresentam, em geral, contaminação com
proteínas. Essa contaminação provavelmente é devido aos polissacarideos estarem
ligados uns aos outros por proteínas (KLOAREG & QUATRANO, 1988). As análises
do teor de proteínas realizadas para todas as amostras neste estudo demonstram
que este variou de 0,80 a 2,56%. Esses resultados estão de acordo com os da
literatura utilizando a mesma metodologia. Pesquisas realizadas anteriormente com
a alga Padina gymnospora mostraram uma contaminação por proteína variando de
1,6 - 7,5% (SILVA et al, 2005). Já as fucanas A e B da alga Spatoglossum
schröederi mostraram uma contaminação da ordem de 5,8 e 1%, respectivamente
(LEITE, et al., 1998, ROCHA, 2002).
Para as atividades biológicas desempenhadas pelas fucanas, a presença de
sulfato é uma característica importante, juntamente com a conformação estrutural.
As análises de sulfato das fucanas e galactanas obitidas neste trabalho mostraram
que o sulfato variou de 17,90 a 44,10%, estando de acordo com os resultados
citados na literatura, que estão compreendidos entre 15 e 40% (ROBERTS &
QUEMENER, 1999, MEDEIROS, 2003, SILVA, 2005). Haroun-Bouhedja et al (2000),
examinaram através dos testes de atividade anticoagulante e antiproliferativa o
papel do grupo sulfato presente em fucanas extraídas da alga Ascophyllum
sulfatação. Eles observaram que as duas atividades dependiam do conteúdo de
sulfato e que o efeito diminuia com a redução do grau de sulfatação. Em estudos
feitos com o polissacarídeos da alga Porphyra yezoensis foi relatado que o grupo
sulfato provavelmente contribui para a estimulação de macrófagos (YASHIZAWA et
al, 1995).
Os radicais livres são gerados por substâncias oxidantes e são moléculas
instáveis, pelo fato de seus átomos possuírem um número ímpar de elétrons. O
radical superóxido é uma espécie altamente tóxica, gerado por numerosas reações
biológicas e fotoquímicas (YUAN et al. 2005). Nos estudos feitos por Zhang, Li,
Zhou, Lu, Xu e Li (2003) com porfirano, polissacarídeo extraído da alga vermelha
Porphyra haitanesis, a fração F3, que teve um maior conteúdo de sulfato,
apresentou uma forte atividade “varredora” de radicais superóxidos, enquanto as
frações F1 e F2 tiveram uma fraca atividade, pois apresentaram menos sulfato. Nos
estudos feitos por Qi et al (2005), as frações do Ulvan (polissacarídeo extraído da
alga verde Ulva pertusa Kjellm), que têm quantidades de sulfato semelhantes entre
si, apresentaram forte atividade “varredora” de radicais superóxidos, apresentando
um IC50 de 0,0221 mg/mL. Resultado semelhante foi encontrado por Wu et al (2006),
onde o IC50 do polissacarídeo de Aloe vera var. chinensis foi de 0,022mg/mL. Em
nosso estudo os menores valores para o IC50 foram obtidos com o fucoidan e com a
carragenana lambda, 0,058 e 0,046 mg/mL, respectivamente. Isto demonstra que
existe uma variabilidade na ação destes compostos e que o teor de sulfato influencia
na sua ação. Os nossos resultados também estão de acordo com os encontrados
por Yuan et al. (2005), mostrando que o conteúdo de sulfato pode estar
influenciando diretamente na inibição da formação de radicais superóxidos já que o
(2002) obtiveram resultados similares aos nossos utilizando o fucoidan de Fucus
vesiculosus. A relação entre estrutura e função de polissacarídeos foi analisada por
Yuan et al. (2005). Eles observaram que os polímeros super sulfatados, acetilados e
fosforilados tinham diferentes ações, sendo que, os acetilados e os super sulfatados
tiveram um forte efeito “varredor” de radicais superóxido, enquanto os polímeros
fosforilados apresentaram fraco efeito .
Entre as espécies reativas do metabolismo do oxigênio, o radical hidroxila é o
mais reativo e induz danos severos às biomoléculas adjacentes. Yuan et al. (2005),
observaram que a inibição de radicais hidroxilas por carragenanas dependia da
concentração empregada, e que estas apresentavam forte atividade inativadora de
radicais hidroxilas.
Nos estudos feitos por Zhang, Li, Zhou, Lu, Xu e Li (2003) com porfiranos, as
frações de polissacarídeos F1 e F2 apresentaram moderada atividade “varredora” de
radicais hidroxilas, enquanto F3 apresentou um efeito inativador bastante baixo.
Chen et al. (2005) observaram que polissacarídeos extraídos do chá verde tinham
habilidade de “varrer” ou inativar os radicais hidroxilas proporcional ao aumento da
concentração de polissacarídeos. Wang & Luo (2007) observaram uma taxa de
inibição de radicais hidroxilas de 57% para o extrato bruto do polissacarídeo extraído
da planta Gynostemma pentaphyllum Makino, numa concentração de 0,8 mg/mL e
Luo (2008) estudando polissacarídeos da planta Dioscorea nipponica Makino,
obteve uma taxa de inibição de 43,73% utilizando 4 mg. Qi et al (2006) relatou que a
taxa de inibição para a vitamina C era de 20% numa concentração de 1 mg/mL. No
nosso estudo a taxa de inibição das fucanas e galactanas ficou entre 34 e 55% nas
concentrações entre 0,133 e 0,267 mg/mL, demonstrando que esses compostos
literatura utilizando uma concentração bem menor. Os resultados encontrados neste
estudo para essa atividade estão de acordo com Zhang et al. (2003) e Wang & Luo
(2007), onde as frações, exceto a F0,5, tem moderado efeito varredor de radicais
hidroxilas. A fração F0,5 exibiu uma curva descendente nas concentrações 0,144 e
0,267 mg/mL, sugerindo que houve a formação do radical hidroxila, e não inibição,
provavelmente isso ocorre nestas concentrações, devido a essa fração ser rica em
alginatos.
A peroxidação lipídica é um processo complexo e quando induzida por
radicais livres é a razão principal do dano celular (WEI et al., 2003). Esse processo
envolve a formação e propagação de peróxidos lipídicos, e a eventual destruição
das membranas lipídicas, produzindo produtos secundários como o malonildialdeído
em microssomos (ZHANG et al., 2003). Os resultados deste estudo para essa
inibição estão de acordo com os encontrados por Zhang et al. (2003), que
observaram forte inibição da produção de MDA in vitro por porfirano de Porphyra
haitanesis, utilizando a mesma metodologia. Nos seus resultados o IC50 mais baixo
foi de 0,8 mg/mL para F2. Em nossos resultados o IC50 mais relevante foi o da
carragenana kappa, que foi de 0,323 mg/mL e a sua taxa de inibição atingiu quase
100% na concentração de 0,572 mg/mL. Dore et al. (2007) observou que ȕ-glucanas
extraídas do cogumelo Geastrum saccatum inibiam a peroxidação lipídica em 59 %
na concentração de 0,27 mg/mL. Nos estudos feitos por Liu et al (1997) os extratos
de polissacarídeos obtidos de oito espécies de cogumelos não foram capazes de
inibir a peroxidação lipídica microssomal e duas espécies ainda foram capazes de
estimular esse processo. Isso mostra como esses compostos podem ter
Os resultados obtidos para a atividade antioxidante, inibição de radicais
superóxidos, hidroxilas e peroxidação lipídica, estão de acordo com os encontrados
na literatura (MATSUKAWA et al, 1997, ZHANG, YU, LI, ZHANG, XU, & LI, 2003,
WEI et al., 2003, QI et al, 2005).
A utilização desses compostos como agentes antioxidantes podem
representar uma possibilidade na busca de compostos aplicados na indústria
farmacêutica, alimentícia e de cosméticos, já que estes podem inibir danos
6 – CONCLUSÕES
As análises químicas demonstraram que as populações de polissacarídeos
analisadas são polissacarídeos sulfatados com baixa contaminação protéica.
Os polissacarídeos de algas marinhas, tanto as carragenanas, como fucoidan e
heterofucanas (F0,5 e F1,1) possuem propriedades antioxidantes
O fucoidan e a carragenana lambda exibiram significante atividade “varredora” de
radicais superóxido, sugerindo que o conteúdo de sulfato pode estar relacionado
à ação desses compostos com relação a esses radicais, já que estes
apresentaram maior conteúdo de sulfato.
O fucoidan apresentou melhor atividade varredora de radicais hidroxilas.
Para a peroxidação lipídica, a carragenana kappa apresentou uma significante
ALVES, L. G. Polissacarídeos presentes no folíolo, talo e flutuador da alga
Sargassum vulgare. Dissertação - Mesrtado, Universidade Federal do Rio
Grande do Norte . Natal, RN, Brasil, 2000.
ALWAYN, I. P., APPEL, J. Z., GOEPFERT, C., BUHLER, L., COOPER, D. K., & ROBSON, S. C. Inhibition of platelet aggregation in baboons: therapeutic implications for xenotransplantation. Xenotransplantation, v.7, p. 247–257, 2000.
ANDRADE, L. R et al. Ultrastructure of acidic polysaccharides from the cell walls of brown algae. Journal of Structural Biology , v.145, p. 216-225, 2004.
ANGGADIREDJA, J., RIA ANDYANI, HAYATI, MUAWANAH. Antioxidant activity of
Sargassum polycystum (Phaeophyta) and Laurencia obtusa (Rhodophyta) from
Seribu Islands. J. Appl. Phycol., v.9, p.477-479, 1997.
AUGUSTO, O. Radicais livres: bons, maus e naturais. Oficina de textos: São Paulo, 2006
BANERJEE, A., DASGUPTA, N., & DE, B. In vitro study of antioxidant activity of
Syzygium cumini fruit. Food Chemistry , v.20, p. 727-733, 2005.
BENEVIDES et. al. Proximate analysis, toxic and antinutritional factors of ten brazilian marine algae. Revista Brasileira de Fisiologia Vegetal , v.10, p. 31, 1998.
BILAN, M. I. et al. Structure of a fucoidan from the brown seaweed Fucus evanescens C. Ag. Carbohydrate Research, v.337, p.719-730, 2002.
BIRD, G. M., & HAAS, P. Nature of the cell wall constituents of Laminaria sp.
Biochemystry Journal , v.25, p. 403, 1931.
CHEESEMAN, K. H., & SLATER, T. F. An introduction to free radical biochemistry.
Free Radical in Medicine , p. 700-718, 1993.
clinical marker. Free Radic. Biol. Med , v.5, n.3, p. 373-377, 1998.
CONCHIE, J., & PERCIVAL, E. G. Fucoidin. Part III. The hydrolysis of a methylated fucoidin prepared from Fucus vesiculosus.. J. Chem. Soc., v.827, 1950.
CRAIGIE, J. S. Cell Walls. In: COLE, K M & SHEATH, R G. Biology of the Red
Algae. Cambridge: Cambridge University Press, 1990.
DAVIES, K. J. Protein damage and degradation by oxygen radicals. I. general aspects.J Biol Chem. , v.262, n.20, p. 9895-9901, 15/jul/1987.
DIETRICH, C. P. et al. A new approach for characterization of polysaccharides from algae: Presence of four main acidic polysaccharides in three species of the class Phaeophycea.Plant Science , v.108, p. 143-153, 1995.
Disponível no site: www.cpkelco.com/carrageenan/structure.html, acessado em 07/03/2008 as 17:28.
DODGSON, K. S., & PRICE, R. G. A note on the determination of the ester sulphate content of sulphated polysaccharides. Biochem. J. , v.84, p. 106 – 110, 1962.
DORE, C. M. P. G., AZEVEDO, T. C. G., SOUZA, M. C. R., REGO, L. A., DANTAS, J. C. M., SILVA, F. R. F., ROCHA, H. A. O., BASEIA, I. G., LEITE, E. L. Antiinflammatory, antioxidant and cytotoxic actions of ȕ-glucan-rich extract from
Geastrum saccatum mushroom. International immunopharmacology , v.7, p.
1160-1169, 2007.
DUARTE, M. E., CARDOSO, M. A., NOSEDA, M. D., & CEREZO, A. S. Structural
studies on fucoidans from the brown seaweed Sargassum stenephyllum.
Carbohydrate Research , v.333, p. 281-293, 2001.
DUAVY, S. M. Efeito de dietas ricas em ácido graxo monoinsaturado e poliinsaturado sobre o metabolismo e peroxidação lipídica em ratos. [Dissertação -
Bioquímica] Universidade Federal do Rio Grande do Norte . Natal, RN, Brasil,