i
MINISTÉRIO DA EDUCAÇÃO E CULTURA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Estudo cinético na caracterização do status corporal de zinco na Síndrome de
Berardinelli-Seip.
MARIA GORETTI DO NASCIMENTO SANTOS
Natal – RN
ii
MARIA GORETTI DO NASCIMENTO SANTOS
Estudo cinético na caracterização do status corporal de zinco na Síndrome de
Berardinelli-Seip.
Orientador: Prof. Dr. José Brandão Neto
Co-orientadora: Profa. Dra. Lúcia Dantas Leite
Natal – RN
2012
Tese apresentada ao Programa de
Pós-Graduação em Ciências da Saúde da
Universidade Federal do Rio Grande do Norte,
como requisito para obtenção do Título de
iii
MINISTÉRIO DA EDUCAÇÃO E CULTURA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora do Programa de Pós-graduação em Ciências da Saúde:
iv
MARIA GORETTI DO NASCIMENTO SANTOS
Estudo cinético na caracterização do status corporal de zinco na Síndrome de
Berardinelli-Seip.
Aprovada em 06/07/2012
Banca Examinadora
Profa. Dra. Lúcia Dantas Leite (Presidente)
Profa. Dra. Adriana Bezerra Nunes – UFRN (Membro Interno)
Profa. Dra. Ana Maria de Oliveira Ramos – UFRN (Membro Interno)
Prof. Dr. Francisco de Assis Rocha Neves – UnB (Membro Externo)
v
Àqueles que partiram para outra dimensão deixando alegres
e constantes lembranças que nos remetem ao agradecimento
a DEUS, pelo privilégio de tê-los tido conosco:
MANOEL TEIXEIRA FILHO – meu paizinho
querido, cuja extensão do seu analfabetismo não obscureceu a
grandeza do seu sábio coração de PAI. AMAR-TE-EI SEMPRE!
RAIMUNDA TEIXEIRA DO NASCIMENTO BRITO – minha mana
querida, cuja vivência de uma amizade irrestrita quis o destino intensificá-la
vi
AGRADECIMENTOS
Ao DEUS “meu” e de todas as criaturas, Criador de todas as coisas, Senhor
de todo amor, detentor de todo poder e Outorgante do livre arbítrio, por permitir que
eu viva e resista, digna e humanamente, às dificuldades que se me apresentam,
sempre com a capacidade de reconhecer-me vossa humilde e protegida serva;
Ao meu esposo, Josemar dos Santos, pelo companheirismo incondicional,
sempre externando apoio e compreensão;
Aos meus filhos, Gemma Galgani e Giovanni Galeno, dávidas imerecidas
de Deus e fontes de inspiração para as minhas conquistas;
A minha amiga de todas as horas, Fátima Baracho, pelo apoio, carinho e
pela colaboração irrestrita. Enfim, pela sua existência;
À diretoria da ASPOSBERN e aos portadores da síndrome de
Berardinelli-Seip que participaram da pesquisa, pela confiança em mim depositada;
Ao Prof. Dr. José Brandão Neto, pelo conhecimento compartilhado e pelas
lições acrescentadas;
À Profa. Dra. Lúcia Dantas Leite, pela colaboração valiosa e fundamental
para a conclusão desta tese;
A todos os Colegas do Departamento de Análises Clínicas e
Toxicológicas - DACT, em especial, a Chefe, Profª. Dra. Telma Maria de Araújo
Moura Lemos pelo apoio manifestado e compreensão externada nos momentos
necessários;
As minhas Colegas de disciplina, em particular, Tereza Neuma e Zelinha
vii
Aos Funcionários Técnico-administrativos e de Apoio da Bioquímica
Clínica, do DACT e do Laboratório Integrado de Análises Clínicas – LIAC/UFRN,
pelo auxílio necessário;
Aos Colegas Christiane Passos, Freire-Neto, Felipe Bezerra, Tereza
Dantas e Carlos Ramon (meu sobrinho muito querido) pela ajuda valiosa;
Aos Farmacêuticos, Técnicos e Auxiliares do Laboratório de Análises
Clínicas do Hospital Universitário Onofre Lopes – HUOL /UFRN, pela imensurável
colaboração;
Aos meus familiares e amigos pela torcida e compreensão nas ausências
sentidas;
Por fim, agradeço a todos que, direta ou indiretamente, contribuíram para a
viii
“Dai-me, Senhor, a perseverança das ondas do mar,
que fazem de cada recuo um ponto de partida para novo avanço”.
ix
RESUMO
A Síndrome de Berardinelli-Seip (SBS) é uma doença muito rara caracterizada,
sobretudo, pela extrema escassez de tecido adiposo subcutâneo, hipoleptinemia,
hipertrigliceridemia e diabetes insulino resistente ou lipoatrófico. Sua etiologia
envolve implicações hipotalâmicas e pituitárias, alterações nos receptores de
insulina e mutações nos genes AGPAT2, Gng3lg, CAV1 e PTRF. A predisposição à
deficiência de zinco e a distúrbios renais, relacionados ao diabetes lipoatrófico,
motivou a investigação do status de zinco e da sensibilidade da cinética de zinco em
portadores dessa síndrome. Nesse sentido, foram avaliados 10 pacientes com a
SBS e 10 indivíduos saudáveis. Uma única dose de 25 mg (382,43 µmol) de zinco
foi administrado via intravenosa antes e após 3 meses de suplementação oral de
zinco oral (25 mg Zn/dia). Amostras de sangue foram coletadas, no braço
contralateral, em 0, 30, 60, 90 e 120 min após a injeção de zinco. Sangue total e
soro foram obtidos para medição de parâmetros hematológicos e bioquímicos. A
urina foi coletada para medir creatinina, proteína e zinco. Diferente do zinco sérico
basal que apresentou concentração semelhante nos dois grupos do estudo, o perfil
do zinco sérico foi significativamente menor no grupo experimental, assim como a
alteração no clearance total do zinco foi mais elevada, indicando que estes
pacientes têm deficiência subótima de zinco. O desenvolvimento desse estudo, com
perfil multidisciplinar, concretizou a tese, ora defendida, na área das análises clínicas
e contribuiu para defesa de uma dissertação na área de nutrição e três teses na área
x
LISTA DE ABREVIATURAS E SIGLAS
AGPAT2 1-acylglycerol-3-phosphate O-acyltransferase 2
ASPOSBERN Associação de Pais e Pessoas com a Síndrome de Berardinelli-Seip
AUC Área sob a curva
BSCL1 Berardinelli-Seip congenital lipodystrophy – Tipo 1
BSCL2 Berardinelli-Seip congenital lipodystrophy – Tipo 2
BSCL3 Berardinelli-Seip congenital lipodystrophy – Tipo 3
BSCL4 Berardinelli-Seip congenital lipodystrophy – Tipo 4
CAV1 Caveolin1
CGL Congenital Generalized Lipodystrophy
CZn Clearance (depuração) do zinco
Gng3lg Guanine nucleotide-binding protein (G protein) γ3-subunit-linked
gene
Kel Constante de eliminação
LGC Lipodistrofia Generalizada Congênita
PTRF Polymerase I and transcript release factor
SBS Síndrome de Berardinelli-Seip
SZn Zinco sérico
TVTZn Teste Venoso de Tolerância ao Zinco
Vd Volume de distribuição
ZnSO4.7H2O Sulfato de zinco heptahidratado
xi
LISTA DE TABELAS E FIGURAS
Tabela 1 Heterogeneidade genética da Síndrome de Berardinelli-Seip... 13
xii
SUMÁRIO
RESUMO... IX
LISTA DE ABREVIATURAS E SIGLAS... X
LISTA DE TABELAS E FIGURAS... XI
1. INTRODUÇÃO……… 13
2. JUSTIFICATIVA……….. 18
3. OBJETIVOS………. 19
4. MÉTODO……….. 20
5. ARTIGO PRODUZIDO……….. 26
6. COMENTÁRIOS, CRÍTICAS E SUGESTÕES……….. 33
7. REFERÊNCIAS………... 37
8. APÊNDICES………. 46
9. ANEXO……….. 52
13
1. INTRODUÇÃO
A Lipodistrofia Generalizada Congênita (LGC) ou Síndrome de
Berardinelli-Seip (SBS) consiste em um grupo de distúrbios clínicos com herança autossômica
recessiva, caracterizada pela ausência quase completa de tecido adiposo
subcutâneo e proeminência da massa muscular(1-2).
A SBS teve seus primeiros casos descritos no Brasil por Waldemar
Berardinelli (1954) e na Noruega por Martin Seip (1959), tornando-se, mundialmente,
conhecida pelos seus respectivos sobrenomes. Trata-se de uma síndrome rara que
acomete, igualmente, homens e mulheres em todos os grupos étnicos, tem uma
prevalência mundial estimada de 1 caso para 10 milhões de pessoas, e cerca de
300 casos publicados na literatura(1-4). No Rio Grande do Norte, a ocorrência
ultrapassa o número de 30 portadores vivos, integrantes da Associação de Pais e
Pessoas com a Síndrome de Berardinelli-Seip (ASPOSBERN).
A etiologia da síndrome ainda não está totalmente esclarecida, no entanto,
foram evidenciadas implicações hipotalâmica-pituitárias e alteração nos receptores
de insulina, afetando primariamente o tecido adiposo(1,2,5,6). O estudo da SBS sob a
perspectiva da genética molecular teve início com a identificação de dois loci
BSCL1(9q34)(7) e BSCL2(11q13)(8), possibilitando a primeira classificação dos
principais tipos da síndrome: BSCL1(OMIM-608594) e BSCL2(OMIM-269700).
Independente das especificidades relacionadas à gravidade da doença e à
variabilidade dos sintomas, a heterogeneidade genética da síndrome permaneceu
evidente (Tabela 1). Kim et al. (2008)(9) rastrearam o gene CAV1(7q31) e,
PTRF/CAVIN-14
1(17q21.2), elucidando, respectivamente, os tipos BSCL3 e BSCL4 da síndrome
(11-15) .
TABELA 1. Heterogeneidade genética da Síndrome de Berardinelli Seip.
Tipo OMIM MIM Locus Gene envolvido
BSCL1 608594 603100 LCG1-9q34 AGPAT2 (7)
BSCL2 269700 606158 BSCL2/seipin 11q13 Gng3lg (8)
BSCL3 612526 601047 CAV1-7q31 CAV1(9)
BSCL4 613327 603198 PTRF-17q21 PTRF (10)
OMIM: Online Mendelian Inheritance in Man (Herança Mendeliana no Homen).
O portador da SBS é reconhecido ao nascer ou na primeira infância pela
ausência quase completa do tecido adiposo subcutâneo, cuja extensão da perda de
gordura determina o grau de severidade das complicações metabólicas(4). Os
achados clínicos e laboratoriais que definem a síndrome incluem hiperinsulinemia,
diabetes mellitus insulino resistente sem tendência a cetose, hipertrigliceridemia,
baixos níveis de HDL-colesterol, aumento de VLDL e LDL-colesterol,
hiperproteinemia moderada, acentuada hipoleptinemia e hipoadiponectinemia. Além
disso, observa-se maior atividade das enzimas hepáticas, hiperatividade da
fosfatase alcalina, protuberância abdominal, hepatoesplenomegalia, esteatose
hepática, cirrose, arteriosclerose, retardo mental, cardiomegalia e alargamento dos
rins(3-4,16-19).
Outras manifestações relatadas envolvem acanthosis nigricans, localizada
tipicamente no pescoço, cotovelo, pregas axilares, regiões perineal e genital externa,
xantomas eruptivos, flebomegalia, musculatura proeminente e hipertrófica, orelhas
15
voracidade no apetite, crescimento linear acelerado e idade óssea avançada durante
a infância, e hipertrofia clitoriana ou peniana ao nascimento(20-23). Algumas dessas
manifestações podem ser vistas no Apêndice 1. Segundo Fu et al. (2004) (24), não há
distinção de apresentação das características clínicas entre os portadores de
mutação nos genes AGPAT2 e Gng3lg, exceto no que se refere ao retardo mental,
predominante na primeira(24).
As complicações metabólicas encontradas na SBS decorrem, não apenas da
resistência insulínica, principal anormalidade bioquímica, mas também estão
associadas às alterações nos níveis de leptina e adiponectina(17,25-27). O diabetes
insulino resistente manifestado, também conhecido como diabetes lipoatrófico(28-30)
,
predispõe à deficiência de zinco e ao aparecimento de distúrbios renais(31-32)
.
Embora a doença renal seja um componente significativo na SBS, sua
etiologia não está totalmente esclarecida. Não há conhecimento de ligação entre os
defeitos genéticos causadores da lipodistrofia e a nefropatia. No entanto, a frequente
macroalbuminúria e a severa proteinúria (>3500 mg/24h) foram observadas em 17%
dos portadores de SBS estudados por Javor et al. (2004)(34). Em adição, observa-se
ainda hiperfiltração glomerular que, ao longo do curso do diabetes, é refletida na
elevada depuração de creatinina. Apesar dos portadores da SBS apresentarem
diabetes mellitus e proteinúria, a nefropatia diabética não tem sido um achado
predominante entre eles(33-37).
Em geral, os pacientes com SBS sobrevivem até a idade adulta jovem ou
meia-idade e têm como causas comuns de morte a insuficiência renal e hemorragia
16
Considerando o contexto metabólico da SBS, o zinco parece ter efeito
promissor. Esse elemento traço participa de diversas funções fisiológicas, incluindo
crescimento, desenvolvimento e reprodução em todas as formas de vida(40-42).
Trata-se de um dos mais importantes micronutrientes do organismo humano, onde Trata-se
encontra distribuído em todos os órgãos, fluidos, secreções e tecidos, principalmente
no tecido ósseo e muscular, os quais concentram cerca de 83% do teor corporal
total de zinco (1,5 a 2,5 g)(43-44).
No meio intracelular, o zinco encontra-se associado a proteínas,
principalmente, em interaçõs complexas com os aminoácidos histidina e cisteína,
atuando como componente integral de numerosas metaloenzimas e fatores de
transcrição(45-46). Aproximadamente 0,1% do zinco corporal total encontra-se no
plasma sanguíneo e constituiu a fonte primária desse mineral para todas as
células(47).
A deficiência de zinco em humanos foi caracterizada no início dos anos 60 e,
desde então, houve uma explosão de pesquisas a fim de se esclarecer o papel do
mesmo no organismo humano. Apesar dos avanços nos estudos sobre o zinco,
ainda não foi identificado um método confiável para diagnosticar o status do zinco
corporal em humanos. Esse fato tem dificultado identificar e mensurar a deficiência
de zinco, problema nutricional atual presente nos países desenvolvidos e em
desenvolvimento(48-50). Além disso, há dificuldade de se encontrar um índice
laboratorial confiável que possa detectar o início dessa deficiência (51-53).
Os parâmetros utilizados para avaliar o status corporal de zinco
compreendem a sua concentração no soro, plasma, eritrócitos, leucócitos, cabelo,
mensuração de metalotioneína, fosfatase alcalina, atividade da 5’nucleotidase e
17
de zinco sérico, mesmo com baixa especificidade e sensibilidade, tem sido
amplamente utilizada para avaliar seu status corporal(54-56).
O metabolismo do zinco é susceptível a alterações fisiológicas
circunstanciais. Na busca por marcadores mais fiéis, que contribuam na identificação
dos sítios dessas alterações e que levem a uma melhor compreensão da flutuação,
distribuição e homeostasia desse micronutriente, vários pesquisadores têm estudado
a cinética do zinco(57). Assim sendo, a aplicação da cinética tem permitido investigar
o status de zinco em várias condições clínicas, destacando-se doença de Crohn(58),
diabetes mellitus(59-63), retardo do crescimento(64), escolares(65) e adultos
saudáveis(66).
O estudo da cinética consiste em conhecer o comportamanto de uma
determinada substância durante um tempo pré-estabelecido, em um organismo
humano ou animal. Esse estudo pode envolver um ou mais compartimentos
orgânicos e compreende as etapas de administração, mensuração e análise da
substância, cujas informações cinéticas, envolvendo flutuação, concentração, taxa
de transporte e excreção ao longo do tempo determinado, são dadas a conhecer
mediante equações matemáticas(57).
Uma das formas de avaliar a cinéntica do zinco é a realização do Teste
Venoso de Tolerância ao Zinco (TVTZn). Nesse teste, após a administração venosa
do micronutriente, suas concentrações séricas e urinárias são mensuradas em
tempos sequenciais e geram, mediante equações matemáticas, os seguintes
parâmetros cinéticos: contante de eliminação (Kel), volume de distribuição (Vd),
variação da concentração (ΔCo) depuração do zinco (CZn), além da área sob a
curva (AUC)(63,65). Diante disso, o TVTZn seria útil na avaliação do status corporal de
18
2. JUSTIFICATIVA
A condição clínica de diabetes lipoatrófico(28-30), de difícil controle, expõe os
portadores da SBS a toda vulnerabilidade biológica e/ou social inerente ao paciente
diabético, inclusive ao maior risco para deficiência de zinco. Esta, por sua vez, surge
em decorrência de ingestão dietética inadequada, absorção diminuída, doenças
hepáticas crônicas e disfunções renais com perda urinária de zinco, entre outras
causas(67-68).
O zinco é um micronutriente essencial que exerce numerosas funções
metabólicas e fisiológicas no organismo humano, participando na atividade de várias
metaloenzimas e no metabolismo de carboidratos, lipídios, proteínas e ácidos
nucléicos. O zinco também atua na homeostase energética, modulando a expressão
gênica da leptina; na estrutura e fisiologia da insulina; na manutenção do
desenvolvimento e crescimento normais; no funcionamento adequado do sistema
imunológico; e na função neurossensorial(69-70).
Considerando as funções vitais do zinco(71-74), a complexidade da SBS, e a
carência de publicações nessa área, ressalta-se a grande importância desse estudo,
uma vez que proporcionará evidências para um monitoramento clínico mais eficaz,
19
3. OBJETIVOS
3.1. Objetivo geral:
• Caracterizar o status corporal de zinco na Síndrome de Berardinelli-Seip
mediante estudo cinético.
3.2. Objetivos específicos:
• Mensurar os parâmetros bioquímicos: zinco sérico, zinco urinário, proteinúria,
hemoglobina glicada e triglicerídeos;
• Calcular os parâmetros cinéticos: volume de distribuição, tempo médio,
constante de eliminação e clearance de zinco;
• Correlacionar o clearance de zinco com os parâmetros zinco sérico,
20
4. MÉTODO
4.1. Amostra
Esse estudo teve uma população amostral constituída por um grupo controle
(GC) e um grupo experimental (GE), ambos com 10 integrantes. Os participantes
assinaram o Termo de Consentimento Livre e Esclarecido (TCLE) e o projeto foi
aprovado pelo Comitê de Ética em Pesquisa (CEP) do Hospital Universitário Onofre
Lopes (HUOL) da UFRN, sob o protocolo de no 006/06.
O GC foi composto por dez (10) alunos do Curso de Medicina, sendo cinco (5)
homens e cinco (5) mulheres, com idade de 24,3 ± 2,0 anos. Nenhum tinha história
de endocrinopatia e nem estavam em uso de medicamentos.
O GE foi composto por pacientes com SBS, sendo quatro (4) homens e seis
(6) mulheres, com idade de 23,2 ± 7,9 anos. Três pacientes usavam metformina,
dois usavam insulina e metformina, dois apenas insulina e três não usavam nenhum
medicamento. Todos eram oriundos da ASPOSBERN, com sede na cidade de
Currais Novos – região do semiárido do Estado.
Todos os integrantes do estudo foram atendidos na Sala de Provas
Funcionais do Programas de Pós-graduação em Ciências da Saúde (PPGCSA) e as
análises laboratoriais foram realizadas no Laboratório Multidisciplinar do Programa
de Pós-graduação em Ciências Farmacêuticas (PPGCF) e o Laboratório de Análises
21
Os critérios de exclusão adotados foram: idade inferior a 14 anos, pacientes
com doenças inflamatórias, agudas, bem como aqueles que se submeteram à
cirurgia ou usavam suplementos vitamínico-mineral.
4.2. Desenho do estudo
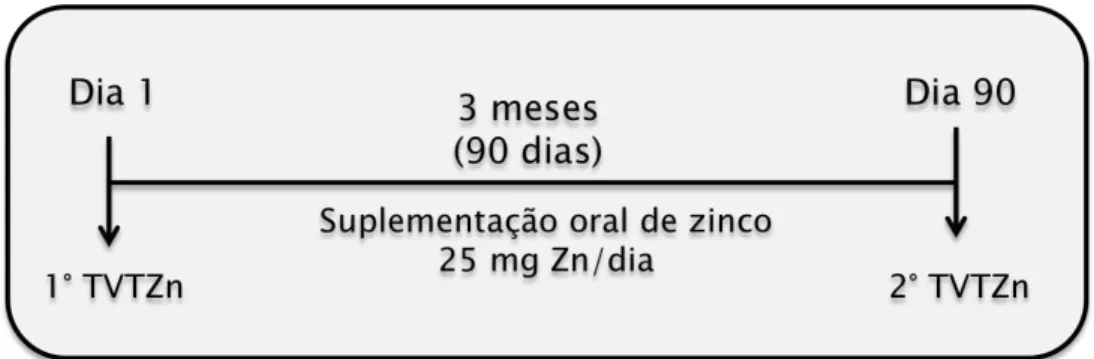
O GC foi submetido apenas a administração venosa de zinco (TVTZn) no Dia
1 e não recebeu suplementação oral de zinco. O GE foi submetido a administração
venosa de zinco (TVTZn) nos Dias 1 e 90, antes e após a suplementação oral de
zinco (Figura 1). Dessa forma, todos os pacientes do GE foram examinados no início
do estudo e após os três meses da suplementação. Foi investigada a cinética do
zinco nos pacientes com início às 7h da manhã, após jejum de 12h. Dispositivos de
infusão com solução salina livre de zinco foram implantados na veia anticubital de
ambos os antebraços e os pacientes foram mantidos em decúbito dorsal durante o
teste.
Após o esvaziamento da bexiga e aferição de peso e altura, amostras basais
de sangue foram coletadas, no tempo de zero minuto (0 min). Em seguida, 25 mg do
22
Amostras de sangue foram então coletadas, no braço contralateral, aos 30, 60, 90 e
120 min após a infusão do zinco. No decorrer do TVTZn, foram administrados via
oral 4 mL de água ultra pura/Kg de peso corporal e, ao final do teste foi coletada
amostra de urina para dosagem de zinco, proteína e creatinina (Figura 2).
4.3. Administração oral e venosa de zinco
Durante 3 meses seguidos, foi suplementado oralmente 25 mg Zn/dia, sob a
formulação de sulfato de zinco heptahidratado (ZnSO4.7H2O) da Merck, Darmstadt,
Germany®. A suspensão foi preparada no Laboratório de Farmacotécnica do
Departamento de Farmácia (DFAR) da UFRN. Cada gota continha 1 mg do
elemento zinco. Todos os pacientes tomaram 25 gotas diariamente no desjejum. A
supervisão dessa suplementação era feita semanalmente pelo mesmo observador. Figura 2. Esquema metodológico do Teste Venoso de Tolerância ao
23
No dia do TVTZn, foi administrado via venosa 25 mg (382,438 µmol) de zinco.
As ampolas continham 5 mL de ZnSO4.7H2O e foram adquiridas no InjectCenter de
Ribeirão Preto, São Paulo, Brasil. Todo o conteúdo da ampola foi injetado no
período de 1 min, no tempo 0 min, após a coleta basal de sangue.
4.4. Parâmetros cinéticos
A cinética do zinco foi estudada durante sua administração venosa, nos
grupos controle e experimental, em estado basal e após a suplementação oral do
grupo experimental.
Os parâmetros cinéticos estudados foram: zinco sérico (SZn); volume de
distribuição (Vd) = dose i.v./∆C0; constante de eliminação (Kel) = 0,693/t1/2; e
clearance corporal de zinco (CZn) = Kel . Vd. Todas essa variáveis, além da área sob
a curva (AUC), foram calculadas utilizando-se programa computacional(63,65).
4.5. Análises bioquímicas
Todos os procedimentos de manipulações com amostras de zinco foram
realizados conforme as normas internacionais e de acordo com as diretrizes para
rastreamento de elementos traço(75).
Para a punção venosa utilizou-se seringas sem torniquete. Tubos, ponteiras
e todo o material utilizado para coleta, separação e armazenamento de zinco eram
de plástico e livres do elemento traço. As amostras de sangue foram coletadas em
tubos próprios e sem anticoagulante e, imediatamente após a coleta, mantidas em
incubadora de aço inoxidável (FANEM 502, São Paulo, Brasil), durante
aproximadamente 2h, para formação do coágulo. Em seguida, 500 µL de soro foram
24
Millipore, EUA) para diluição. As amostras que evidenciaram hemólise foram
descartadas porque eritrócitos são ricos em zinco(76).
A urina, coletada em recipiente plástico livre do metal, teve o volume medido
em um cilindro de 500 mL. Em seguida, o volume de 500 µL foi diluído em 2000 µL
de água ultra-pura.
As amostras de soro e urina foram armazenadas a -20 °C, durante 2 meses,
para posterior análise. Cada indivíduo teve as suas amostras de soro e urina
analisadas em duplicata, dentro do mesmo ensaio, usando espectrofotômetro de
absorção atómica (SpectrAA-200, Varian, Victoria, Austrália), em comprimento de
onda de 213,9 nm e corrente da lâmpada de 5 mA. Todos os procedimentos de
calibrações e medições foram realizados seguindo as instruções do fabricante.
A sensibilidade do ensaio foi de 0,01 µg/mL, o coeficiente de variação
intra-ensaio de 2,6%,e os valores de referência para SZn foi de 0,7-1,20 µg/mL. A
concentração de zinco das amostras foi determinada usando, como controle de
qualidade, uma solução padrão do nosso laboratório(61), a fim de verificar a
reprodutibilidade e precisão das medições.
A solução padrão de zinco (0,5 µg/mL), obtida por diluição da solução de
estoque de zinco (500 µg/mL) e preparada a partir de 0,5 g de zinco em pó adquirido
da Merck (Darmstadt, Alemanha), foi dissolvida em um pequeno volume de ácido
clorídrico (HCI, Merck, Darmstadt, Alemanha), posteriormente reconstituído para 1 L,
com HCl 1% (v/v).
Outros parâmetros laboratoriais também foram dosados antes e após a
suplementação oral de zinco, como hemoglobina glicada, proteinúria e triglicerídios.
Para tanto, foi usado métodos padrão de laboratório de bioquímica (Dade Behring,
25
Clínicas do HUOL e no Laboratório Multidisciplinar de Doenças Crônicas
Degenerativas dos Programas de Pós-graduação em Ciências da Saúde e em
Ciências Farmacêuticas, ambos da UFRN.
4.6. Análise estatística
As análises estatísticas foram realizadas utilizando-se o teste t de Student para
dados pareados e não pareados, análise de variância (one-way ANOVA) com
correção de Bonferroni para teste de comparação múltipla, além da análise de
correlação e regressão linear. Foi adotado um nível de significância estatística de
5% (p<0,05) e utilizou-se o GraphPad Prism 5,0 como programa estatístico (San
26
5. ARTIGO PRODUZIDO
Titulo: Kinetics of zinc status and zinc deficiency in Berardinelli-Seip syndrome
Periódico: Journal of Trace Elements in Medicine and Biology
ISSN: 0946-672X
Qualis: Internacional B (Medicina II – CAPES)
27
JournalofTraceElementsinMedicineandBiology26 (2012) 7–12
ContentslistsavailableatSciVerseScienceDirect
Journal
of
Trace
Elements
in
Medicine
and
Biology
jo u r n al h o m e p a g e :w w w . e l s e v i e r . d e / j t e m b
REVIEW
Kinetics
of
zinc
status
and
zinc
deficiency
in
Berardinelli-Seip
syndrome
MariaGorettidoNascimentoSantosa,MariadeFátimaPaivaBarachoa,
SanchaHelenadeLimaValea,LúciaDantasLeiteb,ÉrikaDantasdeMedeirosRochaa,
NairaJoseleNevesdeBritoa,MardoneCavalcanteFranc¸ac,MariadasGrac¸asAlmeidad,
SamantaCristinaChiquettie,JúlioSérgioMarchinif,JoséBrandão-Netog,∗
aPostgraduatePrograminHealthSciences,FederalUniversityofRioGrandedoNorte(UFRN),Natal,Brazil bDepartmentofNutrition,UFRN,Natal,Brazil
cDepartmentofStatistics,UFRN,Natal,Brazil
dDepartmentofClinicalPharmacyandToxicology,UFRN,Natal,Brazil eDepartmentofChemistry,UFRN,Natal,Brazil
fDivisionofClinicalNutrition,USP-RP,RibeirãoPreto,SãoPaulo,Brazil gDepartmentofInternalMedicine,UFRN,Natal,Brazil
ar t i cl e in f o
Articlehistory:
Received31March2011 Accepted6November2011
Keywords:
Berardinelli-Seipsyndrome Venousandoralzincadministration Zinckinetics
Zincstatus
ab s tr a ct
Berardinelli-Seipsyndrome(BSS)isaveryraredisordercharacterizedbynear-completeabsenceof adi-posetissuefrombirthorearlyinfancy,hypoleptinemia,hypertriglyceridemia,insulinresistance,diabetes mellitus,andotherclinicalsignals.ItiscausedbymutationsinAGPAT2orGng3lg.Weevaluated10BSS patientsand10healthysubjects.Asingledoseof382.43!molzincwasadministeredintravenouslybefore andafter3monthsoforalzincsupplementation.Bloodsampleswerecollectedfromthecontralateral armat0,30,60,90,and120minafterzincinjection.Plasmaandserumwereobtainedtomeasure hema-tologicalandbiochemicalparameters.Urinewascollectedtomeasurecreatinine,protein,andzinc.Basal serumzinclevelsweresimilarincontrolsandBSSpatients.However,serumzincprofilesweresignificant reducedinBSSpatientsincomparisonwithcontrols.Thechangeintotal-bodyzincclearancewasmore significantinBSSpatients,indicatingthatthesepatientshadsuboptimumzincdeficiency.
© 2011 Elsevier GmbH. All rights reserved.
Contents
Introduction... 8 Materialsandmethods... 8 Subjects... 8 Experimentaldesign... 8 Zincadministration... 8 Kineticapproach... 8 Biochemicalanalysis... 8 Statisticalanalysis... 9 Results... 9 Biochemicalanalysis... 9 Venouszincadministration... 9 Oralzincadministration... 10 Kineticapproach... 10 Discussion... 11 Acknowledgements... 12 References... 12
∗Correspondingauthor.Tel.:+558433429776.
E-mailaddress:jbn@ppgcsa.com.br(J.Brandão-Neto).
0946-672X/$–seefrontmatter© 2011 Elsevier GmbH. All rights reserved.
28
8 M.G.d.N.Santosetal./JournalofTraceElementsinMedicineandBiology26 (2012) 7–12
Introduction
Berardinelli-Seip syndrome (BSS) isa rare autosomal reces-sive disease characterized by near total absence of adipose tissue[1,2].Nearly300 cases havebeen describedinthe liter-ature;itisararesyndrome,with aprevalenceofonecaseper ten millionpeople [3]. These patients present with nonketotic and insulin-resistant type 2 diabetes mellitus, hyperinsuline-mia, acanthosis nigricans, hyperglycemia, and other clinical signals[3–5].
Mutations in AGPAT2, which encodes the
1-acylglycerol-3-phosphateO-acyltransferase2,locatedinchromosome9q34,and Gng3lg,whichencodesaproteincalledseipin,whosefunctionis unknown,locatedinchromosome11q13,arerelatedtothe phys-iopathologyofthissyndrome[6].
Zincisanimportantmicronutrientforhumanhealth.Itis asso-ciatedwithmanyphysiologicalfunctions,includingfunctionsin metalloenzymes relate to intermediary metabolism [7]. Subop-timumzincdeficiency ismorecommonthanseveredeficiency, especiallyindevelopingcountries[8].Itismorethananutritional riskfactorandmayberesponsibleforanumberofpathologiesin humanbeing[9,10].
Thereisaninterrelationshipbetweenzincanddiabetesmellitus, andzinckineticswasfirststudiedinpatientswithtype1diabetes, showingnoevidenceofzincdeficiencyorofchangesinthekinetic parametersofzinc[11].Theseresultsareimportantin understand-ingBSSpatients,sinceallofthempresentwithdiabetesmellitus [3].
On theother hand, many BSSpatients have renal dysfunc-tion,withelevatedurinealbuminexcretion,microalbuminuriaand nephrotic-rangeproteinuria.Theetiologicbasisforrenaldiseaseis unknown,andtherearefewreportsintheliteratureassociated withthesedisorders[12,13].
Giventhescarcityofreportsstudyingtotal-bodyzincclearance inhealthysubjectsandtheabsenceofstudiesonBSSpatients,we investigatedzinckineticsinthesepatientsinordertoclarifythe existenceornotofsuboptimalzincdeficiencyusingthekinetic parameterofthision.
Materialsandmethods
Subjects
Thisstudyconsistedof10healthyindividuals(controlgroup) and10BSSpatients(experimentalgroup)afterwritteninformed consentandtheMedicalEthicsCommitteeapprovalwasobtained (n◦006/06).Normalindividualswerestudentvolunteersfromthe
School ofMedicine. The study group was composed of5 sub-jects ofeachgender,aged24.30±2anda conveniencesample
ofnequaltotheexperimentalgroupstudied.Theyhadno his-toryofendocrinopathyandwerenotusinganymedications.BSS patients (4 malesand 6females, aged23.2±7.9)were treated
attheMultidisciplinaryLaboratoryofChronicDegenerative Dis-eases (PPGCSA, PPGCF, UFRN).They had a generalizedform of lipodystrophy,withmuscularhypertrophyandneartotalabsence ofadiposetissuefrombirth.Theyalsohadtwogenemutations: AGPAT2andGng3lg[6].Threepatientstookmetformin,twopatients
usedinsulinplusmetformin,twopatientstookinsulin(NPH)and threeusednomedicine.AllpatientswerefromthestateofRio GrandedoNorte,Brazil.Allpatients(controlandexperimental) undertheageof14yearsorthosewhodidnotagreetotakepart inthestudywereexcluded.Patientswithacute,chronic, infec-tious or inflammatory diseases were alsoexcluded, as well as thosewhohadundergonesurgeryorwereusingvitamin–mineral supplements.
Experimentaldesign
Thecontrolgroupwassubmittedtovenouszincadministration andtheexperimentalgrouptooralandvenouszincadministration. Allpatientswereevaluatedatthebeginningofthestudyandafter 3months(Fig.1).
Weinvestigatedzinckineticsinthesepatientsduringvenous zinc administrationat 7:00 a.m., after a 12-hfast. Individuals weremaintainedindorsaldecubitusthroughoutthetest.Infusing deviceswereimplantedintotheantecubitalveinsofbothforearms andmaintainedwithphysiologicalsaline(zincfree).Basalblood sampleswerecollectedat0min.Next,intravenousadministration of25mgofelementalzincwasadministeredoveraperiodof1min (8:00h).Bloodsampleswerethencollectedfromanotherveinin thecontralateralarmat30,60,90,and120min.Theurinesample wascollectedat10:00hforzinc,proteinandcreatinine.Weight andheightweremeasuredattheendofthetest.
Zincadministration
Oralzincadministration(382.438!molzinc/day,intheform
ofZnSO4·7H2O)(Merck,Darmstadt,Germany),wasusedduring3
monthsfollowup.Thesyrupwaspreparedatthe Pharmacotech-nicalLaboratoryoftheDepartmentofPharmacy,UFRN.Eachdrop contained1mgofelementalzinc.Allthepatientswere periodi-callycheckedtodetermineiftheywerefaithfullytakingthezinc supplementationandkeepingfoodrecords.Theywereinstructed toconsumezincsupplementationatbreakfast.
Venouszincadministrationwasperformedbetween08:00and 10:00h.Adoseof382.438!molzinc(5mLasheptahydratedzinc
sulfate)wasinjectedaftertime0minandoveraperiodof1min (InjectCenter,RibeirãoPreto,SP,Brazil).Bloodsampleswere col-lectedfromthecontralateralarmat0(beforezincinjection),30,60, 90,and120min(afterzincinjection)[11].Eachampoulecontained 5mL=382.438!molelementalzincasZnSO4·7H2O.
Kineticapproach
Zinc kinetics was investigated in control (basal values) and experimental groups during venous zinc administration. Kineticparameterswere calculatedasfollows:serumzinc,SZn; distribution volume, Vd=dose i.v./!Co; elimination constant, Kel=0.693/t1/2; and total-bodyzinc clearance, CZn=Kel×Vd.All thesevariables,includingtheareaunderthecurve,werecalculated usingacomputationalprogram[14,15].
Biochemicalanalysis
Allproceduresregarding manipulationofzinc sampleswere performedaccordingtointernationalstandards.Venipuncturewas performedusingplasticsyringeswithoutatourniquet.Alltubes andpipettetipsweretracemetal-free.Allmaterialusedforzinc collection,separation,and storagewas plastictracemetal-free, andprocedureswereperformedaccordingtoguidelinesfortrace elements[16].Bloodsamples,immediatelyaftercollection,were maintainedintracemetal-freetubeswithoutanticoagulantsand kept120mininthestainlesssteelincubator(FANEM502,SãoPaulo, Brazil)untilclotformation.Next,500!Lofserumwerecollected
withplastictrace metal-freepipettesand transferredto plastic tubescontaining2000!Lofultrapurewater(Milli-Qplus,
Mil-lipore,USA)todilutetheserum.Samplesshowinghemolysiswere discardedbecause erythrocytesarerich inzinc [17].Urine was collectedinaplastictracemetal-freerecipient,thevolumewas measuredinacylinderandthen500!Lwascollectedanddiluted
with2000!Lofultrapurewater.Serumandurinesampleswere
29
M.G.d.N.Santosetal./JournalofTraceElementsinMedicineandBiology26 (2012) 7–12 9
Fig.1.Experimentaldesignofvenouszincadministration,incontrolandexperimentalgroup,toevaluatethetotal-bodyzincclearance.
Serumandurinezincsamplesfromeachindividualwereanalyzed induplicatewithinthesame assayusing anatomic absorption spectrophotometer(SpectrAA-200,Varian,Victoria,Australia)in accordancewiththemanufacturer’sinstructions.Assaysensitivity was0.01!g/mL,theintra-assaycoefficientofvariationwas2.6%, andthenormalreferencevalueswere0.7–1.20!g/mL.Zinc concen-trationofthesampleswasdeterminedusingastandardsolution fromourlaboratory asqualitycontrol,inordertocheck repro-ducibilityandaccuracyofthemeasurements.Thestandardzinc solution(0.5!g/mL)wasobtainedbydilutingthestockzinc solu-tion(500!g/mL)preparedfrom0.5gofzincpowderpurchased fromMerck(Darmstadt,Germany)anddissolvedinasmallvolume ofhydrochloricacid(HCl,Merck,Darmstadt,Germany),whichwas laterreconstitutedto1L,with1%HCl(v/v).Zincconcentrationof thesampleswasdeterminedwithawidelyusedstandardsolution fromourlaboratoryasqualitycontrol[11].Wavelengthwas213.9, lampcurrentwas5mAandallotherprocedures,suchas calibra-tionsandmeasurementswerecarriedoutinaccordancewiththe manufacturer’sinstructions.
Clinicallaboratoryparameterswerealsoevaluatedatthe begin-ning of the study and after 3 months using standard clinical laboratorymethods:hematologic(HoribaABXDiagnostics,Micros 60,Montpellier,France),biochemical(DadeBehring,Dimension AR,IL,USA).TheanalyseswereperformedbytheMultidisciplinary LaboratoryofChronicDegenerativeDiseases.
Statisticalanalysis
StatisticalanalyseswereperformedusingtheStudent’st-test forpairedandunpaireddata,one-wayANOVAbyBonferroni mul-tiplecomparisontest,correlationanalysisand linearregression (GraphPadPrism5.0,SanDiego,CA,USA).Allcomparisonswere
consideredtobestatisticallysignificantat5% significancelevel (p<0.05).
Results
Biochemicalanalysis
Clinicallaboratoryparameterswereinnormalreferenceranges. Glycated hemoglobin (HbA1c) decreased significantly over the 3-month period inthe experimentalgroup,while triglycerides (3.62±0.65and3.56±0.61mmol/L,p=0.8197)remainedelevated throughoutthestudy.Proteinuriawaspresentintheexperimental group,anditwaspositivebeforeandafteroralzinc administra-tion(53.29±16.60mg/dLand41.41±12.21mg/dL,respectively), althoughnodifferencewasobserved.Normalreferenceranges: gly-catedhemoglobin,5.3–7%;triglycerides,≤1.7mmol/L;proteinuria, 1–15mg/dL.
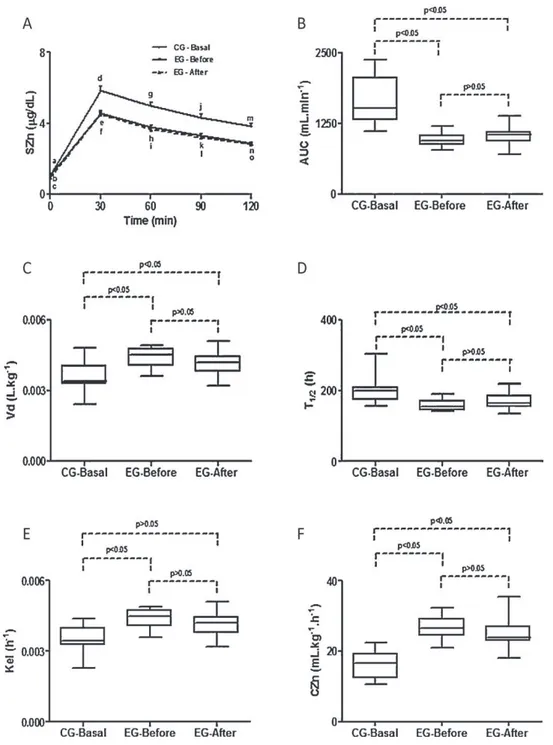
Venouszincadministration
Basalserumzinclevelsweresimilarinbothgroupsandwithin thenormalreferencerange(0.7–1.2!g/mL)(Fig.2A).Duringzinc injection,no differencewas detected inserum zinc profiles in theexperimentalgroup,beforeorafteroralzincadministration. However,thecontrol group(basalvalues) showeda difference incomparisonto theexperimentalgroup,from 30to 120min, (p<0.05)(Fig.2A).Thus,theareaunderthezinccurveswashigher
30
10 M.G.d.N.Santosetal./JournalofTraceElementsinMedicineandBiology26 (2012) 7–12
Fig.2.Valuesofkineticsofzincobtainedin10healthysubjects(controlgroup)and10patientswithBerardinelli-Seipsyndrome(experimentalgroup)duringvenous zincadministration.(A)Serumzinclevels;basalserumzinclevelsweresimilarinbothgroups,a×b,c=p>0.05;zincprofileinthecontrolgroup(CG)wasdifferentin comparisontoexperimentalgroup(EG)beforeorafteroralzincadministration,d×e,f=p<0.05;g×h,i=p<0.05;j×k,l=p<0.05;m×n,o=p<0.05;therewasnodifference intheexperimentalgroup,comparingbeforeversusafteroralzincadministration,i.e.,b×c,e×f,h×i,k×l,andn×o,p>0.05.(B)Areaunderthezinccurves(AUC).(C) Volumeofdistribution(Vd).(D)Half-lifeofserumzinc(t1/2);(E)eliminationconstant(Kel).(F)Total-bodyzincclearance(CZn).pSignificanceisshownineachfigure.
Oralzincadministration
Allsubjectsusedzincdropsfaithfullythroughoutthestudy,and basalserumzinclevelsweresimilarinbothgroups(Fig.2A).Noside effectswerereportedafteritsadministration.
Kineticapproach
Therewasadifferenceindistributionvolume(Vd)between con-trols(basalvalues)andtheexperimentalgroup(p<0.05),butitwas notdifferentintheexperimentalgroup,beforeandafteroralzinc administration(Fig.2C).
Thehalf-lifeofserumzinc(t1/2)wasdifferentinthetwogroups. However,therewasnodifferenceintheexperimentalgroup,before andoralzincadministration(Fig.2D).
Theeliminationconstant(Kel)obtainedthesameresultsfort1/2. Thecontrolgroup(basalvalues)wasdifferentfromthe experimen-talgrouponlybeforeoralzincadministration(p<0.05);therewas nodifferenceintheexperimentalgroup,beforeandafterresults (Fig.2E).
31
M.G.d.N.Santosetal./JournalofTraceElementsinMedicineandBiology26 (2012) 7–12 11
Table1
CorrelationsamongCZnandSZn,HbA1c,proteinuria,in10healthysubjects(controlgroup)and10patientswithBerardinelli-Seipsyndrome(experimentalgroup).
Group Test Variables Y-interceptwhenX=0.0 r2 pValues
Controlgroup Basal
SZnandCZn
8.513±6.97 0.1377 0.2912
Experimentalgroup Before 16.07±8.62 0.1603 0.2516
After 14.84±6.68 0.2388 0.1518
Controlgroup Basal
HbA1candCZn
19.95±18.28 0.0051 0.8437
Experimentalgroup Before 24.53±8.34 0.0081 0.8043
After 7.68±19.06 0.0958 0.3840
Experimentalgroup Before
ProteinuriaandCZn 26.55±1.68 0.0008 0.9389
After 27.93±2.10 0.2755 0.1193
CZn,total-bodyzincclearance;SZn,basalserumzinclevels;HbA1c,glycatedhemoglobin.
Finally,thecorrelationcoefficientandlinearregressionshowed nodifferencebetweenbasalserumzinclevelsandCZn valuesin thecontrolgroup(basalvalues)andexperimentalgroup.Thesame wasobservedwithHbA1candCZn.Proteinuria,whileCZnshowed nodifferenceintheexperimentalgroup(Table1).
Discussion
Itisverydifficulttoestablishzincstatus,becausethereareno satisfactorybiomarkersfortheassessmentofzincintakeandstatus [18].Zincinplasma,serum,erythrocytes,platelets,leukocytes,hair, sweat,urineandmetalloenzymeactivitieswasusedtoassessbody zincstatus[19].Further,high-qualitystudiesarerequired,since thereisnoreliablemethodtomeasurezincdeficiency[18].
Inadditiontotheabove,Nakamuraetal.[14,20]andLeiteetal. [15]proposedakineticapproachtostudyzincmetabolismand reportedevidenceofzincdeficiencyinchildrenwithtype1 dia-betesmellitus,aswellasinshortandeutrophicchildren.
Inthepresentstudy,patientsexhibitednodifferenceinmean age,bodyweightandBMI,demonstratinguniformitybetween con-trolandexperimentalgroups[18].
All biochemical values remained within normal reference
rangesthroughoutthestudyincontrolandexperimentalgroups. TriglyceridesandHbA1cremainedincreased,beforeandafteroral zinc administration, becausehypertriglyceridemia and diabetes mellitusarecharacteristicsofBSSpatients[3,21].However,HbA1c decreasedsignificantly(9.20±0.42to8.16±0.22%,p=0.0163)at theend ofthe 3-month follow-up inthe experimental group, although they remained above normal reference ranges.Other researchers reported similarresults, i.e., mean HbA1clevels in thesupplementedgroupdecreasedsignificantlyoverthe3-month period,whilenosignificantchangeswerefoundinmeanHbA1c forthecontrolgroup[22].Additionally,wefoundnocorrelation betweenHbA1clevelsandbasalserumzinclevelsinthecontrol andexperimentalgroups,aswellasbetweenHbA1clevelsbefore andafteroralzincadministrationonlyintheexperimentalgroup. However,thechangeinHbA1clevelsafteroralzinc supplemen-tationhadasignificantnegativecorrelationwithbaselineHbA1c levels[22].
Proteinuriawasobservedintheexperimentalgroup,although withnochangebeforeandafteroralzincadministration.Zinc sup-plementationreducedalbuminexcretioninmicroalbuminurictype 2diabeticpatients[23],probablyduetotheantioxidanteffectof zinc[24].Thereisnoknownlinkbetweengeneticmutationsand nephropathy[3].Further, nephropathyhasnot beenwell char-acterizedasafeatureofBSS.However,Javoretal.[13]recently reportedelevated creatinineclearance inthemajorityofthese patients.Itispresumedthatcreatinineclearanceelevationreflects markedhyperfiltrationfromtheirlong-standingdiabetesmellitus [13].Moreover,therearesomecasereportswherepatientswere successfullytreatedwithrenaltransplantation,showingenhanced renaldysfunction[12,25].Wealsoobservedthatproteinurialevels andCZnvaluesshowednocorrelation.Lackofcorrelationbetween
urinaryzincandproteinexcretionwasreportedbyMartinez-Vea [26]inpatientswithnephroticsyndrome.AllourBSSpatientshad creatinineandBUNvalueswithinnormalreferenceranges.
The serum zinc profile during venous zinc administration increasedafterbaseline,showingadifferencebetweencontrols andtheexperimentalgroup(Fig.1A).However,indiabeticand hyperthyroidpatientsnodifferencewasobservedusingthesame methodology [11,27]. This finding may reflect changes in the biodistributionofzinc.
Withrespecttothezinckineticstudy,therewasnodifference amongAUC,Vd,t1/2,Kel,andCZn,beforeandafterdietandoralzinc administrationintheexperimentalgroup.However,therewasa differenceintheseparameterswhencomparedtothecontrolgroup (Fig.1B–F).Theseresultsarenotinagreementwithourprevious reports[11].First,wefoundnochangesinthekineticparametersof zincinpatientswithtype2diabetesmellitusfollowingvenouszinc administration,despitethepresenceofhyperglycemia.Second,we didnotobserveanyevidenceofzincdeficiencyinthesamediabetic patients.
Inthisregard,BSSpatientsshowed increasedCZn compared to the control group (Fig. 1F), demonstrating secondary zinc deficiency. Additionally, this parameter is much more useful thanserum zincconcentrationsindiagnosingsuboptimumzinc deficiencyinthisuniquesyndrome.Thus,theseresultsarein agree-mentwithNakamuraetal.[20],whoreportedCZn≥20mLkg−1h−1
ascutoffpoint.We foundvaluesof16.24±1.40 forthecontrol
groupand26.65±1.09(before)and25.18±1.54(afterdietand
oralzincadministration)fortheexperimentalgroup.Conversely, type1diabeticpatientshadnoCZndifferencewhencomparedto healthysubjects[11].Inadditiontotheabove,theseresultsmust beviewedwithsomecaution,sincethesestudieswereconducted withchildrenandzincinjectionwasdifferent.Nevertheless,Leite etal.[15]obtainedCZnconcentrationsoflessthan20mLkg−1h−1 in42childrenwithsuspectedzincdeficiency.
Furthermore,therewasnocorrelationbetweenbasalserumzinc levelsandCZn values(Table1)inthecontrolandexperimental group.Basalserumzinclevelslikelydonotreflectrealzinc sta-tus,incontrasttoCZn.Theexplanationforthisphenomenonisthat thereislittleplasmazinc(<0.1%or∼3.5mg)comparedto∼3gof
total-bodyzinccontentinadults.Thus,theserumzinc homeosta-sisisdifferentfromsomeelectrolyteslikesodiumandpotassium [28,29].
Detection of precocious zinc deficiency is very important becauseitisapotentialnutritionalfactor,whichcanestablish seri-ousabnormalitiesinrenalfunctionandmorphology,responsible forcardiovascularcomplications[9].
32
12 M.G.d.N.Santosetal./JournalofTraceElementsinMedicineandBiology26 (2012) 7–12
Acknowledgements
ThisstudywassupportedbyCNPqgrantn◦135226/06-6and
FAPERN(1◦Edital-PRONEX).WethankFranciscoPauloFreireNeto
forhisinvaluabletechnicalassistance.Wearealsogratefultothe Association ofParentsand Patients withBerardinelli-Seip Syn-dromeofRioGrandedoNorte(ASPOSBERN).
References
[1] BerardinelliW.Anundiagnosedendocrinometabolicsyndrome:reportoftwo cases.JClinEndocrinolMetab1954;14:193–204.
[2]SeipM.Lipodystrophyandgigantismwithassociatedendocrinemanifestation: anewdiencephalicsyndrome?ActaPaediatr1959;48:555–74.
[3] GargA.Acquiredandgeneticlipodystrophies.NEnglJMed2004;350:1220–34. [4]GargA.Lipodystrophies.AmJMed2000;108:143–52.
[5] HaqueWA,ShimomuraI, MatsuzawaY, GargA. Serumadiponectinand leptin levels in patients with lipodystrophies. J Clin Endocrinol Metab 2002;87:2395–8.
[6] FuM,KazlauskaiteR,BarachoMFP,SantosMGN,Brandão-NetoJ,VillaresS,etal. MutationsinGng3lgandAGPAT2inBerardinelli-Seipcongenital lipodystro-phyandBrunzellsyndrome:phenotypevariabilitysuggestsimportantmodifier effects.JClinEndocrinolMetab2004;89:2916–22.
[7] BrownKH,RiveraJA,BhuttaZ,GibsonRS,KingJC,LönnerdalB,etal. Inter-nationalZincNutritionConsultativeGroup(IZiNCG)technicaldocument#1. Assessmentoftheriskofzincdeficiencyinpopulationsandoptionsforits control.FoodNutrBull2004;25:S99–203.
[8] Sazawal S, Black RE, Ramsan M, Chwaya HM, Dutta A, Dhingra U, etal.Effectofzincsupplementationonmortalityinchildrenaged1–48 months:acommunity-basedrandomized placebocontrolledtrial. Lancet 2007;369:927–34.
[9] TomatAL,CostaMA,GirgulskyLC,VeirasL,WeisstaubAR,InserraF,etal.Zinc deficiencyduringgrowth:influenceonrenalfunctionandmorphology.LifeSci 2007;80:1292–302.
[10]YanagisawaH.Zincdeficiencyandclinicalpractice–validityofzinc prepara-tion.YakugakuZasshi2008;128:333–9.
[11]Brandão-NetoJ,SilvaCA,FigueiredoNB,ShuhamaT, HolandaMB,Diniz JM.Zinckineticsininsulin-dependentdiabetesmellituspatients.Biometals 2000;13:141–5.
[12] CasaliRE,ResnickJ,GoetzF,SimmonsRL,NajarianJS,KjellstrandC.Renal transplantationinapatientwithlipoatrophicdiabetes.Acasereport. Trans-plantation1978;26:174–7.
[13]JavorED,MoranSA,YoungJR,CochranEK,DePaoliAM,OralEA,etal.Proteinuric nephropathyinacquiredandcongenitalgeneralizedlipodystrophy:baseline
characteristicsandcourseduringrecombinantleptintherapy.JClinEndocrinol Metab2004;89:3199–207.
[14]NakamuraT,HigashiA,NishiyamaS,FujimotoS,MatsudaI.Kineticsofzinc statusinchildrenwithIDDM.DiabetesCare1991;14:553–7.
[15]LeiteLD,RochaEDM,AlmeidaMG,RezendeAA,SilvaCAB,Franc¸aMC,etal. Sensitivityofzinckineticsandnutritionalassessmentofchildrensubmittedto venouszinctolerancetest.JAmCollNutr2009;28:405–12.
[16] LoweNM,FeketeK,DecsiT.Methodsofassessmentofzincstatusinhumans: asystematicreview.AmJClinNutr2009;89:2040S–51S.
[17] BerdanierCD.Advancednutrition.Micronutrients.BocaRatón:CRCPress; 1998.
[18] RochaEDM,LeiteLD,BarachoMFP,SantosMGN,AraújoDM,Franc¸aMC,etal. Effectofdietinterventionandoralzincsupplementationonmetaboliccontrol inBerardinelli-Seipsyndrome.AnnNutrMetab2010;57:9–17.
[19]Hambidge M. Biomarkers of trace mineral intake and status. J Nutr 2003;133:948S–55S.
[20]NakamuraT,NishiyamaS,Futaigoishi-SuginoharaY,MatsudaI,HigashiA.Mild tomoderatezincdeficiencyinshortchildren:effectofzincsupplementation onlineargrowthvelocity.JPediatr1993;123:65–9.
[21] Agarwal AK, Garg A. Congenital generalized lipodystrophy: significance of triglyceridebiosyntheticpathways.TrendsEndocrinolMetab2003;14: 214–21.
[22]Al-MaroofRA,Al-SharbattiSS.Serumzinclevelsindiabeticpatientsandeffect ofzincsupplementationonglycemiccontroloftype2diabetics.SaudiMedJ 2006;27:344–50.
[23]KadhimHM,IsmailSH,HusseinKI,BakirIH,SahibAS,KhalafBH,etal.Effectsof melatoninandzinconlipidprofileandrenalfunctionintype2diabeticpatients poorlycontrolledwithmetformin.JPinealRes2006;41:189–93.
[24]ParhamM,Amini M,AminorroayaA,HeidarianE.Effectof zinc supple-mentationonmicroalbuminuriainpatientswithtype2diabetes:adouble blind, randomized, placebo-controlled, cross-over trial. Rev Diabet Stud 2008;5:102–9.
[25]MacNallyM,MannonRB,JavorED,SwansonSJ,HaleDA,GordenP,etal. Success-fulrenaltransplantioninapatientwithcongenitalgeneralizedlipodystrophy: acasereport.AmJTransplant2004;4:447–9.
[26] Martinez-VeaA,SerratN,PaternainJL,GarciaC,GarciaN,OliverJA.Zincand metallothioneinmetabolisminnephroticsyndrome.TraceElemElectrolytes 1996;13:14–7.
[27]FarooqiL,MazetoGM,ShuhamaT,Brandão-NetoJ.Effectsofasinglevenous doseofzinconthyroidstatusinhealthyindividualsandpatientswithGraves’ disease.MetBasedDrugs2000;7:151–5.
[28]KajiM,GotohM,TakagiY,MasudaH,KimuraY,UenoyamaY.Studiesto determinetheusefulnessofthezincclearancetesttodiagnosemarginalzinc deficiencyandtheeffectsoforalzincsupplementationforshortchildren.JAm CollNutr1998;17:388–91.
33
6. COMENTÁRIOS, CRÍTICAS E SUGESTÕES
A SBS vem sendo estudada pelo nosso grupo desde 1998, com publicações
em eventos científicos e periódicos nacionais e internacionais (Apêndice 2). Tendo
em vista a amplitude do tema e o progresso dos estudos sobre a função e as ações
do zinco na saúde humana, sobretudo nos metabolismos glicídico e lipídico,
planificamos o “Estudo da cinética de zinco como bom método para caracterizar
deficiência subótima de zinco na síndrome de Berardinelli-Seip”. Tema, até então,
não explorado na literatura médica.
O delineamento metodológico inicial funcionou, satisfatoriamente, sem a
necessidade de plano piloto, incluindo as análises bioquímica do sangue e da urina,
antes e após a suplementação oral de zinco.
O redirecionamento do estudo gerou novas informações que culminaram
com publicação do artigo Santos MG, Baracho MFP, Vale SH, et al. Kinetics of zinc
status and zinc deficiency in Berardinelli-Seip syndrome. J Trace Elem Med Biol,
26:7-12, 2012, atingindo nossa expectativa. Trata-se de um estudo inédito e
bastante oportuno, motivado pelas múltiplas ações do elemento zinco no organismo
humano e seus efeitos benéficos frente aos inúmeros distúrbios metabólicos,
conforme relatos encontrados na literatura.
A publicação do artigo em um periódico de impacto (FI = 2,176), demonstra
a importância cientifica do mesmo. No entanto, a procura incessante pelo
aprimoramento e novos conhecimentos constituem características inerentes à
pesquisa científica. Desse modo, a adiponectina, não contemplada no presente
trabalho, torna-se, sob nosso ponto de vista, um imperativo de novas investigações,
34
biológica desse hormônio, sobretudo, em portadores BSCL2/seipin que representam
a maioria dos nossos pacientes.
Reportamos que o nosso grupo publicou recentemente outro artigo revendo,
nesses pacientes, as implicações do diabetes mellitus, resistência à insulina e
hipoleptinemia, frente a administração oral e venosa de zinco. E nesse estudo não
foi possível incluir a adiponectina por razões financeiras (Rocha EDM, Leite LD,
Baracho MFP, et al. Effect of diet intervention and oral zinc supplementation on
metabolic control in Berardinelli-Seip syndrome. Ann Nutr Metabol, 57:9-17, 2010).
Por outro lado, a aplicação da cinética do zinco para caracterizar o status desse
micronutriente representa mais um avanço frente à inesgotável fonte de estudos em
que consistem esses pacientes.
As análises estatísticas utilizadas permitiram comprovar nossas hipóteses.
Demonstraram que a deficiência subótima do zinco e o status real desse
micronutriente na SBS podem ser evidenciados por meio do clearance corporal.
O mérito dessa publicação está, indubitavelmente, na sua originalidade e na
relevante contribuição que trará para a metabologia, uma vez que revela
concentrações muito baixas de zinco sérico e elevado clearance, significativamente
elevada, importantes para a compreensão do metabolismo intermediário.
Salientamos que apesar do ineditismo desse estudo, temos uma jornada
percorrida ao longo de pouco mais de uma década, acompanhando e assistindo o
grupo da ASPOSBERN, numa trajetória traduzida pelos trabalhos publicados e/ou
apresentados em congressos, nos quais atuamos como autor ou colaborador
(Apêndice 2).
O Cronograma foi cumprido satisfatoriamente, apesar de dificuldades
35
Não obstante as alterações ocorridas e as dificuldades existentes no
cumprimento do trabalho de pesquisa, pudemos computar um saldo cientificamente
positivo, uma vez que fatos como esses se convertem em oportunidade
enriquecedora.
Contemplando o caráter multidisciplinar do Programa de Pós-graduação em
Ciências da Saúde, o estudo desenvolvido além de contribuir para concretização
dessa tese na área de análises clínicas, também teve participação na elaboração de
uma dissertação na área de nutrição e em três teses na área médica, sendo em
curso médico, sendo duas em cardiologia e uma em genética molecular.
O crescimento intelectual e científico é item indissociável de um Programa
de Pós-graduação e a obtenção de um título não traduz conclusão dos estudos,
mas, finalização de uma etapa que nos deixa capacitados para próximos desafios.
Desse modo, a doutoranda, professora adjunto IV do Departamento de Análises
Clínicas e Toxicológicas, além de ministrar aulas na graduação do Curso de
Farmácia e na Especialização em Análises Clínicas, desenvolve atividades de
supervisão e orientação acadêmica, integra um grupo de pesquisa na base de
Bioanálises e participa do projeto de pesquisa denominado “Estudo clínico molecular
de indivíduos com síndrome de Berardinelli-Seip”. Além disso, coordena oprojeto de
extensão intitulado “Prevenindo a Obesidade e o Diabetes Mellitus em um Grupo de
Escolares Pré-Adolescentes e Adolescentes da Zona Leste do Natal/RN” e participa
do Ambulatório de Atenção à Saúde dos Portadores da Síndrome de
Berardinelli-Seip e do Projeto “Ações de Apoio e Educação Junto ao Indivíduo Diabético”.
Como perspectivas futuras, queremos continuar estudando os portadores da
SBS, desta feita, ampliando o leque de investigações acerca das adiponectinas e
36
quanto aos tipos da SBS existentes e identificar possíveis comorbidades da
síndrome nesses pacientes. Também é pretensão imediata nossa estudar,
bioquímica e molecularmente, três indivíduos portadores da SBS e do Traço
Falciforme.
Afirmamos ainda que a exemplo de um trabalho de conclusão do Curso de
Medicina, recentemente por nós co-orientado, estaremos disponíveis para
orientações em quaisquer níveis acadêmicos, bem como para a formação e
solidificação de grupos de pesquisa.
Adicionamos aos louros obtidos, a constatação gratificante da melhoria da
qualidade de vida desses pacientes, expressa inclusive verbalmente por eles. Isso
nos motiva a continuar prestando tal assistência.
Por fim, esclarecemos que outros parâmetros estudados, igualmente
importantes, isolados ou acrescidos, certamente darão origem a trabalhos
37
7. REFERÊNCIAS
1. Berardinelli W. An undiagnosed endocrinometabolic syndrome: report of 2 cases.
J Clin Endocrinol Metab 1954;14(2):193-204.
2. Seip M. Lipodystrophy and gigantism with associated endocrine manifestations.
A new diencephalic syndrome? Acta Paediatr 1959;48:555-574.
3. Garg A. Lipodystrophies. Am J Med 2000;108(2):143-152.
4. Garg A. Acquired and inherited lipodystrophies. N Engl J Med 2004;350(12):
1220-1234.
5. Alcaraz Quiñonero M, Leon RG, Ortigosa MAG, Gimenez RD, Ortiz MER, Ripoll
AA, et al. Lipodistrofia generalizada congénita. An Esp Pediatr
1992;37(2):173-174.
6. Berge T, Brun A, Hansing B, Kjellman B. Congenital generalized lipodystrophy -
report on one case, with special reference to postmortem findings. Acta Pathol
Microbiol Scand A 1976;84(1):47-54.
7. Garg A, Wilson R, Barnes R, Arioglu E, Zaidi Z, Gurakan F, et al. A gene for
congenital generalized lipodystrophy maps to human chromosome 9q34. J Clin
Endocrinol Metab 1999;84(9):3390-3394.
8. Magré J, Delépine M, Khallouf E, Gedde-Dahl T, Van Maldergem L, Sobel E, et
al. Identification of the gene altered in Berardinelli-Seip congenital lipodystrophy
on chromosome 11q13. Nat Genet 2001;28(4):365-370.
9. Kim CA, Delépine M, Boutet E, El Mourabit H, Le Lay S, Meier M, et al.
Association of a homozygous nonsense caveolin-1 mutation with
38
10. Rajab A, Straub V, McCann LJ, Seelow D, Varon R, Barresi R, et al. Fatal
cardiac arrhythmia and long-QT syndrome in a new form of congenital
generalized lipodystrophy with muscle rippling (CGL4) due to PTRF-CAVIN
mutations. PLoS Genet 2010;6(3):1-10.
11. Dwianingsih EK, Takeshima Y, Itoh K, Yamauchi Y, Awano H, Malueka RG, et al.
A Japanese child with asymptomatic elevation of serum creatine kinase shows
PTRF-CAVIN mutation matching with congenital generalized lipodystrophy type
4. Mol Genet Metab 2010;101(2-3):233-237.
12. Hayashi YK, Matsuda C, Ogawa M, Goto K, Tominaga K, Mitsuhashi S, et al.
Human PTRF mutations cause secondary deficiency of caveolins resulting in
muscular dystrophy with generalized lipodystrophy. J Clin Invest 2009;119(9):
2623-2633.
13. Hill MM, Bastiani M, Luetterforst R, Kirkham M, Kirkham A, Nixon SJ, et al.
PTRF-cavin, a conserved cytoplasmic protein required for caveola formation and
function. Cell 2008;132(1):113-124.
14. Jeninga EH, Kalkhoven E. Central players in inherited lipodystrophies. Trends
Endocrinol Metab 2010;21(10):581-587.
15. Vigouroux C, Caron-Debarle M, Le Dour C, Magré J, Capeau J. Molecular
mechanisms of human lipodystrophies: from adipocyte lipid droplet to oxidative
stress and lipotoxicity. Int J Biochem Cell Biol 2011;43(6):862-876.
16. Agarwal AK, Arioglu E, Almeida S, Akkoc N, Taylor SI, Bowcock AM, et al.
AGPAT2 is mutated in congenital generalized lipodystrophy linked to
chromosome 9q34. Nat Genet 2002;31(1):21-23.
17. Haque WA, Shimomura I, Matsuzawa Y, Garg A. Serum adiponectin and leptin
39
18. Hegele RA, Joy TR, Al-Attar SA, Rutt BK. Lipodystrophies: windows on adipose
biology and metabolism. J Lipid Res 2007;48(7):1433-1444.
19. Simha V, Garg A. Inherited lipodystrophies and hypertriglyceridemia. Curr Opin
Lipidol 2009;20(4):300-308.
20. Seip M, Trygstad O. Generalized lipodystrophy, congenital and acquired
(lipoatrophy). Acta Paediatr Suppl 1996;413:2-28.
21. Westvik J. Radiological features in generalized lipodystrophy. Acta Paediatr
Suppl 1996;413:44-51.
22. Bhayana S, Hegele RA. The molecular basis of genetic lipodystrophies. Clin
Biochem 2002;35(3):171-177.
23. Seip M. The syndrome of generalized lipodystrophy. Birth Defects Orig Artic Ser
1975;11(2):325-327.
24. Fu M, Kazlauskaite R, Baracho MDP, Santos MGD, Brandao-Neto J, Villares S,
et al. Mutations in Gng3lg and AGPAT2 in Berardinelli-Seip congenital
lipodystrophy and Brunzell syndrome: phenotype variability suggests important
modifier effects. J Clin Endocrinol Metab 2004;89(6):2916-2922.
25. Gomes KB, Pardini VC, Fernandes AP. Clinical and molecular aspects of
Berardinelli-Seip congenital lipodystrophy (BSCL). Clin Chim Acta
2009;402(1):1-6.
26. Pardini VC, Victória IM, Rocha SM, Andrade DG, Rocha AM, Pieroni FB, et al.
Leptin levels, beta-cell function, and insulin sensitivity in families with congenital
and acquired generalized lipoatropic diabetes. J Clin Endocrinol Metab
40
27. Santos MGN, Medeiros TMD, Baracho MFP, Brandao-Neto J, Gurgel AM, Silva
AS. Lipodistrofia Generalizada Congênita: correlação com leptina e outros
aspectos bioquímicos. Acta Cir Bras. 2005;20 Suppl 1:190-5.
28. Oral EA. Lipoatrophic diabetes and other related syndromes. Rev Endocr Metab
Disord 2003;4(1):61-77.
29. Schutz Y, Golay A, Dusmet M, Felber JP, Mosse A. Physiopathological
mechanisms in lipoatrophic diabetes. Diabetes Metab 1986;12(6):355-358.
30. Schwartz R, Schafer IA, Renold AE. Generalized lipodystrophy, hepatic cirrhosis,
disturbed carbohydrate and accelerated growth (lipoatrophic diabetes). Am J
Med 1960;28(6):973-985.
31. Agarwal AK, Garg A. Genetics basis of lipodystrophies and management of
metabolic complications. Annu Rev Med 2006;57:297-311.
32. Miranda DM, Wajchenberg BL, Calsolari MR, Aguiar MJ, Silva JMCL, Ribeiro
MG, et al. Novel mutations of the BSCL2 and AGPAT2 genes in 10 families with
Berardinelli-Seip congenital generalized lipodystrophy syndrome. Clin Endocrinol
(Oxf) 2009;71(4):512-517.
33. Casali RE, Resnick J, Goetz F, Simmons RL, Najarian JS, Kjellstrand CT. Renal
transplantation in a patient with lipoatrophic diabetes: a case report.
Transplantation 1978;26(3):174-177.
34. Javor ED, Moran SA, Young JR, Cochran EK, DePaoli AM, Oral EA, et al.
Proteinuric nephropathy in acquired and congenital generalized lipodystrophy:
baseline characteristics and course during recombinant leptin therapy. J Clin
41
35. Musso C, Javor E, Cochran E, Balow JE, Gorden P. Spectrum of renal diseases
associated with extreme forms of insulin resistance. Clin J Am Soc Nephrol
2006;1(4):616-622.
36. Saito I, Saruta T, Iyori S, Sakaguchi H. The renal lesion associated with total
lipodystrophy. J Am Geriatr Soc 1977;25(4):175-178.
37. Senior B, Gellis SS. The syndromes of total lipodystrophy and of partial
lipodystrophy. Pediatrics 1964;33:593-611.
38. Bjornstad PG, Foerster A, Ihlen H. Cardiac findings in generalized lipodystrophy.
Acta Paediatr Suppl 1996;413:39-43.
39. Prasad AN. Berardinelli Seip syndrome - case report. Armed Forces Med J India
2006;62:83-84.
40. Al-Maroof RA, SS. l-S. Serum zinc levels in diabetic patients and effect of zinc
supplementation on glycemic control of type 2 diabetics. Saudi Med J
2006;27(3):344-50.
41. Prasad AS. Zinc deficiency: Has been known of for 40 years but ignored by
global health organisations. BMJ 2003;326:409-10.
42. Tomat AL, Costa MA, Girgulsky LC, Veiras L, Weisstaub AR, Inserra F, et al. Zinc
deficiency during growth: Influence on renal function and morphology. Life
Sciences 2007;80:1292-302
43. Hotz C, Brown KH. Assessment of the Risk of Zinc Deficiency in Populations and
Options for Its Control. International Zinc Nutrition Consultative Group (IZiNCG).
Food Nutr Bull 2004;25(1 (suppl 2)):91-204.
44. Valko M, Morris H, Cronin MTD. Metals, toxicity and oxidative stress. Curr medic
42
45. Coleman JE. Zinc proteins: enzymes, storage proteins, transcription factors, and
replication proteins. Ann rev biochem 1992;61:897-946.
46. Vallee BL, Falchuk KH. The biochemical basis of zinc physiology. Physiol Rev
1993;73(1):79-118.
47. Mafra D, Cozzolino SMF. Importância do zinco na nutrição humana. Rev Nutr
2004;17(1):79-87.
48. Salgueiro MJ, Zubillaga M, Lysionek A, Cremaschi G, Goldman CG, Caro R, et
al. Zinc status and immune system relationship: a review. Biol Trace Elem Res
2000;76(3):193-205.
49. Sena KCM, Pedrosa LFC. Efeitos da suplementação com zinco sobre o
crescimento, sistema imunológico e diabetes. Rev Nutr 2005;8(2):251-9.
50. Baer MT, King JC. Tissue zinc levels and zinc excretion during experimental zinc
depletion in young men. Am J Clin Nutr 1984;39:556-70.
51. Bales CW, DiSilvestro RA, Currie KL, Plaisted CS, Joung H, Galanos AN, et al.
Marginal zinc deficiency in older adults: responsiveness of zinc status indicators.
J Am Coll Nutr 1994;13(5):455-62.
52. Salgueiro MJ, Bioch MZ, Sarabia MI, Caro R, Paoli TD. Zinc as an essential
micronutrient: a review. Nutr Res 2000;20(5):737-55.
53. Sian L, Mingyan X, Miller LV, Tong L, Krebs NF, Hambidge KM. Zinc absorption
and intestinal losses of endogenous zinc in young Chinese women with marginal
zinc intakes. Am J Clin Nutr 1996;63(3):348-53.
54. Hambidge M. Biomarkers of Trace Mineral Intake and Status. J Nutr 2003;133(3):
948S-55S.
55. King JC. Assessment of Zinc Status. J Nutr 1990;120:1474-9.