ESTRATÉGIAS REPRODUTIVAS DE Leiothrix vivipara (Bong.)
Ruhl (ERIOCAULACEAE) NA SERRA DO CIPÓ
MARCOS HANASHIRO E SILVA
MARCOS HANASHIRO E SILVA
ESTRATÉGIAS REPRODUTIVAS DE Leiothrix vivipara (Bong.)
Ruhl (ERIOCAULACEAE) NA SERRA DO CIPÓ
BELO HORIZONTE – MG 2012
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Vegetal do Departamento de Botânica do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, como requisito parcial à obtenção do título de Mestre em Biologia Vegetal.
Área de concentração: Botânica Aplicada Orientadora: Profa. Dra. Queila Souza Garcia
Universidade Federal de Minas Gerais Coorientador: Prof. Dr Fernando H. Aguiar Vale
AGRADECIMENTOS
À professora Queila Souza Garcia por ter aceitado a parceria que resultou nesta orientação, pelo convívio sempre agradável e pelo incentivo em melhorar sempre.
Ao professor Fernando Henrique Aguiar Vale pela confiança depositada, por ter me orientado na academia e fora dela e por ter me contagiado com seu fascínio pela anatomia vegetal e pelos campos rupestres.
À professora Rosy Mary dos Santos Isaias pelas orientações em projetos paralelos, pelas conversas sinceras e pelos momentos de descontração compartilhados.
Às professoras Andréa Rodrigues Marques e Vera Lúcia Scatena por terem aceitado participar da banca examinadora como membros titulares. Aos suplentes, José Pires de Lemos Filho, Rosy Mary dos Santos Isaias e, em especial, à professora Denise Maria Trombert de Oliveira que aceitou assumir prontamente a titularidade, quando solicitada.
Ao Programa de Pós-Graduação em Biologia Vegetal da UFMG, pela oportunidade de realização do curso.
Aos professores do Departamento de Botânica, pela contribuição na minha formação. Aos funcionários do Departamento de Botânica.
Aos centros de microscopia eletrônica da UFMG, do ICB e do Laboratório de Fitopatologia da UFLA.
Aos motoristas do ICB.
Ao IBAMA, por conceder a licença de coleta. À FAPEMIG, pelo apoio financeiro.
Aos amigos do Laboratório de Anatomia Vegetal pela convivência fantástica ao longo dos anos, por estarem sempre dispostos a ajudar e ensinar, e pelas inúmeras “happy hours”. Agradeço especialmente aos meus “irmãos” (Luciana, Maria Tereza e Vinícius) e a alguns “primos” (Anete, Ariane, Bruno, Cibele, Renê, Rafaella, Sarah e Thiago).
Aos meus amigos da biologia que sempre proporcionaram alegria e descontração. Aos meus irmãos de coração pela amizade duradoura.
À Cláudia pelo companheirismo, amor e incentivo durante toda esta importante trajetória. Aos meus queridos pais Luzia e Tião, e irmã Marina por todo amor, carinho e suporte.
SUMÁRIO
RESUMO ... 1
ABSTRACT ... 2
INTRODUÇÃO ... 3
MATERIAL E MÉTODOS ... 5
Área de estudo ... 5
Morfologia e anatomia ... 5
Morfometria e viabilidade das sementes ... 6
Germinação e emergência de plântulas ... 7
Análise estatística ... 8
RESULTADOS ... 9
Morfologia e anatomia ... 9
Morfometria e viabilidade das sementes ... 10
Germinação e emergência de plântulas ... 11
DISCUSSÃO ... 12
CONCLUSÕES ... 15
REFERÊNCIAS BIBLIOGRÁFICAS ... 16
RESUMO
A reprodução vegetativa através de brotamentos em estruturas reprodutivas é denominada pseudoviviparidade e é encontrada em plantas que vivem em ambientes terrestres com alta sazonalidade, como regiões de montanha, árticas ou desérticas. Leiothrix vivipara (Eriocaulaceae), uma espécie endêmica dos campos rupestres da Cadeia do Espinhaço no sudeste do Brasil, além da reprodução por sementes, apresenta pseudoviviparidade. O objetivo deste trabalho foi caracterizar anatomicamente o desenvolvimento dos rametes originados nas estruturas reprodutivas em L. vivipara e avaliar a viabilidade, a germinabilidade das sementes em laboratório e a emergência de plântulas sob condições naturais. Para morfologia e anatomia, os capítulos foram preparados para microscopia eletrônica de varredura e microscopia de luz. A viabilidade foi estimada através do teste de tetrazólio em sementes recém-coletadas e armazenadas por 12 meses. Testes de germinação foram realizados em câmaras de germinação utilizando fotoperíodo de 12 h e escuro contínuo sob diversas temperaturas, bem como aplicação de giberelina nas concentrações de 500 e 1000 µmol. Experimentos foram instalados no campo para avaliar a emergência das plântulas sob condições naturais e sob influência do fogo. A microscopia revelou que as folhas originadas no capítulo são formadas pelo meristema reprodutivo. Quando a produção de flores cessa, o meristema começa a produzir folhas e estas podem ser observadas no centro do capítulo, antes da antese de algumas flores estaminadas. As novas folhas são formadas a partir de um redirecionamento da diferenciação das células meristemáticas, retomando a expressão de estruturas vegetativas que constituirão os rametes. A viabilidade das sementes é alta, porém, a germinabilidade foi baixa sob todas as condições testadas. O armazenamento não alterou significativamente a viabilidade das sementes e a aplicação de giberelina não promoveu a germinação. A emergência de plântulas no campo atingiu os maiores valores quando as sementes foram semeadas em solo esterilizado e o fogo não exerceu influência sobre a emergência das plântulas. Os resultados indicam que a reprodução clonal representa o maior investimento reprodutivo de L. vivipara e que, apesar do recrutamento de plântulas ser muito pequeno, seu papel é importante na manutenção da variabilidade genética da população.
ABSTRACT
Pseudovivipary is a kind of vegetative reproduction characterized by the development of plantlets on reproductive structures. This form of reproduction occurs in plants living in terrestrial environments with high seasonality such as the Arctic, highlands, or deserts.
Leiothrix vivipara (Eriocaulaceae), an endemic species from the “campos rupestres”
vegetation of the Espinhaço mountain chain in southeastern Brazil, presents this type of reproduction. The objective of this study was to anatomically characterize the development of ramets originated by pseudovivipary in L. vivipara, and evaluate the viability and germination of seeds in the laboratory and seedling emergence under natural conditions. For morphological and anatomical analyses, the inflorescences were prepared for scanning electron and light microscopies. Viability was estimated using the tetrazolium test in fresh and in seeds stored for 12 months. Germination tests were carried out in germination chambers using 12 h photoperiod and continuous darkness under various temperatures, as well the application of gibberellic acid at concentrations of 500 and 1000 µmol. Field experiments were carried out to evaluate seedling emergence either under natural conditions or under the influence of fire. Microscopical analysis revealed that leaves were originated from the central reproductive meristem, after the end of flowers production, just before anthesis of some staminate flowers. The new leaves are formed by a change in the fates of the meristematic cells, reassuming the production of vegetative structures, which constitute the ramets. Seed viability is high, however germination was very low under all conditions tested. The storage did not significantly alter the viability of the seeds and gibberellin application did not promote germination. The emergence in the field reached the highest values when the seeds were sown in sterilized soil and the fire did not influence seedling emergence. The results indicate that clonal reproduction represents the largest reproductive investment of L. vivipara and despite the recruitment of seedlings being very small, their role is important to maintain genetic variability of the population.
INTRODUÇÃO
Muitas espécies de plantas perenes combinam reprodução sexuada com reprodução clonal e a importância relativa destes dois modos de reprodução pode variar entre e dentro de espécies (Eckert, 2002). Em geral, a reprodução vegetativa permite que a prole se estabeleça rapidamente, uma vez que os clones permanecem fisiologicamente ligados à planta-mãe (Harper, 1985; Pitelka e Ashmun, 1985). Esta estratégia torna-se muito importante em habitats de solo pobre e com baixa capacidade de reter umidade, como é o caso dos campos rupestres (Figueira e Del Sarto, 2007).
A relação entre o investimento em reprodução clonal e sexuada pode ter interferência de diversos fatores, incluindo a densidade intraespecífica (Humphrey e Pyke, 1998), disponibilidade de nutrientes (van Baalen et at., 1990) e de luz (Lezberg et al., 2001) e herbivoria (Fischer e van Kleunen, 2002). A germinação é influenciada principalmente por luz e temperatura (Baskin e Baskin, 1988). A luz é geralmente necessária para a germinação de sementes pequenas (Milberg et al., 2000; Thompson e Grime, 1983), cujas espécies habitam ambientes abertos (Baskin e Baskin, 1971; Hewitt, 1998). A temperatura influencia na velocidade e na porcentagem de germinação, principalmente por alterar as velocidades de absorção de água e das reações metabólicas responsáveis pelo desenvolvimento da plântula (Bewley e Black, 1994).
Pseudoviviparidade é o termo utilizado para a reprodução vegetativa através de brotamentos a partir de estruturas reprodutivas (Elmqvist e Cox, 1996). Esta forma de reprodução é encontrada em plantas que vivem em ambientes terrestres com alta sazonalidade, como regiões de montanha, árticas ou desérticas, que propiciam curtas estações favoráveis para a germinação e o estabelecimento da prole (Lee e Harmer, 1980; Elmqvist e Cox, 1996) e tem sido relatada em diversas famílias como Agavaceae, Alliaceae, Amaryllidaceae, Bromeliaceae, Cactaceae, Crassulaceae, Cyperaceae, Eriocaulaceae, Gesneriaceae, Juncaceae, Poaceae, Polygonaceae, Oxalidaceae e Saxifragaceae (Arizaga e Ezcurra, 2002; Elmqvist e Cox, 1996; Gordon-Gray et al., 2009; Wang e Cronk, 2003).
ocorrência pantropical e sua diversidade concentra-se nas montanhas da América do Sul, especialmente no sudeste do Brasil. Compreende cerca de 1.100 espécies, distribuídas em 11 gêneros. Seus indivíduos caracterizam-se pelo porte herbáceo a subarbustivo, folhas dispostas em roseta nos caules aéreos ou rizomas, de onde crescem escapos portando inflorescências do tipo capítulo, que são bastante conspícuos na família (Giulietti e Hensold, 1990; Giulietti et al., 2000).
As Eriocaulaceae pseudovivíparas ainda são pouco estudadas, entretanto, Leiothrix
vivipara (Bong.) Ruhl. é uma espécie que tem sido alvo de um maior número de estudos. Leiothrix vivipara apresenta caule curto, com folhas lineares, de textura membranácea a
coriácea e dispostas em roseta, raízes adventícias esbranquiçadas, escapos flexuosos abundantes, capítulos monoicos e flores diclinas. Esta espécie é endêmica da Cadeia do Espinhaço, em Minas Gerais, e ocorre em solos arenosos e secos dos topos de morro, ou em solos argilosos úmidos em terrenos alagáveis. A colonização do ambiente, não raro, está associada a manchas extensas e dominantes de rosetas enraizadas, escapos e capítulos, formando um emaranhado que dificulta a individualização dos espécimes (Giulietti, 1978).
MATERIAL E MÉTODOS Área de Estudo
A Serra do Cipó localiza-se na porção sul da Cadeia do Espinhaço, conjunto de serras que se estende ao longo dos estados de Minas Gerais e Bahia e possui aproximadamente 1.100 km de extensão na direção Norte-Sul, e de 50 a 100 km de largura (Figura 1A). Suas serras possuem altitudes que variam entre 800 e 2.000 m (Moreira, 1977). Nas áreas com altitude superior a 900 m, ocorre a predominância dos campos rupestres (Figura 1B). A cadeia do Espinhaço encontra-se na interface de dois importantes biomas brasileiros: o cerrado, na região central, e a mata atlântica no litoral, o que contribui para uma grande diversidade biológica (Echternacht et al., 2011). O clima da região da Serra do Cipó pode ser classificado no sistema Köppen como (Cwb), caracterizado por um verão chuvoso de 5-6 meses e um inverno seco de 6-7 meses (Marques et al., 2000).
A população de L. vivipara estudada se encontra em área de solo arenoso dos campos rupestres (Figura 1C), nos arredores do Parque Nacional da Serra do Cipó no município de Santana do Riacho, 120 km a nordeste de Belo Horizonte no estado de Minas Gerais (19°17’14”S e 43°35’16”W). O material testemunho foi depositado no Herbário do Departamento de Botânica, Universidade Federal de Minas Gerais, Brasil (BHCB no 154000).
Morfologia e anatomia
Foram realizadas excursões mensais entre fevereiro de 2009 e maio de 2010 para o acompanhamento do desenvolvimento e coleta de capítulos para os estudos de anatomia e morfologia. Os capítulos foram classificados em cinco estágios de desenvolvimento: capítulo fechado, capítulo aberto, capítulo com as primeiras folhas, capítulo com folhas bem desenvolvidas e capítulo transformado em roseta. Os capítulos de todos os estágios foram fixados em FAA 50 (formaldeído 37-40%, ácido acético glacial e álcool etílico 50% 1:1:18 v/v) por 48 horas e, posteriormente, preservados em álcool etílico 70% (Johansen, 1940).
Para microscopia eletrônica de varredura (MEV), as amostras foram pós-fixadas em tetróxido de ósmio 2% (2 horas), lavadas em água destilada e desidratadas em série etílica (Johansen 1940). Em seguida, o material foi levado ao aparelho de ponto crítico (Bal-Tec® CPD030; Balzers Union® - CPD020), montado em stubs e coberto com 15-30 nm de ouro em metalizador (Bal-Tec® SCD 050; Edward Scancoat® Six) para a observação ao microscópio eletrônico de varredura (Leo Evo® 40; Fei® Quanta 200F).
Cortes a mão livre foram clarificados com hipoclorito de sódio 1% e corados com azul de astra e safranina (1:9 v/v) (Kraus e Arduin, 1997) com concentração modificada para 0,5 e montados entre lâmina e lamínula utilizando gelatina glicerinada de Kaiser (Kraus e Arduin, 1997). Para a confecção de lâminas permanentes, amostras foram desidratadas em série etílica e incluídas em historesina (2-hidroxietil metacrilato) Leica®, seccionadas em micrótomo rotativo (Jung Biocut® 2035) com espessura de 6 a 10 µm e corados com azul de toluidina 0,05% em NaHPO4 0,1 M (pH6,8) (O’Brien & McCully, 1981). O registro fotográfico do material preparado para microscopia de luz foi realizado utilizando câmera digital Canon® A630 acoplada ao fotomicroscópio Olympus® BH-2 ou câmera digital Canon® A650 acoplada ao microscópio Zeiss® Primo Star.
Morfometria e viabilidade das sementes
A coleta de capítulos em fase de dispersão de sementes ocorreu durante os meses de outubro e novembro de 2009, 2010 e 2011. Em laboratório, os capítulos foram triturados com auxílio de liquidificador e peneirados para a separação das sementes (Oliveira e Garcia, 2005).
A massa fresca (µg) e a massa seca (µ g) foram obtidas por meio da pesagem de sementes recém coletadas e após a secagem em estufa a 80 ºC por 48 horas, sendo utilizada uma amostragem de 400 sementes distribuídas em quatro repetições de 100. Foram utilizadas 200 sementes para a obtenção do comprimento (mm) e diâmetro (mm). As sementes foram fotografadas com câmera digital Canon® A650 em microscópio estereoscópio Zeiss® Stemi 2000-C e as medidas de comprimento e diâmetro foram realizadas utilizando o software livre ImageJ® (NIH, USA).
Devido à reduzida massa das sementes, a permeabilidade do envoltório seminal foi avaliada por meio do aumento do diâmetro. Foram fotografadas e medidas (como no procedimento anterior) 80 sementes antes e após 72 horas de imersão em água destilada.
sendo consideradas viáveis aquelas cujos embriões apresentaram coloração rósea ou avermelhada.
Germinação e emergência de plântulas
Testes de germinação foram realizados em câmaras de germinação com luz e temperaturas controladas. Para todos os tratamentos foram utilizadas quatro repetições de 50 sementes, que foram mantidas em placas de Petri forradas com folha dupla de papel filtro umedecida com solução de nistatina 1% (Lemos Filho et al., 1997). Testes com sementes recém coletadas e armazenadas por 12 meses foram realizados sob fotoperíodo de 12 h (30 µmol m-2 s-1) e escuro contínuo nas temperaturas constantes de 15, 20, 25 e 30 ºC. As sementes recém-coletadas também foram submetidas à alternância de 30 ºC (luz) / 15 ºC (escuro). A condição de escuro foi obtida pelo envolvimento das placas em papel alumínio e saco plástico opaco e o monitoramento dos tratamentos de escuro ocorreu sob luz verde. A germinação foi acompanhada diariamente por 40 dias e o critério utilizado para determinar a ocorrência da germinação foi a emergência do eixo vegetativo (Scatena et al., 1993; 1996).
Com o objetivo de avaliar a influência da giberelina na germinação de sementes recém-coletadas e armazenadas de L. vivipara, foram realizados tratamentos com solução de GA3 (Sigma-Aldrich) nas concentrações de 500 e 1000 µM. As sementes foram embebidas na solução de GA3 por 24 horas e após este período, foram trocadas de placa e umedecidas com solução de nistatina 1%, as placas foram mantidas em câmara de germinação a 25 ºC sob fotoperíodo de 12h.
verificar sua sobrevivência.
Para avaliar a influência do fogo sobre a emergência de plântulas oriundas das sementes presentes no solo do local de ocorrência da espécie, foram demarcadas parcelas de aproximadamente 60x60 cm em meio à população de L. vivipara e queimadas artificialmente em setembro de 2011 (final da estação seca). Sobre o local queimado, foram instaladas, diretamente no solo, 15 tampas como as dos recipientes do experimento anterior, sem a introdução de sementes ou alteração no solo (Figura 2C). No entorno desses, em local não queimado foram instaladas 15 tampas, adotadas como controle (Figura 2D). A germinação e a sobrevivência das plântulas foram monitoradas como no experimento anterior.
Análise estatística
RESULTADOS
Morfologia e anatomia
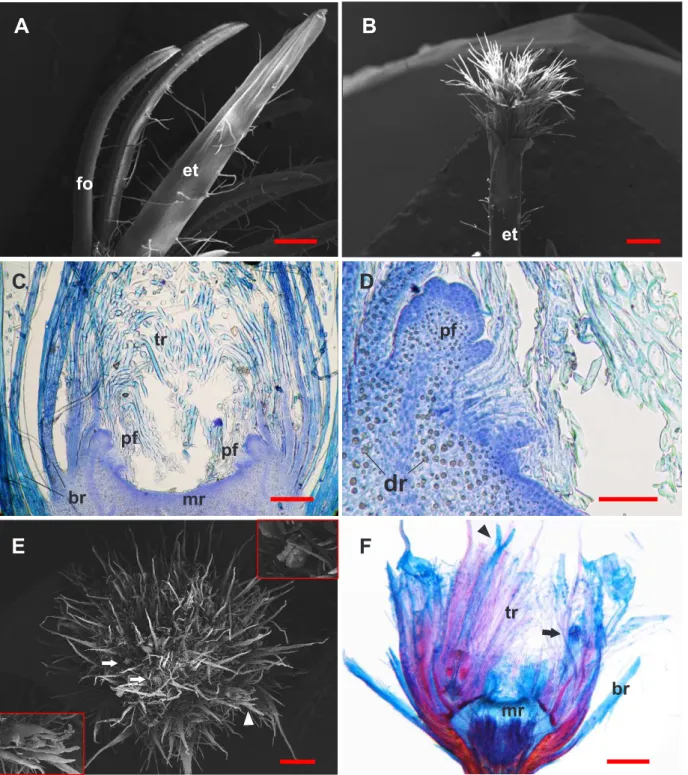
O escapo de L. vivipara tem seu desenvolvimento inicial envolvido por uma bráctea, a espata (Figura 3A). O escapo cresce através da espata e expõe no seu ápice o capítulo com muitos tricomas no início do desenvolvimento (Figura 3B). Os escapos apresentam comprimento muito variável, podendo ter de dois a mais de 40 cm. Cada um dos cinco estágios do capítulo, pré-definidos, foi analisado separadamente:
Capítulo fechado – É o estágio mais jovem, no qual as brácteas involucrais se
encontram fechadas protegendo o meristema, o que confere um aspecto alongado ao capítulo (Figura 3C). A região meristemática é côncava, as células são pequenas com paredes finas, citoplasma denso e núcleo evidente. A região apresenta um grande número de drusas. O meristema apical produz primórdios florais em sua periferia (Figuras 3C e 3D).
Capítulo aberto – À medida que a inflorescência se desenvolve, o seu eixo se expande
e as flores, distribuídas em meio a grande quantidade de tricomas conferem um aspecto denso à superfície do capítulo (Figura 3E), de plano a ligeiramente convexo. As flores de L. vivipara são unissexuais, as pistiladas estão dispostas em uma única série periférica, enquanto as estaminadas encontram-se em várias séries dispostas internamente a estas. As flores estaminadas mostram-se mais abundantes que as pistiladas. As flores pistiladas, que se desenvolvem primeiro, são as primeiras a atingir o período de antese e seus estigmas são observados na superfície do capítulo. A partir desta fase as flores estaminadas começam a expor as anteras na superfície do capítulo, mas a maioria ainda se encontra imersa entre os tricomas e seu período de antese é mais extenso, se estendendo até os estágios seguintes de capítulo. O meristema apical varia de plano a ligeiramente côncavo (Figura 3F).
Capítulo com as primeiras folhas emergindo– Neste estágio é possível observar,
macroscopicamente, uma coroa de folhas fotossintetizantes emergindo no centro do capítulo (Figura 4A). A produção de folhas ocorre antes e durante o período de antese das flores estaminadas (Figuras 4A e 4B). Os primórdios foliares são observados no centro do capítulo em torno do meristema apical enquanto as folhas mais desenvolvidas emergem na superfície do capítulo em meio aos tricomas (Figura 4B. Nesta fase, notam-se pericarpos jovens com sementes em desenvolvimento (Figura 4B).
Capítulo com folhas bem desenvolvidas – As folhas vão sendo produzidas
da roseta no qual o capítulo está se transformando (Figura 4C Os traços que fazem a vascularização das novas folhas são bem evidentes. As flores, brácteas e tricomas são empurrados para a periferia do capítulo pelo crescimento do caule e pela adição de novas folhas, que passam a ser maioria no capítulo. Neste estágio, observam-se sementes maduras em fase de dispersão e vestígios de frutos (Figura 4C, 4D) A partir deste estágio, também é comum observar nas axilas de algumas folhas, a formação de um escapo floral protegido pela espata (Figura 4C, 4E).
Capítulo transformado em roseta – Neste estágio, o capítulo se encontra tomado pelas
folhas e não é possível encontrar as flores ou vestígios da inflorescência. Assim, é mais apropriado chamar esta estrutura de ramete, pois a partir deste momento a estrutura é completamente vegetativa (Figura 4E).
Por serem finos e flexíveis os escapos de L. vivipara não conseguem se sustentar na vertical quando apresentam comprimento maior que 15 cm e crescem paralelamente ao solo, apoiando-se na vegetação ou no próprio terreno. Ao tocar o solo, os capítulos que já se encontram com folhas desenvolvidas no centro estão aptos a se enraizar. Isto ocorre com mais freqüência em capítulos que possuem escapos mais compridos. Os rametes enraizados permanecem ligados à planta mãe até que algum esforço mecânico ou a degradação natural do escapo os separe. Quando o escapo é curto, as rosetas vegetativas permanecem suspensas por mais tempo. Foi verificado que na floração do ano seguinte à produção dos capítulos vegetativos, os dois últimos estágios de capítulo estão aptos a emitir novas inflorescências, independente de estarem enraizados ou suspensos. Até três gerações de rosetas puderam ser observadas suspensas, sequencialmente, pelos escapos.
Morfometria e viabilidade das sementes
As sementes de L. vivipara apresentam formato elipsoide com envoltório de coloração amarelo-ocre (Munsell 5 Y 8/12) e aspecto rugoso (Figura 5A e 5B), medindo 0,52 ± 0,04 mm de comprimento e 0,33 ± 0,03 mm de diâmetro. A massa fresca da semente é 20,1 ± 1,0 µg e a massa seca 17,4 ± 0,7 µg, o que representa um conteúdo de água de 13,4 ± 6,04%. Após 72 horas imersas em água destilada, as sementes apresentaram um aumento significativo de 6,4% em seu diâmetro,
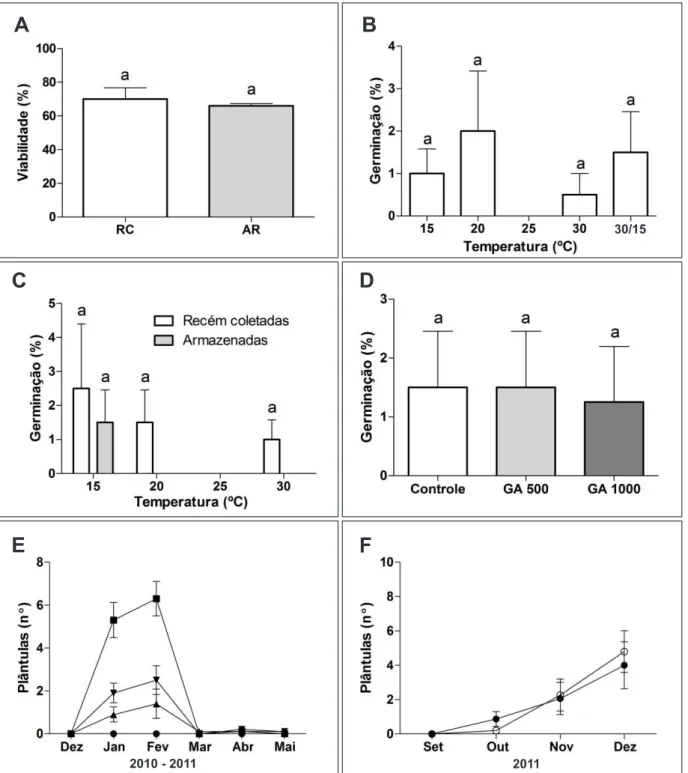
ao final do teste de germinação mdiferiu da viabilidade do lote de origem apenas no tratamento que foi submetido à temperatura de 30 ºC.
Germinação e emergência de plântulas
Em câmara de germinação, as sementes de L. vivipara germinaram somente na presença de luz, porém, o percentual de germinação em todas as temperaturas testadas (incluindo a alternância 30/15 ºC), foi muito baixo, sem diferença significativa entre os tratamentos (Figura 6B). O armazenamento a seco por 12 meses não alterou a germinação das sementes (Figura 6C). Os tratamentos com giberelina a 500 e 1000 µ M não diferiram do controle (Figura 6D).
No experimento in situ, o maior número médio de plântulas foi observado no tratamento com sementes semeadas em solo estéril (6,4 plântulas), seguido pelos de sementes semeadas em solo natural (2,8 plântulas) e solo natural sem sementes (1,5 plântulas). Não houve emergência no tratamento de solo estéril sem sementes. A emergência das plântulas no tratamento de sementes semeadas em solo estéril no experimento in situ foi significativamente maior que os demais e atingiu 12,8%, maior também que os valores obtidos nos experimentos de germinação. Estas porcentagens foram atingidas após 60 dias, no início do mês de fevereiro. No mês de março, todas as plântulas se encontravam mortas (Figura 6E). Durante o experimento ocorreu um período de seca de aproximadamente 30 dias com início na segunda quinzena de janeiro.
DISCUSSÃO
Monteiro-Scanavaca e Mazzoni (1976) sugeriram que o meristema responsável pela pseudoviviparidade poderia estar relacionado a células meristemáticas residuais ou a uma rediferenciação de outros tecidos. No entanto, o presente estudo mostra que em todos os estágios, desde o capítulo fechado até a formação do ramete, observou-se uma região meristemática na porção apical do capítulo. Nos primeiros estágios este meristema é responsável pelo desenvolvimento do capítulo, produzindo brácteas, flores e tricomas. Em determinado momento o meristema cessa a produção dessas estruturas reprodutivas e inicia a produção de folhas fotossintetizantes equivalentes às da roseta-mãe, que formarão o ramete, evidenciando um redirecionamento na diferenciação das células meristemáticas da inflorescência. Em Agavaceae e Cyperaceae, os rametes são formados a partir de meristemas nas axilas das brácteas presentes nos eixos da inflorescência (Arizaga e Ezcurra, 1995, 2002; Gordon-Gray et al., 2009), enquanto em Poaceae, é comum a transformação de toda espigueta, ou parte dela, em um ramete (Vega e Agrasar, 2006). Em Titanotrichum (Gesneriaceae) cada meristema floral da inflorescência, que deveria produzir uma única flor, pode dar origem a inúmeros rametes (Wang e Cronk, 2003). Assim, este é o primeiro registro de uma espécie pseudovivípara cujo meristema de uma inflorescência se transforma inteiramente em um único ramete.
Foi observado que os brotamentos vegetativos emergem na superfície do capítulo antes da antese das flores estaminadas mais internas, o que sugere que o espaço temporal entre o término da produção de flores e o início da produção de folhas seja muito curto ou até inexistente. O retorno à produção de folhas após um período de desenvolvimento de flores é chamado de reversão da inflorescência e está fortemente associado às condições ambientais, como temperatura e fotoperíodo (Tooke et al., 2005).
células meristemáticas de L. vivipara. Aparentemente, os brotamentos não apresentam relação com a disponibilidade hídrica ou o fotoperíodo que variam entre as estações seca e chuvosa no local de ocorrência da espécie, uma vez que o surgimento dos brotamentos vegetativos ocorre praticamente durante todo o ano (Coelho et al., 2006).
As sementes de L. vivipara podem ser consideradas como muito pequenas (sensu Hughes et al., 1994) com menos de 1 mm de comprimento e massa seca menor 0,1 mg, característica observada em espécies do gênero Syngonanthus e Comanthera (Oliveira e Garcia 2005, 2011). O teor de água das sementes, de aproximadamente 13%, sugere que as mesmas sejam ortodoxas, o que é reforçado pela manutenção da viabilidade após 12 meses de armazenamento a seco. O baixo teor de água das sementes ortodoxas permite que estas permaneçam viáveis por mais tempo (Bewley e Black,1994; Sautu et al., 2006).
A necessidade de luz para a germinação geralmente está associada a sementes pequenas, já que a reduzida reserva energética limitaria o crescimento das plantas até a superfície do solo caso estivessem enterradas (Bewley & Black 1994; Hewitt, 1998; Milberg et al., 2000). Segundo Schwienbacher et al. (2010), o formato arredondado e o tamanho reduzido favorecem a longevidade das sementes no solo. A manutenção da viabilidade por 12 meses, a necessidade de luz para a germinação e o tamanho reduzido sugerem que as sementes de L. vivipara têm a capacidade de formar bancos de sementes do tipo persistente (sensu Thompson, 1993). Este padrão foi observado por Garcia e Oliveira (2007) para diversas espécies de Eriocaulaceae, Velloziaceae e Xyridaceae ocorrentes nos campos rupestres da Cadeia do Espinhaço.
níveis do inibidor de crescimento (ácido abscísico) e o promotor de crescimento (giberelina) (Finch-Savage e Leubner-Metzger, 2006) e a germinação pode ser promovida por aplicação exógena de giberelina (Dissanayake et al., 2010; Yamaguchi e Kamiya, 2002). Como as sementes de L. vivipara não germinaram após o armazenamento a seco e aplicação de giberelina (500 e 1000 µ M), indica dormência fisiológica de nível intermediário ou profundo (sensu Baskin e Baskin, 2003), e além do balanço hormonal, outros fatores estão envolvidos na superação da dormência.
No experimento in situ, a esterilização do solo favoreceu a emergência das plântulas, provavelmente por eliminar microrganismos responsáveis pela degradação das sementes no solo (Crist e Friese, 1993; Leishman et al., 2000; Moles et al., 2003). A morte de todas as plântulas pode ser atribuída ao extenso período de seca durante a realização do experimento, demonstrando sua fragilidade e a dificuldade em se estabelecer em um ambiente com sazonalidade marcante. Várias ações relacionadas ao estímulo da germinação e emergência de plântulas têm sido atribuídas ao fogo, tais como o aumento de nutrientes no solo (Harper, 1977; Kinloch e Friedel, 2005), o aumento da incidência de luz (Hulbert, 1988), a influência da fumaça na germinação (Keeley e Fotheringhan, 1997; Ghebrehiwot et al., 2009, 2011) e a ação conjunta do calor e da fumaça (Read et al., 2000; Wills e Read. 2002). No entanto a emergência de plântulas de L. vivipara não foi favorecida pelo fogo, excluindo este fator como estimulador da germinação desta espécie em seu ambiente natural.
As sementes e rametes produzidos por plantas clonais desempenham papeis diferentes em seus ciclos de vida. Em ambientes com condições limitantes, a reprodução clonal representa uma maneira segura de perpetuar um genótipo de sucesso naquele ambiente, enquanto a reprodução sexuada apresentaria mais riscos e estaria envolvida na conquista de novos ambientes e na variabilidade genética (Silander, 1985; Eriksson, 1989, 1992). Os resultados indicam que a reprodução clonal representa o maior investimento reprodutivo de L.
vivipara e que, apesar do recrutamento de plântulas ser muito pequeno, seu papel é importante
CONCLUSÕES
A pseudoviviparidade em L. vivipara ocorre devido a um processo de reversão completo da inflorescência, no qual o capítulo transforma-se, gradativamente, em uma roseta vegetativa. O desenvolvimento do capítulo e a sua posterior reversão acontecem de maneira contínua ao longo do ano, o que dificulta a identificação de um estímulo desencadeador desta transformação. As sementes de L. vivipara apresentam alta viabilidade que pode ser mantida por pelo menos doze meses, porém, baixa germinabilidade provavelmente devido a uma dormência fisiológica de nível profundo ou intermediário. A emergência das plântulas em condições naturais também foi baixa e o fogo não influenciou este comportamento. O estabelecimento destas plântulas mostrou-se extremamente vulnerável a períodos de seca.
Leiothrix vivipara é predominantemente clonal e a reprodução por sementes pode ser
REFERÊNCIAS BIBLIOGRÁFICAS
Arizaga, S., Ezcurra, E., 1995. Insurance against reproductive failure in a semelparous plant: bulbil formation in Agave macroacantha flowering stalks. Oecologia 101, 329-334.
Arizaga, S., Ezcurra, E., 2002. Propagation mechanisms in Agave macroacantha (Agavaceae), a tropical arid-land succulent rosette. Am. J. Bot. 89, 632-641.
Baskin, J.M., Baskin, C.C, 1971. The possible ecological significance of the light requirement for germination in Cyperus inflexus. B. Torrey Bot. Club 98, 25-33.
Baskin, J.M., Baskin, C.C., 1988. Germination ecophysiology of herbaceous plant species in a temperature region. Am. J. Bot 75, 286-305.
Baskin, J.M., Baskin, C.C., 2003. Classification, biogeography, and phylogenetic relationships of seed dormancy. In: Smith, R.D., Dickie, J.B., Linington, S.H., Pritchard, H.W., Probert, R.J., (Eds.), Seed conservation: turning science into practice. London: Royal Botanical Gardens, Kew, pp. 517-544.
Bewley, J.D., Black, M., 1994. Seeds: Physiology of Development and Germination. Nova York, Plenum Press.
Brasil. Ministério da Agricultura, Pecuária e Abastecimento. Regras para análise de sementes /Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. – Brasília : Mapa/ACS, 2009. 399 p. ISBN 978-85-99851-70-8.
Coan, A.I., Scatena, V.L., 2004. Embryology and seed development of Blastocaulon scirpeum and Paepalanthus scleranthus (Eriocaulaceae). Flora 199, 47-57.
Coan, A.I., Rosa, M.M., Scatena, V.L., 2007. Embryology and seed development of
Syngonanthus caulescens (Poir.) Ruhland (Eriocaulaceae-Poales). Aquat. Bot. 86, 148-156.
Coelho, F.F., Neves, A.C.O., Capelo, C., Figueira, J.E.C., 2005. Pseudovivipary in two rupestrian endemic species (Leiothrix spiralis and Leiothrix vivipara). Curr. Sci. India 88, 1225-1226.
Coelho, F.F, Capelo, C., Neves, A.C.O., Martins, R.P., Figueira J.E.C., 2006. Seasonal timing of pseudoviviparous reproduction of Leiothrix (Eriocaulaceae) rupestrian species in south-eastern Brazil. Ann. Bot-London 98, 1189-1195.
Coelho, F.F, Capelo, C., Ribeiro, L.C., Figueira, J.E.C., 2008. Reproductive modes in
heterogeneity. Ann. Bot-London 101, 353-360.
Crist, T.O., Friese, C. F., 1993. The impact of fungi on soil seeds: implications for plants and granivores in a semiarid shrub-steppe. Ecology 74, 2231-2239.
Dissanayake, P., George, D.L., Gupta M.L., 2010. Effect of light, gibberellic acid and abscisic acid on germination of guayule (Parthenium argentatum Gray) seed. Ind. Crop. Prod. 32, 111-117.
Eckert, C.G., 2002. The loss of sex in clonal plants. Evol. Ecol. 15, 501-520.
Elmqvist, T., Cox, P.A., 1996. The evolution of vivipary in flowering plants. Oikos 77, 3-9. Eriksson, O., 1989. Seedling dynamics and life histories in clonal plants. Oikos 55, 231-238. Eriksson, O., 1992. Evolution of seed dispersal and recruitment in clonal plants. Oikos 63,
439-448.
Figueira, J.E.C., Del Sarto, M.C.L., 2007. Clonal growth and dispersal potential of Leiothrix
flagellaris Ruhland (Eriocaulaceae) in the rocky grasslands of Southeastern Brazil. Rev.
bras. Bot. 30(4), 679-686.
Finch-Savage, W.E., Leubner-Metzger, G., 2006. Seed dormancy and the control of germination. New Phytol. 171, 501-523.
Fischer, M., van Kleunen, M., 2002. On the evolution of clonal plant life histories. Evol. Ecol. 15, 565-582.
Garcia, Q.S., Oliveira, P.G., 2007. Germination patterns and seed longevity of monocotyledons from the Brazilian Campos Rupestres. Seed Sci. Biotechnol. 1(2), 35-41. Ghebrehiwot, H.M., Kulkarni, M.G., Light, M.E., Kirkman, K.P.J., van Staden, J., 2009.
Smoke solutions and temperature influence the germination and seedling vigour of South African mesic grassland species. Rangeland Ecol. Manag. 62, 572-578.
Ghebrehiwot, H.M., Kulkarni, M.G., Kirkman, K.P.J., van Staden, J., 2011. Germination activity of smoke residues in soils following a fire. S. Afr. J. Bot. 77, 718-724.
Giulietti, A.M., 1978. Os gêneros Eriocaulon L. e Leiothrix Ruhl. (Eriocaulaceae) na Serra do Cipó, Minas Gerais, Brasil. Tese de doutorado. Instituto de Biociências, Universidade de São Paulo, São Paulo.
Giulietti, A.M., Hensold, N., 1990. Padrões de distribuição geográfica dos gêneros de Eriocaulaceae. Acta Bot. Bras. 4(1), 133-158.
Giulietti, A.M., Scatena, V.L., Sano, P.T., Parra, L.R., Queiroz, L.P., Harley, R.M., Menezes, N.L., Benko-Yseppon, A.M., Salatino, A., Salatino, M.L., Vilegas, W., Santos, L.C., Ricci, C.V., Bonfim, M.C.P., Miranda, E.B. 2000. Multidisciplinary studies on Neotropical Eriocaulaceae. pp. 580-589. In: Wilson, K.L., Morrison, D.A. (Eds.), Monocots II: Systematics and evolution. Melbourne, CSIRO.
Gordon-Gray, K.D., Baijnath, H., Ward, C.J., Wragg, P.D., 2009. Studies in Cyperaceae in southern Africa 42: Pseudo-vivipary in South African Cyperaceae. S. Afr. J. Bot. 75, 165-171.
Harper, J.L., 1977. Population biology of plants. Academic Press, London, UK.
Harper, J.L., 1985. Module, branches, and the capture of resources. In: Jackson, J.B.C., Buss L.W., Cook R.E. (Eds.), Population biology and evolution of clonal organisms. Yale University Press, New Haven, Connecticut, USA, pp. 1-33.
Hewitt, N., 1998. Seed size and shade-tolerance: a comparative analysis of North American temperate trees. Oecologia 114, 432-440.
Hughes, L., Dunlop, M., French, K., Leishman, M.R., Rice, B., Rodgerson, L., Westoby, M., 1994. Predicting dispersal spectra: a minimal set of hypotheses based on plant attribute. J. Ecol. 82, 933–950.
Hulbert, L.C., 1988. Causes of fire effects in tall-grass prairie. Ecology 69, 46-58.
Humphrey, L.D., Pyke, D.A., 1998. Demographic and growth responses of a guerilla and a phalanx perennial grass in competitive mixtures. J. Ecol. 86, 854-865.
Johansen, D.A, 1940. Plant microthechnique. Mc Grall-Hill Book Co., New York.
Kaiser, E., 1880. Verfahren zur Herstellung einer tadellosen Glycerin-Gelatine. Bot. Zentralb. 1880, 25-26.
Keeley, J.E., Fotheringham, C.J., 1997. Trace gas emissions and smoke-induced seed germination. Science 23, 1248-1250.
Kinloch, J.E., Friedel, M.H., 2005. Soil seed reserves in arid grazing lands of central Australia. Part 1: seed bank and vegetation dynamics. J. Arid Environ. 60, 133-161.
Brasiliensis Fried. Fleischer, Leipzig, 3, pp. 273- 307.
Kraus, J.E., Arduin, M., 1997. Manual básico de métodos em morfologia vegetal. Seropédica, Edur.
Kraus, J.E., Scatena, V.L., Lewinger, M.E., Trench, K.U.S., 1996. Morfologia externa e interna de quatro espécies de Paepalanthus Kunth (Eriocaulaceae) em desenvolvimento pós-seminal. Bol. Bot. Univ. São Paulo 15, 45-53.
Leck, M.A., Schütz, W., 2005. Regeneration of Cyperaceae, with particular reference to seed ecology and seed banks. Perspect. Plant Ecol. 7, 95-133.
Lee, J.A., Harmer, R., 1980. Vivipary, a reproductive strategy in response to environmental stress? Oikos 35, 254-265.
Leishman, M.R., Wright, I.J., Moles, A.T., Westoby, M., 2000. The evolutionary ecology of seed size. Seeds: the ecology of regeneration in plant communities, 2nd ed (ed. by Fenner, M.), pp. 31-57.
Lemos Filho, J.P., Guerra, S.T.M., Lovato, M.B., Scotti, M.R.M.M.L., 1997. Germinação de sementes de Senna macranthera, Senna multifuga e Stryphnodendron polyphyllum. Pesqui. Agropecu. Bras. 32, 357-361.
Lezberg, A.L., Halpern, C.B., Antos, J.A., 2001. Clonal development of Maianthemum
dilatatum in forests of differing age and structure. Can. J. Bot. 79, 1028-1038.
Marques, A.R., Garcia, Q.S., Resende, J.L.P., Fernandes, G.W., 2000. Variations in leaf characteristics of two species of Miconia in the Brazilian cerrado under different light intensities. Trop. Ecol. 41, 47-60.
Milberg, P., Andersson, L., Thompson, K., 2000. Large-seeded species are less dependent on light for germination then small-seeded ones. Seed Sci. Res. 10, 99-104.
Moles, A., T., Warton, D.I.,Westoby, M., 2003. Seed size and survival in the soil in arid Australia. Austral Ecol. 28, 575-585.
Monteiro-Scanavacca, W.R., Mazzoni, S.C., 1976. Reprodução vegetativa a partir da inflorescência em Eriocaulaceae. Bol. Bot. Univ. São Paulo 4, 23-30.
Moreira, A.N., 1977. Relevo, p. 1-45. In: IBGE, Geografia do Brasil. Região Nordeste. Rio de Janeiro, IBGE, 3.
methods. Termarcarphi Pty, Melbourne.
Oliveira, P.G., Garcia, Q.S., 2005. Efeitos da luz e da temperatura na germinação de sementes de Syngonanthus elegantulus Ruhland , S. elegans (Bong.) Ruhland e S. venustus Silveira (Eriocaulaceae). Acta Bot. Bras. 19(3), 639-645.
Oliveira P.G., Garcia, Q.S., 2011. Germination characteristics of Syngonanthus seeds (Eriocaulaceae) in campos rupestres vegetation in south-eastern Brazil. Seed Sci. Res. 21, 39-45.
Pitelka, L.F., Ashmun, J.W., 1985. Physiology and integration of ramets in clonal plants. In: Jackson, J.B.C., Buss L.W., Cook, R.E. (Eds.), Population biology and evolution of clonal organisms. Yale University Press, New Haven, Connecticut, USA, pp. 399-435.
Read, T.R., Bellairs, S.M., Mulligan, D.R., Lamb, D., 2000. Smoke and heat effects on soil seed bank germination for the re-establishment of native forest community in New South Wales. Austral Ecol. 25, 48-57.
Ruhland, W., 1903. Eriocaulaceae. In: A. Engler (Eds.), Das Pflanzenreich. Wilhelm Engelmann, Leipzig, 4(1), pp. 294.
Sautu, A., Baskin, J.M., Baskin, C.C., Condit, R., 2006. Studies on the seed biology of 100 native species of trees in a seasonal moist tropical forest, Panama, Central America. Forest Ecol. Manag. 234, 245-263.
Scatena, V.L., Menezes, N.L., 1993. Embryology and seedling development in Syngonanthus
rufipes Silveira (Eriocaulaceae). Beitr. Biol. Pflanzen 67, 333-343.
Scatena, V.L.; Lemos Filho, J.P., Lima, A.A.A., 1996. Morfologia do desenvolvimento pós-seminal de Syngonanthus elegans e S. niveus (Eriocaulaceae). Acta Bot. Bras. 10, 85-91. Schmidt, I.B, Figueiredo, I.B, Borghetti, F., Scariot, A., 2008. Produção e germinação de
sementes de “capim dourado”, Syngonanthus nitens (Bong.) Ruhland (Eriocaulaceae): implicações para o manejo. Acta Bot. Bras. 22(1), 37-42.
Schwienbacher, E., Marcante, S., Erschbamer, B., 2010. Alpine species seed longevity in the soil in relation to seed size and shape - A 5-year burial experiment in the Central Alps. Flora 205, 19-25.
Press, New Haven, Connecticut, USA, pp. 107-152.
Thompson, K., Grime, J.P., 1983. A comparative study of germination responses to diurnally-fluctuating temperatures. J. Appl Ecol. 20, 141-156.
Thompson, K., 1993. Seeds, In: Hendry, G.A.F., Grime, J.P. (Eds.), Methods in comparative plant ecology Champman & Hall. Great Britain, pp. 176-205.
Tooke, F., Ordidge, M., Chiurugwi, T., Battey, N., 2005. Mechanisms and function of flower and inflorescence reversion. J. Exp. Bot. 56, 2587-2599.
van Baalen, J., Ernst, W.H.O., van Andel, J., Janssen, D.W., Nelissen, H.J.M., 1990. Reproductive allocation in plants of Scrophularia nodosa grown at various levels of irradiance and soil fertility. Acta Bot. Neerl. 39, 183-196.
Vázquez-Yanes, C., Orozco-Segovia A., 1993. Patterns of seed longevity and germination in the tropical rainforest. Annu. Rev. Ecol. Syst. 24, 69-837.
Vega, A.S., de Agrasar, Z.E.R., 2006. Vivipary and pseudovivipary in the Poaceae, including the first record of pseudovivipary in Digitaria (Panicoideae: Paniceae). S. Afr. J. Bot. 72, 559-564.
Vitta, F.A., 1995. Composição florística e ecologia de comunidades campestres na Serra do Cipó, Minas Gerais. Dissertação de Mestrado. Instituto de Biociências da Universidade de São Paulo.
Yamaguchi, S., Kamiya, Y., 2002. Gibberellins and Light-Stimulated Seed Germination. J. Plant Growth Regul. 20, 369-376
Wang, C.N., Cronk, Q.C., 2003. Meristem fate and bulbil formation in Titanotrichum (Gesneriaceae). Am. J. Bot. 90, 1696-1707.
Wesche, K., Ronnenberg, K., Hensen, I., 2005. Lack of sexual reproduction within mountain steppe populations of the clonal shrub Juniperus sabina L. in semi-arid southern Mongolia. J. Arid Environ. 63, 390-405.
Figura 1. Serra do Cipó, Minas Gerais. A. Localização da Serra do Cipó na Cadeia do Espinhaço (retângulo) (Mapa modificado de Vitta, 1995). B. Campo rupestre onde ocorre Leiothix vivipara. C. Leiothrix vivipara em solo arenoso da Serra do Cipó, barra = 2 cm.
A
B
Tecido
Solo Recipiente Tampa
A
B
C
D
Ø 9 cm
Figura 2. Experimentos de germinação in situ. A. Recipiente e tampa desenvolvidos para o experimento. B. Experimento instalado na Serra do Cipó. C. Tampa instalada na área queimada. D. Tampas instaladas em locais não queimados.
Figura 3. Capítulos de Leiothrix vivipara. A, B e E em MEV; C, D e F seção longitudinal.A. Espata envolvendo o escapo floral em início de desenvolvimento. B. Capítulo jovem repleto de tricomas. C - D. Capítulo fechado, seção longitudinal mostrando a região meristemática e primórdios florais em seu entorno. E. Capítulo aberto mostrando as flores estaminadas no interior e flores pistiladas na periferia, em detalhe flor estaminada (acima) e pistilada (abaixo). F. Capítulo aberto, seção longitudinal. (br = bráctea, dr = drusas, et = espata, fo = folha, mr = meristema, pf = primórdio floral, tr = tricomas, cabeça de seta = flor pistilada, seta = flor estaminada). Barras: A, B, E, F = 500 µm; C = 150 µm ; D = 50 µm.
A
B
C
D
E
F
mr pf
pf
pf
dr
tr
tr
mr
et
et
br
br
Figura 4. Capítulos de Leiothrix vivipara. A - B. Capítulo com primeiras folhas emergindo no centro. A. Visão geral do capítulo. B. Seção longitudinal. C- D. Capítulo com muitas folhas. C. Seção longitudinal do capítulo emitindo um escapo. D. Capítulo dispersando sementes (detalhe). E. Capítulo totalmente transformado em roseta emitindo novos escapos. (br = báctea involucral, ca = caule, ec = escapo, et = espata, fo = folha, mr = meristema, pr = primórdio foliar, se = semente, tr = tricomas, vf = vestígio de fruto, cabeça de seta = flor pistilada, seta = flor estaminada). Barras: A, B, C,D, E = 500 µm.
se
fo mr
fo
pr tr
fo
tr
et
C
fo
et
ec
vf
ec
E
fo
br
D
A
B
fo
ca
ec
B
A
C
D
E
Figura 5. Semente de Leiothrix vivipara. A. Sementes vistas ao microscópio estereoscópico. B. Semente vista em MEV. C - E. Sementes cortadas longitudinalmente após o teste de tetrazólio. C. Controle/negativo. D. Positivo, coloração rósea. E. Positivo, coloração avermelhada. (ed = endosperma, em = embrião, es = envoltório seminal). Barras: A = 500 µm; B, C, D, E = 100 µm.
em ed es
em ed es
em ed
es
Figura 6. Viabilidade das sementes e germinação de Leiothrix vivipara (Média e erro padrão). A. Viabilidade de sementes recém-coletadas (RC) e armazenadas (AR). B. Porcentagem final de germinação de sementes recém-coletadas sob temperaturas constantes de 15, 20, 25 e 30 °C e alternância de 30/15 °C, sementes coletadas em 2010. C. Porcentagem final de germinação de sementes recém-coletadas e armazenadas, sementes coletadas em 2009. D. Porcentagem final de germinação de sementes tratadas com giberelina (500 e 1000 mM), sementes coletadas em 2011. E. Emergência e sobrevivência das plântulas in situ: sementes em solo estéril (<), sementes em solo in natura (6), solo estéril sem sementes (=), solo in natura sem sementes (5). F. Influência do fogo sobre a emergência de plântulas em áreas atingidas pelo fogo (¡), controle (=). Valores seguidos por letras iguais não diferem entre si pelo teste de Kruskal-Wallis seguido de Conover, p<0,05.
A
C
D
E
F
B
30/15