Raphaela Mendes Fernandes de Souza Lôbo
Efeitos do Envelhecimento
na Tolerância Oral e na
Alergia Alimentar
Raphaela Mendes Fernandes de Souza Lôbo
Efeitos do Envelhecimento
na Tolerância Oral e na
Alergia Alimentar
Orientadora: Prof
a. Dr
a. Ana Maria Caetano de Faria
Área de Concentração: Imunologia Tese apresentada ao Curso de Pós-Graduação em
Bioquímica e Imunologia do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, como parte do requisito para obtenção do título de doutora.
BELO HORIZONTE
2011
Esse trabalho foi realizado no Laboratório de Imunobiologia do
Departamento de Bioquímica e Imunologia do Instituto de
Ciências Biológicas da Universidade Federal de Minas Gerais.
Apoio Financeiro: Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior (CAPES) e Fundação de Amparo à Pesquisa do estado de Minas
"É impossível avaliar a força que
possuímos sem medir o tamanho do
obstáculo que podemos vencer, nem o
valor de uma ação sem sabermos o
sacrifício que ela comporta."
AGRADECIMENTOS
Muitos foram aqueles, que direta ou indiretamente, cooperaram na realização deste trabalho. Entretanto, dirijo agradecimentos especiais à:
Deus, por me amparar nos momentos difíceis, me dar força interior para superar as dificuldades e nunca desistir, mostrando o caminho certo para as incertezas;
Minha orientadora Ana Maria Caetano de Faria, que fez desse trabalho um ideal, mesclando a arte de ensinar com o dom da convivência, transformando o mestre em amiga, transmitindo suas experiências que grandemente ajudaram na minha formação. Ana, o meu profundo agradecimento e respeito, que sempre serão poucos diante do muito que você ofereceu.
À todos os colegas do Laboratório de Imunobiologia, Andréia, Ana Cristina, Archimedes, Bernardo, Thaís e Rafael Rezende, pelo ótimo convívio e aprendizado constante.
Aos amigos inesquecíveis Andrezza, Samara, Rafael Pires, Magda, Frank, Bárbara, Flávia e Josiely, que com muito bom humor e competência, me ajudaram incansavelmente em todo trabalho. Meu eterno agradecimento a todos!
Aos professores Nelson, Cláudia e Tomaz por aumentarem meu
interesse pela ciência;
À Celise pelo auxílio nos assuntos acadêmicos;
À Ildinha, Ana Cecilia e Luciana, pelo cuidado extremo com os animais idosos e com o biotério;
Aos meus pais, Pedro e Dalva, que sempre me apoiaram e muitas vezes, acordaram cedo para me levar à UFMG. Amo vocês!
Ao meu marido Alan, que foi um grande aliado em todo esse árduo período, minha eterna gratidão pelos inúmeros incentivos de apoio,
compreensão e paciência, cuidando do nosso filho Pedro, desde 4 meses até
hoje, com muito amor para que eu pudesse “viajar” para UFMG todos os dias
às 5 horas da manhã e voltar só á noite. Meus amores, minhas sinceras desculpas pelos dias e finais de semana de ausência, roubando-lhes meu convívio como esposa e mãe. Vocês são minha vida!
Aos meus irmãos, Jansen e Ráisa, pelo companheirismo e
compreensão pelos dias de estresse. Obrigada!
À família Lôbo; Josi, Gisele, Celci, Marcela, Sérgio Júnior, D. Carmélia, e principalmente D. Marta, que me incentivou e cuidou com todo carinho do Pedro nesses últimos anos que estive fora todos os dias. Meus eternos agradecimentos;
Aos amigos, cunhada, concunhados, enfim...
A todos o meu obrigado por permitirem que esta
Sumário
LISTA DE FIGURAS _____________________________________________ I LISTA DE TABELAS ____________________________________________ III LISTA DE ABREVIAÇÕES _______________________________________ IV RESUMO ____________________________________________________ VII ABSTRACT ___________________________________________________ X 1. Introdução ________________________________________________ 1 O Tecido Linfóide associado às mucosas ________________________ 1 O Tecido Linfóide associado ao intestino ________________________ 2 A Tolerância Oral ____________________________________________ 6 A Alergia Alimentar __________________________________________ 14 O Envelhecimento ___________________________________________ 20 2. Objetivo Geral ____________________________________________ 27 Objetivos Específicos ________________________________________ 27 3. Materiais e Métodos _______________________________________ 30 A. Animais _____________________________________________ 30 B. Protocolo Experimental para Indução de Tolerância Oral em camundongos BALB/c idosos: _______________________________ 30 C. Protocolo Experimental para Indução de alergia alimentar em camundongos BALB/c idosos: _______________________________ 31 D. Protocolo Experimental para Indução de alergia alimentar em camundongos idosos DO. 11.10: _____________________________ 33 E. Indução de Tolerância Oral _____________________________ 34 F. Indução de alergia alimentar ____________________________ 35
M. Medida de IgA secretória total por ELISA _________________ 38 N. Medida de IgE sérica anti-Ova por ELISA _________________ 39 O. Medida de IgE sérica total por ELISA _____________________ 39 P. Preparação de suspensão das células linfóides ____________ 40 Q. Cultura de células e coleta do sobrenadante ______________ 41 R. Medida da concentração de citocinas no sobrenadante da
cultura celular por ELISA ___________________________________ 41 S. Obtenção dos dados no citômetro de fluxo e análise dos
resultados ________________________________________________ 42 T. Análise Estatística______________________________________ 44 U. Soluções utilizadas ___________________________________ 44 4. Resultados _______________________________________________ 46 Parte I: ______________________________________________________ 46 O Processo de Envelhecimento e a Indução da Tolerância Oral _______ 46 Parte II: _____________________________________________________ 71 O Processo de Envelhecimento e a Indução da Alergia Alimentar _____ 71 5. Discussão ________________________________________________ 97 6. Conclusões _____________________________________________ 119 1. Referências _____________________________________________ 123
Anexo A: Aprovação do projeto pelo Comitê de Ética em
Página | I
LISTA DE FIGURAS
Figura 1: Trato Gastrointestinal. ... 3 Figura 2: Mecanismos indutores da tolerância oral. ... 8 Figura 3: O aumento da permeabilidade epitelial e seu papel no desenvolvimento do processo inflamatório mediado por células T do intestino. ... 17 Figura 4: Efeitos do envelhecimento na produção de linfócitos e na distribuição para os órgãos secundários. ... 23 Figura 5: Análise de leucócitos do baço por citometria de fluxo. ... 43 Protocolo 1 : Indução de Tolerância Oral em camundongos BALB/c idosos normais. ... 47 Figura 6: Efeito do envelhecimento na indução de imunidade e tolerância oral. ... 49 Figura 7: Efeito do envelhecimento na produção de IgG2a específica. .... 50 Figura 8: Efeito do envelhecimento na produção de IgA secretória total e anti-Ova no muco intestinal. ... 52 Figura 9: Efeito do envelhecimento na produção de anticorpos IgE séricos totais e anti-Ova. ... 54 Figura 10: Efeito do envelhecimento na produção de IL-4 por células do baço, linfonodos mesentéricos e placas de Peyer. ... 56 Figura 11: Efeito do envelhecimento na produção de IL-10 por células do baço, linfonodos mesentéricos e placas de Peyer. ... 58 Figura 12: Efeito do envelhecimento na produção de TGF-β por células do
baço, linfonodos mesentéricos e placas de Peyer. ... 60 Figura 13: Efeito do envelhecimento na produção de TNF-α por células do
Página | II
Página | III
LISTA DE TABELAS
Página | IV
LISTA DE ABREVIAÇÕES
µg micrograma
µl microlitros
µm micrômetros
µl mililitros
mg miligramas
Al(OH)3 Hidróxido de Alumínio
APCs Células apresentadoras de antígeno
BALT Tecido linfóide associado aos brônquios
BCR Receptor de células B
CD Grupo de diferenciação (cluster of diferenciation)
CFA Adjuvante Completo de Freund
Con A Concanavalina A
DCs Células dendríticas
EDTA Ácido etileno diamino tetraacético
ELISA Ensaio imuno adsorvente ligado à enzima
FITC Isocianato de fluoresceína
Foxp3 Fator de transcrição forkhead box p3
GALT Tecido linfóide associado ao intestino
H.E Hematoxilina e Eosina
HRP Antígeno horseradish peroxidase
Página | V
IELs Linfócitos intraepiteliaisIFN Interferon
i.p. Intraperitoneal
Ig Imunoglobulina
IgAS Imunoglobulina A secretória
IL Interleucina
ILFs Folículos linfóides isolados
LnMs Linfonodos Mesentéricos
LAP Latency-Associated Peptide
NKT Célula T matadora natural (T natural killer)
LP Lamina propria
LPS Lipopolissacarídeo
MALT Tecido linfóide associado às mucosas
MHC Complexo de histocompatibilidade principal
NALT Tecido linfóide associado á nasofaringe
nm Nanômetros
0C Grau centígrado
OPD Ortofenileno-diamino
Ova Ovalbumina
PAS Periodic Acid Shiff
PBS Salina tamponada com fosfato
Página | VI
PP Placas de PeyerRPM Rotações por minuto
s.c. Subcutâneo
TGF- Fator de transformação e crescimento
TCR Receptor de células T
Th Linfócito auxiliar (T helper)
Th1 Resposta celular do tipo 1
Th2 Resposta celular do tipo 2
TNF Fator de necrose tumoral
Página | VII
RESUMO
Página | VIII
Página | IX
respostas imunes inflamatórias declinam com o envelhecimento. A manutenção de alguns fatores reguladores ( omo a IL-10) e algumas populações de células T reguladoras nos tecidos linfóides associados ao intestino em camundongos idosos pode ter um efeito de preservação da homeostase da mucosa e da indução da tolerância oral induzido por regimes orais naturais como a ingestão voluntária.
Página | X
ABSTRACT
Oral tolerance has been classically defined as a state of hyporesponsiveness of cellular and/or humoral response to an antigen by prior administration of the same antigen by oral route. Studies from our group have shown that susceptibility to oral tolerance decreases with age. Since oral tolerance is critical to maintain gut homeostasis, its decline with aging may result in increased susceptibility to develop gut inflammatory reactions such as food allergy in aged animals. Thus, the aim of this study was to evaluate the effects of aging in oral tolerance and food allergy induction. We used BALB/c mice at 8, 28, 53 and 92 weeks of age and analyzed oral tolerance induction by either gavage or continuous feeding of ovalbumin (Ova). We observed that aging is followed by a decreased in induction of both oral tolerance induction by gavage and immune responses (Ig, IgG1, S-IgA and IgE) to Ova. Production of specific IL-4 and IL-10, cytokines with proinflammatory/regulatory activity, by spleen cells stimulated with Ova was reduced in aged mice. The effects of aging were more accentuated in spleen than in mucosal sites (mesenteric
lymph nodes and Peyer’s patches). However, numbers of spleen and
anti-Página | XI
OVA SIgA levels in allergic mice diminished with aging. It seems that the accumulation of already experienced and committed cells in the immune system of aged animals lead to a reduced ability to deal with novel antigens. Second, the reduced ability of aged mice to mount an immune response could be kinetically monitored in the food allergy model. Young (8-week-old) allergic mice produced high levels of specific serum IgE and IgG1 as well as specific S-IgA in the intestinal mucus; they had elevated levels of specific IL-4, IL-5, IL-10 and TGF-beta produced by spleen and MLN cells in vitro and a significant reductionPágina | 1
1. Introdução
O Tecido Linfóide associado às mucosas
O termo “sistema imune das mucosas” foi criado por John Bienenstock há 40 anos atrás (Gill et al., 2010). Ele sugeriu o conceito quando descreveu o tecido linfóide associado aos brônquios e observou sua similaridade anatômica com o do trato gastrointestinal (Bienenstock and McDermott, 2005). Evidências sugerem que o sistema imune linfóide associado às mucosas constitui m único órgão, com grande extensão e em constante interação entre seus componentes distantes. Trabalhos já demonstraram que imunizações intranasais contra o vírus da Herpes podem gerar proteção vaginal contra infecções geradas pelo mesmo vírus (Gallichan et al., 2001). Outros estudos com pacientes com HIV (Human Immunodeficiency Virus)
observaram altas concentrações de Imunoglubulina A (IgA) específica nas secreções vaginais, nasais e na saliva desses pacientes (Artenstein et al., 1997).
Entretanto, a maioria dos autores divide o tecido linfóide associado às mucosas (MALT) em termos morfológicos e funcionais, como formado pelo tecido linfóide associado ao intestino ou trato gastrointestinal (GALT), pelo tecido linfóide associado aos brônquios (BALT) e pelo tecido linfóide associado à nasofaringe (NALT) (Brandtzaeg, 1996)
Página | 2
O Tecido Linfóide associado ao intestino
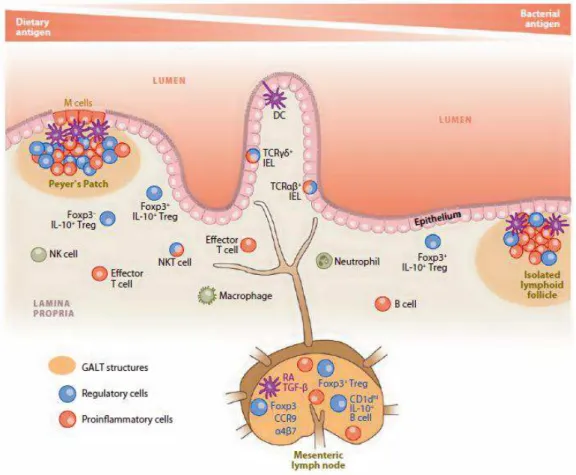
O tecido linfóide associado ao intestino ou ao trato gastrointestinal (GALT), como os demais tecidos associados à mucosa, está em constante interação com o meio externo. No intestino, a presença de células epiteliais e os elementos imunes aí presentes facilitam o reconhecimento e a absorção de nutrientes, induzindo respostas imuno-moduladoras e também respostas inflamatórias contra patógenos (Chahine and Bahna, 2010).
O GALT é formado por tecidos linfóides organizados e células imunocompetentes distribuídas na superfície da mucosa. As placas de Peyer (PPs) e os linfonodos mesentéricos (LnMs) formam as estruturas linfóides organizadas enquanto os linfócitos da lamina propria (LP) e os linfócitos
intraepiteliais (IELs) representam as células imunocompetentes dispersas. As placas de Peyer estão localizadas na região da submucosa do intestino delgado, são um dos sítios mais importantes de geração de plasmócitos produtores de IgA secretória (S-IgA) e não dependem da microbiota intestinal para sua geração (Mowat, 2003). Entretanto, seu papel indutor já foi motivo de discussão. Em camundongos deficientes de placas de Peyer, foram observados plasmócitos produtores de S-IgA na lamina própria,
sugerindo a existência de locais alternativos para a indução da troca de isotipo
para IgA secretória (Yamamoto e cols., 2000). De fato, Fagarasan e
colaboradores mostraram mais tarde que pelo menos 50% da IgA secretória tem origem de linfócitos B1 da lamina própria onde eles fazem a troca de isotipo e se tornam plasmócitos secretores de IgA ( Fagarasan et al, 2001). Esses autores defendem a idéia que o microambiente da LP é suficiente para induzir troca de isotipo de células B IgM+ para plasmócitos produtores de S-IgA. Além disso, Rescigno e colaboradores demonstraram que as células dendríticas localizadas na lamina própria do intestino são capazes de captar
bactérias do lúmen intestinal e realizar a apresentação de antígenos in situ
(Rescigno and Borrow, 2001).
Página | 3
representam a conexão entre as vias periféricas e mucosas na recirculação linfática (Newberry & Lorenz, 2005). Alguns trabalhos sugerem que a ausência dos LnMs inibe a indução de tolerância oral e a produção de IgAS nas mucosas (Spahn et al., 2002; Yamamoto et al., 2000). Logo os linfonodos mesentéricospossuem um papel fundamental na reatividade imunológica das mucosas.
Figura 1: Trato Gastrointestinal.
As células do intestino são especializadas na captação e apresentação de antígeno, na indução de imunidade antimicrobiana e na manutenção de tolerância contra antígenosexógenos (Izcue et al., 2009).
Página | 4
apresentadoras de antígenos (APCs) apresentam grande proximidade, o que possivelmente facilitaria a apresentação de antígenos e a indução da resposta imune (Astwood et al., 1996; Hamada et al., 2002; Lorenz, 2003).Os sítios indutores das mucosas apresentam características comuns, como uma camada de células epiteliais interligadas por junções formando uma barreira impermeável entre o lúmen intestinal e o meio externo. Além disso, contêm grande quantidade de células M organizadas em folículos linfoides, que são essenciais na captação, transporte e processamento de antígenos provenientes do lúmen intestinal (Ogra, 2009). O GALT apresenta uma variedade de células efetoras presentes ao longo do lúmen intestinal, como células B e T, células dendríticas, macrófagos e outras células apresentadoras de antígenos (APCs) que participam ativamente desse complexo processo de manutenção da homeostase da mucosa intestinal (Faria and Weiner, 2005).
Desta forma, a mucosa intestinal é a maior área de contato natural dos antígenos com o organismo, representando assim, a maior fonte de perturbações na atividade do sistema imune.
A IgA secretória (S-IgA) é o anticorpo mais abundante nas secreções mucosas e possui diversos atributos funcionais, atuando como eficiente barreira imunológica contra agentes infecciosos no intestino.
A IgA é secretada principalmente na forma de dímeros associados por uma única cadeia J. Esses dímeros de IgA se ligam especificamente a receptores de imunoglobulinas poliméricas (pIgR), presentes nas superfícies basais das células epiteliais. Posteriormente, esse complexo é internalizado e transportado por transcitose (Apodaca et al., 1991). Na superfície apical das células epiteliais, o receptor pIgR é clivado, liberando a porção extracelular ainda aderida à IgA dimérica, denominada componente secretor (SC) (Brandtzaeg et al., 1999). Esse componente secretor possivelmente contribui na proteção da S-IgA contra clivagens proteolíticas.
Página | 5
observado também em camundongos deficientes em pIgR, a ausência de S-IgA e o aumento da permeabilidade da mucosa. Esse processo levaria a um conseqüente aumento desregulado da captação de antígenos da dieta e de bactérias da microbiota (Johansen et al., 1999).Já 80% da IgA sérica dos primatas incluindo os humanos, é monomérica, resultante da síntese de células B provenientes da medula óssea. (Otten and van Egmond, 2004).
Através da mucosa intestinal, cerca de 130-190 gramas de proteínas circulam diariamente provenientes da dieta. Menezes e colaboradores demonstraram que as proteínas presentes na dieta têm um papel importante na maturação do GALT. Eles observaram que em camundongos tratados com dieta livre de proteínas há prejuízo do desenvolvimento morfológico do trato gastrointestinal, que apresenta baixos níveis de linfócitos, IgG, IgA e citocinas ativadas perante respostas do tipo Th2 (Menezes et al., 2003).
Além da estimulação por proteínas da dieta, as bactérias que colonizam o intestino grosso em humanos, chegando a 1012microorganismos /g de fezes que representam uma fonte de estimulação importante nesse sítio (Menezes et al., 2003). Na presença de antígenos, as bactérias comensais do intestino (microbiota) se ligam aos receptores do tipo Toll (TLRs) presentes nas células do sistema imune inato, como macrófagos, ativando-os. Em geral, a resposta imune resultante dessa ativação é não inflamatória em condições normais (Hooper and Macpherson, 2001; Neish et al., 2000).
Além disso, para a manutenção de condições propícias para a homeostase, a microbiota fornece energia através de nutrientes (como vitaminas K e B12) e proteção contra colonização de bactérias patogênicas ao intestino (Peterson et al., 2007; Tsuji et al., 2009).
Estudos com animais germ-free (isentos de germes) sugerem que o
Página | 6
microbiota intestinal é uma importante fonte de regulação e maturação do sistema imune no intestino.A interação do epitélio intestinal (indução da produção de citocinas) com as células dendríticas, macrófagos e células T reguladoras presentes na lamina própria do intestino também parece ser importante para a manutenção da homeostase do intestino (Iliev et al., 2009; Rescigno et al., 2008).
A Tolerância Oral
A tolerância oral tem sido classicamente definida como um fenômeno de longa duração, no qual a exposição prévia de um determinado antígeno pela via oral resulta em uma diminuição da capacidade do organismo de montar respostas imunes após exposições parenterais subseqüentes a este mesmo antígeno, com ou sem a presença de adjuvantes (Thomas and Parrott, 1974; Vaz et al., 1977). Uma vez que a tolerância oral tenha sido induzida, vários aspectos da resposta imune antígeno específica Th1 e Th2 são suprimidos como: produção de imunoglobulinas de várias classes como IgE, IgM, e Ig de diferentes isotipos (Afuwape et al., 2004; Vaz et al., 1977); reação de hipersensibilidade tardia – DTH (Mowat et al., 1982) e produção de várias citocinas (Afuwape et al., 2004; Weiner, 1994).
Diversos fatores do sistema imune da mucosa favorecem o desenvolvimento da tolerância oral.
O processo digestivo do intestino altera estruturalmente as proteínas da dieta facilitando o desenvolvimento de tolerância oral. Já foi comprovado que a hidrólise de antígenos, tornando-os solúveis, deixa-os mais tolerogênicos que os antígenos particulados (Chehade and Mayer, 2005).
A microbiota também tem um papel importante na manutenção da tolerância oral. Em estudos com camundongos germ-free, foi demonstrado uma
Página | 7
Outros fatores também estão relacionados à indução da tolerância oral, como a idade (Faria et al., 1993; Hanson, 1981; Vaz et al., 1981), o estado nutricional (Lamont et al., 1987a; Lamont et al., 1987b) e o estado imunológico dos animais (Vaz et al., 1987); além da natureza, dose e via de administração do antígeno, bem como a freqüência e o intervalo entre elas (Gaboriau-Routhiau and Moreau, 1996).Strobel e colaboradores demonstraram que camundongos de linhagem susceptível à indução de tolerância por via oral (B6D2F1), quando tratados com Ova nas primeiras 48 horas de vida, não desenvolveram o estado de tolerância, apresentando altos níveis de anticorpos específicos anti-Ova. Somente após a segunda semana de vida, o estado de tolerância oral foi alcançado, com a obtenção de níveis significativos de supressão dos anticorpos anti-Ova (Strobel and Ferguson, 1984).
A suscetibilidade á indução de tolerância por via oral surge provavelmente por volta do 17º dia após o nascimento, posterior à organização do tecido linfóide da mucosa intestinal; principalmente das placas de Peyer; ao surgimento das enzimas proteolíticas, à migração dos linfócitos para o intestino
e ao “fechamento” da mucosa intestinal com a conseqüente diminuição da
absorção de moléculas (Vaz et al., 1981).
Os processos de envelhecimento e maturação do GALT também
interferem na indução de tolerância oral. Camundongos de linhagens
susceptíveis á tolerância por via oral (B6D2F1 e C3H/HeJ) com 8 semanas de idade, tornam-se refratários á tolerância induzida por gavagem quando adultos(24º semana) ou de meia idade (40º a 44º semana de idade) (Faria et al., 1993; Rios et al., 1988).
A transferência de células do baço de animais B6D2F1 jovens tanto para animais neonatos como idosos aumenta a susceptibilidade à indução da tolerância oral nestes animais, em contraste, a transferência de células de camundongos idosos para jovens os tornam menos susceptíveis (Lahmann et al., 1992).
Página | 8
envelhecimento está associado a uma diminuição na suscetibilidade à indução de tolerância oral, mas não a uma completa refratariedade (Faria et al., 1998).Já foram descritos dois mecanismos para explicar o fenômeno da tolerância oral: anergia (ausência de função) ou deleção clonal (perda de função devido à apoptose) e regulação ativa (células T reguladoras). Estas idéias já foram estendidas pela demonstração que células T tolerizadas oralmente têm problemas na atividade locomotora, o qual restringe sua habilidade em atravessar o endotélio vascular ou a sua interação com DCs e células B in vivo (Strobel and Mowat, 2006).
Figura 2: Mecanismos indutores da tolerância oral.
A ausência de resposta a antígenos inócuos pode ser explicada por células T anérgicas, deleção clonal por apoptose ou ativação de subpolulações de células T reguladoras. Essa ativação de células T reguladoras pode ocorrer localmente ou em sítios distantes, como nos linfonodos mesentéricos ou no fígado após a disseminação de antígenos solúveis absorvidos ou transportados por APCs. As células reguladoras CD25+ podem ser positivas ou negativas para Foxp3 e contém subpopulações de células Tr1,Th3 ou LAP+, que produzem citocinas supressivas como IL-10 e TGF- . Essas células reguladoras são importantes no desenvolvimento do balanço de produção de células Th2 e Th1. (Per Brandtzaeg, 2010).
Página | 9
estariam associadas a geração de células T reguladoras (Weiner, 1994), como as células T reguladoras das subpopulações Tr1 (produtoras de IL-10), Tr3 (produtoras de TGF- ) e CD4+CD25+ (produtoras de TGF- ) (Chahine andBahna, 2010).
Já foi observado em humanos que baixas doses de proteínas administradas via leite materno para bebês é uma maneira eficiente de torná-los tolerantes a essas proteínas (Verhasselt et al., 2008). Os primeiros testes experimentais foram em camundongos utilizando modelos de asma induzida por ovalbumina. Os antígenos inalados pela mãe aparecem no leite materno e protegem a prole dos efeitos da asma com a produção de células T reguladoras (Verhasselt et al., 2008).
A relação da dose administrada e a indução de tolerância também foi observada em neonatos sensibilizados com PN e desenvolveram alergia com produção de IgG1, que pode ser prevenida parcialmente por inibidor de PAF e pelo consumo materno de baixa dose de PN durante a gestação e lactação (a proteção foi associada a baixa razão IgG2/IgG1 e baixa produção de IgE) (Lopez-Exposito et al., 2009).
Algumas evidências têm sido mostradas de que as formas de tolerância, anergia ou deleção e regulação não são independentes e podem se sobrepor.
Um fator em comum desses mecanismos está a secreção de TGF-(Transforming Growth Factor Beta). O TGF- é uma citocina reguladora, que
pode ser induzida através do tratamento de células T com anticorpo anti-CTLA-4 (antígeno anti-CTLA-4 de linfócitos T citotóxicos), embora esta molécula tenha sido primeiramente descrita na indução de anergia in vivo (Nakamura et al., 2001).
Além disso, alguns estudos sobre propriedades de células reguladoras as descrevem como anérgicas e os eventos de deleção clonal ocorridos na mucosa intestinal parecem criar condições para secreção local de TGF-(Takahashi et al., 1998).
Página | 10
Inicialmente, a atividade reguladora das células T CD4+ foi ligada àprodução de citocinas Th2, como IL-4 e IL-10, e associada à supressão da produção de citocinas Th1, como IL-2 e INF- . No entanto, vários estudos
demonstraram que a supressão mediada pela tolerância oral também é efetiva em respostas mediadas por células Th2, ou seja, tanto respostas Th1 como Th2 podem ser suprimidas na tolerância oral (Faria and Weiner, 2006a; Faria and Weiner, 2006b; Melamed et al., 1996).
Atualmente o papel das células T reguladoras na tolerância oral e seu mecanismo de ação têm sido bastante discutidos.
As células T reguladoras foram descritas primeiramente por Gershon e colaboradores em 1970 e eram tidas como células T CD8+ supressoras (Gershon and Kondo, 1970). No entanto, Sakaguchi e colaboradores em 1995 caracterizaram as células T regulatórias como células T CD4+ expressando o receptor da alta afinidade para IL-2 (IL-2Ra ou CD25), que é essencial para a sua função reguladora (Sakaguchi et al., 1995a; Sakaguchi et al., 1995b). Outros estudos, realizados em camundongos deficientes para a expressão de
CD8+, confirmaram que a indução da tolerância oral ocorria
independentemente de células T CD8+, mas era dependente de células T CD4+ (Garside et al., 1995; Hornquist et al., 1996).
As células Tregs CD4+CD25+ são células anérgicas, ou seja, não proliferam bem e não secretam IL-2, apresentam propriedades supressoras, e têm sido descritas como responsáveis pela regulação dos mecanismos de doenças autoimunes e alergias (Sakaguchi et al., 2004; Sakaguchi, 2004; Takahashi et al., 1998). Além disso, seu mecanismo de ação envolve o contato celular mais que a secreção de citocinas embora elas sejam dependentes para sua sobrevivência e expansão da IL-2 produzida por outros linfócitos T (Sakaguchi et al., 2004). Essa dependência de IL-2 exógena parece não ser somente um requisito importante para sua manutenção e funcionamento, mas também para o controle da freqüência dessas células no corpo.
Vários marcadores já foram descritos para as células T CD4+CD25+,
como o CD45RBlow, CD25, CTLA-4, receptor de TNF induzido por
glicorcoticóide (GITR), fator de transcrição FoxP3 (Forkhead box p3), LAP
Página | 11
McHugh and Shevach, 2002; McHugh et al., 2002; Nakamura et al., 2001; Oida et al., 2003). O CTLA-4 tem papel inibidor da proliferação de linfócitos T e possui um papel importante durante a indução da tolerância oral. Camundongos tratados oralmente com anti-CTLA-4 apresentam proliferação de células T específicas acelerada, prejudicando a indução da tolerância (Chenand Ma, 2002).O GITR é um marcador constitutivo expresso em células Tregs
CD4+CD25+, CD8+CD25+ e CD4+CTLA-4 intracelular (McHugh et al., 2002). O FoxP3 é um fator de transcrição essencial para o desenvolvimento e função das células T CD4+CD25+ nativas, e está relacionado na supressão de doenças autoimunes e alergias alimentares (Sakaguchi et al., 2006).
Uma forma de TGF- expressa na membrana celular está associada
com a atividade regulatória das células Tregs CD4+CD25+ (Nakamura et al.,
2001). O TGF- de membrana das células T reguladoras é produzido na forma
inativa e ligado ao peptídio associado à latência (LAP). Assim, a atividade
biológica dessas células depende da dissociação da TGF- madura do
complexo latente.In vivo, são ativadas por proteases que clivam o complexo
latente, e a plasmina é uma das proteases envolvidas no processo de ativação (Oida et al., 2003). Células T CD4+CD25-LAP+ também já foram descritas como imuno-moduladoras em modelos experimentais de colite (Oida et al, 2003).
O CD45RB é uma fosfatase expressa em altos níveis na superfície celular de linfócitos virgens. A expressão de CD45RB diminui após a ativação dos linfócitos T sendo que células CD45RBlow são consideradas células T de
memória (Lee and Vitetta, 1990; Lee et al., 1990).
Alguns estudos indicam que o intestino é um importante local de desenvolvimento de Tregs Foxp3+ e que células dendríticas (DCs) intestinais
especializadas promovem a expressão de Foxp3 através de um mecanismo que é dependente de TGF- local tendo como cofator o ácido retinóico, um
Página | 12
Trabalhos também mostram uma reciprocidade entre o desenvolvimento de Tregs Foxp3+ e células T efetoras, sendo que células TCD4+ se diferenciam em Tregs Foxp3+ na presença de TGF- ou em células
Th17, que secretam IL-17, uma citocina pro-inflamatória potente, na presença de TGF- e IL-6. Deste modo, o TGF- tem um efeito paradoxal, pois estimula
distintas subpopulações de células T com efeitos opostos na resposta imune (Bettelli et al., 2006; Veldhoen and Stockinger, 2006).
Mucida e colaboradores, utilizando modelo experimental de asma, demostraram que camundongos deficientes em Tregs naturais (nTregs), produzidas no timo como resultado da seleção por autoantígenos, são altamente suscetíveis à indução de tolerância oral. A exposição oral ao antígeno nesses animais leva à geração de Tregs periféricas antígeno-específicas que expressam Foxp3 e CTLA-4, sugerindo que a indução da tolerância oral não requer nTregs e que Tregs com características similares são induzidas pela administração oral de antígeno. Entretanto, essa tolerância é
reduzida quando TGF- é bloqueado. Esse trabalho é consistente com a idéia
de que a administração oral de antígeno gera Tregs antígeno-específicas num processo que requer TGF- para indução de Foxp3 (Mucida et al., 2005).
Vários estudos mostraram que existe uma expansão de células T CD4+CD25+ nas placas de Peyer, LnM e tecidos periféricos linfóides de camundongos tratados oralmente com antígenos (Chung et al., 2005). Essas células mostraram ter atividade reguladora in vitro e in vivo e expressam Foxp3
assim como outros marcadores associados às Tregs incluindo CTLA-4 e GITR. A função supressora de Tregs oralmente induzidas parece ser, pelo menos, parcialmente dependente de TGF- , com um pequeno papel para IL-10. Isto
condiz com evidências de que Tregs que produzem TGF- ou expressam essa
molécula em sua superfície são responsáveis pela prevenção de várias formas de doenças inflamatórias como a colite (Strobel and Mowat, 2006).
Como mencionado anteriormente, vários trabalhos apontam a
citocina TGF- como fator de ligação entre os dois mecanismos de indução de
tolerância oral (Faria and Weiner, 2006b). TGF- pertence à família de
polipeptídios envolvidos no controle do crescimento e desenvolvimento celular.
Página | 13
O TGF- 1 é abundante no intestino, tendo efeito estimulador na diferenciaçãodas células epiteliais, troca de isotipo de S-IgA possuindo, além disso, propriedades imunossupressoras sobre linfócitos (Kim and Kagnoff, 1990).
O envolvimento do TGF- na tolerância oral foi descrito inicialmente
por Miller e colaboradores demonstrando a capacidade de células T CD8+ tolerantes de migrar para órgãos linfóides suprimindo respostas imunes (Miller et al., 1992). Após a administração oral de proteína básica de mielina (MBP), essa supressão foi relacionada com a liberação de TGF- que resultava na
inibição de células efetoras e liberação de citocinas não-específicas (“bystander suppression”-supressão do espectador inocente) (Miller et al., 1992).
Posteriormente, foi observado que camundongos geneticamente modificados (receptores TCR-Ova específicos), após serem tratados oralmente
com altas doses de Ova, produziam TGF- e apresentavam deleção de células
T (Chen et al., 1995; Chen et al., 1997). Sendo assim, o surgimento de TGF-poderia estar relacionado com eventos apoptóticos, justificando a deleção dessas células T específicas.
A capacidade do TGF- em induzir troca de isotipos para IgA pode
justificar estudos clássicos que sugeriram que a tolerância oral estava interligada com um aumento da síntese de S-IgA na mucosa intestinal (Challacombe and Tomasi, 1980). Entretanto, a relação entre a indução de tolerância oral e a produção de S-IgA no intestino ainda não está esclarecida. Alguns trabalhos sugerem que ocorre um aumento na produção de S-IgA durante a indução de tolerância oral (Fujihashi et al., 1996), já outros acreditam que os níveis de S-IgA diminuem durante a indução da tolerância (Grdic et al., 1998; Kato et al., 2001).
Vários estudos já comprovaram o papel regulador do TGF- ,
demonstrando que, em camundongos geneticamente deficientes para a via de
sinalização de TGF- em células T, ocorre o desenvolvimento espontâneo de
doença autoimune com secreção de autoanticorpos e ocorrência de infiltrado inflamatório em vários órgãos (Gorelik and Flavell, 2000).
Página | 14
expressando o transgene que codifica o TCR específico para um peptídeo da Ova) (Simioni et al., 2004). Esses autores observaram que a administração de Ova por gavagem ou por ingestão voluntária induzia tolerância oral dose dependente em camundongos normais jovens e senis, mas nos camundongos DO.11.10 a tolerância não ocorria. A produção de TGF- foi maior em culturasde células T de camundongos normais e geneticamente modificados quando estimuladas por células dendríticas de camundongos normais tolerantes (Simioni et al., 2004). Esses resultados sugerem a importância das células
dendríticas na estimulação de células produtoras de TGF- durante a indução
de tolerância oral específica em modelo murino.
Entretanto, o aumento da produção de TGF- não é uma
conseqüência comum em todos os modelos de indução de tolerância oral (Baggi et al., 1999; Gonnella et al., 2001; Hirahara et al., 1995). Baggi e colaboradores, utilizando modelo experimental para miastenia grave, observaram que, após administração oral de epitopos de células T específicos
(TAChR) em camundongos, a produção de TGF- não sofria alterações (Baggi
et al., 1999). Husby e colaboradores demonstraram que, em humanos, o aumento deTGF- não é observado durante a indução da tolerância específica
para KLH (“keihole limpet hemocyanin”) (Husby et al., 1994).
Portanto, apesar de em alguns modelos experimentais já estarem estabelecidos mecanismos responsáveis pela indução de tolerância oral, incluindo as células moduladoras envolvidas, existem outros mecanismos de indução de tolerância oral ainda não explorados.
A Alergia Alimentar
Página | 15
A alergia alimentar é uma dessas reações, definida como um tipo de aversão imune a proteínas da alimentação sendo ou não dependente da produção específica de imunoglobulinas de classe IgE (Sampson, 1999).As alergias alimentares têm sido consideradas um dos maiores problemas de saúde das Américas (Mansueto et al., 2006). Em 2007, foi observando um aumento de 18% de incidência de alergia alimentar em crianças, comparado à década anterior (Fleischer et al., 2011).
A prevalência de reações alérgicas em humanos é maior nos primeiros cinco anos de vida, sendo mais frequentes em crianças com menos de quatro anos de idade (Sicherer and Sampson, 2006). Os alimentos mais comuns causadores de alergia alimentar na infância são leite de vaca, ovos, amendoim, trigo, soja, castanha, peixe e frutos do mar (Sicherer, 2011).
Entretanto, a maioria das alergias alimentares infantis é curada espontaneamente com o avançar da idade do indivíduo e somente 2% dos adultos sofrem dessa doença (Sampson, 1999). Em adultos, os alimentos mais comuns causadores da alergia são frutos do mar, amendoim, castanha e peixe (Sicherer, 2002). As reações alérgicas alimentares podem afetar diversos órgãos e conseqüentemente induzir uma diversidade de sintomas (Sicherer and Sampson, 2010). De acordo com um trabalho publicado em 2001 pela Academia Européia de Alergia e Imunologia Clínica (EAACI), existem dois tipos de reações alimentares; as tóxicas e as não-tóxicas (Johansson et al., 2001).
As não-tóxicas, também conhecidas como intolerância alimentar, são reações fisiológicas desencadeadas por agentes tóxicos ao organismo (ex: venenos) ou responsáveis pela geração de doenças metabólicas (ex: deficiência à lactose) (Mansuetoe cols., 2006).
Por outro lado, as reações alimentares tóxicas ou as consideradas
como “verdadeiras” são mediadas por respostas imunológicas dependentes ou não da produção da Imunoglobulina E (IgE) (Sicherer, 2002).
Página | 16
reconhecidos por receptores de células T específicos. Na presença de interleucina-4 (IL-4), a indução da reação alérgica é iniciada com a diferenciação de células T virgens auxiliares (Th) em células Th2 efetoras. Geralmente, células Th2 quando estimuladas, produzem uma diversidade de citocinas, incluído IL-4, IL-5, IL-10 e IL-13 que, entre outras funções, têm o papel de indução da diferenciação de células B em plasmócitos produtores de IgE (van Wijk and Knippels, 2007).Os anticorpos IgE específicos apresentam alta afinidade para os receptores de mastócitos e basófilos. Após uma segunda exposição ao mesmo alérgeno, a ligação de anticorpos IgE estimula a degranulação de mastócitos e liberação de mediadores inflamatórios, como histaminas, citocinas e proteases. Esses mediadores desencadeiam uma série de reações alérgicas cutâneas (urticárias, equizemas), gastrointestinais (náuseas, diarréias, dores abdominais, vômitos), respiratórias (tosse, rinites) e sistêmicas (colapsos) (Sampson, 2004).
De acordo com alguns estudos, 4% da população mundial apresenta reações alérgicas alimentares mediadas pela produção de IgE (Kanny, 2001).
Curiosamente, 50% das crianças alérgicas ao leite de vaca não apresentam reações IgE-dependentes. Testes diagnósticos para alergia alimentar foram realizados para detectar na pele desses indivíduos anticorpos IgE ligados a mastócitos na pele, e isso não foi observado. Alega-se que as reações imunológicas que ocorrem são devido à ativação de células T efetoras ou de anticorpos da classe IgG (Bischoff et al., 2000; Majamaa et al., 1999; Veres et al., 2003).
Entretanto, é importante lembrar que embora anticorpos da classe IgE induzam a degranulação de mastócitos, os reais mecanismos efetores que acontecem nas lesões intestinais dos pacientes alérgicos são difíceis de identificar usando somente testes clínicos ou biopsias de mucosa (Bengtsson et al., 1997; Knutson et al., 1993; Lim et al., 2001).
Página | 17
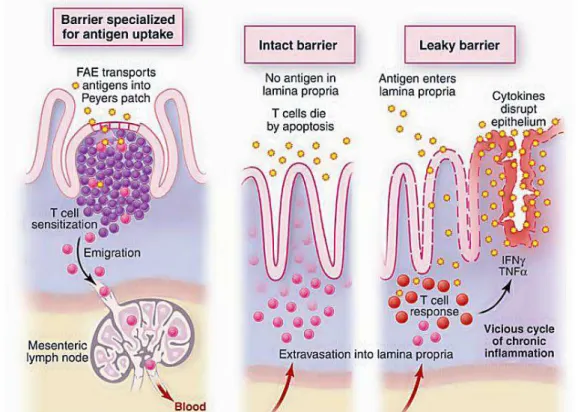
com liberação de citocinas ou ingestão oral de etanol (Andrade et al., 2003; Hogan and Rothenberg, 2008).Nas placas de Peyer, as células T CD4+ são ativadas por antígenos do intestino e migram para a lamina própria. Em indivíduos saudáveis, essas
células morrem por apoptose, mas, na alergia alimentar, o aumento da permeabilidade pode levar a entrada exacerbada de antígenos para a lamina própria ativando mais que o normal as células T, quebrando a tolerância
mediada pelas citocinas imunossupressoras e células T reguladoras. As citocinas pró-inflamatórias logo estimulam o aumento da permeabilidade epitelial, gerando um ciclo contínuo de inflamação (Macdonald and Monteleone, 2005)(Figura 3).
Figura 3: O aumento da permeabilidade epitelial e seu papel no desenvolvimento do processo inflamatório mediado por células T do intestino.
(Macdonald and Monteleone, 2005)
O colostro humano é rico em S-IgA materna. Estudos já comprovaram que bebês com amamentação exclusiva, apresentam baixa incidência de alergia alimentar (Zeiger and Heller, 1995). A presença no leite
Página | 18
desenvolvimento da tolerância oral, pelo fato de terem efeitos supressivos e por induzirem a produção de IgAS na mucosa (Brandtzaeg, 2010).Outros estudos também já comprovaram que mães que apresentam baixos níveis de S-IgA específicas para proteínas do leite de vaca têm maior probabilidade de terem bebês alérgicos ao antígeno (Jarvinen et al., 2000; Savilahti et al., 1991).
O grupo de Sicherer observou que humanos alérgicos ao amendoim apresentam HLA (antígeno leucocitário humano) distintos dos indivíduos alérgicos ao leite de vaca (Sicherer, 2002). Ambos os grupos respondem preferencialmente às reações do tipo Th2 e cada um ao seu alérgeno específico, apresentando níveis séricos muitos altos de IgE específica com subseqüente desenvolvimento da alergia (Sicherer, 2002).
Como mencionado anteriormente, os antígenos solúveis são menos imunogêncicos que os particulados. Estudos já demonstraram que bebês alimentados via mamadeira com introdução precoce de dieta sólida apresentam uma tendência a desenvolverem respostas tipo Th2 e conseqüente incidência de alergia alimentar (Anderson, 1997). A causa provável desse fato seria a complexidade das proteínas do leite contrapondo com a imaturidade do trato gastrointestinal dos bebês (Anderson, 1997).
As células epiteliais intestinais são importantes para o desenvolvimento da tolerância oral ou indução da alergia alimentar. Já foi demonstrado que enterócitos expressando MHC de classe II atuam como células apresentadoras de antígenos na mucosa intestinal (Blumberg et al., 1999; Yu and Perdue, 2001).
Além disso, outros trabalhos observaram que, em camundongos, após sensibilização com “horseradish peroxidase” (HRP), ocorre um transporte
acelerado através do epitélio intestinal de complexos formados por alérgenos-IgE ligados ao receptor CD23 dos enterócitos com subseqüente transferência aos mastócitos da mucosa (Yu & Perdue, 2001). Logo, essa via mediada pelo receptor CD23 dos enterócitos provavelmente facilita o transporte de antígenos específicos no epitélio intestinal de camundongos (Tu et al., 2005).
Página | 19
processo alérgico (Bilsborough and Viney, 2004). Essas APCs apresentamreceptores do tipo Toll (“Toll-like receptors”-TLRs) que estão envolvidos no
reconhecimento de alérgenos em mastócitos humanos estimulando a produção de citocinas, como IL-9 e IL-13 (Stassen et al., 2001). A IL-13 tem um papel importante na troca de isotipo para IgE e a IL-9 provavelmente está envolvida na diferenciação de células Th específicas, juntamente com a IL-4, auxiliando nas respostas alérgicas dependentes de IgE (Takeda et al., 2003).
Outra característica importante nas reações alérgicas é a acumulação de eosinófilos no sangue periférico e nos tecidos (Bischoff et al., 1997). A atuação dos eosinófilos como APCs promove uma expansão de células Th2 nos tecidos inflamados, amplificando as respostas imunes do tipo Th2 (Shi et al., 2004). Os eosinófilos expressam uma série de moléculas co-estimuladoras (CD40, CD28, CD86, B7-1 e B7-2) (Woerly e cols., 1999; Rothenberg, 2001), algumas citocinas estimulatórias ( 2, 6, 12, 4, IL-10) (Kita and Gleich, 1996; Lacy et al., 1998; Lucey et al., 1989; Ohkawara et al., 1996) e podem induzir a expressão de MHC de classe II (Lucey et al., 1989)
(Lucey e cols., 1989). Shi e colaboradores demonstraram que a transferência
de eosinófilos ativados induz resposta antígeno-específica in vivo (Shi et al.,
2004).
A ativação e o recrutamento dos eosinófilos para as áreas inflamatórias são dependentes da estimulação de eotaxina e IL-5 (Coeffier et al., 1994; Yamaguchi et al., 1988).
A IL-5 estimula a diferenciação e proliferação dos eosinófilos na medula óssea além de regular o recrutamento dos eosinófilos para os tecidos inflamados (Coeffiere cols., 1991; Rothenberge cols., 1995). Já a eotaxina tem efeito quimiotático estimulando a acumulação de eosinófilos para os sítios inflamatórios (Coeffier et al., 1994; Rothenberg et al., 2001).
Página | 20
Nos modelos de indução de alergia alimentar aplicados em roedores, a variedade de linhagens existentes, a utilização de animais geneticamente modificados e a possibilidade de análises experimentais com muitas amostras, são algumas das vantagens da aplicação freqüente desses modelos em trabalhos experimentais (Knippels et al., 1999; Noverr and Huffnagle, 2005).Cara e colaboradores utilizaram modelo murino de alergia alimentar para analisar a indução de tolerância oral e a produção de IgE-específica (Cara, 1995). Observaram que, em animais tolerantes a alergia não era detectada e consequentemente a produção de IgE era baixa. Já os imunizados previamente com Ova, quando desafiados oralmente com o antígeno, apresentavam aversão ao mesmo e a produção de IgE era maior, o que caracteriza uma reação alimentar alérgica (Andrade, 1999; Cara, 1995).
Nesse trabalho, utilizaremos como antígeno a ovalbumina (Ova) e como adjuvante o hidróxido de alumínio (Al (OH)3), analisando a produção IgE,
IgA secretória e de outras imunoglobulinas totais e específicas. Além disso, vamos avaliar as alterações ocorridas no intestino após o processo de envelhecimento em um modelo experimental de alergia alimentar murino anteriormente descrito por Saldanha e colaboradores (Saldanhae cols., 2004).
O Envelhecimento
Devido aos avanços da medicina, das políticas públicas de saúde e do desenvolvimento socioeconômico, estamos vivendo mais do que antigamente e em ritmo acelerado. Em 2009, havia cerca de 21 milhões de idosos no país e, entre 1999 e 2009, o percentual das pessoas com 60 anos ou mais de idade no conjunto da população passou de 9,1% para 11,3% (IBGE, 2010).
Página | 21
continuará adicionando anos na vida média de sua população, alcançando em 2050 o patamar de 81,29 anos, basicamente o mesmo nível atual da Islândia (81,80), Hong Kong, China (82,20) e Japão (82,60).Em escala mundial, a esperança de vida ao nascer foi estimada, no período 2005-2010 em 67,2 anos e, para 2045-2050, a ONU projeta uma vida média de 75,40 anos (IBGE, 2010).Entretanto, apesar do aumento do tempo de vida ser um fator positivo, também representa novos desafios para os indivíduos e para a sociedade. O avanço da idade é acompanhado pelo surgimento de doenças decorrentes do aumento da susceptibilidade a infecções.
Nos mamíferos, o desenvolvimento, a diversificação estrutural e a maturação funcional do repertório imune são marcadas por um processo contínuo e dinâmico. Esse processo, denominado senescência, se inicia na vida fetal e culmina com a senescência (Ogra, 2010).
Apesar do grande progresso nos últimos anos da caracterização do sistema imune da mucosa, ainda não está claro quais são as reais alterações que ocorrem nesse sistema com o envelhecimento (Fujihashi and Kiyono, 2009).
De acordo com alguns trabalhos, o envelhecimento afeta tanto a resposta imune adaptativa quanto inata. A ativação de macrófagos, migração e fagocitose de células dendríticas, ativação mediada por receptores Toll, síntese de intermediários reativos de oxigênio e a eficiência de fagocitose dos neutrófilos demonstram estar enfraquecidas ou desreguladas em algum grau durante o processo de senescência (Nikolich-Zugich, 2005; Pfister and Savino, 2008).
Página | 22
Na imunidade adaptativa, os efeitos do envelhecimento são drásticos nas propriedades das células B e T. No entanto, as células T têm se mostrado mais susceptíveis aos efeitos do envelhecimento (Listi et al., 2006; Taub and Longo, 2005). Essa maior susceptibilidade se dá pelo fato das células T serem produzidas no timo, o qual involui com o avançar da idade, diminuindo assim, a produção de timócitos tanto em humanos quanto em camundongos. Acreditava-se que a perda de timócitos e de massa tímica estava diretamente relacionada ao declínio da função imune mediada por células T, assim como a resistência reduzida a infecções e a incidência aumentada de câncer e doenças autoimunes no idoso. Entretanto, vários trabalhos mostram que, apesar da atrofia significante, o timo do idoso ainda tem capacidade, ainda que reduzida, de promover diferenciação de células T e de produzir células T virgens (Taub and Longo, 2005).Durante o processo de envelhecimento, distúrbios na sinalização das células T supressoras podem estar associados com a relativa abundância de células T helper. As respostas imunes funcionais e reguladoras alteradas do
GALT podem explicar o aumento da incidência de infecções e neoplasias no trato gastrointestinal com a o avançar da idade ( Schmucker ET AL,2003; Thoreux,2007).
Página | 23
Figura 4: Efeitos do envelhecimento na produção de linfócitos e na distribuição para os órgãos secundários.
Muitos eventos contribuem para o declínio do número e da função das células do sistema imune adaptativo com o avanço da idade. A geração de células T diminui como resultado da involução tímica (que envolve o decréscimo das massas medulares e corticais tímicas e aumento de gordura). A produção de células B provavelmente também diminui com o envelhecimento devido ao declíneo de medula óssea hematopoiética. Logo, poucas células T virgens e possivelmente poucas células B são exportadas para a periferia. A expansão oligoclonal da população de células T CD8+ se inicia por volta dos 60 anos de idade, o que resulta no declínio do repertório de células T virgens e o aumento de células T CD8+ de memória na periferia.
Estudos em camundongos demonstram que o perfil de produção de citocinas por células T ativadas também é alterado durante o processo de senescência. Observa-se uma redução de IL-2, TNF-α, e GM-CSF e um aumento de IL-4, IL-5, IL-6 e IL-10 por células T CD4+ (de Faria et al., 1998; Kang et al., 2004). Entretanto, em humanos, alguns autores relatam que a produção de IL-2 por células T CD4+ virgens é relativamente normal e essas
células se diferenciam em células T efetoras de maneira similar àquela ocorrida em indivíduos jovens (Gomez and Cabrini, 2004).
A redução substancial de linfócitos T virgens e o aumento concomitante de linfócitos T de memória pode ser uma das razões pela qual a imunidade mediada por célula esteja prejudicada no idoso (Linton and Dorshkind, 2004). Essa troca de populações parece ser uma conseqüência da
Página | 24
proliferação homeostática compensatória em resposta ao número reduzido de linfócitos T naive, assim como, à influência da exposição acumulativa a antígenos (Linton and Dorshkind, 2004). O efeito dessa redução de células Tvirgens no “pool” periférico seria uma contração do repertório de células T que
levaria a uma baixa capacidade de responder a novos antígenos. Outra possível razão para essa baixa capacidade de resposta seria a ativação alterada das células T de memória que se acumulam no envelhecimento (Linton and Dorshkind, 2004).
Alguns trabalhos demonstram que a frequência aumentada de doenças autoimunes na senescência pode ser devida a uma transdução de sinais alterada em células T e B (Hasler and Zouali, 2005). Em células T, um dos eventos iniciais na ativação, a liberação de cálcio, está reduzida tanto em humanos como em camundongos idosos. Em células B, ocorrem alterações substanciais no mecanismo celular de sinais de transdução no receptor de células B (BCR) e outros receptores (Hasler and Zouali, 2005).
Concomitantemente com a produção tímica reduzida de células T não reguladoras é concebível que também haja uma redução na produção de células T reguladoras (Tregs) ao longo do envelhecimento. Sendo assim, caminhos alternativos para a geração periférica de Tregs são necessários para compensar esse déficit e para prevenir o aparecimento de doenças autoimunes. Apesar de alguns estudos mostrarem que a função supressora das Tregs está reduzida em quase 90% após 50 anos de idade em humanos, outros estudos não confirmam esse resultado mostrando que a função supressora das Tregs no idoso está tão preservada quanto no jovem (Dejaco et al., 2006).
Outra alteração comum de células T no envelhecimento é a expansão clonal de células T CD8+, sendo que um único clone pode ocupar uma proporção significativa do total no “pool” de células T CD8+. Embora
Página | 25
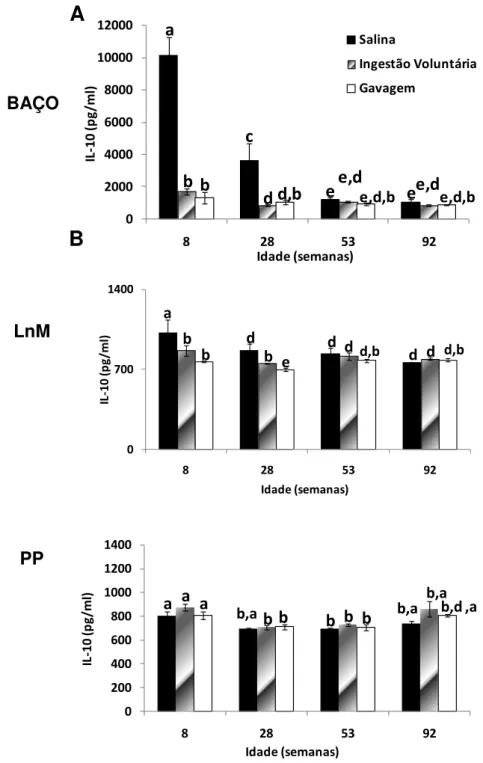
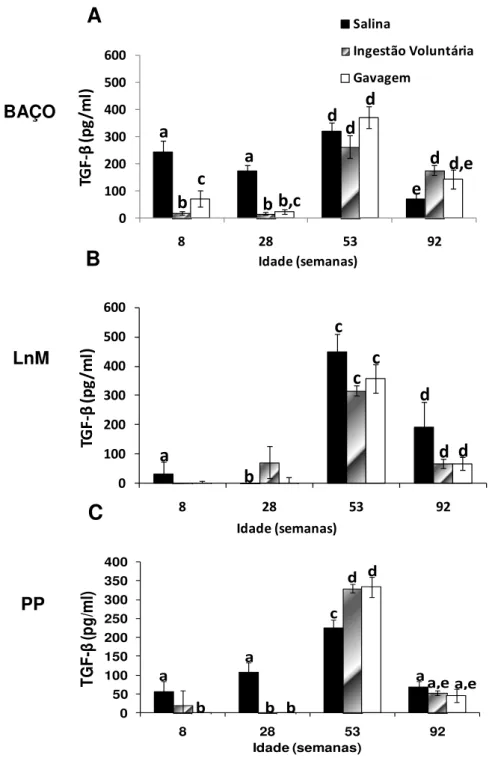
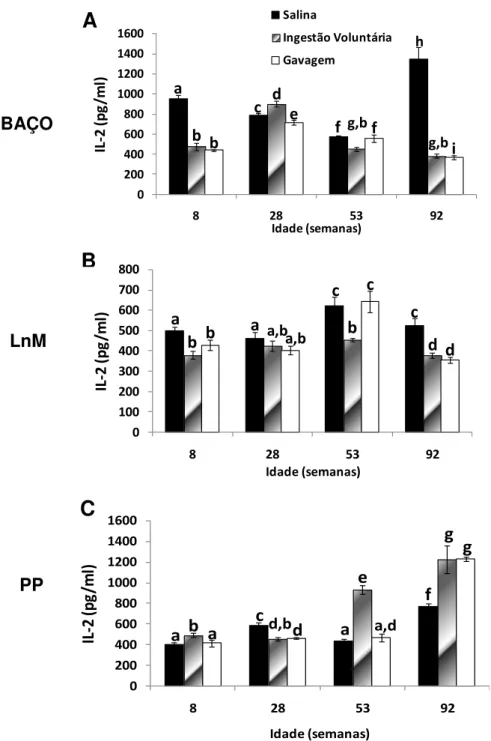
Em relação ao repertório de células B, observou-se que a produção de células B pela medula óssea declina significativamente com a idade (Min et al., 2006). Em humanos senescentes, a afinidade dos anticorpos pelo antígeno é baixa e a troca de isotipo das células B é deficiente quando comparadas às células jovens (Frasca et al., 2008). Trabalhos na literatura relatam um declínio na produção de imunoglobulinas IgM, IgG e IgA em linfonodos periféricos e de IgA secretória no muco intestinal de animais idosos (Fujihashi and McGhee, 2004). Entretanto, outros estudos observaram um aumento de IgM e IgG no soro e de IgA na saliva de humanos idosos (Arranz et al., 1992).Em trabalho recente do nosso grupo, mostramos que vários elementos reguladores presentes na mucosa intestinal, tais como linfócitos intraepiteliais com TCR, a produção local de TGF- e IL-10 assim como a frequência de células Treg com o fenótipo CD4+LAP+, estão reduzidos durante do processo de envelhecimento em camundongos. No entanto, alguns outros elementos como as células Treg CD4+CD25+Foxp3+ da mucosa intestinal são particularmente resistentes aos efeitos do envelhecimento e a preservação dessas células pode estar relacionada à manutenção da homeostase intestinal em animais idosos (Santiago et al, 2011).
Deste modo, podemos observar que, no envelhecimento, ocorrem alterações de vários mecanismos e células do sistema imune em geral e do tecido linfóide associado ao intestino em particular, dos quais grande parte está envolvida na indução da tolerância oral. Sendo assim, provavelmente o fenômeno do envelhecimento atue de alguma forma no processo de indução da tolerância oral.
Neste trabalho, analisaremos os efeitos do processo de envelhecimento na indução de tolerância oral e da alergia alimentar. Trabalhos anteriores do nosso laboratório demonstraram que camundongos idosos exibem um decréscimo na susceptibilidade à indução de tolerância oral. Várias linhagens de camundongos foram testadas e observou-se que a partir de 20° semana de idade a indução de tolerância oral e seus efeitos sistêmicos são alterados pelo processo de senescência (Faria et al., 1993).
Página | 27
2. Objetivo Geral
Estudar os efeitos do envelhecimento na indução de tolerância oral e no processo de alergia alimentar.
Objetivos Específicos
1. Avaliar a susceptibilidade de camundongos fêmeas BALB/c quanto à:
Indução de tolerância oral, utilizando como adjuvante hidróxido de alumínio (Al(OH)3) durante o processo de envelhecimento;
Produção de anticorpos totais e específicos, séricos e fecais contra ovalbumina (Ova).
2. Analisar, em camundongos fêmeas BALB/c, como as mudanças ocorridas durante o envelhecimento interferem na indução de tolerância oral avaliando:
Freqüência e função de células T reguladoras (LAP+,
CD4+CD25+FoxP3+) em linfonodos mesentéricos, placas de Peyer e baço de animais senis comparados com animais jovens, após a administração oral da Ova;
Produção de citocinas (IL-10, TGF- , IL-4, IL-2, IL-5, TNF-α) por células isoladas de baço, placas de Peyer e linfonodos mesentéricos de animais senis comparados com animais jovens, após a administração oral de Ova;
3. Avaliar a susceptibilidade de camundongos fêmeas BALB/c jovens e idosos quanto à:
Página | 28
Características fenotípicas das subpopulações de linfócitos
(utilizando os marcadores CD4, CD25, CD45RBlow) isoladas do baço, linfonodos mesentéricos;
4. Avaliar a susceptibilidade de camundongos DO11.10 BALB/c de 53 semanas quanto à:
Indução de alergia alimentar;
Frequência de células T reguladoras das subpopulações
CD4+CD25+FoxP3+, CD4+CD25+LAP; CD4+CD25-LAP; CD4+CD44+ na
Página | 30
3. Materiais e Métodos
A.
Animais
Foram utilizados camundongos fêmeas BALB/c com idade de 8 a 92 semanas de idade que foram fornecidos pelo Biotério do Instituto de Ciências Biológicas (CEBIO) da UFMG e mantidos no Biotério Experimental do Laboratório de Imunobiologia.
Também foram utilizados camundongos DO.11.10 (transgênicos para o TCR reativo com o peptídeo 323-339 da ovalbumina) (Haskins et al., 1983; Kearney et al., 1994).
Os camundongos DO.11.10 possuem o fundo genético BALB/c e, na nossa colônia, contam com 60-85% dos linfócitos T circulantes positivos para o anticorpos KJ.17 (reativo com o TCR transgênico). Esses animais foram adquiridos do Centro de Bioterismo da Universidade de São Paulo (USP), São Paulo. Os animais permaneceram em ambiente com controle de iluminação, ventilação e temperatura, e também receberam água e comida sem restrições durante todo o tempo do experimento.
B.
Protocolo Experimental para Indução de Tolerância Oral
em camundongos BALB/c idosos:
Animais de 8, 28, 53 e 92 semanas de idade foram tratados por via oral com Ova (grupos gavagem e ingestão voluntária) ou salina (grupo imune). A imunização primária foi realizada 7 dias após o tratamento oral e consistiu na injeção de 10 µg de OVA e 1 mg de Al(OH)3, diluídos em 0,2ml
de solução salina (NaCl 0,15M) na cavidade peritoneal.
A imunização secundária foi realizada 14 dias após a primária e consistiu na injeção, por via intraperitoneal, de 10µg de Ova diluídos em 0,2ml de solução salina (NaCl 0,15M). Sete dias após o reforço com Ova,
os animais foram sacrificados para obtenção do soro, fezes e órgãos para
Página | 31
C.
Protocolo Experimental para Indução de alergia
alimentar em camundongos BALB/c idosos:
Animais de 8 e 53 semanas de idade foram tratados por via oral com Ova por gavagem (grupo tolerante) ou salina (alérgico). A imunização primária foi realizada 7 dias após o tratamento oral e consistiu na injeção de 10 µg de OVA e 1 mg de Al(OH)3, diluídos em 0,2ml de solução salina
(NaCl 0,15M) na cavidade peritoneal. A imunização secundária foi realizada 14 dias após a primária e consistiu na injeção, por via intraperitoneal, de 10µg de OVA diluídos em 0,2ml de solução salina (NaCl 0,15M). Sete dias após o desafio, os animais foram sacrificados para obtenção do soro, fezes e órgãos para suspensão de células. Sete dias após a imunização secundária iniciou-se a indução de alergia alimentar com solução de clara de ovo diluída 1:5 em água, contendo aproximadamente
Coleta fezes (IgAs)
Coleta soro (Igs-totais, IgE, IgG1)
Coleta Baço e LnM (IL-4, IL-5, IL-10, TGF-β
Salina Gavagem
14 dias
Ova
4mg/ml
Ingestão Voluntária
10 µg Ova 1 mg Al (OH)3
Tratamento
Oral
7 dias 7 dias
10 µg Ova
Imunização
Primária (i.p)
Imunização
Secundária (i.s)
Cultura de células
FACS
Coleta de soro e fezes
Coleta de intestino
Página | 32
10 mg/ml de Ova e após sete dias consecutivos os animais foram sacrificados e os mesmos órgãos já descritos coletados. Número de animais/grupo: 5Salina Gavagem
14 dias
Ova
4mg/ml
Ingestão Voluntária
10 µg Ova 1 mg Al (OH)3
Tratamento Oral
7 dias 7 dias
10 µg Ova Imunização
Primária (i.p)
Imunização Secundária (i.s)
Cultura de células
FACS
Coleta de soro
e fezes
Coleta de intestino
Fim da Indução da tolerância oral
e início da indução de alergia alimentar
a Ova
7 dias
Solução Clara de Ovo 1: 5
Ova 10mg/ml
Dia 0
Dia 7
Dia 14
Dia 21
Dia 35
Coleta fezes (IgAs)
Coleta soro (Igs-totais, IgE, IgG1,)
Coleta Baço e LnM (IL-4, IL-5, IL-10, TGF-β Peso dos animais
Página | 33
D.
Protocolo Experimental para Indução de alergia
alimentar em camundongos idosos DO. 11.10:
Animais transgênicos DO.11.10 de 53 semanas de idade foram tratados oralmente com Ova por gavagem (GRUPO TOLERANTE) ou salina (GRUPO IMUNE). A imunização primária foi realizada 7 dias após o tratamento oral e consistiu na injeção de 10 µg de OVA e 1 mg de Al(OH)3, diluídos em