SOLUBILIDADE DE ALGUNS TIPOS DE
CALCÁRIOS (*)
J . ROMANO G A L L O e R . A . CATANI, engenheiros agrônomos, Secção de Agrogeologia, Instituto Agronômico de Campinas
RESUMO
N o presente trabalho é apresentado um estudo comparativo da solubilidade de alguns tipos de calcários. Verifica-se o comportamento dêsses materiais em solução de ácido acé-tico a 1% e assinala-se a vantagem do método na caracterização do tipo de calcário. Nêste estudo foram utilizados três calcários sedimentares e cinco metamórficos, entre os quais um dolomito típico e um altamente cálcico, todos do Estado de São Paulo. Como referência, devido sua elevada solubilidade, foi incluída uma amostra de calcita, procedente de Goiás. Foram determinados os teores totais de CaO e MgO nas duas frações usadas : 65-150 e 150-270 malhas e cs íeores solúveis em ácido acético a 1% nas.relações dè uma parte em pêso do material para 100, 200, 300, 500, 750 e 1.000 partes e n volume da solu-ça-o. Os dados obtidos foram computados em termos de CaCO3 equivalente e a solubilidade
dos materiais foi medida : 1) em relação ao peso de material; 2) em função do total de neutralizante das frações.
Os resultados mostraram a solubilidade mais elevada dos calcários altos em cálcio em relação acs calcários dolomíticos de igual finura. Entre êstes, os sedimentares revela-ram-se mais solúveis que os metamórficos de semelhante composição química. O estado de divisão do material teve importância relativa, maior sôbre a solubilidade nos calcários dolomíticos que nos de elevado teor em cálcio.
1 - I N T R O D U Ç Ã O E O B J E T I V O
O uso de calcário c o m o corretivo é prática agrícola generalizada. A composição química de qualquer material calcário expressa seu poder neu-tralizante num estado potencial e, por conseguinte, sua capacidade em corri-gir a acidez do solo. N ã o indica, porém, sua eficiência. Conforme tem sido demonstrado conclusivamente ( 5 , 6 , 7 ) a rapidez de reação de um calcário no solo ou em qualquer meio ácido diluído, depende, em grande parte, d o estado de divisão d o material. A diminuição d o diâmetro das partículas e conseqüente acréscimo da superfície de exposição, traduz-se num aumento de solubilidade. Por outro lado, para um mesmo grau de finura, a rapidez de reação varia c o m o tipo de calcário.
(*) Trabalho apresentado à IV Reunião Brasileira de Ciência do Solo, realizada em Belo Horizonte de 6 a 18 de julho de 1953.
64 B R A G A N T I A V O L . 1 3 , N . ° 5
Alguns autores têm procurado correlacionar a solubilidade c o m certas propriedades físicas. M o r g a n e Salter ( 6 ) não encontraram nenhuma relação aparente entre a solubilidade e as propriedades físicas c o m o dureza, peso específico, porosidade e composição cristalina. Obtiveram, contudo, uma relação estreita entre a solubilidade dos materiais calcários em ácido acético e a reação desses materiais no solo. Lenglen e Durier, citados por Léroux
( 4 ) , estudando a solubilidade de calcários de diferentes durezas, e m água
impregnada de anídrido carbônico, mostraram que para u m mesmo teor os calcários tenros são mais solúveis que os semiduros, e estes mais que os duros.
Os calcários diferem grandemente quanto à composição química, pro-priedades físico-químicas e características mineralógicas. A solubilidade depende da ação conjunta desses fatores.
O presente trabalho tem por objetivo estudar a solubilidade de alguns tipos de calcários em solução de ácido acético a 1% ( ' ) e as possibilidades d e identificação desses materiais segundo esse comportamento.
2 - M A T E R I A I S E M É T O D O S
2.1 - MATERIAIS UTILIZADOS
Os calcários estudados foram coletados e m regiões d o Estado de São Paulo, c o m exceção da amostra i, calcita, procedente de Goiás.
Foram utilizados os materiais seguintes :
a — Calcário, amostra média, procedente de Bairrinho — M u
-nicípio de Piracicaba,
b — Calcário, amostra média, procedente de Limeira, Fazenda
Caieira.
c — Calcário, procedente de Assistência — Município de R i o Claro, d — Calcário, procedente de Itapeva, Campina d o Veado,
e — Calcário, procedente de Registro — Município de Taubaté.
f — Calcário, amostra média, procedente de Votorantim —
Soro-caba.
g — Calcário, amostra média, procedente de Capão Bonito, Sumi-douro.
h — Calcário, procedente de Itapeva, Bairro d o Alegre,
i — Calcita, procedente de Goiás.
A identificação química desses materiais pode ser feita através d o quadro 1, n o qual estão contidos os seguintes dados : na l .a
coluna, os materiais calcários ; na 2 .a
e 3 .A
, os teores e m óxido de cálcio e óxido de magnésio,
respectivamente ; na 4 .a
, 5 .a
e 6 .a
colunas, os teores de sílica (resíduo inso-lúvel), óxidos totais e perda ao fogo, respectivamente, e na 7 .A
coluna está expresso o poder neutralizante total em termos de C a C 03 equivalente.
Para a investigação da solubilidade foram separadas, de cada calcário, duas frações quanto ao grau de finura : partículas de 0,208 a 0,104 m m e de
(1
A B R I L , 1 9 5 4 GALLO & C A T A N I : SOLUBIL. DE CALCÁRIOS 65
QUADRO 1. — Características químicas dos materiais calcários
Material CaO MgO R J . RaOs P.F.
Poder neu-tralizante CaCOs = 100
% % % % %
a — 25,92 18,21 13,10 1,30 41,50 91,40
b — Limeira 26,70 17,12 12,60 3,10 40,10 90,09
0 — Rio Claro 28,15 21,00 4,40 1,20 45,30 102,30
d — 29,70 20,34 2,60 2,20 45,70 103,42
e — Taubaté 31,10 19,72 2,70 0,70 45,90 104,39
f — 40,60 6,78 11,30 2,10 39,60 89,24
g — Capão Bonito . 41,72 5,61 10,40 2,70 39,50 88,34
h — Itapeva, B. A. 48,06 1,80 10,00 1,00 39,76 90,20
i — Calcita 55,98 55,98 44,01 44,01 99,87 99,87
0,104 a 0,053 m m de diâmetro. Empregaram-se, nessa operação, peneiras Tyler de 65, 150 e 270 malhas por polegada, respectivamente. A moagem
foi conduzida em gral até que todas as partículas atravessassem a peneira de 65 malhas. A fim de evitar pulverização excessiva foram feitas tamisações periódicas, à medida que o material era triturado. Esse critério teve em vista obter maior homogeneidade d o material nas frações. O ácido acético foi usado como solvente, devido à sua baixa constante de ionização ( K = l,76 x
10 "*"6
; pela facilidade e rapidez de diluição ; por não estar sujeito ao ataque intenso de fungos, quando diluído, o que comumente ocorre nas soluções de ácido cítrico.
A s amostras a, b e c , de Piracicaba, Limeira e R i o Claro, são calcários
de origem sedimentar, aparentemente amorfos (microcristalinos). Os
cal-cários a e c são brancos acinzentados, e o de Limeira, cinzento escuro, quase preto. Estrutura comumente em leitos (estratificações). O sílex, em geral bastante freqüente, apresenta-se c o m o inclusões. Pertencem geologicamente
à Série Passa Dois, Sistema de Santa Catarina (2). Apresentam-se c o m teor
elevado em M g O e, por isso, são considerados altamente magnesianos. São materiais que se deixam fragmentar c o m relativa facilidade, dando u m pro-duto b o m quanto ao grau de finura, mesmo quando moídos em moinhos de martelos.
Todas as amostras restantes são materiais metamórficos e contêm mais
de 10% de M g O e m relação à soma C a O + M g O , c o m exclusão da calcita,
que só encerra carbonato de cálcio, e d o calcário de Itapeva, Bairro d o Alegre,
altamente cálcico. (1
)
O dolomito de Taubaté, representado pela amostra e, é branco, brilhante, bem cristalizado, de cristais grandes, compacto, homogêneo e bastante duro. Pertence ao Arqueano.
A s amostras d, f, g e h são todas de calcários da idade algonqueana, pertencentes à série de São R o q u e (2). São de tonalidades cinza, desde o cinza claro ao b e m escuro ou negro, compactos, de cristais na maioria das
vezes minúsculos, notando-se, e m alguns casos, cristais de C a C 03. O calcário
d, de Itapeva, Campina d o Veado, é cinza-claro," duro, formado de uma massa
fina. Subdivide-se c o m facilidade e m fragmentos de arestas nítidas. N o
(1
6 6 B R A G A N T I A V O L . 1 3 , N . ° 5
calcário de Capão Bonito, amostra g, a massa fina, dura e compacta está atravessada por vênulas de calcita. A nota proeminente no calcário de Itapeva, Bairro d o Alegre (amostra h) é a existência de concentrações de calcita no seio da massa, que se prolongam em veias brancas, em direções variáveis, contrastando c o m a côr negra d o material. Esses calcários, como outros metamórficos, em geral, somente dão u m grau de finura recomendável quando passados por moinhos de bolas.
A calcita procedente de Goiás foi incluida neste estudo para servir de termo de comparação, em virtude de seu elevado grau de solubilidade.
2 . 2 - MÉTODOS D E ANÁLISE
2.2.1 - TOTAL D E CaO É MgO NAS FRAÇÕES
Os teores totais de óxidos de cálcio e de magnésio das frações estudadas foram determinados pelos processos usuais de análise de calcário. Os resul-tados obtidos são apresenresul-tados no quadro 2 .
QUADRO 2 . — Teores totais de CaO, MgO e CaCÜ3 equivalente, das frações 6 5 - 1 5 0
ma-lhas e 1 5 0 - 2 7 0 malhas
Material
Fração 65-150 malhas Fração 150-270 malhas
Material
CaO MgO C a C 03
equiv. CaO MgO
CaCOs equiv.
% % % % % %
a — Piracicaba 25,82 18,83 92,75 25,48 19,19 93,05
b — Limeira 26,91 18,47 93,81 26,32 19,55 95,43
c — Rio Claro 28,31 21,36 103,48 29,40 21,00 104,53
d — Itapeva, C.V. 30,24 22,45 109,62 29,68 21,58 106,46
e — 31,11 20,28 105,80 31,36 19,47 104,23
f — 38,22 9,89 92,71 36,06 10,13 89,45
K — 42,28 7,24 93,39 42,84 6,75 93,16
h — 48,58 2,53 92,94 48,44 2,17 91,80
i — Calcita 55,93 55,93 99,78 99,78 55,99 55,99 99,89 99,89
2 . 2 . 2 - T E O R SOLÚVEL E M ÁCIDO ACÉTICO A 1%
A solubilidade dos diversos calcários em ácido acético foi estudada, tratando-se diferentes quantidades^'de material c o m u m volume constante de solução de ácido acético a 1%, nas proporções seguintes : 1 : 1 0 0 , 1 : 2 0 0 ,
1 : 3 0 0 , 1 : 5 0 0 , 1 : 7 5 0 , 1 : 1 0 0 0 ( 1 ) . Assim foram transferidos 2 , 5 0 0 g, 1 , 2 5 0 g,
0 , 8 3 3 g, 0 , 5 0 0 g, 0 , 3 3 3 g e 0 , 2 5 0 g de cada calcário para Erlenmeyers de 5 0 0 ml
e agitados c o m 2 5 0 ml de solução de ácido acético a 1%, durante 3 0 minutos a 3 0 — 4 0 r.p.m. Filtrou-se o mais prontamente possível.
A B R I L , 1 9 5 4 GALLO & C A T A N I : SOLUBIL. DE CALCÁRIOS 6 7
N a soluçãOj precipitou-se o cálcio c o m o oxalato e titulou-se o ácido oxálico c o m permanganato de potássio 0,1 ou 0,04 normal, conforme o caso.
O magnésio foi dosado pelo método d o hidroxiquinolato. (1
) A marcha, adotada foi a seguinte :
A o filtrado d o cálcio acrescentaramse 3 ml de uma solução de m e t a -bissulfito de sódio a 5 % , submeteu-se a ebulição durante 5 a 10 minutos, adicionou-se 1 ml de HC1 e deixou-se ferver por mais 5 minutos. Esperou-se esfriar e foram adicionadas 2 a 3 gotas de solução de fenolftaleína a 1%, amoníaco (1 + 1) até viragem d o indicador e u m excesso de 3 ml. Aqueceu-se a 70 - 80°C, em banho maria e juntaram-se, gota a gota, c o m agitação, 10 m l de uma solução a 2 % de 8- hidroxiquinoleína em ácido acético (5 + 4 5 ) . Deixou-se enr repouso durante meia a uma hora, àquela temperatura, n o banho maria e filtrou-se e m seguida, lavando-se o precipitado c o m uma solução quente de amoníaco (5 + 95). Dissolveu-se o 8- hidroxiquinolato de magnésio c o m uma solução quente de HC1 (1 -f- 4) e determinou-se a 8-hidroxiquinoleína por titulação bromométrica (3).
3 - R E S U L T A D O S O B T I D O S
N o s quadros 3 e 4 estão expressos os resultados da solubilidade dos m a t e -riais calcários em ácido acético a 1%. N a l .a
coluna de ambos os quadros são enumerados os materiais calcários ; nas demais colunas, reunidas em grupos de três encimados pelas relações 1:100,1:200,1:300,1:500, 1:750 e 1:1000 s ã o apresentados, respectivamente na l .a
, 2 .a
e 3 .a
colunas de cada grupo, os teores de CaO, M g O e C a C 03 equivalente solubilizados em solução de á c i d o
acético a 1%, nas relações de 1 parte em peso d o material para 100, 2 0 0r
300, 500, 750 e 1000 partes em volume da solução.
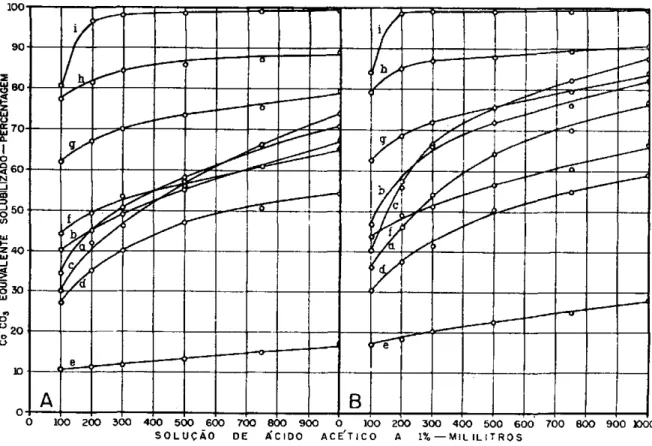
A figura 1 reproduz graficamente os resultados obtidos. N o eixo d a s abcissas estão dispostos os volumes de solução de ácido acético a 1%, e x -pressos em mililitros e, no das ordenadas, os teores solubilizados e m termos de carbonato de cálcio equivalente.
Conforme se pode deduzir dos dados contidos nos quadros 3 e 4 e resu-midos pela figura 1, a calcita revelou-se o material mais solúvel. Este fato que já havia sido constatado e m ensaio preliminar, constituiu o m o t i v o prin-cipal de sua inclusão c o m o referência.
E m segundo lugar, em ordem decrescente de solubilidade, encontra-se o calcário de Itapeva, Bairro d o Alegre, altamente cálcico. Segue-se-lhe o calcário de Capão Bonito, também c o m elevado teor em C a C 03, o qual
mostrou-se mais solúvel que os sedimentares em todas as relações de material para volume da solução de ácido acético na fração 65-150 malhas. N a fração mais fina (150-270 malhas) esta superioridade persiste até a relação 1:500. D a í por diante (relações 1:750 e 1:1000) o calcário de R i o Claro afigura-se ligeiramente mais solúvel.
N u m plano intermediário aparecem os calcários dolomíticos de Piraci-caba, Limeira e R i o Claro, que podem ser considerados c o m o materiais
6 8 B R A G A N T I A V O L . 13, N.° 5 O cá rQ 3 O > cá ry ü » :100
0 O SC CA O CACO S EQUIV . 1:75
0 O
M
CA
<
c . O >
33 O1
ü <U 1:50 0 MG O CA O CACO S EQUIV . 1:30 0 MG O CA O CO O > cá O*
ü v
1:20 0 MG O CA O CACO S EQUIV . O
O O
M CA O IA L t i ( ¾
6S 70,9
3 67,2 8 74,1 5 54,6 1 17,1 0 65,7 7 79,8 2 89,0 1 99,7 4 TH CO O
t
—
_
Ooo OI OJ
O
•O CN IN OJ LO
CD_ J IO~
T-H T-H LÓ" T-H
T-H oi "Ó" Tf" rt
; CO Tf IO Tf O CD Tf
O rH TH CN OJ OI OJ
O CO
TH OJ
CÓ" Oí oi Tf
T-H
CD" 00
OJ oo"
CO IN
Tf IO" LO CD
00 "O Tf Tf CM CO OJ Tf OJ
LO
CO IN LO CN Tf O) CO
CD"
CO CO CO" CO © LO
Tf o
CO LO"
IN IN
00 oi OJ
65 CN
00 oo
O)
O
8
OI O
OJ LO
oo
O N CO
i
65 Tf T-H
O Tf" oi Tf" CO
1 i£ TH CO_ CM CO Tf CC CM
T-H CO_
oo
O o O Tf
00 i£
r-" oi" IN CO T-H
lo" IN
CN oo" co N"
Tf lo" LO 68 lo CM O
i--
LOTf CO "O Tf O O» OJ IO O O CO 68 oo" "O LO LO N LO 1--"
Tf
CO CO" LO
CO
r-CÓ" oo od OJ
T? IN Oi
O CO
IO LO IN oo
IN OJ
O_ ;
oi oi oi O" T-H
CO oi
\ o tH_ CO N o Tf oo
CS CN "O
1> OJ
IO IN OI IN CN
LO~ >N LO
T-H LO CO" CM IN CO CO" Tf LO LO 68 T-H
IN CO 00 T-H
t>
LO CO
o
O CO
t»
OJ Tf
CM
CO oo O
68 O"
LO oi" Tf o" Tf O"
Tf oi
CO"
>O O
IN Tf oo oo" OJ
SS 00 t
-CO
oq CO T-H CO Tf LO OI CO CO .N o_
IN
00 1
SS O" IN
o T-H
00 ^ OF oi O
1
68 Tf
Tf N © O
T-H o OJ
OJ
OJ 00 Tf CO © CN CM oo OJ 68 CO
oi T-H
o T-H
Tf CO" CM CO CO" CD Tf
Tf" LO
Tf
Tf IÍ5
CD
10_ CO "O CN OJ O CO OJ_ OJ CO
i>
lo"Tf IO
Tf oi Tf
Tf
CO TH oi Tf CO
TH 00 CO" OJ CD Tf LO Oi IO
OJ OJ N O N oo H LO oo IO 1
OS CO" OO" CO" TH TH O
!
CM
CO CC LO O) Tf LO IN OJ IN TH CO CN CD IO CM O»
oi T-H
lo" oi Tf LO
OI IO" CO IO"
Tf Tf" LO 68 'O oq
CO oo OI
o
N O IN CO
oo OI H OI LO IO 00
68 Tf"
CO O" Tf O CO IN CN
O" Tf" Tf cm" CO IN
o O" oo
I £ OO
oo T-H CM LO •O CO OJ OJ CN o
00 CO
OI
CO !
I £ CO" LO" CD IO O" O" O"
]
Tf CO IO OJ CM OJ
O CM
CO CO IN oo oo TO H OI CO oi" Tf" oo" oo" Tf CO"
O) CO
CO CO
Tf IO" Tf
1 \ 1
1 >
03 ; O EI
1 tH
ç3 03 cá"
'C3 'cu ü >
CJ
53 O AP
5 rH
o! -1
03 3 03 EH 03 03 a O M cá
O 's 3, o
t- TH *5 —<
O m
7 0 B R A G A N T I A V O L . 1 3 , N . ° 5
semelhantes. A não obediência da mesma ordem relativa de solubilidade -entre esses três calcários em ambas as frações é perfeitamente justificável
reportando-se à origem sedimentar dos mesmos.
D e p o i s v e m o calcário procedente de Sorocaba, representado neste estudo pela amostra f, c o m menor solubilidade que os sedimentares, cuja diferença, como se nota, se acentuou c o m diminuição d o diâmetro das partí-culas e aumento da relação material para volume da solução.
Por último, figuram os calcários metamórficos de Itapeva-Campina d o Veado e Taubaté, dos quais o dolomito de Taubaté surge como o menos solúvel de todos.
Os resultados dos quadros 3 e 4 permitem duas observações gerais : a elevada solubilidade dos calcários altos em cálcio e a reação menos pronun-ciada dos calcários dolomíticos c o m a solução de ácido acético. Pode-se ainda verificar, pelo exame desses dados, que c o m a diminuição d o diâmetro das partículas registrou-se um aumento de solubilidade dos materiais cal-cários, variável segundo a natureza d o material. O acréscimo de solubili-dade nas partículas de menores diâmetros (fração 150-270 malhas) foi mais sensível para os calcários altos em magnésio que para os de elevado teor em cálcio. Essas observações estão de acordo c o m os resultados obtidos por M o r g a n e Salter ( 6 ) e Schollenberger e Salter (7).
100
90
$ so
5= 1
.
\ ~i1
< - 8
<
L
1
*^-<
b/fí .
7 r *
1
Vi
(/4
/
>- ^ > < r
—o—
1
A B
rsi
! 50
: 40
o 30
20
10
100 200 300 400 500 600 700 800 900 0 100 200 300 400 500 600 700 800 900 1000 SOLUÇÃO DE A'CIDO ACE'TICO A 1% — MIL ILITROS
FIGURA 1. — Curvas de solubilidade dos materiais calcários, construidas com os teores
ABRIL, 1 9 5 4 GALLO & C A T A N I : SOLUBIL. DE CALCÁRIOS 7 1
Outro ponto interessante é a maior solubilidade d o calcário de Itapeva, Campina do Veado, comparativamente ao de Taubaté, embora sejam ambos metamórficos e apresentem os teores de M g C 03 e C a C 03 praticamente na
relação dolomítica (1:1,19). Tal fato deve, por conseguinte, ser atribuído às diferenças de textura dessas rochas calcárias. C o m efeito, o dolomito de Taubaté, como já foi descrito na apresentação dos materiais, em 2.1, é da cristais macroscópicos, bastante nítidos, enquanto o calcário procedente de Itapeva constitui uma massa fina, formada de cristais minúsculos, invisíveis a olho nu (microcristais). Semelhantemente, a solubilidade mais elevada dos calcários dolomíticos de Piracicaba, Limeira e R i o Claro, em relação aos calcários metamórficos de semelhante composição química, assenta-se na formação sedimentar dos primeiros.
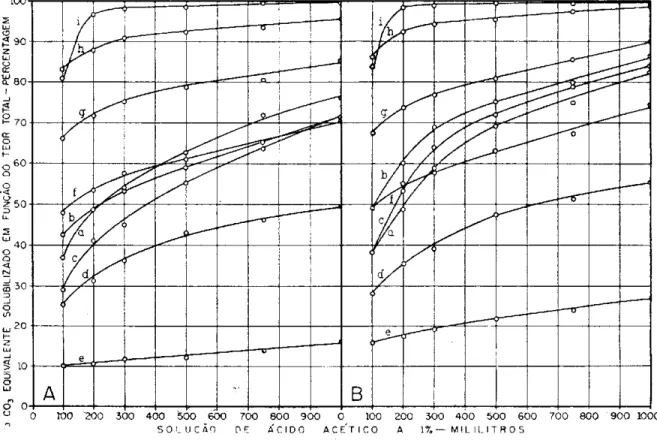
O comportamento dos diversos materiais calcários em solução de ácido acético pode ser melhor estimado medindo-se a solubidade em função do teor total. Considerando-se que os materiais calcários contêm impurezas, a solubilidade dos mesmos é apresentada, agora, com base em seu poder neu-tralizante. Os resultados obtidos por cálculo, relacionando-se os teores de C a C 03 equivalente solubilizados (quadros 3 e 4) e o total de C a C 03
equiva-lente das frações (quadro 2), são os que constam do quadro 5 .
FIGURA 2 . — Curvas de solubilidade dos materiais calcários, construidas com os teores percentuais de CaCÜ3 equivalente, calculados em função do teor total e com os volu-mes da solução de ácido acético a 1%. A — Fração 6 5 - 1 5 0 malhas. B — Fração 1 5 0 - 2 7 0
72 B R A G A N T I A V O L . 1 3 , N.° 5 3 O * C U O ü ü CD o o T) O ICÁ O d 3 A CD O O +3 V» O CÁ O T3 • p—i O A CD o ti CÁ rQ 1—i O m o 3 ^ õ CÁ
.í5 e3
3 "O
D1 cp eo ^ cu CO CD
' l - l
CD CÁ CÁ -TJ Cl CD CD <M
CH O
SH C3
O CD IH CD rH CD rH CÁ T3 <j > O* O 03 43 3 OS 3 O * O O oi ü O O) H 03 RD. O IN i O IO O
»3 Oi 03 M P=H 03 rd • — i 03 a O 10 th IO T O O 103 t» 03 ÍH Éh O O O O IO O O IO O O CO O O C N O O O O O O IO O O IO O O CO O O <N O O 65 O OS <N oo C O
C O oo
CN C O
0 0
1 0 0 0 T F "
O CO © CS O S C S 0 0 O O O
CO O I O C O IO 0 0 EO O I O S
<N
1—1 T—1 Í> 1—1 C O T~ 0 0 C O
I O O" O I
rH TF" L> •O
jt —r O S
T~ 0 0 1 > I O (N C D 0 0 OS O S
C O 0 0 C O 0 0 CO T F T F T F
IO T F C O C D C S T F T F OS 0 0 OÍ •O " <n" 1 > CO"
rH I O O S
C O L> T F IN C C OO O I O S
T F C O I—1 rH O I T F O C D T F
C O C N T F T F C O O CO 0 0 0 0
65 OO" CÍ T F " OÍ OÍ OO" T-T T F O S
65 I O C O C O CO
rH IO OS OS
C N ,_, OO IO C N !> T F I O O
CD CO < N OO L> T- CO
65 CS O CO" IO T-T I O " EO" IN O S
65 T F
CO IO C O rH I O Í> O S O S
<N CO T—i T F O I J N I O O O S
0 0 C O O I
IO T F CQ
IO CQ T F 65 OD Oi" 0 0 OO" CD" O:' T-" C D T F
65 CO T F CO C N
rH T F C D 0 0 0 0
IN C D C N C O T F ' 1 > L> C O
T F CO_ 0 0
rH Oi T F 1 > O S 65 C O "
rH rH* OÍ CO" O
IO I O OÍ
1 > T~ T~ T F
rH 0 0 O S OS
O S O rH T F C N CN C N T F
O
lO_ O < N
I—r T F O S 0 0 OO_
6¾ C N V) T F CO" T F "
IO O" CO" OÍ
6¾ T~ C O C D T F
rH C D 0 0 O S O S
O 0 0 C N O I C N O IO O S C N
0 0 CO_
IO C O C O T F O I O OO
65 < N
Oi I O " CO" cn" O S " C N OO"
65 C O •O
IO T F C D L> O S O S
IO T F rH T F CJJ 0 0 I O O C O
rH rH 0 0 CO_ OS T F Q_ CO 65 T F " CO"
IO CO" rH T> I O "
r-T OO"
65
IO IO T F . CO
rH 1 0 - O S OS
Cl r—1 CO O O C O C N T F
O I
IO rH IO C O O ( N ° I
65 CO OO" rH O CO" CÍ OO" CO"
65 T F T F T F C O
tH IO 1 ^ 0 0 O S
0 0 CD T> O S C N rH EO
IO L> C N ( N rH EO IO T F O I
65 CM~ CÍ I O " O" OO" C O CO
rH" 1
65 C O T F IN <N
rH T F C O 0 0 OO
03 -O O
o3 ü O s > 03 03 3 03 H 03 -O O O « O 103 a 03 ü m 03 > as a 03 03 a
N a l .a
coluna estão os materiais calcários ; nas colunas seguintes, os teores de C a C 03 equivalente solubilizados em ácido acético a 1% em função
d o teor total nas diferentes relações entre material e volume, para as duas frações estudadas.
A figura 2 mostra as curvas de solubilização construídas c o m os dados d o quadro 5 . N o eixo das abcissas estão dispostos, e m ordem crescente, os volumes de solução de ácido acético a 1 % e, n o das ordenadas, os teores de carbonatos solubilizados, obtidos conforme foi dito.
Através dos dados d o quadro 5 e da observação da figura 2 , pode-se verificar que a solubilidade relativa dos materiais calcários não sofreu grandes oscilações comparativamente aos resultados já obtidos (quadros 3 e 4 , fi-gura 1). E m linhas gerais, as mesmas considerações feitas anteriormente aplicam-se, também, a esses resultados, o que aliás é aceitável, uma v e z que os calcários apresentavam u m teor total em C a C 03 equivalente, nas
frações, superior a 9 0 % . 1 — O aumento d o teor de magnésio geralmente manifesta-se p o r uma 4 - C O N C L U S Õ E S diminuição de solubilidade. Os calcários dolomíticos são menos solúveis que os calcários altos em cálcio, de igual finura. Essa diferença é mais sensível para materiais de partículas grossas. O grau de finura das partículas num calcário dolomítico tem influência relativa maior sobre a solubilidade que nos calcários de elevado teor em cálcio. composição química, propriedades físico-químicas e características minera-2 — A solubilidade dos diversos materiais calcários é o reflexo de sua
lógicas. O estudo da solubilidade em ácido acético a 1%, nas diversas rela-ções entre material (peso) e solução (volume), permite caracterizar mais facilmente os diferentes tipos de calcários. 3 — A s observações sobre a rapidez de ataque dos calcários por uma solução diluída de ácido acético, num intervalo de tempo convencional, talvez possam se constituir em uma base para se estimar a atividade relativa des-ses materiais n o solo, em períodos não muito longos. The solubility in 1 per cent acetic acid solution of 8 types of limestones from the SOLUBILITY OF L I M E S T O N E S SUMMARY
State of São Paulo, Brazil, was studied. A sample of pure calcite from the State of Go;
The results on solubility of the different samples, expressed as C a C O3 equivalent,
are summarized in figures 1 and 2. They indicate that the limestones with a high content in CaO are more soluble than those with a high content in MgO. Within the group of dolomitic limestones, those of sedimentary origin were more soluble than the metamorphic ones. The influence of texture of the material on solubility was relatively greater for the metamorphic dolomitic limestones than for those with a high CaO content.
LITERATURA CITADA
1. CATANI, R. A. & NASCIMENTO, A. C. Solubilidade de alguns fosfatos
natu-rais. Rev. Agric, Piracicaba 27:149-168. 1952.
2. GUIMARÃES, J. E. P., FERItEIRA, B. A. & BARBOSA, A. F. Calcáreo no
sul do Estado de São Paulo. I. G. G. (Revista do Instituto geográfico e geoló-gico) 5:358-413. 1947.
3. KOLTHOFF, I. M . & SANDELL, E. B. Textbook of quantitative inorganic
ana-lysis. Rev. ed. New York, MacMillan, 1943. xvii, 794 p.
4 . LEROUX, D. Engrais amendements produits pour la protection des cultures :
étude et analyse. Paris, Gauthier-Villars, 1951. vi, 387 p.
5. MEYER, T. A. & VOLK, G. W . Effect of particle size of limestones on soil
reaction, exchangeable cations, and plant growth. Soil Sci. 73:37-52. 1952.
6. MORGAN, M . F. & SALTER, R. M . Solubility of limestones as related to their physical properties. Soil Sci. 15:293-305. 1923.
7. SCHOLLENBERGER, C. J. & SALTER, R. M . A chart for evaluating