Vítor Rodrigo de Melo e Melo
Síntese e caracterização de carreadores de oxigênio para combustão com recirculação
química obtidos via reação de combustão assistida por microondas
_______________________________________
Dissertação de Mestrado
Natal/RN, agosto de 2011
INSTITUTO DE QUÍMICA
Vítor Rodrigo de Melo e Melo
SÍNTESE E CARACTERIZAÇÃO DE CARREADORES DE OXIGÊNIO PARA COMBUSTÃO COM RECIRCULAÇÃO QUÍMICA OBTIDOS VIA REAÇÃO DE
COMBUSTÃO ASSISTIDA POR MICROONDAS
Dissertação apresentada ao programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, em cumprimento as exigências para obtenção do título de Mestre em Química.
Orientadora: Profª. Drª. Dulce Maria de Araújo Melo Co-orientador: Prof. Dr. Bráulio Silva Barros
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial de Química
Melo, Vítor Rodrigo de Melo e.
Síntese e caracterização de carreadores de oxigênio para combustão com recirculação química obtidos via reação de combustão assistida por microondas / Vitor Rodrigo de Melo e Melo. Natal, RN, 2012
90 f.
Orientador:Dulce Maria de Araújo Melo Co-Orientador: Bráulio Silva Barros
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Carreadores de oxigênio - Dissertação. 2. CLC - Dissertação. 3. CO2 – Dissertação. 4. Perovsquita - Dissertação. I. Melo, Dulce Maria de Araújo. II. Barros, Bráulio Silva. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
Primeiramente agradeço a Deus, por ter me dado fé, paciência e sabedoria.
Aos Professores Dr. Marcus Antônio de Freitas Melo e Dra. Dulce Maria de Araujo Melo, a minha eterna gratidão, primeiramente pelo acolhimento, pela orientação segura, pela paciência, compreensão, apoio e incentivos dedicados durante este trabalho.
Aos meus pais Brás de Melo Filho e Maria de Fátima Freitas Melo e Melo, pelo amor incondicional e que mesmo de longe se fizeram presentes durante todo o tempo.
Às minhas irmãs Carina e Ana Rita Melo, que sempre me ajudaram com incentivo e companheirismo.
À minha namorada, Bruna Monteiro, pela confiança, pelo seu carinho, companheirismo, incentivo e, principalmente, pela compreensão.
A todos meus familiares e amigos por estarem sempre ao meu lado em todos os momentos de minha vida.
Aos Prof. Eledir Vitor, Luciene Santos, Joana, Júlio pelo incentivo, pela convivência, pela colaboração e pelo companheirismo.
A todos os professores do Departamento de Química da UFRN, especialmente aos Professores do Grupo de pesquisa do qual faço parte, pelo incentivo e carinho.
Ao Prof. Dr. Bráulio Silva Barros do CE&T da UFRN, pela compreensão, pelo incentivo e dedicação.
Às Professoras. Dra. Sibele Berenice Pergher Castelã e Dra. Joana Maria Farias de Barros, pelo incentivo e por aceitar participar desta banca.
Aos amigos e a todos os técnicos e/ou laboratoristas do NUPPRAR, do LABTAM, do LCR, do LABCIM e do NEPGN pela boa vontade em ajudar, pela amizade e pela colaboração durante este trabalho.
Aos amigos Rodolfo, Rodrigo, Alexandre, Marcus, Glauco, José Antônio, Tiago e às amigas, Renata Braga, Flávia, Asenete, Amanda, Larissa, Gicélia, Auristela, Socorro e Elania pela convivência, pela amizade e pela grande disposição em colaborar.
A todos os amigos e colegas de disciplinas, presentes em todos os momentos do curso. A todos meus amigos de João Pessoa-PB, mesmo que a distância, pela amizade e pelo companheirismo durante toda minha vida.
Ao CNPq pela bolsa de mestrado concedida, à FINEP e Petrobrás pelo financiamento do projeto através da rede de Catálise.
“Comece fazendo o que é necessário, depois o que é possível, e de repente você estará fazendo o impossível.”
São Francisco de Assis
"A mente que se abre a uma nova idéia, jamais voltará ao seu tamanho original."
Albert Einstein
RESUMO
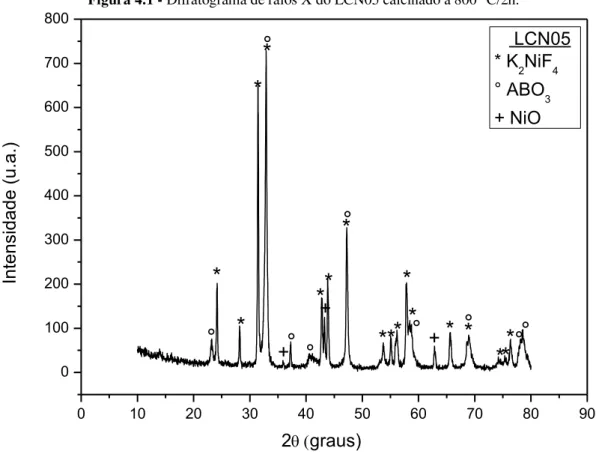
Óxidos com estrutura tipo perovsquita destacam-se por suas diversas propriedades e aplicações comerciais, pois possuem alta estabilidade térmica, apresentam propriedades condutoras, elétricas, catalíticas, eletrocatalíticas, ópticas e magnéticas, além de serem termicamente estáveis. Devido a estas propriedades, estão sendo amplamente estudados como carreadores de oxigênio em processos de geração de energia com captura de CO2. Neste trabalho, carreadores a base do sistema La1-xMexNiO3 ( Me = Ca e Sr) foram sintetizados a partir do método via reação de combustão assistida por microondas. Este método controla as condições de síntese para obtenção de materiais com características específicas. Os carreadores calcinados a 800°C/2h foram analisados através de análise térmica (TG-DTA), para verificação de sua estabilidade térmica; difração de raios-X (DRX), para verificação das fases formadas, com posterior refinamento através do método de Rietveld, para quantificar o percentual das fases formadas; área superficial pelo método BET; microscopia eletrônica de varredura (MEV) e redução à temperatura programada (TPR). Após toda caracterização proposta e análise dos seus resultados pode-se inferir a esses óxidos, características fundamentais para que os mesmos possam ser aplicados como carreadores em reações de combustão por ciclos químicos. Os carreadores de oxigênio obtidos possuem estruturas perovsquitas do tipo K2NiF4 (principal) e ABO3.
ABSTRACT
Perovskites oxides win importance by its properties and commercials applications, they have a high thermal stability, have conductive properties, electrical, catalytic, electro catalytic, optical and magnetic, and are thermally stable. Because of these properties, are being widely studied as carriers of oxygen in the process of power generation with CO2 capture. In this work, the base carrier system La1-xMexNiO3 (Me = Ca and Sr) were synthesized by the method via the combustion reaction assisted by microwave. were synthesized from the combustion reaction method by microwave process. This method control the synthesi`s conditions to obtain materials with specific characteristics.
The carriers calcined at 800 ° C/2h were analyzed by thermal analysis (TG-DTA), to verify its thermal stability, X-ray diffraction (XRD) to verify the phase formation, with subsequent refinement by the Rietveld method, to quantify the percentage of phases formed, the surface area by BET method was determined, scanning electron microscopy (SEM) was obtained to evaluate the material morphology and temperature programmed reduction (TPR) was done to observe the metallic phase of the nickel. After all proposed characterization and analysis of their results can be inferred to these oxides, key features so that they can be applied as carriers for combustion reactions in chemical cycles. The final products showed perovskite-type structures K2NiF4 (main) and ABO3.
LISTA DE FIGURAS
Figura 2.1 - Reservas provadas de gás natural, segundo regiões geográficas, em 31/12/2009 (trilhões m3)... 23 Figura 2.2 - Produção de gás natural, segundo regiões geográficas, em 31/12/2009
(trilhões m3)...
24
Figura 2.3 - Evolução das reservas provadas de gás natural, por localização (terra e mar) – 2000-2009... 26
Figura 2.4 - Distribuição percentual das reservas provadas de gás natural, segundo Unidades da Federação, em 31/12/2009... 27
Figura 2.5 - Evolução da produção de gás natural, por localização (terra e mar) –
2000-2009... 27
Figura 2.6 - Efeito estufa. (Fonte: www.educar.sc.usp.br, 2010)... 30
Figura 2.7 - Combustão com recirculação química (CLC). MyOx and MyO
x-1simboliza oxidado e carreador reduzido, respectivamente... 32 Figura 2.8 - Combustão com recirculação química (CLC) usando dois leitos
fluidizados interconectados... 33
Figura 2.9 - Conversão do CH4 para CO2 em função da temperatura para diferentes carreadores de oxigênio (MATTISSON e LYNGFELT, 2001)... 36
Figura 2.10 - Estrutura ideal de uma perovsquita ABO3: (a) Cátion B e (b) Cátion A no centro da célula unitária... 38
Figura 2.11 - Distorções (a) ortorrômbica e (b) romboédrica da estrutura perovsquita. PROVENDIER (1999)... 40
Figura 2.12 - Série de Ruddlesden-Popper. (a) Para n =1 e (b) Para n =
2... 41
Figura 3.1 - Fluxograma da reação de combustão assistida por microondas para a síntese do LCN e LSN... 49
Figura 4.1 - Difratograma de raios X do LCN5 calcinado a 800 °C/2h... 58
Figura 4.2 - Difratograma de raios X do LCN5 após refinamento pelo método Rietveld... 58
Figura 4.4 - Difratograma de raios X do LCN10 após refinamento pelo método Rietveld... 59
Figura 4.5 - Difratograma de raios X do LCN15 calcinado a 800 °C/2h... 60
Figura 4.6 - Difratograma de raios X do LCN15 após refinamento pelo método Rietveld. ... 60
Figura 4.7 - Difratograma de raios X do LCN20 calcinado a 800 °C/2h... 61
Figura 4.8 - Difratograma de raios X do LCN20 após refinamento pelo método Rietveld. ... 61
Figura 4.9 - Difratograma de raios X do LSN5 calcinado a 800 °C/2h... 63
Figura 4.10 - Difratograma de raios X do LCN5 após refinamento pelo método Rietveld. ... 64
Figura 4.11 - Difratograma de raios X do LSN10 calcinado a 800 °C/2h... 64
Figura 4.12 - Difratograma de raios X do LCN10 após refinamento pelo método Rietveld. ... 65
Figura 4.13 - Difratograma de raios X do LSN15 calcinado a 800 °C/2h... 65
Figura 4.14 - Difratograma de raios X do LCN15 após refinamento pelo método Rietveld. ... 66
Figura 4.15 - Difratograma de raios X do LSN20 calcinado a 800 °C/2h... 66
Figura 4.16 - Difratograma de raios X do LCN20 após refinamento pelo método Rietveld. ... 67
Figura 4.17 - Curvas da TG das amostras LCN5, LCN10, LCN15 e LCN20 após síntese por microondas... 70
Figura 4.18 - Curvas da TG das amostras LSN5, LSN10, LSN15 e LSN20 após síntese por microondas... 71
Figura 4.19 - Correlação entre cristalinidade e perda de massa para as amostras LCN5, LCN10, LCN15 E LCN20... 72
Figura 4.20 - Correlação cristalinidade e perda de massa para as amostras LSN5, LSN10, LSN15 e LSN20... 72
Figura 4.21 - Perfil de redução à temperatura programada do óxido do tipo perovsquita LaNiO3 calcinado a 800°C/2h... 75 Figura 4.22 - Perfil de redução à temperatura programada do carreador LCN20... 75
Figura 4.24 - Micrografia obtida por MEV do carreador LCN5 calcinado a 800°C/2h. ... 77
Figura 4.25 - Micrografia obtida por MEV do carreador LCN10 calcinado a 800°C/2h. ... 78
Figura 4.26 - Micrografia obtida por MEV do carreador LCN15 calcinado a 800°C/2h. ... 78
Figura 4.27 - Micrografia obtida por MEV do carreador LCN20 calcinado a 800°C/2h. ... 79
Figura 4.28 - Micrografia obtida por MEV do carreador LSN05 calcinado a 800°C/2h. ... 79
Figura 4.29 - Micrografia obtida por MEV do carreador LSN10 calcinado a 800°C/2h. ... 80
Figura 4.30 - Micrografia obtida por MEV do carreador LSN15 calcinado a 800°C/2h. ... 80
LISTA DE TABELAS
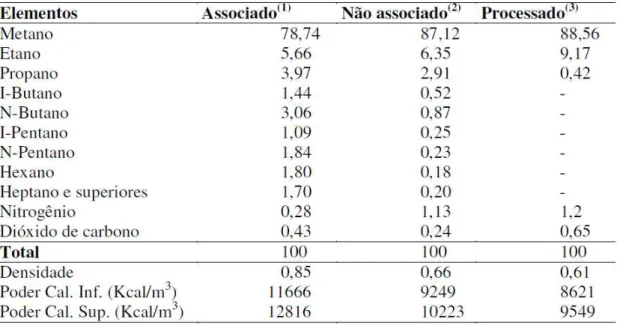
Tabela 2.1 - Composições típicas para o gás natural proveniente do campo de Marlin na Bacia de Campos – RJ (1) , campo de Merluza na Bacia de
Santos – SP (2) e na saída de UPGN em Candeias (3) – BA... 21
Tabela 3.1 - Reagentes utilizados na preparação dos catalisadores... 48
Tabela 3.2 - Codificação dos carreadores de oxigênio utilizados... 50
Tabela 4.1 - Fórmula dos carreadores de oxigênio utilizados... 57
Tabela 4.2 - Proporção de cada estrutura, calculada pelo método de Rietveld, dos carreadores de oxigênio sintetizados... 62
Tabela 4.3 - Proporção de cada estrutura, calculada pelo método de Rietveld, dos carreadores de oxigênio sintetizados com estrôncio... 67
Tabela 4.4 - Tamanho de cristalito e cristalinidade das amostras apresentadas... 69
LISTA DE ABREVIATURAS
ANP Agência Nacional de Petróleo
ANEEL Agência Nacional de Energia Elétrica/Agência Nacional do Petróleo
BET Brunauer-Emmett-Teller
BNDES Banco Nacional do Desenvolvimento Econômico e Social
CLC Chemical-Looping Combustion
COP Conference of the Parties
DRX Difração de raios X
GEE Gases do efeito estufa
IEA Internacional Energy Agency
IPCC Intergovernmental Panel on Climate Change
MEV Microscopia eletrônica de varredura
OPEP Organização dos Países Exportadores de Petróleo
SPE Society of Petrolleum Engineers
TG Termogravimetria
TPR Redução à temperatura programada
UNFCCC United Nations Framework Convention on Climate Change
SUMÁRIO
1 INTRODUÇÃO... 15
2 REVISÃO BIBLIOGRÁFICA... 19
2.1 GÁS NATURAL... 20
2.1.1 Gás Natural no Mundo... 23
2.1.2 Gás Natural no Brasil... 25
2.1.3 Aplicações para o gás natural... 28
2.2 EFEITO ESTUFA... 28
2.3 COMBUSTÃO COM RECIRCULAÇÃO QUÍMICA (CHEMICAL LOOPING COMBUSTION-CLC)... 31
2.4 CARREADORES DE OXIGÊNIO... 34
2.4.1 Perovsquitas... 37
2.4.1.1 Perovsquitas com estrutura tipo ABO3... 38
2.4.1.2 Perovsquitas com estrutura tipo K2NiF4... 40
2.4.2 Aplicações... 42
2.5 SÍNTESE VIA REAÇÃO DE COMBUSTÃO... 43
2.5.1 Reação de combustão por microondas... 45
3 METODOLOGIA EXPERIMENTAL... 47
3.1 REAGENTES UTILIZADOS... 48
3.2 SÍNTESE DOS CARREADORES A PARTIR DA REAÇÃO DE COMBUSTÃO POR MICROONDAS... 48
3.2.1 Síntese do sistema La(1-x) MexNiO3 (x = 0,05; 0,10; 0,15; 0,20) por reação de combustão assistida por microondas (onde Me = Ca e Sr)... 49
3.2.2 Codificação dos carreadores... 50
3.3 CARACTERIZAÇÕES... 50
3.3.1 Análise termogravimétrica (TG)... 50
3.3.2 Difração de raios X (DRX)... 51
3.3.3 Método Rietvel... 52
3.3.4 Área Superficial Específica (BET)... 53
3.3.5 Microscopia Eletrônica de Varredura (MEV)... 54
4 RESULTADOS E DISCUSSÃO... 56
4.1 CARREADORES DE OXIGÊNIO FÓRMULAS... 57
4.1.1 Difração de raios-X dos carreadores de oxigênio de formula LCN5 a LCN20... 57
4.1.2 Difração de raios-X dos carreadores de oxigênio de formula LSN5 a LSN20... 63
4.1.3 Análise Termogravimétrica dos carreadores de oxigênio de formula LCN e LSN... 69
4.1.4 Correlação entre cristalinidade e perda de massa para as amostras de formula LCN e LSN... 70
4.1.5 Área de superficial e diâmetro de poros dos carreadores de oxigênio de formula LCN e LSN... 73
4.1.6 Redução a temperatura programada... 74
4.1.7 MICROGRAFIAS ELETRÔNICAS DE VARREDURA... 77
4.1.7.1 Micrografias eletrônicas de varredura das amostras tipo LCN e LSN... 77
5 CONCLUSÕES... 82
1 INTRODUÇÃO
A intensificação do aquecimento global, suas causas e conseqüências têm ganhado cada vez mais importância nos dias atuais. Um cenário de preocupações e inquietações mundiais formou-se nas últimas décadas em face das possíveis repercussões deste processo em um futuro próximo. O que levou a comunidade científica a realizar progressos significativos para um melhor entendimento do clima mundial e dos impactos em longo prazo das alterações climáticas.
O alto nível de emissão de CO2, proveniente da combustão de combustíveis fósseis, é um dos principais responsáveis pelo aumento da temperatura na terra, promovendo a intensificação do fenômeno natural, denominado de efeito estufa, responsável pelas diversas mudanças climáticas que vem ocorrendo atualmente. Todas essas mudanças surgem como um grande desafio para pesquisadores e engenheiros quanto ao controle e a redução da emissão do dióxido de carbono, forçando-os a realizar estudos para o desenvolvimento de tecnologias para captura desse gás.
Dentre as tecnologias existentes, a combustão com recirculação química (Chemical-Looping Combustion- CLC), surge como uma alternativa para redução das emissões de gases na atmosfera, capturando o CO2 a partir de processos de geração de energia. Em resumo, esse sistema consiste numa junção de dois reatores, um de ar e outro de combustível, interligados, onde um catalisador tem a função de transportar oxigênio ao circular de um reator ao outro. Ou seja, isso ocorre quando o catalisador, ao circular pelos reatores, se reduz em contato com o reator que contém o combustível, produzindo CO2 e H2O como produtos da combustão, e se oxida em contato com o reator que contém O2 e N2, voltando ao seu estado inicial após reagir com o oxigênio gasoso presente. Dentre as características essenciais para que um sistema de CLC seja eficiente, podemos destacar:
A utilização de um carreador de oxigênio com propriedades específicas;
A circulação do carreador entre o reator de combustível e o reator de ar tem que ser suficiente para que se consiga uma combustão completa do combustível;
O contato entre o combustível/ar e o transportador de oxigênio tem que ser adequado para que se consiga uma conversão máxima.
Não pode ocorrer o vazamento do CO2 produzido de um reator para o outro.
O crescente interesse no processo de captura de dióxido de carbono fez surgir inúmeras pesquisas relacionadas ao processo de combustão com recirculação química, dentre elas, investigações teóricas e experimentais de possíveis candidatos a carreadores de oxigênio. De acordo com as pesquisas, um transportador de oxigênio ideal tem que atender aos seguintes pré-requisitos:
Ser altamente reativo tanto com o combustível quanto com o oxigênio.
Ser termodinamicamente capaz de converter uma grande parte de combustível em CO2 e H2O.
Ser estável sob repetitivos ciclos de oxidação/redução em temperaturas elevadas.
Ter baixa tendência para a fragmentação, ser resistente ao atrito, a aglomeração e a outros tipos de dispositivos mecânicos ou de degeneração térmica.
Não promover grande formação de coque no reator de combustível.
Ser economicamente viável e benigno ao meio ambiente.
De acordo com Lyngfelt e col. (2001), o CO2 produzido durante o processo de CLC, depois de capturado, pode ser armazenado em formações geológicas, tais como campos esgotados de petróleo e gás, ou em áreas aqüíferas salinas em grandes profundidades, sendo estes, locais de grande potencial para o armazenamento de grandes quantidades de dióxido de carbono. De acordo com os estudos de De Lasa e col. (2008), a captura de CO2 mediante o processo de combustão com recirculação química tem potencial para reduzir consideravelmente as emissões desse gás na atmosfera a partir de fontes pontuais de grandes dimensões, tais como usinas e indústrias, o que não se aplica, segundo Lyngfelt e col. (2001), a pequenas fontes móveis, tais como automóveis, caminhões e aviões, onde os custos para realização desse processo seriam economicamente inviáveis.
Recentemente, grande atenção tem sido dada ao estudo de sistemas de óxidos com estruturas perovsquitas do tipo ABO3 e K2NiF4 devido suas propriedades e aplicações se adequarem aos pré-requisitos necessários para obtenção de um bom carreador de oxigênio.
2 REVISÃO BIBLIOGRÁFICA
Neste capítulo será abordada uma breve revisão sobre as reservas, composição e vantagens do gás natural, os problemas ambientais causados por sua combustão e as soluções para esses problemas.
2.1 GÁS NATURAL
Similarmente aos demais combustíveis fósseis, o gás natural consiste de uma mistura de hidrocarbonetos gasosos, decorrentes da decomposição de matéria orgânica fossilizada ao longo de milhões de anos. Em seu estado bruto ou natural, o gás natural é composto principalmente por metano, com proporções variadas de etano, propano, butano e hidrocarbonetos mais pesados. Além disso, é composto por impurezas como CO2, N2, H2S, água, ácido clorídrico, metanol, dentre outras. Os maiores teores de carbono são encontrados no gás natural não-associado (GASNET, 2010). Tais impurezas precisam ser eliminadas ou reduzidas para permitir o uso do gás natural dentro de padrões estabelecidos através da Agência Nacional do Petróleo (ANP).
Tabela 2.1 - Composições típicas para o gás natural proveniente do campo de Marlin na Bacia de Campos – RJ
(1), campo de Merluza na Bacia de Santos – SP (2) e na saída de UPGN em Candeias (3) – BA.
De acordo com informações contidas no código geral para avaliação de reservas publicadas pela “Society of Petrolleum Engineers (SPE)” e no Regulamento Técnico ANP Nº 001/2000 sobre Reservas de Petróleo e Gás Natural, entende-se como Reservas os recursos descobertos de gás natural comercialmente recuperável a partir de uma data de referência. Contudo, a estimativa desses valores incorpora certo grau de incerteza quanto às informações de geociências, engenharia e de natureza econômica e, em função disso, as reservas podem ser classificadas como:
Reservas Provadas - são aquelas que, com base na análise de dados geológicos e de engenharia, se estima recuperar comercialmente com elevado grau de certeza;
Reservas Prováveis - são aquelas cuja análise dos dados geológicos e de engenharia indica uma maior incerteza na sua recuperação quando comparada com a estimativa de reservas provadas;
Reservas Totais - representa o somatório das reservas provadas, prováveis e possíveis;
Dados apresentados pela ANP (2010) mostram que, no Brasil, durante o período de 1964 a 2009 as reservas provadas de gás natural cresceram a uma taxa média de 7,1% a.a.. Este crescimento está relacionado principalmente às descobertas decorrentes do esforço contínuo do país para diminuir o grau de dependência do petróleo.
Quanto às vantagens, o gás natural, se comparado às outras fontes de energia, é encontrado na natureza praticamente pronto para o consumo. Além de ter alto poder calorífico por unidade de massa, quando queimado produz níveis de emissão de dióxido do carbono, óxidos de nitrogênio e de particulados inferiores aos demais combustíveis fósseis. Com relação ao transporte, mesmo com a exigência de grandes investimentos iniciais na construção de redes de dutos, é um dos mais seguros e confiáveis. A redução da freqüência na manutenção dos equipamentos que o consomem, a não necessidade de formações de estoque por parte do consumidor final e sua ampla utilização podendo substituir praticamente qualquer tipo de combustível em qualquer aplicação, com exceção do querosene de aviação, são outros atrativos que faz, sem dúvida alguma, com que este combustível possa ser considerado uma fonte nobre de energia.
De acordo com dados do CONPET (1996) e BNDES (1997a), a sua utilização pode ocorrer de quatro formas:
Como fluído de recuperação secundária, como selante em máquinas rotativas e como força motriz em turbo - compressores na indústria do Petróleo;
Como matéria prima o gás natural pode ser utilizada na indústria de fertilizantes, química, petroquímica e siderúrgica (como redutor do minério de ferro);
Como energia secundária o gás pode ser usado nos setores residencial, comercial, público, agropecuário e industrial, principalmente em aquecimento direto ou calor de processo;
2.1.1 Gás Natural no Mundo
No século XIX, nos Estados Unidos, o gás natural era considerado um empecilho ao ser encontrado junto com o petróleo, pois exigia uma série de procedimentos de segurança que encareciam e complicavam as atividades de prospecção. Já no século XX, a partir dos anos 80, o gás natural transformou-se na fonte de energia de origem fóssil a registrar maior crescimento no mundo (ANEEL, 2008).
O estudo Key World Energy Statistics, publicado pela International Energy Agency (IEA) em 2008, evidencia que, no período entre 1973 e 2007, a produção mundial mais que dobrou, passou de 1,227 bilhões de m3 para 3,031 bilhões de m3. Mesmo com esse aumento significativo, o gás natural manteve a terceira posição na matriz energética mundial, ficando atrás apenas do carvão e de derivados de petróleo.
De acordo com o Anuário Estatístico Brasileiro do Petróleo e do Gás Natural de 2010, as reservas provadas mundiais de gás natural no ano de 2009 somaram 187,5 trilhões m³, registrando um crescimento de 1,2% em comparação com os valores do ano anterior. As reservas mundiais segundo regiões geográficas são apresentadas na Figura 2.1.
Figura 2.1 - Reservas provadas de gás natural, segundo regiões geográficas, em 31/12/2009 (trilhões m3).
provadas de gás natural. No mesmo período, as reservas localizadas nos países da Opep, que concentraram 48,7% do total, apresentaram crescimento de 1,1%, somando 91,2 trilhões m³ nesse ano. Os países que concentraram a maior parte das reservas provadas de gás natural do mundo foram: Rússia, Irã e Catar, que responderam por 23,7%, 15,8% e 13,5% do total de reservas provadas, respectivamente. A Arábia Saudita, maior detentora de reservas de petróleo, ficou apenas em quinto no ranking de reservas provadas de gás natural, com 4,2% do total.
Dando continuidades aos dados apresentados pelo Anuário Estatístico Brasileiro do Petróleo e do Gás Natural de 2010, a produção mundial de gás natural, no ano de 2009, alcançou 3 trilhões m³, apresentando queda de 2,4% em relação a 2008. Na contramão dessa queda de produção estão os países da Opep que apresentaram um crescimento de 1,2% em sua produção, passando de 16,4% para 17% sua participação na produção mundial. A Figura, abaixo, apresenta a produção de gás-natural segundo regiões geográficas.
Figura 2.2 - Produção de gás natural, segundo regiões geográficas, em 31/12/2009 (trilhões m3).
2,3% nas Américas Central e do Sul e 4,9% na África, enquanto que na América do Norte e na região Ásia-Pacífico a produção cresceu 1,4% e 4,9%, respectivamente.
Com uma produção de 21,1 bilhões m³, o Brasil registrou uma queda de 2,1% quando comparado a 2008, subindo para a 29ª posição entre os maiores produtores mundiais de gás natural. Ranking esse liderado pelos Estados Unidos que produziram 19,8% do volume total de gás natural registrado em 2009, seguido da Rússia com 17,6% e do Canadá com 5,4%.
2.1.2 Gás Natural no Brasil
O Gás Natural somente passou a ser produzido no Brasil na década de 60 com as descobertas de Petróleo na Bahia e ficou restrita a área próxima a sua produção. Na década de 80, com o aumento da produção nacional de Petróleo e com a construção da rede de gasodutos que liga a Bacia de Campos ao Rio de Janeiro e São Paulo, o gás natural foi finalmente disponibilizado para consumo residencial e Industrial na região Sudeste. Da mesma forma no Nordeste do país o gasoduto ligando Guamaré a Cabo foi concluído, possibilitando assim a distribuição de gás natural nos estados de Pernambuco, Paraíba e Rio Grande do Norte (NEIVA, 1988).
Em 2009, dados apresentados pelo Anuário Estatístico Brasileiro do Petróleo e do Gás Natural de 2010, demonstram que as reservas nacionais provadas de gás natural cresceram 0,6% atingindo a marca de 366,5 bilhões m³, o que representou 61% dos 600,3 bilhões m³ das reservas nacionais totais, aumentando 1,9% em relação ao ano anterior.
Figura 2.3 - Evolução das reservas provadas de gás natural, por localização (terra e mar) – 2000-2009.
O Rio de Janeiro, estado com maior participação nestas reservas com cerca de 166,2 bilhões m³ em reservatórios offshore, concentrou 45,4% do volume nacional, seguido do Amazonas, cujas jazidas terrestres com 52,4 bilhões m³ corresponderam a 14,3% das reservas provadas nacionais. Estes dados são ilustrados na figura abaixo.
Figura 2.4 - Distribuição percentual das reservas provadas de gás natural, segundo Unidades da Federação, em 31/12/2009.
Assim como nas reservas, o Estado do Rio de Janeiro foi o maior produtor, com 10,5 milhões m³, concentrando 49,7% do total nacional e 69,5% da produção marítima. Também seguido pelo Amazonas, que foi o segundo maior produtor sendo responsável por 3,8 milhões m³ ou 17,9% da produção nacional e 62,5% do total onshore.
2.1.3 Aplicações para o gás natural
A combustão do gás natural provoca uma redução nas emissões de CO2 de 20 a 23% menos que o óleo combustível e 40 a 50% menos que os combustíveis sólidos, como o carvão (BARROS, 2009; SANTOS e col. 2002). A inexistência de emissões de óxido de enxofre, fuligem e materiais particulados pode ser alcançada quando esse combustível é utilizado em equipamentos adaptados e adequados para a queima de gás, bem como as emissões de CO e NOx podem ser relativamente bem controladas.
É um combustível fóssil utilizado no setor de transportes, no setor residencial e principalmente no setor industrial, destacando sua utilização em indústrias químicas, petroquímicas, de alimentos, etc.
Entretanto, é de conhecimento mundial que a queima de combustíveis fósseis tem impactos significativos no meio ambiente e que a intensificação das emissões de gases poluentes, principalmente o CO2, conduz ao efeito estufa provocando o aquecimento excessivo da Terra.
2.2 EFEITO ESTUFA
Watson e col. (2001) citam, em seus trabalhos, dados do relatório do Grupo de Trabalho I do “Intergovernmental Panel on Climate Change (IPCC) que mostram novas e fortes evidências de que a maior parte do aquecimento global observado nos últimos 50 anos é decorrente da atividade humana. O grande aumento dessas atividades se deu principalmente pela expansão do setor industrial, agrícola e de transportes, o que demandou um grande consumo de energia proveniente, principalmente, da queima de combustíveis fósseis. Fato este responsável por 57% do total das emissões de gases poluentes na atmosfera, ocasionando, portanto, o fenômeno chamado de efeito estufa.
O efeito estufa é um fenômeno natural que ocorre na baixa atmosfera, causado pela retenção de radiação de ondas curtas. De acordo com Legget (1992), estima-se que, sem o efeito estufa, a temperatura média da Terra seria 33°C menor que a atual, tornando-o essencial para a vida e as atividades humanas em diversas áreas do planeta. Ele é assim chamado por atuar de forma semelhante ao que acontece em uma estufa de vidro, porém, neste caso, a atmosfera atua como o vidro, freando e espaçando o processo de perda da radiação infravermelha emitida pela superfície terrestre. A Figura 2.6 adiante demonstra o processo do efeito estufa. Essa retenção da radiação infravermelha é ocasionada pelos gases do efeito estufa, dentre os quais estão, pela ordem de importância e volume na atmosfera, o vapor d’água, o dióxido de carbono, o metano, o óxido nitroso e outros com menor participação, tais como hidrocarbonetos e compostos artificiais como os clorofluorcarbonos. De acordo com os dados do IPCC (2004), acredita-se que mesmo zerando totalmente as emissões desses gases, o que é impossível, o resultado prático de tal empreitada poderia levar décadas para manifestar seus efeitos sobre o comportamento da atmosfera e do clima.
Durante a Conferência das Nações Unidas sobre Meio Ambiente e Desenvolvimento (Rio-92), 155 países participantes, baseados no acúmulo de evidências científicas de que as atividades humanas estariam interferindo no clima do planeta, assinaram o primeiro acordo internacional (United Nations Framework Convention on Climate Change – UNFCCC) em busca de um controle da influência antropogênica sobre o clima. Contudo, a UNFCCC estabeleceu as primeiras medidas de controle das emissões de gases causadores de efeito estufa (GEE) e também o fórum de debate, onde tais medidas de controle deveriam ser discutidas, as chamadas Conferências das Partes (Conference of the Parties – COP).
aos níveis de 1990, no período entre 2008-2012. Embora o Protocolo tenha sido assinado por 84 países, ainda não foi ratificado por todos. O maior impedimento encontra-se na recusa dos Estados Unidos (responsável por cerca de um quarto de todas as emissões de combustíveis fósseis no mundo) em ratificar ao texto. O Brasil ratificou o Protocolo em 2002, assim como importantes membros, tais como União Européia e Japão.
Figura 2.6 - Efeito estufa.
(Fonte: www.educar.sc.usp.br, 2010)
2.3 COMBUSTÃO COM RECIRCULAÇÃO QUÍMICA (CHEMICAL LOOPING COMBUSTION - CLC)
De acordo com Ishida (1994), Jin e col. (1998) e Cho e col. (2004) o CO2 pode ser capturado antes ou depois da combustão de combustíveis fósseis e existem várias técnicas conhecidas para esse fim. Porém, uma grande desvantagem para a maioria dessas técnicas é a quantidade de energia necessária para se obter o dióxido de oxigênio puro, o que faz com que o processo seja pouco eficiente. Entretanto, um processo nomeado de combustão com recirculação química tem se apresentado eficaz, tendo, dentre suas vantagens, a capacidade de separar o CO2 dos demais gases da combustão.
Richter e.col. (1983), Ishida e col. (1987) e Wolf e col. (2005) relatam que os princípios de Chemical-Looping Combustion (CLC) foram introduzidos no início de 1980, onde as pesquisas passaram a ser realizadas em processos conjuntos de produção de carreadores de oxigênio e de construção de reatores. Estes estudos mostram que o processo de geração de energia por CLC com captura de CO2 é bem mais eficiente que os processos comerciais atuais de captura desse gás.
Mattisson (2009) mostra em seus estudos que a combustão com recirculação química (CLC) é uma nova tecnologia em combustão onde o carreador de oxigênio é utilizado para transferir oxigênio do ar para o combustível, ou seja, os carreadores são compostos por partículas de óxidos metálicos responsáveis pelo transporte de oxigênio do reator de ar para o reator de combustível, conforme mostra a Figura 2.7.
No reator do combustível, o combustível gasoso reage com o óxido metálico, de acordo com a reação (Equação 1), e no reator de ar o óxido metálico reduzido se oxida novamente, conforme mostra a reação (Equação 2).
CnH2m + (2n + m)MeyOx nCO2 + mH2O + (2n + m)MeyOx-1 (1)
O2 + 2MeyOx-1 2MeyOx (2)
Figura 2.7 - Combustão com recirculação química (CLC). MyOx and MyOx-1simboliza oxidado e carreador
reduzido, respectivamente.
Dentre as vantagens desse sistema podemos destacar que tanto o CO2 quanto o H2O(v) podem ser separados inerentemente dos outros gases provenientes da combustão, além de não se gastar nenhuma energia na separação. Este processo que, de acordo com Lyngfel e col. (1999), se comparado com outras tecnologias de captura de CO2 que utiliza hidrocarbonetos como combustíveis, apresenta uma redução relativa da eficiência da planta de 12-19%.
Lyngfelt e col. (2001) apresentam em seus estudos, um projeto de combustão com recirculação química que utiliza dois leitos fluidizados interconectados. Neste projeto, figura 2.8, o reator de ar (1) possui alta velocidade no leito fluidizado, onde as partículas do carreador de oxigênio são transportadas juntamente com o fluxo de ar para a parte superior do reator, onde, posteriormente, são transferidas para o reator de combustível (3) usando um ciclone (2).
Figura 2.8 - Combustão com recirculação química (CLC) usando dois leitos fluidizados interconectados.
A aplicação do CLC em larga escala ainda é muito dependente da disponibilidade de carreadores de oxigênio adequados. Sendo assim, o sucesso dessa metodologia de CLC está diretamente relacionado às propriedades dos carreadores utilizados. Portanto, eles devem possuir termodinâmica favorável em ciclos de oxidação e redução, ou seja, devem possuir alta reatividade, estabilidade sob ciclos de oxidação/redução, resistência mecânica em leitos fluidizados e resistência à aglomeração, além de baixo impacto ambiental e baixos custos de produção (ADANEZ e col., 2004; CHO e col., 2004; LYNGFELT e col., 2001; MATTISSON e col., 2004; DE LASA e col., 2008.)
armazenado no fundo do oceano, uma vez que os poços perfurados na região do pré-sal têm produzido grandes quantidades desse gás.
De Lasa e. col. (2008), faz uma observação no que diz respeito ao tipo de combustível utilizado, se for um hidrocarboneto, como por exemplo, o gás natural, quando exposto a uma temperatura elevada, pode ocorrer deposição de carbono no reator operacional; fato como esse deve ser evitado, pois a formação de coque desativa os carreadores de oxigênio, no caso os catalisadores. Ações como a escolha dos carreadores é de vital importância, pois a inibição da formação de coque passa primeiramente pela composição do catalisador, como também da sua microestrutura e condições térmicas e termodinâmicas do mesmo.
2.4 CARREADORES DE OXIGÊNIO
De acordo com De Lasa (2008) a seleção de carreadores de oxigênio é considerada um dos fatores essenciais para o bom desenvolvimento do processo de combustão com recirculação química. Desde a primeira proposta por Richter e Knoche (1983) até os dias atuais, a aplicação em larga escala do CLC está diretamente ligada ao desenvolvimento de carreadores de oxigênio adequados. Portanto, dentre as características mais importantes para a eficiência dos carreadores de oxigênio podemos destacar tanto a sua reatividade em ciclos de redução e oxidação como a capacidade de realizar a combustão completa do combustível, obtendo assim uma maior eficiência do processo. Baseando-se nos critérios apresentados acima, os carreadores de oxigênio deverão apresentar as seguintes características:
Ser estável sob repetidos ciclos de oxidação / redução em altas temperaturas;
Possuir boa fluidização;
Ser resistente à aglomeração e fragmentação;
Ser resistente ao atrito associado à grande circulação de partículas;
Ser ambientalmente benigno e ser economicamente viável;
Grande parte da literatura técnica sobre CLC está focada no desenvolvimento de carreadores de oxigênio adequados. Óxidos metálicos de transição, tais como níquel, cobre, ferro, cobalto e manganês são bons candidatos devido as suas propriedades termodinâmicas favoráveis.
essas características, o grau de conversão de metano para dióxido de carbono foi calculado usando o método de minimização de energia livre de Gibbs (MATTISSON e LYNGFELT, 2001; JERNDAL e col., 2006.). Neste cálculo CH4, CO2, CO, H2O, H2 e O2 são considerados possíveis produtos gasosos (entre 600 e 1200 °C). A conversão de metano para de CO2 é mostrado na Figura 2.9. Esta análise mostra alguns prováveis carreadores, dentre eles Mn2O3/Mn3O4, CuO/Cu2O, Fe2O3/Fe3O4 e NiO/Ni que são capazes de converter o metano em CO2 quase completamente.
Outra consideração importante no processo de CLC é o ponto de fusão do carreador de oxigênio. Ponto este, que deve ser alto o suficiente tanto para suportar a temperatura de reação no CLC quanto para evitar a aglomeração de partículas em circulação. De acordo com as temperaturas de operação do CLC, 600 e 1200 °C, alguns metais podem fundir, se a temperatura de operação estiver perto do seu ponto de fusão. Por exemplo, Cd, Zn e Ce, com pontos de fusão abaixo ou próximos de 600 °C, são inadequados como carreadores para CLC. Cu, também possui um ponto de fusão relativamente baixo (1085 °C) e, como conseqüência, não pode ser usado acima 900 °C.
Além da termodinâmica, algumas propriedades físicas, tais como densidade, área de superficial, volume de poros e tamanho das partículas também são parâmetros importantes para um carreador de oxigênio eficiente (ADÁNEZ e col., 2004;.. CHO e col., 2004). A densidade e o tamanho das partículas não só determinam a fluidização do carreador de oxigênio, mas também podem afetar a reação global, dada a sua influência sobre a massa e transferência de calor no interior das partículas. Conforme literatura, transportadores de oxigênio com partículas que variam de 0,08 a 2 mm são adequados para CLC.
Figura 2.9 - Conversão do CH4 para CO2 em função da temperatura para diferentes carreadores de oxigênio
(MATTISSON e LYNGFELT, 2001).
Para aumentar a reatividade, a durabilidade e a fluidização dos carreadores de oxigênio, estes podem ser suportados em materiais inertes, como SiO2, TiO2, ZrO2, Al2O3, YSZ e bentonita.
2.4.1 Perovsquitas
De acordo com West (1971), o mineral que deu origem à família das perovsquitas, foi o Titanato de cálcio (CaTiO3), descrito, primeiramente, em 1830, pelo geólogo Gustav Rosa, que o nomeou depois que adotou a famosa contagem russa do mineralogista Lev Aleksevich von Perovski. Entretanto, apenas em 1970, o uso de óxidos do tipo perovsquitas como catalisadores foi reportado pela primeira vez por Meadowcroft quando estudava a reação de redução eletroquímica do oxigênio. Devido ao vasto campo de propriedades e aplicações comerciais que estes materiais oferecem, principalmente como catalisadores, a pesquisa de novos óxidos com essa estrutura tem se intensificado cada vez mais, nos últimos 10 anos.
Segundo Liu e col. (2002), estes óxidos, quando utilizados como catalisadores em aplicações comerciais, podem ser aproveitados em uma grande quantidade de reações, tais como oxidação do CO e hidrocarbonetos leves, combustão do gás natural, redução de NO e SO2, hidrogenação de hidrocarbonetos, dentre outras. No âmbito da tecnologia dos processos de despoluição de gases de exaustão, as perovsquitas podem ser consideradas uma alternativa promissora para substituição dos catalisadores à base de metais nobres suportados, cujo uso é predominante atualmente. Ao contrário destes últimos, que apresentam alto custo e baixa seletividade a nitrogênio, as perovsquitas podem ser facilmente sintetizadas, com grande flexibilidade de composição, baixo custo e alta estabilidade térmica, assim como é mostrado nos estudos de Pena e Fierro (2001). Além disso, estes materiais cerâmicos possuem uma grande diversidade de propriedades físico-químicas, o que deriva do fato de que 90% dos elementos metálicos naturais da tabela periódica são considerados estáveis na estrutura perovsquita (GIANNAKAS e col., 2006).
2.4.1.1 Perovsquitas com estrutura tipo ABO3
Os estudos de Tanaka e Misono (2001), mostram que as perovsquitas são óxidos mistos que, em geral, apresentam uma estrutura cristalina representada pela fórmula geral ABO3, em que A pode ser composto por íons de terras raras, alcalinos, alcalinos terrosos ou outros íons grandes como Pb+2 e Bi+3, que se encaixam no sítio dodecaédrico da estrutura, e B pode ser composto de íons de metais de transição dos grupos 3d, 4d ou 5d situados no centro de um octaedro, onde os vértices são ocupados por íons O2-.
Esses óxidos possuem uma estrutura bem definida, sendo a estrutura cristalina cúbica ideal para uma perovsquita. Nessa estrutura ideal, representada na figura 2.10b, a origem centra-se nos íons B que ocupam os vértices do cubo, estando o íon A no centro e os íons de oxigênio nos pontos médios das arestas. Logo, os íons B adaptam-se exatamente dentro do sítio octaédrico, ou seja, estão coordenados a seis átomos de oxigênio, enquanto que o íon A está coordenado a doze átomos de oxigênio, chegando os ânions e os cátions a entrarem em contato devido a sua proximidade. Os octaedros têm seus eixos orientados ao longo das arestas da célula unitária e estão unidos pelos vértices formando um arranjo tridimensional. Contudo, quando a unidade de cela é centrada nos íons A o empacotamento cúbico é centrado nas faces, como é mostrado na figura 2.10a.
Figura 2.10 - Estrutura ideal de uma perovsquita ABO3: (a) Cátion B e (b) Cátion A no centro da célula unitária.
estado de oxidação. Então, para que a estrutura perovsquita permaneça estável, é necessário que o cátion do sítio B tenha preferência pela coordenação octaédrica e possua uma elevada carga iônica, bem como o cátion do sítio A seja maior e ocupe as vacâncias dodecaédricas. Ou seja, para satisfazer essas condições, o cátion A deve possuir raio iônico maior que 0,9 Å e o cátion B, maior que 0,51 Å como mostram Spinicci e col. (2001) e Melo (2007). Com base em considerações geométricas, foram definidos os limites toleráveis do tamanho dos íons mediante um fator de tolerância t, mostrado na equação abaixo.
(3)
Onde: R é o raio iônico dos íons A, B ou do átomo de oxigênio. Quando o valor de t é aproximadamente igual a um, a estrutura obtida é a cúbica ideal, como mostrada na Figura 2.3. A estrutura perovsquita se forma dentro do intervalo de tolerância: 0,75 < t < 1,0.
Assim como a relação entre os raios iônicos, a eletroneutralidade é outra condição fundamental para a estabilidade das perovsquitas, ou seja, para se manter a estabilidade da estrutura, a soma das cargas, dos íons A e B, deve ser igual ao total de cargas dos ânions oxigênio. Deste modo, as cargas nos óxidos podem ser distribuídas da seguinte forma: A+1B+5O3, A+2B+4O3 ou A+3B+3O3. De acordo com Tejuca e Fierro (1992) e Soares (2005) as estruturas mais comuns são aquelas em que o cátion A é um elemento terra rara e o cátion B é um metal de transição, ambos no estado de oxidação +3.
De acordo com Barros (2009), qualquer condição que não satisfaça a estabilidade de uma estrutura ideal resultará em estruturas distorcidas, sendo as mais conhecidas e estudadas a ortorrômbica e a romboédrica. Ou seja, se o fator de tolerância está compreendido entre 0,75 a 0,9 Å geralmente ocorre uma distorção ortorrômbica apresentada na figura 2.11a, onde a coordenação do cátion A é 8 ao contrário de 12 como ocorre no sistema cúbico ideal. Já para valores de tolerância que correspondem entre 0,9 e 1,0 Å a distorção da estrutura observada é a romboédrica, figura 2.11b, passando a variar o fator de coordenação do cátion A de 12 para 6.
Figura 2.11 - Distorções (a) ortorrômbica e (b) romboédrica da estrutura perovsquita. PROVENDIER (1999).
Alvarez (1999) e Fierro (1993) mostram que, em muitos casos, ocorre o desvio da estequiometria das perovsquitas e que tais eventos permitem, com freqüência, a estabilização de íons em estados de valência incomuns e a coexistência de diferentes coordenações. Isso acontece principalmente quando os íons tipo B podem estar em diferentes estados de oxidação e o oxigênio atua como um agente que compensa a carga dos cátions.
2.4.1.2 Perovsquitas com estrutura tipo K2NiF4
A falta de estequiometria nas perovsquitas ABO3 pode muitas vezes levar a mudanças estruturais sutis, podendo produzir outras simetrias cristalinas e diferentes comportamentos do reticulado cristalino. Um exemplo deste tipo de fenômeno são as perovsquitas com estrutura tetragonal tipo K2NiF4 (DARAUKH e col., 2003). Apesar de apresentarem um formula estrutural “A2BO4” similar a formula química dos espinélios, estes óxidos são considerados por vários autores como membros da família das perovsquitas.
com uma camada de “sal de rocha” (“rock-salt”) (AO), ao longo da direção cristalográfica c. As fases RP são formadas por blocos de octaedros BO6 com vértices compartilhados que extendem-se ao infinito no plano xy e tem uma espessura de n octaedros paralelos ao eixo z. Os exemplos mais claros disto são n = 1 e n = 2, conhecidas como fases de Ruddleson-Popper (La2NiO4 e La3Ni2O7), Figura 2.12. Para estas fases, o La é o cátion A e Ni é o cátion B.
Figura 2.12 - Série de Ruddlesden-Popper. (a) Para n =1 e (b) Para n = 2.
Para a estrutura La2NiO4, por exemplo, observa-se uma alternância de camadas de óxidos LaO e de camadas de perovsquitas LaNiO3. De certa forma a estrutura formada confere ao oxido boas condução iônica e eletrônica (BARROS, 2009; STEELE, 2000). Outra característica importante deste óxido em especifico é a quantidade de níquel (15 wt.%) com relação à perovsquita LaNiO3 (24 wt.%). A menor quantidade de níquel pode permitir uma melhor dispersão deste metal após a redução e por conseqüência promover uma melhor atividade catalítica. Gallego e col. (2006) observaram em seus trabalhos que após tratamento de redução em atmosfera de hidrogênio, a fase La2NiO4 conduzia a formação de partículas de níquel da ordem de 7 nm, menores que as partículas obtidas após a redução da perovsquita LaNiO3, aproximadamente 15 nm. Estes autores atribuíram a maior atividade e estabilidade da fase La2NiO4 durante a reforma do metano com CO2, ao menor tamanho das partículas de níquel obtidas após a redução.
variável K2NiF4±. Os sólidos com estrutura K2NiF4 são protótipos para investigar a reatividade do oxigênio superficial com a atividade catalítica. Os sistemas dopados com Sr, como por exemplo, La2-xSrxNiO4-, apresentam a propriedade de aceitar elétrons em uma ampla faixa de composição (FIERRO, 1993). Em particular, as vacâncias de oxigênio podem introduzir até um elétron por unidade de formula para obter um material altamente dopado de elétrons, o que o torna bastante atrativo para a combustão do metano.
2.4.2 Aplicações
Comercialmente, as perovsquitas de elementos terras raras têm sido muito aplicadas na fabricação de eletrodos. Na catálise, vários trabalhos na área ambiental têm demonstrado a versatilidade das perovsquitas contendo Co e Mn como metais de transição. Assim, as perovsquitas têm sido aplicadas na redução seletiva de óxido nítrico com propeno, na oxidação de CO e hidrocarbonetos, na redução de NO com CO ou hidrogênio para produzir CO2 e N2. Outras aplicações, mostradas por Silva (2004), tais como combustão do metano, acoplamento oxidativo de alcanos, hidrogenação e hidrogenólise de hidrocarbonetos, e oxidação da amônia, evidenciam a importância dos óxidos do tipo perovsquita.
Ultimamente, as perovsquitas têm sido extensivamente estudadas como catalisadores de oxidação devido a suas propriedades favoráveis, fazendo delas alternativas potenciais para substituir metais nobres em aplicações ambientais de combustão catalítica para geração de energia. Nesse contexto, muita atenção tem sido dada as perovsquitas à base de lantânio (LaBO3), B = Ni, Co ou Mn, devido à sua alta atividade catalítica e estabilidade térmica em reações de oxidação de hidrocarbonetos. De acordo com Norman e Morris (1999), um dos sistemas mais conhecidos é o LaNiO3, onde o níquel tem carga +2, porém assume a carga +3 em óxidos de terras raras. Tejuca, Fierro e Tascon (1989), afirmam em seus estudos que essas perovsquitas à base de lantânio e níquel chegam a ter atividades comparáveis àquelas observadas nos metais nobres. Portanto, Gomes (2005) mostra que esses niquelatos de terras raras, puros ou suportados, têm sido testados como catalisadores industriais potencialmente importantes e suas aplicações estão relacionados com a existência de mais de um estado de oxidação dos metais de transição d, com a presença de defeitos e com a alta mobilidade de oxigênio existente nestas estruturas.
estrutura. As perovsquitas do tipo ABO3 dispõem de dois tipos de oxigênio móveis, o adsorvido na superfície e o oxigênio de rede. Tanto a temperatura de calcinação quanto o elemento substituinte na perovsquita podem levar a modificações na proporção desses oxigênios superficiais, chamados α, em relação aos oxigênios da rede cristalina das perovsquitas, chamados β. Estas trocas modificam fortemente a redutibilidade do cátion B e também a mobilidade do oxigênio na perovsquita. Estes fatos foram observados nos estudos de Royer e col. (2005), tanto por redução à temperatura programada quanto por desorção de oxigênio a temperatura programada.
Atualmente, pode-se encontrar uma grande variedade de técnicas de preparação para a síntese de óxidos do tipo perovsquita, porém, a escolha do método de síntese é de fundamental importância para se obter óxidos com um melhor controle estequiométrico, com um menor tamanho de partículas e com um baixo grau de aglomerações. Então, faz-se necessário a utilização de uma síntese controlada de alta pureza, permitindo assim, uma melhor reprodutividade de suas propriedades. Em virtude disso, a utilização de métodos químicos, como uma alternativa promissora para a obtenção desses materiais, vem crescendo consideravelmente.
2.5 SÍNTESE VIA REAÇÃO DE COMBUSTÃO
Dentre os diversos métodos de sínteses, o presente trabalho baseia-se na síntese via reação por combustão, também conhecida por síntese auto-propagante, que faz uso de reações exotérmicas para a produção de pós cerâmicos. De acordo com Jain e col. (1981), este método resulta na obtenção de um material cerâmico em um curto intervalo de tempo, visto que, uma vez iniciada a reação por uma fonte externa, esta ocorre de forma rápida e auto-sustentável. Além de ser uma técnica fácil, rápida e segura, outras vantagens podem ser destacadas, tais como a obtenção de produtos com estrutura e composição desejadas (KIMINAMI e col., 2000), devido à elevada homogeneização favorecida pela solubilidade dos sais em água e o baixo custo de processamento, pois não necessita de múltiplas etapas e utiliza menos energia que os processos convencionais.
alta solubilidade em água e por fundirem em baixas temperaturas, os nitratos metálicos são as fontes de íons mais usadas. Ainda nesse contexto, o produto dessa reação é um pó óxido fino, seco e geralmente cristalino, podendo ser composto por uma única fase ou pela combinação de óxidos metálicos, sendo, neste caso, necessário passar por etapas secundárias de calcinação para obtenção da fase desejada. De acordo com Sousa e col. (1999), outro fator importante a observar nessa reação é que, devido a grande quantidade de gases liberados durante a síntese, ocorre o aparecimento de uma chama que pode alcançar temperaturas superiores a 1000 °C.
A glicina (C2H5NO2), a triazina tetraformol (TFTA, C4H16N6O2), a hidrazina maléica (C4H4N2O2) e a carbohidrazida (CO(N2H3)2, dentre outros, são outros combustíveis, além da uréia, usados na síntese via reação de combustão de óxidos cerâmicos mistos e puros. Apesar de todos estes combustíveis conterem nitrogênio, eles diferem na capacidade de “redução do óxido metálico” e na quantidade de gases por eles gerados, afetando assim, as características do produto final da reação. De acordo com SEGADÃES e col. (1998), a uréia é o combustível que possue a mais baixa capacidade redutora (valência total +6), produz um pequeno volume de gases e possui várias vantagens em seu uso, tais como baixo custo, disponibilidade comercial e a capacidade de gerar altas temperaturas na combustão. Outra vantagem, apontada por Kiminami e col. (2000), é a de se utilizar teor de uréia em excesso, visto que os gases gerados são liberados mais rapidamente e com maior dissipação de energia, evitando assim, a formação de aglomerados duros e/ou crescimento de partículas, devido a utilização de uma menor quantidade de energia para a sinterização e cristalização do material.
De acordo com os conceitos termodinâmicos utilizados na química dos propelentes e explosivos, a mistura composta pelo combustível e o oxidante é caracterizado pelos parâmetros razão de mistura Øm (relação combustível/oxidante na mistura), razão equivalente Ø e coeficiente estequiométrico dos elementos Øe. A deficiência ou excesso de combustível na mistura é determinado pela razão equivalente, que é definida pela relação:
(4)
combustível, enquanto que para Ø=1, os sistemas estão misturados estequiometricamente.
Com base nos métodos propostos anteriormente, Jain e col. (1981) propôs um método simples, aplicável em sistemas com mais de dois componentes, baseado no cálculo da valência total do combustível e do oxidante para determinar as quantidades de reagentes necessários à reação de combustão. Sendo assim, se a mistura é estequiométrica quando o valor das respectivas valências é igual, podemos concluir que a mistura será estequiométrica quando o valor total das valências positivas for igual ao valor total das valências negativas, como observado na equação:
(5)
Os cálculos são feitos considerando as valências que os elementos apresentam nos produtos gasosos, CO2, H2O e N2. O carbono e o hidrogênio são elementos redutores com valências correspondentes a +4 e +1, respectivamente; o oxigênio é um elemento oxidante com valência -2, o nitrogênio tem valência zero (para efeito de cálculo) e os cátions metálicos terão as valências que apresentam nos óxidos finais.
2.5.1 Reação de combustão por microondas
3 METODOLOGIA EXPERIMENTAL
Neste capítulo são descritos o método de síntese adotado para a preparação dos carreadores a base de lantânio dopado com cálcio e estrôncio, bem como as técnicas utilizadas para a caracterização desses carreadores.
3.1 REAGENTES UTILIZADOS
Os reagentes utilizados na preparação dos catalisadores do tipo perovsquita via reação de combustão assistida por microondas são apresentados na tabela 3.1.
Tabela 3.1 - Reagentes utilizados na preparação dos catalisadores.
Reagentes Marca Teor (%)
Nitrato de Lantânio
Hexahidratado Sigma Aldrich 99,50
Nitrato de Cálcio CRQ 98,00
Nitrato de Estrôncio Sigma Aldrich 99,50
Nitrato de Amônio CRQ 98,00
Uréia Sigma Aldrich 99,50
3.2 SÍNTESE DOS CARREADORES A PARTIR DA REAÇÃO DE COMBUSTÃO POR MICROONDAS
A síntese dos carreadores por reação de combustão assistida por microondas teve como precedente uma mistura redox contendo nitratos metálicos, como agentes oxidantes, e a uréia como um combustível redutor.
3.2.1 Síntese do sistema La(1-x) MexNiO3 (x = 0,05; 0,10; 0,15; 0,20) por reação de combustão assistida por microondas (onde Me = Ca e Sr)
Para a preparação dos carreadores dopados com cálcio e estrôncio no sítio A foram realizados cálculos estequiométricos, onde se considera o produto a se obter em relação ao combustível utilizado. Neste caso, usou-se uma mistura estequiométrica de combustíveis, baseado na valência dos precursores envolvidos. O fluxograma da Figura 3.1 mostra a seqüência da preparação dos óxidos com estrutura perovsquita.
3.2.2 Codificação dos carreadores
A codificação dos carreadores de oxigênio obtidos via reação de combustão assistida por microondas são apresentados na tabela 3.2.
Tabela 3.2 - Codificação dos carreadores de oxigênio utilizados.
Carreadores Codificação
LCN5 Niquelato de Lantânio com 5% de cálcio
LCN10 Niquelato de Lantânio com 10% de cálcio
LCN15 Niquelato de Lantânio com 15% de cálcio
LCN20 Niquelato de Lantânio com 20% de cálcio
LSN5 Niquelato de Lantânio com 5% de estrôncio
LSN10 Niquelato de Lantânio com 10% de estrôncio
LSN15 Niquelato de Lantânio com 15% de estrôncio
LSN20 Niquelato de Lantânio com 20% de estrôncio
3.3 CARACTERIZAÇÕES
Os carreadores obtidos foram caracterizados por análise térmica (TG-DTA), difração de raios-X (DRX) e um posterior refinamento Rietveld, área superficial pelo método BET, microscopia eletrônica de varredura (MEV) e redução à temperatura programada (TPR).
3.3.1 Análise termogravimétrica
O conjunto de técnicas que envolvem a medição de propriedades físicas de substâncias ou materiais capazes de sofrer variações em função da temperatura denomina-se Análise Térmica. Dentre estas propriedades físicas pode-se incluir massa, temperatura, entalpia, dimensão, características dinâmicas e etc (CIENFUEGOS e VAISTMAN, 2000).
substâncias orgânicas e inorgânicas, reações em estado sólido, determinação de umidade dos mais diversos materiais, etc (HAINES, (2005).
Análise termogravimétrica foi realizada em uma balança da Shimadzu TG-60H sob atmosfera de N2, na faixa de temperatura entre 30 e 900 °C a uma razão de aquecimento de 10 °C min-1, massa de 6,0 mg.
3.3.2 Difração de Raios X
A difração de raios X é uma técnica baseada no fenômeno de interferência de ondas espalhadas por um cristal. As radiações magnéticas características de raios X possuem comprimento de onda entre 0,05 e 0,25 nm ocupando uma posição intermediária entre o ultravioleta e a radiação gama no espectro eletromagnético. Esses raios são gerados a partir de elementos que emitem determinada quantidade de fótons que são colimados e direcionados sobre o material a ser analisado, e, simultaneamente, difratados em um determinado ângulo. Estes raios difratados são detectados e transformados em sinais, cujo seus registros são representados em um gráfico que expressa sua intensidade em função do ângulo de varredura de 2θ.
A partir da equação a seguir, conhecida como Equação de Scherrer (KLUNG e ALEXANDER, 1962), que utiliza a largura e a meia altura dos picos de difração das amostras analisadas (FWHM), foi possível calcular o tamanho dos cristalitos.
(6)
Nessa equação, D é o tamanho do cristalito, k é uma constante cujo valor depende da forma da partícula, sendo igual a 0,9 para partículas esféricas de tamanho uniforme e igual a 1,0 para as demais formas, é o comprimento de radiação eletromagnética utilizada ( Cu = 1,542 Ǻ, valor referente a radiação emitida pelo cobre), q é o ângulo de difração de Bragg e b é a largura a meia altura, que é corrigida pela Equação:
Onde B é a largura a meia altura do pico difratado de maior intensidade da amostra e b é a largura a meia altura de um pico difratado do padrão a uma região próxima e colhido nas mesmas condições da amostra a ser analisada. Um padrão interno de silício (Si) policristalino foi utilizado para essa medida, em seguida, usou-se uma função matemática denominada de Pseudo-Voight para ajustar o perfil dos picos de difração.
As amostras dos catalisadores preparados foram analisados através da técnica de difração de raios-X usando radiação CuK, em um equipamento da Shimadzu, modelo XRD-7000. Os dados foram coletados em um intervalo de variação angular entre 10 e 80º.
3.3.3 Método Rietveld
O método de Rietveld consiste na construção de um padrão de difração calculado, de acordo com o modelo estrutural. O padrão calculado é obtido pela introdução direta dos dados cristalográficos, como: Simetria do grupo espacial, posições atômicas, posições de ocupação e parâmetros de rede (FRANCIO, 1999).
O método tem como principio realizar um ajuste do padrão de difração, refinando os fatores instrumentais e os parâmetros estruturais característicos da amostra a ser analisada (parâmetro de rede, posições atômicas, anisotropia, parâmetros de alargamento relacionados com tensões da rede e tamanho de cristalitos) (RODRIGUES, 2007).
É fundamental ter o cuidado de verificar se o padrão de difração calculado está suficientemente próximo do observado. A aproximação entre os padrões calculados e observados é feita pelo método dos mínimos quadrados. Este método apresenta algumas vantagens como rapidez de resolução e determinação dos erros estatísticos em cada ciclo do refinamento. A quantidade minimizada utilizada no refinamento é o resíduo (R). A diferença entre o difratograma experimental e um difratograma baseado num modelo estrutural de partida resulta em uma função que expressa o resíduo (R), de acordo com a equação 6 (RODRIGUES, 2007; FRANCIO, 1999):
R = Σ wi ( yio - yic )2 (8)
wi = 1/yi
yio = intensidade observada no i-ésimo passo do difratograma. yic = intensidade calculada no i-ésimo passo do difratograma.
O método de Rietveld pode ser aplicado na análise quantitativa de fases, ajuste de parâmetros de célula e estudos estruturais como: determinação de tamanho de cristalitos, distribuição de cátions, incorporação de átomos e formação de vacâncias, posições atômicas e posições de ocupação.
3.3.4 Área Superficial Específica
O “método BET” proposto por Brunauer, Emmett e Teller (1λ38) descreve a medida da área superficial específica de um sólido, pelo acompanhamento da adsorção de nitrogênio, na temperatura do nitrogênio líquido sob condições controladas (LIMA, 2006; RODRIGUES, 2007). Um volume ocupado por uma monocamada de um gás adsorvido na superfície da amostra na forma de pó, de massa conhecida, pode ser medido em temperaturas próximas às de condensação do gás e com o aumento da pressão. Inicialmente, a amostra sofre antes um aquecimento para eliminação da umidade e, posteriormente, é resfriada. Então o gás, que em geral é o N2, é colocado em contato com a amostra a uma temperatura fixa e pressão parcial variável. As curvas de adsorção são tratadas e analisadas de forma a obter informação que determinam a área de superfície específica.
Com os resultados de área superficial específica (ASS) é possível o cálculo de tamanho médio de partícula (DBET) do material através da equação de Johnson (Equação 7).
DBET = 6/ Dt SBET (9)
Onde:
DBET: Diâmetro médio (nm); Dt: Densidade teórica (g/cm3);
SBET: Área superficial especifica (m2/g);