Gustavo Thalmer de Medeiros Silva
Caracterização físico-química de sistemas micelares
____________________________________
Dissertação de Mestrado
Natal/RN, julho de 2014
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE CIÊNCIAS EXATAS E DA TERRA - CCET PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA - PPGQ
DISSERTAÇÃO DE MESTRADO
CARACTERIZAÇÃO FÍSICO-QUÍMICA DE SISTEMAS MICELARES
Gustavo Thalmer de Medeiros Silva
Orientador: Prof. Dr. Alcides de Oliveira Wanderley Neto
Gustavo Thalmer de Medeiros Silva
CARACTERIZAÇÃO FÍSICO-QUÍMICA DE SISTEMAS MICELARES
Natal – RN 2014
Dissertação apresentada ao programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para a obtenção do grau de Mestre em Química.
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Silva, Gustavo Thalmer de Medeiros.
Caracterização físico-química de sistemas micelares / Gustavo Thalmer de Medeiros Silva. - Natal, RN, 2014.
60 f. : il.
Orientador: Alcides de Oliveira Wanderley Neto.
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química. Afetividade. Química. Aulas experimentais.
1. Tensoativos - Dissertação. 2. Micelização - Dissertação. 3. Adsorção em interface liquido gás- Dissertação. I. Wanderley Neto, Alcides de Oliveira. II. Universidade Federal do Rio Grande do Norte. III. Título.
AGRADECIMENTOS
Agradeço ao meu pai, Valdemar de Sena Silva, minha mãe, Aldaíse de Medeiros Silva, e meu irmão, Whenderson Thalmer de Medeiros Silva, pelo apoio, colaboração e incentivo.
À minha querida e amada noiva, Mayara Jardim de Medeiros Silva, pela paciência e companheirismo.
Ao professor e orientador Alcides de Oliveira Wanderley Neto, pela a ajuda, orientações, sugestões e conselhos.
Ao professor José Luís Cardozo Fonseca pelas colaborações, orientações, sugestões e conselhos neste trabalho e a disponibilização do Laboratório de Membranas e Colóides.
À professora Márcia Rodrigues Pereira por aceitar e participar da banca de qualificação e a disponibilização do Laboratório de Membranas e Colóides.
Aos colegas de laboratório pelo companheirismo e amizade durante o curso. A toda minha família, principalmente aqueles que me apoiaram.
RESUMO
Os processos de micelização e adsorção dos tensoativos dodecil sulfato de sódio, cloreto de dodecilamônio e hexaetileno glicol mono-n-dodecil éter em interface líquido-gás foram estudados a partir de medidas de tensão superficial em meio aquoso e em NaCl 0,1 mol/L em temperaturas de 25, 33 e 40 °C. A partir destes dados, a concentração micelar crítica e parâmetros termodinâmicos de micelização e adsorção foram determinados, a fim de elucidar os comportamentos de micelização e adsorção para esses tensoativos nos meios propostos. Para a determinação dos parâmetros termodinâmicos de adsorção, foram utilizadas as equações das isotermas de Gibbs e de Langmuir. Os valores de Γmáx determinados pelas diferentes equações foram correlacionados para a explicação dos resultados. A temperatura e salinidade foram analisadas quanto às suas influências no processo de micelização e adsorção, e os resultados foram explicados baseados nas interações intermoleculares. Os valores de
Gmic confirmaram que a formação micelar para os tensoativos estudados ocorre
espontaneamente.
ABSTRACT
The process of adsorption and micellization of the surfactants sodium dodecyl sulfate, dodecylammonium chloride and hexaethylene glycol mono-n-dodecyl ether in water-air interface has been studied using measurements of surface tension in aqueous media and NaCl 0.1 mol/L in temperatures of 25, 33 and 40 °C. From these data, critical micelle concentrations and thermodynamic parameters of micellization and adsorption were determined in order to elucidate the behaviors of micellization and adsorption for these surfactants in the proposed medium. For the determination of the thermodynamic parameters of adsorption we utilized the equations of isotherms of Langmuir and Gibbs. Γmáx values determined by the different equations were correlated to the explanation of results. Temperature and salinity were analyzed in terms of their influence on the micellization and adsorption process, and the results were explained based on intermolecular interactions. The
values of Gmic have confirmed that the micelle formation for the surfactants studied occurs
spontaneously.
LISTA DE FIGURAS
Figura 2.1 - Variação de alguma propriedade geral, P, com distância perpendicular a partir da superfície na imediação de uma
interface entre duas fases. ... 17 Figura 3.2 - Tensiômetro utilizado no experimento. ... 26
Figura 4.1 - Espectrometria na região do infravermelho do DAC
sintetizado. ... 27 Figura 4.2 - Variação da tensão superficial em função da concentração
dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL
L60 (triângulos), em meio aquoso e a 25 °C. ... 28 Figura 4.3 - Condutividade como uma função da concentração de DAC,
em 25 °C. ... 33 Figura 4.4 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulos), em meio aquoso a 25 °C, para o estudo da
isoterma de Langmuir. ... 36 Figura 4.5 - Variação da tensão superficial em função da concentração do
tensoativo UNITOL L60 (triângulos), em NaCl 0,1 M a 40
°C. ... 39 Figura 7.1 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60
(triângulo), em meio aquoso a 33 °C (azul). ... 44 Figura 7.2 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60
(triângulo), em meio aquoso a 40 °C (vermelho). ... 45 Figura 7.3 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60
(triângulo), em NaCl 0,1 M a 25 °C (preto). ... 46 Figura 7.4 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60
Figura 7.5 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos) e DAC (quadrados), em NaCl 0,1
M a 40 °C (vermelho). ... 49 Figura 7.6 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em meio aquoso a 33 °C, para o estudo da
isoterma de Langmuir. ... 50 Figura 7.7 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em meio aquoso a 40 °C, para o estudo da
isoterma de Langmuir. ... 52 Figura 7.8 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em NaCl 0,1 M a 25 °C, para o estudo da
isoterma de Langmuir. ... 53 Figura 7.9 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em NaCl 0,1 M a 33 °C, para o estudo da
isoterma de Langmuir. ... 55 Figura 7.10 - Variação da tensão superficial em função da concentração dos
tensoativos SDS (círculos) e DAC (quadrados) em NaCl 0,1
LISTA DE TABELAS
Tabela 3.1 - Concentração inicial das soluções de tensoativos. ... 24
Tabela 4.1 - Concentração micelar crítica do SDS, DAC e UNITOL L60,
em meio aquoso e salino nas temperaturas de 25, 33 e 40 °C. ... 29
Tabela 4.2 - CMC dos tensoativos em diferentes meios à 25 °C. ... 30
Tabela 4.3 - Grau de dissociação, α, dos tensoativos SDS e DAC, em meio
aquoso, nas temperaturas de 25, 33 e 40 °C. ... 33
Tabela 4.4 - Gmic de cada tensoativo em diferentes meios e temperaturas. ... 34
Tabela 4.5 - Γmáx dos tensoativos, SDS, DAC e UNITOL L60 em diferentes meios em função da temperatura, calculados a
partir da equação de Gibbs. ... 35
Tabela 4.6 - Valores de Γmáx obtidos a partir da isoterma de Langmuir... 37
LISTA DE ABREVIATURAS E SÍMBOLOS
SDS - Dodecil Sulfato de Sódio
DAC - Cloreto de Dodecilamônio
UNITOL L60 - Álcool Laurílico com 6 grupos etoxilados ou Hexaetileno glicol mono-n-dodecil éter
NaCl - Cloreto de Sódio
CMC - Concentração Micelar Crítica
Gmic - Variação da energia livre de Gibbs padrão de micelização
Γmáx - Concentração máxima de excesso superficial de tensoativo
- Tensão superficial
KL - Constante da isoterma de Langmuir
α - Grau de dissociação
- Potencial químico padrão do tensoativo na forma micelar
SUMÁRIO
1 INTRODUÇÃO ... 10
2 FUNDAMENTAÇÃO TEÓRICA ... 11
2.1 TENSOATIVOS ... 11
2.1.1 Classificação dos tensoativos ... 11
2.1.1.1 Tensoativos iônicos... 11
2.1.1.2 Tensoativos não-iônicos ... 11
2.1.1.3 Tensoativos anfóteros ... 12
2.2 MICELIZAÇÃO (PROCESSO DE FORMAÇÃO MICELAR) ... 12
2.2.1 Termodinâmica de formação micelar ... 13
2.2.2 Fatores que afetam a CMC ... 15
2.2.2.1 Estrutura do tensoativo ... 15
2.2.2.2 Adição de eletrólitos ... 15
2.2.2.3 Efeito da temperatura ... 16
2.3 ADSORÇÃO DE TENSOATIVOS EM INTERFACES ... 16
2.3.1 Adsorção de tensoativos em interfaces fluidas ... 16
2.3.2 Localização da superfície ... 17
2.4 TENSÃO SUPERFICIAL ... 19
2.5 ISOTERMAS DE ADSORÇÃO ... 20
3. MATERIAIS E MÉTODOS ... 23
3.1 MATERIAIS ... 23
3.2 PARTE EXPERIMENTAL ... 23
3.2.1 Tensoativos... 23
3.2.2 Síntese e caracterização do DAC ... 24
3.2.3 Preparação das soluções de tensoativos ... 24
3.2.4 Medidas de tensão superficial ... 25
3.2.5 Medidas de condutividade ... 26
4 RESULTADOS E DISCUSSÃO ... 27
4.1 CARACTERIZAÇÃO FÍSICO-QUÍMICA DO CLORETO DE DODECILAMÔNIO SINTETIZADO ... 27
4.2 DETERMINAÇÃO DA CONCENTRAÇÃO MICELAR CRÍTICA ... 27
4.2.1 Efeito estrutural na CMC ... 30
4.2.3 Efeito da temperatura na CMC... 31
4.3 PARÂMETRO TERMODINÂMICO DE MICELIZAÇÃO ... 32
4.4 PARÂMETRO TERMODINÂMICO DE ADSORÇÃO NA INTERFACE LÍQUIDO-GÁS ... 34
4.5 ISOTERMA DE ADSORÇÃO DE LANGMUIR ... 35
4.6 OBSERVAÇÃO AO UNITOL L60 ... 39
5 CONCLUSÃO ... 40
REFERÊNCIAS ... 41
APÊNDICE ... 44
APÊNDICE A ... 44
1 INTRODUÇÃO
Os tensoativos vêm sendo utilizados extensivamente em diferentes aplicações, tais como, detergência, inibição de corrosão, recuperação de petróleo, flotação mineral, formação de espumas, emulsificação e outras. A natureza estrutural dos tensoativos é a principal responsável por características como a capacidade de adsorção em diferentes interfaces e formação de agregados moleculares, que são propriedades fundamentais nas diversas aplicações de tensoativos (ROSEN, 2004; MYERS, 2006; FAN, 2008; ZDZIENNICKA e
JA CZUK, 2008; SHI, 2010). As diversas possibilidades de aplicações continuam a motivar esforços para descrever agregados de tensoativos e monocamadas em interfaces formadas por tensoativos (SHI, 2010).
É conhecido que os tensoativos possuem capacidade de adsorver em interfaces e que formam monocamadas em interfaces líquido-gás, no entanto, há poucos estudos que explicam claramente a atividade superficial dos tensoativos. Um dos meios utilizados para elucidar os fenômenos interfaciais é a utilização de dados de tensão superficial, que variam com a concentração de tensoativos no sistema. A partir desses dados é possível obter parâmetros necessários para elucidação das propriedades dos tensoativos, tais como, a adsorção em interface líquido-gás e a formação de agregados moleculares.
Tendo em vista a importância dessas propriedades, a proposta deste trabalho foi estudar e comparar o comportamento de micelização e adsorção na interface líquido-gás dos tensoativos dodecil sulfato de sódio, cloreto de dodecilamônio e hexaetileno glicol mono-n-dodecil éter.
Esses tensoativos foram analisados empregando medidas de tensão superficial, utilizando o método da pressão máxima da bolha, como uma função da concentração. A partir desses dados foram determinados valores de concentrações micelar críticas, e posteriormente valores da variação da energia livre de Gibbs padrão de micelização, para caracterizar o processo de formação micelar.
11
2 FUNDAMENTAÇÃO TEÓRICA
2.1 TENSOATIVOS
Os tensoativos são moléculas anfifílicas, ou seja, moléculas que possuem regiões de afinidades distintas. Essas moléculas são constituídas de uma parte hidrofílica (solúvel em água), de característica polar, conhecida como a cabeça do tensoativo, e outra parte que é hidrofóbica (insolúvel em água), de característica apolar, sendo conhecida como a cauda do tensoativo, geralmente é uma cadeia de hidrocarbonetos contendo de 8 a 18 carbonos. Essa natureza da estrutura dos tensoativos é responsável pela tendência dessas moléculas se adsorverem em diferentes interfaces, líquido-líquido, sólido-líquido e líquido-gás, reduzindo a tensão interfacial no meio que se encontra (TADROS, 2005).
2.1.1 Classificação dos tensoativos
Os tensoativos são comumente classificados em três grupos principais (tensoativos iônicos, não-iônicos e anfóteros) com base na natureza do grupo hidrofílico (TADROS, 2005).
2.1.1.1 Tensoativos iônicos
Os tensoativos iônicos são caracterizados em função da carga elétrica da parte hidrofílica, resultando em dois grupos: tensoativos aniônicos e catiônicos.
Os tensoativos aniônicos quando dissociados em água originam íons carregados negativamente. Seus principais representantes são os sabões, os compostos sulfonados, sulfatos e fosfatos (TADROS, 2005).
Os tensoativos catiônicos quando dissociados em água originam íons carregados positivamente. Os sais quaternários de amônio são os principais representantes desta classe (TADROS, 2005).
2.1.1.2 Tensoativos não-iônicos
polioxietilênicos contidos na estrutura. Os tensoativos não-iônicos mais comuns são os referidos tensoativos etoxilados, tensoativos à base de óxido de etileno (TADROS, 2005).
2.1.1.3 Tensoativos anfóteros
Esses tensoativos apresentam caráter aniônico ou catiônico, dependendo do pH do meio. Em pH ácido se apresentam como tensoativo catiônico, e em pH básico atuam como tensoativo aniônico. Os aminoácidos estão entre os principais representantes desta classe (TADROS, 2005).
2.2 MICELIZAÇÃO (PROCESSO DE FORMAÇÃO MICELAR)
Como mencionado anteriormente, a estrutura específica da molécula de tensoativo é responsável pela sua tendência de se concentrar em interfaces, o que ocasiona uma redução da energia livre do sistema no qual estão presentes. Então, devido suas características estruturais, as moléculas de tensoativos tendem a reduzir interações energéticas desfavoráveis, migrando para a interface. Entretanto, quando a interface estiver saturada, a redução de energia livre pode continuar por meio de outros processos (MYERS, 2006). Um dos principais processos é a formação de agregados moleculares ou micelas, que se apresentam como espécies dispersas em solução, termodinamicamente estáveis, com propriedades distintas da solução monomérica.
Em meio aquoso, as moléculas de tensoativos se agregam de forma que a região hidrofóbica do tensoativo mantenha o mínimo de contato superficial com a água, enquanto a região hidrofílica se direciona para o meio aquoso. As micelas formadas no meio são conhecidas por micelas diretas. Em meio apolar, acontece o inverso do observado em meio aquoso, e as micelas são conhecidas como micelas inversas.
As micelas são formadas a partir de uma determinada concentração de tensoativos em solução. A concentração a partir da qual se inicia o processo de micelização é conhecida como concentração micelar crítica, CMC, a qual é característica de cada tensoativo e dependente da temperatura, da natureza do meio e de impurezas presentes (ROSEN, 2004; TADROS, 2005).
13 tensoativos é bastante influenciada pelo tipo de solvente. A adição de solventes orgânicos nas soluções de tensoativos, por exemplo, afeta propriedades micelares, tais como, a concentração micelar crítica e o grau de dissociação. O comportamento de agregação dos tensoativos tem sido normalmente explicado por efeitos hidrofóbico e solvofóbico. A força motriz para a agregação de tensoativos é considerado o efeito hidrofóbico, devido à solubilidade das cadeias de hidrocarbonetos de tensoativos ser baixa na água (BATIGÖÇ et al., 2011).
2.2.1 Termodinâmica de formação micelar
O processo de micelização, ou de formação micelar, é o resultado de interações físicas entre as moléculas tensoativas, sendo uma das mais importantes características dos tensoativos em solução. A formação micelar tem sido explicada através de duas abordagens
termodinâmicas (TADROS, 2005;MYERS, 2006; HIEMENZ e RAJAGOPALAN, 1997). A
primeira é mencionada como o modelo de separação de fases, que trata as micelas como uma fase simples (única), a qual se encontra como uma fase separada, formada no sistema acima da CMC. A segunda abordagem é referida como o modelo de ação das massas, que considera as micelas e moléculas de tensoativos individuais ou íons num equilíbrio dinâmico de associação e dissociação.
No modelo de separação de fases considera-se o potencial químico do tensoativo na forma micelar constante, a uma dada temperatura, o qual é adotado como potencial químico padrão, . No estado de equilíbrio entre micelas e monômeros de tensoativos, têm-se,
(2.1)
no qual é o potencial químico padrão do monômero de tensoativo, R é a constante universal dos gases, T é a temperatura e é a atividade do tensoativo na solução, que é igual ao produto de f1 , em que f1 é o coeficiente de atividade e é a fração molar. Para
soluções diluídas, normalmente assume-se que f1 é próximo a unidade (comportamento de
uma solução ideal). A energia livre padrão de micelização por mol de monômero de
tensoativo, , é a diferença entre os potenciais químicos (TADROS, 2005), como representado na equação abaixo.
A fração molar pode ser expressa a partir da , assumindo-se que = /[ ], em que, [ ] é a concentração molar de água em 1 litro (TADROS, 2005; DA SILVA, et al. 2011; ZDZIENNICKA et al., 2012, p. 126).
(2.3)
O segundo modelo, o modelo de ação das massas, assume o equilíbrio de associação-dissociação entre monômeros e micelas. Assim, uma constante de equilíbrio, , pode ser calculada a partir do equilíbrio de associação-dissociação entre os monômeros, , e agregados micelares, :
(2.4)
o é encontrado como:
(2.5)
Para que haja uma micelização bem definida o número de agregação, , deve ser maior que 50, tornando desprezível o primeiro termo do resultado final da Equação (2.5). Sendo assim, segue que é dado por:
(2.6)
O modelo de ação das massas permite uma simples extensão que deve ser utilizada quando se aplica tensoativos iônicos (TADROS, 2005). Uma conveniente solução para relatar
o em relação à foi dada por Philips (1955), no qual, chega a seguinte equação:
(2.7)
15
2.2.2 Fatores que afetam a CMC
As propriedades de formação micelar têm sido bastante estudadas a partir da determinação da concentração micelar crítica. Em muitos desses trabalhos há a investigação de alguns fatores que afetam a concentração micelar crítica de forma significante, especialmente em meio aquoso. Entre os fatores que afetam a CMC, se destacam: a estrutura do tensoativo (natureza da cauda hidrofóbica, tipo do grupo cabeça e contra íon) e fatores externos, não diretamente relacionados com a estrutura química do tensoativo (ROSEN, 2004; MYERS, 2006). Abaixo se encontra alguns fatores que afetam a CMC.
2.2.2.1 Estrutura do tensoativo
O comprimento da cadeia de hidrocarboneto de um tensoativo tem demonstrado ser um importante fator para CMC. Em geral a CMC diminui com o aumento do caráter hidrofóbico do tensoativo, ou seja, com o aumento da cadeia hidrocarbônica.
Com relação ao grupo hidrofílico, em meio aquoso, tensoativos iônicos aprensentam CMC bastante alta em relação aos tensoativos não-iônicos, considerando a mesma cadeia hidrocarbônica. As diferenças de raio iônico, grau de hidratação e outras contribuições não elétricas irão resultar em pequenas diferenças entre os grupos hidrofílicos (ROSEN, 2004).
2.2.2.2 Adição de eletrólitos
Em soluções aquosas as presenças de eletrólitos causam variação na CMC, este efeito é mais pronunciado em tensoativos iônicos, nos quais, os eletrólitos atuam diminuindo as repulsões eletrostáticas entre as cabeças polares dos tensoativos. Normalmente, a variação que ocorre é uma diminuição da CMC (MYERS, 2006). Para os tensoativos não-iônicos esse efetito é pouco pronunciado (SANTOS et al., 2009). Além disso, as alterações observadas na CMC com a adição de eletrólitos, para tensoativos não-iônicos não podem ser atribuídas aos mesmos efeitos eletrostáticos, como para tensoativos iônicos. A explicação mais aceita tem sido desenvolvida no contexto de mudanças nas propriedades do solvente em soluções aquosas, grupo hidrofóbico e o grau de hidratação do grupo hidrofílico (MYERS, 2006).
2.2.2.3 Efeito da temperatura
O efeito da temperatura sobre a CMC de tensoativos em solução aquosa é complexo. Os valores de CMC diminuem para alguns tensoativos e aumentam para outros, com o aumento da temperatura. O aumento da temperatura provoca a diminuição da hidratação do grupo hidrofílico, o que favorece a micelização. No entanto, o aumento da temperatura também causa a ruptura das estruturas de água, circundante aos grupos hidrofóbicos do tensoativo, efeito que desfavorece a micelização. A magnitude relativa desses dois efeitos opostos determina se CMC aumenta ou diminui em uma faixa de temperatura específica (ROSEN, 2004).
Zdziennicka et al., (2012, p. 126) estudaram a concentração micelar crítica e termodinâmica de micelização de diversos tensoativos por medidas de densidade, viscosidade, condutividade e espalhamento de luz, em diferentes temperaturas.
2.3 ADSORÇÃO DE TENSOATIVOS EM INTERFACES
Resumidamente para a química, uma interface ou uma superfície pode ser descrita como o limite entre, pelo menos, duas fases imiscíveis. Assim, é conhecido que existem apenas cinco tipos de interfaces: sólido-sólido, sólido-líquido, sólido-gás, líquido-gás e líquido-líquido. Geralmente, efeitos de tensoativos sobre as propriedades físicas de algum sistema, são encontrados em sistemas que contenham pelo menos uma fase líquida (MYERS, 2006). A maneira a qual os tensoativos se adsorvem em interfaces, necessita ser amplamente estudada, e explicações dos resultados práticos se deve a utilização de procedimentos teóricos.
2.3.1 Adsorção de tensoativos em interfaces fluidas
A adsorção de tensoativos em interface líquido-gás e líquido-líquido pode ser descrita pela variação da tensão superficial com a concentração da solução aquosa e a determinação do excesso superficial usando a equação de adsorção de Gibbs (ROSEN 2004, GRANGE e LEVIS, 1986), que na sua forma simplificada é descrita como:
17
sendo, d a variação da tensão superficial ou interfacial da fase líquida, Γi é a concentração de
excesso na superfície de algum componente do sistema e dµi é a variação de potencial
químico de algum componente do sistema.
2.3.2 Localização da superfície
Considerando sistemas bicomponentes, por exemplo, um sistema líquido-gás,
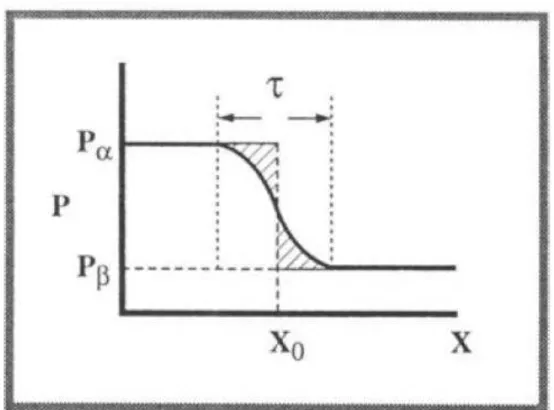
imaginemos uma propriedade P, comportamento na medida em que se move de α em direção a , que varia como função da localização em um sistema bifásico. Representação na figura abaixo:
Figura 2.1 - Variação de alguma propriedade geral, P, com distância perpendicular a partir da superfície na imediação de uma interface entre duas fases.
Fonte: Hiemenz & Rajagopalan, 1997.
A interface não é uma superfície no senso estritamente matemático, mas sim uma
região de espessura, , na qual as propriedades variam continuamente de uma fase para outra.
O volume desta região, normalmente não é explicitado e a propriedade da superfície é tratada como se estivesse em um local, X0, qualquer. O X0 é apenas um ponto de referência e não um
Para esses sistemas bicomponentes é definido que a concentração de excesso superficial do solvente é zero, Γ1 = 0, não sendo necessário o somatório na equação (2.8).
Assim, a superfície pode ser definida como a região em que a quantidade de solvente é igual a zero. Para esta situação, de sistemas bicomponentes, a equação de Gibbs, equação (2.8), torna-se:
(2.9)
Para Γ1 = 0,
(2.10)
Como significado físico, Γ2 é igual a diferença algébrica entre as áreas sombreadas que correspondem a superestimação e subestimação de P, representado na Figura 2.1. Então, o excesso superficial é uma quantidade algébrica que pode ser tanto positiva quanto negativa,
dependendo da convenção usada para escolher Γ.
A partir da equação (2.10) e da equação (2.11), é possível obter uma relação entre a
tensão superficial da fase líquida, , e a concentração de excesso superficial do soluto.
(2.11)
Diferenciando e considerando que a concentração é baixa o suficiente para ser aproximada a uma solução ideal, encontra-se a propriedade de excesso superficial relacionada a tensão superficial e concentração do soluto,
(2.12)
em que, é o número de espécies de soluto (componentes independentes) cuja concentração na interface varia com a mudança no valor de C2. Eastoe e Dalton (2000) informam que, = 1
19 = 2, nesse caso é assumido que o tensoativo iônico é completamente dissociado no seio e interface da solução (SANTOS et al., 2009; ZDZIENNICKA et al., 2012, p. 25).
Estudos de processos de adsorção a partir da equação de adsorção de Gibbs têm sido realizados com diversos tensoativos em diferentes condições. Um grupo de pesquisa do departamento de fenômeno interfacial da faculdade de química da universidade Maria Curie-Sklodowska, Lublin, Polônia, vêm se destacando com estudos em comportamentos de adsorção em interface líquido-ar, aplicando a equação de Gibbs. Ja czuk et al. 2003 estudaram mistura de dois tensoativos aniônicos em água, numa interface líquido-ar, aplicando a equação de Gibbs. Zdziennicka e Ja czuk, 2008, a partir de medidas de tensão superficial de brometo de cetiltrimetilamônio em água e misturas de propanol explicou o comportamento de adsorção do CTAB na interface líquido-ar com relação a concentração de propanol.
Bermúdez-Salguero et al. 2011, mostra uma interessante abordagem sobre a equação de adsorção de Gibbs. Com base em um modelo termodinâmico, é provado que o processo de adsorção e a saturação da superfície precedem a micelização e que os resultados obtidos a partir da equação de Gibbs são válidos para o processo de adsorção.
Yunfei et al. 2012, destaca que além da equação de adsorção de Gibbs ser utilizada para encontrar a quantidade de moléculas de tensoativos adsorvidas em equilíbrio, pela relação matemática mencionada acima, pode também ser utilizada para medidas da dependência do tempo da concentração das moléculas na interface, o que é importante para entender a cinética de adsorção.
2.4 TENSÃO SUPERFICIAL
A tensão superficial apresenta-se em muitas situações, sendo responsável por diversas propriedades, como a geometria de interfaces envolvendo fluidos, molhabilidade de líquidos, efeito de capilaridade, entre outros.
separadas da fase gasosa, as moléculas presentes na superfície possuem uma maior energia potencial do que aquelas presentes no interior da fase líquida.
Considerando a abordagem acima, uma quantidade de trabalho igual a essa diferença de energia, deve ser gasto para mover uma molécula a partir do interior para a superfície. A energia livre superficial por unidade de área, ou tensão superficial, é a medida deste trabalho. A tensão superficial é a quantidade mínima de trabalho necessária para mover moléculas do interior para a superfície para expandi-la por unidade de área (ROSEN, 2004), representada pela equação 2.13.
(2.13)
Medidas de tensão superficial em função de concentração de tensoativos podem ser utilizadas para calcular a concentração micelar crítica de tensoativos, a concentração de excesso superficial do tensoativo na superfície e a área mínima por molécula adsorvida (de
tensoativo na interface), . As medidas de tensão superficial também podem ser realizadas por diversos métodos. Fan et al. (2008) estudaram as propriedades superficiais e comportamento de agregação em solução aquosa de tensoativos sintetizados, por meio de medidas de tensão superficial pelo método da placa de Wilhelmy e método da gota. A partir desse estudo foi possível estimar valores de CMC, Γ e . No estudo de Gamboa e Olea (2006), sobre efeitos na superfície ativa de soluções aquosas de misturas de ácido húmico com tensoativos catiônicos, foi utilizado o método do anel para as medidas de tensão superficial. Franses et al. (1996) avalia as técnicas mais importantes para medir tensão superficial dinâmica, entre os métodos avaliados estão, método do volume da gota, pressão máxima da bolha, placa de Wilhelmy, anel Du Noüy, gota pendente, entre outros.
Uma explicação bem detalhada sobre esses métodos de medidas de tensão superficial é encontrada em Adamson e Gast (1997).
2.5 ISOTERMAS DE ADSORÇÃO
21 isotermas podem ser utilizados com propósito de elucidar os mecanismos de adsorção, tais como: isoterma de Henry, isoterma de Langmuir, isoterma de Frumkin, isoterma de Freudlinch, isoterma de Volmer e isoterma de Van der Waals (EASTOE e DALTON, 2000; DANOV et al., 2006). De acordo com Stoyanov et al. (2004) essas isotermas são as mais comumente utilizadas para tensoativos não-iônicos.
A isoterma de Henry é somente válida em baixas concentrações de moléculas de tensoativos na superfície, devido não considerar as interações entre monômeros adsorvidos e a existência do valor máximo para o excesso superficial. As isotermas de Langmuir e Volmer correspondem a adsorção localizada e não localizada, respectivamente, mas sem interação atrativa entre as moléculas de tensoativos na superfície. As isotermas de Frumkin e Van der Waals fornecem generalizações das isotermas de Langmuir e Volmer para o caso de interação entre as moléculas, por meio da introdução de um parâmetro de interação, que representa as interações atrativas e repulsivas entre as cadeias de tensoativo (STOYANOV et al., 2004).
Entre as isotermas citadas, a isoterma de Langmuir é uma das que mais se destaca. A isoterma de Langmuir possui bastante simplicidade e utilidade, fatores esses, que possibilita a uma ampla aplicabilidade em diversas situações. Como muitas outras abordagens, ela possui limitações, mas a sua utilidade geralmente supera suas deficiências (MYERS, 1999).
A isoterma de Langmuir é baseada, em teoria, nas seguintes condições (ROSEN, 2004):
O adsorvente é homogêneo;
Os constituintes, solutos e solventes, têm áreas superficiais iguais;
Tanto a superfície, como o seio da solução, apresenta comportamento ideal, ou seja, nenhuma interação soluto-soluto e soluto-solvente existente nas fases;
O filme de adsorção é monomolecular, formação apenas de monocamada.
Muitas soluções de tensoativos apresentam comportamento do tipo de Langmuir, mesmo quando essas restrições não são cumpridas.
Abaixo, segue uma simples abordagem que descreve a adsorção do tipo Langmuir (EASTOE e DALTON, 2000).
(2.14)
A taxa de variação de Γ devido à dessorção é proporcional ao número de espécies adsorvidas:
(2.15)
Em equilíbrio, estas duas taxas são iguais e ao introduzir a constante de adsorção de Langmuir,
(2.16)
o resultado é a equação da isoterma de Langmuir:
(2.17)
23
3. MATERIAIS E MÉTODOS
Este capítulo relata os materiais, as técnicas e os procedimentos experimentais utilizados neste trabalho.
3.1 MATERIAIS
Dodecil sulfato de sódio (Sigma); Hexaetileno glicol mono-n-dodecil éter (UNITOL L60, Oxiteno); Dodecilamina 98% (Acros organic); Cloreto de Sódio P.A. (Vetec); Água destilada; Ácido clorídrico P.A. (Vetec); Etanol 95 % (vetec); Aparelho de ponto de fusão (MQAPF – 301); Destilador TE – 178 (Tecnal); Tensiômetro QC6000 (SensaDyne); Balança analítica digital (Tecnal); Transsonic T – 460 (Elma).
3.2 PARTE EXPERIMENTAL
3.2.1 Tensoativos
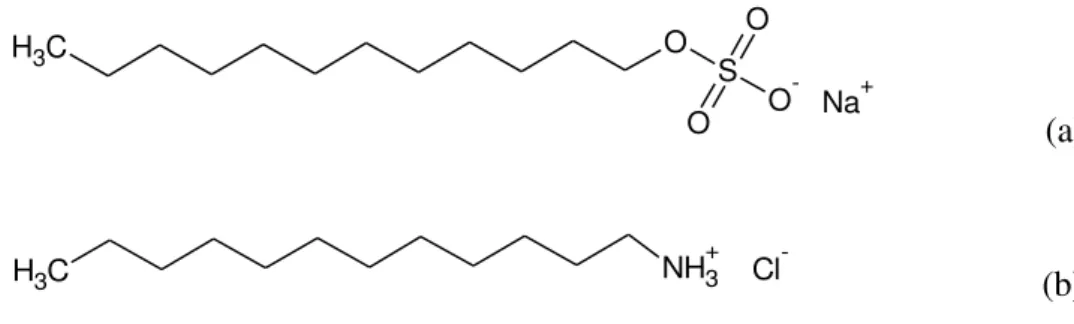
A ideia foi escolher tensoativos de acordo com a estrutura dos mesmos, que possuíssem a região hidrofóbica semelhante e a região hidrofílica distinta. Os tensoativos escolhidos foram o dodecil sulfato de sódio (SDS), cloreto de dodecilamônio (DAC) e álcool laurílico com seis grupos etoxilados, ou seja, o hexaetileno glicol mono-n-dodecil éter (UNITOL L60), sendo um de caráter aniônico, outro catiônico e um não iônico, respectivamente. A Figura 3.1 apresenta as estruturas moleculares destes tensoativos.
Figura 3.1 - Estrutura dos tensoativos utilizados no trabalho: (a) Dodecil sulfato de sódio (SDS); (b) Cloreto de dodecilamônio (DAC); (c) hexaetileno glicol mono-n-dodecil éter (UNITOL L60).
Na+ C
H3
S O
O O
O
(a)
NH3+ C
C
H3 O OH
6 (c)
3.2.2 Síntese e caracterização do DAC
Os tensoativos SDS e Unitol L60, tensoativos comerciais, foram utilizados como recebidos para a etapa posterior (preparação das soluções de tensotivos). O DAC foi sintetizado de acordo com Grange e Levis (1986), por reação de ácido clorídrico com dodecilamina, sendo purificado por recristalização utilizando etanol. Foi feita uma caracterização física e uma química, através da medição do ponto de fusão e de espectrometria na região do infravermelho, a fim de justificar a obtenção do DAC.
3.2.3 Preparação das soluções de tensoativos
As soluções de tensoativos, SDS, DAC e Unitol L60, foram preparadas em água destilada e em solução de NaCl 0,1 M. As concentrações iniciais das soluções de tensoativos foram estabelecidas de acordo com a solubilidade. Na Tabela 3.1 são apresentadas as concentrações das soluções de tensoativos utilizadas para iniciar as medidas de tensão superficial em diferentes temperaturas:
Tabela 3.1 - Concentração inicial das soluções de tensoativos.
Tensoativos
Concentração (mol/L) em solução
aquosa
Concentração (mol/L) em solução
de NaCl 0,1 M.
25
3.2.4 Medidas de tensão superficial
Medidas de tensão superficial das soluções aquosas e salinas dos tensoativos, SDS, DAC e UNITOL L60 foram realizadas em diferentes temperaturas, 25, 33 e 40 °C, utilizando o tensiômetro SensaDyne QC6000 da Chem-Dyne Research Corp. (Figura 3.2), com fluxo de nitrogênio gasoso. De cada solução inicial apresentada na Tabela 3.1 foi retirado determinada quantidade de solução, após isto, as medidas foram procedidas com diluições. Para gerenciar a execução da análise foi utilizado o programa computacional SensaDyne Tensiometer Software, versão 1.21. O método adotado por este tensiômetro é o da pressão máxima da bolha, que é composto de dois capilares com orifícios e diâmetros diferentes para eliminar a interferência de componentes hidrostáticos (diferença de densidade entre o líquido e o gás, multiplicado pela aceleração da gravidade e profundidade de imersão do capilar). O capilar maior mede o efeito da profundidade de imersão (eliminando os componentes hidrostáticos) e o capilar menor mede o valor da pressão máxima da bolha, o qual é convertido à tensão superficial. Para isso, esse método utiliza a equação de Laplace-Young, a qual fornece a pressão máxima da bolha relacionada à tensão superficial:
(3.1)
em que é a diferença de pressão de formação da bolha imersa na solução, é o raio do capilar de menor diâmetro e é o raio do capilar de maior diâmetro.
Figura 3.2 - Tensiômetro utilizado no experimento.
3.2.5 Medidas de condutividade
27
4 RESULTADOS E DISCUSSÃO
4.1 CARACTERIZAÇÃO FÍSICO-QUÍMICA DO CLORETO DE
DODECILAMÔNIO SINTETIZADO
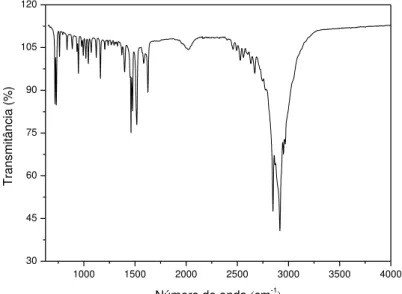
De acordo com a literatura (WANG et al., 1993), os espectros na região do infravermelho do DAC são atribuídos a modos de vibração da cadeia de hidrocarbonetos, em que, é distinguido duas características principais, a região entre 2800 e 3000 cm-1 assinalada como a região de estiramento dos grupos C-H e a região entre 700 e 1650 cm-1. Na última região, a maioria das bandas são características de modos de flexão de CH2. Com ressalva a
região entre 1500 e 1630 cm-1 correspondente ao modo de deformação de NH3.
A partir da Figura 4.1 podemos verificar as bandas nas regiões apontadas por Wang et al. (1993), justificando dessa forma a obtenção do cloreto de dodecilamônio. Para concretizar a obtenção do DAC, foi medido o ponto de fusão que resultou em torno de 182 – 189 °C, o qual foi de acordo com o ponto de fusão do DAC comercial.
Figura 4.1 - Espectrometria na região do infravermelho do DAC sintetizado.
1000 1500 2000 2500 3000 3500 4000 30
45 60 75 90 105 120
Tra
ns
mit
ânc
ia
(%
)
Número de onda (cm-1)
4.2 DETERMINAÇÃO DA CONCENTRAÇÃO MICELAR CRÍTICA
temperatura de 25 °C. No apêndice A, encontram-se outros gráficos referentes aos tensoativos em meio aquoso e salino e nas temperaturas analisadas nesse trabalho.
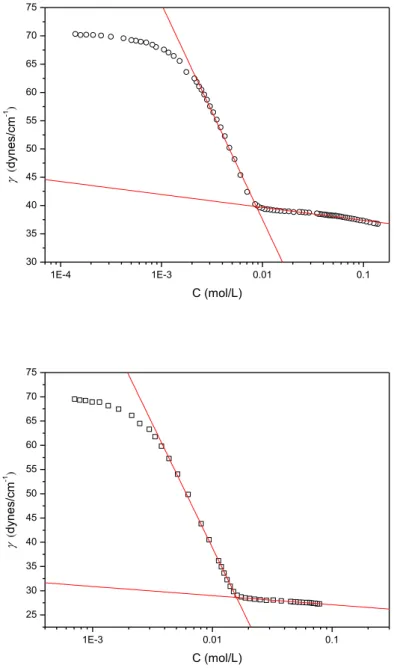
Figura 4.2 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulos), em meio aquoso e a 25 °C.
1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70 75 ( d yn e s/ cm -1 ) C (mol/L)
1E-3 0.01 0.1
29
1E-5 1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70 75 ( d yn e s/ cm -1 ) C (mol/L)
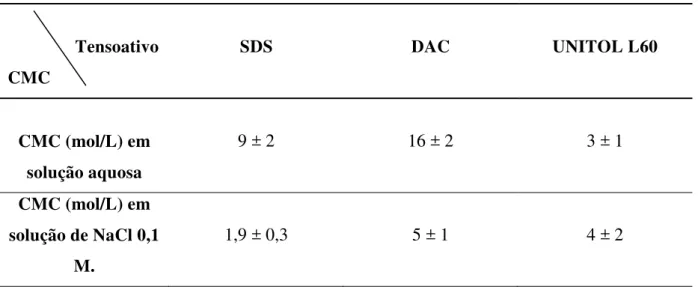
A partir da inflexão das curvas na Figura 4.2, determinou-se a concentração micelar crítica, ao qual, está representada pela intersecção de duas retas. Na Tabela 4.1 encontram-se os valores gerais de CMC para cada tensoativo em meio aquoso e salino nas temperaturas de 25, 33 e 40 °C. Os resultados de CMC, foram analisados com relação à estrutura dos tensoativos, adição de eletrólito (NaCl) e temperatura.
Tabela 4.1 - Concentração micelar crítica do SDS, DAC e UNITOL L60, em meio aquoso e salino nas temperaturas de 25, 33 e 40 °C.
Tensoativos Temperatura (°C) CMC (10-3 mol/L) em solução aquosa
CMC (10-3 mol/L) em solução de NaCl
0,1 M.
SDS
25 33 40
9 ± 2 9 ± 2 9 ± 2
1,9 ± 0,3 1,9 ± 0,4 1,9 ± 0,6
DAC
25 33 40
16 ± 2 16 ± 3 16 ± 2
5 ± 1 4,2 ± 0,9
5 ± 1
UNITOL L60
25 33 40
3 ± 1 4 ± 3 3 ± 2
4 ± 2 4 ± 3
4.2.1 Efeito estrutural na CMC
Analisando o efeito das estruturas dos tensoativos na CMC, de início, como planejado, é conhecido que o fator estrutural da região hidrofóbica não será prioridade nas diferenças de CMC dos tensoativos, quando comparado entre os mesmos, tendo em vista que a região hidrofóbica para o SDS, DAC e UNITOL L60 são semelhantes. Sendo assim, as diferentes CMC determinadas para estes tensoativos, com relação à estrutura, são explicadas devido ao grupo hidrofílico dos tensoativos.
A partir da Tabela 4.2 (parte retirada da Tabela 4.1), é possível verificar que os valores de CMC dos tensoativos iônicos em água são maiores que o do UNITOL L60. Isto ocorre, devido às moléculas dos tensoativos iônicos possuírem um maior grau de hidratação (ou solvatação) e existência de fortes repulsões eletrostáticas entre os grupos cabeças iônicos da molécula do tensoativo.
Tabela 4.2 - CMC dos tensoativos em diferentes meios à 25 °C.
Tensoativo CMC
SDS DAC UNITOL L60
CMC (mol/L) em solução aquosa
9 ± 2 16 ± 2 3 ± 1
CMC (mol/L) em solução de NaCl 0,1
M.
1,9 ± 0,3 5 ± 1 4 ± 2
Comparando os tensoativos iônicos, percebe-se que a CMC do DAC é maior do que a do SDS. Rosen (2004) informa que a CMC de tensoativos iônicos é mais elevada quando a carga do grupo iônico é mais próxima do átomo de carbono alfa do grupo hidrofóbico, o que de fato é observado nas estruturas do SDS e DAC (Figura 3.1). Além disso, devido o raio iônico do DAC ser menor, em relação aos outros tensoativos, um maior grau de hidratação é esperado para o mesmo. Provavelmente as interações repulsivas existentes nos grupos hidrofílicos do DAC são maiores do que as do SDS.
31 (seção 4.2.2), o que ocasiona a redução da CMC para esses tensoativos. Em NaCl 0,1 mol/L, o valor da CMC para o tensoativo SDS foi menor do que o UNITOL L60, isso pode ser compreendido devido a maior capacidade do UNITOL L60 em formar ligações hidrogênio, em relação ao SDS, nesse meio.
4.2.2 Efeito da presença de eletrólitos na CMC
A presença de NaCl, em uma concentração de 0,1 mol/L, ocasionou uma forte diminuição nos valores de CMC dos tensoativos iônicos. A presença de eletrólitos ocasiona uma diminuição na dissociação dos tensoativos iônicos, neutralizando parcialmente suas cargas iônicas e diminuindo as interações eletrostáticas repulsivas, resultando numa agregação micelar em baixas concentrações.
Os eletrólitos atuam blindando as cabeças hidrofílicas dos tensoativos diminuindo as repulsões eletrostáticas existentes. Além disso, a presença de eletrólitos diminui a hidratação da região hidrofílica do tensoativo iônico. A CMC diminui devido os eletrólitos agirem comprimindo a espessura da dupla camada elétrica da região polar do tensoativo (SANTOS et. al., 2009).
Para as moléculas de tensoativos não-iônicos, como não possuem cargas, não foi observado mudanças na CMC, com a presença de NaCl 0,1 mol/L.
4.2.3 Efeito da temperatura na CMC
Analisando a Tabela 4.1, é perceptível que não houve alterações nos valores de CMC no intervalo de temperatura utilizado neste trabalho. Certamente, o método utilizado para a determinação da CMC não foi suficientemente sensível para detectar qualquer dependência da CMC com a temperatura, no intervalo utilizado para essa variável.
proporcionando o aumento da CMC. Então, o balanceamento entre esses dois efeitos é que irá resultar no aumento ou diminuição da CMC em relação ao aumento da temperatura.
4.3 PARÂMETRO TERMODINÂMICO DE MICELIZAÇÃO
A energia livre de Gibbs padrão de micelização, , mede a tendência do tensoativo em formar micelas. Como mencionado anteriormente, a formação micelar é explicada a partir de duas abordagens termodinâmicas (seção 2.2.1) que finaliza nas idênticas
equações 2.3 e 2.6 para encontrar o .
Para a determinação da energia livre de Gibbs padrão de micelização para o tensoativo não-iônico UNITOL L60 foi utilizado a equação 2.3, neste caso foi assumido que a fração molar da equação 2.2 é igual /[ ], já que a CMC dos tensoativos utilizados
correspondem a valores bastante pequenos (ROSEN, 2004). O valor de [H2O] corresponde a
55.56 mol/L. Com relação aos tensoativos iônicos SDS e DAC, em solução aquosa, foi considerado o grau de dissociação, α, (PHILLIPS, 1955; TADROS, 2005). Então, a equação utilizada foi à equação 4.1:
(4.1)
O grau de dissociação foi calculado conforme o método de Frahm et al., 1980, em que o α corresponde à razão entre os declives das retas nas regiões pós e pré micelar:
, (4.2)
no qual, S1 é o declive da reta antes da formação de micelas e S2 é o seu valor após a formação
33
Figura 4.3 - Condutividade como uma função da concentração de DAC, em 25 °C.
0,00 0,01 0,02 0,03 0,04 0 500 1000 1500 2000 2500 C (mol/L) C o n d u tivida d e ( S/ cm )
Tabela 4.3 - Grau de dissociação, α, dos tensoativos SDS e DAC, em meio aquoso, nas temperaturas de β5, γγ e
40 °C.
Tensoativos Temperatura (°C) α
SDS
25 33 40
0,377 ± 0,058 0,380 ± 0,076 0,397 ± 0,035
DAC
25 33 40
0,466 ± 0,025 0,473 ± 0,022 0,498 ± 0,018
Os valores de energia livre de Gibbs padrão de micelização para os tensoativos estudados em NaCl 0,1 mol/L foram determinados por meio da equação 2.3.
Na Tabela 4.4 encontram-se os valores de Gmic. Os valores obtidos foram todos
negativos, o que indica que o processo de micelização, para os tensoativos estudados, é espontâneo. Da mesma forma que foi encontrada para a CMC, o método não foi
suficientemente sensível para detectar uma dependência dos valores de Gmic com a
entre a variação de entropia e entalpia com a mudança de temperatura (SADEGHI e SHAHABI, 2011; USMAN e SIDDIQ, 2013).
Tabela 4.4 - Gmic de cada tensoativo em diferentes meios e temperaturas.
Tensoativos Temperatura (°C) Gmic (kJ/mol) em
(Solução aquosa)
Gmic (kJ/mol) (NaCl 0,1 M)
SDS
25 33 40
- 35 ± 8 - 36 ± 8 - 36 ± 8
- 25 ± 4 - 26 ± 6 - 27 ± 8
DAC
25 33 40
- 31 ± 4 - 32 ± 6 - 32 ± 4
- 23 ± 5 - 24 ± 5 - 24 ± 5
UNITOL L60
25 33 40
- 24 ± 8 (- β ± β) ∙ ńŃ
(- β ± β) ∙ ńŃ
(- β ± ń) ∙ ńŃ
(- β ± β) ∙ ńŃ
-
Há uma tendência de menores valores de Gmic para os tensoativos iônicos.
Zdziennicka, et al. (p. 126, 2012), em seu estudo, atribuiu que isto pode ser o resultado de maiores interações hidrofóbicas das caudas dos tensoativos iônicos, o que causa forte reorientação nas moléculas de água, no qual, foi explicado a partir da área contactável entre as moléculas do tensoativo iônico e a água, que são maiores do que as do não-iônico, resultando em uma maior entropia de micelização.
4.4 PARÂMETRO TERMODINÂMICO DE ADSORÇÃO NA INTERFACE LÍQUIDO-GÁS
35 Para os tensoativos iônicos em meio aquoso, utilizou-se na equação o n = 2. Já em
meio salino foi utilizado n = 1, assim como, para o tensoativo não-iônico que em ambos os
meios n = 1.
Analisando a Tabela 4.5, é visto que com a presença de NaCl 0,1 mol/L há um aumento nos valores de Γmáx para os tensoativos iônicos, indicando um aumento de moléculas de tensoativos adsorvidas na interface líquido-gás. Como já discutido, isto ocorre devido à diminuição das repulsões entre os grupos cabeças dos tensoativos iônicos, favorecendo a acomodação de um maior número de tensoativos na interface. Para o tensoativo não-iônico esse efeito não é observado, visto que o mesmo não possui grupos carregados.
Entre os tensoativos estudados, o DAC foi o que apresentou maior Γmáx, possivelmente devido ao tamanho do grupo hidrofílico ser menor e o modo como estará orientado na interface, no qual, a molécula ocupará uma menor área na interface, fazendo com que necessite de mais moléculas desse tensoativo para saturar a interface líquido-gás. Os experimentos não foram sensíveis o suficiente para detectar uma dependência entre Γmáx e temperatura, no intervalo de temperatura analisado.
Tabela 4.5 - Γmáx dos tensoativos, SDS, DAC e UNITOL L60 em diferentes meios em função da temperatura,
calculados a partir da equação de Gibbs.
Tensoativos Temperatura (°C) Γmáx (10-6 mol m-2) (Solução aquosa)
Γmáx(10-6 mol m-2) (NaCl 0,1 M)
SDS
25 33 40
3,3 ± 0,3 3,3 ± 0,3 3,3 ± 0,2
5,8 ± 0,1 6,5 ± 0,1 5,5 ± 0,1
DAC
25 33 40
4,6 ± 0,3 4,6 ± 0,4 4,1 ± 0,2
6,8 ± 0,2 7,5 ± 0,2 6,2 ± 0,2
UNITOL L60
25 33 40
2,8 ± 0,1 2,5 ± 0,2 2,37 ± 0,08
2,45 ± 0,07 2,4 ± 0,1
-
A equação da isoterma de Langmuir (Equação 2.16, em que Γ é o mesmo que Γmáx)
foi relacionada com a equação de Gibbs para calcular os valores de Γmáx. A partir da
substituição da equação 2.16 na equação de Gibbs 2.12 e por integração, resultou nas equações:
(4.3)
para os tensoativos iônicos, SDS e DAC, em solução aquosa, e para o tensoativo não iônico, UNITOL L60, em ambos os meios, e os tensoativos iônicos em meio salino,
(4.4)
A Figura 4.4 mostra os dados de tensão superficial em função da concentração dos tensoativos estudados, usados para obter os parâmetros da isoterma de Langmuir, apresentados na Tabela 4.6. É notório que a isoterma de Langmuir não se ajusta bem para os tensoativos iônicos, visto que essa isoterma não considera as interações laterais existentes, tais como, forças atrativas e repulsivas entre os grupos hidrofílicos (cabeças polares) desses tensoativos. Os outros gráficos das isotermas de Langmuir estão disponíveis no Apêndice B.
Figura 4.4 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulos), em meio aquoso a 25 °C, para o estudo da isoterma de Langmuir.
0.0000 0.0006 0.0012
66 68 70 72
(
d
yn
e
s/
cm
-1 )
37
0.000 0.001 0.002 0.003
60 65 70 ( d yn e s/ cm -1 ) C (mol/L)
0.0000 0.0002 0.0004 0.0006 0.0008
45 50 55 60 65 70 75 ( d yn e s/ cm -1 ) C (mol/L)
Tabela 4.6 - Valores de Γmáx obtidos a partir da isoterma de Langmuir.
Tensoativos Temperatura (°C) Γmáx (10-6 mol m-2) (solução aquosa)
Γmáx(10-6 mol m-2) (NaCl 0,1 M)
SDS
25 33 40
3± 2 3 ± 1 3 ± 2
DAC
25 33 40
4 ± 2 4 ± 3 5 ± 2
8 ± 1 8 ± 2 9,9 ± 0,3
UNITOL L60
25 33 40
2,98 ± 0,09 2,8 ± 0,1 2,69 ± 0,07
2,52 ± 0,06 2,54 ± 0,06
-
Analisando os dados da Tabela 4.6, pode-se ver que os valores de Γmáx obtidos pela isoterma de Langmuir confirmam o que foi exposto através da equação da isoterma de Gibbs (secção 4.4), que com a presença do NaCl 0,1 mol/L no meio há um aumento da concentração de tensoativos na superfície, para os tensoativos SDS e DAC (explicado anteriormente). Entre os Γmáx determinados a partir dos dois métodos utilizados, também pode ser visto que os valores de Γmáx não foram diferentes dentro do intervalo de erros experimentais associados.
Na Tabela 4.7 encontram-se os valores da constante de Langmuir que representa o equilíbrio entre a taxa de adsorção e dessorção. Os valores de KL indicam que a presença de
NaCl, favorece o processo de adsorção na interface líquido-gás, em coerência com os resultados de Γmáx.No intervalo de temperatura utilizado neste trabalho, o método usado não foi sensível o suficiente para detectar uma dependência entre KL e a temperatura.
Tabela 4.7 - Valores de KL obtidos a partir da isoterma de Langmuir.
Tensoativos Temperatura (°C) ln KL (mol-1 L) (Solução aquosa)
ln KL (mol-1 L) (NaCl 0,1 M)
SDS
25 33 40
5,6 ± 0,7 5,3 ± 0,4 5,6 ± 0,7
8,2 ± 0,2 7,2 ± 0,3 7,4 ± 0,1
DAC
25 33 40
5,1 ± 0,6 4,8 ± 0,9 4,9 ± 0,5
7,6 ± 0,2 7,1 ± 0,3 7,0 ± 0,1
UNITOL L60
25 33 40
11,1 ± 0,2 11,0 ± 0,2 11,3 ± 0,2
11,3 ± 0,2 11,3 ± 0,2
39 4.6 OBSERVAÇÃO AO UNITOL L60
No decorrer dos resultados não foram apresentados os valores de concentração micelar crítica e os parâmetros de adsorção e micelização para o UNITOL L60 em NaCl 0,1 M à temperatura de 40 °C, devido o mesmo apresentar comportamento diferente em relação as outras temperaturas utilizadas no mesmo meio salino. A Figura 4.5 mostra esse comportamento da variação de tensão superficial em função da concentração e verifica-se que esse tensoativo, a temperatura e meio salino citado acima, apresentou três concentrações críticas. Possivelmente não houve formação de micelas, já que foi visível a turvação da solução, havendo separação de fases em concentrações mais baixas. É conhecido que as micelas são formadas em concentrações e temperaturas específicas, no caso dos tensoativos não-iônicos o processo de formação micelar ocorre numa temperatura abaixo de uma temperatura crítica, conhecida como ponto de névoa. Possivelmente, na concentração inicial utilizada, a temperatura de 40 °C está acima do ponto de névoa, o que ocasionou a turvação e separação de fases da solução, não sendo possível com os métodos empregados nesse trabalho, determinar a CMC e consequentemente os parâmetros termodinâmicos de micelização e adsorção.
Figura 4.5 - Variação da tensão superficial em função da concentração do tensoativo UNITOL L60 (triângulos), em NaCl 0,1 M a 40 °C.
1E-5 1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70
(
d
yn
e
s/
cm
-1 )
5 CONCLUSÃO
Os dados obtidos, a partir do método da pressão máxima da bolha, de tensão superficial em função da concentração, permitiram determinar a CMC e os parâmetros termodinâmicos de adsorção e micelização.
O intervalo de temperatura utilizado não afetou a CMC dos tensoativos estudados, no entanto, a presença de NaCl 0,1 mol/L diminuiu a CMC dos tensoativos iônicos. Os valores de Gmic para os tensoativos estudados foram todos negativos indicando que a formação de
micelas ocorre espontaneamente.
O parâmetro Γmáx determinados através da equação da isoterma de Langmuir foram de acordo com os valores de Γmáx determinados por meio da equação Gibbs, destacando que a presença de eletrólito (NaCl 0,1 mol/L) no meio, aumentou a atividade superficial dos tensoativos iônicos estudados. O aumento nos valores de KL com a presença de NaCl 0,1
41
REFERÊNCIAS
ADAMSON, A. W.; GAST, A. P.; Physical chemistry of surfaces. New York: Wiley-interscience. 6ª ed. 1997.
BATIGÖÇ, Ç.; AKBAS, H.; BOZ, M.Micellization behaviour and thermodynamic
parameters of 12-2-12 gemini surfactant in (water + organic solvent) mixtures.J. Chem. Thermodynamics. v.43; p. 1349–1354, 2011. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0021961411001182. Acesso em: 13 jun. 2013. Doi: http://dx.doi.org/10.1016/j.jct.2011.04.007.
BERMÚDEZ-SALGUERO, C.; GRACIA-FRADIQUE, J. Analysis of Gibbs adsorption equation and thermodynamic relation between Gibbs standard energies of adsorption and micellization through a surface equation of state. Journal of colloid and interface science. v. 355; p. 518–519, 2011. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0021979710014207. Acesso em: 01 mar. 2014. doi: http://dx.doi.org/10.1016/j.jcis.2010.12.040.
DANOV, K. D.; KRALCHEVSKY, P. A.; ANANTHAPADMANABHAN, K. P.; LIPS, A. Interpretation of surface-tension isotherms of n-alkanoic (fatty) acids by means of the van der Waals model. Journal of colloid and interface science. v. 300; p. 809-813, 2006. Disponível em: http://www.sciencedirect.com/science/article/pii/S0021979706003225. Acesso em: 12 dez. 2012. doi: http://dx.doi.org/10.1016/j.jcis.2006.04.026.
DA SILVA, G. C.; ROSSI, C. G. F. T.; DANTAS NETO A. A.; DANTAS, T. N. C.; FONSECA, J. L. C. Characterization of wormlike micellar systems using DLS, rheometry and tensiometry. Colloids and Surfaces A: Physicochem. Eng. Aspects. v. 377; p. 35–43, 2011. Disponível em: http://www.sciencedirect.com/science/article/pii/S0927775710007478. Acesso em: 15 jan. 2014. doi: http://dx.doi.org/10.1016/j.colsurfa.2010.12.016.
EASTOE, J.; DALTON, J. S. Dynamic surface tension and adsorption mechanisms of surfactants at the air-water interface. Advances in colloid and interface science. v. 85; p. 103-144, 2000. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0001868699000172. Acesso em: 15 jan. 2014. doi: http://dx.doi.org/10.1016/S0001-8686(99)00017-2.
FAN, H.; HAN, F.; LIU, Z.; QIN, L.; LI, Z.; LIANG, D.; KE, F.; HUANG, J.; FU, H. Active control of surface properties and aggregation behavior in amino acid-based Gemini surfactant systems. Journal of Colloid and Interface Science. v. 321; p. 227–234, 2008. Disponível em: http://www.sciencedirect.com/science/article/pii/S0021979708000817. Acesso em: 15 jan. 2014. doi: http://dx.doi.org/10.1016/j.jcis.2008.01.039.
FRAHM, J.; DIEKMANN, S.; HAASE, A. Electrostatic properties of ionic micelles in aqueous solutions. Berichte der Bunsengesellschaft für physikalische Chemie. v. 84; p. 566-571, 1980. Disponível em:
http://onlinelibrary.wiley.com/doi/10.1002/bbpc.19800840610/abstract. Acesso em: 06 jan.
2014. doi: 10.1002/bbpc.19800840610.
1996. Disponível em: http://www.sciencedirect.com/science/article/pii/S1359029496800185. Acesso em: 18 jan. 2014. doi: http://dx.doi.org/10.1016/S1359-0294(96)80018-5.
GAMBOA, C.; OLEA A. F. Association of cationic surfactants to humic acid Effect on the surface activity. Colloids and Surfaces A: Physicochem. Eng. Aspects. v. 278; p. 241–245, 2006. Disponível em: http://www.sciencedirect.com/science/article/pii/S0927775705010113. Acesso em: 15 jan. 2014. doi: http://dx.doi.org/10.1016/j.colsurfa.2005.12.026.
GRANGE, G.; LEVIS, A.; Adsorption of dodecylammonium chloride at water/air and at water/laurone interfaces. Journal of colloid and interface science. v. 109; p. 229-234, 1986. Disponível em: http://www.sciencedirect.com/science/article/pii/0021979786902973. Acesso em: 15 jan. 2014. doi: http://dx.doi.org/10.1016/0021-9797(86)90297-3.
HIEMENZ, P. C.; RAJAGOPALAN, R. Principles of colloid and surface chemistry. 3ª ed. New York: Marcel Dekker, Inc., 1997.
JA CZUK, B.; ZDZIENNICKA, A.; WÓJCIK, W. The properties of mixtures of two anionic surfactants in water at the water/air interface. Colloids and surfaces A: physicochem. eng. aspects. v. 220; p. 61-68, 2003. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0927775703000608. Acesso em: 18 jan. 2014. doi: http://dx.doi.org/10.1016/S0927-7757(03)00060-8.
MYERS, D. Surfaces, interfaces, and colloids: principles and applications. Wiley-VCH, John Wiley & Sons, Inc. 2ª ed., New York, 1999.
MYERS, D. Surfactant science and technology. John Wiley & Sons, Inc. 3ª ed., Hoboken, New Jersey, 2006.
PHILIPS J.N. The energetic of micelle formation. Trans. Faraday Soc. v. 51; p. 561–569, 1955. Disponível em: http://dx.doi.org/10.1039/TF9555100561. Acesso em: 25 nov. 2013.
ROSEN, M. J. Surfactants and interfacial phenomena. Wiley-interscience. 3ª ed. Hoboken, New Jersey, 2004.
SADEGHI, R.; SHAHABI, S. A comparison study between sodium dodecyl sulfate and sodium dodecyl sulfonate with respect to the thermodynamic properties, micellization, and interaction with poly(ethylene glycol) in aqueous solutions. J. Chem. Thermodynamics. v. 43; p. 1361-1370, 2011. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0021961411001236. Acesso em: 13 nov. 2013. doi: http://dx.doi.org/10.1016/j.jct.2011.04.012.
SANTOS, F. K. G.; BARROS NETO E. L.; MOURA, M. C. P. A.; DANTAS, T. N. C.; DANTAS NETO, A. A. Molecular behavior of ionic and nonionic surfactants in saline médium. Colloids and Surfaces A: Physicochem. Eng. Aspects. v. 333; p. 156–162, 2009. Disponível em: http://www.sciencedirect.com/science/article/pii/S0927775708006456. Acesso em: 22 out. 2013. doi: http://dx.doi.org/10.1016/j.colsurfa.2008.09.040.
SHI, L.; TUMMALA, N. J.; STRIOLO, A. C12E6 and SDS surfactants simulated at the vacuum-water interface. Langmuir. v. 26 (8); p. 5462-5474, 2010. Disponível em:
43 STOYANOV, S. D.; PAUNOV, V. N.; REHAGE, H.; KUHN, H. A new class of interfacial tension isotherms for nonionic surfactants based on local self-consistent mean field theory: classical isotherms revisited. Physical chemistry chemical physics. v. 6; p. 596-603, 2004. Disponível em: http://dx.doi.org/10.1039/B314100D. Acesso em: 15 fev. 2014.
TADROS, T. F. Applied surfactants: principles and applications. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
USMAN, M.; SIDDIQ, M. Surface and micellar properties of chloroquine diphosphate and its interactions with surfactants and human serum albumi. J. Chem. Thermodynamics. v. 58; p.
359-366, 2013. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0021961412004466. Acesso em: 15 fev. 2014. doi: http://dx.doi.org/10.1016/j.jct.2012.11.022.
WANG, W.; LI, L.; XI, S. An infrared spectroscopic characterization of the solid-solid behavior of dodecylammonium chloride. Journal phys. chem. solids. v. 54; p. 73-77, 1993. Disponível em: http://www.sciencedirect.com/science/article/pii/0022369793901169. Acesso em: 22 nov. 2013. doi: http://dx.doi.org/10.1016/0022-3697(93)90116-9.
YUNFEI, H.; YAZHUO, S.; HONGLAI, L.; DOMINIQUE, L.; ANNIINA, S. Surfactant adsorption onto interfaces: measuring the surface excess in time. Langmuir. v. 28; p. 3146-3151, 2012. Disponível em: http://dx.doi.org/10.1021/la2047454. Acesso em: 15 fev. 2014.
ZDZIENNICKA, A.; JA CZUK, B. Adsorption of cetyltrimethylammonium bromide and propanol mixtures with regard to wettability of polytetrafluoroethylene. I. Adsorption at aqueous solution-air interface. Journal of colloid and interface science. v. 317; p. 44-53, 2008. Disponível em: http://www.sciencedirect.com/science/article/pii/S0021979707013355. Acesso em: 18 jan. 2014. doi: http://dx.doi.org/10.1016/j.jcis.2007.09.026.
ZDZIENNICKA, A.; SZYMCZYK, K.; KRAWCZYK, J.; JA CZUK, B. Activity and
thermodynamic parameters of some surfactants adsorption at the water–air interface. Fluid Phase Equilibria. v. 318; p. 25-33, 2012. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0378381212000155. Acesso em: 18 jan. 2014. doi: http://dx.doi.org/10.1016/j.fluid.2012.01.014.
ZDZIENNICKA, A.; SZYMCZYK, K.; KRAWCZYK, J.; JA CZUK, B. Critical micelle
concentration of some surfactants and thermodynamic parameters of their micellization. Fluid Phase Equilibria. v. 322– 323; p. 126– 134, 2012. Disponível em:
APÊNDICE
APÊNDICE A
Nesta secção encontram-se os gráficos de variação de tensão superficial em função da concentração, que foram utilizados para determinação da CMC.
Figura 7.1 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em meio aquoso a 33 °C (azul).
1E-4 1E-3 0.01 0.1
35 40 45 50 55 60 65 70 ( d yn e s/ cm -1 ) C (mol/L)
1E-3 0.01 0.1
45
1E-5 1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70 75 ( d yn e s/ cm -1 ) C (mol/L)
Figura 7.2 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em meio aquoso a 40 (vermelho)
1E-3 0.01 0.1
1E-5 1E-4 1E-3 0.01 0.1 25 30 35 40 45 50 55 60 65 70 ( d yn e s/ cm -1 ) C (mol/L)
Figura 7.3 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em NaCl 0,1 M a 25 °C (preto).
1E-4 1E-3 0.01 0.1
47
1E-4 1E-3 0.01 0.1
20 25 30 35 40 45 50 55 60 65 70 75 ( d yn e s/ cm -1 ) C (mol/L)
1E-5 1E-4 1E-3 0.01 0.1
Figura 7.4 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos), DAC (quadrados) e UNITOL L60 (triângulo), em NaCl 0,1 M a 33 °C (azul).
1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70
(
d
yn
e
s/
cm
-1 )
C (mol/L)
1E-4 1E-3 0.01 0.1
20 25 30 35 40 45 50 55 60 65 70
(
d
yn
e
s/
cm
-1 )
49
1E-5 1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70
(
d
yn
e
s/
cm
-1 )
C (mol/L)
Figura 7.5 - Variação da tensão superficial em função da concentração dos tensoativos SDS (círculos) e DAC (quadrados), em NaCl 0,1 M a 40 °C (vermelho).
1E-4 1E-3 0.01 0.1
30 35 40 45 50 55 60 65 70
(
d
yn
e
s/
cm
-1 )