Aplicação e otimização de métodos eletroquímicos combinados para
remoção e determinação de cromo hexavalente em efluentes simulados
Elaine Cristina Martins de Moura
____________________________________________
Tese de Doutorado
Natal/RN, julho de 2015
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
Elaine Cristina Martins de Moura
Aplicação e otimização de métodos eletroquímicos combinados para remoção e determinação de cromo hexavalente em efluentes simulados
Tese apresentada ao Programa de Pós-graduação em Química da Universidade Federal do Rio Grande do Norte como parte dos requisitos para obtenção do titulo de Doutora em Química.
Orientação: Prof. Dr. Carlos Alberto Martinez Huitle Co-orientação: Prof. Dr. Djalma Ribeiro da Silva
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Moura, Elaine Cristina Martins de.
Aplicação e otimização de métodos eletroquímicos combinados para remoção e determinação de cromo hexavalente em efluentes simulados /Elaine Cristina Martins de Moura. – Natal, RN, 2015.
152 f.; il.
Orientador: Carlos Alberto Martinez Huitle. Co-orientador: Djalma Ribeiro da Silva
Tese (Doutorado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Eletroquímica – Tese. 2. Eletrocoagulação – Tese. 3. Cromo hexavalente – Tese. 4.
Eletroanálise – Tese. 5. Planejamento fatorial – Tese. 6. Metodologia de superfície de resposta. Martinez-Huitle, Carlos Alberto. II. Silva, Djalma Ribeiro. III. Universidade Federal do Rio Grande do Norte. IV. Título.
Dedico este trabalho aos meus pais
Leonardo e Maria, ao meu esposo Antonio Carlos e aos meus irmãos Eliane Cristina e Mauricio, aos meus cunhados Luiz Alberto e
AGRADECIMENTOS
A Deus, por não me deixar desanimar diante dos obstáculos, mas perseverar sempre.
Ao Prof. Dr. Carlos Alberto Martinez Huitle pela oportunidade e orientação para o desenvolvimento deste trabalho, bem como a motivação, apoio e palavras de incentivo decorrer destes quatro anos.
Ao Prof. Dr. Djalma Ribeiro da Silva pelas orientações e oportunidades.
Ao Prof. Dr. José Heriberto Oliveira do Nascimento pelo apoio, colaboração e amizade desde a graduação.
Ao aluno de iniciação científica Paulo Rafael que colaborou na execução deste trabalho.
A todos do Laboratório de Eletroquímica Ambiental e Aplicada que colaboraram de forma direta ou indireta na realização deste trabalho.
As minhas amigas Cátia Guaraciara, Anna Kelly, Andréa Carla, Rosélia, pela amizade e incentivo.
À minha família agradeço pelo companheirismo, amor, incentivo, paciência e compreensão, durante a elaboração desse trabalho.
Ao meu esposo sou imensamente grata por todos os momentos que no decorrer do doutorado me incentivou e encorajou, e por ser paciente, compreensivo, acima de tudo companheiro e amigo de todas as horas.
Construi amigos, enfrentei derrotas, venci obstáculo, bati na porta da vida e disse-lhe: Não tenho medo de vivê-la!
RESUMO
O cromo hexavalente é um dos metais pesados presente em diversos efluentes industriais, e dependendo de sua concentração pode causar danos irreparáveis ao meio ambiente e aos seres humanos. Diante deste contexto, este trabalho objetivou-se na aplicação de métodos eletroquímicos para determinar e remover o cromo
hexavalente (Cr6+) em efluente simulado. Para determinação foi aplicada a
Voltametria de Redissolução catódica (VRC), utilizando os eletrodos de ultra traço de grafite (trabalho), Ag/AgCl (referência) e platina (contra-eletrodo), as amostras coletadas foram complexadas com a 1,5-difenilcarbazida e em seguida submetidas à
análise. Na remoção de Cr6+ foi aplicado o processo de eletrocoagulação (EC),
utilizando eletrodos de Fe e Al. As variáveis que constituíram o planejamento fatorial
24, aplicado para otimização do processo de EC, foram: densidade de corrente (5 e
10 mA.cm-2), temperatura (25 e 60 ºC), concentração (50 e 100 ppm) e velocidade
de agitação (400 e 600 RPM). Através dos testes preliminares foi possível a
adequação da aplicação da VRC para a determinação de Cr6+, removido durante a o
processo de EC. Os eletrodos de Fe e Al utilizados como ânodos de sacrifício, mostraram resultados satisfatórios no processo de EC, entretanto o Fe favoreceu uma remoção completa em 30 min, enquanto que, com Al ocorreu em 240 min. Na
aplicação do planejamento fatorial 24 e análise da Metodologia de Superfície de
Resposta foi possível a otimização do processo de EC para remoção de Cr6+ em
solução de H2SO4 (0,5 mol.L-1), na qual a temperatura, com efeito positivo, foi a
variável que apresentou maior significância estatística em relação as demais variáveis e interações, enquanto que na otimização do processo de EC para
remoção de Cr6+ em solução de NaCl (0,1 mol.L-1) a densidade de corrente, com
efeito positivo, e a concentração, com efeito negativo, foram as variáveis que apresentaram maior significância estatística em relação as demais variáveis e
interações. A utilização dos eletrólitos suportes NaCl e Na2SO4 não apresentaram
diferenças significativas, entretanto o NaCl apresentou uma rápida melhora na
cinética de remoção de Cr6+, e o aumento da concentração de NaCl proporcionou
um aumento na condutividade da solução, resultando em um menor consumo energético. Os desgastes dos eletrodos avaliados em todos os processo de EC
mostraram que o Al em solução de H2SO4 (0,5 mol.L-1) sofre anodização durante o
processo de EC, logo a perda de massa experimental é menor que a perda de massa teórica, entretanto, o Fe, no mesmo meio, mostrou uma perda de massa experimental maior que a estimada teoricamente. Este fato se deve a uma reação
espontânea do Fe com H2SO4, e quando o meio reacional foi o NaCl e Na2SO4 a
perda de massa experimental aproximou-se da perda de massa teórica. Além disso, foi verificado o consumo energético de todos os processos aplicados, neste estudo, apresentaram um baixo custo operacional, viabilizando desta forma, a aplicação do processo de EC para o tratamento de efluentes industriais. Os resultados obtidos
foram satisfatórios, pois foi alcançada a remoção completa do Cr6+ em todos os
processos aplicados neste estudo.
ABSTRACT
Hexavalent chromium is a heavy metal present in various industrial effluents, and depending on its concentration may cause irreparable damage to the environment and to humans. Facing this surrounding context, this study aimed on the application
of electrochemical methods to determine and remove the hexavalent chromium (Cr6+)
in simulated wastewater. To determine was applied to cathodic stripping voltammetry (CSV) using ultra trace graphite electrodes ultra trace (work), Ag/AgCl (reference) and platinum (counter electrode), the samples were complexed with
1,5-diphenylcarbazide and then subjected to analysis. The removal of Cr6+ was applied
electrocoagulation process (EC) using Fe and Al electrodes. The variables that
constituted the factorial design 24, applied to optimizing the EC process, were:
current density (5 and 10 mA.cm-2), temperature (25 and 60 ºC), concentration (50
and 100 ppm) and agitation rate (400 and 600 RPM). Through the preliminary test it
was possible the adequacy of applying the CSV for determining of Cr6+, removed
during the EC process. The Fe and Al electrodes as anodes sacrifice showed satisfactory results in the EC process, however Fe favored complete removal in 30
min, whereas with Al occurred at 240 min. In the application of factorial design 24 and
analysis of Response Surface Methodology was possible to optimize the EC process
for removal of Cr6+ in H2SO4 solution (0.5 mol.L-1), in which the temperature, with
positive effect, was the variable that presented higher statistical significance compared with other variables and interactions, while in optimizing the EC process
for removal of Cr6+ in NaCl solution (0.1 mol.L-1) the current density, with positive
effect, and concentration, with a negative effect were the variables that had greater statistical significance with greater statistical significance compared with other
variables and interactions. The utilization of electrolytes supports NaCl and Na2SO4
showed no significant differences, however NaCl resulted in rapid improvement in
Cr6+ removal kinetics and increasing the NaCl concentration provided an increase in
conductivity of the solution, resulting in lower energy consumption. The wear of the
electrodes evaluated in all the process of EC showed that the Al in H2SO4 solution
(0.5 mol.L-1), undergoes during the process of anodization CE, then the experimental
mass loss is less than the theoretical mass loss, however, the Fe in the same medium showed a loss of mass greater experimental estimated theoretically. This
fact is due to a spontaneous reaction of Fe with H2SO4, and when the reaction
medium was the NaCl and Na2SO4 loss experimental mass approached the
theoretical mass loss. Furthermore, it was observed the energy consumption of all processes involved in this study had a low operating cost, thus enabling the application of the EC process for treating industrial effluents. The results were
satisfactory, it was achieved complete removal of Cr6+ in all processes used in this
study.
LISTA DE FIGURAS
Figura 1 – Diagrama de Pourbaix para espécies de cromo... 30
Figura 2 – Diagrama de distribuição das espécies de Cr6+ em função do pH
a 25 ºC e 1 mol.L-1... 31
Figura 3 – Diagrama representativo da capacidade mutagenica e toxicidade
de Cr6+ na célula... 32
Figura 4 – Principais métodos aplicados para remoção de poluentes em
efluentes... 35
Figura 5 – Processo de eletrocoagulação... 37
Figura 6 – Diagrama da zona de predominância para as espécies químicas
Fe2+ em solução aquosa, as linhas retas representam o
equilíbrio de solubilidade de Fe(OH)2 e as linhas a tracejado
representam os limites predomínio entre as espécies químicas
solúveis... 40
Figura 7 – Diagrama da zona de predominância para as espécies químicas
Fe3+ em solução aquosa, as linhas retas representam o
equilíbrio de solubilidade de Fe(OH)3 e as linhas a tracejado
representam os limites predomínio entre as espécies químicas
solúveis... 41
Figura 8 – Diagrama de solubilidade de espécies do Al3+ em função do pH.. 57
Figura 9 – Reação de formação do complexo de cromo... 59
Figura 10 – Fotografia do Espectrofotômetro Specord 210 Plus Analytikjena.. 59
Figura 11 – Fotografia do Potenciostato Autolab PGSTAT 302N... 59
Figura 12 – Fotografia de célula eletroquímica e seus componentes... 61
Figura 13 – Sistema eletroquímico para eletrocoagulação: (1) fonte de alimentação DC; (2) agitador magnético; (3) barra magnética; (4)
cuba eletroquímica; (5) eletrodos... 62
Figura 14 – Fotografia do sistema eletroquímico para eletrocoagulação... 67
Figura 15 – Voltamogramas registrados, com a utilização do eletrodo ultra traço grafite, após análise de diferentes concentrações (0,1 a 10
ppm) de Cr6+. Inserção: Curva analítica, que mostra a
concentração de Cr6+... 68
Figura 16 – Representação gráfica do comportamento dos resíduos, o que
confirma a eficácia da curva analítica obtida através da VRC... 69
Figura 17 – Espectros do UV-Vis obtidos após análise de diferentes
concentrações (0,1 a 2,0 ppm). Inserção: Inserção: Curva
analítica, que mostra a dependência linear do absorbância em
função da concentração de Cr6+... 69
Figura 18 – Representação gráfica do comportamento dos resíduos, o que
confirma a eficácia da curva analítica obtida através do UV-Vis... 70
Figura 19 – (a) Amostras coletadas durante o processo de EC, e (b) após a
formação de complexo de cromo, nos testes preliminares... 71
Figura 20 – Percentual de remoção de Cr6+ durante o processo EC, determinada por VRC, em função do tempo, em diferentes
densidades de corrente... 72
Figura 21 – Percentual de remoção de Cr6+ durante o processo EC,
determinada por VRC, em função do tempo, em diferentes
densidades de corrente... 72
Figura 22 – Comparação do efeito da concentração e densidade de corrente
de aplicados nos testes preliminares do processo de EC... 73
Figura 23 – Percentual de remoção de Cr6+ durante o processo EC,
determinada por UV-Vis, em função do tempo, em diferentes
densidades de corrente... 73
Figura 24 – Percentual de remoção de Cr6+ durante o processo EC,
determinada por UV-Vis, em função do tempo, em diferentes
densidades de corrente... 74
Figura 25 – Difratogramas de raios-X dos eletrodos de Al após a aplicação
de EC a J= 5 mA.cm-2... 75
Figura 26 – Evolução do consumo de energia versus ao percentual de
remoção de Cr6+, durante eletrocoagulação utilizando eletrodos
Al... 75
Figura 27 – Perda de massa dos eletrodos de Al, utilizado nos teste
preliminares... 77
determinada por VRC, em função do tempo, diferenciando os
ânodos e cátodos em cada processo avaliado... 79
Figura 29 – Evolução do consumo de energia versus ao percentual de
remoção de Cr6+, durante eletrocoagulação utilizando ânodos de
Fe... 80
Figura 30 – Evolução do consumo de energia versus ao percentual de
remoção de Cr6+, durante eletrocoagulação utilizando ânodos de
Al... 80
Figura 31 – Perda de massa dos ânodos de Al versus a corrente aplicada no
processo de eletrocoagulação, no decorrer de 5 horas... 82
Figura 32 – Perda de massa dos ânodos de Fe versus a corrente aplicada
no processo de eletrocoagulação, no decorrer de 5 horas... 82
Figura 33 – Diagrama de Pareto mostrando os principais efeitos e interações dos parâmetros para a resposta (percentual de remoção de
Cr6+), onde: A = densidade de corrente; B = temperatura; C =
concentração; D = velocidade de agitação... 85
Figura 34 – Valores observados em função dos valores previstos... 87
Figura 35 – Representação da superfície de contorno (3D) para o efeito da densidade de corrente e temperatura na eficiência do percentual
de remoção de Cr6+ através do processo de eletrocoagulação... 89
Figura 36 – Representação da superfície de contorno (3D) para o efeito da concentração e temperatura na eficiência do percentual de
remoção de Cr6+ através do processo de eletrocoagulação... 89
Figura 37 – Representação da superfície de contorno (3D) para o efeito da velocidade de agitação e temperatura na eficiência do
percentual de remoção de Cr6+ através do processo de
eletrocoagulação... 90
Figura 38 – Percentual de remoção de Cr6+ durante o processo EC, determinada por VRC, em função do tempo, diferenciando os
eletrólitos da solução suporte em cada processo
avaliado... 92
concentração de NaCl na solução suporte em cada processo
avaliado... 93
Figura 40 – Efeito do eletrólito suporte na remoção de Cr6+, e na variação do
pH durante o processo de EC... 94
Figura 41 – Evolução do consumo de energia versus o percentual de
remoção de Cr6+, durante EC comparando-se os eletrólitos
suporte... 95
Figura 42 – Perda de massa do ânodo de Fe versus a corrente aplicada no processo de eletrocoagulação, comparando os eletrólitos
suporte... 96
Figura 43 – Diagrama de Pareto mostrando os principais efeitos e interações dos parâmetros para a resposta (percentual de remoção de
Cr6+), onde: A = densidade de corrente; B = temperatura; C =
concentração; D = velocidade de agitação... 99
Figura 44 – Valores observados em função dos valores previstos... 102
Figura 45 – Representação da superfície de contorno (3D) para o efeito da temperatura e densidade de corrente na eficiência do percentual
de remoção de Cr6+ através do processo de eletrocoagulação... 103
Figura 46 – Representação da superfície de contorno (3D) para o efeito da concentração e densidade de corrente na eficiência do
percentual de remoção de Cr6+ através do processo de
eletrocoagulação... 104
Figura 47 – Representação da superfície de contorno (3D) para o efeito da velocidade de agitação e densidade de corrente na eficiência do
percentual de remoção de Cr6+ através do processo de
eletrocoagulação... 104
Figura 48 – Representação da superfície de contorno (3D) para o efeito da temperatura e concentração na eficiência do percentual de
remoção de Cr6+ através do processo de
eletrocoagulação... 105
Figura 49 – Representação da superfície de contorno (3D) para o efeito da velocidade de agitação e concentração na eficiência do
eletrocoagulação... 105
Figura 50 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC nos teste preliminares: (a) 50 ppm, 5
mA.cm-2; (b) 50 ppm, 10 mA.cm-2; (c) 100 ppm, 5 mA.cm-2; (d)
100 ppm, 10 mA.cm-2... 142
Figura 51 – Espectros de UV-Vis obtidos nas análises das amostras coletadas durante o processo de EC nos teste preliminares: (a)
50 ppm, 5 mA.cm-2; (b) 50 ppm, 10 mA.cm-2; (c) 100 ppm, 5
mA.cm-2; (d) 100 ppm, 10 mA.cm-2... 142
Figura 52 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC na comparação dos ânodos de
sacrifício: (a) Al-Al; (b) Al-Fe; (c) Fe-Al; (d) Fe-Fe... 143
Figura 53 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC no ensaios do planejamento fatorial:
(a) 7,5 mA.cm-2, 42,5°C, 75 ppm, 500 RPM; (b) 5 mA.cm-2, 25°C,
50 ppm, 400 RPM; (c) 7,5 mA.cm-2, 42,5°C, 75 ppm, 500 RPM;
(d) 10 mA.cm-2, 25°C, 50 ppm, 400 RPM; (e) 5 mA.cm-2, 60°C,
100 ppm, 600 RPM; (f) 5 mA.cm-2, 60°C, 50 ppm, 400 RPM; (g)
7,5 mA.cm-2, 42,5°C, 75 ppm, 500 RPM; (h) 10 mA.cm-2, 25°C,
100 ppm, 400 RPM... 144
Figura 54 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC no ensaios do planejamento fatorial:
(i) 10 mA.cm-2, 60°C, 50 ppm, 400 RPM; (j) 5 mA.cm-2, 25°C,
100 ppm, 400 RPM; (k) 10 mA.cm-2, 25°C, 100 ppm, 600 RPM;
(l) 5 mA.cm-2, 60°C, 100 ppm,,400 RPM; (m) 5 mA.cm-2, 25°C,
100 ppm, 600 RPM; (n) 10 mA.cm-2, 60°C, 100 ppm, 400 RPM;
(o) 10 mA.cm-2, 60°C, 100 ppm, 600 RPM; (p) 5 mA.cm-2, 60°C,
50 ppm, 600 RPM... 145
Figura 55 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC no ensaios do planejamento fatorial:
(q) 7,5 mA.cm-2, 42,5°C, 75 ppm, 500 RPM; (r) 10 mA.cm-2,
25°C, 50 ppm, 600 RPM; (s) 5 mA.cm-2, 25°C, 50 ppm, 600
Figura 56 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC na comparação dos eletrólitos
suporte: (a) NaCl 0,1 mol.L-1; (b) NaCl 0,01 mol.L-1; (c) Na2SO4
0,1 mol.L-1... 147
Figura 57 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC nos ensaios do planejamento fatorial:
(a) 5 mA.cm-2, 25°C, 100 ppm, 400 RPM; (b) 7,5 mA.cm-2,
42,5°C, 75 ppm, 500 RPM; (c) 7,5 mA.cm-2, 42,5°C, 75 ppm, 500
RPM; (d) 7,5 mA.cm-2, 42,5°C, 75 ppm, 500 RPM; (e) 5 mA.cm-2,
25°C, 50 ppm, 600 RPM; (f) 5 mA.cm-2, 60°C, 50 ppm, 600 RPM;
(g) 10 mA.cm-2, 60°C, 100 ppm, 600 RPM; (h) 10 mA.cm-2, 60°C,
50 ppm, 600 RPM... 148
Figura 58 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC nos ensaios do planejamento fatorial:
(i) 5 mA.cm-2, 25°C, 100 ppm, 600 RPM; (j) 10 mA.cm-2, 25°C,
50 ppm, 600 RPM; (k) 5 mA.cm-2, 60°C, 100 ppm, 400 RPM; (l)
7,5 mA.cm-2, 42,5°C, 75ppm, 500 RPM; (m) 10 mA.cm-2, 25°C,
100 ppm, 400 RPM; (n) 10 mA.cm-2, 25°C, 100 ppm, 600 RPM;
(o) 5 mA.cm-2, 25°C, 50 ppm, 400 RPM; (p) 5 mA.cm-2, 60°C,
100 ppm, 600 RPM... 149
Figura 59 – Voltamogramas obtidos nas análises das amostras coletadas durante o processo de EC nos ensaios do planejamento fatorial:
(q) 5 mA.cm-2, 60°C, 50 ppm, 400 RPM; (r) 10 mA.cm-2, 25°C, 50
ppm, 400 RPM; (s) 10 mA.cm-2, 60°C, 50 ppm, 400 RPM; (t) 10
LISTA DE TABELAS
Tabela 1 – Representação dos fatores e níveis para um planejamento
fatorial 24...
63
Tabela 2 – Estimativa do custo operacional do processo de
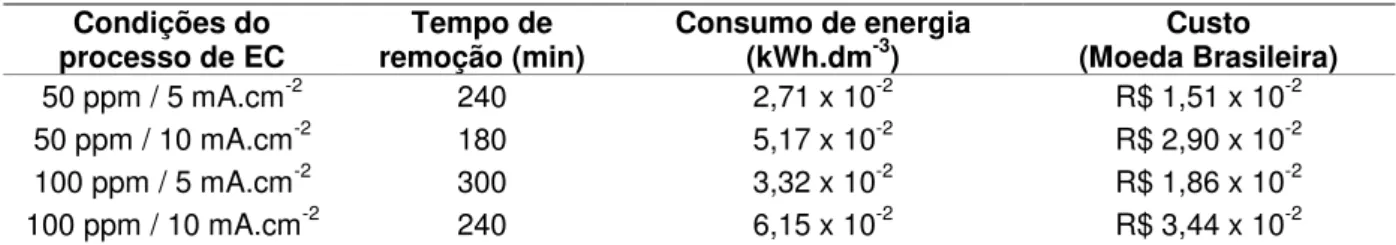
eletrocoagulação nos testes preliminares... 76
Tabela 3 – Estimativa do custo operacional do processo de eletrocoagulação aplicado a comparação de ânodos de
sacrifício... 80
Tabela 4 – Matriz das variáveis e valores operacionais para o planejamento
fatorial 24 com 4 pontos centrais... 85
Tabela 5 – Análise de variância (ANOVA) para a resposta (% remoção)... 87
Tabela 6 – Parâmetros aplicados no experimento 6 e 11 no processo de
eletrocoagulação... 88
Tabela 7 – Valor previsto e observado com IC e IP de 95%, para o
experimento 6... 88
Tabela 8 – Estimativa do consumo de energia e custo operacional dos processos de eletrocoagulação aplicados nos experimentos do
planejamento fatorial 24... 91
Tabela 9 – Estimativa do custo operacional do processo de eletrocoagulação aplicado à comparação de eletrólitos
suporte... 95
Tabela 10 – Matriz das variáveis e valores operacionais para o planejamento
fatorial 24 com 4 pontos centrais... 96
Tabela 11 – Análise de variância (ANOVA) para a resposta (% remoção)... 101
Tabela 12 – Parâmetros aplicados no experimento 3 e 6 no processo de
eletrocoagulação... 102
Tabela 13 – Valor previsto e observado com IC e IP de 95%, para o
experimento 3... 103
Tabela 14 – Estimativa do consumo de energia e custo operacional dos processos de eletrocoagulação aplicados nos experimentos do
planejamento fatorial 24... 106
ânodos de sacrifício; média da variação de potencial durante o
LISTA DE ABREVIATURAS
ANOVA Análise de variância
CONAMA Conselho Nacional de Meio Ambiente
COT Carnono orgânico Total
CSV Cathodic stripping voltammetry
DBO Demanda Biológica Orgânica
DQO Demanda Química Orgânica
EA Eletroanálise
EC Eletrocoagulação
IC Intervalo de confiança
IP Intervalo de previsão
LOD Limite de detecção
MSR Metodologia de superfície de resposta
RPM Rotação por minuto
UV-Vis Espectrofotometria de absorção na região do UV-Visível
SUMÁRIO
1 INTRODUÇÃO………...……. 20
2 OBJETIVOS... 24
2.1 OBJETIVO GERAL... 24
2.2 OBJETIVOS ESPECÍFICOS... 24
3 FUNDAMENTAÇÃO TEÓRICA... 25
3.1 ÁGUA... 25
3.2 EFLUENTES INDUSTRIAIS... 27
3.2.1 Metais Pesados... 27
3.2.1.1 Cromo Hexavalente... 29
3.2.2 Tratamento de Efluentes Industriais... 33
3.2.2.1 Tratamento Eletroquímico... 36
3.2.2.1.1 Processo de Eletrocoagulação... 36
3.2.2.1.1.1 Mecanismo proposto para remoção de Cr6+através da eletrocoagulação... 44
3.2.2.2 Eletroanálises... 48
3.2.2.3 Otimização de processos para tratamento de efluentes industriais... 51
4 MATERIAIS E MÉTODOS...……….. 56
4.1 REAGENTES E EQUIPAMENTOS... 56
4.2 MEDIDAS ANALÍTICAS... 58
4.2.1 Espectrofotometria e voltametria... 58
4.2.2 Difração de Raios-X... 60
4.2.3 Monitoramento do pH no decorrer do processo... 60
4.3 PROCESSOS DE ELETROCOAGULAÇÃO... 61
4.3.1 Testes preliminares para determinação de Cr6+ após o processo de eletrocoagulação... 62
4.3.2 Comparação de ânodos de sacrifício aplicados na eletrocoagulação... 62
4.3.3 Aplicação de planejamento fatorial 2n para otimização do processo de eletrocoagulação para remoção de Cr6+ em ácido sulfúrico 0,5 mol.L-1... 63
dos eletrólitos suportes aplicados no processo de
eletrocoagulação... 63
4.3.5 Otimização do processo de eletrocoagulação para remoção de Cr6+ em cloreto de sódio 0,1 mol.L-1... 64
4.3.6 Estimativa do consumo energético e custo operacional... 64
4.3.7 Desgaste dos ânodos de sacrifício... 65
5 RESULTADOS E DISCUSSÃO... 66
5.1 CURVAS ANALÍTICAS... 66
5.1.1 Voltametria... 66
5.1.2 Espectrofotometria... 68
5.2 TESTES PRELIMINARES PARA DETERMINAÇÃO DE Cr6+ APÓS O PROCESSO DE ELETROCOAGULAÇÃO... 70
5.2.1 Determinação de cromo hexavalente... 70
5.2.2 Difração de raios-X... 74
5.2.3 Estimativa do consumo energético e custo operacional... 75
5.2.4 Desgaste dos ânodos de sacrifício... 76
5.3 COMPARAÇÃO DOS ÂNODOS DE SACRIFICIO APLICADOS NA ELETROCOAGULAÇÃO... 77
5.3.1 Determinação de cromo hexavalente... 77
5.3.2 Estimativa do consumo energético e custo operacional... 79
5.3.3 Desgastes de ânodos de sacrifícios utilizados na avaliação de eficiência dos eletrodos Fe e Al... 81
5.4 APLICAÇÃO DE PLANEJAMENTO FATORIAL 24 PARA OTIMIZAÇÃO DO PROCESSO DE ELETROCOAGULAÇÃO PARA REMOÇÃO DE Cr6+ EM ÁCIDO SULFÚRICO 0,5 mol.L-1... 83
5.5 AVALIAÇÃO DA INFLUÊNCIA DE ELETRÓLITOS SUPORTE APLICADOS NA ELETROCOAGULAÇÃO... 91
5.5.1 Determinação de cromo hexavalente... 91
5.5.2 Influência do eletrólito suporte na mudança de pH durante o processo de EC... 93
5.5.3 Estimativa do consumo energético e custo operacional... 94
5.6 OTIMIZAÇÃO DO PROCESSO DE ELETROCOAGULAÇÃO
PARA REMOÇÃO DE Cr6+ EM CLORETO DE SÓDIO 0,1 mol.L-1... 96
6 CONCLUSÕES... 107
7 PRODUÇÃO CIENTÍFICAS... 109
REFERÊNCIAS... 114
1 INTRODUÇÃO
O avanço mundial no setor industrial proporcionou a poluição de diversas fontes de água (subterrâneas e superficiais) através do descarte de seus efluentes sem um tratamento prévio (HAMDAN e EL-NAAS, 2014). A redução da quantidade e/ou melhoraria do efluentes a ser descartados é de fundamental importância, pois atualmente a preservação ambiental é uma das prioridades no contexto mundial. O descarte de efluentes é um dos desafios que diversos setores industriais enfrentam para atingir um desenvolvimento adequado, livre de agressões ao meio ambiente. Diante das restrições impostas pelos órgãos ambientais, é imprescindível o tratamento de efluentes industriais, para atender aos requisitos de disposição do efluente, quer sejam estes legais ou operacionais, com a finalidade de reduzir o teor dos contaminantes a níveis permitidos pela legislação, antes da mesma ser descartada no meio ambiente.
Em geral os efluentes produzidos pelas indústrias são resultantes de diversas atividades, que são originadas em setores diferentes do processo produtivo, consequentemente podendo ocorrer uma complexibilidade relativa à sua composição. Esses efluentes podem conter poluentes orgânicos (hidrocarbonetos, fenóis, ácido carboxílicos, dentre outros) e inorgânicos (metais pesados tais como cobre, chumbo, cromo, cádmio, zinco e níquel). Dentre os contaminantes presentes nos efluentes industriais, os metais pesados não são biodegradáveis, apresentam alta toxicidade e dependendo da concentração desses, podem causar danos irreparáveis ao meio ambiente, bem como podem causar doenças crônicas ao seres humanos (GRAY, 2008; KHOSA et al., 2013; MUKHERJEE et al., 2013; ZEWAIL e YOUSEF, 2014). Os metais pesados podem ser absorvidos e acumulados pelos organismos vivos presentes no meio aquático, tornando-se uma fonte de contaminação para o homem, através do consumo de peixe, onde os metais pesados podem acumular-se no corpo humano. Para a maioria dos países, a concentração de metais pesados em efluentes deve ser controlada a fim de satisfazer os padrões de qualidade da água (KIM et al., 2005).
Dentre os metais destacamos o cromo hexavalente (Cr6+), por ser
ainda podem causar náuseas, alergias, doenças respiratórias e renais (COSTA, 1997; LIU, 1997; AGUIAR e NOVAES, 2002; COSTA, 2003; SAHA e ORVIG, 2010; SAHA et al., 2011; VERMA et al., 2013). O cromo pode estar presente em diversos setores produtivos, como metalurgia, galvanoplastia, curtimento de couro, catalisadores químicos, pigmentos, inibidores de corrosão e tintas de impressão (MOUEDHEN et al., 2009).
Diante deste contexto, se fazem necessários estudos e desenvolvimento de novas tecnologias, bem como a otimização das já existentes para que estas possam ser utilizadas em escala industrial, com maior eficiência de remoção dos poluentes. Dentre estas tecnologias enfatizamos a Eletroquímica, pois tem apresentado resultados promissores para o tratamento de efluentes, devido à sua compatibilidade
ambiental mediante a produção in situ de oxidantes fortes que reagem com
substâncias tóxicas eliminando-as ou transformado-as em substâncias menos nocivas (MARTINEZ-HUITLE e BRILLAS, 2009; COMNINELLIS e CHEN, 2010; ROCHA et al., 2014).
Neste trabalho destacamos a Eletrocoagulação (EC), pois tem sido muitas vezes considerado para remoção de espécies de cromo de resíduos líquidos, utilizando eletrodos de sacrifício como o alumínio (MURUGANATHAN et al., 2004; HEIDMANN e CALMANO, 2008a; MOUEDHEN et al., 2008; AKBAL e CAMCI, 2011, DERMENTZIZ et al., 2011a) ou ferro (GAO et al., 2005; GOLBER et al., 2007a,b; MUKHOPADHYAY et al., 2007; HEIDMAN e CALMANO, 2008b; DERMENTZIZ et al., 2011b; AKBAL e CAMCI, 2012; VERMA et al., 2013). As principais vantagens da eletrocoagulação em relação aos outros métodos convencionais como coagulação e adsorção química estão no sítio de reação em que não ocorre a geração de poluentes secundários. Além de se tratar de um método simples, confiável e de baixo custo para o tratamento de águas residuais sem qualquer necessidade de produtos químicos adicionais, e ainda reduz a quantidade de lama, que tem de ser descartado (GOLDER et al., 2007a,b; EYVAZ et al., 2009; MARTINEZ-HUITLE e BRILLAS 2009; KESHMIRIZADEH et al., 2011). Esse processo eletroquímico ocorre através da oxidação do metal (ferro ou alumínio) e promove a geração de
coagulantes in situ, ou seja, se caracteriza pela eletrólise realizada com ânodos de
eletrólise da água (SILVA e MAINIER, 2005; MARTINEZ-HUITLE e BRILLAS, 2009; COMNINELLIS e CHEN, 2010).
Para a determinação da concentração de Cr6+ durante e após o tratamento,
utilizamos neste trabalho a Eletroanálise (EA), pois nas últimas décadas, tem-se
apresentado como uma conveniente alternativa a outras técnicas instrumentais para a detecção, quantificação e monitoramento da concentração de diferentes espécies orgânica e inorgânica, uma vez que estes métodos eletroquímicos oferecem alta sensibilidade e seletividade (KATZ e SALEM, 1994; LOSI et al., 1994; VITALE et al., 1997; KESHMIRIZADEH et al., 2011; ARAÚJO et al., 2013). Dentre as técnicas utilizadas na EA a voltametria é a mais versátil e sensível utilizada em diversos trabalhos que tratam da eletroanalítica para espécies de cromo. (GOLIMOWSKI et al., 1985; MALAKHOVA et al., 1991a,b; ELLEOUET et al., 1992;. WANG et al., 1992; OLSEN et al., 1994; FILIPOVICH-KOVACEVIC et al., 1996; GANDOUR et al., 1996; GAO e SIOW 1996; PEREIRA et al., 1997; WANG et al., 1997a; WANG et al., 1997b). Embora a utilização destas técnicas, para quantificar as espécies orgânicas e inorgânicas, apresentam limitações particulares, poucos estudos têm aparecido na sua utilização em combinação com as tecnologias de tratamentos eletroquímicos, tais como processo de EC (NAUSEU-NJIKI et al., 2009).
E ainda para a otimização dos processos aplicados nos tratamentos de efluentes industriais, tem-se aplicado o planejamento fatorial (BHATTI et al., 2009; NAIR et al., 2014; THIRUGNANASAMBANDHAM et al., 2014), pois através desta metodologia é possível visualizar e analisar o comportamento de um determinado sistema, bem como a significância estatística e a influência de determinados parâmetros pré-estabelecidos no estudo desse mesmo sistema. O interesse em desenvolver um planejamento experimental é justificado pela intenção de minimizar os custos, o número e o tempo dos ensaios necessários à realização e aplicação de uma investigação. Além de que, através desta metodologia é possível a manipulação de vários parâmetros ou variáveis, bem como de todas as interações possíveis, sem ambiguidade dentro de um domínio experimental pré-determinado, com um número mínimo de ensaios (MYERS et al., 2009).
promover uma redução da carga de poluentes. Dentre os poluentes enfatiza a
necessidade da remoção do Cr6+. Destaca ainda, a eletrocoagulação, dentre os
métodos eletroquímicos aplicados no tratamento de efluentes industriais e eletroanálise para quantificação de espécies, bem como a necessidade da aplicação de um planejamento fatorial para otimização do processo de eletrocoagulação. No Capítulo 2 encontram-se o objetivo geral e os específicos deste trabalho. O Capítulo 3 apresenta a fundamentação teórica e estado da arte relacionada aos efluentes industriais, metais pesados (cromo hexavalente), métodos de tratamento, eletrocoagulação, eletroanálise e planejamento fatorial. No Capítulo 4 mostra-se a metodologia empregada durante o procedimento experimental, os materiais e, equipamentos, bem como e descrição do planejamento fatorial aplicado ao processo de EC. No Capítulo 5 são apresentados e discutidos os resultados obtidos neste estudo, e no Capítulo 6 as conclusões que foram observadas. No Capítulo 7 mostra-se a produção científica gerada no decorrer do doutorado, na forma de artigos e trabalhos publicados em congressos nacionais e internacionais, seguido das Referências Bibliográficas. Nos Apêndices apresentam-se os voltamogramas obtidos para quantificação da concentração de cromo hexavalente durante e após os processos de EC.
2 OBJETIVOS
2.1 OBJETIVO GERAL
Aplicar métodos eletroquímicos combinados para remover e determinar a
concentração de cromo hexavalente (Cr6+) em efluentes industriais.
2.2 OBJETIVOS ESPECÍFICOS
Realizar testes preliminares para determinação de Cr6+ após o processo de
eletrocoagulação;
Determinar através da aplicação de métodos analíticos (UV-Vis) e
eletroanalíticos (voltametria de redissolução catódica) a concentração de Cr6+
em efluente simulados submetidos ao processo de eletrocoagulação;
Analisar através da técnica de difração de raios-X os eletrodos utilizados na
eletrocoagulação, para verificar a ocorrência de adsorção de cromo na superfície dos eletrodos;
Comparar a eficiência dos eletrodos de Al e Fe utilizados na
eletrocoagulação;
Calcular a taxa de dissolução teórica e experimental dos ânodos de sacrifício
utilizados na eletrocoagulação;
Aplicar o planejamento fatorial 2n para otimização do processo de
eletrocoagulação para remoção de Cr6+ utilizando ácido sulfúrico (0,5 mol.L-1)
como eletrólito suporte;
Avaliar a influência dos eletrólitos suportes aplicados na eletrocoagulação
para remoção de Cr6+;
Aplicar o planejamento fatorial 2n para otimização do processo de
eletrocoagulação para remoção de Cr6+ utilizando cloreto de sódio
(0,1 mol.L-1) como eletrólito suporte;
Estimar o consumo energético e custo operacional do processo de
3 FUNDAMENTAÇÃO TEÓRICA
Neste capítulo são abordados os aspectos relevantes referente a água, as legislações vigentes sobre seus procedimentos de controle de qualidade, bem como as condições e padrões de lançamento de efluentes industriais. Também são apresentados os poluentes que podem estar presentes nestes efluentes, dentre estes o cromo hexavalente. Ainda são relatados os métodos de tratamento aplicados para remoção de poluentes, destacando entre os métodos eletroquímicos a eletrocoagulação, e eletroanálise (voltametria) para detecção, quantificação e monitoramento de poluentes. Além da aplicação de planejamento fatorial para otimização desses processos de tratamento.
3.1 ÁGUA
A água é uma substância de fundamental importância para subexistência dos seres vivos. Pois é através da água que o seres vivos eliminam as toxinas de seus corpos, bem como regulam a temperatura dos mesmos. Além disso, a água é essencial para diversas atividades, como lavar, cozinhar, transportar resíduos,
resfriar máquinas, irrigar colheitas (SPIRO e STIGLIANI, 2009). Por esta razão se
tem a preocupação em preservar e conservar em boas condições a água que dispomos.
Embora a água seja a substância de maior abundância na Terra,
aproximadamente 1.385.000.000 Km3, sendo que 97,4% desta água é salgada, e
encontra-se em oceanos, mares e lagos salgados, e apresentam-se imprópria para consumo. Apenas 2,6% corresponde à água doce, que esta distribuída em gelo polar, geleiras, águas subterrâneas, lagos, rios, umidade do solo, umidade atmosférica. Entretanto desse percentual, 90% encontram-se indisponível (gelo polar, geleiras e águas subterrâneas), restando 10% que se encontram na superfície (rios e lagos), apenas uma fração muito pequena esta disponível ao homem, ou seja 0,3% do percentual de água da Terra, e ainda esta disponibilidade não é a mesma em todas as regiões do mundo, pois 10 países detêm 60% desta água, entre estes países esta o Brasil, em segundo lugar, dispondo de 12%. (LENZI et al., 2014).
Atlântico, que concentram 45,5% da população total, estão disponíveis apenas 2,7% dos recursos hídricos do país, enquanto que na região Norte, onde vivem apenas cerca de 5% da população, têm-se aproximadamente 81% deste recurso (AGÊNCIA NACIONAL DE ÁGUAS, 2015).
Segundo Toledo (2004) aproximadamente 70% do total de água disponível para o consumo mundial são empregados no setor agrícola para irrigação, 22% na
indústria, e os 8% restante no uso doméstico. Diante desta distribuição para o
consumo de água doce, os problemas decorrentes a contaminação deste recurso hídrico vêm se destacando e preocupando a sociedade em relação preservação ambiental. Pois, estima-se, até 2050, um aumento da demanda hídrica mundial de 55%, principalmente devido ao crescimento do setor industrial, dos sistemas de geração de energia termoelétrica e dos usuários domésticos (UNESCO, 2015).
Recentemente a Fundação SOS Mata Atlântica coordenou uma análise da qualidade da água em rios, córregos e lagos de 5 estados brasileiros e o Distrito Federal, onde foram realizadas coletas entre março de 2014 e fevereiro de 2015. Este levantamento revelou que 23,3% apresentam uma classificação de qualidade ruim ou péssima. A situação é preocupante, visto que a poluição diminui ainda mais a oferta de água para consumo humano (SOS MATA ATLANTICA, 2015). Logo resulta na busca da conservação deste precioso recurso, através de dispositivos legais para o monitoramento, manutenção e conservação.
Assim como no Brasil e em diversos países, a legislação ambiental regula o
descarte de efluentes sobre corpos d’água, com o objetivo de limitar a carga
Nos Estados Unidos a Agência Nacional de Proteção Ambiental (Environmental Protetion Agency - EPA) regula o descarte e o tratamento dos efluentes no âmbito da Lei da Água Limpa (Clean Water Act - CWA) (ACT, 2002). Na União Européia este descarte é regulado pela Diretiva 2010/75/UE do Parlamento Europeu e do
Conselho, de 24 de novembro de 2010, que dispõe sobre às emissões industriais –
prevenção e controle integrado da poluição (DIRECTIVE, 2010).
3.2 EFLUENTES INDUSTRIAIS
A água é um dos insumos utilizados, em grandes volumes, na maior parte dos processos industriais de grande porte. Logo resultando na produção de grandes volumes de efluentes industriais, sendo este originado nas áreas de utilidade e/ou nos processo industriais.
As características destes efluentes dependem de diversos fatores tais como a natureza da indústria, as matérias primas que são processadas, as etapas
envolvidas nos processos, dentre outros. De modo geral um efluente industrial é
resultante da mistura de diversas atividades geradas em diferentes unidades do processo produtivo. Apresentando, também, uma complexibilidade, referente à composição química e à forma na qual se apresentam os poluentes. Nestes efluentes podem conter sólidos suspensos, orgânicos biodegradáveis, orgânicos voláteis, patogênicos, orgânicos refratários, sólidos orgânicos dissolvidos, nitrogênio, fósforo e metais pesados (CAMMAROTA, 2013).
3.2.1 Metais Pesados
Dentre os poluentes presentes nos efluentes industriais, os metais pesados encontram-se entre os principais.
Os metais pesados são definidos como qualquer elemento químico que tem uma densidade relativa elevada. Estes metais podem ser solubilizados na água, podendo gerar danos à saúde devido a sua toxicidade e em função da quantidade ingerida.
visto que eles não conseguem metabolizar estas substâncias, assim se inicia um ciclo de contaminação na cadeia alimentar, e a tendência é que a concentração desta substância aumente à medida que cresce o nível trópico, potencializado seu efeito nocivo ao longo da cadeia alimentar colocando em risco os organismos situados no topo dessa cadeia (CAMMAROTA, 2013).
Desta forma, todos os seres vivos podem ser afetados pela presença de metais dependendo da quantidade e da forma química. Embora, muitos metais sejam essenciais para o crescimento de todos os tipos de organismos, ou seja, são
essenciais para manter o metabolismo, desde as bactérias até mesmo o ser
humano, porém eles são requeridos em baixas concentrações, por exemplo, cobre,
selênio, zinco.
Os elementos químicos podem ser classificados de acordo com essecialidade que apresentam para exercerem as atividades biológicas. Estes elementos considerados essenciais devem ser mantidos em concentrações adequadas para que os organismos possam se desenvolver e se reproduzir normalmente, por exemplo, nos animais estas concentrações são mantidas através da dieta alimentar e nas plantas através da qualidade do solo. Além do carbono, hidrogênio, oxigênio e nitrogênio, todos os animais precisam de sete elementos minerais (cálcio, fósforo, potássio, magnésio, sódio, cloreto, e enxofre), para manter o equilíbrio iónico e partes integrantes de aminoácidos, ácidos nucleicos, e compostos estruturais. Outros treze são denominados elementos traço (ferro, iodo, cobre, manganês, zinco, cobalto, molibdénio, selénio, crómio, níquel, vanádio, o silício, e arsénico) também são necessários. Alguns outros elementos, tais como lítio, alumínio, flúor e estanho são essenciais com níveis em ultra traço. Alguns elementos apresentam uma pequena essecialidade, devidos suas toxicidades acima de certos níveis. Metais não-essenciais, tais como mercúrio e cádmio também pode afetar organismos induzindo deficiências de elementos essenciais de moléculas importantes (WALKER et al., 2012)
As doenças que podem ser adquiridas pelo ser humano através da exposição
A Quadro 1 apresenta algumas atividades industriais em que são produzidos efluentes com metais pesados (MOURA, 1997; CLARISSE et al., 1999; VOLESKY, 2001; MAGOSSI e BONACELLA, 2006; MOHAN e PITTAMAN Jr., 2006).
Quadro 1– Atividades industriais e os metais pesados que são encontrados em seus efluentes.
Indústria Metais
Mineração Cu, Zn, Pb, Mn, U, Cr, As, Se Processos metálicos Cu, Zn, Mn
Geração de energia elétrica pela queima do carvão Cu, Cd, Mn, Zn Papel Cr, Cu, Hg, Pb, Ni, Zn
Fertilizantes Cd, Cr, Cu, Fe, Hg, Mn, Pb, Ni, Zn, Al, As Petroquímica Cd, Cr, Ag, Pb, Ni, Zn
Refinarias de petróleo Cd, Cr, Cu, Hg, Mn, Pb, Ni, Zn, As, Fe Usinas Siderúrgicas Cd, Cr, Cu, Ag, Pb, Ni, Sn, Zn
Galvanoplastia Cd, Cr, Cu, Ni, Zn, Al Vidro, cimento e amianto Cr, As
Álcalis, cloro e produtos inorgânicos Cd, Cr, Hg, Pb, Sn, Zn Curtimento de couro Cr
Produtos têxteis Cr
Automóvel Cd, Cr, Fe, Pb, Ni, Zn, Sn, Aço Cd, Cr, Fe, Pb, Ni, Zn, As
Produtos químicos orgânicos Cd, Cr, Fe, Hg, Pb, Zn, Al, As, Sn Produtos químicos inorgânicos Cd, Cr, Fe, Hg, Pb, Zn, Al, As Drenagem ácida de minas Cr, Cu, Mn, Al, Zn
Fonte: Moura, 1997; Clarisse et al., 1999; Volesky, 2001; Magossi e Bonacella (2006); Mohan e Pittaman Jr., 2006.
Nos últimos anos o desenvolvimento industrial tem provocado o aumento da quantidade de metais pesados em águas, pois vêm sendo descartados pelas indústrias em níveis cada vez maiores apesar das legislações rígidas sobre o despejo desses produtos tóxicos no meio ambiente, consequentemente apresentando uma ameaça aos ecossistemas (LIN et al., 2000; ZOU et al., 2004; UNLU e ERSOZ, 2007). Dentre estes metais o arsênio, cádmio, cromo e mercúrio (BHATTACHARYYA e GUPTA, 2008).
3.2.1.1 Cromo Hexavalente
A principal fonte do cromo é o mineral cromita (FeOCr2O2), pois este elemento
na sua forma metálica não ocorre naturalmente. O cromo existe em diversos estados
de oxidação (Quadro 2), entretanto o Cr3+ e Cr6+ são suficientemente estáveis para
ocorrer no ambiente (ZAYED e TERRY, 2003).
complexante, que não H2O e OH-. As linhas verticais tracejadas representam a faixa
de pH normal das águas naturais e zona cinza mostra a estabilidade do Cr(OH)3(s)
para concentração 10-6 mol.L-1 de cromo total (RAI et al., 1987; NIEBOER e JUSYS,
1988; RAI et al., 1989; RICHARD e BOURG, 1991; BALL e NORDSTROM, 1998).
Quadro 2 – Número de oxidação do cromo e suas principais características.
Estado de
Oxidação Exemplos Observações
Cr0 Não ocorre naturalmente Cr2+ CrBr
2, CrCl2, CrF2 , CrSe,
Cr2Si
Relativamente instável e pronto para ser oxidado para Cr3+
Cr3+ CrB, CrB2, CrBr3,
CrCl3.6H2O, CrCl3,
CrF3,CrN,
KCr(SO4)2.12H2O
Compostos de forma estável e ocorre na natureza na forma de mineral, como a cromita (FeCr2O4)
Cr4+ CrO2, CrF4 Não ocorre naturalmente e representa um importante
intermediário da redução entre o estados Cr6+ e Cr3+. È dificilmente detectado experimentalmente
Cr5+ CrO
43- Não ocorre naturalmente. Representa um importante
intermediário que influencia a razão de redução do Cr6+ Possui tempo de meia vida, podendo ser facilmente detectado
Cr6+ (NH4)2CrO4, BaCrO4,
CaCrO4, K2CrO4, K2Cr2O7
O segundo estado de oxidação mais estável. Raramente, ocorre na natureza, sendo introduzido na natureza por fontes antropogénicas
Fonte: Zayed e Terry, 2003.
Figura 1 – Diagrama de Pourbaix para espécies de cromo.
De acordo com a Figura 1 o Cr3+ é o estado de oxidação termodinamicamente
mais estáveis sob condições redutoras, enquanto que o Cr6+ pode permanecer
estáveis por períodos de tempo significativos (MOHAN e PITTAMAN Jr., 2006). O
Cr3+ predomina em pH < 3,0. Em pH > 3,5, a hidrólise aquosa de Cr3+ produz
espécies de hidroxi cromo trivalente [CrOH2+, Cr(OH)2+, Cr(OH)30 e Cr(OH)4-]. O
Cr(OH)3é a única espécie sólidos, existente como um precipitado amorfo (US EPA,
2000).
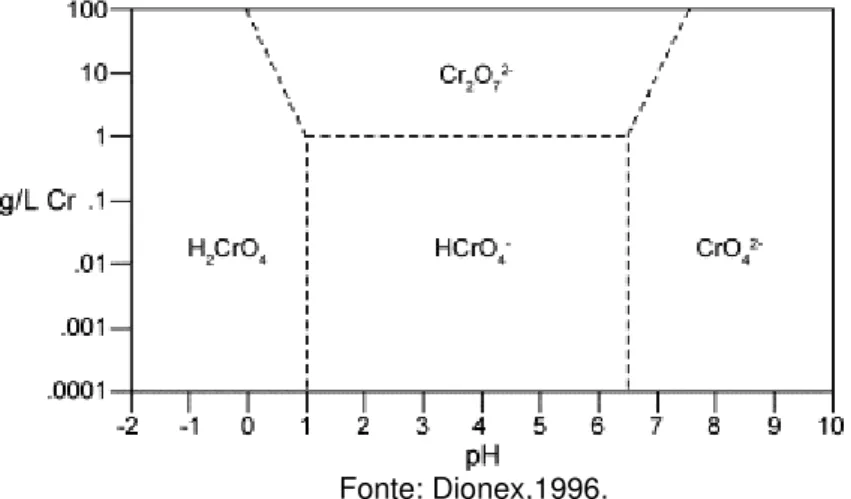
A Figura 2 apresenta as formas químicas do Cr6+ em função do pH. O Cr6+,
normalmente, está presente em solução na forma de íon hidrocromato (HCrO4-), íon
dicromato (Cr2O72-) e íon cromato (CrO42-) dependendo do pH da solução
(RAMIREZ-DIAZ et al., 2008). Ou seja, em soluções com pH > 6, o CrO3 forma
CrO4-2; quando o pH está no intervalo de 1 a 6, o HCrO4- e o Cr2O72- estão em
equilíbrio; e para valores de pH < 1, H2CrO4 é a principal especie (MOHAN e
PITTAMAN Jr., 2006).
Esses íons são soluveis e, desta forma, apresentam mobilidade no ambiente.
Entretanto, oxiânions de Cr6+ são reduzidos a cromo Cr3+ por doadores de elétrons
presentes no solo, água e atmosfera (KOTA e STASICKA 2000).
Figura 2 – Diagrama de distribuição das espécies de Cr6+ em função do pH a 25 ºC e 1 mol.L-1.
Fonte: Dionex,1996.
O metal cromo, no seu estado como Cr6+ apresenta elevada solubilidade,
mobilidade e disponibilidade quando comparados com os compostos de Cr3+
(KOTA e STASICKA 2000; JEYASINGH e PHILIP 2005), e ainda, estima-se que o
Cr6+ seja 10-100 vezes mais tóxico que o Cr3+ (VITI et al., 2006), provavelmente
pelo forte potencial de oxidação e a capacidade do Cr6+ conseguir penetrar
RAJESH, 2009), acumulando-se na cadeia alimentar e causando sérios problemas
de saúde (PATRA et al., 2010; FU e WANG, 2011).
O Cr6+ é um forte oxidante, com elevado potencial redox no intervalo de 1,33
a 1,38 eV, sendo, consequentemente, responsável pela rápida e elevada produção de espécies reativas de oxigênio (ROS) e pela toxicidade que estes representam (SHANKER et al.,2005). Por estas características, é altamente tóxico, cancerígeno e mutagênico, além de causarem nos seres humanos doenças como náuseas, vômito, diarréia, danos ao fígado e rins, choque cardiovascular, perda de sangue no trato gastrointestinal, dermatites alérgicas crônicas e problemas respiratórios (AGUIAR e NOVAES, 2002; KRISHNA e PHILIP, 2005; RAMIREZ-DIAZ et al., 2008).
A Figura 3 mostra as várias rotas seguidas pelo Cr6+ para atingir a célula, e
consequentemente, desta forma, provocar efeitos carcinogênicos e mutagênicos (CHEUNG e GU, 2007).
Figura 3 –Diagrama representativo da capacidade mutagenica e toxicidade de Cr6+ na célula.
As principais indústrias que produzem resíduos contendo cromo são: metalurgia, curtimento de couro, têxtil, mineração, produção e manufatura de tintas, plásticos, cimento, cerâmica, papel, pilhas, inibidores de corrosão, galvanoplastia, fertilizantes e pesticidas (CLARISSE et al., 1999; VOLESKY, 2001; MAGOSSI e BONACELLA, 2006; BHATTACHARYA et al., 2008).
De acordo com o inciso II no Artigo 16 da resolução 430/2011 do CONAMA,
o limite de descarga do Cr6+ em efluentes aquosos não deve ultrapassar 0,1 mg.L-1.
Logo se faz necessário o tratamento de efluentes, para que possam ser descartados obedecendo à legislação vigente (BRASIL, 2011a).
Geralmente os efluentes com a presença de metais pesados são tratados de pela indústria através da aplicação de processos químicos e físico-quimicos, tais como: elevação de pH, sedimentação e filtração dos compostos insolúveis.
Entretanto os efluentes contaminados por Cr6+ necessitam de um pré-tratamento,
visto que o cromo na forma hexavalente é insolúvel em pH ácido ou alcalino. Por
esta razão os efluentes contendo Cr6+ devem ser separados dos demais para serem
submetidos a este pré-tratamento, o qual consiste na redução do Cr6+ para Cr3+, para
isto são empregados agentes redutores como dióxido de enxofre, sulfato ferroso ou derivados de bissulfito, e em seguida é adicionado ácido, pois a redução ocorre em pH inferior a 2,5 (GIORDANO, 2004).
3.2.2 Tratamento de Efluentes Industriais
Diversos metódos vêm sendo aplicado e aprimorados para o tratamento adequado aos diverso tipos de efluentes que são produzidos, para que atendam as legislações vigentes, e possam ser descartados adequadamente.
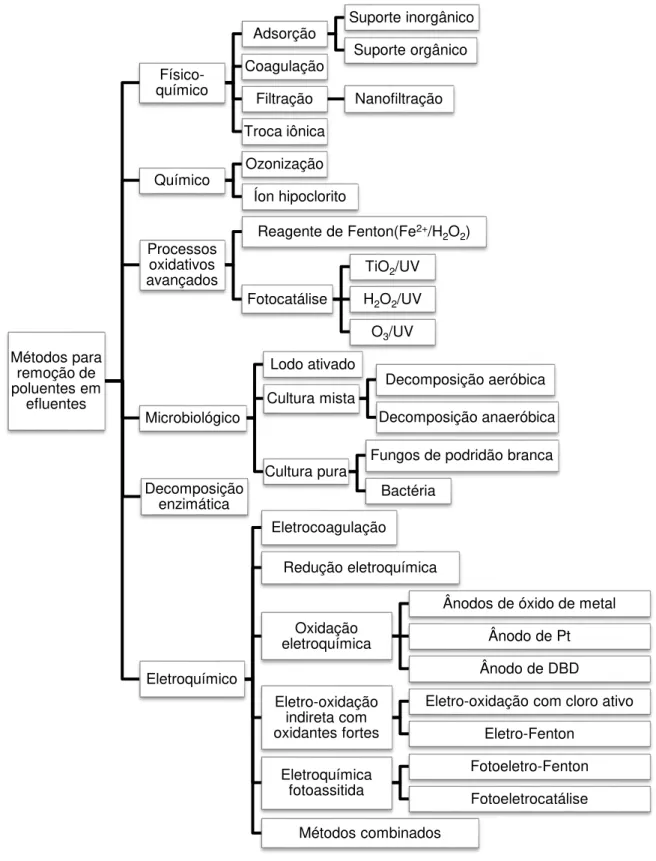
A Figura 4, mostra as metodologias convencionais e as alternativas que vem sendo aplicadas e otimizadas no tratamento de efluentes industriais (MARTINEZ-HUITLE e BRILLAS, 2009).
Embora as metodologias convencionais sejam amplamente exploradas, elas apresentam alguns desvantagens frente as demais tecnologias, por exemplo, o tratamento químico de efluentes demanda transporte, estocagem e manuseio de produtos químicos perigosos, além de proporcionar a geração de lamas tóxicas, enquanto que, processos biológicos são lentos e demandam grandes áreas físicas,
Figura 4 –Principais métodos aplicados para remoção de poluentes em efluentes.
Fonte: Martinez-Huitle e Brillas, 2009. Métodos para
remoção de poluentes em
efluentes
Físico-químico
Adsorção Suporte inorgânico Suporte orgânico Coagulação
Filtração Nanofiltração
Troca iônica
Químico Ozonização Íon hipoclorito
Processos oxidativos avançados
Reagente de Fenton(Fe2+/H 2O2)
Fotocatálise
TiO2/UV
H2O2/UV O3/UV
Microbiológico
Lodo ativado
Cultura mista
Decomposição aeróbica
Decomposição anaeróbica
Cultura pura Fungos de podridão branca Bactéria
Decomposição enzimática
Eletroquímico
Eletrocoagulação
Redução eletroquímica
Oxidação eletroquímica
Ânodos de óxido de metal Ânodo de Pt
Ânodo de DBD
Eletro-oxidação indireta com oxidantes fortes
Eletro-oxidação com cloro ativo
Eletro-Fenton
Eletroquímica fotoassitida
Fotoeletro-Fenton Fotoeletrocatálise
3.2.2.1 Tratamento Eletroquímico
Um processo muito estudado e bastante promissor na atualidade é o eletroquímico, onde através da ação do próprio elétron, as substâncias tóxicas e nocivas ao meio ambiente são removidas ou transformadas através de reações de óxido-redução em substâncias menos tóxicas. A tecnologia eletroquímica apresenta as seguintes vantagens (RAJESHWAR e IBANEZ, 1997, BRILLAS et al., 2003, MARTINEZ-HUITLE e FERRO, 2006):
versatilidade;
relativa disponibilidade de energia elétrica;
condições energéticas reacionais reduzidas (processos a frio);
compatibilidade ambiental, pois não utiliza produtos químicos nocivos e
prejudiciais ao meio ambiente;
sistemas altamente reprodutíveis e facilmente controláveis permitindo a
automação e montagem de plantas relativamente compactas;
efetividade da relação custo/benefício, podendo ser atingida quando os
sistemas eletroquímicos são projetados com materiais eficientes.
A utilização da eletroquímica, na área ambiental, tem sido aplicada para oxidação de produtos contaminante como é o caso de fenóis (ZAÑARTU et al., 2001; FOCKEDEY e LIERDE, 2002). Outro exemplo de aplicação da eletroquímica é a remoção de fosfato (BEKTAS et al., 2004), eliminação de metais pesados em efluente (RUOTOLO, 2003; GAO et al., 2005; EIBAND et al., 2014), e degradação de corantes (DE OLIVEIRA et al., 2011; SOLANO et al., 2013; ROCHA et al., 2014). Há também aplicações para produção de cloro, ozônio e peróxido de hidrogênio para desinfecção, além de diversos estudos relacionados à remoção de coloides por eletrocoagulação (CRESPILHO et al., 2004).
3.2.2.1.1 Processo de Eletrocoagulação
A eletrocoagulação (EC) é um processo eletroquímico que se baseia na
geração de coagulantes in situ através da dissolução eletroquímica de um metal (Al
ou Fe) cujo íon atua como coagulante. Este processo ocorre quando se aplica uma corrente elétrica no ânodo sacrifício (Fe ou Al) imerso no efluente, originando os
utilizados, dependendo das características dos efluentes, como pH e a concentração da solução. Estas espécies atuam como coagulantes ou desestabilizador que causam a neutralização das cargas para a separação de poluentes dos efluentes. Enquanto que no cátodo ocorre à liberação de gás hidrogênio devido à eletrólise da
água (GREGORY e DUAN, 2001; BARRERA-DIAZ et al., 2003; SILVA e MAINIER,
2005; MARTINEZ-HUITLE e BRILLAS, 2009; FERNANDES et al., 2014).
Devido à complexidade dos fenômenos envolvidos no processo de tratamento eletrolítico de efluentes, estes processos ocorrem de acordo com as sucessivas etapas descritas a seguir (Figura 5), (IBANEZ et al., 1998, CAN et al., 2003, MOLLAH et al., 2004, MODIRSHAHLA et al., 2007; MARTINEZ-HUITLE e BRILLAS, 2009; COMNINELLIS e CHEN 2010):
formação de agentes coagulantes através da oxidação eletrolítica do eletrodo
de sacrifício (Fe/Al), no cátodo ocorre a eletrólise da água, produzindo H2;
desestabilização dos poluentes através dos hidróxidos de Fe ou Al;
agregação das fases desestabilizadas para formar flocos;
remoção do poluente com coagulantes por sedimentação ou por flotação com
a evolução de H2.
Figura 5 –Processo de eletrocoagulação.
A escolha dos materiais que são utilizados no processo de EC é muito importante, sendo o ferro e o alumínio os mais comuns, porque são baratos, eficazes e prontamente disponíveis. Assim, ambos são geralmente aplicados em estudos eletroquímicos.
Quando são utilizados eletrodos de Fe as reações que ocorrem são descritas
nas Equações (1) e (2). A formação de Fe(OH)2 insolúvel pode ser descrita através
da Equação (3) (IBANEZ et al., 1998, DANESHVAR et al., 2006, DANESHVAR et al., 2007; MARTINEZ-HUITLE e BRILLAS, 2009):
Fe → Fe2+ + 2e- (ânodo) (1)
2H2O + 2e- → 2OH + H2(g) (cátodo) (2)
Fe2+ + 2OH-→ Fe(OH)2(s) (3)
O íon hidroxila (OH-) e gás hidrogênio (H2), gerados no cátodo (Equação 2),
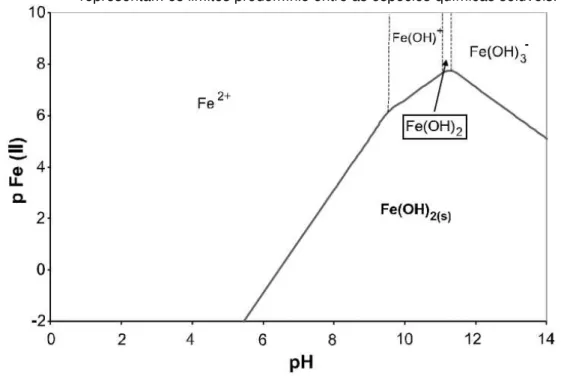
provoca um aumento do pH durante a eletrólise. Conforme a Figura 6, Fe(OH)2
insolúvel precipita em pH > 5,5 e mantém-se em equilíbrio com Fe2+ até pH 9,5 ou
com espécies monoméricas, tais como Fe(OH)+, Fe(OH)
2 e Fe(OH)3- em valores de
pH mais elevados. Consequentemente, o pH é fator condicionante para o favorecimento da formação de compostos de ferro que podem absorver ou co-precipitar os poluentes, e assim promover a qualidade da água (IBANEZ et al., 1998, BARRERA-DIAZ et al., 2003, DANESHVAR et al., 2006, DANESHVAR et al., 2007).
Ainda, na Figura 6 , a linha reta representa a solubilidade de equilíbrio de Fe(OH)2 e
a linha a tracejado representa os limites de dominância entre as espécies químicas solúveis. (BARRERA-DIAZ et al., 2003).
A Equação (4) mostra a reação global do processo de EC utilizando o eletrodo de Fe:
Fe + 2H2O → Fe(OH)2(s) + H2(g) (4)
Na presença de O2 dissolvido, o íon Fe2+ também é oxidado pelo processo
eletrolítico, produzindo Fe(OH)3 insolúvel, e os elétrons podem ser reduzidos
1998, DANESHVAR et al., 2006, DANESHVAR et al., 2007; MARTINEZ-HUITLE e BRILLAS 2009):
4Fe2+ + 10H2O + O2(g)→ 4Fe(OH)3(s) + 8H+ (ânodo) (5)
8H+ + 8e- → 4H2(g) (cátodo) (6)
A Equação (7) mostra a reação global, obtida pela combinação das Equações (1), (5) e (6):
4Fe2+ + 10H2O + O2(g)→ 4Fe(OH)3(s) + 4H2(g) (7)
Contudo, em meio ácido onde o pH < 5, a quantidade do ânodo de Fe dissolvida na solução é maior que a esperada, segundo a lei Faraday, a dissolução do Fe (Equação 1) ocorre devido ao ataque químico (CAÑIZARES et al., 2007).
Figura 6 –Diagrama da zona de predominância para as espécies químicas Fe2+ em solução aquosa, as linhas retas representam o equilíbrio de solubilidade de Fe(OH)2 e as linhas a tracejado
representam os limites predomínio entre as espécies químicas solúveis.
Fonte: Barrera-Díaz et al., 2003.
A Figura 7 mostra que o Fe(OH)3 coagula em pH > 1,0, ou seja, ele está
pode estar em equilíbrio com espécies monoméricas solúveis como Fe3+, Fe(OH)2+,
Fe(OH)2+, Fe(OH)3 e Fe(OH)4- em função do intervalo de pH. Entre eles, os cátions
de hidróxido de ferro têm uma tendência pronunciada para polimerizar na faixa de pH entre 3,5 e 7,0, produzindo desta forma cátions poliméricos, tais como
Fe2(OH)24+ e Fe2(OH)42+ (BARRERA-DIAZ et al., 2003). Enfim, quando os flocos de
Fe(OH)3 insolúveis são produzidos, eles podem remover poluentes dissolvidos por
complexação ou atração eletrostática (RAGHU e AHMED-BASHA, 2007; DANESHVAR et al., 2007), isto dependerá das características dos efluentes.
Figura 7 –Diagrama da zona de predominância para as espécies químicas Fe3+ em solução aquosa, as linhas retas representam o equilíbrio de solubilidade de Fe(OH)3 e as linhas a tracejado
representam os limites predomínio entre as espécies químicas solúveis.
Fonte: Barrera-Díaz et al., 2003.
Quando são utilizados eletrodos de Al as reações que ocorrem durante a eletrocoagulação são descritas nas Equações (8) e (9) (CAN et al., 2003; ALINSAFI et al., 2005; MODIRSHSHLA et al., 2007; DANESHVAR et al., 2007):
Al → Al3+ + 3e– (ânodo) (8)
A Figura 8 mostra que Al3+ é transformado em espécies monoméricas
solúveis, tais como Al(OH)2+, Al(OH)
2+, Al(OH)3 e Al(OH)4-, dependendo da faixa de
pH. Os cátions monoméricos predominam em meio ácido, e Al(OH)4- em meio
alcalino. Estes cátions monoméricos podem evoluir para espécies poliméricas, tais
como Al 2(OH)24+ , Al6(OH)153+, Al7(OH)17 4+ , Al8(OH)204+ , Al13O4(OH)247+ e
Al13(OH)345+ (CAN et al., 2003; KOBYA et al., 2006; DANESHVAR et al., 2007). Os
cátions monoméricos e poliméricos solúveis, podem ser convertidos em flocos de
Al(OH)3 insolúvel através da cinética de precipitação.
Figura 8 –Diagrama de solubilidade de espécies do Al3+ em função do pH.
Fonte: Gregory e Duan, 2001.
A Equação (10) mostra a reação global do processo de EC utilizando o eletrodo de Al:
Al + 3H2O → Al(OH)3(s) + (3/2)H2(g) (10)
Entretanto, quando o cátodo de Al também é utilizado, ele pode ser
quimicamente atacado por OH-, gerado um aumento do pH durante a evolução H2,
de acordo com a Equação (11) (PICARD et al., 2000; CAÑIZARES et al., 2007):
e os efluentes tratados contêm uma quantidade de íons de Al maior do que o
esperado (Equação 8). Entretanto, os ânodos de Fe ou aço não são atacados por
OH -em meio alcalino, evitando assim a formação de um excesso de espécie
Fe(OH)4-.Da mesma forma que ocorre no processo de EC com Fe, a remoção de
poluentes em efluentes utilizando o eletrodo de Al pode ser explicada por complexação ou atração eletrostática (CAN et al., 2003; ALINSAFI et al., 2005; RAGHU e AHMED-BASHA, 2007) .
O processo de eletrocoagulação apresenta muitas vantagens, dentre as quais destacamos as seguintes (LIN e PENG, 1994; BRILLAS et al., 2003; CHEN, 2004):
separação do material de forma mais eficaz e mais rápido do que na
coagulação;
controle do pH não é necessário, exceto para os valores extremos;
A quantidade de produtos químicos necessários é pequena;
A quantidade de lamas produzidas é reduzida em comparação com a
coagulação. Por exemplo, a suspensão formada no processo de EC com Fe contém um maior teor de matéria seca e de sólidos hidrofóbicos do que a
produzida pela ação da coagulação FeCl3, seguido pela adição de NaOH ou
de cal;
Os custos operacionais são muito mais baixos quando comparados a maioria
das tecnologias convencionais.
No entanto, este método apresenta algumas desvantagens (BRILLAS et al., 2003):
A passivação do ânodo e a deposição de lamas nos eletrodos podem inibir o
processo eletrolítico em modo de operação contínua.
As concentrações elevadas de íons de ferro e de alumínio no efluente que
tem de ser removido.