ASSOCIAÇÃO DA ATIVIDADE FÍSICA E DE COMPONENTES DA
DIETA HABITUAL COM ESTRESSE OXIDATIVO E OUTROS
FATORES DE RISCO CARDIOMETABÓLICO EM HOMENS DE
MEIA-IDADE
VIÇOSA
MINAS GERAIS
–
BRASIL
2013
Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência da Nutrição, para obtenção do título de
PAULA GUEDES COCATE
ASSOCIAÇÃO DA ATIVIDADE FÍSICA E DE COMPONENTES DA
DIETA HABITUAL COM ESTRESSE OXIDATIVO E OUTROS
FATORES DE RISCO CARDIOMETABÓLICO EM HOMENS DE
MEIA-IDADE
APROVADA: 16 de dezembro de 2013
______________________________ ______________________________ Eliane Lopes Rosado Leandro Licursi de Oliveira
______________________________ ______________________________
Helen Hermana Miranda Hermsdorff Rita de Cássia Gonçalves Alfenas (Coorientadora) (Coorientadora)
______________________________ Antônio José Natali
(Orientador)
Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência da Nutrição, para obtenção do título de
AGRADECIMENTOS
Primeiramente a Deus, pois foi Ele que me deu forças para percorrer esta jornada e fez com que cada obstáculo fosse um momento de crescimento pessoal e profissional.
Aos meus pais Paulo Roberto Cocate e Déborah Guedes Cocate por sempre terem prezado pela minha educação, incentivando-me em todos os momentos desta jornada com atos de carinho, dedicação, amparo, conselhos e, acima de tudo, com um amor incondicional.
Aos meus irmãos pela amizade e pelo carinho de todas as horas.
Aos meus tios, tias, primos, primas e avós (in memoriam) pelo incentivo e por acreditarem nesta conquista tão desejada.
Ao meu orientador Professor Dr. Antônio José Natali pela dedicação, pelos conselhos, ensinamentos preciosos, pelas reuniões produtivas, correções precisas, pela disponibilidade e cordialidade com que sempre me recebeu. Sou-lhe imensamente grata também por ter-me concedido liberdade de ação, o que permitiu que este trabalho contribuísse para o meu desenvolvimento pessoal e profissional.
À minha coorientadora Professora Dr.a Giana Z. Longo pelas inúmeras ajudas nas Análises Estatísticas, pelas ajudas na revisão dos artigos, pela dedicação, pelo carinho em todas as horas, pela atenção, confiança e transmissão de alegria com sorriso cativante.
À minha coorientadora Professora Dr.a Helen Hermana M. Hermsdorff por tudo, pois não tenho palavras para agradecer tamanha dedicação, disponibilidade e utilidade de suas considerações. Também pela paciência e persistência em ensinar-me novos conhecimentos e pela ajuda incessante na revisão dos artigos. Sua maneira exigente de conduzir as coisas e sua crítica criativa durante todo o processo de elaboração dos artigos científicos facilitaram, sobremaneira, o alcance dos objetivos propostos.
artigos, pelas considerações produtivas, pelo carinho e pela gentileza em todos os momentos.
À minha querida coorientadora ProfessoraDr.a Rita de Cássia G. Alfenas pela sabedoria, pelos ensinamentos construtivos, pela disponibilidade irrestrita, dedicação, ajuda na revisão dos artigos, pelo apoio incessante, pela força, amizade, pelas conversas agradabilíssimas, pelo carinho infinito e por sempre ter acreditado no meu potencial.
A toda a Comissão Orientadora - Professor Dr. Antônio José Natali, Professora Dr.a Rita de Cássia G. Alfenas, ProfessoraDr.a Helen Hermana M. Hermsdorff, ProfessoraDr.a Giana Z. Longo e ProfessoraDr.a Maria do Carmo G. Peluzio-, por ter sido, e ainda ser, fundamental na transmissão de experiências, na criação e solidificação dos saberes que adquiri ao longo desses anos de convivência com essa seleta equipe.
Aos Professores Eliane Lopes Rosado, Antônio José Natali, Rita de Cássia G. Alfenas, Helen Hermana M. Hermsdorff, Leandro Licursi de Oliveira Giana Z. Longo e Thales Nicolau Primola Gomes por terem, gentilmente, aceitado participar da minha banca examinadora.
Ao Professor Dr. Paulo Roberto dos Santos Amorim pela colaboração no Projeto de Pesquisa e na correção do primeiro artigo científico desta tese.
Ao Professor Dr. Leandro Licursi de Oliveira pela ajuda nos cálculos para a estimativa dos marcadores de estresse oxidativo, pela paciência e disponibilidade irrestrita.
Ao Professor Dr. Joaquín H. Patarroylo Salcedo e ao laboratorista Márcio Alberto D. Mendes por terem cedido o “ultra freezer” para o congelamento de material biológico coletado.
Aos bolsistas de Iniciação Científica, em especial Jéssica Buthers, Mateus Freitas e Joel Alves, bem como à mestranda Fernanda R. Faria, pela dedicação e preciosa colaboração na pesquisa de campo.
À minha querida Eliziária C. dos Santos, menina guerreira e de extrema disponibilidade, pelos dias de dedicação, grandiosa competência, extremo cuidado, detalhamento nas análises de relevantes marcadores bioquímicos, carinho e amizade.
Aos voluntários, servidores da UFV, pela participação, apoio, disponibilidade e confiança na equipe desta pesquisa. A colaboração de cada um de vocês foi imprescindível para a concretização deste trabalho.
À equipe do Laboratório de Análises Clínicas da Divisão de Saúde (DSA), em especial ao bioquímico Alexandre Azevedo Novello, aos técnicos Newton Alexandre Camacho Gomide, Pedro Simão Teixeira, Salvador Pena Filho, Alinimarcia de Lima Pataro, Adriana Bhering Fialho e Adriana Gouveia. E também às recepcionistas Cláudia Dinis Pereira e Heliene Gonçalves Mendes, bem como à equipe do Laboratório de Raios X da DSA Wanderson Luís Batista, Divino Paulo de Carvalho e Maria Aparecido Diniz, por terem colaborado com seus conhecimentos, assegurando que este trabalho apresentasse dados confiáveis e de qualidade.
Aos servidores do Departamento de Nutrição e Saúde por sempre terem me tratado com respeito e carinho, e oportunizar o desenvolvimento harmônico deste trabalho; em especial, à Secretária Rita de Cássia S. Lopes pelas preciosas informações, pela disponibilidade, ajuda e cordialidade.
Aos meus colegas do Laboratório de Metabolismo Energético e Composição Corporal Viviane S. Macedo, Fernanda Vidigal, Ana Paula Boroni, José Luiz Rocha, Flávia Galvão e Raquel Duarte M. Alves, bem como às minhas colegas do Laboratório de Bioquímica Nutricional Damiana D. Rosa e Patrícia Fontes pelos empréstimos de equipamentos, disponibilidade em me ajudarem, esclarecimento de dúvidas, apoio e carinho.
Boroni, Patrícia Feliciano e Fernanda Vidigal pelas relevantes contribuições em minha vida e por me ensinarem a grandeza da cooperação e da amizade.
Às minhas amigas Janice Massensine, Aline M. Marchi e Daniela Caldi Cazetta pela confiança, incentivo e constantes palavras de apoio, carinho e amizade.
Ao meu marido Heitor Vieira pelo amor, carinho, admiração e presença constantes com que me apoiou ao longo do período de elaboração desta tese.
À Fundação de Amparo à Pesquisa Estado de Minas Gerais pela concessão da bolsa de estudo e auxílio financeiro para a realização deste estudo.
À Universidade Federal de Viçosa, ao Programa de Pós-Graduação em Ciências da Nutrição e ao Departamento de Nutrição e Saúde pela oportunidade de realizar a Pós-Graduação “Stricto Sensu” nesta Instituição de excelência.
SUMÁRIO
LISTA DE ABREVIATURAS ... vii
RESUMO ... viii
ABSTRACT ... x
1. INTRODUÇÃO GERAL ... 1
1.2. Objetivos ... 5
1.2.1. Objetivo Geral ... 5
1.2.2. Objetivos Específicos ... 5
1.3. Procedimentos metodológicos gerais ... 6
2. ARTIGOS ... 16
2.1. Artigo 1: Benefits and relationship of steps walked per day to cardiometabolic risk factor in brazilian middle-aged men ... 16
2.2. Artigo 2: Habitual dietary glycemic load is associated with cardiometabolic risk factors in physically active Brazilian middle-aged men ... 33
2.3. Artigo 3: Fruit and vegetable intake and related-nutrients are associated with oxidative stress markers in middle-aged men ... 51
2.4. Artigo 4: Red but not white meat consumption is associated with metabolic syndrome, insulin resistance and lipid peroxidation in Brazilian middle-aged men ... 72
3. CONCLUSÕES GERAIS ... 90
4. ANEXOS ... 91
Anexo 1: Aprovação pelo Comitê de Ética em Pesquisa com Seres Humanos da Universidade Federal de Viçosa ... 91
Anexo 2: Questionário para a seleção da população do estudo ... 92
Anexo 3: Termo de Consentimento Livre e Esclarecido ... 94
Anexo 4: Instruções para avaliação da atividade física habitual e ficha de anotações do número de passos diários ... 96
Anexo 5: Instruções para avaliação da composição corporal pela absortometria de feixe duplo de raio-x e realização dos exames bioquímicos ... 97
Anexo 6: Técnica da medida da pressão arterial ... 98
Anexo 7: Ficha de anotação dos dados de avaliação antropométrica, da pressão arterial, composição corporal e bioquímica ... 100
Anexo 8: Questionário de frequência do consumo alimentar ... 101
LISTA DE ABREVIATURAS
8-iso-PGF2α: 8-iso-prostaglandin F2α 8-OHdG: 8-hydroxy-2´-deoxyguanosine ANOVA: analysis of variance
BMI: body mass index BP: blood pressure
CVD: cardiovascular disease DCV: doenças cardiovasculares
DEXA: dual-energy X-ray absorptiometry DM2: type 2 diabetes
DNA: deoxyribonucleic acid FFA: free fatty acids
FFQ: food frequency questionnaire FHL: frutas, hortaliças e legumes FV: fruit and vegetable
GI: glycemic index GL: glycemic load
HDL-c: high density lipoprotein cholesterol
HOMA-IR: homeostasis model assessment of insulin resistance MetS: metabolic syndrome
MUFA: monounsaturated fatty acid ox-LDL: oxidized low density lipoprotein PUFA: polyunsaturated fatty acid
RM: red meat
SFA: saturated fatty acid SM: síndrome metabólica TBF: total body fat
TC: total cholesterol
TG/HDL-C: ratio between triglycerides and high density lipoprotein TG: triglycerides
USDA: United State Department of Agriculture WHO: World Health Organization
RESUMO
COCATE, Paula Guedes, D.Sc., Universidade Federal de Viçosa, dezembro, 2013. Associação da atividade física e de componentes da dieta habitual com estresse oxidativo e outros fatores de risco cardiometabólico em homens de meia-idade. Orientador: Antônio José Natali. Coorientadores: Giana Zarbato Longo, Helen Hermana Miranda Hermsdorff, Maria do Carmo Gouveia Pelúzio, Rita de Cássia Gonçalvez Alfenas.
A síndrome metabólica (SM) e o estresse oxidativo têm sido reconhecidos como importantes fatores de risco cardiometabólico. Entre os principais fatores de risco comportamentais associados à SM e ao estresse oxidativo destacam-se o estilo de vida destacam-sedentário e o padrão alimentar não saudável. Dessa forma, este estudo transversal foi desenvolvido para avaliar a associação da atividade física habitual e de componentes da dieta habitual com fatores de risco cardiometabólico em homens de meia-idade. Dentre os 300 homens servidores da Universidade Federal de Viçosa-MG recrutados, 296 (idade 50,5 ± 3,5 anos e índice de massa corporal 25,8 ± 3,5 kg/m2) completaram todas as etapas do estudo voluntariamente. A atividade física habitual foi avaliada pelo número de passos diários (média de sete dias consecutivos). Variáveis antropométricas (peso, estatura e perímetro da cintura) e clínicas (pressão arterial sistólica e diastólica), a ingestão alimentar habitual (questionário de frequência do consumo alimentar) e o estilo de vida foram avaliados por procedimentos validados. Marcadores metabólicos sanguíneos (perfil glicídico e lipídico), diagnóstico da SM, homeostase da resistência à insulina (HOMA-IR), razão triacilgliceróis e HDL-c e biomarcadores de estresse oxidativo também foram determinados apropriadamente. Verificou-se que a SM, indicadores de adiposidade corporal e resistência à insulina foram significativamente (p< 0,05) inferiores no grupo de indivíduos fisicamente ativos (≥ 10.000 passos/ dia) comparado ao grupo não fisicamente ativo (< 10.000 passos/ dia). Além disso, constatou-se que o número de passos foi negativamente associado com
adiposidade corporal (ginóide, androide e total) e HOMA-IR,
ABSTRACT
COCATE, Paula Guedes, D.Sc., Universidade Federal de Viçosa, December, 2013. Association of physical activity and components of habitual diet with oxidative stress and other cardiometabolic risk factors in middle-aged men. Adviser: Antônio José Natali. Co-adviser: Giana Zarbato Longo, Helen Hermana Miranda Hermsdorff, Maria do Carmo Gouveia Pelúzio, Rita de Cássia Gonçalvez Alfenas.
1. INTRODUÇÃO GERAL
A síndrome metabólica (SM) é caracterizada por um conjunto de anormalidades fisiológicas e metabólicas1 e é reconhecida como significante fator de risco para diabetes mellitus (DM) tipo 22 e para o desenvolvimento e aumento da gravidade de doenças cardiovasculares (DCV) em geral3.
A prevalência desta síndrome é cada vez mais frequente em países em desenvolvimento, atingindo mais de 35% entre os adultos mexicanos4 e em torno de 30% da população adulta de um estado venezuelano5. No Brasil, um recente estudo com uma amostra representativa da população adulta residente na capital (Brasília) constatou prevalência de 32% de indivíduos com SM6.
Os fatores que definem a SM incluem obesidade central, dislipidemia (elevadas concentrações sanguíneas de triacilgliceróis e baixas concentrações de lipoproteína de alta densidade colesterol), elevadas concentrações de glicemia e elevada pressão arterial1. Tais componentes estimulam o aumento da capacidade oxidante bem como a redução da capacidade antioxidante do organismo, criando um desequilíbrio redox que resulta no estresse oxidativo3.
Dessa forma, o aumento das concentrações de radicais livres/espécies reativas manifestadas durante o estresse oxidativo favorece a oxidação de biomoléculas como lipídeos, ácido desoxirribonucleico (DNA) e/ou proteínas7. Nesse sentido, a oxidação de biomoléculas gera metabólitos específicos denominados biomarcadores de estresse oxidativo que são passíveis de avaliação e mensuração em fluídos biológicos8.
O estilo de vida sedentário é um dos principais fatores de risco comportamentais associados à SM16 e ao estresse oxidativo17. Em contrapartida, a prática regular de atividade física tem sido considerada como fator de proteção contra tais complicações metabólicas. A prática de atividade física relaciona-se negativamente com a SM18 e com relevantes fatores de risco para DCV, inclusive com estresse oxidativo19, assim como com melhoria da sensibilidade à insulina20 e aumento da atividade da enzima lipase lipoprotéica que favorece o aumento das concentrações de lipoproteína de alta densidade colesterol e redução das concentrações de triacilgliceróis21.
Tradicionalmente, estudos epidemiológicos nacionais envolvendo a relação do nível de atividade física com parâmetros metabólicos estimam a atividade física habitual por meio de questionários22-24. Dessa forma, para análise mais precisa dessa variável é interessante o uso de instrumentos objetivos, como os sensores de movimento. Nesse sentido, os pedômetros têm sido largamente empregados por serem instrumentos de baixo custo, não invasivo, de fácil interpretação25. Os mesmos têm sido confiáveis para uso em saúde pública26, tendo como meta controlar o volume de atividade física habitual pela contagem do número de passos diários27 o qual está diretamente relacionado com a caminhada, atividade física mais comumente praticada por adultos no Brasil28 e em diversos países29-31. Adicionalmente, estudos atuais32,33
tem constatado relação inversa entre número de passos diários e fatores de risco cardiometabólico, reforçando a relevância de estudos dessa natureza envolvendo indivíduos brasileiros.
elevadas concentrações de triacilgliceróis)40, 41 e com maiores concentrações de biomarcadores de estresse oxidativo42.
Por sua vez, o padrão alimentar saudável inclui a elevada ingestão de frutas, hortaliças e legumes (FHL), exceto tubérculos (ex. batata-inglesa), que tem sido alvo de pesquisas atuais por relacionarem negativamente com SM43 e com estresse oxidativo44. Dessa forma, o consumo adequado de FHL pode
desempenhar um importante papel na prevenção de doenças
cardiometabólicas em indivíduos de meia-idade45. De fato, em recente estudo envolvendo indivíduos brasileiros de ambos os gêneros de mediana idade o consumo adequado de frutas foi associado como fator de proteção contra SM46. A associação inversa do grupo alimentar FHL com doenças crônicas47, fatores de risco cardiovascular48 e estresse oxidativo44, 49 pode ser explicada pelo potencial anti-inflamatório50, 51 e efeitos antioxidantes52-55 de seus componentes.
Figura 1: Fatores de risco e fatores de proteção contra síndrome metabólica, estresse oxidativo e doenças cardiovasculares. RI: resistência à insulina; +: fator de risco; - fator de proteção.
Apesar do descrito anteriormente, estudos sobre a relação entre a atividade física habitual estimada por número de passos, a carga glicêmica da dieta consumida, a ingestão de FHL e de carne vermelha com características clínicas, metabólicas e marcadores de estresse oxidativo na população nacional são ainda escassos.
de carne vermelha62 pode ser um importante fator de risco cardimetabólico; e 5) o consumo nacional de FHL é aproximadamente 90% menor66 do que a quantidade diária recomendada pela WHO (400 g/dia)47, julga-se relevante investigar a relação desses fatores comportamentais com marcadores de estresse oxidativo e outros fatores de risco cardiometabólico envolvendo indivíduos brasileiros de mediana idade.
1.2. Objetivos
1.2.1. Objetivo geral
Investigar a associação da atividade física habitual e de componentes da dieta habitual com SM, biomarcadores de estresse oxidativo e outros fatores de risco cardiometabólico em homens de meia-idade.
1.2.2. Objetivos específicos
1) Avaliar a relação do número de passos com fatores de risco cardiometabólico em brasileiros de meia-idade;
2) Verificar a associação da carga glicêmica da dieta habitual com marcadores de estresse oxidativo e outros indicadores de risco cardiovascular em homens fisicamente ativos de meia-idade;
3) Avaliar a relação entre a ingestão de frutas, hortaliças e legumes e concentrações de biomarcadores de estresse oxidativo em homens de meia-idade;
1.3. Procedimentos metodológicos gerais
O presente estudo possui delineamento transversal e foi desenvolvido no período de março a dezembro de 2011, na cidade de Viçosa-MG, Brasil. A população de referência foi constituída por homens com idade entre 40 e 59 anos, servidores da Universidade Federal de Viçosa (UFV).
Para o cálculo do tamanho amostral foram considerados dados da prevalência de indivíduos fisicamente ativos no tempo de lazer na cidade de Belo Horizonte-MG (16,0%)67 bem como da prevalência estimada de SM em homens brasileiros de meia-idade (24,3%)68, associados ao número total de servidores da UFV (1.744), intervalo de confiança de 95% e erro amostral inferior a 4,5 pontos percentuais. Dessa forma, o número amostral mínimo correspondeu a 273 e 293 indivíduos, respectivamente. Os participantes foram selecionados por amostragem sistemática.
Foram excluídos do estudo indivíduos que autodeclararam apresentar: alterações de peso corporal ≥ 3 kg, alteração do nível de atividade física e dos hábitos alimentares nos três meses anteriores ao início do estudo; doenças tireoidianas, insuficiências cardíacas, doenças cerebrovasculares, doenças infecciosas, doenças inflamatórias, doenças do trato gastrintestinal, doenças hepáticas, doenças renais crônicas e/ou história de litíase renal, câncer nos dez anos anteriores, doenças de transtorno alimentar (bulimia e anorexia) e alergias alimentares. Indivíduos que usavam suplementos vitamínicos, diuréticos ou medicamento que afeta o consumo alimentar e metabolismo de nutrientes, usuários de prótese de membros e que eram atletas de elite também não foram selecionados.
O estudo atende à resolução do Ministério da Saúde 196/96 de pesquisa envolvendo seres humanos e foi aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos da UFV (Of. Ref. n. 069/2010/CEPH) (Anexo 1). Os voluntários que concordaram participar da pesquisa assinaram o termo de consentimento livre e esclarecido (Anexo 3).
como, exames bioquímicos sanguíneos (perfil lipídico, perfil glicídico e um marcador de estresse oxidativo plasmático) e urinários (marcadores de estresse oxidativo) que estão detalhados na metodologia dos artigos científicos apresentados a seguir. Nesse mesmo dia foi aplicado um questionário de frequência do consumo alimentar para estimativa da ingestão alimentar habitual dos participantes. Após o cumprimento das etapas mencionadas os resultados das avaliações antropométricas, da composição corporal e dos exames bioquímicos foram apresentados aos voluntários e indicavam a busca de um profissional especializado caso houvesse alguma alteração nos parâmetros analisados segundo classificações validadas e condizentes com padrão “adequado” de saúde de homens da meia-idade (Figura 2).
Figura 2: Recrutamento dos participantes e etapas realizadas ao longo do estudo. a: Anexo 2; b: Anexo 3; c: Anexo 4; d: Anexo 5; e: Anexo 8; f: Anexo 9.
Figura 3: Principais dados utilizados para a elaboração dos artigos científicos
Referências
1. Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120: 1640-1645.
2. Ford ES. Risks for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome: a summary of the evidence. Diabetes Care 2005; 28: 1769-1778.
3. Hutcheson R, Rocic P. The metabolic syndrome, oxidative stress, environment, and cardiovascular disease: the great exploration. Exp Diabetes Res 2012; 2012: 271028.
4. Rojas R, Aguilar-Salinas CA, Jimenez-Corona A, Shamah-Levy T, Rauda J, Avila-Burgos L, et al. Metabolic syndrome in Mexican adults: results from the National Health and Nutrition Survey 2006. Salud Publica Mex 2010; 52 Suppl 1: S11-18.
5. Florez H, Silva E, Fernandez V, Ryder E, Sulbaran T, Campos G, et al. Prevalence and risk factors associated with the metabolic syndrome and dyslipidemia in White, Black, Amerindian and Mixed Hispanics in Zulia State, Venezuela. Diabetes Res Clin Pract 2005; 69: 63-77.
6. Dutra ES, de Carvalho KM, Miyazaki E, Hamann EM, Ito MK. Metabolic syndrome in central Brazil: prevalence and correlates in the adult population. Diabetol Metab Syndr 2012; 4: 20.
7. Barbosa KBF, Costa NMB, Alfenas RCG, De Paula SO, Minim VPR, Bressan J. Oxidative stress: concept, implications and modulating factors. Rev Nutr 2010; 23: 629-643.
8. Vasconcelos SM, Goulart MOF, Moura JBdF, ManfrediniI V, Benfato MS, Kubota LT. Espécies reativas de oxigênio e de nitrogênio, antioxidantes e marcadores de dano oxidativo em sangue humano: principais métodos analíticos para sua determinação Quím Nova 2007; 30: 1323-1338.
10. Kim JY, Lee JW, Youn YJ, Ahn MS, Ahn SG, Yoo BS, et al. Urinary levels of 8-iso-prostaglandin f2alpha and 8-hydroxydeoxyguanine as markers of oxidative stress in patients with coronary artery disease. Korean Circ J 2012; 42: 614-617.
11. Kaviarasan S, Muniandy S, Qvist R, Ismail IS. F(2)-isoprostanes as novel biomarkers for type 2 diabetes: a review. J Clin Biochem Nutr 2009; 45: 1-8. 12. Duarte M, Moresco RN,Bem AF. Assays for measurement of oxidized low density lipoprotein and its application as a marker of cardiovascular risk. RBAC 2008; 40: 101-106.
13. Homma Y. Predictors of atherosclerosis. J Atheroscler Thromb 2004; 11: 265-270.
14. Mayne ST. Antioxidant nutrients and chronic disease: use of biomarkers of exposure and oxidative stress status in epidemiologic research. J Nutr 2003; 133 Suppl 3: 933S-940S.
15. Wu LL, Chiou CC, Chang PY, Wu JT. Urinary 8-OHdG: a marker of oxidative stress to DNA and a risk factor for cancer, atherosclerosis and diabetics. Clin Chim Acta 2004; 339: 1-9.
16. Mohan V, Gokulakrishnan K, Deepa R, Shanthirani CS, Datta M. Association of physical inactivity with components of metabolic syndrome and coronary artery disease--the Chennai Urban Population Study (CUPS no. 15). Diabet Med 2005; 22: 1206-1211.
17. Bartfay W, Bartfay E. A Case-Control Study Examining the Effects of Active Versus Sedentary Lifestyles on Measures of Body Iron Burden and Oxidative Stress in Postmenopausal Women. Biol Res Nurs 2013.
18. Zhou J, Zheng Q, Xu T, Liao D, Zhang Y, Yang S, et al. Associations Between Physical Activity-related miRNAs and Metabolic Syndrome. Horm Metab Res 2013.
19. Venkatasamy VV, Pericherla S, Manthuruthil S, Mishra S, Hanno R. Effect of Physical activity on Insulin Resistance, Inflammation and Oxidative Stress in Diabetes Mellitus. J Clin Diagn Res 2013; 7: 1764-1766.
21. Prado ES, Dantas EHM. Efeitos dos exercícios físicos aeróbio e de força nas Lipoproteínas HDL, LDL e lipoproteína(a). Arq Bras Cardiol 2002; 79: 429-433.
22. Pitanga CPS, Oliveira RJ, Lessa I, Costa MC, Pitanga FJG. Physical activity as a protective factor against cardiovascular comorbidities in obese women. Rev Bras Cineantropom Desempenho Hum 2010; 12: 324-330.
23. da Costa FF, Montenegro VB, Lopes TJA, Costa EC. Combination of Risk Factors for Metabolic Syndrome in the Military Personnel of the Brazilian Navy. Arq Bras Cardiol 2011; 97: 485-492.
24. Leitão MPC, Martins IS. Prevalence and factors associated with metabolic syndrome in users of primary healthcare units in São Paulo-SP, Brazil. Rev Assoc Med Bras 2012; 58: 60-69.
25. Bassett DR, John D. Use of pedometers and accelerometers in clinical populations: validity and reliability issues. Physical Therapy Reviews 2010; 15: 135-142.
26. Craig CL, Cragg SE, Tudor-Locke C, Bauman A. Proximal impact of Canada on the Move: the relationship of campaign awareness to pedometer ownership and use. Can J Public Health 2006; 97 Suppl 1: S21-27, S22-29. 27. Tudor-Locke C, Bassett DR, Jr. How many steps/day are enough? Preliminary pedometer indices for public health. Sports Med 2004; 34: 1-8. 28. Malta DC, Moura EC, Castro AM, Cruz DK, Morais Neto OL, Monteiro CA. Padrão de atividade física em adultos brasileiros: resultados de um inquérito por entrevistas telefônicas, 2006. Epidemiol Serv Saúde 2009; 18: 7-16.
29. Stephens T, Jacobs DR, Jr., White CC. A descriptive epidemiology of leisure-time physical activity. Public Health Rep 1985; 100: 147-158.
30. Hughes JP, McDowell MA, Brody DJ. Leisure-time physical activity among US adults 60 or more years of age: results from NHANES 1999-2004. J Phys Act Health 2008; 5: 347-358.
31. Vaz de Almeida MD, Graca P, Afonso C, D'Amicis A, Lappalainen R, Damkjaer S. Physical activity levels and body weight in a nationally representative sample in the European Union. Public Health Nutr 1999; 2: 105-113.
33. Sisson SB, Camhi SM, Church TS, Tudor-Locke C, Johnson WD, Katzmarzyk PT. Accelerometer-determined steps/day and metabolic syndrome. Am J Prev Med 2010; 38: 575-582.
34. Foster-Powell K, Holt SH, Brand-Miller JC. International table of glycemic index and glycemic load values: 2002. Am J Clin Nutr 2002; 76: 5-56.
35. Brand-Miller JC. Glycemic load and chronic disease. Nutr Rev 2003; 61: S49-55.
36. Hardy DS, Hoelscher DM, Aragaki C, Stevens J, Steffen LM, Pankow JS, et al. Association of glycemic index and glycemic load with risk of incident coronary heart disease among Whites and African Americans with and without type 2 diabetes: the Atherosclerosis Risk in Communities study. Ann Epidemiol 2010; 20: 610-616.
37. Vidigal FC, Cocate PG, Pereira LG, Alfenas RCG. The role of hyperglycemia in the induction of oxidative stress and inflammatory process. Nutr Hosp 2012; 27: 1391-1398.
38. Ackermann D, Jones J, Barona J, Calle MC, Kim JE, LaPia B, et al. Waist circumference is positively correlated with markers of inflammation and negatively with adiponectin in women with metabolic syndrome. Nutr Res 2011; 31: 197-204.
39. O'Sullivan TA, Bremner AP, O'Neill S, Lyons-Wall P. Glycaemic load is associated with insulin resistance in older Australian women. Eur J Clin Nutr 2010; 64: 80-87.
40. Denova-Gutierrez E, Huitron-Bravo G, Talavera JO, Castanon S, Gallegos-Carrillo K, Flores Y, et al. Dietary glycemic index, dietary glycemic load, blood lipids, and coronary heart disease. J Nutr Metab 2010; 2010.
41. Liu S, Manson JE, Stampfer MJ, Holmes MD, Hu FB, Hankinson SE, et al. Dietary glycemic load assessed by food-frequency questionnaire in relation to plasma high-density-lipoprotein cholesterol and fasting plasma triacylglycerols in postmenopausal women. Am J Clin Nutr 2001; 73: 560-566.
42. Hu Y, Block G, Norkus EP, Morrow JD, Dietrich M, Hudes M. Relations of glycemic index and glycemic load with plasma oxidative stress markers. Am J Clin Nutr 2006; 84: 70-76; quiz 266-267.
lifestyle factors in young adults: the Bogalusa Heart Study. Public Health Nutr 2009; 12: 2493-2503.
44. Meyer KA, Sijtsma FP, Nettleton JA, Steffen LM, Van Horn L, Shikany JM, et al. Dietary patterns are associated with plasma F(2)-isoprostanes in an observational cohort study of adults. Free Radic Biol Med 2013; 57: 201-209. 45. Lambrinoudaki I, Ceasu I, Depypere H, Erel T, Rees M, Schenck-Gustafsson K, et al. EMAS position statement: Diet and health in midlife and beyond. Maturitas 2013; 74: 99-104.
46. de Oliveira EP, McLellan KC, Vaz de Arruda Silveira L, Burini RC. Dietary factors associated with metabolic syndrome in Brazilian adults. Nutr J 2012; 11: 13.
47. WHO. Diet, nutrition and the prevention of chronic diseases. Geneva: WHO; 2003.
48. Radhika G, Sudha V, Mohan Sathya R, Ganesan A, Mohan V. Association of fruit and vegetable intake with cardiovascular risk factors in urban south Indians. Br J Nutr 2008; 99: 398-405.
49. Thompson HJ, Heimendinger J, Sedlacek S, Haegele A, Diker A, O'Neill C, et al. 8-Isoprostane F2alpha excretion is reduced in women by increased vegetable and fruit intake. Am J Clin Nutr 2005; 82: 768-776.
50. Hermsdorff HH, Zulet MA, Puchau B, Martinez JA. Fruit and vegetable consumption and proinflammatory gene expression from peripheral blood mononuclear cells in young adults: a translational study. Nutr Metab (Lond) 2010; 7: 42.
51. Coelho RC, Hermsdorff HH, Bressan J. Anti-inflammatory properties of orange juice: possible favorable molecular and metabolic effects. Plant Foods Hum Nutr 2013; 68: 1-10.
52. Asemi Z, Samimi M, Tabassi Z, Sabihi SS, Esmaillzadeh A. A randomized controlled clinical trial investigating the effect of DASH diet on insulin resistance, inflammation, and oxidative stress in gestational diabetes. Nutrition 2013; 29: 619-624.
53. Riccioni G, Speranza L, Pesce M, Cusenza S, D'Orazio N, Glade MJ. Novel phytonutrient contributors to antioxidant protection against cardiovascular disease. Nutrition 2012; 28: 605-610.
vegetable diet affect antioxidant capacity in healthy adults. Nutrition 2013; 29: 965-971.
55. Crujeiras AB, Parra MD, Rodriguez MC, Martinez de Morentin BE, Martinez JA. A role for fruit content in energy-restricted diets in improving antioxidant status in obese women during weight loss. Nutrition 2006; 22: 593-599.
56. Gimeno SG, Andreoni S, Ferreira SR, Franco LJ, Cardoso MA. Assessing food dietary intakes in Japanese-Brazilians using factor analysis. Cad Saude Publica 2010; 26: 2157-2167.
57. Pereira RA, Duffey KJ, Sichieri R, Popkin BM. Sources of excessive saturated fat, trans fat and sugar consumption in Brazil: an analysis of the first Brazilian nationwide individual dietary survey. Public Health Nutr 2012: 1-9. 58 Williams P. Nutritional composition of red meat. Nutrition & Dietetics 2007; 64: S113-S119.
59. Babio N, Sorli M, Bullo M, Basora J, Ibarrola-Jurado N, Fernandez-Ballart J, et al. Association between red meat consumption and metabolic syndrome in a Mediterranean population at high cardiovascular risk: cross-sectional and 1-year follow-up assessment. Nutr Metab Cardiovasc Dis 2012; 22: 200-207. 60. Micha R, Michas G, Mozaffarian D. Unprocessed red and processed meats and risk of coronary artery disease and type 2 diabetes--an updated review of the evidence. Curr Atheroscler Rep 2012; 14: 515-524.
61. Damiao R, Castro TG, Cardoso MA, Gimeno SG, Ferreira SR. Dietary intakes associated with metabolic syndrome in a cohort of Japanese ancestry. Br J Nutr 2006; 96: 532-538.
62. Pan A, Sun Q, Bernstein AM, Schulze MB, Manson JE, Stampfer MJ, et al. Red meat consumption and mortality: results from 2 prospective cohort studies. Arch Intern Med 2012; 172: 555-563.
63. Mansur AP, Favarato D. Mortality due to Cardiovascular Diseases in Brazil and in the Metropolitan Region of São Paulo: A 2011 Update. Arq Bras Cardiol 2012.
64. Williams PT, Thompson PD. Walking Versus Running for Hypertension, Cholesterol, and Diabetes Mellitus Risk Reduction. Arteriosclerosis, Thrombosis, and Vascular Biology 2013.
66. IBGE. National Household Budget Survey 2008–2009: Analysis of individual food intake in Brazil. Rio de Janeiro: Brazilian Institute of Geography and Statistics, 2011.
67. Brazil. Vigitel Brazil 2010: protective and risk factors for diseases by telephone survey Brasília, DF: Ministry of health, 2011.
2.1. ARTIGO 1
BENEFITS AND RELATIONSHIP OF STEPS WALKED PER DAY TO
CARDIOMETABOLIC RISK FACTOR IN BRAZILIAN MIDDLE-AGED MEN
Benefícios e associação do número de passos diários com fatores de risco cardiometabólico em homens brasileiros de meia-idade
Paula Guedes Cocate, Alessandro de Oliveira, Helen Hermana M. Hermsdorff, Rita de Cássia G. Alfenas; Paulo Roberto S. Amorim; Giana Z. Longo; Maria do Carmo G. Peluzio; Fernanda R. Faria, Antônio José Natali
Journal of Science and Medicine in Sport 2013;
doi:10.1016/j.jsams.2013.04.017
Fator de Impacto (2012): 2,899
Classificação Qualis Nutrição: A2
RESUMO
independentemente da idade, cargo de trabalho, razão TG/HDL-c, prevalência de sobrepeso/obesidade e gordura androide. Adicionalmente, houve correlação negativa do número de passos com gordura corporal total, gordura na região androide e ginóide e HOMA-IR. Conclusão: Homens brasileiros de meia-idade que realizam mais de 10.000 passos diários têm melhores condições cardiometabólica do que aqueles que caminham menos do que 10.000 passos diários. O número de passos/dia é inversamente relacionado com indicadores de obesidade total e regional e com resistência à insulina.
Palavras chave: Atividade física; Envelhecimento; Saúde; Adiposidade; Resistência à insulina; Síndrome metabólica.
ABSTRACT
The number of steps per day is inversely related to the indicators of total and regional adiposity and insulin resistance.
1. Introduction
The prevalence of overweight and obesity has increased at an alarming rate in Brazil, following what appears to be a global trend in contemporary society.1 The last Household Budget Survey 2008–2009 held by the Brazilian Institute of Geography and Statistics in partnership with Ministry of Health evaluated approximately 188 thousand subjects from all over the Brazilian territory of urban and rural areas, ranging from children to seniors, and found that 50.1% and 12.4% of adult men were overweight or obese,respectively.2 Obesity is often associated with the metabolic syndrome (MetS) and is closely related to major public health problems in the world, such as cardiovascular disease and diabetes mellitus type 2.3
2. Methods
This cross-sectional study was carried out between March and December 2011 with men aged between 40 and 59 years, who were staff members of the Federal University of Viçosa (UFV), Viçosa city, Brazil. The sample size was calculated by: the total number of male staff members with ages between 40 and 59 years (1744 individuals), confidence level of 95%, 16% expected prevalence of physically active individuals during leisure time11 and 4% sampling error, resulting in 273 participants as a minimum of sample size required. Ten percent was added in the recruitment to the total sample to offset losses and confounding variables. The Epi Info software, version 6.04, for cross-sectional studies was used to estimate sample size.
Participants were recruited by systematic sampling and replaced if they did not meet the inclusion criteria. We excluded those individuals who self-declared the following: body weight alterations greater than 3 kg in the three months preceding the study, altered levels of physical activity and eating habits in the three months preceding the study, thyroid diseases, heart failure, cerebrovascular diseases, infectious diseases, inflammatory diseases, diseases of the gastrointestinal tract, liver disease, chronic kidney disease and/or a history of kidney stones, cancer in the previous ten years, eating disorders (anorexia and bulimia) and food allergies. Individuals using diuretics or drugs that alter food intake and/or the metabolism of nutrients, pacemaker and/or prosthetic limbs users, and elite athletes were also excluded. The study is in accordance with the resolution 196/96 from the Ministry of Health regarding research involving human subjects and was approved by the institutional Human Research Ethics Committee (reference no.069/2010). Informed consent was obtained from all participants and those selected received the results of all tests performed for free.
The selected participants were instructed how to use a digital pedometer, and answered a questionnaire about lifestyle covariates. Two weeks later blood sample collection, anthropometric and body composition measures, and hemodynamic data were obtained after a 12-h fast.
including the weekend (eight continuous days). Participants were instructed to position the pedometer above the iliac crest in the midline of the right thigh, attached to their waist-band during all waking. In addition, they were advised to perform their routine activities and remove the pedometer only when lying down, riding a bicycle or motorcycle, bathing or practicing water activities. The participants were told that the pedometer should be placed back in the waistband immediately after these activities. They were also instructed to record the number of steps shown on the pedometer on a log given at the end of each day before lying down to sleep. On the next day after waking up, participants were told to reset the pedometer and verify if the display showed zero before placed back on the waist band.
To calculate the number of steps per day, the value obtained in the first day was excluded to minimize physical activity behavior changes due to monitoring. The average was obtained from the next 7 days.12 The number of 10,000 steps/day was considered an adequate cut-off point, since it was associated with health-related parameters as well as it was proposed to classify individuals asactive.9 Thus, the participants were placed in groups to reflect different reflect different levels of steps per day and were categorized as Group 1: <10,000 steps and Group 2: ≥10,000 steps. Such methodological procedure of dividing participants into groups of risk has been used in cross-sectional studies previously.13,14
The staff members who participated in this study occupied technical administrative positions, classified as levels A–E, or professors. To evaluate how lifestyle and occupation influenced the level of physical activity they were grouped according to their education level and positions: Group ABC was composed of technical and administrative staff, levels A–C, with an education level up to high school. Group DE was composed of technical and administrative staff, levels D, E and professors. Participants were also asked about smoking and categorized as smokers and nonsmokers.
The participants were instructed not to perform physical activities of medium or high intensity, not to ingest alcohol 48 h prior and to fast for 12 h prior to the anthropometric, blood pressure and body composition measurements, and blood sample harvesting.
index (BMI) was calculated as weight (kg) divided by height squared (m2). We adopted a cut-off of 25.0–29.9 kg/m2 for overweight and ≥ 30 kg/m2 for obesity classification by BMI.15 Waist circumference was measured considering the midpoint between the last rib and the top of the iliac ridge as suggested by the World Health Organization,16 using a flexible, and inelastic tape measure (TR4010, Sanny, São Bernardo do Campo, SP, Brazil). Waist circumference was measured in triplicate and the average value was considered for data analysis.17
Total body scanning with a dual energy X-ray absorptiometry (DXA) (LUNAR, GE, Encore software version 13:31, Madison, WI, USA) was used to assess total body fat percentage. Total body fat was considered the total adiposity indicator. We adopted a cut-off of 21% of total body fat for overweight classification.18 The percentage of fat in the android and the gynoid regions were determined by using the “region of interest” program, according to the manufacturer’s instructions. Waist circumference and android body fat were considered abdominal adiposity indicators. Blood pressure was measured and classified following the guidelines of the VI Brazilian Guidelines on Hypertension.19 It was used an automatic inflation blood pressure monitor (BP3AA1-1, G-Tech, Onbo Electronic Co., Schenzen, China), properly calibrated and registered in ANVISA (no. 80275310004).
Blood samples were collected from the anti-cubital vein and the serum was separated by centrifugation at 2225 × g for 15 min, at room temperature (2–3 Sigma, Sigma Laborzentrifuzen, Osterodeam Harz, Germany).
Blood glucose was measured by the glucose oxidase method using the Cobas Mira Plus equipment (Roche Diagnostics, GmbH, Montclair, NJ, USA). Insulin was measured by electrochemiluminescence using the Modular Analytics (E170, Roche Diagnostics, GmbH, Mannheim, Germany).
Serum total cholesterol, high-density lipoprotein cholesterol (HDL-c) and triglycerides were determined by an enzymatic colorimetric method using Cobas Mira Plus (Roche Diagnostics GmbH, Montclair, NJ, USA). The atherogenic index was calculated by ratio between triglycerides and HDL-c.20
Metabolic syndrome is characterized by an aggregation of relevant risk factors for cardiovascular disease, such as abdominal obesity, dyslipidemia, high blood pressure and high fasting blood glucose.3 Metabolic syndrome, was diagnosed by using the ethnic value for Central America and South America: waist circumference ≥ 90 cm (specific value for men)23
with two or more of the following alterations: systolic blood pressure ≥ 130 mmHg or diastolic blood pressure ≥ 85 mmHg, fasting HDL-c < 40 mg/dL, fasting glucose ≥ 100 mg/dL and fasting triacylglycerol ≥ 150 mg/dL.3
The Skewness and Kurtosis test was used to evaluate the normality of the assessed data set. Data were exposed by descriptive statistics consisting of mean, standard deviation, median deviation and interquartile range for continuous variables and frequency for categorical variables.
The Student’s t test was used for independent samples and its nonparametric equivalent, the Mann–Whitney test, was used for the differences between mean values per group. The Chi-square test compared proportions and analyzed the associations between categorical variables.
To examine the adjusted effects of the number of steps in relation to the variables, multiple linear regressions were used considering the body composition variables obtained from DXA and all metabolic variables (glucose, total cholesterol, HDL-c, triglycerides, ratio triglycerides/HDL-c and HOMA-IR) as dependent variables and the number of steps as the main independent variable. Those models were controlled by variables defined as confounding factors. Among the tested regression models only those in which the number of steps was statistically significant (p < 0.05) are presented. The Spearman correlation coefficient was used to investigate the correlation of the number of steps with total and regional body fat, adiposity and insulin resistance (p < 0.05). Data processing and analysis were performed by using the STATA software, version 9.1.
3. Results
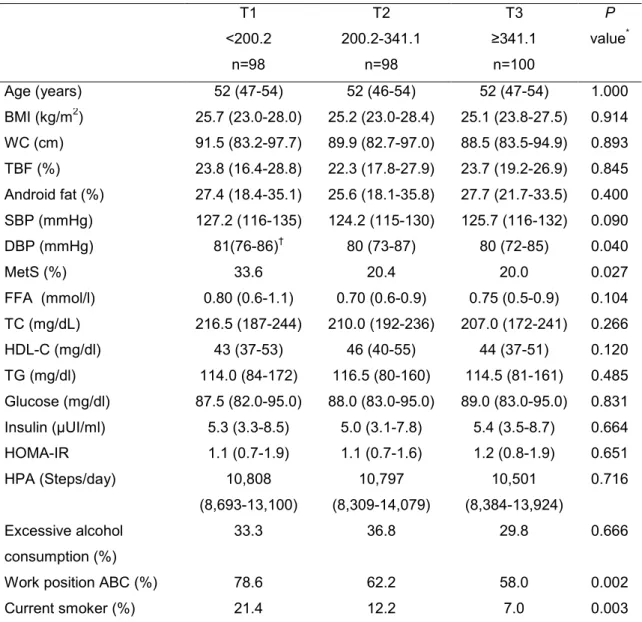
Anthropometric measures, body composition, clinical, metabolic and lifestyle characteristics are shown in Table 1, according to the category of the subjects as to the number of steps/day (<10,000 steps vs. ≥10,000 steps). All adiposity indicators and overweight prevalence from BMI data were significantly higher in participants from the Group <10,000 steps compared to the Group ≥10,000 steps. Among the clinical and metabolic parameters, higher values of insulin, triglycerides, HOMA-IR and triglycerides/HDL-c ratio were found in Group <10,000 steps compared to Group ≥10,000 steps (Table 1). A tendency (p = 0.07) for higher values of HDL-c in Group ≥10,000 steps compared to Group <10,000 steps was observed. Despite that, there were no statistical differences between groups for blood pressure, obesity, blood glucose and total cholesterol.
Table 1
Characteristics of the participants, presented by the number of steps per day.
Variables
<10,000 steps groupa
(n=123)
≥10,000 steps groupa
(n=176) p-Valueb
Age (years) 51 (46-54) 52 (47-54) 0.419
Steps per day (steps) 7,458 (1,984) 13,561 (2,779)c < 0.001
Waist circumference (cm) 91.3 (85.1-97.1) 88.5 (81.0-95.7)c 0.038
BMI (kg/m2) 25.5 (23.9-28.3) 24.9 (22.7-27.6)c 0.040
Overweight by BMI (%) 49.6 36.5c 0.024
Obesity by BMI (%) 12.2 12.9 0.852
Fat in the region gynoid (%) 29.0 (26.1-33.8) 25.8 (19.9-30.8)c < 0.001
Fat in the region android (%) 28.8 (23.0-35.8) 24.2 (14.9-32.4)c < 0.001
Total body fat (%) 25.1 (0.5) 20.8 (0.6)c < 0.001
Overweight/obesity by TBF(%) 79.7 54.5c < 0.001
Systolic BP (mm Hg) 123 (115-134) 126 (117-131) 0.777
Diastolic BP (mm Hg) 82 (10) 80 (9) 0.100
Glucose (mg/dL) 88.0 (83.0-95.0) 89.0 (83.0-95.0) 0.870
Insulin (µUI/mL) 6.5 (4.1-8.9) 4.4 (3.0-7.0)c < 0.001
HOMA-IR 1.43 (0.94-2.01) 0.99 (0.65-1.57)c < 0.001
Total cholesterol (mg/dL)
211.0
(188.0-241.0)
211.5
(183.0-241.0)
0.720
HDL-c (mg/dL) 43.0 (37.0-50.0) 45.5 (39.0-54.5) 0.070
Triglycerides (mg/dL) 138.0 (97.0-190.0) 105.5 (75.0-144.5)c 0.001
Triglycerides/HDL-c 3.2 (1.8-4.8) 2.3 (1.5-3.6)c < 0.001
Smoker (%) 11.4 14.8 0.340
ABC staff position (%) 48.0 80.7c < 0.001
DE professor position (%) 52.0 19.3c < 0.001
a
Data are mean (SD), median (interquartile range) and frequency for normally distributed, non-normally distributed and dichotomous variables, respectively.
b
p-Value from t-test, Mann-Whitney test and Chi-squared, as appropriate to each variable.
c
Multiple linear regression models were applied for evaluation of the relationship between the number of daily steps and total and regional adiposity. Interestingly, the number of steps was a negative predictor (p < 0.05) for total body fat, android body fat and gynoid body fat (Table 2), independent of age, working position and triglycerides/HDL-c ratio. Concerning the metabolic markers, the number of steps was also negatively associated with HOMA-IR, a recognized insulin resistance indicator (Table 2), independently of age, working position, android fat, overweight/obesity prevalence, and triglycerides/HDL-c ratio.
Table 2
Multiple linear regression models with the number of steps per day as the main independent variable.
Dependent variables β CI 95% R2 p-Value
Total body fat (%)a -0.000303 -0.0005; -0.0001 0.20 0.003c
Android fat (%)a -0.000306 -0.0006;-0.0001 0.19 0.041c
Gynoid fat (%)a -0.000340 -0.0005; -0.0001 0.18 0.001c
HOMA-IRb -0.00002 -0.00005; -0.0000002 0.39 0.034c
a
Models adjusted for age, position (ABC or DE professor) and triglycerides/HDL-c ratio.
b
Model adjusted for age (years), position (ABC or DE professor), fat in the region android (%),
prevalence of overweight/obesity (BMI ≥ 25 kg/m2
) and triglycerides/HDL-c ratio. CI: confidence interval; HOMA-IR: homeostasis model assessment of insulin resistance.
c
Significant relationship.
4. Discussion
The findings of this cross-sectional study confirm our hypothesis that there is an inverse relationship between the number of steps walked per day and cardiometabolic risk factors. We showed lower values for the adiposity indicators (waist circumference, total body fat, android body fat and gynoid body fat) and lower overweight (BMI data) prevalence in participants from the ≥10,000 steps group as compared to those from the <10,000 steps group, as well as a negative relationship of the numbers of steps per day to total body fat, android body fat and gynoid body fat.
Our data show that the number of steps/day was a negative predictive factor for total body fat, android body fat and gynoid body fat. In agreement with these results, another cross-sectional study showed an inverse correlation between the number of daily steps and adiposity in African-American middle-aged women.10 In addition, negative associations between number of steps and BMI and central obesity after adjusted for age, ethnicity, sex, insulin use and number of oral hypoglycemic agents were found in individuals with diabetes mellitus.24
Our findings together with those from the above mentioned studies indicate that the higher the number of steps per day the lower the body adiposity. It suggests that the increase in the number of steps per day would result in reduction of body fat. In fact, an increase of daily steps was associated with reduced BMI and abdominal fat in diabetic patients.24 It is also suggested that there is a dose–response relationship between aerobic exercise, such as brisk walking, and visceral fat reduction in obese subjects with-out metabolic-related disorders.25 In this context, it is noteworthy that current recommendations are made for 150 min of moderate-intensity physical activity each week or for walking 10,000 steps per day for adults to achieve health benefits.9,26
sensitivity, compared with those who practiced a lower number of steps/day.5 Thus, previous studies as well as the present findings suggest an association between increased physical activity and increased insulin sensitivity/decreased insulin resistance. We also observed an inverse relationship between the number of steps per day and MetS. There was a negative correlation between both variables as a function of the lowest frequency of MetS diagnosis in those who practiced ≥10,000 steps per day. Additionally participants in this group had higher levels of HDL-c and lower triglycerides and waist circumference, three components of MetS.
In this sense, the improvement of metabolic syndrome components through the practice of physical exercise is partly related to the reduction of abdominal adiposity. This may occur due to a significant increase in the release of lipolysis-stimulating hormones, which increases blood concentrations of free fatty acids that can be captured and used as an energy source by skeletal muscles.27 Moreover, physical exercise can increase the activity of lipoprotein lipase which leads to reduced concentrations of triacylglycerol and possibly to increased levels of HDL-c.28 Interestingly, the increase in lipoprotein lipase activity can also be obtained by the accumulation of low-intensity physical activity throughout the day,29 and this type of exercise has been negatively associated with waist circumference, an indicator of central adiposity and metabolic syndrome risk scores independent of the time spent on moderate- and high-intensity physical activities.30
Despite the inverse relationship between the number of steps walked per day and cardiometabolic risk factors observed here, there were no statistical differences between the ≥10,000 steps and <10,000 steps groups for blood pressure, blood glucose and total cholesterol. Although moderate walking is thought to promote risk reductions for hypertension, hypercholesterolemia and diabetes mellitus,6 in the present study those individuals who self-declared hypertensive, diabetic or under treatment for dyslipidemia were not included. Therefore, such absences of differences were expected.
variables; all methods for contributing to internal validity of study. And second, pedometers are limited as walking measurement devices because they capture movement only of the lower body in the vertical plane and cannot distinguish the intensity of walking, load carriage as well as between walking on different surfaces or gradients. Thus, our results should be seen as the number of steps only.
5. Conclusion
We conclude that: (a) apparently healthy Brazilian middle-aged men performing ≥10,000 steps per day have better cardiometabolic conditions than those walking <10,000 steps; and (b) the number of steps per day is inversely related to the indicators of total and regional adiposity, insulin resistance and metabolic syndrome in these individuals.
Practical implications
• The practice of accumulating ≥10,000 steps per day can be a useful indicator of protection against insulin resistance and metabolic syndrome in apparently healthy Brazilian middle-aged men.
• The higher the number of steps per day the lower the total body fat, android and gynoid fat and insulin resistance in apparently healthy Brazilian middle-aged men.
• Apparently healthy middle-aged men with low levels of physical activity should be encouraged to increase the number of steps per day to achieve cardiometabolic benefits.
References
1. Caballero B. The global epidemic of obesity: an overview. Epidemiol Rev 2007; 29:1–5.
3. International Diabetes Federation. The International Diabetes Federation consensus worldwide definition of the metabolic syndrome. Available at: http://www.idf.org/webdata/docs/IDFMetadef final.pdf. Accessed 27 April 2012. 4. Eriksson J, Taimela S, Koivisto VA. Exercise and the metabolic syndrome. Diabetologia 1997; 40(2):125–135.
5. Dwyer T, Ponsonby AL, Ukoumunne OC et al. Association of change in daily step count over five years with insulin sensitivity and adiposity: population based cohort study. BMJ 2011; 342:c7249.
6. Williams PT, Thompson PD. Walking versus running for hypertension, cholesterol, and diabetes mellitus risk reduction. Arterioscler Thromb Vasc Biol 2013. http://dx.doi.org/10.1161/ATVBAHA.112.300878.
7. Hallal PC, Dumith SC, Bastos JP et al. Evolution of the epidemiological research on physical activity in Brazil: a systematic review. Rev Saúde Pública 2007; 41(3):453–460.
8. Malta DC, Moura EC, Castro AM et al. Padrão de atividade física em adultos brasileiros: resultados de um inquérito por entrevistas telefônicas, 2006. Epidemiol Serv Saúde 2009; 18(1):7–16.
9. Tudor-Locke C, Bassett DR. How many steps/day are enough? Preliminary pedometer indices for public health. Sports Med 2004; 34(1):1–8.
10. Thompson DL, Rakow J, Perdue SM. Relationship between accumulated walking and body composition in middle-aged women. Med Sci Sports Exerc 2004; 36(5):911–914.
11. Brazil. Vigitel Brazil 2010: protective and risk factors for diseases by telephone survey, Brasília, DF, Ministry of Health, 2011.
12. Clemes SA, Griffiths PL. How many days of pedometer monitoring predict monthly ambulatory activity in adults? Med Sci Sports Exerc 2008; 40(9):1589– 1595.
13. Barbosa KB, Volp AC, Hermsdorff HH et al. Relationship of oxidized low density lipoprotein with lipid profile and oxidative stress markers in healthy young adults: a translational study. Lipids Health Dis 2011; 10:61.
15. World Health Organization. Obesity: preventing and managing the global epidemic, in Report of a WHO consultation on obesity, Geneva, World Health Organization,1998.
16. World Health Organization. Waist circumferences and waist-hip ratio: report of a WHO expert consultation, Geneva, World Health Organization, 2008.
17. Lohman TG. Advances in body composition assessment, Champaign, IL, Human Kinetics Publishers, 1992.
18. Sociedad Española para el Estudio de la Obesidad. Consenso SEEDO’2000 para la evaluación del sobrepeso y la obesidad y el establecimiento de criterios de intervención terapéutica. Med Clin (Barc) 2000; 115(15):587–597.
19. VI Brazilian guidelines on hypertension. Arq Bras Cardiol 2010; 95(1):1–51. 20. Gaziano JM, Hennekens CH, O’Donnell CJ et al. Fasting triglycerides, high-density lipoprotein, and risk of myocardial infarction. Circulation 1997; 96(8):2520–2525.
21. Matthews DR, Hosker JP, Rudenski AS et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28(7):412–419. 22. Geloneze B, Repetto EM, Geloneze SR et al. The threshold value for insulin resistance (HOMA-IR) in an admixtured population IR in the Brazilian Metabolic Syndrome Study. Diabetes Res Clin Pract 2006; 72(2):219–220.
23. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120(16):1640–1645.
24. Manjoo P, Joseph L, Dasgupta K. Abdominal adiposity and daily step counts as determinants of glycemic control in a cohort of patients with type 2 diabetes mellitus. Nutr Diabetes 2012; 2:1–6.
25. Ohkawara K, Tanaka S, Miyachi M et al. A dose–response relation between aerobic exercise and visceral fat reduction: systematic review of clinical trials. Int J Obes (Lond) 2007; 31(12):1786–1797.
Medicine and the American Heart Association. Med Sci Sports Exerc 2007; 39(8):1423–1434.
27. Curi R, Lagranha CJ, Rodrigues Junior J et al. The krebs cycle as limiting factor forfatty acids utilization during aerobic exercise. Arq Bras Endocrinol Metabol 2003; 47(2):135–143.
28. Grandjean PW, Crouse SF, Rohack JJ. Influence of cholesterol status on blood lipid and lipoprotein enzyme responses to aerobic exercise. J Appl Physiol 2000; 89(2):472–480.
29. Hamilton MT, Hamilton DG, Zderic TW. Role of low energy expenditure and sit-ting in obesity, metabolic syndrome, type 2 diabetes, and cardiovascular disease. Diabetes 2007; 56(11):2655–2667.
2.2. ARTIGO 2
HABITUAL DIETARY GLYCEMIC LOAD IS ASSOCIATED WITH
CARDIOMETABOLIC RISK FACTORS IN PHYSICALLY ACTIVE BRAZILIAN
MIDDLE-AGED MEN
Carga glicêmica da dieta habitual é associada com fatores de risco cardiometabólico em homens brasileiros fisicamente ativos de meia-idade
Paula G. Cocate, Antônio J. Natali, Alessandro de Oliveira, Helen Hermana M. Hermsdorff, Maria do Carmo G. Peluzio, Giana Z. Longo, Jéssica M. Buthers, Eliziária C. dos Santos, Leandro L. de Oliveira, Rita de Cássia G. Alfenas
Nutrición Hospitalaria: Aceito 20/11/13
Fator de Impacto (2012): 1,305
Classificação Qualis Nutrição: B1
RESUMO
Introdução: Os efeitos da carga glicêmica da dieta sobre os fatores de risco cardiometabólico em indivíduos fisicamente ativos não são completamente conhecidos.
Objetivo: Neste estudo transversal a associação da carga glicêmica da dieta habitual com fatores de risco cardiometabólico em homens brasileiros fisicamente ativos foi avaliada.
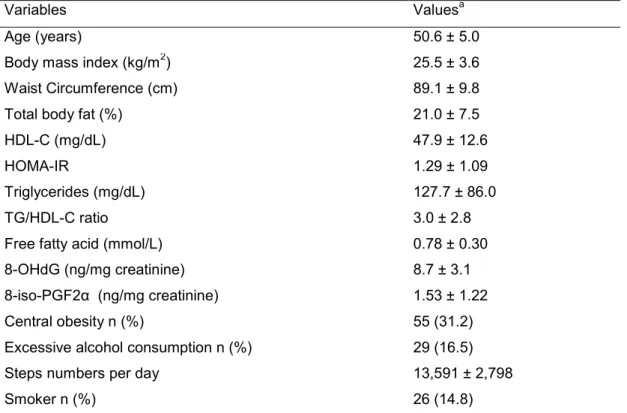
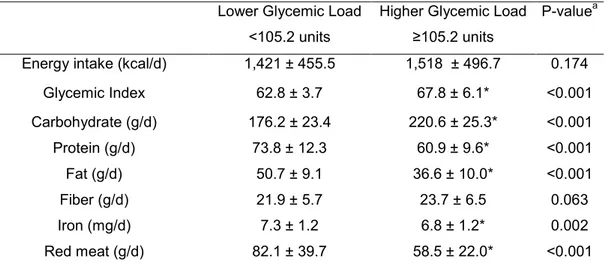
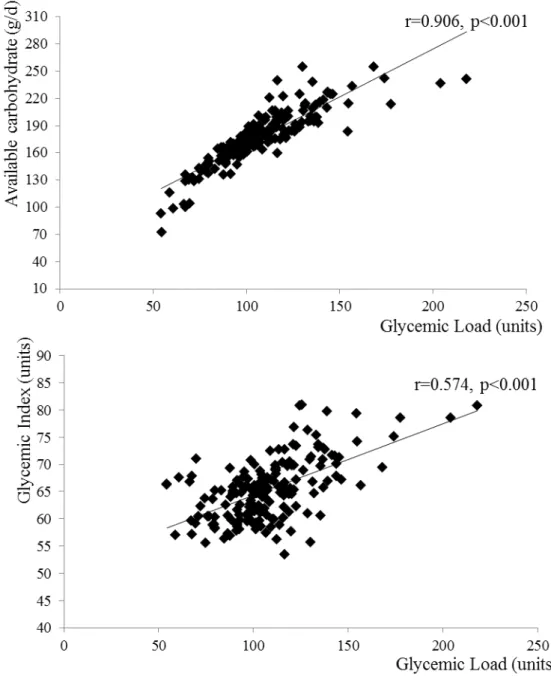
Materiais e Métodos: Cento e setenta e seis indivíduos (Idade: 50,6 ± 5,0 anos, índice de massa corporal: 25,5 ± 3,6 kg/m2) foram avaliados. Dados antropométricos, características de estilo de vida, resistência à insulina (HOMA-IR), biomarcadores de estresse oxidativo (8-iso-prostaglandina F2α; 8-iso-PGF2α e 8-hidroxi-2-deoxiguanosina; 8-OHdG) e perfil lipídico foram determinados. A ingestão alimentar foi estimada por meio de um questionário de frequência do consumo alimentar.
de fatores intervenientes (obesidade central, consumo de carne vermelha, idade e ingestão calórica). O biomarcador de estresse oxidativo, 8-OHdG, também foi associado com a carga glicêmica da dieta habitual (ß=0,432, r2=0,11, valor de p=0,004), independente dos fatores intervenientes previamente mencionados associado com as variáveis: consumo excessivo de álcool, ingestão de ferro e tabagismo.
Conclusão: A carga glicêmica da dieta habitual foi positivamente associada com perfil lipídico (ácido graxo livre e razão triacilgliceróis/HDL-c) e concentrações de 8-OHdG (marcador de estresse oxidativo). Esses resultados indicam um potencial prejuízo da dieta com maior carga glicêmica para fatores de risco cardiometabólico em homens de meia-idade, mesmo sendo fisicamente ativos.
Palavras chave: Hábito alimentar. Carboidrato. Triacilgliceróis. Lipoproteína de alta densidade. Estresse oxidativo.
ABSTRACT
Introduction: The effects of dietary glycemic load (GL) on cardiometabolic risk factors in physically active subjects are not completely known.
Objective: This cross-sectional study assessed the association of habitual dietary GL with cardiometabolic risk factors in physically active Brazilian middle-aged men.
Conclusions: The dietary GL was positively associated with lipid profile (free fatty acid levels and triglycerides/HDL cholesterol ratio) and oxidative stress biomarker (8-OHdG). These results indicate potential harmfulness of diet with higher GL to cardiometabolic risk factors in middle-aged men, even in physically active individuals.
Keywords: Food habits. Carbohydrate. Triglycerides. High-density lipoproteins. Oxidative stress.
Abbreviations
8-iso-PGF2α: 8-iso-prostaglandin F2α
8-OHdG: 8-hydroxydeoxyguanosine
BMI: body mass index
CVD: Cardiovascular diseases
DM2: type 2 diabetes
FFA: Free fatty acids
FFQ: food frequency questionnaire
GI: glycemic index
GL: glycemic load
HDL-C: high density lipoprotein
HOMA-IR: Homeostatic model of assessment of insulin resistance.
NADH: Reduced nicotinamide adenine dinucleotide
NAD+: Oxidized nicotinamide adenine dinucleotide
TG/HDL-C: ratio between triglycerides and high density lipoprotein
Introduction
Cardiovascular diseases (CVDs) are the leading cause of mortality worldwide. The World Health Organization estimated that approximately 30% of deaths from CVDs occurred in the world in 2008 and that this rate will reach higher proportions in 2030.1 The occurrence of these diseases is highly influenced by environmental factors, particularly, the quality of food intake2 and the level of physical activity.3
The role of carbohydrate intake as a risk factor for manifestation of chronic diseases has received important attention in the scientific community. The dietary glycemic load (GL), obtained by multiplying the glycemic index (GI) of a food/meal by its available carbohydrate content,4 reflects the quality and the amount of the consumed carbohydrate. The consumption of high-GL diets leads to postprandial hyperglycemia/hyperinsulinemia, increasing the risk for CVDs.5 Moreover, the increase of dietary GL has been associated with CVDs risk factors, such as reduced levels of high density lipoprotein (HDL-C), high concentrations of triglycerides6-8 and higher levels of oxidative stress marker.9 Thus the dietary pattern adopted by the modern society, characterized by high consumption of carbohydrate-rich foods and high-GI diet10 may increase the risk for CVDs in the population.