UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
CARACTERIZAÇÃO FENOTÍPICA E MOLECULAR DA RESISTÊNCIA ANTIMICROBIANA EM
Acinetobacter sp.: ÊNFASE AOS β-LACTÂMICOS
MARIA CAROLINA SOARES LOPES
CARACTERIZAÇÃO FENOTÍPICA E MOLECULAR DA RESISTÊNCIA ANTIMICROBIANA EM
Acinetobacter sp.: ÊNFASE AOS β-LACTÂMICOS
Trabalho apresentado ao Programa de Pós-Graduação em Ciências Biológicas, da Universidade Federal do Rio Grande do Norte, como requisito para a obtenção do título de Mestre em Ciências Biológicas, área de concentração Biologia Parasitária e Microbiológica.
Profa.Orientadora: Dra. Maria Celeste Nunes Melo
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Lopes, Maria Carolina Soares.
Caracterização fenotípica e molecular da resistência antimicrobiana em Acinetobacter sp: ênfase aos
β-lactâmicos / Maria Carolina Soares Lopes
123 f.: il.
Orientadora: Profa. Dra. Maria Celeste Nunes Melo.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Ciências Biológicas.
1. Infecção hospitalar. – Dissertação. 2. Acinetobacter. – Dissertação. 3. Resistência. – Dissertação. I.
Melo, Maria Celeste Nunes. II. Universidade Federal do Rio Grande do Norte. III. Título.
DEDICATÓRIA
AGRADECIMENTOS
Meus mais sinceros agradecimentos...
À Deus nosso Pai Maior pelo dom da vida e por ter me guiado ao longo desta me enchendo de bênçãos e oportunidades.
Aos meus pais, Rosineide e Luiz que me ensinaram tudo o que sei hoje, pelo apoio constante, pelo amor recebido, por ter cuidado dos meus filhos na minha ausência, por terem aguentado esses anos de luta junto sem nunca desanimarem.
Ao meu grande amor, Ramon, companheiro de todas as horas e maior incentivador, pela paciência, ensinamentos, compreensão e atenção.
Aos meus filhos, minha maior inspiração, minha força, amparo e alegria em todos os momentos.
Aos meus irmãos, Daniele, Rodrigo, Rodolfo, Daniel, João, Maria Luiza, Leonardo e Lula Neto por terem sido um exemplo para mim de união, pela força nos momentos que precisei e também pelo apoio com as crianças.
Aos meus cunhados e cunhadas que têm tanto mérito quanto meus irmãos por tudo o que fizeram por mim.
À grande família Lopes e Rocha Soares por serem tão especiais na minha
vida, por terem me dado exemplos, “empurrões” e amor por todos esses anos.
Aos meus amigos e irmãos em Cristo da Sociedade Espírita Casa do Caminho e do Núcleo de estudos espíritas Sementeira de Luz que foram o meu sustentáculo quando caía, a força que me erguia quando eu mais precisava.
À professora Maria Celeste, minha orientadora e exemplo, por tudo o que me proporcionou ao longo desses dois anos. Pelo tempo de convivência, aprendizado, incentivo, paciência e carinho. Serei eternamente grata por tudo.
Ao professor Ermeton Duarte, pela amizade, respeito e simplicidade. Pelos momentos de descontração, por ter sido um grande companheiro nessa jornada, sempre retirando minhas dúvidas e me direcionando. Agradeço também por ter sido o incentivador inicial.
Às professoras, Claúdia Souza (UFF) e Renata Picão (UFRJ) por terem colaborado cedendo algumas cepas padrões e a professora Beatriz Meurer (UFRJ) por ter colaborado na identificação das amostras de Acinetobacter sp. pelo sistema MALDI-TOFF.
À professora Gilmara Celli pelo auxílio com as análises estatísticas e por ter aceitado o meu convite tão repentinamente. Por ser sempre tão solícita a nos ajudar.
Aos amigos e companheiros do Labmed, Tiago Cidral, Sabina Paulino, Bruna Costa, Juliette Oliveira, Cristiano de Sá, Harrysson, Deyse Félix, Amanda, Ingrid Goes, Felipe, Heloíza, pelo amparo em todos os momentos. Um agradecimento especial à Ana Paula, Emília Sousa, Rafindrade Ganilson e Bruna Évora, alunos de Iniciação Científica que trabalharam ao meu lado, saíram tarde do laboratório, ouviram minhas lamentações, trabalharam fim de semana e se esforçaram ao máximo para que meu trabalho de dissertação fosse finalizado com sucesso.
Ao Dr. Jesaías Rodrigues pela oportunidade de trabalhar no Centro Integrado de Microbiologia (CIM) e assim não só aperfeiçoar o que eu sabia, mas também me deu a chance de conhecer várias pessoas especiais, uma verdadeira equipe. Pela compreensão dos meus momentos de ausência e auxílio para a conclusão do mestrado.
A todos os funcionários e estagiários do CIM que tanto me apoiaram, me cobriram quando não pude ir trabalhar, coletaram as amostras para mim, me deram a oportunidade de compartilhar de grandes momentos, o meu agradecimento!
Aos funcionários dos Hospitais onde foram coletadas as amostras, sempre dispostos a auxiliarem e a tirarem as minhas dúvidas.
Às Meninas do Laboratório de Aulas Práticas de Microbiologia, Érika Galvão e Alessandra Marinho por tudo, tudo mesmo que fizeram por mim ao longo do mestrado. Pelos ouvidos sempre dispostos a me escutarem, pelos conselhos e empréstimos.
Aos funcionários da UFRN, em especial à Lindaci, do qual eu recebia o melhor estímulo para começar um novo dia de experimentos.
Aos colegas da pós-graduação que tanto se importaram com meu projeto, por terem compartilhado comigo esses dois anos maravilhosos.
À Louise da Mata, secretária do PPgCB, por todo auxílio prestado a mim ao longo desses anos, por ter respondido pacientemente todas as minhas dúvidas.
Ao professor Humberto Fulco por tudo o que fez para mim e para o Programa de Pós-Graduação.
Agradeço ao programa de pós-graduação em Ciências Biológicas por ter me acolhido tão bem. Agradeço especialmente aos professores das disciplinas que cursei que auxiliaram no meu crescimento profissional.
Agradeço a Universidade Federal do Rio Grande do Norte por todas as oportunidades fornecidas a mim, de caráter educacional e profissional.
Agradeço a Capes pela concessão da bolsa.
Por fim, agradeço àqueles que direta ou indiretamente me auxiliaram para que essa pesquisa fosse realizada.
“O mundo é a oficina. O corpo é a ferramenta. A
existência é a oportunidade. O dever a executar é
RESUMO
As Infecções Hospitalares constituem a principal causa de morbidade e mortalidade
em pacientes hospitalizados. Relatos de isolamentos de Acinetobacter
multirresistentes a partir de espécimes clínicos obtidos de pacientes internados bem como do ambiente hospitalar são cada vez mais frequentes. Assim, esse estudo teve como objetivo caracterizar fenotipica e molecularmente, isolados de
Acinetobacter sp. quanto à susceptibilidade aos antimicrobianos, com ênfase nos
β-lactâmicos. Isolados clínicos e de superfícies hospitalares de Acinetobacter sp. foram coletados em quatro hospitais localizados na cidade do Natal-RN, no período de março de 2013 a março de 2014. A identificação dos isolados foi realizada
através de provas laboratoriais convencionais, pelo sistema MALDI-TOF e pela
pesquisa do gene blaOXA-51. A susceptibilidade aos antimicrobianos foi avaliada
pela metodologia de disco-difusão. Para a droga tigeciclina, a concentração inibitória mínima (CIM) foi determinada através do E-test. Além disso, foram realizados testes de triagem para as enzimas AmpC, ESBL e Carbapanemases e pesquisa dos genes para as carbapenemases (IMP-1, VIM-1, NDM-1, KPC-2, OXA-23,OXA-24,OXA-58,OXA-143), através da técnica da Reação em Cadeia da Polimerase (PCR). Fatores associados à presença de multirresistência também foram estudados. Foram estudadas 242 amostras, sendo 155 amostras clínicas e 87 amostras das superfícies hospitalares. A média da ocorrência de Acinetobacter sp. nos hospitais estudados foi de 7,6% em amostra clínicas e 12,8% nas amostras das superfícies hospitalares. Neste, os locais mais contaminados por essa bactéria foi a bancada de procedimentos e o piso. Duzentos e trinta e sete amostras
(97,9%) e 198(81,8%) das amostras foram identificadas como A.baumannii pelos
testes convencionais e MALDI-TOF, respectivamente e, a positividade do gene blaOXA-51 ocorreu em 235(97,1%) das amostras. A maioria, 141(58,2%) das cepas de Acinetobacter sp. apresentaram resistência a três ou mais classes de antibióticos. A positividade para o teste de detecção da enzima AmpC foi de 5,8% ,
no Teste de Hodge foi de 61,1% e para o teste de detecção de Metallo β-lactamase
foi de 78,5%. Nenhuma amostra se mostrou produtora de ESBL. Os genes mais
encontrados, foram o blaOXA-23 e blaOXA-143. O uso de dispositivos invasivos
fatores associados à aquisição de cepas de Acinetobacter sp. multirresistente. O óbito foi o desfecho clínico mais frequente(p<0,001) nos pacientes com infecções
por essas cepas. O elevado número de Acinetobacter multirresistente aos
antimicrobianos, isolados a partir de pacientes e sobretudo das superfícies inanimadas dos hospitais é preocupante. Esse cenário pode comprometer tanto os tratamentos empíricos de pacientes em estado grave quanto às estratégias de controle de infecção hospitalar.
ABSTRACT
The Hospital Infections are the main cause of morbidity and mortality in hospitalized
patients. Isolations reports of multidrug-resistant Acinetobacter from clinical
specimens obtained from hospitalized patients and the hospital are more frequent. Thus, this study aimed to characterize molecular and phenotypic isolated from Acinetobacter sp. for susceptibility to antimicrobials, with emphasis on β-lactams. Clinical isolates and hospital surfaces isolates of Acinetobacter sp. were collected in four hospitals located in the city of Natal-RN, from March 2013 to March 2014. The identification of the isolates was carried out by standard laboratory tests, the MALDI-TOF system and research blaOXA-51 gene. The antimicrobial susceptibility was evaluated by disk diffusion method. For tigecycline drug, the minimum inhibitory concentration (MIC) was determined by the E-test. Furthermore, screening tests were performed for AmpC enzymes, and ESBL Carbapanemases and research of genes for carbapenemases (IMP-1, VIM-1, NDM-1, KPC-2, OXA-23, OXA-24, OXA- 58, OXA-143) by technique of polymerase chain reaction (PCR). Factors associated with the presence of multidrug resistance were also studied. 242 samples were studied, with 155 clinical samples and 87 samples of hospital surfaces. The mean occurrence of Acinetobacter sp. in the hospitals studied was 7.6% in clinical sample and 12.8% in samples of hospital surfaces. In this, the sites most contaminated by this bacterium was the bench procedures and the floor. Two hundred and thirty seven samples (97.9%) and 198 (81.8%) of the samples were identified as A.baumannii by conventional tests and MALDI-TOF, respectively, and
the positivity of blaOXA-51 gene occurred in 235( 97.1%) samples. Most, 141
(58.2%) of the strains of Acinetobacter sp. They were resistant to three or more classes of antibiotics. A positive test for the detection of enzyme AmpC were 5.8%
in Test Hodge was 61.1% and the β-lactamase Metallo was 78.5% detection test. No samples proved producing ESBL. The genes most commonly found were the blaOXA-23 and blaOXA-143. The use of invasive devices (p = 0.001), the amount of antimicrobials used (p = 0.01), the ICU stay (p = 0.008) and hospitalization in a public hospital (p = 0.05) presented themselves as factors associated with the
acquisition of Acinetobacter sp. strains MDR. Death was the most frequent clinical
of inanimate surfaces in hospitals is disturbing. This scenario may compromise both the empirical treatment of seriously ill patients as the hospital infection control strategies.
LISTA DE FIGURAS
Figura 1- Mecanismos de Resistência em Acinetobacter...Pág.29 Figura 2- Estrutura dos antibióticos β-lactâmicos...Pág.30 Figura 3- Mecanismo de Ação do Sistema MALDI-TOF...Pág.39 Figura 4-Testes bioquímicos utilizados para a identificação de Acinetobacter
sp ...Pág.53 Figura 5- Teste de susceptibilidade a diferentes classes de antimicrobianos
pela técnica de disco-difusão...Pág.54 Figura 6- Perfil de resistência aos antimicrobianos dos isolados clínicos de Acinetobacter...Pág.55 Figura 7- Perfil de resistência aos antimicrobianos dos isolados de
LISTA DE TABELAS
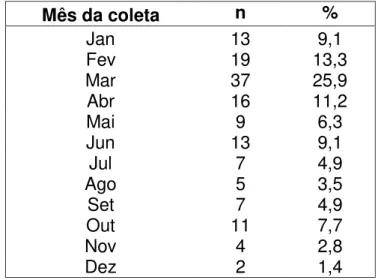
Tabela 1- Espécies de Acinetobacter descritas...Pág.22 Tabela 2- Classificação das Beta-Lactamases...Pág.32 Tabela 3- Iniciadores utilizados no estudo...Pág.43 Tabela 4-Variáveis dependentes analisadas no estudo...Pág.44 Tabela 5-Variáveis independentes qualitativas do estudo...Pág.45 Tabela 6-Variáveis independentes quantitativas do estudo...Pág.46 Tabela 7- Valor absoluto e percentual de Acinetobacter isolados de acordo
com o mês do isolamento...Pág.49 Tabela 8- Análise descritiva das variáveis qualitativas considerando as
amostras clínicas, em números absolutos e percentuais...Pág.50 Tabela 9- Análise descritiva das variáveis qualitativas considerando as
amostras das superfícies hospitalares, em números absolutos e percentuais...Pág.51 Tabela 10- Médias, desvios padrões, medianas e quartis 25 e 75 para as variáveis quantitativas idade; número de comorbidades; número de antimicrobianos utilizados previamente; histórico de trauma, cirurgia ou queimadura; quantidade de dispositivos invasivos; número de antimicrobiano resistente...Pág.52 Tabela 11- Relação entre a média da quantidade de classes de antibióticos resistentes com as variáveis independentes qualitativas para amostras clínicas de Acinetobacter sp...Pág.62 Tabela 12- Análise da presença e ausência de multirresistência com relação
às variáveis independentes qualitativas para amostras clínicas de Acinetobacter sp...Pág.64 Tabela 13 - Relação entre a média da quantidade de classes de antibióticos
LISTA DE SIGLAS OU ABREVIATURAS
ACB- Complexo Calcoaceticus-Baumannii. AIM-“Australian imipenemase”.
AMC- Amoxacilina + Clavulanato.
AMI- Amicacina.
AMK- Ágar Mac Conkey. AMPC- Ampicilinase.
ANVISA- Agência Nacional de Vigilância Sanitária.
APS- Ampicilina+Sulbactam.
AS- Ágar Sangue.
ATCC-“American Type Culture Collection”. BD-“Becton, Dickinson and Company”. BHI- “Brain- Hearth Infusion Ágar”.
CAZ- Ceftazidina.
CDC- “Center for Disease Control and Prevetion”.
CIM- Concentração Inibitória Miníma.
CIP- Ciprofloxacino.
CLSI-“Clinical Laboratory Standart Institute”.
CPM- Cefepime.
CRO- Ceftriaxona.
CTX ou CFA- Cefotaxima.
DIM- ―Deutschland imipenemase”.
DNA- Ácido desoxirribonucléico.
DME- Diagnósticos Médicos Especializados. EDTA- Ácido etilenodiaminotetracético.
EPA- Agência de Proteção Ambiental.
ESBL- Beta-Lactamase de Espectro Estendido.
ESKAPE- Grupo formado por E.coli, S.aureus, K.pneumoniae, A.baumannii, Providencia e Enterobacter.
EUA- Estados Unidos das Américas. FDA-“Food and Drug Administration”.
GEN- Gentamicina.
GIM-“Germany imipenemase”.
IH- Infecções Hospitalares.
IMP- Imipenemase. IPM- Imipenem.
IRAS- Infecções Relacionais à Assistência a Saúde. KHM- ―Kyorin Hospital metallo-β-lactamase”.
KPC- Klebsiella pneumoniae carbapenemase. LABMED- Laboratório de Microbiologia Médica.
MALDI-TOF- “Matrix Associated Laser Desorption-Ionization - Time of
Flight”.
MBL-Metallo_β_lactamases.
MMR- Multiresistente. MER- Meropenem.
NDM- “New Delhi metallo-β-lactamase”.
OXA- Oxacilinase.
PCR- Reação da Polimerase em Cadeia.
pH- Potencial de Hidrogênio.
PIT- Piperacilina + tazobactam.
R- Ribossomal.
RN-Rio grande do Norte.
RNA- Ácido ribonucleico.
S- Subunidade.
SENTRY- Antimicrobial Surveillance Programme SIM- ―Seul imipenemase”.
SPM- São Paulo metallo-β-lactamase. SUT- Sulfametoxazol+ Trimetropim. TBE- Tris-Borato-EDTA.
TET- Tetraciclina. TGC- Tigeciclina. TU- Trato urinário.
TSA- Teste de Susceptibilidade aos Antimicrobianos.
TSI-“Triple Sugar Iron”.
UFC- Unidade Formadora de Colônia.
UFRJ- Universidade Federal do Rio de Janeiro.
UFRN- Universidade Federal do Rio Grande do Norte. UK-“United Kingdom”.
UTI- Unidade de Terapia Intensiva.
LISTA DE SÍMBOLOS
µg-Microgramas
mL-Mililitro
mm- Milímetro
dL-Decilitro
ºC-Grau Celsius
%-Porcentagem.
sp.-Espécie.
spp.-Espécies.
≥- Maior ou Igual a. > - Maior.
<- Menor. β- Beta. L-Litro.
h-Hora.
V-Volts.
X-Vezes.
pb- Pares de bases.
rpm- Rotações por minuto. Min.-Minuto.
n- Número de isolados.
p- Probabilidade de aceitar hipótese de nulidade utilizando nível de
significância de 5%.
RP- Razão de prevalência.
dp- Desvio-padrão.
SUMÁRIO
1. Introdução... Pág.19 2. Referencial Teórico... Pág.20 2.1. Infecções Hospitalares... Pág.20 2.2. O gênero Acinetobacter... Pág.21 2.2.1. Espécies de Acinetobacter de importância clínica... Pág.23 2.2.1.1. A. baumannii... Pág.23 2.2.1.2. A.pittii...Pág.24 2.2.1.3. A. nosocomialis... Pág.25 2.2.1.4. A. calcoaceticus... Pág.25 2.2.1.5. A.radioresistents...Pág.26 2.2.1.6. Outras espécies de Acinetobacter...Pág.26 2.3. Epidemiologia e prevalência por Acinetobacter...Pág.26 2.4. Resistência a antibióticos em Acinetobacter sp...Pág.27 2.4.1 Antimicrobianos β-lactâmicos...Pág.29 2.4.2 A Produção de β-lactamases...Pág.30
2.4.2.1 ESBL(Beta-Lactamase de Expectro Estendido)...Pág.32
2.4.2.2 AmpC ( Ampicilinase) ...Pág.33 2.4.2.3 MBL( Metallo-β-Lactamase) ... Pág.33 2.4.2.4 OXA( Oxacilinase) ... Pág.34
2.4.2.5 KPC(Klebsiella pneumoniae carbapenemase)...Pág.35
3. Objetivos... Pág.36 3.1. Objetivo geral... Pág.36 3.2. Objetivos específicos... Pág.36 4. Metodologia... Pág.37 4.1. Tipo de estudo... Pág.37 4.2. Comitê de Ética em Pesquisa... Pág.37 4.3. Período, local de estudo e recrutamento dos espécimes... Pág.37
4.4. Coleta e Isolamento das amostras das superfícies
hospitalares... ...Pág.37 4.5. Identificação dos isolados de Acinetobacter... Pág.38 4.6. Técnicas utilizadas para os testes de susceptibilidade aos
4.6.1. Kirby-Bauer... Pág.40 4.6.2. Avaliação fenotípica dos mecanismos de resistência... Pág.40 4.6.2.1. Técnica de disco-aproximação para ESBL... Pág.40 4.6.2.2. Técnica de disco-aproximação para AmpC... Pág.40 4.6.2.3. Teste de detecção de Metallo-β-lactamase... Pág.41 4.6.2.4. Teste de Hodge Modificado... Pág.41 4.7. Reação em Cadeia da Polimerase... Pág.41 4.7.1. Extração do DNA... Pág.42 4.7.2. Amplificação do DNA... Pág.42 4.7.3. Eletroforese em gel de agarose... Pág.43 4.8. Coleta de dados sócio-demográficos, comorbidades e relativos à internação... Pág.44 4.9. Elenco das variáveis... Pág.44 4.10. Análise estatística... Pág.46 5. Resultados... Pág.48 5.1 Caracterização da amostra... Pág.48 5.2 Identificação dos isolados de Acinetobacter sp. ... Pág.52 5.3 Caracterização fenotípica da resistência aos antimicrobianos para os
isolados de Acinetobacter sp. ... Pág.54 5.4 Presença dos genes para as carbapenemases (IMP-1, VIM-1,NDM-1,
KPC-2, OXA-23, OXA-24, OXA-51, OXA-58,
OXA-143)... Pág.59 5.5 Relação entre as variáveis dependentes e as variáveis independentes
envolvidas no estudo... Pág.61
6. Discussão... Pág.66 7. Conclusões... Pág.75 8. Referências Bibliográficas... Pág.77 9. Apêndices...Pág.105
9.1 Apêndice A- Questionário utilizado no estudo...Pág.105 9.2 Apêndice B- Amostras clínicas utilizadas no estudo...Pág.106 9.3 Apêndice C- Amostras das superfícies hospitalares utilizadas no
19
1 Introdução
O gênero Acinetobacter vêm emergindo no contexto das doenças graves pela sua alta capacidade de permanecer no ambiente (Peleg, Seifert, Paterson,2008) e pela resistência às drogas antimicrobianas ( Maragakis & Perl, 2008) , existindo cada vez mais relatos de surtos e infecções causadas por esse gênero bacteriano ( van der Irfan et al., 2011) , associadas ,na maioria das vezes, com a mortalidade dentro dos locais de assistência à saúde.
Os mecanismos de resistência aos antimicrobianos em Acinetobacter
são diversos, porém a produção de betalactamases é o mais comumente encontrado (Zavascki et al., 2010) . Vários genes estão envolvidos com a codificação de enzimas que degradam os antibióticos betalactâmicos, antimicrobianos mais utilizados para tratar as infecções por esse gênero.
Determinar o perfil de susceptibilidade aos antimicrobianos para essa bactéria, bem como pesquisar quais mecanismos moleculares estão envolvidos nessa resistência se torna primordial para auxiliar nas ações de controle de infecções e tratamento adequado, consequentemente diminuindo os índices de morbidade e mortalidade.
Baseado na elevada ocorrência do gênero bacteriano Acinetobacter nos hospitais da cidade do Natal e considerando que não foram encontrados relatos de estudos que abordem a resistência aos antimicrobianos assim como os aspectos moleculares dessa resistência no estado do Rio Grande do Norte, esse estudo visa contribuir para um melhor entendimento das características
fenotípicas, moleculares e epidemiológicas da resistência em Acinetobacter,
20
2 Referencial Teórico
2.1 Infecções hospitalares
As Infecções Hospitalares (IH) são complicações relacionadas à assistência à saúde e se constituem na principal causa de morbidade e mortalidade no ambiente hospitalar, gerando prejuízos aos usuários, à comunidade e ao Estado (Oliveira & Maruyama, 2008).
A disseminação de infecções hospitalares ou relacionadas à assistência à saúde frequentemente ocorre pela transferência de patógenos entre as mãos de profissionais de saúde e pacientes, porém, as condições do ambiente hospitalar e características da microbiota endógena do paciente também podem contribuir para disseminação de patógenos (Drees et al., 2008).
Uma pesquisa recente realizada nos Estados Unidos constatou que cerca de 1 em cada 25 pacientes internados em hospitais têm pelo menos uma infecção relacionada à assistência à saúde (IRAS) e cerca de 75 mil pacientes com IRAS morreram durante a hospitalização sendo que mais da metade de todas as infecções hospitalares ocorreu fora da unidade de terapia intensiva (Magill,Edwards,Bamberg, 2014).
No Brasil, existem poucos estudos acerca da magnitude das IRAS. Um estudo nacional avaliou a prevalência destas infecções em hospitais terciários das cinco regiões do país relatando uma taxa de IH de 15,5% (Prade,Oliveira,Rodrigues,1995).
De acordo com o “Center for Disease Control and Prevetion” (CDC,
2013), em 2013 cerca de 16% das IHs foram causadas por microrganismos multirresistentes (MMR). Em 2008, uma denominação foi criada para esses
MMR causadores de IHs, sendo então chamados de “ESKAPE bugs”, pois
tinha como representantes as seguintes bactérias: Enterococcus faecium,
Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii,
21
Alguns estudos observaram também que em surtos hospitalares
destacaram-se as bactérias não fermentadoras de carboidratos Acinetobacter
baumannii e Pseudomonas aeruginosa resistentes aos carbapenêmicos. Observou-se similaridade entre as cepas encontradas em pacientes e aquelas isoladas das superfícies ambientais (Oliveira & Damasceno,2010; Enoch et al., 2008; Simor et al., 2002).
Dentre os dois gêneros de bactérias citados acima se destaca o gênero Acinetobacter por estar associado com alta morbidade e mortalidade em pacientes infectados (Chen et al., 2005).
2.2 O gênero Acinetobacter
O gênero Acinetobacter compreende um grupo heterogêneo de
cocobacilos Gram-negativos não fermentadores de carboidratos, estritamente aeróbios, ubiquitários, imóveis, catalase positiva e oxidase negativa (Montefour, 2008; Peleg,Seifert,Paterson,2008) com 34 espécies validamente nomeadas (Kim et al., 2014; Tabela 1).
Acinetobacter sp. foi descrito pela primeira vez em 1911 pelo microbiologista holandês Beijerinck (Peleg,Seifert,Paterson,2008; Murray & Hospenthal,2008) e ao longo dos últimos 30 anos esse gênero sofreu modificação taxonômica significativa. Atualmente é classificado na ordem Pseudomonadales e família Moraxellaceae (Visca,Seifert,Towner, 2011).
22 Tabela 1- Espécies de Acinetobacter descritas (adaptado de Kim et al., 2014).
Acinetobacter spp comumente isolados de infecções humanas
A. baumannii (genoespécie 2)
A. nosocomialis (genoespécie 13TU)
A. pittii (genoespécie 3)
A. calcoaceticus (genoespécie 1)
Acinetobacter spp incomuns em infecções humanas
A. baylyi A. guillouiae A. lwoffii A. soli
A. beijerinckii A. gyllenbergii A. nectaris A. tandoii
A. bereziniae A. haemolyticus A. parvus A. tjernbergiae
A. boissieri A. harbinensis A. puyangensis A. towneri
A. bouvetii A. indicus A. qingfengensis A. ursingii
A. brisouii A. johnsonnii A. radioresistens A. venetianus
A. gerneri A. junii A. rudis
A. grimontii A. kookii A. schindleri
O gênero Acinetobacter está amplamente distribuído na natureza tendo
sido encontrado em água, solo, lama, organismos vegetais, fezes, urina e como colonizador provisório da pele de seres humanos e animais, além de piolhos
(Zordan et al., 2011; Turton et al., 2010; Peleg,Seifert,Paterson,2008; La Scola
& Raoult, 2004).
Esses microrganismos se tornaram alvo de uma atenção crescente como importante patógeno oportunista, usualmente no contexto de doença
grave subjacente (Visca,Seifert,Towner, 2011; Figueiredo et al., 2009;
23
2.2.1 Espécies de Acinetobacter de importância clínica
2.2.1.1 Acinetobacter baumannii
A espécie Acinetobacter baumannii é um patógeno tipicamente nosocomial, identificado como frequente colonizador humano em pacientes hospitalizados e nos ambientes onde é realizada a prestação de cuidados de
saúde (Dijkshoorn,Nemec, Seifert, 2007). O habitat do A. baumannii não é
típico das outras espécies de Acinetobacter, havendo pouca evidência, que
este seja residente no solo, segundo Torres e colaboradores (2010). Essa espécie é pouco frequente no meio ambiente e tem prevalência sazonal (Perez et al., 2007).
Entre as diferentes espécies existentes, o Acinetobacter baumannii é a
de maior importância no que concerne à patologia humana. Refere Peleg, Seifert e Paterson em 2008, que Acinetobacter baumannii, bem como as outras espécies semelhantes fenotipicamente fazem parte do complexo A. calcoaceticus–A. baumannii (ACB), o qual integra quatro diferentes espécies
genômicas: Acinetobacter calcoaceticus, Acinetobacter baumannii,
Acinetobacter pittii e Acinetobacter nosocomialis, todos associados a surtos epidêmicos de infecção (Peleg,Seifert,Paterson,2008; Visca,Seifert,Towner, 2011).
Esse microrganismo afeta principalmente, pacientes gravemente enfermos em unidades de terapia intensiva-UTI (Peleg,Seifert,Paterson,2008; Figueiredo et al., 2009). Desde a década de 1980, essa bactéria tem emergido como um patógeno altamente problemático para muitas instituições a nível mundial devido à sua extraordinária capacidade de se adaptar ao ambiente
hospitalar. A. baumannii apresenta necessidades nutricionais mínimas e
24
2006) e adquirir resistência à dessecação e desinfecção
(Peleg,Seifert,Paterson,2008). Além disso, A. baumannii pode formar biofilmes, o que confere a esse microrganismo uma proteção a mais contra todos os fatores já descritos anteriormente (Roca et al., 2012; Davey & O´Toole, 2000). A identificação dos fatores de virulência e dos mecanismos de patogenicidade pode contribuir para o desenvolvimento de novas alternativas terapêuticas para o controle das infecções por esse microrganismo (Tomaras et al., 2003).
Várias superfícies inanimadas dentro do ambiente hospitalar foram relatadas por estarem colonizadas por A.baumannii, por exemplo, os trilhos da cama, mesas de cabeceira, superfícies de ventiladores, pias, equipamentos de sucção, colchões, equipamentos de ressuscitação, cortinas, baldes, maçanetas, estetoscópios, incubadoras e teclados de computador, entre outros (Lu et al., 2009) .
Vários são os fatores de risco para colonização e infecção por A.
baumannii: cirurgias de grande extensão, traumas, queimaduras, parto prematuro, internações repetitivas , tempo de permanência em UTI, tamanho do hospital ou UTI, uso de ventilação mecânica, dispositivos de longa permanência no exterior (por exemplo, cateteres intravasculares, cateteres urinários e tubos de drenagem), o número de procedimentos invasivos realizados e terapia antimicrobiana anterior são os mais relatados (García-Garmendia et al., 2001; Poutanen, Louie, Simor, 1997; Seifert, Strate, Pulverer, 1995).
Vários genes de resistência já foram descritos nessa espécie. Estudos demonstram a presença de genes que codificam para Ampicilinases (AmpC;
Rodríguez-Martínez et al., 2010), Betalactamases de Espectro Extendido
(ESBL; Mohajeri, 2013), Metallobetalactamases (MBL; Zhang et al., 2013),
Oxacilinases (OXA, Feizabadi et al., 2008) e Serino carbapenemases ou KPC ( Perez et al., 2010).
2.2.1.2 Acinetobacter pittii
Acinetobacter pittii foi descrito pela primeira vez em 2011, juntamente
com o A.nosocomialis (Nemec et al., 2011) e é relatada como a segunda
25
2010). Chamada anteriormente de Acinetobacter espécie genômica “3” devido
à dificuldade de ser diferenciada fenotipicamente das outras espécies do complexo ACB , cada vez mais é reconhecida como um importante patógeno (Boo, Walsh, Crowley, 2009). É encontrada em alimentos, no solo, e em indivíduos doentes e saudáveis (Yang et al., 2012; Houang et al., 2001; Chu et al.1999 ). Apesar de sua incidência ser bem mais baixa que de A. baumannii, acredita-se que esse percentual seja maior e que esse fato esteja baseado na
dificuldade na identificação da espécies do complexo ACB (Karah et al., 2011;
Chuang et al., 2011).
Geralmente essa espécie é suscetível aos carbapenêmicos (Zander, 2014), porém, genes de resistência como o blaNDM-1, blaOXA-23, blaOXA-40 e blaOXA-58 têm sido relatados em amostras de A.pitti resistentes a esse grupo de drogas (Bonnin et al., 2014; Yang et al., 2012; Montealegre et al., 2012; Evans et al., 2010; Boo et al., 2006, ) o que reforça a importância dessa espécie no contexto das IHs.
2.2.1.3 Acinetobacter nosocomialis
Chamada anteriormente de Acinetobacter espécie genômica “13TU” por
ter sido encontrada pela primeira vez infectando o trato urinário, essa bactéria
foi descrita em 2011. Também compõe o complexo ACB
(Peleg,Seifert,Paterson,2008). Seu habitat é semelhante ao de outras espécies de Acinetobacter, notadamente a espécie A. nosocomialis. A.pittii emergiu no contexto dos cuidados com a saúde e pode servir como um reservatório de determinantes de resistência (Van et al., 2002; McDonald, Amyes, Paton,1999).
Já foram relatadas as presenças dos genes blaOXA-58 e blaOXA-23 nessa
espécie (Kim et al., 2012; Chen et al., 2010).
2.2.1.4 Acinetobacter calcoaceticus
A primeira espécie de Acinetobacter a ser descrita. Este microrganismo
26
reservatório de genes de resistência, que conferem resistência aos carbapenêmicos, como o blaNDM-1(Sun et al., 2014).
2.2.1.5 Acinetobacter radioresistents
Acinetobacter radioresistens constitui parte da microbiota normal da pele, e raramente está associado à infecções humanas (Berlau et al., 1999). Essa espécie foi descrita pela primeira vez em 1988 por Nishimura e colaboradores e é proposto para três estirpes de Acinetobacter resistentes à radiação que foram isolados a partir de amostras de solo e de algodão. É
distinta de outras espécies de Acinetobacter nos aspectos fenotípicos,
genéticos e enzimáticos (Nishimura, Ino,Iizuka,1988). Essa espécie de
Acinetobacter é mais conhecida e estudada pelo fato de abrigar o gene para
uma enzima oxacillinase, blaOXA-23, responsável pela resistência aos
carbapenêmicos (Mugnier, Poirel, Nordmann,2010; Poirel, 2008). Até o presente momento apenas um caso de bacteremia causada por essa espécie, adquirida na comunidade, foi descrito (Visca et al., 2001).
2.2.1.6 Outras espécies de Acinetobacter
Mais recentemente, outras espécies menos conhecidas, tais
como A. lwoffii , A. soli, A. bereziniae, A. guillouiae, A. haemolyticus, A.
johnsonii, A. junii, A. parvus, A. schindleri, e A. ursingii têm sido associadas com infecções graves e estão sendo consideradas novos agentes patogênicos (Wisplinghoff et al., 2004).
2.3 Epidemiologia e prevalência de infecções por Acinetobacter sp.
Antes da década de 1970, as infecções por Acinetobacter eram
27
gênero apenas começou em 1991 quando se observou o primeiro relato de surto em hospitais na cidade de Nova York (Rungruanghiranya,Charurat, Termkiat, 2005). Desde essa época, vários surtos foram descritos em diferentes países como EUA, Inglaterra, França, Índia, Itália, Espanha, Holanda, Brasil, entre outros (van den Irfan et al., 2011; Ferreira et al., 2011; Broek et al., 2009). Pelo fato dessa bactéria ter sido implicada em uma grande porcentagem de infecções em soldados que lutaram no Iraque, essa bactéria
ganhou o apelido de “Iraquebacter” (Turton et al.,2006; Davis et al., 2005). A distribuição dos diferentes tipos de infecções varia de um hospital para outro e está, provavelmente, relacionado com a população do hospital e o tipo de procedimentos e intervenções realizadas. Um estudo regional prospectivo, realizado na Espanha mostrou que mais de 90% das infecções por A. baumannii foram adquiridas no hospital e que apenas 4% delas foram adquiridas na comunidade. Nesse estudo, as infecções do trato respiratório foram as mais comuns (39%), seguido de infecções de feridas (24%) e infecções do trato urinário (23%). A bacteremia só representava 3% das infecções (Rodiguez-Bano et al.,2004 ).
A distribuição de infecções foi também observada em um estudo retrospectivo realizado em um Hospital de ensino, em Marselha, na França. Neste estudo, infecções de feridas foram as infecções mais comuns (32%), seguidas por infecções do trato urinário (25%), infecções do trato respiratório (20%), e bacteremia (12%). Este estudo também mostrou sazonalidade na ocorrência de infecção por A. baumannii , com um número significativamente maior de infecções nos períodos quentes comparado ao período frio. Esse fato é observado também por outros estudos (Castelo et al., 2014; Richet, 2012; McDonald, Banerjee,Jarvis,1999). Outra evidência observada em alguns estudos é que a gravidade da infecção por Acinetobacter depende do local da infecção e da susceptibilidade do paciente à infecção como resultado de uma doença subjacente (Peleg,Seifert,Paterson,2008; Joly-Guillou,2005).
2.4 Resistência a antibióticos em Acinetobacter sp.
28
vez mais resistentes à terapia disponível aumenta o tempo de internação e exige medicamentos de custo alto e de difícil acesso. Também aumenta a morbidade e mortalidade na UTI e nos serviços de saúde em geral, com graves consequências sociais e econômicas para cada país (Dijkshoorn,Nemec, Seifert, 2007).
Infecções causadas por Acinetobacter geralmente são tratadas com
ampicilina – sulbactam, fluoroquinolonas, cefalosporinas de amplo espectro e
carbapenêmicos combinado ou não com um aminoglicosídeo (Moffatt et al.,
2010). Desde 1970, isolados clínicos de Acinetobacter têm apresentado
resistência a antibióticos. Inicialmente adquiriram resistência a penicilinas, cefalosporinas de primeira e segunda geração, cefamicinas, aminoglicosídeos, cloranfenicol e tetraciclinas, as quais foram denominadas de cepas multi-droga resistentes (MDR), ou seja, apresentam resistência a 3 ou mais classes de antimicrobianos (Vila & Pachón,2012). Porém, com a aquisição de diversos mecanismos de resistência, ao final dos anos 90, os carbapenêmicos eram os antimicrobianos de escolha para tratamento de infecções graves por Acinetobacter (Vila & Pachón,2012), Cepas multiresistentes que adquiriram resistência também aos carbapenêmicos estão sendo cada vez mais descritas. Essas cepas foram denominadas de extensivamente resistente a drogas (XDR), ou seja, resistentes aos carbapenêmicos e todas as outras classes de antibióticos, exceto colistina ou tigeciclina (Navon-Venezia, Leavitt, Carmeli, 2007). Esse perfil de Acinetobacter é o mais isolado atualmente. Porém, cepas de A. baumannii que são resistentes a todos os compostos antibióticos em uso clínico incluindo medicamentos recentemente aprovados, tais como a
tigeciclina e colistina, já foram relatadas (Mak et al., 2009; Dijkshoorn,Nemec,
Seifert, 2007;Navon-Venezia, Leavitt, Carmeli, 2007; Peleg et al., 2007).
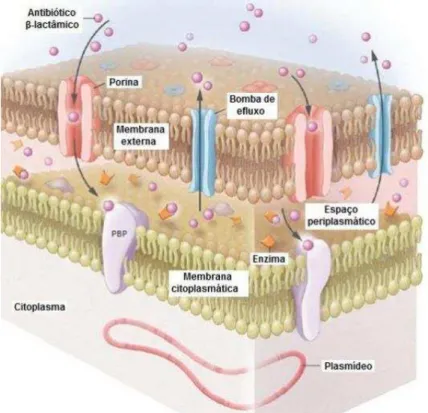
A resistência em Acinetobacter pode ser intrínseca ou pela aquisição de
inúmeros mecanismos, dentre eles a perda de porinas, a produção de β
29 Figura 1 – Mecanismos de resistência em Acinetobacter (Munoz-Price &
Weinstein, 2008).
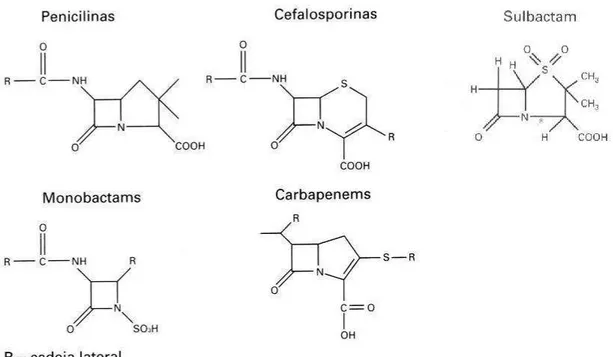
2.4.1 Antimicrobianos β-lactâmicos
Os β-lactâmicos são antimicrobianos que agem interferindo nas enzimas
que realizam a síntese da camada de peptideoglicano da parede celular bacteriana, e foram os primeiros a serem descritos em 1929, por Alexander Fleming.
Esse é o maior grupo de antimicrobianos utilizados na prática clínica, sendo que mais da metade das infecções bacterianas são tratadas por antibióticos dessa família. O seu uso é extenso haja vista a grande variedade de formas farmacêuticas disponíveis e sua baixa toxicidade. Os representantes dessa família possuem um anel beta-lactâmico, cuja estrutura química consiste em uma amida cíclica, heteroatômica, formada por três átomos de carbono e
um átomo de nitrogênio. (Junior, 2014; Thomas et al., 2007). As drogas dessa
30
Algumas penicilinas foram também associadas com inibidores de beta-lactamases (Figura 2; Kong, Schneper; Mathee, 2010).
Dentre essas classes de drogas, as cefalosporinas, distribuídas em quatro gerações, com espectro de atividade característico representam uma das principais classes utilizadas na clínica para tratamento de infecções bacterianas (Greenwood, 2000). Já, os carbapenêmicos (imipenem,
meropenem) são os β-lactâmicos com o maior espectro de ação antibacteriana.
Estes antibióticos foram originalmente desenvolvidos a partir da tienamicina,
um produto natural derivado de Streptomyces cattleya (Kahan et al., 1983), e
são frequentemente utilizados para o tratamento de isolados de Pseudomonas aeruginosa e Acinetobacter baumannii (Livermore et al., 2006) resistentes às cefaslosporinas.
Figura 2- Estrutura dos antibióticos β-lactâmicos (Adaptado de Williams,1999).
2.4.2 A produção de β-lactamases
31 Inúmeras β-lactamases, desde a primeira descrita em meados dos anos
40, estão sendo caracterizadas (Abraham & Chain, 1940).Essa enzima quebra
o anel β-lactâmico dos diferentes fármacos dessa classe, resultando na formação do ácido penicilóico substância que não tem efeito antimicrobiano
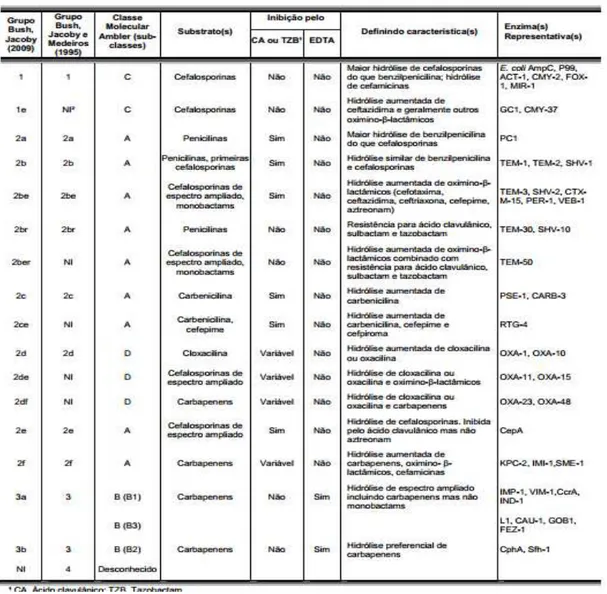
(Tavares, 2001). As β_lactamases podem ser classificadas de 2 modos
distintos, segundo a estrutura primária (classe A à D) e as características funcionais e bioquímicas (grupo I à IV). Enzimas classificadas como classe A ou grupo II, hidrolisam penicilinas e cefalosporinas; classe B ou grupo III, carbapenêmicos; classe C ou grupo I, cefalosporinas; classe D, penicilinas e cloxacilina; e grupo IV penicilinas (Bush & Jacoby, 2010; Ambler, 1980; Tabela 2).
A produção de β-lactamases cromossomais ou plasmidiais, tais como a
hiper-expressão da enzima ampicilinase do tipo C-AmpC (Gusatti et al., 2009;
Héritier et al., 2005) e a produção de Beta-Lactamase de Espectro Extendido-ESBL (Brown & Amyes, 2006) geralmente está associada com a resistência
aos β-lactâmicos em bactérias Gram-negativas. Já a resistência aos
carbapenêmicos (β-lactâmicos de amplo espectro de ação) pode ocorrer pela
combinação de diferentes mecanismos, sendo que as principais formas de
resistência a essas drogas são a expressão de metallo-β-lactamases (MBLs) e
a expressão de oxacilinases-OXA (Gusatti et al., 2009; Walsh et al., 2005). Outra carbapenemase bastante estudada em enterobactérias é a serino
carbapenemase, também denominada de Klebsiella Pneumoniae
Carbapenemase (KPC), porém, relatos de espécies de Acinetobacter
32 Tabela 2- Classificação das β -lactamases (Adaptado de Bush & Jacoby, 2010).
2.4.2.1 ESBL (Beta-Lactamase de Espectro Estendido)
As Betas Lactamases de Espectro Estendido (ESBL) são um grupo clinicamente importante de Beta-lactamases, capazes de hidrolisar as cefalosporinas de amplo espectro (ceftazidima, cefotaxima, ceftriaxona) e monobactans (Aztreonam; Emery & Weymouth, 1997). O primeiro isolado clínico, expressando essa enzima, foi identificado por Knothe, na Alemanha, em 1983 em uma cepa de Klebsiella ozanae (Knothe et al., 1983). A maioria
das ESBLs evoluiu a partir de mutações genéticas em β-lactamases clássicas
33
ESBLs, a CTX-M, emergiu nos últimos anos (Bonnet et al., 2001). Atualmente, o número de ESBLs já ultrapassa 500 e essas enzimas possuem uma ampla distribuição ao longo do mundo (Gniadkowski, 2008).
Alguns estudos têm relatado a presença da ESBL em Acinetobacter
(Poirel et al., 1999; Emery & Weymouth, 1997), porém ainda são raros os
relatos nesse gênero bacteriano (Mohajeri et al., 2013). Embora pouco
frequente, alguns autores ressaltam que a resistência aos carbapenêmicos
(principal resistência vista em Acinetobacter atualmente) pode ser o resultado
de combinações de uma beta-lactamase, geralmente uma ESBL codificada
pelo gene blaCTX-M associada a impermeabilidade e/ou aumento de efluxo
das drogas (Pitout & Laupland, 2008).
2.4.2.2 AmpC (Ampicilinase C)
Esta enzima expressa constitutivamente por Acinetobacter, hidrolisa
penicilinas, cefamicinas, e, em menor escala, oxyiminocefalosporinas, tais como a ceftazidima, cefotaxima, ceftriaxona e aztreonam (Bush, Jacoby, Medeiros, 1995). Até o momento não há informações sobre a regulamentação
da expressão de AmpC por Acinetobacter (Corvec et al., 2003). Sabe-se,
porém que uma hiperprodução dessa enzima, associada a um aumento de efluxo das drogas está implicado na resistência aos carbapenêmicos (Pitout & Laupland, 2008). Acreditava-se que a AmpC estava mais relacionada às Enterobactérias, porém, uma nova enzima AmpC foi descrita em uma cepa clínica de A. baumannii multirresistente isolada durante um surto de infecção
por essa bactéria na Espanha (Rodríguez-Martínez et al., 2010; Bou &
Martínez-Beltrán, 2000). No Brasil, alguns estudos apontam a presença de AmpC em cepas de Acinetobacter (Gusatti et al., 2009).
2.4.2.3 MBL (Metallo-β-lactamases)
34
betalactâmicos comercialmente disponíveis, sendo a única exceção o monobactam, aztreonam (Bush, 1998) . Essas enzimas caracterizam-se por necessitarem de dois íons divalentes, como co-fatores para atividade catalítica (Murphy et al., 2003) . Além disso, essas enzimas são inibidas pelo ácido etilenodiaminotetracético (EDTA; Bush, Jacoby, Medeiros, 1995). O primeiro relato de MBL ocorreu em 1994 (Osano et al., 1994), quando foi descrita uma nova subclasse denominada IMP-1. Desde lá, várias subclasses já foram descobertas e se tornaram uma grande preocupação ao redor do mundo. Atualmente, 9 subclasses são descritas: IMP-1(Imipemenase), VIM-1 (Verona
imipenemase), SPM-1 (São Paulo metalo-β-lactamase), GIM-1 (Germany
imipenemase), SIM-1 (Seul imipenemase), AIM-1 (Australian imipenemase),
KHM-1 (Kyorin Hospital metalo-β-lactamase), NDM-1 (New Delhi metalo-β
-lactamase), DIM-1 (Deutschland imipenemase; Ong et al., 2009; Lee et al., 2005; Castanheira et al., 2004; Toleman et al., 2002; Lauretti et al., 1999; ). No Brasil, o primeiro relato de cepas produtoras de MBL ocorreu em 2002, em isolados de Pseudomonas aeruginosa obtidos do Hospital Universitário Clementino Fraga Filho no Rio de Janeiro (Pellegrino et al., 2002). Um estudo realizado em amostras bacterianas isoladas de pacientes internados no Hospital São Paulo durante os anos de 2002 e 2003, detectou o gene
blaIMP-1 , blaIMP-blaIMP-16 e blaVIM-2 em amostras de Acinetobacter spp. (Castanheira et
al., 2003). Recentemente foram detectados casos de microrganismos produtores de NDM- 1 no estado do Rio Grande do Sul (ANVISA, 2013). O gene blaNDM-1 foi identificado em Providencia rettgeri e Enterobacter cloacae.
Em Acinetobacter, praticamente todos os genes que codificam para
MBLs são descritos, porém os mais comuns são: blaVIM-1(Tsakris et al.,
2006), blaNDM-1(Zhang et al., 2013) e blaIMP-1(Shiro et al., 2012).
2.4.2.4 OXA (Oxacilinases)
As oxacilinases (OXA) são betalactamases capazes de hidrolisar mais rapidamente a oxacilina, cloxacilina e a meticilina do que as penicilinas clássicas. Não são inibidas por EDTA (Opazo et al., 2012; Heritier et al., 2005)
e fracamente inibidas por ácido clavulânico (Pournaras et al., 2006). São
35
possuem naturalmente em seus genomas os genes que codificam as OXA. Essas enzimas são organizadas pela identidade de suas sequências de aminoácidos (Poirel, Naas, Nordmann, 2010). No presente momento 443 tipos de OXA são descritos (Lahey, 2015) e elas apresentam características hidrolíticas distintas (Picão, 2009). Porém, entre os diferentes mecanismos envolvidos na resistência aos antibióticos carbapenêmicos, a produção de
diferentes β-lactamases do tipo OXA é a mais prevalente(Sohrabi et al., 2012).
Surtos nosocomiais com isolados de Acinetobacter que produzem
enzimas de resistência OXA têm sido relatados no Brasil (Medeiros & Licopan,2013), Polinésia Francesa (Falagas et al., 2008), Espanha , Sudeste Europeu, Coréia e Argentina (Feizabadi et al., 2008). Vários tipos de OXA são
descritas em Acinetobacter, as duas mais importantes são a OXA-51 e a
OXA-23 ambas localizadas cromossomicamente em A.baumannii e A.
radioresistents respectivamente (Poirel et al., 2008). A pesquisa do gene blaOXA-51 vêm sendo utilizada para a identificação de espécies de Acinetobacter baumannii (Turton et al., 2006).
2.4.2.5 KPC (Klebsiella pneumoniae carbapenemase)
KPC são um grupo de carbapenemases potentes capazes de hidrolisar
todos β-lactâmicos, apresentando maior potencial de hidrólise para cefalotina, benzilpenicilina, amipicilina e piperacilina. Inicialmente foi identificada em um
isolado de Klebsiella pneumoniae nos Estados Unidos em 1996 e que se
difundiu para outros membros da família Enterobacteriaceae em todo o mundo (Nordmann, Cuzon, Naas, 2009; Queenan & Bush, 2007). No Brasil, essa
carbapenemase foi descrita primeiramente em 2009 em quatro cepas de K.
pneumoniae isoladas de urina e sangue, de pacientes internados na UTI de um hospital do Recife em 2006 (Monteiro, et al., 2009).
Atualmente 11 variantes são descritas (Tsakris et al., 2006) e apesar de
ser mais comuns nas enterobactérias, amostras de Acinetobacter produtoras
36
3 Objetivos
3.1 Objetivo geral
Avaliar fenotípica e geneticamente isolados de Acinetobacter sp. quanto
à susceptibilidade aos antimicrobianos, com ênfase aos beta-lactâmicos.
3.2 Objetivos específicos
Isolar e identificar amostras de Acinetobacter sp., ao nível de espécie, oriundas de espécimes clínicos e das superfícies hospitalares através de testes bioquímicos convencionais, pelo sistema MALDI-TOF (Matrix Associated Laser Desorption-Ionization - Time of Flight) e através da pesquisa do gene bla-OXA51.
Determinar através da técnica de disco-difusão, o perfil de susceptibilidade aos antimicrobianos utilizados na rotina hospitalar, das espécies de Acinetobacter isoladas;
Determinar, através de testes de triagem fenotípica, a produção de beta-lactamases dos tipos: AmpC, ESBL e Carbapenemases;
Caracterizar genotipicamente as cepas resistentes aos carbapenêmicos através da pesquisa dos genes que codificam beta-lactamases: IMP-1, VIM-1, NDM-1, KPC-2, OXA-23, OXA-24, OXA-51,OXA-58, OXA-143, através da técnica de PCR;
Determinar a ocorrência de Acinetobacter sp. nos hospitais estudados;
Relacionar as variáveis dependentes quantidade de classes de antimicrobianos resistentes e multirresistência bacteriana com as
variáveis independentes do estudo para os Acinetobacter isolados de
37
4 Metodologia
4.1 Tipo de estudo
Trata-se de um estudo transversal, descritivo e inferencial, no qual a amostra foi composta por 242 espécimes bacterianos do gênero Acinetobacter dos quais, 155 foram provenientes de isolados clínicos e 87 de superfícies hospitalares. Participaram do estudo 3 hospitais privados (A, B e C) e 1 público (D) localizados no município de Natal, Rio Grande do Norte.
4.2 Comitê de Ética em Pesquisa
O estudo foi submetido e aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte sob o protocolo 017/2013.
4.3 Período, local de estudo e recrutamento dos espécimes
O processamento e análise das amostras foi realizado no Laboratório de Bacteriologia Médica (LABMED), localizado na Universidade Federal do Rio Grande do Norte (UFRN). A coleta dos espécimes ocorreu durante o período de março 2013 a março de 2014. As amostras clínicas foram recolhidas através de demanda espontânea a partir de repique em Ágar nutriente (HIMEDIA) em tubo, realizado pelos microbiologistas dos laboratórios localizados nos hospitais envolvidos no estudo. A medida que as cepas eram cultivadas, ocorria a notificação para o recolhimento dos cultivos. Esse era realizado em caixa térmica apropriada. As amostras das superfícies hospitalares foram coletadas nos mesmos hospitais e período do recrutamento das amostras clínicas. Todos os hospitais envolvidos nesse estudo são classificados como Hospitais Gerais, com leitos clínicos, cirúrgicos e unidades de terapia intensiva.
4.4 Coleta e isolamento das amostras das superfícies hospitalares
38
pias e trilhos das camas dos diversos leitos de cada hospital ao longo do período do estudo. Os leitos foram escolhidos de forma aleatória, através de sorteio. A coleta foi realizada em dois momentos em cada hospital com intervalo de 3 meses entre as coletas. Estas eram realizadas pelo menos uma hora antes da última limpeza. Os swabs foram incubados a 36°C por 24 horas em Caldo BHI (Brain Hearth Infusion-HIMEDIA) estéril. Os crescimentos foram semeados em Ágar Sangue de Carneiro (AS; HIMEDIA) e Ágar MacConkey (AMC; HIMEDIA), pelo método de esgotamento, para que fossem observadas colônias típicas de Acinetobacter. No AS observa-se colônias com tonalidades amareladas a transparentes e no AMC o crescimento de colônias lactose
negativas – incolores, indicativas de crescimento de Gram-negativos não
fermentadores de carboidratos.
4.5 Identificação dos isolados de Acinetobacter
As colônias sugestivas de Acinetobacter isoladas a partir do ambiente hospitalar foram submetidas a testes fenotípicos de identificação como: Coloração de Gram, prova para fermentação de açúcares nos meios TSI (Triple Sugar Iron - HIMEDIA) ou OF-Glicose, prova da citocromo oxidase, motilidade
e por fim a prova da catalase (Koneman et al., 2008). As amostras que
obtiveram resultados nos testes acima compatível com o gênero Acinetobacter
foram submetidas à prova do crescimento em AMC a 44oC, recomendado por
Bouvet & Grimont (1987) para a identificação sugestiva de A. baumanni . As
cepas de Escherichia coli ATCC-25922, Pseudomonas aeruginosa
ATCC-27853 e Staphylococcus aureus ATCC-25923 foram utilizadas como controle
em todas as etapas da identificação.
Os isolados clínicos recebidos a partir dos hospitais estudados vieram
previamente identificados como Acinetobacter, mas no LABMED tiveram sua
identificação confirmada com os mesmos testes citados acima.
39
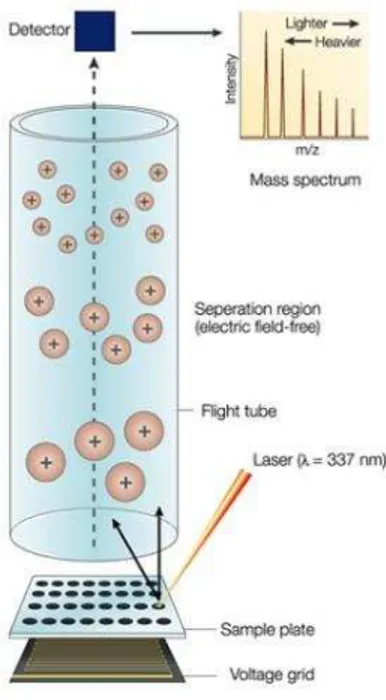
submetidas a identificação pelo sistema MALDI-TOF (BD- Bruker Biotyper),
sistema baseado na espectrofotometria de massa (Benagli et al., 2011).
O MALDI-TOF consiste em um sistema no qual o material biológico (uma colônia ou um concentrado de hemocultura) é colocado em uma placa em que há a matriz polimérica. Esta é irradiada com um laser que vaporiza a amostra e ioniza as várias moléculas que são aspiradas num tubo de vácuo e levadas a um detector: conforme a molécula, o tempo de chegada ao detector (time of flight) é diferente. Isso é plotado em um gráfico, através de vários picos e, para cada espécie bacteriana, obtém-se um gráfico específico. Uma base de dados computadorizada interpreta e fornece o resultado (Sistema MALDI-TOF Bruker,2015; Benagli et al., 2011; Figura 3).
Figura 3- Mecanismo de Ação do Sistema MALDI-TOF (Kim et al., 2003).
A pesquisa do gene blaOXA-51 também foi realizada para a
40
4.5 Técnicas utilizadas para os testes de susceptibilidade aos antimicrobianos
4.5.1 Kirby-Bauer
O método do disco-difusão (Kirby–Bauer) recomendado pelo Clinical and
Laboratory Standards Institute (CLSI,2014) foi utilizado para testar os seguintes
discos de antimicrobianos: Ciprofloxacina(CIP), Amicacina(AMI),
Gentamicina(GEN), Ampicilina + Sulbactam(APS), Piperacilina +
Tazobactam(PIT), Meropenem(MER), Imipenem(IPM), Sulfametoxazol + Trimetropim(SUT), Ceftriaxona (CRO), Cefotaxima(CTX), Ceftazidina(CAZ), Cefepime(CPM), Tetraciclina (TET) e Tigeciclina (TGC). Todos os discos foram adquiridos do fabricante DME- Diagnósticos Microbiológicos
Especializados-Rio de Janeiro, Brasil, exceto a tigeciclina, adquirida da Oxoid Limited,
Inglaterra, UK. A determinação da Concentração Inibitória Mínima (CIM) foi realizada para o antimicrobiano tigeclina através do E-Teste, seguindo as recomendações do Food and Drug Administration-FDA (FDA, 2015). As cepas de Escherichia coli ATCC-25922 e Pseudomonas aeruginosa ATCC-27853 foram utilizadas como controle.
4.5.2 Avaliação fenotípica dos mecanismos de resistência
4.5.2.1 Técnica de disco-aproximação para ESBL
Foi realizado teste fenotípico para detecção de ESBL em todas as cepas do estudo, segundo recomendações de Jarlier e colaboradores (1988) através da aproximação de discos de cefalosporinas (CTX, CRO, CAZ, CPM) com uma peniclina associada a um inibidor de betalactamase (AMC). O teste positivo é
visualizado pela formação de uma zona, chamada “zona fantasma” entre os
discos.
4.6.2.2 Técnica de disco-aproximação para AmpC
41
discos de betalactâmicos. O teste positivo é visualizado pelo achatamento do halo entre essas drogas.
4.6.2.3 Teste de detecção de Metallo-β-lactamase
As cepas foram selecionadas a partir do método do disco-difusão e aquelas que apresentaram resistência a pelo menos um carbapenêmico testado (Meropenem ou Imipenem) foram submetidas ao teste de detecção de
Metallo-β-lactamase segundo a norma técnica 01/2013 da ANVISA (Agência
Nacional de Vigilância Sanitária; 2013). Essa técnica consiste no uso do EDTA (Ácido etilenodiaminotetracético) impregnado em um disco de carbapenêmico e na posterior comparação entre o halo formado apenas pelo disco de carbapenêmico com o halo formado pelo disco de carbapenêmico no qual foi adicionado o EDTA. O cofator da Metallo-β-lactamase, zinco, é quelado pela ação do EDTA impedindo então que essa enzima exerça sua atividade. O aumento de cerca de 5 mm no tamanho do halo é indicativo de teste positivo.
4.6.2.4 Teste de Hodge Modificado
As cepas selecionadas a partir do método do disco-difusão e que apresentaram resistência a pelo menos um carbapenêmico testado (Meropenem ou Imipenem) também foram submetidas ao teste de Hodge Modificado, realizado de acordo com o CLSI (2014). Esse teste é realizado a partir do preparo de um inóculo da cepa E. coli ATCC 25922 e posterior semeio de colônias controles ( positivo e negativo) e da colônia teste. Esse teste é considerado positivo quando ocorrer um alargamento da área de crescimento bacteriano na inserção com o limite externo do halo de inibição.
4.7 Reação em cadeia da polimerase
42
OXA-58, OXA-143). Todas as amostras foram testadas para a presença do gene blaOXA-51. Esse método envolveu 3 etapas, conforme segue abaixo:
4.7.1 Extração do DNA
Para a extração do DNA bacteriano, após isolamento de colônias puras, se fez uma suspensão bacteriana densa de cada amostra em um tubo contendo Caldo BHI (HIMEDIA). O conteúdo desse tubo foi transferido para um microtubo e centrifugada a 3000 rpm durante 15 min, descartando o sobrenadante. O pellet obtido foi ressuspenso em 500 µl de água livre de nuclease e incubou-se por 15 min a 100ºC em banho-maria. Após incubação, o conteúdo foi transferido imediatamente para um freezer a -20 °C para que fosse permitido um choque térmico. As amostras então ficaram em freezer até o total congelamento. Após esse período elas foram descongeladas e centrifugadas por 30 segundos a 14000 rpm. Uma alíquota (200 µL) do sobrenadante é removida para tubos de eppendorf e estocada a 4°C até o uso. Foram utilizados 5 µL do sobrenadante para a amplificação do DNA.
4.7.2 Amplificação do DNA
As reações de PCR foram realizadas em volumes de 25µl contendo 5µ de DNA extraído, 12,5 µl de GreenTaqMaster Mix (Promega, Brasil) e 1 µl de cada iniciador (correspondente a 12,5 pmol). Para o controle positivo nas PCR foram utilizadas amostras de Acinetobacter sp. positivas para os genes OXA-23, 24, 51, 58, 143 e IMP-1. A Klebsiella pneumoniae ATCC BAA-2146 para o
gene NDM-1 e ATCC BAA-1705 para o gene KPC-2, e a Pseudomonas
aeruginosa controle positivo de VIM-1. A Pseudomonas aeruginosa ATCC-27853 foi utilizada como controle de extração e também como controle negativo para as PCRs.
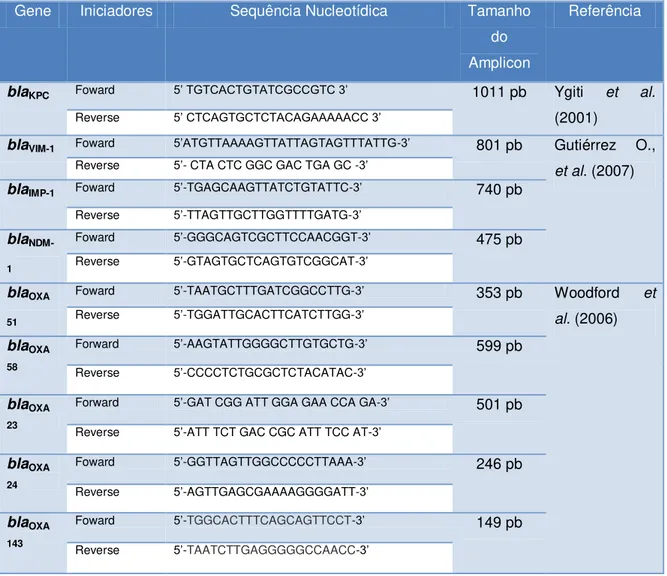
43 Tabela 3- Iniciadores utilizados no estudo.
4.7.3 Eletroforese em gel de agarose
Os produtos da PCR foram submetidos à eletroforese em gel de agarose a 1% para visualização das bandas correspondentes. O gel foi preparado com agarose em tampão TBE ( Tris-Borato-EDTA) 1X.
A eletroforese foi realizada em tampão de corrida TBE 1X sob uma corrente de 100 V no período de 1h. Após a corrida o gel foi corado com brometo de etídio e observado sob a luz ultravioleta.
Gene Iniciadores Sequência Nucleotídica Tamanho do Amplicon
Referência
blaKPC Foward 5’ TGTCACTGTATCGCCGTC 3’ 1011 pb Ygiti et al. (2001)
Reverse 5’ CTCAGTGCTCTACAGAAAAACC 3’
blaVIM-1 Foward 5’ATGTTAAAAGTTATTAGTAGTTTATTG-3’ 801 pb Gutiérrez O.,
et al. (2007)
Reverse 5’- CTA CTC GGC GAC TGA GC -3’
blaIMP-1 Foward 5’-TGAGCAAGTTATCTGTATTC-3’ 740 pb Reverse 5’-TTAGTTGCTTGGTTTTGATG-3’
bla NDM-1
Foward 5’-GGGCAGTCGCTTCCAACGGT-3’ 475 pb
Reverse 5’-GTAGTGCTCAGTGTCGGCAT-3’
blaOXA 51
Foward 5’-TAATGCTTTGATCGGCCTTG-3’ 353 pb Woodford et
al. (2006)
Reverse 5’-TGGATTGCACTTCATCTTGG-3’
blaOXA 58
Forward 5’-AAGTATTGGGGCTTGTGCTG-3’ 599 pb
Reverse 5’-CCCCTCTGCGCTCTACATAC-3’
blaOXA 23
Forward 5’-GAT CGG ATT GGA GAA CCA GA-3’ 501 pb
Reverse 5’-ATT TCT GAC CGC ATT TCC AT-3’
blaOXA 24
Foward 5’-GGTTAGTTGGCCCCCTTAAA-3’ 246 pb
Reverse 5’-AGTTGAGCGAAAAGGGGATT-3’
blaOXA 143
Foward 5’-TGGCACTTTCAGCAGTTCCT-3’ 149 pb
44
4.8 Coleta de dados sócio-demográficos, comorbidades e relativos à internação
Os dados referentes aos isolados clínicos de Acinetobacter e para o cálculo da ocorrência foram colhidos junto ao serviço de Controle de Infecção Hospitalar dos hospitais envolvidos no estudo em questionário previamente organizado (Apêndice A). Dados como: Sexo, idade, tempo de internação em UTI, quantidade de dispositivos invasivos utilizados, tipo de hospital (público ou privado), relato de colonização prévia por Acinetobacter, desfecho clínico, co-infecção no mesmo sítio por outras bactérias, mês da coleta (para avaliar a sazonalidade), sítio de infecção, quantidade de antimicrobianos utilizados previamente, comorbidades e se os pacientes passaram por traumas, cirurgia ou queimaduras foram considerados para essa análise.
Dados das amostras do ambiente hospitalar como a superfície coletada, o setor do hospital e a natureza (tipo) do hospital também foram coletados.
Todos os dados foram processados estatisticamente para avaliar a associação entre a presença de resistência aos antimicrobianos e as características dos isolados bacterianos recolhidas.
4.9 Elenco de variáveis
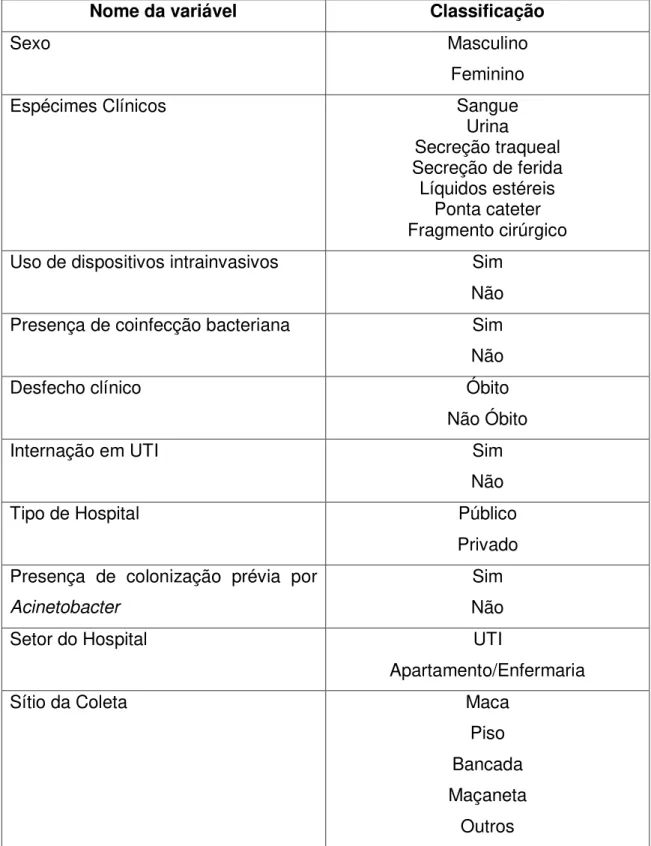
As variáveis dependentes e independentes envolvidas no estudo e suas respectivas classificações encontram-se descritas na tabela abaixo:
Tabela 4- Variáveis dependentes analisadas no estudo.Natal-RN, 2015.
Nome da variável Classificação
Quantidade de classes de antibióticos resistentes
0 a 7
Presença de multirresistência
bacteriana
45 Tabela 5- Variáveis independentes qualitativas do estudo.Natal-RN, 2015.
Nome da variável Classificação
Sexo Masculino
Feminino
Espécimes Clínicos Sangue
Urina
Secreção traqueal Secreção de ferida Líquidos estéreis
Ponta cateter Fragmento cirúrgico
Uso de dispositivos intrainvasivos Sim
Não
Presença de coinfecção bacteriana Sim
Não
Desfecho clínico Óbito
Não Óbito
Internação em UTI Sim
Não
Tipo de Hospital Público
Privado Presença de colonização prévia por
Acinetobacter
Sim Não
Setor do Hospital UTI
Apartamento/Enfermaria
Sítio da Coleta Maca
Piso Bancada Maçaneta
46 Tabela 6- Variáveis independentes quantitativas do estudo.Natal-RN, 2015.
Nome da variável Classificação
Idade 17 a 99 anos
Quantidade de antimicrobianos
utilizados previamente
0 a 15
Quantidade de comorbidades 0 a 7
Quantidade de dispositivos
intrainvasivos
0 a 8
Histórico de trauma, cirurgia e/ou queimadura
0 a 3
4.10 Análise estatística.
Para verificar se houve diferença significativa entre as médias da variável dependente quantidade de classes de antibióticos resistentes em relação às variáveis independentes qualitativas (sexo, uso de dispositivo intrainvasivo, presença de coinfecção, desfecho clínico, internação em UTI, tipo de
hospital,setor do hospital, presença de colonização prévia por Acinetobacter e
47