ROSELI DOS REIS GOULART
BIOFUMIGAÇÃO COM Brassica rapa PARA O CONTROLE DE
Meloidogyne exigua em DIFERENTES TEXTURAS E UMIDADES DO
SOLO
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Fitopatologia, para obtenção do título de Magister Scientiae.
VIÇOSA
Ao meu pai João Justino Goulart, minha querida
mãe Margarida Emília Goulart e as minhas irmãs
Claudisse, Magnólia, Glória e Rosane, que muito
AGRADECIMENTOS
Primeiramente, agradeço a Deus pelo dom da vida e por sempre estar
ao meu lado nos momentos difíceis.
A toda minha família, em especial a minha mãe, que apesar de não
estar mais presente para prestigiar mais esta conquista, é a principal
responsável por tudo que sou na vida.
À Universidade Federal de Viçosa e ao Departamento de Fitopatologia,
pela oportunidade de realização do Programa de Pós-Graduação.
À Fundação de Amparo à Pesquisa do Estado de Minas Gerais
(FAPEMIG)
À professora Rosângela D’Arc de Lima Oliveira, pela orientação.
Aos professores Júlio César Lima Neves e Hugo Alberto Ruiz, pelas
sugestões e informações necessárias ao desenvolvimento deste trabalho.
Aos funcionários Delfim, Célio e Braz pela colaboração na realização de
meus trabalhos.
Às amigas, Maria e Jéssica pelo apoio e compreensão nos momentos
difíceis encontrados durante todo esse percurso.
Ao amigo de turma Gustavo pela amizade sincera.
Aos colegas da Nematologia, Rodrigo, Naylor, Dalila, Douglas, Daniela,
Elói, especialmente, ao Edson que participou ativamente na realização deste
trabalho.
E a todos que, de alguma forma, contribuíram para a realização deste
BIOGRAFIA
Roseli dos Reis Goulart, filha de João Justino Goulart e Margarida Emília
Goulart, nascida em 05 de janeiro de 1979, em Muzambinho, Minas Gerais.
Em março de 2005, graduou-se em Engenharia Agronômica pela
Universidade Federal Rural do Rio de Janeiro (UFRRJ), Seropédica, RJ.
Em fevereiro de 2005, iniciou o Programa de Pós-Graduação em
Fitopatologia, em nível de Mestrado, na área de Nematologia, na Universidade
Federal de Viçosa.
SUMÁRIO
RESUMO ... vii
ABSTRACT ... viii
INTRODUÇÃO GERAL ... 1
REFERÊNCIAS BIBLIOGRÁFICAS ... 6
CAPÍTULO 1: CONTROLE DE Meloidogyne exigua PELA BIOFUMIGAÇÃO DO SOLO COM Brassica rapa... 11
INTRODUÇÃO... 12
MATERIAL E MÉTODOS ... 15
Ensaio 1: Efeito de diferentes concentrações de farinha de sementes de mostarda na eclosão de juvenis de M. exigua in vitro... 17
Ensaio 2: Efeito de diferentes concentrações de farinha de sementes de mostarda na biofumigação de solo infestado por M. exigua em casa de vegetação ... 18
RESULTADOS... 19
Ensaio 1... 19
Ensaio 2... 20
DISCUSSÃO ... 21
REFERÊNCIAS BIBLIOGRÁFICAS... 27
CAPÍTULO 2: INFLUÊNCIA DA TEXTURA E UMIDADE DO SOLO NO PROCESSO DE BIOFUMIGAÇÃO COM MOSTARDA ... 31
INTRODUÇÃO ... 32
Ensaio 1: Efeito da farinha de sementes de mostarda na
mortalidade de juvenis de segundo estádio (J2) de M . exigua, in vitro, em solos de diferentes classes texturais
sob diferentes umidades ... 36
Ensaio 2: Efeito da farinha de sementes de mostarda
associada a três texturas de solo e a um potencial de água
na biofumigação de solo infestado por M. exigua em casa de vegetação ...
Ensaio 3: Efeito da biofumigação com a farinha de
sementes de mostarda em substratos para produção de
mudas de café infestados com M. exigua em casa de vegetação ...
37
38
RESULTADOS ... 39
Ensaio 1 ... 39
Ensaio 2 ... 40
Ensaio 3 ...
DISCUSSÃO...
REFERÊNCIAS BIBLIOGRÁFICAS...
CONCLUSÃO GERAL ...
42
43
49
RESUMO
GOULART, Roseli dos Reis, M.Sc., Universidade Federal de Viçosa, fevereiro de 2007. Biofumigação com Brassica rapa para o controle de
Meloidogyne exigua em diferentes texturas e umidades do solo.
Orientadora: Rosângela D’Arc de Lima Oliveira. Co-orientadores: Onkar Dev Dhingra e Hugo Alberto Ruiz.
Os nematóides formadores de galhas radiculares, pertencentes ao
gênero Meloidogyne Goeldi, 1887, constituem um dos grupos de fitonematóides mais importantes para as culturas agrícolas. Meloidogyne exigua é uma das principais espécies que parasitam o cafeeiro, sendo mais prejudicial para a cultura no estádio de muda, pois reduz o desenvolvimento
das mesmas e impede a comercialização de mudas contaminadas. O brometo
de metila ainda é o principal produto utilizado para a desinfestação de
substratos, mas não por longo período, uma vez que o mesmo está sendo
gradativamente retirado do mercado. Dentre as alternativas de substituição
deste fumigante, a mostarda, planta da família Brassicaceae, têm–se destacado por produzir glucosinolatos, que ao sofrerem reação de hidrólise
enzimática liberam gases tóxicos como os isotiocianatos. Dessa forma,
acredita-se que a incorporação da farinha desengordurada de sementes de
Brassica rapa pode promover um controle eficiente de M. exigua na produção de mudas de cafeeiro. Com esse propósito, foram testadas diferentes
concentrações dessa farinha no controle de M. exigua e a partir de doses que propiciaram melhor eficiência estudouse a influência da umidade (10 kPa à
-500 kPa) e da textura do solo (Muito argiloso à franco-argilo-arenoso).
Comprovou-se que a farinha desengordurada teve efeito nematostático na
eclosão dos juvenis de M. exigua, nas doses menores (0,375 e 0,75 g/dm3) e efeito nematicida nas doses superiores (acima de 1,5 g/dm3). Em casa de
vegetação, a farinha na dose 2,0 g/dm3 controlou eficientemente o nematóide
com redução média de 94% no número de galhas e 93% no número de ovos. A
textura e a umidade do solo não influenciaram a eficiência da farinha na
biofumigação, exceto no solo franco-arenoso no potencial de -500 kPa.
Conclui-se que a farinha desengordurada constitui uma alternativa viável para o
ABSTRACT
GOULART, Roseli dos Reis, M.Sc., Universidade Federal de Viçosa, February, 2007. Biofumigation with Brassica rapa to control of Meloidogyne exigua in textures and humidities different of the soil. Adviser: Rosângela D’Arc de Lima Oliveira. Co-Advisers: Onkar Dev Dhingra and Hugo Alberto Ruiz.
The root-knot nematodes belong to the genus Meloidogyne Goeldi, 1887, and constitute one of the most important plant nematode groups to agriculture.
Meloidogyne exigua is one of the main species that parasitize coffee trees, being problematic especially in seedlings, because it reduces their development
and delays their commercialization. The methyl bromide still is the main product
used for soil and substrate disinfestation, but not for too long time, since it has
been gradually removed from the market. Among the alternatives to substitute
this fumigant, the mustard, plant from Brassicaceae family, has received special attention, because of the production of glicosinolates, which are broken down to
toxic gases, such as isoticianates, by enzymatic hydrolysis. In this way, it is
believed that soil incorporation of degreased flour of Brassica rapa seeds can promote efficient control of M. exigua in the soil. With this purpose, there were studied different flour doses for the control of M. exigua and from the best doses, it was studied the influence of soil humidity (-10 kPa to -500 kPa) and
the soil texture in the biofumigation process. It was proved that degreased flour
had nematostatic effect in M. exigua egg hatching, in the lowest doses (0,375 and 0,75 g/dm3) and nematicide affect in the superior doses (higher than 1,5
g/dm3). In greenhouse, in the dose 2,0 g/dm3 the flour controlled efficiently the
nematode, with an average reduction of 94% of galls and 93% of the eggs. Soil
texture and humidity did not affect flour efficiency in biofumigation, except in
franc-loamy soil at the potential of -500 kPa. Concluding, the degreased flour
Introdução Geral
Os nematóides pertencentes ao gênero Meloidogyne Goeldi, 1887, são causadores de galhas radiculares e constituem um dos grupos de patógenos
de maior importância econômica para a agricultura. Ocorrem em todo o mundo
e frequentemente são encontrados em regiões de clima tropical ou subtropical,
em locais de inverno curto ou moderado (Agrios,1997). Possuem ampla gama
de hospedeiros, englobando mais de 2000 espécies de plantas, o que inclui
quase todas as plantas cultivadas. Em todo o mundo são estimadas perdas
médias anuais de 12,3% na produtividade das principais culturas (Sasser &
Freckman, 1987). Plantas severamente atacadas por estes nematóides
apresentam um volume de raízes reduzido e o sistema vascular
completamente desorganizado devido a formação das galhas, comprometendo
seriamente a absorção de água e nutrientes pela planta (Netscher & Sikora,
1990). Certas espécies de nematóide promovem não só a formação de galhas
como também o desenvolvimento de raízes curtas e ramificadas, resultando
em um sistema radicular limitado, e consequentemente, com menor área de
absorção (Agrios, 1997). O ataque de nematóides fitoparasitas é mais
problemático para as plantas no estádio de muda, no qual grande número de
plantas morre no canteiro e outras nem resistem ao transplantio (Netscher &
Sikora,1990).
Na década de 70, mais de três milhões de mudas de café destinadas ao
transplantio, no estado de São Paulo (Gonçalves et al., 1978) e mais de cinco milhões no estado do Paraná (Jaehn et al., 1977) foram destruídas por estarem infectadas com Meloidogyneincognita.
Para a cultura do cafeeiro, uma espécie que merece destaque é
Meloidogyne exigua, pois está amplamente disseminada nas regiões produtoras de café do Brasil, especialmente no sul de Minas Gerais (Campos
et al., 1985) e Zona da Mata Mineira (Oliveira, 2002). No Estado do Rio de Janeiro, um estudo revelou que 70% das lavouras pesquisadas estavam
infectadas pelo nematóide (Barbosa et al., 2004). Mudas de café pesadamente infectadas por este nematóide, ao serem transplantadas para o campo,
à estação seca. Dependendo do tipo de solo, plantas de café adultas
infectadas podem sofrer intensa desfolha ou até chegar a morte (Campos et al., 1990).
Barbosa et al. (2004) relataram perdas variando entre 13 e 30% na produtividade de cafeeiros infectados, quando se encontravam com menos de
cinco anos de idade, mas as perdas atingiam 45% naqueles com mais de cinco
anos.
No sistema produtivo, as estratégias de controle deveriam ser
preventivas e não curativas, já que após o estabelecimento de altas
populações de Meloidogyne spp. no campo, é praticamente impossível suprimí-las ou mantê-suprimí-las em níveis suficientemente baixos para não causar prejuízos
(Netscher & Sikora,1990). O problema é ainda mais grave quando se trata da
comercialização de mudas, pois quando o produtor adquire uma muda
infectada com fitonematóides, a probabilidade de sucesso no desenvolvimento
da doença no campo é grande, uma vez que o nematóide já se encontra
associado ao hospedeiro suscetível, e as condições ambientais adequadas ao
desenvolvimento da muda, também favorecerão o desenvolvimento do
nematóide. A realidade é que após o estabelecimento do nematóide no campo,
a sua erradicação fica praticamente impossível. Dessa forma, o produtor
deverá adotar estratégias de manejo que visem à redução da população do
nematóide no solo a um nível tal que não traga prejuízos econômicos, o que
nem sempre é fácil. Assim, a produção de mudas sadias é ferramenta de
extrema importância no manejo de fitonematóides.
Uma prática comum e efetiva em operações de produção de mudas é a
desinfestação química do solo (Heald,1987).
O brometo de metila, usado há mais de 40 anos na fumigação do solo
em pré-plantio, têm amplo espectro de ação sobre fungos, nematóides, insetos,
ácaros, roedores, plantas daninhas e algumas bactérias (Duniway, 2002).
Contudo, este tem causado sérios problemas ambientais (Yates et al., 2002). Em base global, cerca de 75% do brometo utilizado na agricultura é destinado
ao tratamento de solo (US EPA, 1995), o que demonstra a dependência por
este produto na desinfestação de substratos usado para produção de mudas.
devido ao produto pertencer à classe das principais substâncias destruidoras
do ozônio da estratosfera (Duniway, 2002; Thomas, 1996), além de ser
altamente tóxico e reduzir a biodiversidade do solo (López-Pérez et al., 2003). Entretanto, com a crescente necessidade do produto e o reduzido
abastecimento, não haverá quantidade suficiente para suprir essa demanda
(Duniway, 2002). Atualmente, os produtores já têm encontrado dificuldade na
aquisição do brometo de metila no mercado.
Essa realidade tem estimulado o desenvolvimento de estratégias de
controle de fitonematóides menos danosas ao homem e ao ambiente, de modo
a proporcionar também alternativas viáveis para o manejo destes em áreas de
cultivo protegido e para o tratamento de substratos visando a produção de
mudas em viveiros comerciais.
Uma alternativa para a substituição dos fumigantes sintéticos é o uso de
partes de plantas ou compostos bioativos derivados de plantas. Estes
compostos, ou plantas que os contenham, podem ser utilizados como
biopesticida ou material orgânico incorporado ao solo (Yu et al., 2005).
A incorporação de material orgânico ao solo, estimula a atividade
microbiana, inclusive de microrganismos antagonistas de nematóides (Bridge,
1996). Além disso, o processo de decomposição resulta na liberação de gases,
que podem atuar na eliminação ou controle de patógenos do solo, processo
esse denominado biofumigação (UNEP, 1998). Diversas são as espécies de
plantas que ao serem incorporadas ao solo produzem compostos nematicidas
(Ferraz & Freitas, 2004), entretanto, atenção especial tem sido dada às plantas
da família Brassicaceae, devido às potencialidades de seu uso no controle de nematóides parasitas de plantas (UNEP, 1998).
Dentre as brassicáceas, merece destaque a mostarda que inclui
espécies como Brassica rapa, B. nigra e B. juncea, além de espécies no gênero Sinapsi (Fahey et al. 2001). A mostarda é originária do sul da Europa e constitui uma planta daninha de inverno. Frequentemente é encontrada em
cultivos de cereais no Sul do país, também ocorrendo em beira de estradas e
terrenos baldios (Lorenzi, 2000). Sua rusticidade pode facilitar o cultivo pelo
próprio produtor, levando a uma diminuição no custo com transporte na
O uso de plantas da família Brassicaceae se deve ao fato delas possuírem um grupo de metabólitos secundários denominados glucosinolatos
(Mojtahedi et al., 1993; Potter et al., 1998). Os glucosinolatos pertencem a um grupo de β-D- tioglucosídeos, que contêm enxofre em sua cadeia e
distinguem-se um do outro por diferenças que ocorrem em sua cadeia lateral orgânica
(grupo R). Com base nestas diferenças, os glucosinolatos são agrupados em
alifáticos, aromáticos e forma indol (Zasada & Ferris, 2003). São encontrados
em todos os tecidos da planta, armazenados nos vacúolos das células (Brown
& Morra, 2005). Quando o tecido é rompido, glucosinolatos relativamente não
reativos entram em contato com a enzima mirosinase (tioglucosídeo
glucohidrolase, EC 3.2.3.1), a qual é armazenada separadamente nas células,
resultando no processo de hidrólise e formação de nitrilas, epitionitrilas,
tiocianatos e/ou isotiocianatos (Zasada & Ferris, 2003).
Em geral, os isotiocianatos (ITCs) são considerados os produtos mais
tóxicos da hidrólise enzimática dos glucosinolatos (Morra & Kirkegaard, 2002).
São relativamente tóxicos aos nematóides, podendo ser utilizados como
nematicidas. Eles interagem de forma não específica e irreversível com
proteínas e aminoácidos para formar produtos estáveis (Brown & Morra, 1997).
O efeito pesticida dos glucosinolatos tem sido questionado por vários
pesquisadores, devido ao fato de ser atribuído mais aos produtos da
decomposição enzimática do que dos glucosinolatos propriamente ditos (Borek
et al., 1994; Lazzeri et al., 1993). Buskov et al. (2002) relataram que o glucosinolato intacto não teve efeito na mortalidade de juvenis de segundo
estádio de Globodera rostochiensis, entretanto, tal efeito foi alcançado quando a enzima mirosinase foi adicionada, liberando os produtos da hidrólise
enzimática dos glucosinolatos. O mesmo comportamento foi observado em
Caenorhabditis elegans (Donkin et al., 1995) e H.schachtii (Lazzeri et al., 1993).
A forma com que o material é incorporado ao solo vai influenciar a
velocidade com que os produtos da hidrólise dos glucosinolatos são
disponibilizados. Tecido na sua forma integral pode liberar mais lentamente os
produtos que aqueles que já sofreram uma ruptura física antes. O uso de
esmagamento das sementes promove uma extensiva ruptura celular,
maximizando a liberação dosITCs para o solo (Brown & Morra, 2005).
Lima (2006) empregou 1,6% de folha desidratada de B. rapa na biofumigação de solo infestado com M. incognita, e obteve redução de 92,7% no número de galhas, 97,7% no número de massas de ovos e 94,2% no
número de ovos em relação a tomateiros mantidos em solos não tratados. Com
a farinha desengordurada das sementes a dosagem de 0,1% (p/v) foi suficiente
para a supressão de 100% do nematóide. Foi verificada também mortalidade
superior a 95% nos juvenis de Heterodera glycines, M.incognita, M. mayaguensis, M. javanica e M. exigua utilizando folha desidratada ou farinha de sementes ou farinha desengordurada de sementes de mostarda.
Os produtos da hidrólise dos glucosinolatos têm efeito comprovado não
somente em nematóides como também em plantas daninhas (Haramoto &
Gallandt, 2004), Pseudomonas marginalis (Charron et al., 2002), Fusarium
oxysporum (Smolinska et al., 2003), Aphanomyces euteiches (Smolinka, 1997),
Rhizoctoniasolani (Chung et al., 2002), entre outros.
Vários são os trabalhos relatando o efeito da biofumigação no controle
de organismos fitopatogênicos. Contudo, fatores relevantes relacionados a este
processo devem ser levados em consideração. Brown & Morra (2005)
relataram que o tempo de vida dos produtos da hidrólise dos glucosinolatos no
solo, a volatilização, o teor de matéria orgânica no solo, a temperatura, o teor
de umidade, o pH, a textura e a atividade microbiana exercem influência no
processo da biofumigação. A farinha desengordurada obtida a partir de
sementes de B. rapa, em virtude de seu efeito nematicida recém comprovado por Lima (2006), merece maiores investigações quanto ao efeito de fatores
bióticos e abióticos na sua decomposição.
Assim, neste estudo foi dada ênfase à determinação da concentração
ideal da farinha desengordurada de sementes de mostarda (B. rapa), para a biofumigação do solo, visando ao controle de M. exigua, e ao estudo da influência da textura e umidade do solo no processo de biofumigação.
Acredita-se que a incorporação desAcredita-se material irá promover um eficiente controle de
fitonematóides em substratos para produção de mudas, criando dessa forma
uma alternativa viável para a substituição do brometo de metila e com menor
REFERÊNCIAS BIBLIOGRÁFICAS
AGRIOS, N. G. 1997. Plant Diseases Caused by Nematodes In: Plant
Pathology. Fourth Edition. Academic Press, Inc: San Diego. 565-597.
BARBOSA, D. H. S. G., VIEIRA, H. D., SOUZA, R. M., SILVA, C. P. 2004.
Survey of Root-Knot Nematode (Meloidogyne Spp.) in Coffee Plantations in the State of Rio de Janeiro, Brazil. Nematologia Brasileira, 28(1): 43-47.
BARBOSA, D. H. S. G., VIEIRA, H. D., SOUZA, R. M., VIANA, A. P., SILVA, C.
P. 2004. Field estimates of coffee yield losses and damage threshold by
Meloidogyne exigua. Nematologia Brasileira, 28(1): 49-54.
BOREK, V., MORRA, M. J., BROWN, P. D., MCCAFFREY, J. P. 1994.
Allelochemicals Produced During Sinigrin Decomposition in Soil. J. Agric. Food
Chem., 42: 1030-1034.
BRIDGE, J. 1996. Nematode Management in Sustainable and Subsistence
Agriculture. Annu. Rev. Phytopathol, 34: 201-225.
BROWN, J., MORRA, M. J. 2005. Glucosinolate-Containing Seed Meal as a
Soil Amendment to Control Plant Pests. Disponível em:
<http://www.nrel.gov/docs/fy05osti/35254.pdf#search=%22Glucosinolate-Containing%20Seed%20Meal%20as%20a%20Soil%20Amendment%20to%22>
Acesso em 01 agos. 2006.
BROWN, P. D., MORRA, M. J., 1997. Control of soil-borne plant pest using
glucosinolate-containing plants. Advances in Agronomy, 61: 167-231.
BUSKOV, S., SERRA, B., ROSA, E., SORENSEN, H., SORENSEN, J. C. 2002.
Effects of Intact Glucosinolates and Products Produced from Glucosinolates in
Myrosinase – Catalyzed Hidrolysis on the Potato Cyst Nematode (Globodera
CAMPOS, P. V., SIVAPALAN, P., GNANAPRAGASAM, N. C. 1990. Nematode
Parasites of Coffee, Cocoa and Tea. In: Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. C.A.B International, pp 387-430.
CAMPOS, V. P., LIMA, R. D., ALMEIDA, V. F. 1985. Nematóides parasitos do
cafeeiro. Informe Agropecuário, 11: 50-58.
CHARRON, C. S., SAMS, C. E., CANADAY, C. H. 2002. Impact of
Glucosinolate Content in Broccoli (Brassica oleracea (Italica Group) on Growth of Pseudomonas marginalis, a Causal Agent of Bacterial Soft Rot. Plant Disease, 86(6): 629-632.
CHUNG, W.C., HUANG, J.W., HUANG, H.C., JEN, J. F. 2002. Effect of ground
Brassica seed meal on control of Rhizoctonia damping-off of cabbage. Can. J. Plant Pathol, 24: 211-218.
DONKIN, S. G., EITEMAN, M. A., WILLIAMS, P. L. 1995. Toxicity of
Glucosinolates and Their Enzymatic Decomposition Products to Caenorhabditis elegans. Journal of Nematology, 27(3): 258-262.
DUNIWAY, J. M. 2002. Status of Chemical Alternatives to Methyl Bromide for
Pre-Plant Fumigation of Soil. In: Symposium: Methyl Bromide Alternatives – Meeting the Deadlines. Phytopathology, 92(12):1337-1343.
FAHEY, J. W., ZALCMANN, A. T., TALALAY, P. 2001. The chemical diversity
and distribution of glucosinolates and isothiocyanates among plants.
Phytochemistry, 56: 5-51.
FERRAZ, S., FREITAS, L. G. 2004. Use of Plants and Natural Products. In: Chen, Z. X., Chen, S. Y., and Dickson, D. W. (Ed.). Nematology: Advances and
Perspectives. Nematode Management and Utilization. vol. 2, pp 931-977.
GONÇALVES, W., THOMAZIELLO, R. A., MORAES, M. V., FERNANDO, J. A.
Estimativas de danos ocasionados pelos nematóides do cafeeiro. In:
Congresso Brasileiro de Pesquisas Cafeeiras, 6. Ribeirão Preto. Resumos, Rio
de Janeiro, IBC/GERCA, s.d p.182-186.
HARAMOTO, E. R., GALLANDT, E. R. 2004. Brassica cover cropping for weed
management: A review. Renewable Agriculture and Food Systems, 19(4):
187-198.
HEALD, C. M. 1987. Classical Nematode Management Practices. In: Veech, J. A., Dickson, D. W. Vistas on Nematology: A Commemoration of the Twenty-fifth
Anniversary of the Society of Nematologists, pp 100-104.
JAEHN, A., REBEL, E. K. & MATIELLO, J. B. 1977. Estudo do efeito curativo
de nematicidas em mudas de café infestado com Meloidogyne incognita. In: Congresso Brasileiro de Pesquisas Cafeeiras, 5., Guarapari. Resumos. Rio de
Janeiro, IBC/GERCA, s.d. p. 32-33.
LAZZERI, L., TACCONI, R., PALMIERI, S. 1993. In Vitro Activity of Some
Glucosinolates and their Reaction Products toward a Population of the
Nematode Heterodera schachtii. J. Agric. Food Chem., 41: 825-829.
LÓPEZ-PÉREZ, J. A., ARIAS, M., SANZ, R., ESCUER, M. 2003. Evaluación de
Alternativas al bromuro de metilo para el Control de Meloidogyne incognita en cultivos de pepino. Nematropica, 3(2): 189-196.
LIMA, A. O. 2006. Uso da Mostarda (Brassica rapa) como biofumigante de solo no controle de Meloidogyne incognita. Dissertação de Mestrado em Fitopatologia. UFV/Viçosa. 55 p.
LORENZI, H. 2000. Plantas Daninhas do Brasil. Terrestres, aquáticas
MOJTAHEDI, H., SANTO, G. S., WILSON, J. H., HANG, A. N. 1993. Managing
Meloidogyne chitwoodi on potato with rapeseed as green manure. Plant Dis.,77: 42-46.
MORRA, M. J., KIRKEGAARD, J. A. 2002. Isothiocyanate release from soil –
incorporated Brassica tissues. Soil Biology & Biochemistry,34:1683-1690.
NETSCHER, C., SIKORA, A. R. 1990. Nematode Parasites of Vegetables. In: Luc, M.; Sikora, R. A.; Bridge, J. Plant Parasitic Nematodes in Subtropical and
Tropical Agriculture. C.A.B International, pp 237-283.
OLIVEIRA, D. S. 2002. Caracterização de populações de M. exigua associadas a cafeeiro na Zona da Mata de Minas Gerais. Dissertação de Mestrado em
Fitopatologia. UFV/Viçosa, 48 p.
POTTER, M. J., DAVIES, K., RATHJEN, A. J. 1998. Supressive impact of
glucosinolates in Brassica vegetable tissue on root lesion nematode
Pratylenchus neglectus. J. Chem. Eco., 24: 67-80.
SASSER, J. N., FRECKMAN, D. W. 1987. A world perspective Nematology: the
role of the society. In: Veech, J. A., Dickson, D.W., ed. Vistas on Nematology. A Commemoration of the Twenty-fifth Anniversary of the Society of
Nematologists, 7-14.
SMOLINSKA, U., MORRA, M. J. KNUDSEN, G. R., JAMES, R. L. 2003.
Isothiocyanates Produced by Brassicaceae Species as Inhibitors of Fusarium oxysporum. Plant Disease, 87(4): 407-412.
SMOLINSKA, U., KNUDSEN, G. R., MORRA, M. J., BOREK, V. 1997. Inhibition
of Aphanomyces euteiches f. sp. pisi by Volatiles Produced by Hydrolysis of
Brassica napus Seed Meal. Plant Disease, 81(3): 288-292.
THOMAS, W. B. 1996. Methyl Bromide: Effective Pest Management Tool and
United Nations Environment Programme. 1998. Methyl bromide technical
options committee. Montreal Protocol on Substances that deplete the ozone
layer. Assessment of Alternative to Methyl Bromide, 354 p.
U.S. Environmental Protection Agency. 1995. Methyl bromide consumption
estimates. Washington, DC.
YATES, S. R., GAN, J., PAPIERNIK, S. K., DUNGAN, R., WANG, D. 2002.
Reducing Fumigant Emissions After Soil Application. In: Symposium: Methyl Bromide Alternatives – Meeting the Deadlines. Phytopathology, 92(12):
1344-1348.
YU, Q., Tyan, R., CHIBA, M., POTTER, J. 2005. Selective nematicidal activity
of allyl isothiocyanate. Journal of Food Agriculture & Environment, 3(2):
218-221.
ZASADA, I. A., FERRIS, H. 2003. Sensitivity of Meloidogyne javanica and
CAPÍTULO 1
CONTROLE DE
Meloidogyne exigua
PELA BIOFUMIGAÇÃO DO
Introdução
Os nematóides formadores de galhas radiculares, pertencentes ao
gênero Meloidogyne Goeld, 1887, têm ampla disseminação por todo o mundo. As espécies pertencentes a este gênero são bastante polífagas, atacando
diversas culturas economicamente importantes. M. exigua é uma das espécies mais importantes para a cultura do cafeeiro, e está amplamente disseminada
nas regiões produtoras de café do Brasil, especialmente no sul de Minas
Gerais (Campos et al., 1985) e na Zona da Mata Mineira (Oliveira, 2002). No estado do Rio de Janeiro, 70% das lavouras analisadas estavam infestadas
pelo nematóide (Barbosa et al., 2004).
O
manejo de fitonematóides não é uma tarefa fácil, principalmente emáreas com altas densidades populacionais. Medidas de controle isoladas não
surtem bons resultados, e por isso, elas devem ser utilizadas de forma
integrada.
O problema é ainda mais grave quando se trata da produção de mudas,
áreas de cultivo protegido e produção de olerícolas, pois os produtores são
altamente dependentes de fumigantes industrializados, como o brometo de
metila, para a desinfestação química do solo e substratos. Este produto, devido
a sua natureza biocida e seu efeito deletério ao ambiente e à destruição da
camada de ozônio, está sendo gradativamente retirado do mercado (Yates et
al., 2002).
Dessa forma, pesquisadores de todo o mundo tem se dedicado ao
estudo de métodos alternativos de controle de fitonematóides, utilizando
plantas ou compostos bioativos derivados de planta, no sentido de viabilizar
estratégias de manejo viáveis aos produtores e minimizar os impactos
negativos que os pesticidas sintéticos vêm causando à natureza. Estes
compostos, ou plantas que o contenham, podem ser utilizados como
biopesticida ou material orgânico incorporado ao solo (Yu et al., 2005).
O uso de plantas da família Brassicaceae vem ganhando espaço nas estratégias de manejo de nematóides devido à produção de compostos voláteis
com ação nematicida quando são incorporadas ao solo. Dentre esses, se
são resultantes da reação de hidrólise dos glucosinolatos pela enzima
mirosinase (Zasada & Ferris, 2003). Apesar da liberação de diferentes
produtos, os isotiocianatos (ITCs) são considerados os produtos mais tóxicos
(Morra & Kirkegaard, 2002) e por esse motivo tem sido um dos principais
compostos estudados para o controle das enfermidades de plantas (Brown &
Morra, 1997).
Estudos quanto à ação nematicida dos isotiocianatos têm sido realizados
em diversas espécies de brássicas. A mostarda, como popularmente é
denominada, é uma planta daninha de inverno, da família Brassicaceae,
frequentemente encontrada em cultivos de cereais no Sul do país, também
ocorrendo em beira de estradas e terrenos baldios (Lorenzi, 2000). Ela engloba
espécies como B. rapa, B. nigra, B. juncea, e inclusive espécies do gênero
Sinapsi (Fahey et al., 2001). Diversos trabalhos vêm sendo realizados com estas espécies de mostarda para a biofumigação do solo visando ao controle
de nematóides parasitas de plantas e de outros fitopatógenos, como por
exemplo, B. juncea-Meloidogyne javanica e Tylenchulus semipenetrans
(Zasada & Ferris, 2004), B. carinata-Heterodera schachtii (Lazzeri et al., 1993),
B. rapa-M. incognita (Lima, 2006), óleo essencial de mostarda (alil isotiocianato)-Rhizoctonia solani (Dhingra et al., 2004) e Sclerotium rolfsii e
Sclerotinia sclerotiorum (Schurt, 2006), dentre outros.
Pequenas diferenças estruturais na cadeia lateral dos glucosinolatos
provocam profundas diferenças no efeito nematicida, confirmando que a
atividade biológica é função não somente da concentração do produto da
hidrólise dos glucosinolatos, mas também da propriedade química da cadeia
lateral R (Lazzeri et al., 1993). Estes autores observaram efeito nematicida diferenciado para Heterodera schachtii quando expostos aos produtos da hidrólise enzimática de diferentes glucosinolatos, o qual variou de acordo com
a natureza do composto, a concentração e o tempo de exposição. Os produtos
da hidrólise da sinigrina à concentração de 0,5% provocou a mortalidade de
quase todos os juvenis após 24 h, enquanto os demais produtos tiveram efeito
somente após 48 h. Na concentração de 0,05% somente os compostos
derivados da sinigrina, gluconapina e glucotropeolina apresentaram efeito
Outro ponto importante é que a toxicidade dos ITCs provenientes da
incorporação de tecidos de brassicáceas é dependente não só da estrutura do
composto como também da espécie alvo (Zasada & Ferris, 2003).
Yu et al. (2005) testando diferentes concentrações de alil isotiocianato na eclosão de diferentes espécies de nematóide, observou que a concentração
de 5 µg/mL do produto inibiu completamente a eclosão de juvenis de cistos de
H. glycines, enquanto que para H. schachtii essa concentração parece ter estimulado a eclosão após dez dias de incubação. Para M. hapla 5 µg/mL de alil isotiocianato não afetou a eclosão, nesse mesmo período de incubação, no
entanto, forte efeito inibitório foi observado na eclosão de juvenis de M.
incognita. Devido a essas variações nos resultados, o autor sugeriu que as diferentes espécies de nematóides têm diferentes níveis de suscetibilidade a
um mesmo composto.
Estudos de nematicidas liberadores de isotiocianatos sobre a eclosão de
fitonematóides são raros. A ação de alguns nematicidas não fumigantes foi
verificada na eclosão em cistos de Heterodera schachtii. Com a concentração
de 5 μg/mL ou mais de aldicarb, carbofuran ou fensulfotion a eclosão do
nematóide foi inibida, entretanto, com fenamifós à dose de 1 μg/mL (menor
concentração testada) a eclosão foi eficientemente inibida (Steele, 1983).
Apesar de se ter alguns trabalhos utilizando os ITCs no controle de
fitonematóides, existem poucas informações sobre o efeito desses compostos
na eclosão dos juvenis. A maioria dos testes buscaram verificar o efeito
nematicida dos ITCs sobre os juvenis, e não o efeito ovicida destes produtos.
Zasada & Ferris (2003) testaram em laboratório o efeito de sete
isotiocianatos comerciais (Alil, benzil, butil, etil, fenil, 2-feniletil e 4-metilsulfinil
isotiocianato) e do nematicida liberador de metil isotiocianato, Metam sódio, na
mortalidade de juvenis (J2) de Tylenchulus seminetrans e M. javanica. O alil e o butil isotiocianato se igualaram ao Metam sódio como o segundo grupo mais
tóxico a Tylenchulus semipenetrans, e o 2-feniletil foi o isotiocianato mais tóxico para ambos os nematóides.
Lima (2006) avaliou o efeito dos subprodutos de B. rapa, folha desidratada, farinha de sementes e farinha de sementes desengordurada na
respectivamente. Entretanto, um estudo sobre o efeito de B. rapa na eclosão de fitonematóides é de extrema importância, uma vez que os ovos, na maioria
dos fitonematóides, correspondem à fase do ciclo de vida que persiste no solo
por períodos prolongados.
Nesse trabalho, objetivou-se testar o efeito de diferentes concentrações
da farinha desengordurada de sementes de mostarda (B. rapa) na eclosão de juvenis de M. exigua in vitro e no controle deste nematóide em casa de vegetação.
Material e Métodos
1. Obtenção e multiplicação do inóculo
Ovos de Meloidogyne exigua foram extraídos segundo Boneti & Ferraz (1981): raízes de plantas de cafeeiro infectadas, cultivadas em casa de
vegetação, foram lavadas cuidadosamente, sob água corrente para retirar as
partículas de solo aderidas à sua superfície, picadas em pedaços de
aproximadamente 1 a 2 cm, trituradas em liquidificador com uma solução de
NaOCl na concentração de 0,5% por 15 a 20 segundos. Os ovos foram
recolhidos da peneira de 0,0254 mm de abertura, após a passagem da
suspensão pela peneira de 0,074 mm. A suspensão de ovos foi ajustada para a
concentração de 1000 ovos/mL. A calibração desta suspensão foi feita em
câmara de Peters sob microscópio estereoscópio.
O inóculo foi multiplicado em plantas de pimentão, devido a eficiente
multiplicação do nematóide nessa cultura (Silva, et al., 2006). Mudas com dois a três pares de folhas foram transplantadas para vasos de plástico com
capacidade para dois litros, contendo uma mistura de solo e areia na proporção
de 2:1 previamente tratada com brometo de metila. Decorrida uma semana do
transplantio, a inoculação foi feita, adicionando-se 5mL da suspensão de ovos
obtida anteriormente, com o auxílio de uma pipeta, em quatro orifícios com
profundidade de aproximadamente 3 cm feitos ao redor das plantas.
As plantas utilizadas para a multiplicação do nematóide e na
crescimento do Departamento de Fitopatologia da Universidade Federal de
Viçosa, recebendo os tratos culturais necessários ao desenvolvimento das
mesmas, de acordo com as recomendações técnicas para a cultura.
Os juvenis de segundo estádio (J2) de M. exigua foram obtidos utilizando-se o método do funil de Baermann (Baermann, 1917, citado por
Jacob & Bezooijen, 1977) modificado, utilizando-se uma tigela, ao invés de
funil. Decorridas doze horas os nematóides eclodidos foram descartados, com
o objetivo de se padronizar a idade dos J2. Após 24 horas do descarte inicial,
os juvenis de segundo estádio (J2) foram recolhidos e a suspensão ajustada
para a concentração de 300 J2 por mL de água.
2. Solo utilizado nos ensaios.
O substrato utilizado nos ensaios foi composto de uma mistura de solo
argiloso e areia na proporção 2:1, previamente tratado com brometo de metila,
na dosagem de 100 cc/m3 de solo.
3. Material vegetal utilizado nos experimentos
A farinha desengordurada de sementes foi obtida a partir de plantas de
mostarda (Brassica rapa) cultivadas em condições de campo no Departamento de Fitopatologia da UFV. A farinha desengordurada foi obtida moendo-se as
sementes e, posteriormente, procedendo-se a extração de seus compostos
lipídicos com solvente.
4. Efeito de diferentes concentrações de farinha de sementes de mostarda na eclosão de juvenis de M. exigua in vitro .
O ensaio foi conduzido seguindo-se a metodologia de Zasada e Ferris
(2004). Nesta, frascos de 10 mL de volume foram parcialmente preenchidos
com 8 g de solo, acrescidos da farinha nas doses de 0 g/dm3, 0,375 g/ dm3,
0,75 g/ dm3, 1,5 g/ dm3, 3,0 g/ dm3 e 6,0 g/ dm3. Sobre o solo de cada frasco foi
feita uma pequena depressão onde se depositou 1 mL do inóculo, contendo
1000 ovos e água suficiente para que este solo atingisse a umidade de
aproximadamente 60% da capacidade de campo. Em seguida, os frascos
foram tampados e vedados com filme plástico, para evitar a perda dos gases
voláteis, e incubados por 7 dias (d) em câmara de crescimento a 26ºC. Após
esse período, o solo foi retirado de cada frasco e depositado sobre o funil de
Baermann. As avaliações foram feitas em intervalos de 48 h durante 10 d,
quando os juvenis de segundo estádio (J2) eclodidos foram coletados e
contados sob microscópio de luz.
O experimento foi montado no esquema de parcelas subdivididas em
delineamento inteiramente casualizado, com 6 tratamentos e 6 repetições. As
doses da farinha constituíram os tratamentos da parcela e as épocas de
avaliação foram os tratamentos da subparcela. As análises estatísticas foram
efetuadas no programa SAEG (Euclides, 1983).
Os dados provenientes do número de J2 acumulados em cada tempo
foram submetidos à ANOVA. A seguir, procedeu-se ao desdobramento da
interação dose de farinha X época de avaliação, independentemente da sua
significância, com o propósito de avaliar o efeito da dose da farinha em cada
época de avaliação sobre os J2 acumulados mediante equações de regressão.
5. Efeito de diferentes concentrações de farinha de sementes de mostarda na biofumigação de solo infestado por M. exigua em casa de vegetação.
O ensaio foi montado em vasos plásticos de 1,5 L de capacidade. O solo
de cada tratamento foi umedecido até atingir aproximadamente 60% da
capacidade de campo, infestado com 5000 ovos/vaso e revolvido para uma
melhor homogeneização do inóculo. Em seguida, a este solo foi adicionada a
farinha desengordurada nas doses de 0 g/dm3, 0,25 g/dm3, 0,50 g/dm3, 1,0
g/dm3, 2,0 g/dm3 e 4,0 g/dm3 revolvendo-o novamente. O solo de cada
repetição foi vedado em saco plástico transparente e permaneceu em câmara
de crescimento a 26ºC por 7 d. Após esse período os sacos plásticos foram
abertos e o solo colocado nos vasos, os quais foram mantidos em casa de
vegetação por dois dias, quando mudas de pimentão com dois a quatro pares
de folhas foram transplantadas para cada vaso.
Após 90 d do transplantio procedeu-se à avaliação do ensaio,
considerando-se o número de galhas e o número de ovos por sistema radicular
de cada planta. Os dados de galhas e ovos foram submetidos à análise de
regressão no programa estatístico SAEG (Euclides, 1983). A partir das
equações de regressão calcularam-se os números médios estimados de galhas
e de ovos obtidos de cada dose. Posteriormente, foi calculado o percentual de
galhas e ovos em relação à testemunha.
O experimento foi montado em delineamento inteiramente casualizado,
com 6 tratamentos e 8 repetições. Este mesmo ensaio foi realizado por duas
vezes.
A média das temperaturas máximas do ar que ocorreram durante os
ensaios foi de 28,9 ºC e das mínimas de 13,4 ºC.
Resultados
Efeito de diferentes concentrações de farinha de sementes de mostarda na eclosão de juvenis de M. exigua in vitro.
Houve efeito significativo da dose da farinha, da época de avaliação e da
interação entre estes dois fatores (P<0,01) sobre o número de J2 eclodidos. As
equações ajustadas para o número de J2 acumulados em função da dose
dentro de cada época de avaliação, seguiram o modelo hiperbólico. Nas
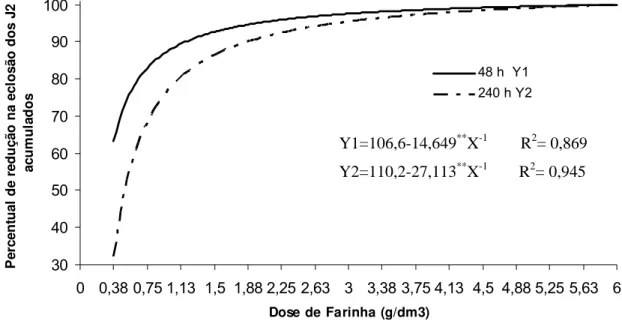
menores concentrações da farinha, o percentual de redução na eclosão dos J2
foi maior nas primeiras 48 horas (h) comparado àquele obtido após 240 h
(Figura 1). Com a dose de 0,375 g/dm3 a redução estimada na eclosão dos J2
acumulados foi de 63,4% e 32,2% após 48 e 240 h, respectivamente. Com o
aumento da dose da farinha essa diferença diminuiu e a partir de 3,0 g/dm3 o
percentual estimado de redução na eclosão dos J2 manteve-se praticamente o
mesmo durante todo o período de avaliação, ou seja, 97,8% na primeira
avaliação e 95,48% na última avaliação.
Figura 1 – Percentual de redução na eclosão de juvenis de Meloidoyne exigua
(J2) acumulados em 48 e 240 hs após a biofumigação do solo com diferentes
doses da farinha de mostarda.
Y1=106,6-14,649**X-1 R2= 0,869
Y2=110,2-27,113**X-1 R2= 0,945
30 40 50 60 70 80 90 100
0 0,38 0,75 1,13 1,5 1,88 2,25 2,63 3 3,38 3,75 4,13 4,5 4,88 5,25 5,63 6
Dose de Farinha (g/dm3)
P er cen tu al d e r ed u çã o n a ecl o são d o s J2 ac u m ul ad os
Efeito de diferentes concentrações de farinha de sementes de mostarda na biofumigação de solo infestado por M. exigua em casa de vegetação.
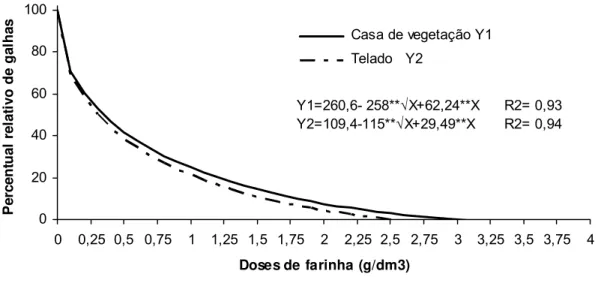
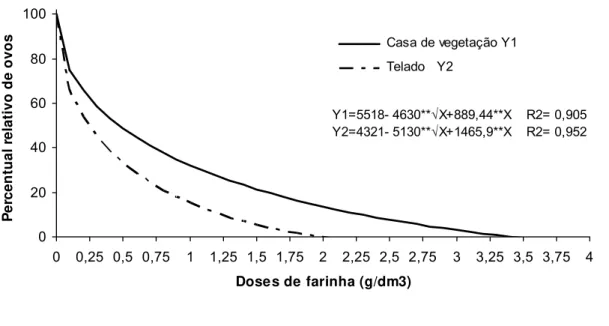
O efeito da dose da farinha foi significativo para o número de galhas e de
ovos. A biofumigação do solo com a farinha promoveu a redução no número de
galhas e de ovos de M. exigua em ambos os ensaios (Figura 2 e 3) e esse percentual de redução aumentou à medida que a concentração da farinha
incorporada ao solo foi aumentada. As menores doses de farinha utilizadas
(0,25 e 0,50 g/dm3 ) resultaram em baixo nível de supressão de M. exigua. Já na dose de 2,0 g/dm3 o percentual de redução das galhas foi de 92,59% no
ensaio 1 e 95,58% no ensaio 2 (Figura 2). O percentual de redução nos ovos
foi de 86,43% no ensaio 1 (Casa de vegetação) e 100% no ensaio 2 (Telado)
(Figura 3). Com a incorporação de 4,0 g/dm3 da farinha ao solo a redução foi
de 100% tanto para galhas quanto para ovos nos dois ensaios. De um modo
geral, o padrão de redução de galhas e ovos nos dois ensaios seguiu a mesma
tendência.
Nenhum sintoma de fitotoxidez foi observado nas plantas de pimentão
nas doses testadas, entretanto, foi observada intensa colonização do solo pelo
fungo Trichoderma sp. nos vasos cujas doses de farinha eram maiores.
Figura 2 – Percentual relativo de galhas em raízes de plantas de pimentão cultivadas em solo infestado com Meloidogyne exigua e tratado com diferentes
0 20 40 60 80 100
0 0,25 0,5 0,75 1 1,25 1,5 1,75 2 2,25 2,5 2,75 3 3,25 3,5 3,75 4
Doses de farinha (g/dm3)
P er cen tu al r el at ivo d e g al h
as Casa de vegetação Y1
Telado Y2
Figura 3 – Percentual relativo de ovos em raízes de plantas de pimentão cultivadas em solo infestado com Meloidogyne exigua e tratado com diferentes doses de farinha desengordurada de sementes de mostarda.
Discussão
A colonização do solo tratado com a farinha de mostarda por
Trichoderma sp. pode ser vista como um ponto positivo, uma vez que esse organismo tem atuado como antagonista de vários patógenos de planta e solo,
e, por isso, tem sido estudado em associação com brássicas na biofumigação
do solo como uma alternativa ao controle químico de doenças de plantas
(Sanchi, et al., 2005).
Este fungo também colonizou o solo infestado com M. incognita quando tratado com essa mesma farinha (Lima, 2006). Segundo o autor, a presença do
fungo pode estar relacionada com a supressão dos organismos competidores
desse fungo, e com a ausência de efeito tóxico da farinha sobre Trichoderma
sp. Essa hipótese pode ser corroborada por outros relatos que mostram a
tolerância de Trichoderma sp. aos isotiocianatos. Sanchi et al., (2005), usando a combinação Brassica carinata - Trichoderma harzianum-T39 para o controle de Sclerotinia sclerotiorum e de Sclerotinia minor, observaram que a habilidade de colonização do saprófita não foi reduzida.
0 20 40 60 80 100
0 0,25 0,5 0,75 1 1,25 1,5 1,75 2 2,25 2,5 2,75 3 3,25 3,5 3,75 4 Doses de farinha (g/dm3)
P er cen tu al r elat ivo d e o vo
s Casa de vegetação Y1
Telado Y2
Contudo, esse efeito pode variar de acordo com o tipo de material
biofumigante e o patógeno alvo de controle. Dandurad et al. (2000) notaram que a atividade biológica de T. harzianum foi reduzida quando este foi incorporado ao solo juntamente com dois cultivares de B. napus (alto e baixo conteúdo de glucosinolatos) no controle de S. sclerotiorum. Em contrapartida, a aplicação desse mesmo fungo associado ao cultivar com alto conteúdo de
glucosinolatos resultou em 100% de controle de Aphanomyces euteiches. No presente estudo, como a farinha desengordurada de sementes de B. rapa não interferiu com a atividade biológica de Trichoderma sp., seu potencial de uso é crescente, por resultar num efeito aditivo dos mesmos quando usados
simultaneamente no tratamento de substratos para a produção de mudas.
A ação nematicida da farinha desengordurada já havia sido comprovada
em trabalhos anteriores para M. incognita (Lima, 2006). Foi detectado que o principal composto presente em B. rapa foi o isotiocianato de alila, com maior concentração nas sementes comparado às folhas, e que possivelmente seria o
principal responsável pela supressão do nematóide. Entretanto, sabe-se que
outros compostos voláteis não quantificados nessa análise, como nitrilas,
epitionitrilas, tiocianatos (Zasada & Ferris, 2003) e compostos de enxofre
(Lewis & Papavizas, 1971) também poderiam estar atuando em conjunto nessa
supressão.
A hipótese de que a farinha desengordurada também teria ação
nematicida sobre M. exigua foi confirmada. A dose de 2,0 g/dm3 ou 0,2% da farinha incorporada ao solo foi suficiente para reduzir o número de galhas em
92,59% no ensaio 1 e 95,58% no ensaio 2. Da mesma forma, foi verificada uma
redução no número de ovos de 86,43% e 100% nos ensaios 1 e 2,
respectivamente. Em relação a M. incognita em tomateiro, Lima (2006) obteve uma redução de 97,5% no número de ovos e 99,4% no número de galhas
quando usou a concentração de apenas 0,05% (p/v) da farinha
desengordurada. Em princípio, esses dados não são contraditórios e
confirmam o que já vem sendo relatado na literatura, pois diferentes espécies
de nematóide possuem diferentes graus de suscetibilidade a um mesmo
composto. Zasada & Ferris (2003) concluíram que a toxicidade dos ITCs
µg/mL de alil isotiocianato inibiu completamente a eclosão de H. glycines após dez dias de incubação, enquanto que para H. schachtii essa mesma concentração parece ter estimulado a eclosão. Da mesma forma, esse
composto não afetou a eclosão de M. hapla, mas exerceu forte efeito inibitório na eclosão de M. incognita (Yu et al., 2005).
Deve-se observar também que diferentes brássicas têm apresentado
resposta diferenciada de eficiência de controle sobre as espécies de
nematóides. Johnson et al. (1992) observaram que a incorporação de 1,3-2,7% de matéria fresca de B. napus ao solo não resultou na supressão de M. javanica, M. incognita e Criconemella ornata, enquanto Zasada & Ferris (2004) conseguiram 100% de supressão de M. javanica com a dose de 2% de biomassa de B. juncea e 70% de redução com a incorporação de 1,2% de B.
hirta. Há que se considerar que o tipo de glucosinolato varia de espécie para espécie vegetal, assim como também seus teores e forma de distribuição nos
diferentes órgãos da planta. A falta de supressão de fitonematóides ou a
incoerência entre os resultados alcançados em alguns trabalhos pode ser
devido a essas diferenças. Até mesmo pequenas diferenças estruturais na
cadeia lateral desses compostos podem resultar em profundas diferenças no
efeito nematicida (Lazzeri et al., 1993).
Foram observadas pequenas diferenças no percentual de redução de
galhas e ovos entre os dois ensaios deste estudo, o que pode ser atribuído a
algum efeito ambiental, uma vez que os ensaios foram realizados em épocas e
locais diferentes, isto é, o ensaio 1 em casa de vegetação e o 2 em telado.
Apesar das médias das temperaturas máximas e mínimas não terem sido muito
discrepantes entre os dois locais durante o período total de condução do
experimento, a temperatura média mínima no primeiro mês, no telado,
apresentou-se menor (em torno de 11ºC), quando comparada à 15,8ºC na casa
de vegetação. Tal condição pode ter interferido na eclosão dos juvenis,
refletindo a diferença observada no número de ovos entre os dois ensaios.
Algumas espécies de Meloidogyne são mais adaptadas aos climas com temperaturas mais altas e, por isso, apresentam desenvolvimento
embriogênico e pós-parasítico mais rápido nessas condições. Observações de
tropical, apresentou 47 a 66% de ovos anormais ou mortos quando incubados
em temperaturas de 10 e 12ºC.
Embora essa diferença tenha sido observada entre os dois ensaios,
deve-se ressaltar que o padrão de redução dessas variáveis seguiram a
mesma tendência, conforme observado nas figuras 2 e 3.
Outra vantagem da biofumigação do solo com brassicáceas em relação
à incorporação de matéria orgânica proveniente de outras fontes também é
notada quando se trata de volume do material por hectare. Considerando-se
que B. rapa, em condições de campo, produz cerca de 1200 kg de sementes por hectare e que 35% desse valor é extraído em óleo, ter-se-ão 780 kg/ha da
farinha desengordurada ( Dhingra et al., 2007, informação pessoal). Adotando-se a doAdotando-se de 2,0 g/dm3 da farinha, a qual resultou em alto nível de supressão
em M. exigua, seriam necessários 4 ton do produto para o tratamento de uma área de um hectare. Essa quantidade pode ser considerada viável na prática,
uma vez que a adição de outros tipos de matéria orgânica gira em torno de
doses similares ou superiores a essa. É recomendado, por exemplo no caso do
esterco bovino, uma dose em torno de 20 ton/ha. Considerando o propósito
deste trabalho que é a aplicação do biofumigante em menores volumes de
solo, o emprego da farinha desengordurada pode ser considerada viável.
O enfoque deste estudo foi proporcionar uma forma de erradicar M. exigua do substrato para produção de mudas de cafeeiro visando à obtenção de mudas livres de nematóides. Para a produção de mudas de meio ano
(saquinho com 20-25 cm altura, 11 cm largura) 1000 L de substrato são
suficientes para produção de 1200-1400 mudas (Guimarães et al., 1989, Alvarenga et al., 2000), partindo-se da dose de 2,0 g/dm3 da farinha desengordurada, precisaríamos de somente 2,0 kg do produto para produzir
esse número de mudas de café. Assim, se o produtor optar por produzir a
mostarda para obter a farinha para a biofumigação do substrato, com a área de
1 hectare ele produziria 780 kg da farinha, e teria quantidade do produto
suficiente para a produção de um grande volume de mudas. Outra vantagem
inerente a essa farinha é que ela pode ser armazenada por alguns meses sem
a perda da eficiência de seu princípio ativo. Entretanto, a vida de prateleira da
Os produtos voláteis da farinha de mostarda afetaram a eclosão dos J2
de M. exigua. Observou-se que esse efeito foi bastante marcante nas primeiras 48 hs após o período de incubação, com 63,4% de redução na eclosão dos J2
com a dose de 0,375 g/dm3, porém ao final das 240 hs de avaliação o
percentual de redução dos J2 caiu para 32,2%. Com 0,75 g/dm3 da farinha, o
percentual de redução foi de 82,9% e 68,4% após 48 e 240 h, respectivamente.
O trabalho feito por Lima (2006), pode corroborar com esses resultados pois,
ao quantificar o isotiocianato de alila neste tipo de farinha, detectou que o pico
de liberação do composto foi de 9,76 ppm e ocorreu cerca de seis hs após a
incorporação da farinha ao solo, caindo para 2,66 ppm após 48 hs. Pode-se
inferir que nas doses menores da farinha o efeito dos produtos voláteis sobre
os J2 foi nematostático, provocando apenas um atraso na eclosão dos
mesmos, ou seja, um retardo no desenvolvimento embrionário dos ovos.
Entretanto, conforme as doses da farinha foram sendo aumentadas essas
diferenças foram diminuindo, como se observou com 3,0 g/dm3 da farinha.
Nesta dose, o percentual de redução dos J2 foi de 97,6% e 95,5% após 48 e
240 hs, respectivamente. Depreende-se, portanto, que o efeito da farinha nas
doses superiores foi nematicida.
Para M. incognita foram necessários 8 g/dm3 da farinha de sementes de
B. rapa para uma redução de 99,7% na eclosão dos juvenis (Lima, 2006). Embora os valores sejam discrepantes quando comparados com os de M. exigua, deve-se levar em consideração que essa redução foi apenas pela ação dos subprodutos voláteis liberados durante a biofumigação. Na metodologia
empregada por Lima (2006), não houve contato direto dos ovos com o solo, ao
contrário do presente estudo que avaliou todo o potencial da farinha, já que os
ovos de M. exigua tiveram íntimo contato com o solo tratado. Então, é provável que outras substâncias não voláteis da farinha da mostarda possam ter ficado
diluídas na solução do solo, aumentando a efetividade do controle efetuado
pelos gases. Além disso, sabe-se que diferentes espécies de fitonematóides
podem ter diferentes níveis de suscetibilidade a um mesmo composto.
Efeito inibitório do alil isotiocianato na eclosão de nematóides,
especialmente de Heterodera glycines e M. incognita foi observado por Yu et
Comparando o efeito da farinha de mostarda sobre a eclosão dos J2 de
M. exigua, in vitro, com os resultados obtidos em casa de vegetação com diferentes concentrações da farinha, conclui-se que foi necessária dose
superior à mencionada anteriormente para um efetivo controle do nematóide.
Explica-se isto, considerando-se que em casa de vegetação não é possível
controlar todos os fatores que interferem com o processo de biofumigação,
como oscilação de umidade no solo e temperatura. Além de que nos testes in vitro estão envolvidos apenas solo-farinha-nematóide, enquanto em casa de vegetação acrescenta-se o fator planta, a qual pode estimular a eclosão dos
juvenis devido a presença de exsudatos radiculares (Siqueira et al., 2004). Como as condições de casa de vegetação se aproximam mais das condições
reais de produção de mudas, pode-se inferir que a dose de farinha mais
adequada ao controle de M. exigua seria de 2 g/dm3 de solo.
Um outro ponto que merece destaque é que a disponibilidade de um
produto com ação ovicida é de extrema importância para o manejo de
fitonematóides, pois sabe-se que os ovos correspondem a fase do ciclo de
vida, na maioria dos fitonematóides, que é capaz de persistir no solo por
períodos prolongados.
Dessa forma, conclui-se que a farinha desengordurada é uma alternativa
REFERÊNCIAS BIBLIOGRÁFICAS
ALVARENGA, A. P., MOURA, V. M., RIBEIRO, M. F. 2000. Escolha de
variedades e produção de mudas de café. Boletim de extensão nº. 42.
Universidade Federal de Viçosa.
BARBOSA, D. H. S. G., VIEIRA, H. D., SOUZA, R. M., SILVA, C. P. 2004.
Survey of Root-Knot Nematode (Meloidogyne Spp.) in Coffee Plantations in the State of Rio de Janeiro, Brazil. Nematologia Brasileira, 28(1): 43-47.
BONETI, J.I.S., FERRAZ, S. 1981. Modificação do método de Hussey & Barker
para extração de ovos de Meloidogyne exigua de raízes de cafeeiro. Fitopatologia Brasileira, 6: 553 p
BROWN, P. D., MORRA, M. J. 1997. Control of soil-borne plant pest using
glucosinolate-containing plants. Advances in Agronomy, 61: 167-231.
CAMPOS, V. P., LIMA, R. D., ALMEIDA, V. F. 1985. Nematóides parasitos do
cafeeiro. Informe Agropecuário, 11: 50-58.
DANDURAND, L. M, MOSTHER, R. D., KNUDSEN, G. R. 2000. Combined
effects of Brassica napus seed meal and Trichoderma harzianum on two soilborne plant pathogens. Can. J. Microbiol/Rev. can. Microbial, 46 (11):
1051-1057.
DHINGRA, O. D., COSTA, M. L. N., SILVA JR, G. J. 2004. Potential of Allyl
Isothiocyanate to Control Rhizoctonia solani Seedling Damping off and Seedling Blight in Transplant Prodution. J. Phytopathology, 152: 352-357.
EUCLIDES, R. F. 1983. Manual de utilização do programa SAEG (Sistema para
Análises Estatísticas e Genética). Versão 5.0. Viçosa, MG: Universidade
FAHEY, J. W.; ZALCMANN, A. T.; TALALAY, P. 2001. The chemical diversity
and distribution of glucosinolates and isothiocyanates among plants.
Phytochemistry, 56: 5-51.
GUIMARÃES, P. T. G., CARVALHO, M. M., MENDES, A. N. G., BÁRTHOLO,
G. F. 1989. Produção de mudas de café: Coeficientes técnicos da fase de
viveiro. Informe Agropecuário. Ano 14, nº 162 . Belo Horizonte.
JOHNSON, A. W.; GOLDEN, A. M.; AULD, D. L.; SUMNER, D. R. 1992.
Effects of rapeseed and vetch as green maure crops and fallow on nematodes
and soil-borne parthogens. J. Nematol, 24(1): 117-126.
LAZZERI, L., TACCONI, R., PALMIERI, S. 1993. In Vitro Activity of Some
Glucosinolates and their Reaction Products toward a Population of the
Nematode Heterodera schachtii. J. Agric. Food Chem.,41: 825-829.
LEWIS, J. A., PAPAVIZAS, G. C. 1971. Effect of Sulfur-Containing Volatile
Compounds and Vapors from Cabbage Decomposition on Aphanomyces euteiches. Phytopathology, 61: 208-214.
LIMA, A. O. 2006. Uso da Mostarda (Brassica rapa) como biofumigante de solo no controle de Meloidogyne incognita. Dissertação de Mestrado em Fitopatologia. UFV/Viçosa. 55 p.
LORENZI, H. 2000. Plantas Daninhas do Brasil. Terrestres, aquáticas
parasíticas e tóxicas. 3º Ed. p. 225.
MORRA, M. J., KIRKEGAARD, J. A. 2002. Isothiocyanate release from soil –
incorporated Brassica tissues. Soil Biology & Biochemistry,34: 1683-1690.
OLIVEIRA, D. S. 2002. Caracterização de populações de M. exigua associadas a cafeeiro na Zona da Mata de Minas Gerais. Dissertação de Mestrado em
SANCHI, S., ODORIZZI, S., LAZZERI, L., MARCIANO, P. 2005. Effect of
Brassica carinata seed meal treatment on the Trichoderma harzianum
t39-Sclerotinia species interaction. Acta Hort. (ISHS), 698: 287-292.
SCHURT, D. A. 2006. Potencial do Isotiocianato de alila no controle de
Sclerotium rolfsii e Sclerotinia Sclerotiorum. Dissertação de Mestrado em Fitopatologia. UFV/Viçosa. 48 p.
SIQUEIRA, K. M. S., TORRES, G. R. C., PEDROSA, E. M. R. & MOURA, R.M.
2004. Eclosão de Meloidogyne incognita, M. javanica e M. mayaguensis em lixiviados de caupi associado a Glomus etunicatum e Bradyrhizobium sp. Fitopatologia Brasileira, 29: 259-262.
SILVA, R. V., OLIVEIRA, R. D. L., JESUS, D. S., FERREIRA, P. S. 2006.
Incremento na produção de ovos de Meloidogyne exigua pela inoculação em plantas de pimentão. In: XXXIX CONGRESSO BRASILEIRO DE
FITOPATOLOGIA, Salvador. Resumos, p. 195.
STEELE, A. E. 1983. Effects of Selected Nematicides on Hatching of
Heterodera schachtii. Journal of Nematology, 15: 467-473.
YATES, S. R., Gan, J., Papiernik, S. K., Dungan, R., and Wang, D. 2002.
Reducing Fumigant Emissions After Soil Application. In: Symposium: Methyl
Bromide Alternatives – Meeting the Deadlines. Phytopathology,
92(12):1344-1348.
YU, Q., Tyan, R., CHIBA, M., POTTER, J. 2005. Selective nematicidal activity
of allyl isothiocyanate. Journal of Food Agriculture & Environment, 3(2):
218-221.
VRAIN, T. C., BARKER, K. R. 1978. Influence of low temperature on
ZASADA, I. A., FERRIS, H. 2004. Nematode supression with brassicaceous
amendments: application based upon glucosinolate profiles. Soil Biology &
Biochemistry, 36: 1017-1024.
ZASADA, I. A., FERRIS, H. 2003. Sensitivity of Meloidogyne javanica and
CAPÍTULO 2
Introdução
Os nematóides fitoparasitas, principalmente os do gênero Meloidogyne, causam sérios problemas em áreas de cultivo de olerícolas e em viveiros de
produção de mudas, levando os produtores a grandes prejuízos, não só pelo
atraso no desenvolvimento das plantas doentes, mas também, pelo
impedimento da comercialização das mudas infectadas(Gonçalves et al., 1978, Jaehn et al., 1977).Medidas de tratamento químico do solo são adotadas como uma das principais ferramentas de manejo (Heald,1987), visto que as mudas
constituem um dos meios mais eficientes de disseminação de fitonematóides,
tanto a curtas como longas distâncias. Além disso, se a disseminação numa
determinada área livre destes patógenos é eficiente, a sua erradicação é
praticamente impossível (Netscher et al., 1990). Assim, o principal meio de controle destes organismos ainda é a prevenção de sua entrada no campo.
O brometo de metila é um dos principais produtos utilizados na
desinfestação de substratos para a produção de mudas. Ele é usado há mais
de 40 anos na fumigação do solo em pré-plantio pelo seu amplo espectro de
ação sobre fungos, nematóides, insetos, ácaros, roedores, plantas daninhas e
algumas bactérias (Duniway, 2002).
O problema é que o brometo é uma das substâncias mais potentes na
destruição da camada de ozônio, o que têm causado sérios danos ao
ambiente, e, por isso, o mesmo deixará de ser produzido e comercializado
(Duniway, 2002; Carpenter, 2000). Como os produtores são altamente
dependentes desse produto para o tratamento do solo e substratos, medidas
alternativas de controle, menos agressivas ao ambiente e ao homem, vem
sendo desenvolvidas a cada dia.
Uma estratégia de manejo de doenças que vem se destacando é a
biofumigação do solo pela incorporação de tecido de plantas da família
Brassicaceae. O uso dessas plantas se deve ao fato delas possuírem um grupo de metabólitos secundários denominados glucosinolatos (Potter et al., 1998), que ao serem incorporados ao solo sofrem reação de hidrólise enzimática
liberando gases tóxicos, como isotiocianatos, tiocianatos, enxofre elementar e
Em geral, os isotiocianatos (ITCs) são considerados os produtos mais
tóxicos da hidrólise enzimática dos glucosinolatos (Morra & Kirkegaard, 2002).
São relativamente tóxicos aos nematóides, podendo ser utilizado como
nematicida.
Quando se trata do controle de nematóides com fumigantes sintéticos,
deve-se considerar que sua eficiência na redução da população de nematóides
no solo fica entre 50-90%, aproximadamente (Schmitt, 1985). O desempenho
destes produtos no solo é afetado, pelo tipo de solo e textura, capacidade de
difusão, dosagem, aeração, umidade, temperatura, pH, conteúdo de matéria
orgânica e tecnologia de aplicação (Lembright,1990). É muito importante o
entendimento de cada fator que regula essa difusão e a conseqüente influência
no controle das doenças. Da mesma forma, diversos fatores podem influenciar
o processo de biofumigação. É extremamente importante que se entenda os
processos e o destino dos aleloquímicos no solo, para que se possa maximizar
o potencial benéfico no controle de pragas (Brown & Morra, 1997).
A volatilização é um fator importante para a distribuição do gás
fumigante no espaço poroso do solo (Brown & Morra, 2005). Não é desejável
que ocorram perdas de isotiocianatos do solo para a atmosfera, pois diminuiria
a quantidade de gás disponível para a supressão do organismo alvo. As perdas
dos gases fumigantes são maiores em solos de textura mais grossa. No
entanto, a textura parece exercer menor influência que outros fatores bióticos e
abióticos
Segundo Morra & Kirkegaard (2002), a melhoria na supressão dos
patógenos de solo poderá ser alcançada selecionando-se variedades com alto
conteúdo de glucosinolatos e adequado conteúdo de umidade no solo, porque
reflete na melhor produção e retenção dos isotiocianatos. Em solos mais secos
é provável que ocorra menor disponibilidade de solução para a reação de
hidrólise dos glucosinolatos (Brown & Morra, 2005), que é mediada pela
mirosinase. Entretanto, o fator que mais limita a supressão dos patógenos é a
liberação dos ITCs do tecido para o solo.
Condições de umidade constante associadas a baixas temperaturas,
poderão levar a um aumento na vida útil do ITC, ou até mesmo, aumentar o
potencial de biofumigação do solo, já que o tempo de exposição do organismo