OSCILAÇÕES TETA NO HIPOCAMPO DO RATO DURANTE
TAREFA DE TOMADA DE DECISÃO ESPACIAL
Oscilações Teta no hipocampo do rato durante tarefa
de tomada de decisão espacial
Tese
apresentada
ao
Departamento de Fisiologia da
Universidade Federal do Rio
Grande
do
Norte
para
a
obtenção do título de doutor em
Psicobiologia.
Orientadores:
Dr. Sidarta T. G. Ribeiro
Dr. Adriano B. L. Tort
______________________________________________
É com grande satisfação e alegria que registro aqui meu profundo
agradecimento a todos aqueles que, ao longo desses quatro anos, compartilharam
comigo seus ensinamentos, atenção e sabedoria. Este trabalho não seria possível sem
a contribuição de cada um de vocês, e por isso, muito obrigado!
Obrigado aos meus orientadores, professor Sidarta Ribeiro e professor
Adriano Tort pela oportunidade, pela liberdade e pelos ensinamentos valiosos, que, de agora em diante, também guiarão meu desenvolvimento profissional. Muito obrigado!
Obrigado aos professores dos programas de pós-graduação em Psicobiologia e
pós-graduação em Neurociências, John Araújo Fontenelle, Regina Silva, George Nascimento, Bruno Lobão, Rodrigo Pereira, Cláudio Querioz, Dráulio Araújo,
Richardson Leão, Martin Cammarota. E obrigado também aos professores e colaboradores Mauro Copelli, Jean Faber, Vinícius Cota, Diego Laplagne, Ernesto Soares. Tenham certeza que vocês sempre despertaram minha motivação para a ciência dentro e fora dos laboratórios e salas de aula.
Obrigado pelo companheirismo! Aprendi muito com vocês!
Agradeço imensamente ao professor Mariano Sigman e ao professor Howard Eichenbaum por me possibilitarem incursões científicas enriquecedoras em seus laboratórios na Universidad de Buenos Aires, Argentina e na Boston University,
Estados Unidos. Essas duas experiências de intercâmbio acadêmico-científico me
trouxeram maturidade para a realização de colaborações frutíferas.
Especial agradecimento à minha família, que sempre me apoiou
inquestionavelmente. À Julia Ciarlini, que acompanhou de perto cada momento dessa jornada. E aos eternos amigos e irmãos, Clayton Santos, Felipe Silvério, Hugo Ricaldoni, e Gabriel Torres. O apoio de vocês foi imprescindível na manutenção da minha sanidade mental.
O hipocampo é uma estrutura essencial para o processamento de memórias
espaciais e episódicas. Evidências recentes têm sugerido que aumentos de amplitude
nas oscilações Teta (5-12 Hz) refletem a participação do hipocampo na execução de
tarefas de tomada de decisão. Com o objetivo de investigar a função da oscilação Teta
hipocampal em processos de decisão espacial, registrei o potencial de campo da
região CA1 dorsal do hipocampo do rato durante a execução de uma tarefa de escolha
em labirinto radial de quatro braços. Observei que animais treinados apresentam
aumento significativo das oscilações Teta durante a decisão, diferentemente de
animais não treinados. Os resultados mostram que o aumento da potência de Teta
durante a decisão está relacionado ao desempenho dos animais na tarefa, e sugerem
que o ritmo Teta hipocampal reflete a evocação de memórias associada à decisão.
Além disso, a potência de Teta foi significativamente maior durante decisões corretas
que nas decisões incorretas. Esses resultados não estão associados a diferenças de
atividade locomotora. Finalmente, verifiquei que é possível utilizar a potência das
oscilações Teta para predizer decisões corretas e incorretas em cada tentativa. Em
conjunto, os resultados apoiam uma função mnemônica das oscilações Teta em tarefas
The processing of spatial and episodic information during memory tasks depends on
hippocampal theta oscillations. In the present study, I investigated the relationship
between theta power and choice selection during spatial decision-making. I recorded
local field potentials from the CA1 region of rats retrieving reward locations in a 4-arm
maze. In trained but not in naïve animals, I observed a significant increase in theta
power during decision-making, which could not be explained by changes in locomotion
speed. Furthermore, a Bayesian decoder based on theta power predicted choice
outcomes in speed-matched trials. The decoding time course revealed that performance
increased above chance before the decision moment exclusively for theta power,
remaining flat for other frequency bands. These results occurred for trained animals, but
no significant prediction could be made for naïve animals. Altogether, the data support a
mnemonic function of theta rhythm during spatial decision-making, indicating that these
______________________________________________
Figure 1 - Experimental design and behavioral performance in the spatial choice task 39
Figure 2 - Theta power increases during decision-making ... 40
Figure 3 - Trained but not naïve animals have increased theta power during decision-making ... 41
Figure 4 - Within speed-controlled conditions, decision-making is associated with highest theta power in trained animals, but not in naïve animals ... 42
Figure 5 - Correct choices are associated with stronger theta power during decision-making ... 43
Figure 6 - Theta power during decision-making predicts choice outcomes ... 44
Supporting Information Figure S1 - General behavior ... 45
Supporting Information Figure S2 - Mean power spectral density for speed-controlled trials during DM and RUN for all animals recorded ... 46
Figura 7 - Representação esquemática da atividade de 4 células de lugar ... 50
Figura 8 - Representação esquemática da atividade de 6 células de lugar durante exploração do ambiente e as durante sessões de sono prévia e subsequente ... 51
Figura 9 - Caracterização da atividade de neurônios do hipocampo que codificam o tempo ... 52
Figura 10 - Segundo trabalho mostrando a existência de neurônios de tempo no
hipocampo ... 53
Figura 11 - Labirinto em T modificado (em forma de 8)... 58
Figura 12 - Matrizes de tetrodos móveis ... 60
Figura 13 - Painel apresentado na “42nd Society for Neuroscience Annual Meeting, 2012, New Orleans – Louisiana, USA” ... 72
Figura 14 - Painel apresentado na XXVI Reunião Anual da Federação das Sociedades de Biologia Experimental FeSBE, 2011, Rio de Janeiro – RJ ... 75
______________________________________________
______________________________________________
Introdução ... 13
Objetivos ... 21
Capítulo 1: Manuscrito ... 22
Abstract ... 23
Introduction ... 23
Methods ... 25
Results ... 30
Discussion ... 35
Figures ... 39
Conclusões e considerações finais ... 47
Capítulo 2: Doutorado sanduíche ... 48
Introdução ... 49
Objetivos ... 55
Métodos ... 57
Resultados preliminares ... 65
Anexo 1: Trabalhos publicados em colaboração ... 66
Anexo 1.1. On high-frequency field oscillations (>100 Hz) and the spectral leakage of spiking activity ... 67
Anexo 1.2. Theta phase modulates multiple layer-specific oscillations in the CA1 region ... 68
Anexo 1.3. Cross-modal responses in the primary visual cortex encode complex objects and correlate with tactile discrimination ... 69
Anexo 1.6. Measuring the distribution of theta-locked spiking activity in hippocampal neuronal ensembles of rats before and after spatial exploration ... 73
Anexo 1.7. Codificação de localização e identidade de objetos em populações
neuronais do hipocampo e do córtex cingulado anterior ... 76
" Ou isto ou aquilo.
Ou se tem chuva e não se tem sol,
ou se tem sol e não se tem chuva!
Ou se calça a luva e não se põe o anel,
ou se põe o anel e não se calça a luva!
Quem sobe nos ares não fica no chão,
quem fica no chão não sobe nos ares.
É uma grande pena que não se possa
estar ao mesmo tempo nos dois lugares!
Ou guardo o dinheiro e não compro o doce,
ou compro o doce e gasto o dinheiro.
Ou isto ou aquilo: ou isto ou aquilo...
e vivo escolhendo o dia inteiro!
Não sei se brinco, não sei se estudo,
se saio correndo ou fico tranquilo.
Mas não consegui entender ainda
qual é melhor: se é isto ou aquilo."
13
Introdução Geral
Evolutivamente, a seleção natural moldou o cérebro dos mamíferos para
interagir com o ambiente, processar informações e tomar decisões que aumentem sua
capacidade de sobrevivência e reprodução. Dessa forma, desenvolveu-se um sistema
nervoso que adquire, armazena e interpreta informações do ambiente, usando
aprendizados prévios para aprimorar comportamentos futuros (Bogacz, 2007).
Formalmente, o processo de tomada de decisão pode ser descrito como um sistema de
aprendizado por reforço, através do qual um conjunto de possíveis situações é
associado às respectivas ações que maximizam a obtenção de recompensas pelo
organismo (Sutton and Barto, 1998). Trata-se de um processo que evolui no tempo
adquirindo e integrando informações de diferentes fontes, e termina com a síntese de
um plano de ação que guia o comportamento na busca de um objetivo (Gold and
Shadlen, 2007). Decisões seguidas de ganhos efetivos imediatos ou no longo prazo
promovem a associação das ações executadas aos sinais de recompensa, e assim,
possibilitam aos animais prever relações frente a contextos semelhantes no futuro
(Schultz et al., 1997). Modelos computacionais foram utilizados para decompor o
processo de decisão em quatro estágios principais (Doya, 2008; Rangel et al., 2008).
Primeiro acontece o reconhecimento da situação, criando uma representação do
problema. Em seguida, alternativas são avaliadas e associadas às suas potenciais
14 decisão é reavaliada de acordo com suas reais consequências, recompensas ou
punições. Para executar decisões guiadas por aprendizados prévios, os animais
precisam integrar informação mnemônica às informações ambientais disponíveis no
momento da decisão. Isso permite a comparação entre resultados de decisões
passadas e a previsão dos possíveis resultados de decisões futuras. Assim, em
contraste com decisões tomadas em um ambiente de total incerteza, a evocação de
memórias se torna uma fonte confiável de informações que sustenta a decisão (Kepecs
et al., 2008; Wimmer and Shohany, 2011).
Dada a gama de contextos em que decisões são aplicadas, o processamento de
diferentes circuitos neurais é recrutado em função dos fatores ambientais analisados.
Por exemplo, decisões podem ser tomadas consciente ou inconscientemente, podem
envolver emoções ou se basear em lógica, podem partir de total incerteza ou de um
histórico de experiências prévias. Segundo uma série de estudos [para revisão (Rangel
et al., 2008)], ao menos três sistemas de decisão são identificados no cérebro de
mamíferos: um sistema baseado em condicionamento clássico (pavloviano), um
sistema baseado na formação de hábitos motores complexos, e um sistema de decisão
deliberativa1.
Tomadas de decisão deliberativas envolvem não apenas, mas notadamente
redes neurais do hipocampo, do córtex pré-frontal, do corpo estriado, e da área
tegmentar ventral (Jog, 1999; Johnson et al., 2007; Pennartz et al., 2009; Womelsdorf
et al., 2010b; van der Meer et al., 2012). Evidências sugerem que esses sistemas de
1
15 decisão competem e interagem no aprendizado de estratégias de comportamento
através das quais o organismo obtenha as maiores recompensas (Poldrack and
Packard, 2003; Womelsdorf et al., 2010b). As funções específicas executadas por cada
uma dessas estruturas permanecem sob intensa investigação. Segundo Tolman, o
cérebro processa decisões deliberativas baseado na formação de esquemas cognitivos
representando as relações causais e espaciais do ambiente2 (Tolman, 1938a, 1948).
Nesse sentido, duas linhas de evidência sustentam o envolvimento do hipocampo no
processamento de decisões: a atividade hipocampal é crítica para a formação de
memórias episódicas (Scoville and Milner, 1957; Squire, 1992; Eichenbaum, 2000,
2004) e para a codificação do espaço durante a navegação pelo ambiente (O’Keefe et
al., 1971; O’Keefe and Nadel, 1978; Bird and Burgess, 2008). Consequentemente, o
aprendizado de associações entre eventos e/ou lugares codificados por grupos de
neurônios hipocampais deve exercer um papel chave na tomada de decisão e na
condução do comportamento.
O funcionamento normal do hipocampo é essencial para a codificação inicial,
armazenamento e recuperação de novas memórias declarativas (Clark et al., 2005;
Spiers and Maguire, 2007; Squire and Bayley, 2008). Para que um traço de memória
permanente seja formado, novas informações devem ser codificadas por circuitos
hipocampais no momento da experiência, e subsequentemente consolidadas em
circuitos neocorticais capazes de armazenamento de longa duração. Lesões
hipocampais provocam amnésia retrógrada gradual, com maior prejuízo de memórias
2
16 formadas recentemente (Scoville and Milner, 1957). Dessa forma, estudos sugerem
que a consolidação de memórias é um fenômeno de gradual redistribuição das novas
informações por circuitos hipocampo-corticais durante os períodos de vigília e
episódios de sono que se seguem à experiência (Buzsaki, 1998; Ribeiro et al., 2007).
Com o passar do tempo, o traço de memória se torna estável e, eventualmente,
resistente a perturbações da atividade hipocampal. Contudo, a participação do
hipocampo na evocação de memórias antigas permanece controversa [para revisão
(Spiers and Maguire, 2007)]. Estudos em roedores indicam que lesões no hipocampo
impedem a evocação de memórias espaciais e episódicas, e sugerem o envolvimento
do hipocampo em processos de decisão dependentes de memória (Womelsdorf et al.,
2010b). Lesões hipocampais completas, ou restritas ao hipocampo dorsal, afetam a
evocação do local da plataforma em labirinto aquático (Moser and Moser, 1998),
mesmo que a tarefa de memória espacial tenha sido aprendida até 14 semanas antes
das lesões. Testes de memória similar à episódica em ratos sugerem que lesões do
hipocampo pioram o reconhecimento de odores e da ordem em que estes são
apresentados (Fortin et al., 2002, 2004). Além disso, ressaltando a importância do
hipocampo sobre processos de decisão, lesões hipocampais também pioram o
desempenho de ratos previamente treinados em tarefas de tomada de decisão espacial
em labirinto em formato de duplo-Y (Bett et al., 2012). Em última instância, a formação
de memórias permite que representações de eventos passados sejam usadas para
guiar decisões futuras, o que sugere uma função crítica do hipocampo sobre processos
17 Para melhor compreender os mecanismos fisiológicos que fazem do hipocampo
uma estrutura fundamental para a formação de memórias e para os processos de
decisão, experimentos em laboratório investigam as variações da atividade elétrica
hipocampal associadas ao desempenho em tarefas comportamentais. Neurônios
piramidais das regiões CA1 e CA3 do hipocampo disparam potenciais de ação
seletivamente quando o animal explora locais específicos do ambiente, e por isso são
chamados de células de lugar (do inglês “place cells”, ver anexo 1) (O’Keefe et al.,
1971). Quando o animal se locomove pelo espaço, sequências de células de lugar
codificam os lugares visitados ao longo da trajetória (Wilson and Mcnaughton, 1993).
Esses achados sugerem que a atividade de populações de neurônios do hipocampo
forma uma representação interna do ambiente (O’Keefe and Nadel, 1978). Dessa
forma, um mapa cognitivo do espaço pode ser usado no processamento de decisões
(Johnson and Redish, 2007), para o planejamento de trajetórias futuras (Pfeiffer and
Foster, 2013), e para evocar representações mnemônicas (Foster and Wilson, 2006)
subjacentes à atividade de navegação espacial.
A atividade rítmica de populações de neurônios registrados no hipocampo de
roedores se comportando ativamente é dominada por oscilações sinusoidais rítmicas
entre 5 e 12 Hz (banda Teta) (Buzsáki, 2006). Diversas evidências sugerem que o ritmo
Teta hipocampal funciona como um marcador temporal, coordenando a atividade de
redes de neurônios no hipocampo e em outras estruturas associadas. Um subgrupo de
interneurônios hipocampais apresenta disparos na frequência de 10 Hz, fortemente
acoplados à onda Teta, e por isso esses neurônios são chamados células-Teta (do
18 Hz) intercalados por longos períodos de silêncio, e também apresentam forte
correlação de disparos com o vale das ondas Teta hipocampais (Fox and Ranck Jr.,
1981). Além disso, oscilações hipocampais modulam atividade de grupos de neurônios
no corpo estriado, amígdala, córtex parietal, córtex pré-frontal, e de outras estruturas
(Seidenbecher et al., 2003; Jones and Wilson, 2005; Siapas et al., 2005; Sirota et al.,
2008; van der Meer and Redish, 2011).
Em períodos de vigília, o surgimento de oscilações Teta está associado a
estados de atenção e a ocorrência de movimentos voluntários, em contraste aos
comportamentos motores automáticos, que não apresentam oscilações Teta
proeminentes (Vanderwolf, 1969). Durante caminhadas e corridas, a amplitude das
oscilações Teta no hipocampo se correlaciona positivamente com a velocidade com
que os animais se locomovem pelo ambiente3 (Vanderwolf, 1969; Hinman et al., 2011).
As oscilações Teta sustentam o processamento hipocampal durante o
desempenho em tarefas de memória e tomada de decisão. Por exemplo, a taxa de
aprendizado de um condicionamento clássico é maior quando os estímulos são
apresentados durante a presença de oscilações Teta no hipocampo (Seager et al.,
2002). O surgimento de oscilações Teta no hipocampo depende de projeções
extra-hipocampais vindas do núcleo medial do septo e do córtex entorrinal4 (Buzsáki,
2002)(Kocsis, 1999). A ablação do ritmo Teta hipocampal através de lesões ou inibição
3
Além de associadas a comportamentos exploratórios na vigília, oscilações Teta no hipocampo surgem acompanhadas de dessincronização da atividade neocortical durante o sono paradoxal (ou sono REM, do inglês rapid eye movements, movimento rápido dos olhos) (Timo-Iaria, 1970).
4
19 farmacológica dessas projeções piora o desempenho de roedores em tarefa de
memória espacial aprendida antes da cirurgia (Winson, 1978; M’Harzi et al., 1987).
Contudo, essas lesões não impedem o reaprendizado da tarefa, indicando um déficit
específico da capacidade de evocação de informações previamente armazenadas.
Surpreendentemente, o reestabelecimento do ritmo Teta hipocampal através de
estimulação do fórnix na frequência de 7 Hz devolve a capacidade de desempenho na
tarefa aos animais lesionados (Mcnaughton et al., 2006).
Durante o aprendizado de tarefas de decisão espacial, o ritmo Teta hipocampal
modula a atividade de circuitos neuronais do corpo estriado (DeCoteau et al., 2007;
Tort et al., 2008; van der Meer and Redish, 2011), do córtex pré-frontal (Jones and
Wilson, 2005; Benchenane et al., 2010), e da área tegmentar ventral (Fujisawa and
Buzsáki, 2011). Segundo Womelsdorf, a sincronização rítmica entre essas estruturas
na banda Teta reflete a comunicação neuronal de circuitos dedicados ao
processamento de decisões (Womelsdorf et al., 2010b). A atividade hipocampal
apresenta forte aumento das oscilações Teta no momento das decisões (Johnson and
Redish, 2007; Tort et al., 2008; Montgomery et al., 2009; Schmidt et al., 2013). Esse
aumento é específico para o hipocampo dorsal, enquanto o hipocampo ventral não
apresenta variações da oscilação Teta durante decisões (Schmidt et al., 2013). Além
disso, o aumento de amplitude e frequência das oscilações Teta observado nos
momentos críticos da decisão não pode ser explicado apenas por alterações
locomotoras do animal (DeCoteau et al., 2007; Montgomery et al., 2009). De maneira
interessante, a relação entre velocidade de locomoção e potência de Teta se apresenta
20 sugerindo que o aumento das oscilações deve ser causado por fatores cognitivos
associados à decisão. Entretanto, a função do ritmo Teta hipocampal na execução de
tarefas de decisão permanece por ser esclarecido.
Para investigar os mecanismos neurais da tomada de decisão espacial, registrei
o potencial de campo local na região CA1 do hipocampo dorsal enquanto ratos Wistar
machos executavam uma tarefa de escolha espacial em labirinto radial de quatro
21
Objetivos
Objetivos gerais
Investigar o papel do ritmo Teta da região CA1 do hipocampo dorsal em tarefa
de tomada de decisão espacial em ratos.
Objetivos específicos
1) Avaliar a potência do ritmo Teta hipocampal no período de intervalo entre
decisões, durante a decisão, e durante a locomoção pós-tomada de decisão.
2) Comparar a potência das oscilações Teta de ratos previamente treinados e
de ratos não treinados na tarefa de escolha espacial.
3) Comparar a potência das oscilações Teta durante decisões corretas e
decisões incorretas.
4) Verificar a viabilidade de se usar a potência das oscilações Teta na tomada
22
Capítulo 1
Title: Retrieval-Related Increase in Hippocampal Theta Oscillations during Spatial Decision-Making
Running Title: Retrieval-Related Theta Oscillations during Decision-Making
Authors: Hindiael Belchior1,2, Vítor Lopes-dos-Santos1, Adriano B. L. Tort1, Sidarta Ribeiro1,2.
Affiliations: 1Brain Institute, Federal University of Rio Grande do Norte, Natal, Brazil; 2
Psychobiology Graduate Program, Federal University of Rio Grande do Norte, Natal,
Brazil.
* Corresponding author: sidartaribeiro@neuro.ufrn.br, Brain Institute, Federal University of Rio Grande do Norte. Av. Nascimento de Castro 2155, Zip Code 59056-450 – Natal /
RN – Brazil.
6 Figures; 2 Supporting Figures, 23 pages of text.
Keywords: Hippocampus, Spatial Memory, Spectral Analysis, Choice Prediction, Locomotion
Acknowledgements: Work supported by Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Financiadora de Estudos e Projetos (FINEP) grant
01.06.1092.00, Pró-Reitoria de Pós-Graduação da Universidade Federal do Rio Grande
do Norte (UFRN), Conselho Nacional de Desenvolvimento Cientifico e Tecnológico
(CNPq)/Ministério da Ciência e Tecnologia (MCT), CNPq Universal Grant
481351/2011-6, Programa de Apoio a Núcleos Emergentes (PRONEM 003/2011) FAPERN/CNPq,
Pew Latin American Fellows Program in the Biomedical Sciences, NIMBIOS working
group “Multi-scale analysis of cortical networks”, Instituto Internacional de
Neurociências de Natal Edmond e Lily Safra, Associação Alberto Santos Dumont para
Apoio a Pesquisa (AASDAP), and Centro de Pesquisa, Inovação e Difusão
23 Pavao, S. A. Mota-Rolim, N. A. Lemos, and F. C. Miranda for help with recordings and
analysis, and A. Ragoni and G. Filho for technical support.
Conflict of Interest: The authors declare no competing financial interests.
ABSTRACT
The processing of spatial and episodic information during memory tasks depends on
hippocampal theta oscillations. In the present study, we investigated the relationship
between theta power and choice selection during spatial decision-making. We recorded
local field potentials from the CA1 region of rats retrieving reward locations in a 4-arm
maze. In trained but not in naïve animals, we observed a significant increase in theta
power during decision-making, which could not be explained by changes in locomotion
speed. Furthermore, a Bayesian decoder based on theta power predicted choice
outcomes in speed-matched trials. The decoding time course revealed that performance
increased above chance before the decision moment exclusively for theta power,
remaining flat for other frequency bands. These results occurred for trained animals, but
no significant prediction could be made for naïve animals. Altogether, our data support a
mnemonic function of theta rhythm during spatial decision-making, indicating that these
oscillations correlate with the retrieval of memories required for successful decisions.
INTRODUCTION
During decision-making, animals must integrate sensorial (Platt, 2002; Gold and
24 information (Tolman, 1938b; Bett et al., 2012; van der Meer et al., 2012), which evolves
over time until the decision moment (Schall, 2001; Gold and Shadlen, 2007; van der
Meer et al., 2012). Successful decision-making requires coordinated processing of
networks distributed over hippocampus, striatum and cerebral cortex (Womelsdorf et al.,
2010b; Pennartz et al., 2011; Viard et al., 2011; van der Meer et al., 2012).
Hippocampal activity is critical for memory retrieval (Moser and Moser, 1998;
Fortin et al., 2004; Clark et al., 2005), spatial decision-making (Bett et al., 2012) and
episodic future thinking (Scoville and Milner, 1957; Squire, 1992; Eichenbaum, 2000,
2004; Hassabis et al., 2007; Bird and Burgess, 2008; Schacter et al., 2008). Theta
oscillations (5–12 Hz) in the hippocampus support mnemonic processes (Leung, 1998;
Buzsáki, 2002), and correlate with performance in memory-guided tasks (Jarrard, 1993;
Berry and Seager, 2001; Kahana et al., 2001; Buzsáki, 2005). During decision-making,
theta power increases in the dorsal hippocampus (Buzsaki and Montgomery, 2007;
DeCoteau et al., 2007; Johnson and Redish, 2007; Tort et al., 2008), and decouples
from locomotion speed, reflecting cognitive demands of the task (Schmidt et al., 2013).
However, the role of hippocampal theta oscillations in spatial decisions remains unclear.
To investigate this issue, we recorded local field potentials (LFPs) from the dorsal
CA1 region of trained and naïve rats during retrieval of reward locations in a four-arm
maze task. We observed that theta power increased during correct decisions of trained
animals - in comparison with incorrect choices, or untrained animals - independently of
locomotion speed. Remarkably, a decoder based on theta power predicted choice
performance on a single trial basis. Altogether, our findings point to a role of theta
25
METHODS
Surgical implantation of electrodes
Animal care and surgery procedures complied with the National Institute of Health
guidelines and were approved by the Ethics Committee for Animal Experimentation of
the Edmond and Lily Safra International Institute of Neuroscience of Natal (permit
02/2007). Eight adult male Wistar rats (3-6 months age, 250-350 g) were kept on a 12 h
light/dark schedule (lights on at 06:00), housed individually with free access to water
and limited access to food, so as to maintain ~85% of the body weight reached by
Wistar rats fed ad libitum. The animals were surgically implanted with 4x8 multielectrode
arrays (Teflon-coated tungsten microwires, diameter: 35-50 ȝm; inter-electrode spacing:
300 ȝm; impedance: ~0.5 MOhm at 1 KHz) targeting the pyramidal layer of the right
dorsal CA1 region of the hippocampus (AP: -3.6 and ML: +1.6 from Bregma; DV: 2.4
from the pial surface; Paxinos & Watson, 1998) under ketamine and xylazine
anesthesia (100 mg/Kg and 8 mg/Kg, respectively). Spiking activity was used to guide
array implantation. Ground and reference were provided by a silver wire soldered to a
stainless steel screw placed in the skull overlying the right frontal lobe.
Electrophysiological and behavioral recordings
Experiments began 7-10 days after surgery and consisted of continuous
electrophysiological and video recordings of freely moving animals during the maze task
and during inter-block intervals that occurred in an opaque plastic cage (35 cm height,
26 began daily at 11:00 with lights on, and were performed using a multichannel acquisition
processor (MAP, Plexon Inc., Dallas, TX). LFPs were pre-amplified (1000x), filtered
between 0.7-300 Hz, and sampled at 1 KHz. Behavior was recorded with a digital video
camera (30 frames per second) and spatial position was tracked by an automated
system that synchronized behavioral and neural data (Cineplex, Plexon Inc., Dallas,
TX).
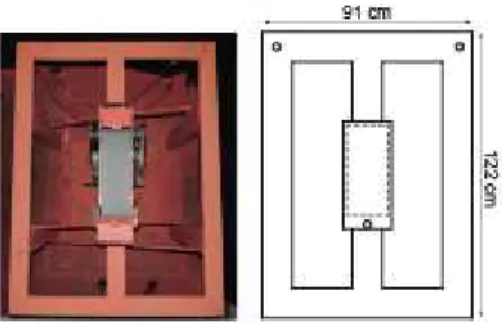
Four-arm radial maze
We used a modified version of the eight-arm radial maze (Olton et al., 1978; Floresco et
al., 1997). The behavioral apparatus was a black four-arm maze elevated 50 cm from
the floor; the arms were 50 cm long, 10 cm wide and 10 cm tall (Fig. 1A). The maze was
wiped with 70% alcohol before each trial block to remove odors. Reward was delivered
in round plastic bowls at the end of each arm. The recording room and the maze walls
displayed distal and proximal geometrical cues, respectively. Animals were individually
habituated to the experimental procedure for 5 days prior to recording.
Spatial choice task
Animals were submitted to a spatial choice task, in which at every trial they had to
choose one among four possible arms to obtain reward. Rats performed four blocks of
10 trials per session; after each block they rested for 30 minutes; only one experimental
session was performed per day. Only one arm was rewarded in each block of 10 trials,
and on the following block the rewarded arm was shifted according to a clockwise
sequential order. Four plastic opaque barriers were used to restrain the rats into the
27 removed and the rat had to choose one arm to enter. When a correct choice was made,
a chocolate cereal pellet was delivered at the end of the arm. Incorrect choices were not
rewarded. The animal then returned to the central area, where it remained restricted for
a 60 seconds delay period until the next trial. Speed of locomotion was calculated as
the distance covered by the animal over regular time intervals (0.03 s), using the center
of the body in each frame as spatial reference. The decision-making period (DM) was
defined as the time interval from the removal of the barriers to when the animal started
a consistent trajectory towards the end of the arm, i.e. when the distance between the
animal and the reward location began to decrease monotonically (the term “decision
moment” refers to the instant animals started to move towards the chosen arm). Notice
that speed of locomotion and distance from reward can vary within DM interval before
the achievement of a final decision. The running period (RUN) was defined as the
interval between the end of the DM period and the moment when the animal reached
the end of the arm. The inter-trial period (DELAY) was defined as the 5-second interval
preceding the beginning of DM (i.e., prior to the removal of the barriers). These intervals
allowed the comparison among a period without cognitive demands (DELAY), a period
in which the animals had to remember the rules of the task learned from previous
sessions (DM), and a post-decision period during which the animal was moving towards
the end of a given maze arm (RUN).
Trained and untrained animal groups
A group of rats (n=5) was trained to obtain 70% of correct performance before being
implanted with multielectrode arrays (7-18 days of training before surgery; Supporting
28 performance after surgery; a total of 1,520 trials were recorded over 38 sessions. To
investigate spatial memory, we compared trained animals that used previous
experience to execute the task with naïve animals performing random choices. To that
end we also recorded the very first training session in a group of naïve animals
implanted with multielectrode arrays before any training (n=3 rats, 120 trials recorded
over 3 sessions). Importantly, notice that within each group of animals (trained and
naïve) we compared correct versus incorrect choices with procedurally identical
conditions. A total of 41 recording sessions were analyzed (Trained: Rat1, 7 days; Rat2,
10 days; Rat4, 9 days; Rat5, 5 days; Rat8, 7 days; Naïve: Rat3, 1 day; Rat11, 1 day;
Rat12, 1 day).
Histology
After the recording sessions, rats were overdosed with pentobarbital (100 mg/Kg) and
perfused with saline, followed by 4% paraformaldehyde solution. The brains were
removed and stored in 4% paraformaldehyde/20% sucrose for 24h, then frozen and
sectioned in a cryostat (Micron). Coronal sections (50 ȝm) were thaw-mounted over
glass slides and stained with cresyl violet for inspecting the anatomical location of the
implants. The final positions of the electrode tips were determined using light
microscopy.
Spectral analysis
All spectral analyses were performed using custom-made and built-in MATLAB routines
(MathWorks, Natick, MA). Power spectra were estimated with the Welch periodogram
29 overlapping Hamming windows with a length of 1 s). Trials in which the DM or RUN
periods were shorter than 1 s were discarded. We computed the power spectrum for
each electrode during the DELAY, DM and RUN periods. Then, we averaged across
electrodes and trials to obtain the mean power spectral density of each period. We used
one-way ANOVA to compare absolute theta power and locomotion speed among
DELAY, DM and RUN periods, followed by Tukey-Kramer post-hoc test. In order to
compare subsets of DM and RUN periods in speed-controlled conditions, we first
normalized each power spectrum by the mean power during DM and RUN periods (i.e.,
normalized DM power = DM power/[DM power/2 + RUN power/2]). To control for
locomotion speed, we discarded trials with the highest and/or lowest speeds, in order to
match the median speed in DM and RUN. Mann-Whitney test was used to identify
differences between DM and RUN speed, and Student’s t-test was used to compare
normalized power values. The “theta/delta ratio” was obtained by dividing the power in
the theta band (5-12 Hz) by the power in the delta band (1-4 Hz); Student’s t-test was
used to compare theta/delta ratios between naïve and trained animals. Time-frequency
decompositions were obtained using continuous wavelet transform. First, we convoluted
LFP signals using complex Morlet wavelets with central frequencies ranging from 0.5 to
20 Hz in 0.5 Hz steps. Then, we calculated the instantaneous energy by the absolute
value of the transform. Finally, we averaged 10-second periods of the spectral
representation centered at the decision points. For the group results shown in Fig. 5,
each LFP signal was normalized by its root mean square before computing the wavelet
transform.
30 We used a uniform prior Bayesian decoder (Davidson et al., 2009) to predict correct and
incorrect choices based on theta power during DM in speed-controlled trials. We used
the cross-validation leave-one-out training protocol, and the input to the decoder was
the mean power in a restricted theta band (6-10 Hz). Other frequency bands were also
tested: delta (1-5 Hz), beta (23-27 Hz), and gamma (38-42 Hz). In order to address the
statistical significance of the predictions for each rat, we repeated the same decoding
protocols for 1,000 surrogate trials. Surrogates were generated by randomly shuffling
the labels of correct and incorrect trials. Thus, the prediction p-value was defined as the
proportion of surrogate trials with higher decoding performance than the original.
RESULTS
Behavioral performance
Trained animals achieved task performance of 75 ± 0.1% before surgery
(Supporting Information Fig. S1A), and performed the task at 59 ± 2% of correct choices
during recording sessions (Fig. 1B). On the other hand, naïve animals explored the
maze randomly and performed correct choices in 22 ± 1% of the trials (Fig. 1B),
statistically lower than trained animals (p<0.01, t-test) and close to chance (i.e., 25%).
Performance across trials increased within blocks for trained but not naïve animals (Fig.
1C). Trained animals exhibited a decrease in performance between the last trial of a
block and the first trial of the next block, but tended to perform above chance already on
the first trial (Fig. 1C). Mean performance was stable across recording sessions in
31 S1A). Fig. 1D shows the trajectories of a trained (left panel) and a naïve (right panel)
animal across the four 10-trial blocks of a session. Supporting Information Fig. S1B
shows the distributions of interval durations for the DM and RUN periods in trained (top)
and naïve (bottom) animals. Fig. 1E shows a representative Nissl-stained coronal
section from the right dorsal hippocampus with electrode paths reaching the pyramidal
layer of the CA1 region.
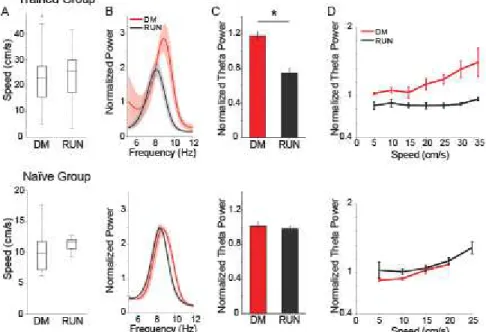
Figure 1. Experimental design and behavioral performance in the spatial choice task. A: Schematic representation of the four-arm maze. Dashed lines mark the region where the rats stay during inter-trial intervals; each trial starts after a square barrier is
removed. Circles denote reward positions (only one position was rewarded per trial
block; see Methods). B: Mean task performance for trained and naïve animals (*p<0.01,
t-test). C: Task performance across trials for trained and naïve animals; mean ± SEM (*
p<0.05, t-test). D: Representative trajectories of a trained (left) and a naive rat (right)
across four 10-trial blocks within one recording session. Reward location changed from
arm to arm at every trial block in a clockwise manner. Trials from different blocks are
represented by different shades of blue. E: Representative cresyl stained brain section
showing glial tracks corresponding to electrodes implanted in the pyramidal layer of the
32
Theta power increases during spatial decision-making
To investigate whether the dorsal CA1 region of the hippocampus contributes to
decision-making, we analyzed LFPs of trained and naïve rats while they performed the
spatial choice task. LFPs of trained animals exhibited strong 5-12 Hz theta oscillations
during the decision period of the task (DM), noticeable both in the raw signal (Fig. 2A
top) and by spectral analysis (Fig. 2A bottom). Fig. 2B shows the animal’s
instantaneous speed (top), and the distance between the animal and the reward
location in the same representative trial (bottom). Fig. 2C shows group results for
locomotion speed (top) and distance to reward location (bottom) triggered by the
decision moment. Note that the distance to reward decreases monotonically after the
decision moment, which defines the end of the DM period. Notice further a period of
increased speed during DELAY, i.e. not accompanied by the same high levels of theta
33
Figure 2. Theta power increases during decision-making. A: Hippocampal LFP (gray) recorded during a representative trial (top). Horizontal green, red and black
segments indicate periods of inter-trial interval (DELAY), decision-making (DM) and
running (RUN), respectively. Vertical dashed lines mark the moment when barriers were
removed (i.e. beginning of DM), and the moment when the animal starts to move
towards the reward (i.e. decision moment; see Methods). Notice the emergence of
robust theta oscillations (5-12 Hz, blue) at the beginning of DM. Wavelet spectrogram
showing increased theta energy during DM and RUN (bottom). B: Instantaneous
locomotion speed of the same representative trials as above (top). Notice that
locomotion speed increases substantially after the decision, during the RUN period.
Distance to reward location of the same representative trials as above (bottom). C:
34 reward location (bottom) with all trials triggered by the decision moment (vertical dashed
line); mean ± SEM (black solid and dashed line, respectively).
We next systematically analyzed theta power and locomotion speed in the
different periods of the task. In trained animals, mean theta power was significantly
higher during DM than during the DELAY period (p<0.01, one-way ANOVA), and not
statistically different from the RUN period (Fig. 3A left). In naïve animals, mean theta
power was not significantly different among DELAY, DM and RUN periods (Fig. 3A
right, p=0.58, one-way ANOVA). As expected from the task design, mean locomotion
speed was higher during RUN than DM, and higher during DM than DELAY periods for
trained and naïve animals (Fig. 3B left and right, respectively; p<0.01, one-way
ANOVA). Therefore, the increased theta power observed during DM in trained animals
could not be solely explained by locomotor activity. We then directly compared theta
power during DM between the two groups, and found significantly higher theta power in
trained than in naïve rats (Fig. 3C, p<0.01, t-test). To control for differences in
locomotion speed, we analyzed the theta/delta power ratio during DM in speed-matched
trials. Similar to the absolute level of theta power, theta/delta power ratio was also
stronger in trained than in naïve animals (Fig. 3D, p<0.05 for speeds up to 15 cm/s).
Therefore, the different results obtained in trained and naïve animals suggest that
hippocampal theta oscillations are involved in the processing of cognitive demands such
35
Figure 3. Trained but not naïve animals have increased theta power during decision-making. A: Mean theta power in trained (left) and in naïve (right) animals during DELAY, DM and RUN periods (*p<0.01, one-way ANOVA). B: Mean locomotion
speed for trained (left) and naïve (right) animals during DELAY, DM and RUN periods
(*p<0.01, one-way ANOVA). C: Mean theta power during decision-making was higher
for trained (black) than naïve (blue) animals (*p<0.01, t-test). D: Theta/delta power ratio
during DM as a function of speed for both groups of animals. Bars represent SEM.
Increased theta power during decision-making is not due to locomotion
To further disambiguate theta power and locomotion speed, we compared theta
power in subsets of DM and RUN periods matched for similar locomotion speed; this
comparison aimed at ruling out the possibility that increases in theta oscillations during
DM were a byproduct of motor execution. Within speed-controlled conditions (Fig. 4A),
we found that theta power in trained animals was higher during DM compared to RUN
36 not occur for any of the naïve animals (Supporting Information Fig. S2). Additionally, we
observed that theta power was higher in DM than in RUN through a wide range of
speeds (Fig. 4D top panel, p<0.05, t-test). These results show that changes in
locomotion speed could not account for the increase in theta power observed during
decision-making. Quite different results were found when the same speed-controlled
analysis was applied to data from naïve animals, which presented no statistical
difference in mean theta power between DM and RUN (Fig. 4B and C bottom panels,
p=0.55, t-test), nor did theta power differ for any of the speed ranges examined (Fig. 4D
bottom panel). In summary, the increased theta power during DM, observed only in
trained animals, does not reflect the locomotor aspects of the task.
Figure 4. Within speed-controlled conditions, decision-making is associated with highest theta power in trained animals, but not in naïve animals. A: Speed distributions in subsets of trials sorted for equivalent running speed during DM and
RUN. In these trials, average locomotion speed was not significantly different between
DM and RUN periods (p=0.71 and p=0.09 for trained and naïve, respectively,
37 speeds). B: Mean power spectral density for speed-controlled trials. C: Average theta
power computed for speed-controlled trials. Theta power was significantly higher during
DM in comparison with RUN in trained animals (*p<0.05, t-test). In naïve animals there
was no significant difference in theta power during DM and RUN (p=0.55, t-test). D:
Mean theta power as a function of speed during DM and RUN periods. To allow the
comparison of theta power in different electrodes and animals in panels B, C and D,
individual power spectral densities were normalized to the mean power level during both
DM and RUN periods (that is, only the relative levels of theta power between RUN and
DM mattered, not the absolute power values; see Methods).
Theta power during decision-making is stronger in correct trials and predicts choice outcome
The results above suggest that theta power during decision-making plays a role
in mnemonic retrieval, leading to the hypothesis that the modulation of theta power
during decision-making would also predict the success of the choices in trained animals.
To investigate this hypothesis, we computed spectral decompositions of LFPs triggered
by the decision moment separated for correct and incorrect decisions. We found that
theta power peaked around the decision for both choice outcomes (Fig. 5A), and that at
the decision moment theta power was stronger for correct than for incorrect trials (Fig.
5B p<0.05, t-test). The peak of theta power around the decision moment reveals a tight
temporal relationship between the emergence of theta oscillations and choice selection.
We next compared theta power during decisions preceding correct and incorrect
choices in subsets of trials matched for locomotion speed (left panels in Fig. 5C and
38 for correct than for incorrect trials (Fig. 5C right, p<0.01, t-test). In naïve animals, there
was no statistical difference in DM theta power between correct and incorrect trials (Fig.
5D right, p=0.58, t-test). These results demonstrate that increased hippocampal theta
power is associated with correct choices. In agreement with these results, we found that
task performance was strongly related to theta power during DM in trained animals (Fig.
5E, top panel), but not in naïve animals (Fig. 5E bottom panel).
Figure 5. Correct choices are associated with stronger theta power during decision-making. A: Average wavelet spectrogram around the decision moment for all correct (top) and incorrect trials (bottom). Red curves indicate locomotion speed (scale
on the right). B: Z-scored theta power values around the decision moment for all correct
(green) and incorrect (red) trials (theta band power values were obtained using
1-second sliding windows, 200-ms step). Theta power was significantly higher at the
decision moment in correct trials (time=0, single bin, p<0.05, t-test). C: Speed
distribution (left) and power spectra (right) for speed-matched trial subsets in trained
animals; notice increased theta power during correct trials in comparison with incorrect
39 difference in theta power between correct and incorrect trials in naïve animals (p=0.58,
t-test). To allow the comparison of theta power in different electrodes and animals in C
and D, individual power spectral densities were normalized to the mean power level
during both correct and incorrect trials. E: Relationship between theta power during
decision-making and task performance in trained (top) and naïve (bottom) animals;
theta power quintiles in crescent order.
To further investigate this relationship, we applied a decoding approach to
investigate whether theta power during DM could be used as a predictor of choice
outcomes in speed-matched trials. We found that theta power could significantly predict
correct and incorrect choices on a single trial basis (Fig. 6A top panel, decoding
performance = 60.2±2.5%, p<0.01, one-tailed t-test compared to 50%), while other
spectral bands were uninformative (decoding performance = 49.9±1% with p=0.83 for
delta band, 52.6±1.4% with p=0.20 for beta band, 51.0±1.8% with p=0.66 for gamma
band). Theta power allowed for significantly correct predictions in 4 out of 5 trained rats
(p=<0.002, permutation test); in contrast, prediction performance was never significant
for naïve animals (Fig. 6A, bottom panel). To investigate whether the predictive signal
emerges around the decision moment, we analyzed the time course of the decoder
performance on decision-triggered LFPs. In trained animals, prediction performance
increased before the decision moment specifically for power in the theta band (Fig. 6B,
top panel). Prediction performance for other frequency bands remained rather constant
at chance levels around the decision moments. No significant temporal modulation in
40 data show that only the theta band in trained animals allows for the LFP-based
decoding of choice outcomes.
Figure 6. Theta power during decision-making predicts choice outcomes. A: Mean decoding performance of choice outcomes (correct vs. incorrect) based on mean power
per frequency band in speed-matched trials for trained (top) and naïve (bottom)
animals. Chance performance is 50%; results expressed as mean decoding
performance ± SEM across rats. Note that statistically significant decoding occurred
only for the theta band (*p<0.01, one-tailed t-test). B: Time course of decoding
performance for different LFP frequency bands, for trained (top) and naïve (bottom)
animals.
DISCUSSION
A critical feature of decision-making is the retrieval of previously stored
41 Shohany, 2011). Although several studies have shown increases in hippocampal theta
power during decision-making tasks (Johnson and Redish, 2007; Montgomery et al.,
2009; Schmidt et al., 2013), and the coordination of distant brain structures in theta
frequency band (Jones and Wilson, 2005; DeCoteau et al., 2007; Tort et al., 2008;
Benchenane et al., 2010; Womelsdorf et al., 2010a), the role of hippocampal theta
oscillations in choice selection remains unclear. Here, we observed that the increased
theta power of spatial decision-making is associated with successful task execution,
since strongest theta oscillations occurred in trained rats during correct choices.
Interestingly, theta power increased over time after the beginning of the
decision-making period, reaching a peak at the decision moment. We also found that
hippocampal theta power during decision-making was predictive of subsequent correct
and incorrect choices on a trial-by-trial basis. Our results reinforce previous
observations of increased hippocampal theta power during decision moments
(DeCoteau et al., 2007; Johnson and Redish, 2007; Tort et al., 2008; Montgomery et al.,
2009; Schmidt et al., 2013), and establish a link between theta power at
decision-making and the success of ensuing choices.
The hippocampus plays an essential role in memory encoding and retrieval
during maze tasks (Milner et al., 1998; Eichenbaum, 2000, 2004; Bird and Burgess,
2008), in which place and event representations guide behavior (Johnson et al., 2007;
Lisman and Redish, 2009; Womelsdorf et al., 2010b; Battaglia et al., 2011; Pennartz et
al., 2011). Direct evidence of the hippocampal involvement in decision-making comes
from lesion studies showing that damage to the hippocampus impairs choice
42 result, we found that trained animals performing the task based on previously acquired
spatial memories presented strong theta oscillations during decision-making. In
contrast, naïve animals performing random foraging showed no significant increases in
theta rhythmic activity (Fig. 3), despite the fact that the hippocampus is important for
random foraging in radial-arm maze tasks (Floresco et al., 1997).
In our experiments, trained and naïve animals were submitted to exactly the same
behavioral procedure during recording sessions, in spite of different memory demands. Rats were rewarded for visiting a specific arm during all the trials within a block, with
fixed rotations of the reward position across blocks. Trained animals had necessarily to
retrieve spatial memories to perform decisions above chance levels, while naïve
animals relied on a random foraging strategy to find rewarded arms (Fig. 1C and 1D).
Our four-arm maze is a modified version of an eight-arm radial maze, which measures
both the reference and working memory components of spatial memory (Olton et al.,
1977; Becker et al., 1980). The radial-arm maze task is hippocampal-dependent when
there is a delay period between consecutive trials, which was the case in our
experiments (Becker et al., 1980; Floresco et al., 1997). In trained animals, the increase
in performance within a block and the decrease between blocks (Fig. 1C) suggest a
strategy shift within each block, from spatial reference in the beginning, to working
memory towards the end.
Given that theta power correlates positively with running speed (Vanderwolf,
1969; McFarland et al., 1975; McNaughton et al., 1983; Hinman et al., 2011), a
fundamental concern in our study was to dissociate the effect of motor activity and
43 oscillations during decision-making are not directly related to locomotion speed
(Montgomery et al., 2009). Moreover, theta power is uncoupled from running speed in
the dorsal but not in the ventral hippocampus (Schmidt et al., 2013). To further
investigate the dissociation between cognitive processing and motor effects on theta
oscillations, we analyzed theta power within subsets of trials matched for the same level
of average speed (Fig. 4 and 5). This approach showed that differences in theta power
were not a byproduct of differences in locomotion speed.
In humans, hippocampal activity also supports memory-guided decision-making.
Functional neuroimaging studies have shown that hippocampal activity increases when
subjects retrieve the goal location in a virtual maze (Viard et al., 2011). In
electrophysiological recordings from temporal areas, theta oscillations are modulated by
contextual and spatial decision-making tasks, and correlate with memory retrieval
(Kahana et al., 1999; Guitart-Masip et al., 2013). In addition, theta power increases in
parieto-temporal areas when subjects correctly recognized previously presented items
(Osipova et al., 2006). Taken together, these data strengthen the notion that
hippocampal theta oscillations support successful choices through the retrieval of
memories that underlie decision-making.
To the best of our knowledge, our results constitute the first observation that
increased hippocampal theta power during decision-making predicts successful
outcomes in a spatial choice task. The capacity to forecast the success of choices
based solely on theta power indicates that this oscillation reflects hippocampal
processing during spatial decision-making (Kahana et al., 1999; Sederberg et al., 2003).
44 which is associated with the activity of hippocampal networks (Hassabis et al., 2007;
Schacter et al., 2007). However, we found no prominent increases in theta power during
decision-making in naïve animals. This result does not support the involvement of theta
rhythm in the mere planning of future actions. Instead, the emergence of strong theta
activity in the hippocampus when memory-guided decisions are required indicates that
theta oscillations support the retrieval of rewarded spatial choices.
45
FIGURES
Supporting Information Figure S1. General behavior. A: Learning curve before (training) and after (recording) the surgical implantation of multi-electrode arrays in the
hippocampus. B: Distribution of durations of DM and RUN periods for trained (top) and
46
Supporting Information Figure S2. Mean power spectral density for speed-controlled trials during DM (red) and RUN (black) for all animals recorded. Insets show speed
distributions in subsets of trials sorted for equivalent running speed. A: Trained animals.
47
Conclusões e considerações finais
Um conjunto de resultados recentes tem sugerido que o aumento das oscilações
Teta no hipocampo reflete o envolvimento dessa estrutura no processamento de
decisões espaciais. Para investigar a função hipocampal em tarefas de decisão
espacial, nós comparamos a potência das oscilações Teta em animais treinados e
animais não-treinados, e verificamos que o hipocampo está envolvido no processo de
decisão à medida que informações mnemônicas são usadas para guiar o
comportamento. Nós observamos que o aumento de potência das oscilações Teta está
associado com o desempenho de execução na tarefa, visto que as oscilações mais
intensas foram observadas em animais treinados durante decisões corretas. Dentro
dos períodos de decisão, a potência de Teta aumenta até atingir um pico no momento
da decisão. Nós então verificamos que usando a potência de Teta durante a decisão é
possível prever o desempenho de escolha dos animais a cada tentativa. Dessa forma,
nossos resultados sugerem que o ritmo Teta hipocampal reflete a evocação de
memórias que dá suporte à tomada de decisão, e que a potência dessas oscilações é
48
Capítulo 2
______________________________________________
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
PROJETO DE DOUTORADO SANDUÍCHE - CNPq
Reativação de sequências temporais no hipocampo do rato
Proponente: Hindiael Belchior
Orientadores: Sidarta Ribeiro, Adriano Tort, Howard Eichenbaum.
Instituições: Instituto do Cérebro (UFRN)
Laboratory of cognitive neurobiology (Boston University)
49
Introdução
______________________________________________
Os neurônios piramidais do hipocampo disparam potenciais de ação seletivamente
quando um animal explora lugares específicos do ambiente, e por isso são chamados
de células de lugar (do inglês “place cells”) (O’Keefe and Dostrovky, 1971). Quando um
animal se locomove pelo espaço, sequências de células de lugar codificam os lugares
visitados durante a trajetória (Nakazawa et al., 2004) (Figura 7). Essas sequências
espaciais são frequentemente reativadas durante os períodos subsequentes de vigília
quieta, sono de ondas lentas e sono REM (sigla para movimento rápido dos olhos, em
inglês) (Wilson and McNaughton, 1993; Lee and Wilson, 2002; Foster and Wilson,
2006; Diba and Buzsáki, 2007; O’Neill et al., 2010). A reativação de trajetórias
espaciais ocorre de maneira temporalmente comprimida e ocorrem concomitantemente
a oscilações de alta frequência no potencial de campo local, chamadas Sharp-wave
Ripples (Buzsaki, 1998) (SWR, ~200 Hz; Figura 8). SWR refletem a atividade de
disparos sincronizados de grandes populações de neurônios hipocampais, e estão
associados à plasticidade sináptica e à comunicação hipocampo-cortical (Ji and Wilson,
2007). A inibição seletiva de SWR no hipocampo piora o aprendizado e o desempenho
de ratos em tarefas de memória espacial, indicando um papel fundamental dos eventos
50
Figura 7: Representação esquemática da atividade de 4 células de lugar. Cada célula emite potenciais de ação em uma determinada região do espaço. Os gráficos de cores
à direita mostram os campos de lugares (“place fields”) das respectivas células. A
atividade conjunta destes neurônios é caracterizada por sequências de disparos (neste
exemplo ilustrativo, temos a sequência Célula 4 -> Célula 2 -> Célula 1 -> Célula 3).
51
Figura 8: Representação esquemática da atividade de 6 células de lugar durante exploração do ambiente e as durante sessões de sono prévia e subsequente. O painel
acima mostra a sequência de células de lugar ativadas ao longo da trajetória do animal.
Abaixo à esquerda, oscilações ripples no potencial de campo hipocampal são
mostradas em associação a atividade das células de lugar durante a sessão de sono
prévia a exploração do ambiente. O painel à direita mostra a atividade dessas células
na sessão de sono subsequente. Note que após a exploração, a atividade das células
de lugar reflete a reativação de sequências espaciais exibida durante a trajetória, o que
fortalece as conexões sinápticas durante o sono de ondas lentas. Retirado de O’Neill e
colaboradores, Trends in Neurosciences (2010).
Neurônios hipocampais também apresentam atividade sequencial durante
intervalos de tempo onde informação mnemônica deve ser mantida para que os
animais possam concluir os objetivos da tarefa (Pastalkova et al., 2008; MacDonald et
al., 2011; Kraus et al., 2013) (Figura 9). Segundo Eichenbaum (2013), essa atividade
sequencial codifica momentos sucessivos no tempo, possivelmente cobrindo intervalos
temporais para estabelecer uma experiência organizada em representações
mnemônicas de longa duração. Por causa de sua especificidade temporal, esses
neurônios foram chamados de células de tempo (“time cells”, em inglês; Figura 10).
Tem sido proposto que a atividade sequencial de células de tempo possibilita a
formação de relações temporais entre eventos ordenados, fornecendo a organização
52
Figura 9: Caracterização da atividade de neurônios do hipocampo que codificam o tempo. (A) Disparos de diferentes neurônios representados por pontos de diferentes
cores ao longo da trajetória do animal pelo labirinto. A tarefa consiste na alternância de
escolhas em um labirinto em T modificado (labirinto em forma de 8) onde o animal
corre em uma roda giratória no período entre as escolhas. (B) Porcentagem de
neurônios ativos de acordo com a posição do animal no labirinto. Note a alta
porcentagem de neurônios ativos durante a espera para uma nova escolha na roda
giratória. (C) Scatter plot da taxa de disparos de potenciais de ação de neurônios
hipocampais na roda giratória e durante trajetória no labirinto. Note que neurônios
ativos em uma etapa possuem baixa atividade em outra etapa. (D) “Campos de tempo”
(“time fields”, em analogia aos “place fields”). Cada painel mostra a atividade de um
neurônio hipocampal através do tempo (eixo x) de espera na roda giratória, para
diferentes tentativas (eixo y). Note que estes neurônios disparam em determinados
tempos após o início da corrida na roda giratória. (E) Atividade de todos os neurônios
de tempo durante o período de espera entre escolhas na roda giratória, ordenada pelo
53 pode ser descrita como uma sequência temporal que preenche todo o evento. Retirado
de Pastalkova e colaboradores, Science (2008).
Figura 10: Segundo trabalho mostrando a existência de neurônios de tempo no hipocampo. Retirado da revisão de Eichenbaum, Trends in Cognitive Sciences (2013);