UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS EXATAS E DA TERRA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
DISSERTAÇÃO DE MESTRADO
SÍNTESE HIDROTÉRMICA ASSISTIDA POR MICRO-ONDAS DE TiO2, E APLICAÇÃO EM NANOCOMPÓSITO
MARA TATIANE DE SOUZA TAVARES
Orientadora: Fabiana Villela da Motta Coorientador: Carlos Alberto Paskocimas
Dissertação n° 117/PPgCEM
MARA TATIANE DE SOUZA TAVARES
SÍNTESE HIDROTÉRMICA ASSISTIDA POR MICRO-ONDAS DE TiO2, E APLICAÇÃO EM NANOCOMPÓSITO
Dissertação apresentada ao Programa de Pós Graduação em Ciência e Engenharia de Materiais da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para a obtenção do título de Mestre em Ciência e Engenharia de Materiais.
Orientadora: Profa. Dra. Fabiana Villela da Motta
Coorientador: Prof. Dr. Carlos Alberto Paskocimas
UFRN / Biblioteca Central Zila Mamede Catalogação da Publicação na Fonte
Tavares, Mara Tatiane de Souza.
Síntese hidrotérmica assistida por micro-ondas de TiO2, e aplicação em nanocompósito. / Mara Tatiane de Souza Tavares. – Natal, RN, 2013.
89 f. : il.
Orientadora: Profa. Dra. Fabiana Villela da Motta. Co-orientador: Prof. Dr. Carlos Alberto Paskocimas.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Ciência e Engenharia de Materiais.
1.Nanotecnologia - Dissertação. 2. Micro-ondas - Dissertação. 3. Nanopartícula - Dissertação. 4. Nanocompósito – Dissertação. 5. Atividade fotocatalítica – Dissertação. I. Motta, Fabiana Villela da. II. Paskocimas, Carlos Alberto. III. Universidade Federal do Rio Grande do Norte. IV. Título.
“Sei que meu trabalho é como uma gota do oceano, mas sem essa gota ele
seria bem menor”.
AGRADECIMENTOS
Agradeço a Deus por me dar condições físicas e mentais para realização desse trabalho.
A minha orientadora Profa. Dra. Fabiana Villela da Motta, pela atenção,
confiança, conhecimentos passados, telefonemas e e-mails atendidos, tornando assim possível a realização deste trabalho.
Ao Prof. Dr. Carlos Alberto Paskocimas, pela oportunidade, confiança e boa vontade que sempre pude contar durante o desenvolvimento do projeto.
Ao Prof. Dr. Maurício Roberto Bomio Delmonte e a Profa. Dra. Amélia Severino
Ferreira e Santos, pelas contribuições para a pesquisa, pelo interesse e disponibilidade em me ajudar durante toda parte prática desse trabalho.
Aos laboratórios de síntese química dos materiais e síntese de polímeros da UFRN, também ao laboratório de materiais e combustíveis da UFPB, por me proporcionar a infra-estrutura necessária para o desenvolvimento deste trabalho.
A Profa. Dra. Iêda Maria da UFPB, e suas alunas Márcia, Laís e Suelem, por
disponibilizar tempo e equipamentos para realização da prática desse trabalho. Agradeço aos meus irmãos, Maíra Ticiane Souza Tavares e Edmilson Dias Tavares Filho. As sobrinhas lindas pelo amor e carinho dedicados a mim e aos meus familiares por torcerem e acreditarem em minhas conquistas, em especial aos meus tios Raimundo Nonato de Souza e Maria Eli Dias.
Ao meu noivo Tarcisio Morais da Silva, pelo companheirismo, dedicação e paciência, acreditando e confiando sempre em mim.
Aos amigos Raquel Carvalho, João José, Igor Jefferson, Gelsoneide Goís, Cesar Rogério e Tharsia, pelo companheirismo e apoio durante o decorrer do curso.
Ao CNPq pela disposição da bolsa de mestrado.
A todos que me apoiaram de alguma forma, e contribuíram para construção desta dissertação.
RESUMO
Nas últimas décadas tem-se observado um crescimento acentuado no estudo da área de nanociência e nanotecnologia em que inclui-se nessa área, o estudo de nanocompósitos com propriedades autolimpantes. Desde que o dióxido de titânio (TiO2) apresenta alta atividade fotocatalítica e também, atividade antimicrobiana, sua aplicação em superfícies autolimpantes tem sido amplamente explorada. Neste trabalho foi feito uma comparação entre duas rotas de síntese para obtenção de nanopartículas de TiO2 pelo método hidrotérmico assistido por micro-ondas. Após análise de DRX e MEV foi analisado o melhor material para aplicação em nanocompósitos. Foram depositados filmes de nanocompósito de poli(dimetil siloxano) (PDMS) com 0,5, 1, 1,5 e 2% em massa de nanopartículas de dióxido de titânio (TiO2) pelo método de aspersão. O nanocompósito foi diluído em hexano e a suspensão foi depositada sobre lâminas de vidro, seguida de cura em estufa com circulação forçada de ar. A atividade fotocatalítica do nanocompósito impregnado com azul de metileno foi avaliada pela técnica de espectroscopia de UV-Vísivel, a partir da variação da intensidade de absorção do pico principal a 660 nm com o tempo de exposição em câmara UV. Alterações no ângulo de contato e na microdureza foram analisadas antes e após o ensaio de envelhecimento UV. O efeito da radiação ultravioleta na estrutura química da matriz de PDMS foi avaliado por espectrofotometria no infravermelho por transformada de Fourier (FTIR). Os resultados indicaram que a adição das nanopartículas de TiO2 em PDMS conferiram
ao revestimento boa atividade fotocatalítica na decomposição do azul de metileno, característica importante para o desenvolvimento de revestimentos autolimpantes.
ABSTRACT
In recent decades have seen a sharp growth in the study area of nanoscience and nanotechnology and is included in this area, the study of nanocomposites with self-cleaning properties. Since titanium dioxide (TiO2) has high photocatalytic activity
and also antimicrobial, self-cleaning surfaces in your application has been explored. In this study a comparison was made between two synthesis routes to obtain TiO2 nanoparticles by hydrothermal method assisted by microwave. And after
analysis of XRD and SEM was considered the best material for use in nanocomposites. It was deposited nanocomposite film of poly (dimethyl siloxane) (PDMS) with 0.5, 1, 1.5 and 2% by weight of nanoparticles of titanium dioxide (TiO2)
by the spraying method. The nanocomposite was diluted with hexane and the suspension was deposited onto glass substrate, followed by curing in an oven with forced air circulation. The photocatalytic activity of the nanocomposite impregnated with methylene blue was evaluated by UV- vis spectroscopy from the intensity variation of absorption main peak at 660nm with time of exposure to the UV chamber. Changes in the contact angle and microhardness were analyzed before and after UV aging test. The effect of ultraviolet radiation on the chemical structure of the PDMS matrix was evaluated by spectrophotometry Fourier transform infrared (FTIR).The results indicated that the addition of TiO2 nanoparticles in the coating
PDMS gave high photocatalytic activity in the decomposition of methylene blue, an important characteristic for the development of self-cleaning coatings.
LISTA DE FIGURAS
Figura 1 Estruturas cristalinas do TiO2 : anatase (A), rutilo (B) e bruquita
(C)
23
Figura 2 Mecanismo para a fotoativação de partícula semicondutora 29 Figura 3 Aplicações em fotocatálise de TiO2 30
Figura 4 (a) Sistema hidrotérmico de micro-ondas, (b) Meio reacional aquecido por micro-ondas, e (c) Acoplamento da água com as micro-ondas
35
Figura 5 Métodos de preparação de nanocompósitos 38
Figura 6 Tipos de nanocompósitos 39
Figura 7 Representação da estrutura química do PDMS 41 Figura 8 Fluxograma da metodologia da rota A 46 Figura 9 Fluxograma da metodologia da rota B 47 Figura 10 Sistema de aplicação dos nanocompósitos 50 Figura 11 (a) Difratograma das nanopartículas de TiO2 obtidas pelas rotas
A, (b) difratograma das nanopartículas de TiO2 obtidas pela rota
B
56
Figura 12 Imagens de MEV das nanopartículas de TiO2 sintetizado pela
rota A (a) e rota B (b)
58
Figura 13 Difratogramas das nanopartículas de TiO2 sem calcinação (a) e
calcinadas a 200°C por 5 (b), 15 (c), 30 (d), 45 (e) e 60 (f) minutos
59
Figura 14a Imagens de MEV das nanopartículas de TiO2 sem 60
Figura 14b Imagens de MEV das nanopartículas de TiO2 calcinadas a 200°
por (b) 5, (c) 15, (d) 30, (e) 45 e (f) 60 minutos
61
Figura 15 Micrografias obtidas por MEV da seção transversal dos filmes depositados à pressão 20 psi e em tempos de 2 (a), 4 (b) e 6 (c) segundos
63
Figura 16 Valores da espessura do filme de PDMS em função do tempo e da pressão empregados durante a deposição por aspersão
64
Figura 17 Variação da concentração de azul de metileno nos
nanocompósito após envelhecimento UV por 120 minutos
Figura 18 Espectro de FTIR/ATR do PDMS puro antes e após envelhecimento UV
66
Figura 19 Reação de formação dos grupos hidroxilas 67 Figura 20 Espectro de FTIR/ATR do compósito PDMS/TiO2 antes e após
envelhecimento UV (a) 0,5% de TiO2, (b) 1% de TiO2, (c) 1,5% de
TiO2 e (d) 2% de TiO2
68
Figura 21 Resultado de nanodureza Vickers para as amostras de PDMS puro e com adição de 0,5 e 1 % em massa de TiO2, antes e após
envelhecimento UV
70
Figura 22 Ângulos de contato de líquidos com superfícies sólidas: (a) não molhantes; (b) predominantemente molhante e (c) superfície molhante
71
Figura 23 Molhabilidade superficial dos filmes de PDMS puro (a) e PDMS/TiO2 (b)
72
Figura 24 Medidas do ângulo de contato dos nanocompósitos antes e após envelhecimento UV
LISTA DE QUADROS
Quadro 1 Diferentes métodos para sistemas de catálise homogênea e heterogênea
27
Quadro 2 Características de sínteses pelo método hidrotérmico encontradas na literatura
34
Quadro 3 Classificação dos nanocompósitos segundo suas ligações. 37 Quadro 4 Aplicações das diferentes formas das siliconas 41 Quadro 5 Denominação, fórmula química e fabricante dos reagentes
utilizados na rota A
44
Quadro 6 Denominação, fórmula química e fabricante dos reagentes utilizados na rota B
44
LISTA DE TABELAS
Tabela 1 Dados cristalográficos da fase anatase 24 Tabela 2 Potencial de oxidação eletroquímica (POE) 27 Tabela 3 Variáveis de composição e tempo de aplicação estudados 50 Tabela 4 Formulações para confecção dos nanocompósitos 51 Tabela 5 Dados cristalográficos dos difratrogramas 57 Tabela 6 Correlação de número de ondas (cm-1) com os modos vibracionais
na amostra do filme de PDMS puro
LISTA DE ABREVIATURAS
TiO2 Dióxido de Titânio
PDMS Polimetilsiloxano DRX Difração de raio-X
MEV-Feg Microscopia eletrônica de varredura com emissão de campo
BET Brunauer, Emmett e Teller
UV Ultravioleta
eV Eletrovolts
Eg Energia de gap
°OH Hidroxila
E° Energia
V Volts
Å Angstrom (1x10-10 m) Nm nanômetros (1x10-9 m)
UVC UVA UVB Radiações ultravioleta BV Banca de Valência
BC Banda de Condução
NaOH Hidróxido de Sódio pH Potencial hidrogeniônico HC Hidrotermal convencional
h Altura
°C Graus Celsius
PLA Poli-lactídeo
PEAD Polietileno de alta densidade
CH3 Metil
gR Gramas
TEOS Tetra ethyl orto silicate
mL Mililitros (10-3 L).
kV Quilovolts
mA Miliampére
hkl Plano cristalográfico
FWHM full-width at half maximum
DBET diâmetro esférico equivalente (nm)
Cm Centrimetros
S Segundos
psi pound force per square inch
FTIR/ATR Espectroscopia de infravermelho com transformada de Fourier com módulo de reflexão total atenuada
m Metros
UV-Vis Ultravioleta visível cm-1 Centímetros (1x10-2 m).
mN Milinewton
µl Microlitro
θ Unidade de medida de ângulo (Teta)
° Graus
u.a Unidades arbitrárias
d Densidade planar
LISTA DE EQUAÇÕES
Equação 1 Reação da Fotólise 28
Equação 2 Reação da Fotocatálise 28
Equação 3 Equação de scherrer 48
SUMÁRIO
1 INTRODUÇÃO 17
1.1 OBJETIVOS 19
2 REVISÃO BIBLIOGRAFICA 20
2.1 MATERIAIS NANOESTRUTURADOS 21
2.2 ESTRUTURAS CRISTALINAS DO DIÓXIDO DE TITÂNIO 22
2.3 PROPRIEDADES E APLICAÇÕES DO TiO2 24
2.3.1 Processos oxidativos avançados 26
2.3.1.1 Fotocatálise 29
2.4 MÉTODOS DE SÍNTESE PARA OBTENÇÃO DO TiO2 31
2.4.1 Método hidrotermal assistido por micro-ondas 34
2.5 NANOCOMPÓSITOS 36
2.5.1 Siliconas: Polidimetilsiloxano (PDMS) 40
3 MATERIAIS E MÉTODOS 43
3.1 MATERIAIS 44
3.2 MÉTODOS 45
3.2.1 Metodologia experimental da Rota A 45
3.2.2 Metodologia experimental da Rota B 46
3.3 TÉCNICAS DE CARACTERIZAÇÃO DAS NANOPARTÍCULAS 47
3.3.1 Difração de raios X (DRX) 47
3.3.1.1 Determinação do tamanho de cristalito 48 3.3.2 Microscopia eletrônica de varredura com canhão de emissão por
campo induzido (MEV-FEG)
48 3.4 CALCINAÇÃO EM FORNO MICRO-ONDAS DAS
NANOPARTÍCULAS OBTIDAS PELA ROTA B
49 3.5 OTIMIZAÇÃO DA APLICAÇÃO EM NANOCOMPÓSITO 49
3.5.1 Teste satisfatório 50
3.6 PREPARAÇÃO DOS NANOCOMPÓSITOS 51
3.7 CARACTERIZAÇÕES DOS NANOCOMPÓSITOS 51
3.7.1 Envelhecimento em câmara de UV 51
3.7.2 Espectroscopia de UV-Visível 52
3.7.3 Espectrofotometria de Infravermelho por transformada de Fourier (FTIR)
52
3.7.5 Analise de molhabilidade 53
4 RESULTADOS E DISCUSSÕES 54
4.1 ESTUDO DAS ROTAS A E B 55
4.1.1 Difração de raios X (DRX) 55
4.1.2 Microscopia eletrônica de varredura (MEV-FEG) 57 4.1.3 Calcinação em micro-ondas das nanopartículas obtidas pela rota
B
59
4.2 OTIMIZAÇÃO DA DEPOSIÇÃO DOS FILMES 62
4.3 ATIVIDADE FOTOCATALÍTICA DOS NANOCOMPÓSITO (PDMS/TIO2)
64
4.4 ESPECTROFOTOMETRIA DE INFRAVERMELHO POR TRANSFORMADA DE FOURIER (FTIR)
65
4.5 ENSAIO DE NANODUREZA VICKERS 69
4.6 ENSAIO DE MOLHABIDADE 70
5 CONCLUSÕES 80
SUGESTÓES PARA TRABALHOS FUTUROS 77
ANEXOS 78
Capítulo I
1 INTRODUÇÃO
Os materiais nanoparticulados tem sido alvo de inúmeros estudos, principalmente com relação ao entendimento de suas características morfológicas e melhoria das propriedades físicas e químicas conferindo melhor desempenho no produto final. Entre estes materiais, podemos destacar uma classe importante que são os materiais cerâmicos inorgânicos e não ferrosos e os nanocompósitos (polímero/cerâmica).
As nanopartículas de dióxido de titânio (TiO2) vem sendo destaque em diversas
áreas de pesquisa da engenharia dos materiais por possibilitar vários tipos de aplicações, tais como células solares, fotocatálise, aplicações fotoeletroquímica, e tratamento de água e efluentes (JENNINGS et al., 2008; ALBU et al., 2007; ZHUANG et al., 2009; ZHANG et al., 2010; KIM, PARK e HAN,2008). Essas aplicações são baseadas nas propriedades semicondutoras e óticas do TiO2, que é
um semicondutor com gap de energia na região ultravioleta. Essas nanopartículas possuem destaque em atividades fotocatalíticas, sendo utilizadas como carga em nanocompósitos de matriz polimérica.
Os nanocompósitos constituem em uma nova classe de materiais que envolvem a dispersão de materiais em nano-escala em uma matriz. Também podemos definir nanocompósitos como sendo combinações entre uma matriz e partículas que atuam como enchimento (LAGALY, 1999). São considerados materiais multifásicos que exibem propriedades das fases constituintes, de tal forma, que uma melhor combinação de propriedades seja alcançada.
Os compósitos contendo cargas com dimensões micrométricas necessitam de quantidade de carga muito maior quando comparados com a quantidade de nanocargas necessárias para proporcionar um incremento nas propriedades mecânicas e térmicas sem causar prejuízo nas propriedades ópticas e reológicas do compósito. Por isso, os nanocompósitos poliméricos com base em materiais inorgânicos revelam-se uma revolucionaria classe de materiais, pois a partir de inclusões inorgânicas eles apresentam alta resistência à tração, fácil processabilidade e flexibilidade mecânica da matriz polimérica (NEWNHAM, 1986).
superficiais, características hidrofóbicas, estabilidade térmica, resistência à oxidação, permeabilidade a gases (O2, N2), resistência a produtos químicos além de
boas propriedades mecânicas (LIPTAY et al., 1987). Essas características são capazes de assegurar a durabilidade adequada para revestimentos autolimpantes de nanocompósitos de PDMS/TiO2.
1.1 OBJETIVOS
Neste contexto, a presente proposta foi atraída pelas vantagens que a energia do método hidrotérmico assistido por micro-ondas oferece para síntese de diversos produtos. Tendo uma primeira etapa de obtenção de nanopartículas (TiO2) por
intermédio desse processo, e depois a aplicação das mesmas como carga em nanocompósitos de matriz polimérica (PDMS), obtendo filmes finos com propriedades autolimpantes e fotocatalíticas. Associado a tudo isto, está à possibilidade de desenvolver produtos de bom desempenho com redução de tempo e/ou temperaturas de processo visando à produção de novos materiais.
Este trabalho tem como objetivo principal analisar as propriedades fotocatalíticas e as características hidrofóbicas do nanocompósito de polidimetilsiloxano (PDMS)/ TiO2. Com base no contexto a cima foi definido os
seguintes objetivos específicos:
Obtenção de pós nanométricos de TiO2 por duas rotas de síntese, pelo
método de hidrotérmico assistido por micro-ondas;
Caracterizar as partículas pelas técnicas de difração de raios-X (DRX), microscopia eletrônica de varredura (MEV) e análise por adsorção de nitrogênio (BET);
Otimizar e investigar o melhor método de aplicação dessas nanopartículas na matriz polimérica (PDMS), para obtenção do nanocompósito;
Estudar a atividade fotocatalítica desse nanocompósito por intermédio de degradação UV;
Capítulo II
2 REVISÃO BIBLIOGRÁFICA
2.1 MATERIAIS NANOESTRUTURADOS
Com o desenvolvimento tecnológico atual, surge o interesse em estudar os materiais nanoestruturados, com partículas que apresentem tamanho menor que 100 nm, devido ao fato de que suas propriedades físicas e químicas dependem fortemente da forma e do tamanho destas partículas. Com a redução do tamanho das partículas é possível alterar as propriedades macroscópicas do material, aprimorando e criando novas aplicações. Deste modo, as propriedades gerais destes materiais podem ser otimizadas através da variação do tamanho das partículas, tornando-os elementos a serem utilizados tecnologicamente em dispositivos magnéticos, ópticos, bem como em catalisadores (GOUVEIA et al., 2005).
O grande interesse de trabalhar em escala nanométrica está no fato dela representar um estágio intermediário entre átomos e moléculas e a matéria condensada. Nesta escala, o comportamento da matéria pode não seguir as leis clássicas e, como consequência, as propriedades dos sistemas podem ser diferentes e/ou intensificadas quando comparadas aos seus respectivos sólidos estendidos (FERREIRA, 2006).
Desde a descoberta dos nanotubos de carbono nos anos 90, foi aberta uma nova linha de pesquisa na área de materiais nanométricos, como: nanopartículas, nanotubos, nanoesferas, nanofibras as quais podem apresentar novas propriedades, como por exemplo, uma habilidade catalítica em nível micro e macro (TOMA, 2005).
A grande área superficial das nanopartículas garante, em muitos casos, excelentes propriedades de adsorção de metais e substâncias orgânicas. As propriedades redox e/ou de semicondutor de nanopartículas podem ser aproveitadas em processos de tratamento de efluentes industriais, águas e solos contaminados baseados na degradação química ou fotoquímica de poluentes orgânicos (QUINA, 2004).
Quando nanoparticulado, o dióxido de titânio apresenta propriedades como alta resistência mecânica e baixa temperatura de sinterização, além de interessantes propriedades ópticas, mostrando-se industrialmente e tecnologicamente importante. A estabilidade de nanoestrutura obtida em diferentes meios ácidos, básicos e neutros é de grande importância para sua aplicação, uma vez que sua morfologia esta relacionada diretamente com o seu meio.
Estas características do material nanoparticulado são devidas ao efeito causado pelo elevado valor da razão superfície/volume, o que pressupõe um excesso de átomos na superfície do material em relação a seu volume estendido, diminuindo a quantidade de energia necessária à superfície para participar de transformações físico-químicas. Além disso, parâmetros de suma importância para as características óticas, elétricas e magnéticas são alterados. Por exemplo, a energia do gap cresce quando se reduz o tamanho das partículas de TiO2 na forma
anatase com tamanho médio de 5 - 10 nm tem a energia do gap aumentada em 0,1 - 0,2 eV (REDDY, MANORAM e REDDY, 2003). A fase anatase tem atraído grande interesse dos pesquisadores pela vasta aplicação do material na forma nanoestrututrada.
2.2 ESTRUTURAS CRISTALINAS DO DIÓXIDO DE TITÂNIO
Tanto a anatase quanto o rutilo podem ser empregados na fotocatálise heterogênea, sendo que a anatase costuma apresentar uma maior atividade fotocatalítica, em que seu mecanismo gera radicais livres, como o radical hidroxila (•OH; E= 2,8 V), além de apresentar a menor velocidade de recombinação de
portadores fotogerados, favorecendo a aplicação desse semicondutor em fotocatálise heterogênea (JUNG, PARK e HEE, 2004; PUMA, GAO e CHEN, 2009; CARP, HUISMAN e RELLER, 2004). A estrutura cristalina anatase é a fase mais estável na escala nanométrica, sendo a fase mais estudada em aplicações de nanotecnologia.
Recentemente, foi observado sob condições elevadas de pressão e temperatura a obtenção sintética de uma nova fase metaestável do TiO2,
apresentando estrutura similar aos minerais PbCl2 e BaF2, também pertencentes ao
sistema ortorrômbico. Por esta similaridade estrutural a fase foi denominada por
cotunnita, sendo então reconhecida como o material de maior dureza, comparado aos materiais tais como o diamante e nitreto de boro (SIGOLI, 2001). Podendo ser utilizado em aplicações na vasta área de desgaste e atrito.
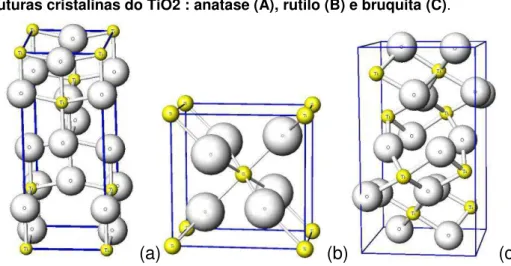
A figura 1 mostra a célula unitária dos cristais do TiO2 nas estruturas anatase,
rutilo e bruquita.
Figura 1. Estruturas cristalinas do TiO2 : anatase (A), rutilo (B) e bruquita (C).
(a) (b) (c)
Fonte: http://www.geocities.jp/ohba_lab_ob_page/structure6.html
O octaedro do rutilo não é regular, mostrando pequenas distorções ortorrômbicas, ao passo que na anatase, o arranjo octaédrico é significantemente distorcido, com uma simetria menor que a ortorrômbica. Estas diferenças estruturais resultam em densidades e estruturas de bandas eletrônicas diferentes. Por exemplo, para energia de bandgap e densidade, tem-se para a anatase valores iguais a Eg=
3,2 eV e d = 3,894 g/cm³, e para rutilo Eg= 3,1 eV e d = 4,250 g/cm³ (DIEBOLD,
2003).
Na tabela 1 são resumidos os dados cristalográficos da fase de maior interesse nesse estudo, a fase anatase. O cristal de anatase possui raio iônico de 0,066 Å, com simetria tetragonal e é descritos pelos eixos cristalográficos a e c. A célula unitária da anatase contem quatro moléculas de TiO2, sua estrutura é mais alongada
e possui maior volume de célula, desta forma, a anatase é menos densa que as outras estruturas (DIEBOLD, 2003).
Tabela 1: Dados cristalográficos da fase anatase. Estrutura
cristalográfica Simetria Eixo a, b (nm) Eixo c (nm)
Densidade (g/cm3)
Anatase Tetragonal 3,733 9,57 3.830
2.3 PROPRIEDADES E APLICAÇÕES DO TiO2
As fases de maior utilidade têm sido reconhecidamente anatase e rutilo, como citado anteriormente, devido às propriedades únicas tais como, o alto índice de refração destes materiais, além de uma ótima estabilidade química e térmica, e boa dispersibilidade, cujos valores propõem sua aplicação na fabricação de produtos com elevada opalescência (CHOI et al., 2001).
1991; IKEZAWA et al., 2001; WANG, LI e WANG, 1998; GOPAL e MORBELY, 1997; FOX e DULAY, 1993; KEMP e MCINTYRE, 2000; CHOI et al., 2001; DABROWSKI et al., 2002; DAS e KRISHAMA, 1999; AARIK et al., 2000; CHAMBERS, 2006; CAITEANU et al., 2006).
Na ciência dos materiais, as propriedades físico-químicas do TiO2 têm sido
exploradas a fim de obter resultados satisfatórios. O recobrimento de vidros, espelhos ou artefatos cirúrgicos com filmes finos de dióxido de titânio possibilita a confecção de materiais anti-embaçantes ou auto-limpantes. A propriedade físico-química explorada neste caso é a variação foto-induzida da hidrofilicidade do dióxido de titânio. Experimentos realizados sob-radiação ultravioleta e posteriormente na ausência desta demonstram o estabelecimento de um equilíbrio reversível em poucas horas (NAKAJIMA et al., 2001; IRIE, MORI e HASHIMOTO, 2004).
Com a ajuda da luz ultravioleta o TiO2 é capaz de decompor a contaminação
orgânica de algumas superfícies. As propriedades auto-limpantes, conferidas pela presença do TiO2, foram desenvolvidas para superfícies exteriores, de modo a
aproveitar a radiação solar, uma vez que os mesmos estão expostos à luz solar e precipitações abundantes. Neste âmbito, surgiram os vidros auto-limpantes, nos quais são aplicadas películas de espessura variável, geralmente próximas dos 40 nm, com partículas de TiO2 incorporadas (PASCHOLINO, 2006).
Em muitas destas aplicações características estruturais e a uniformidade da espessura do filme devem ser rigorosamente controladas, criando a necessidade de métodos especiais de preparo (AARIK et al., 2000).
Além dos vidros, existem também tintas auto-limpantes para aplicação no exterior de edifícios. A sua utilização é já uma realidade em países de primeiro mundo. O objetivo é semelhante ao dos vidros auto-limpantes, ou seja, a redução de custos de manutenção (PASCHOLINO, 2006).
200-280 nm (UV-C), é comumente usada como agente bactericida em tratamentos de água e ar, permitindo uma taxa de desinfecção eficiente pelo emprego de lâmpadas germicidas (254 nm) (PASCHOLINO, 2006). Dentre inúmeras aplicações que dióxido de titânio apresenta serão destacados um dos processos oxidativos avançados, a fotocatálise.
2.3.1 Processos oxidativos avançados
Os processos oxidativos avançados (POAs) vêm atraindo grande interesse por serem mais sustentáveis em longo prazo. Durante as duas últimas décadas, com o objetivo de aumentar a biodegradabilidade e também aumentar a eficiência dos tratamentos biológicos, subsequente os POAs têm sido estudados para tratar poluentes orgânicos encontrados no solo, água e efluentes industriais (BALCIOGLU e ÖTKER, 2003).
Os POAs surgiram da necessidade de eliminar poluentes orgânicos tóxicos e bio-resistentes de efluentes aquosos, transformando-os em espécies inofensivas para o meio ambiente. Esse processo se baseia na formação de radicais hidroxilas (OHˉ), que são agentes altamente oxidantes e reativos. Estes radicais participam efetivamente da reação e podem reagir com uma grande variedade de classes de compostos promovendo sua total mineralização para compostos inócuos como água e CO2. Essa técnica é considerada uma tecnologia limpa, não gerando resíduos
após o processamento (CORDEIRO, LEITE e DEZOTTI, 2004; SILVA, WANG e FARIA, 2006).
Quadro 1: Diferentes métodos para sistemas de catálise homogênea e heterogênea.
Sistemas Homogêneos Sistemas Heterogêneos
Com irradiação Sem irradiação Com irradiação Sem irradiação O3/UV O3/OHˉ Semicondutor/O2/UV Eletro-Fenton
H2O2/UV O3/H2O2 Semicondutor/H2O2/UV Fenton Anódico
H2O2/Fe2+/UV (Vis) H2O2/Fe2+ - Eletro-oxidação
Os sistemas O3 ou H2O2 com irradiação necessitam fótons de pequeno
comprimento de onda (< 310 nm), a fotocatálise (semicondutor (TiO2)/UV) necessita
de fótons com comprimento de onda acima de 380 nm (PERÉS et al., 2002).
Entre os POAs, os sistemas combinados UV/TiO2/H2O2 e UV/Fe2+/H2O2 são
considerados por alguns autores como os mais promissores para a remediação de águas contaminadas. Estes envolvem a geração de radicais hidroxil e tem um alto potencial de oxidação. A tabela 2 mostra o potencial de oxidação para diferentes agentes oxidantes. Estes radicais hidroxil atacam moléculas orgânicas pela substituição do átomo de hidrogênio ou pela adição de O2.
Tabela 2: Potencial de oxidação eletroquímica (POE).
Agente oxidante POE (eV)
Radical hidroxil, HO• 2,80
Oxigênio (atômico), O• 2,42
Ozônio, O3 2,08
Peróxido de Hidrogênio, H2O2 1,78
Oxigênio (molecular), O2 1,23
Alguns destes processos oxidativos implicam na absorção de luz, a qual promove a transição de um elétron de um orbital de energia mais baixa para um orbital de energia superior. Este “salto” facilita a remoção do elétron e promove a formação de uma lacuna, que se cria no orbital de menor energia, num local favorável à captação de um novo elétron do meio.
A fotodegradação pode ocorrer de forma direta (fotólise) ou indireta (fotocatálise). No caso da fotólise ocorre a absorção direta do fóton de luz pelo composto tóxico originando uma molécula excitada (equação 1). No caso da fotocatálise, a absorção do fóton da radiação ocorre numa outra espécie catalítica presente na solução (equação 2) (FERNANDES, 2009). Geralmente essa espécie são os materiais semicondutores ou outros fotocatalizadores.
Goi e Trapido (2002) consideram que na fotólise direta de compostos orgânicos usando somente radiação UV, não é suficiente para alcançar a degradação de compostos orgânicos em efluentes industriais, embora alguma fotodegradação seja esperada acontecer, dependendo do tipo de composto orgânico.
Dentre os POAs, a fotocatálise heterogênea é um processo de tratamento que tem despertado grande interesse e um rápido crescimento nos últimos anos, pois vem apresentando grande eficiência na degradação de compostos orgânicos, permitindo a completa mineralização da maioria deles, incluindo os corantes reativos (DOONG,CHANG e HUANG, 2009; LACHHEB et al., 2009).
Desta forma será destacado esse tipo de reação indireta a qual o TiO2 vem
sendo utilizado com estimulação da luz UV, ativando assim à sua super-hidrofolicidade, e facilitando a propagação do fluxo de gotas de água na superfície, auxiliando no processo de descontaminação de superfícies oleosas, agindo na auto-limpeza das mesmas.
Equação 1
Equação 2 Poluente+O2 COSemicondutor 2 + H2O +minerais
hʋ≥ Egap
C C*
2.3.1.1 Fotocatálise
O termo fotocatálise (fotoquímica + catálise) pode ser definido como a aceleração de uma fotorreação pela presença de um catalisador (semicondutor). Para que o processo de fotocatálise seja iniciado, é necessário que um fóton com energia maior ou igual à energia de band gap do semicondutor atinja a superfície do mesmo, possibilitando a transição eletrônica. A absorção deste fóton provoca a excitação de um elétron da banda de valência (BV) para a banda de condução (BC), gerando uma lacuna (h+) na banda de valência e elétrons livres (e-) na banda de
condução, o qual esse processo oxidativo e redutor é capaz de catalisar diferentes reações químicas (CABRERA, NEGRO e ALFANO, 1997), como ilustrado na figura 2.
Figura 2: Mecanismo para a fotoativação de partícula semicondutora.
Fonte: Paulino, 2011.
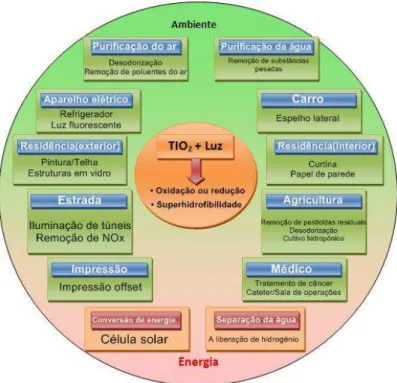
Segundo Nakata e Fujishima (2012), o desenvolvimento da fotocatálise tem sido um foco considerável de atenção nos últimos anos, sendo utilizada em uma variedade de produtos e em uma ampla área de pesquisa, incluindo especialmente a relação de campos ambientais e de energia (figura 3). Dos diversos fotocatalisadores que vem sendo empregado em fotocatálise, o TiO2 tem sido
amplamente estudado e utilizado em várias aplicações por causa de sua forte capacidade oxidativa.
Figura 3: Aplicações em fotocatálise de TiO2.
O semicondutor TiO2 é o mais utilizado como fotocatalisador, devido as suas
Sejam quais forem às aplicações, a influência sobre as características do dióxido de titânio são devido às modificações as propriedades oxidantes do sistema, além de propriedades físico-químicas como energia livre de superfície, expressa na modificação no valor do ângulo de contato com os fluídos e trazendo variação nas propriedades absortivas do sistema (ZHANG et al., 2001).
Segundo Wang (2007), pós de TiO2 na fase anatase que possuem elevadas
áreas superficiais específicas, boa cristalização e pequeno tamanho de cristalito são desejáveis para melhorar a atividade fotocatalítica, criando possíveis sítios reativos em relação a superfície do fotocatalisador.
As propriedades dos catalisadores utilizados nas reações fotocatalíticas são fortemente dependentes do método de preparação dos mesmos. Mudanças na atividade, cristalinidade e na seletividade são observadas quando os catalisadores são preparados por diferentes métodos (ALONSO et al., 2004). Suas propriedades tornam-se superiores em escala nanométrica, com alta homogeneidade e fase com composição química estável (TANG et al., 2002).
2.4 MÉTODOS DE SÍNTESE PARA OBTENÇÃO DO TiO2
Atualmente o desenvolvimento de métodos adequados para a produção de pós cerâmicos tem sido de grande importância, uma vez que as propriedades principais de uma cerâmica dependem, em grande parte, das características originais dos pós utilizados. Essas características são afetadas pelos métodos empregados na obtenção desses pós (COSTA et al., 2006).
O TiO2 pode ser preparado em forma de pó, cristais ou em filmes finos. O pó e
os filmes finos são constituídos de grânulos de cristais de alguns nanômetros até vários micrômetros. Para algumas aplicações, como na obtenção de pó e filmes finos, os métodos de sínteses em fase líquida são mais vantajosos. Estes métodos podem permitir um controle estequiométrico dos reagentes, produção de materiais mais homogêneos e preparação de materiais compósitos (SEM et al., 2005).
O TiO2 têm sido preparados por diferentes métodos, tais com, sol-gel,
A síntese pelo método sol-gel é bastante utilizada para a obtenção de filmes e nanopartículas de TiO2. O método sol-gel possui muitas vantagens sobre outras
técnicas de fabricação, tais como, homogeneidade, facilidade e flexibilidade na introdução de dopantes em grandes concentrações, simplicidade no processo de síntese, obtenção de materiais com alta pureza e elevada área superficial, além de permitir modificações nas propriedades estruturais do catalisador, uma vez que os resíduos orgânicos quimicamente e firmemente ligados no gel afetam a área superficial específica dos catalisadores (SANTOS, 1999).
Este método envolve a formação do TiO2 sol ou gel pela precipitação através
da hidrólise e condensação (com a formação de um polímero) de um alcoóxido de titânio (DUBROVINSKY et al., 2001). Uma das limitações deste método é a necessidade de precisão e rigor, de modo a obter reprodutibilidade (MOURÃO e MENDONÇA, 2008).
O método de precipitação homogênea envolve a precipitação de hidróxidos de titânio pela adição de uma base na solução (NaOH, NH4OH), com posterior
calcinação do material para a formação do óxido. A principal desvantagem deste método é a dificuldade no controle do tamanho das partículas, pois precipitações muito rápidas podem causar a formação de partículas muito grandes (fora da escala nanométrica), que são pouco ativas (PEDRAZA e VASQUEZ, 1999).
Cui et al (2012) investigou a mudança de morfologia variando a concentração de NaOH utilizando o método de precipitação, além disso variou também o tempo de reação e as temperaturas de calcinação. Visando a obtenção de TiO2 com diferentes
morfologias.
O método Pechini tem se destacado como um processo alternativo e promissor para obtenção de pós nanométricos, com tamanho de partícula controlado, alta pureza e homogeneidade química, além de apresentar um custo relativamente baixo e não necessitar de aparelhagem sofisticada para sua realização (PECHINI, 1967). Esse processo é uma alternativa viável para sínteses com um rigoroso controle da esquiometria, morfologia do pó e pureza da fase (LESSING, 2007).
Diversos trabalhos apresentaram a síntese de materiais nanoestruturado utilizando-se o método dos precursores poliméricos, incluindo a síntese de nanopartículas de TiO2, e filmes nanoestruturados de TiO2 (MALAGUTTI et al., 2008;
Costa (2006) utilizou o isopropóxido de titânio como reagente precursor para obtenção de nanopartículas de TiO2 na fase anatase, pelo método dos precursores
poliméricos (Pechini), obtendo além de uma fase pura (anatase), tamanho médio de partícula em torno de 21nm.
Ribeiro et al (2012) utilizou como reagente de partida para obtenção de TiO2 o
citrato de titânio, pelo método Pechini, e variou a temperatura de calcinação. O tamanho de cristalito variou entre 4,8 e 14,6 nm. O caráter nanométrico das partículas que constituem as amostras dos pós obtidos ficou evidenciado por meio dos tamanhos das mesmas que variaram entre 10,4 e 49,6 nm.
Dentre esses métodos se destaca a síntese pelo método hidrotérmico. Nos últimos anos, a síntese hidrotérmica é amplamente aplicada para a preparação de vários materiais inorgânicos e nanocristalinos (BYRAPPA e YOSHIMURA, 2001). O método hidrotérmico é um processo que facilita o controlar de tamanho do grão, a morfologia das partículas, a microestrutura, composição de fases e as propriedades químicas da superfície por meio de ajuste de parâmetros experimentais, tais como temperatura, pressão, tempo de duração do processo e o valor do pH da solução (SU et al., 2006). Além disso, a natureza dos meios de reação (ácido, básico ou neutro), desempenha um papel significativo no controle do tamanho e morfologia das nanoparticulas de titânio (YANG e GAO, 2006).
Andersson et al (2002), estudam o efeito do ácido hidroclorídrico e do ácido nítrico na estrutura cristalina, distribuição de poros e na atividade fotocatalítica do dióxido de titânio preparado pelo método hidrotérmico.
A síntese via hidrotérmica têm se mostrado versátil na preparação de TiO2
nanoestruturado, considerando que o processo de reação é simples, facilmente controlado, a temperatura de reação é baixa e o método pode proporcionar bom controle sobre o comprimento e diâmetro dos materiais obtidos. Neste processo a solução é aquecida indiretamente e a energia é transferida por transmissão de calor, existindo um gradiente de temperatura.
Na literatura encontramos diversos trabalhos que utilizam a síntese de TiO2
pelo método hidrotérmico, no quadro 2 pode-se observar alguns procedimentos para uma simples comparação.
Quadro 2: características de sínteses pelo método hidrotérmico encontradas na literatura.
Parâmetros de síntese Fase Ref.
HC 160°C/10h Anatase+bruquita Yun, Wang e Cheng (2012)
HC 100°C/3h – 200°C/24h Anatase Wang (2007)
HC 100°C/24h Anatase+bruquita+rutilo Yu et al. (2003)
HC 130°C/12h Anatase Pavasupree et al. (2008)
HC 120°C/13h Anatase Tong et al. (2008)
HC: Hidrotermal convencional.
2.4.1 Método hidrotérmico assistido por micro-ondas
Na área de química e de ciências dos materiais, a aplicação da tecnologia de micro-ondas tem despertado especial interesse na síntese de compostos orgânicos e inorgânicos e no tratamento térmico de muitos materiais em escala laboratorial e industrial. O uso da energia de micro-ondas para o processamento de materiais possui potencial para oferecer vantagens quanto à redução do tempo de processamento e economia de energia (HU, LI e YU, 2010; PERIYAT et al., 2010).
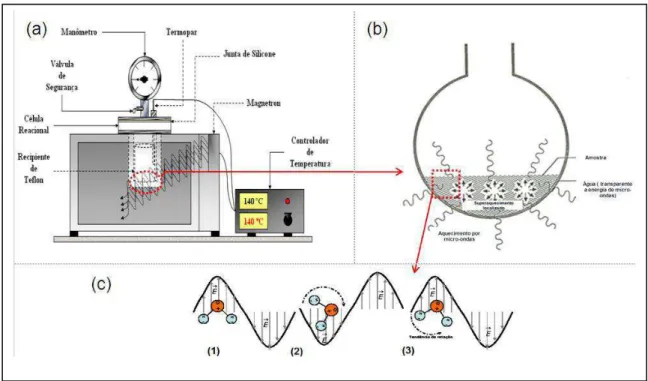
No sistema hidrotérmico irradiado por micro-ondas, o aquecimento da solução é direto como mostrado da figura 4. O gradiente térmico quase não existe, ocorrendo assim uma nucleação homogênea e um crescimento de partículas uniformes. Assim, a síntese hidrotérmica com micro-ondas proporciona rápido tratamento térmico, que envolve mecanismo de polarização iônica e dipolar, em que a energia de micro-ondas é transmitida diretamente ao material por intermédio de interações moleculares com o campo eletromagnético, enquanto no método hidrotermal convencional a energia é transferida ao material por meio dos processos de convecção, condução e radiação do calor a partir da superfície do material (OLIVEIRA, 2007).
Figura 4: (a) Sistema hidrotérmico de ondas, (b) Meio reacional aquecido por micro-ondas, e (c) Acoplamento da água com as micro-ondas.
Fonte: Costa, 2011.
Qi et al (2006) analisaram e compararam o comportamento e forma que as partículas apresentaram, quando se utiliza o método convencional e o método irradiado por micro-ondas, resultando na diminuição da quantidade de aglomerados em materiais de nanoescala, além da aceleração do processo.
homogênea e tamanho de cristalito de 5.0- 8.6 nm, em temperatura de 150°C por 2 horas.
Esse processo além de diminuir o tempo de reação, ainda contribui na formação de partículas regulares e em escala nanométricas, possibilitando melhoria nas propriedades desses materiais, assim podendo ser utilizadas em nanocompósitos de matrizes poliméricas.
2.5 NANOCOMPÓSITOS
Materiais nanocompósitos constituem uma nova classe de materiais que envolvem a dispersão de materiais na escala nanométrica em uma matriz, ainda pode ser definido como materiais formados por híbridos de materiais orgânicos e inorgânicos, em que a fase inorgânica está dispersa em nível nanométrico atuando como enchimento em uma matriz polimérica.
A ciência dos materiais em particular utiliza o termo nanocompósitos em duas áreas distintas: cerâmicas e polímeros, sendo que a classe dos materiais poliméricos vem sendo mais utilizado. Na preparação de nanocompósitos de matriz polimérica permite em muitos casos encontrar um compromisso entre um baixo custo, devido à utilização de menor quantidade de carga e um elevado nível de desempenho, que pode resultar da sinergia entre os componentes (ESTEVES, TIMMONS e TRINDADE, 2004).
Existem vários tipos de nanomateriais que podem ser utilizados como nano-reforços. Compósitos formados por nano-reforço possuem melhores propriedades do que os compósitos com reforços micrométricos devido à maior razão entre área da superfície e volume dos nano-reforços. Logo estes reforços possuem uma área muito maior do que seu volume, possibilitando o aperfeiçoamento nas propriedades mecânicas, físicas, ópticas e térmicas desses materiais (ASHBY e FERREIRA, 2009). Materiais em nanoescala (1-500 nm) utilizados como reforço em compósito exibem uma elevada área superficial, proporcionando uma melhor dispersão na matriz polimérica. (ESTEVES, TIMMONS e TRINDADE, 2004; MENEGHETTI e QUTUBUDDI, 2006).
último fator é muito importante, uma vez que pesquisas vêm demonstrando que aglomerados de reforços podem não gerar ganhos nas propriedades do material (HAMMING et al., 2009). Entretanto, a dispersão de nanocargas ainda é um problema que está sendo investigado. Por isso vários métodos estão sendo elaborados e testados para ser possível atingir uma eficiente dispersão de nanocargas (MA et al., 20120; ZHU et al., 2008).
Os nanocompósitos à base de materiais inorgânicos têm atraído muito interesse nos últimos anos, uma vez que tais materiais, por integração de constituintes complementares, podem exibir tanto uma alta permissividade a partir de inclusões inorgânicas, como uma alta resistência a ruptura, flexibilidade mecânica e fácil processabilidade a partir de matrizes poliméricas sem agregar as desvantagens que geralmente aparecem nos compósitos naturais (ALEXANDRE, DUBOIS e JERÔME, 2001).
Uma das características a ser considerada quando são utilizadas cargas inorgânicas em nanocompósitos é a afinidade química reduzida entre as cargas (natureza hidrofílica) e o polímero (predominantemente hidrofóbico). Essa afinidade pode ser melhorada por intermédio da modificação química superficial das partículas dos componentes, promovendo a compatibilidade química entre os materiais por intermédio de ligações de Van der Waals (pontes de hidrogênio), interações eletrostáticas ou por ligações covalentes na interface reforço/ matriz (ESTEVES, TIMMONS e TRINDADE, 2004).
A preparação de nanocompósitos de matriz polimérica reforçadas com materiais inorgânicos é uma área recente pelo que não existe ainda uma classificação definida para os diferentes materiais híbridos e respectivos métodos de síntese. Uma das classificações que tem sido aceite baseia-se no tipo de ligações químicas que se estabelecem na interface inorgânica/orgânica. O quadro 3 apresentar as classificações segundo as ligações químicas encontradas nos nanocompósito.
Quadro 3: Classificação dos nanocompósitos segundo suas ligações.
Os nanocompósitos que apresentam ligações fracas e são considerados materiais hídricos são classificados como classe I, a classe II são os nanocompósitos que apresentam ligações fortes entre a fase inorgânica/orgânica (SCHOTTNER, 2001).
Existem vários métodos de preparação de nanocompósitos de matriz polimérica, iremos aborda os três principais tipos de preparação que são a mistura simples dos componentes, a síntese das nanopartículas in situ e a polimerização da matriz in situ (figura 5). Em contraste com a alta viscosidade dos polímeros no estado fundido, o meio reacional da polimerização in situ apresenta menor viscosidade e permite uma melhor dispersão das nanopartículas proporcionando uma melhor compatibilidade entre as fases.
Figura 5: Métodos de preparação de nanocompósitos.
Geralmente é usado mais do que um método de preparação no mesmo nanocompósito. A intercalação, por exemplo, consiste na inserção de um dos componentes na estrutura do outro e pode ser aplicada de diferentes formas. Na inserção do polímero em espaços vazios da estrutura do sólido inorgânico, considera-se a mistura simples (método I); se os monômeros forem intercalados e
PI (Precursores Inorgânicos)
+
Nanopartículas+
Polímero
+
M (Manômetros)Nanocompósito I
II
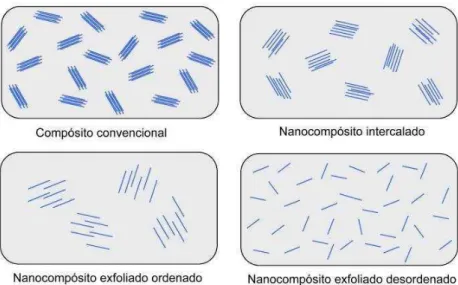
posteriormente polimerizados considera-se a polimerização in situ (método III). Na figura 6 esta esquematizada uma comparação entre os tipos de nanocompósitos com relação aos compósitos convencionais. Podendo ser visualizado a dispersão do reforço na matriz.
Figura 6: Tipos de nanocompósitos.
Fonte: http://www.demar.eel.usp.br/compositos/Notas_aula/nanocompositos.pdf
As propriedades físicas de nanomateriais semicondutores, nos quais ocorrem efeitos quânticos de dimensão, têm sido especialmente estudadas. As nanopartículas de semicondutores, tais como CdS, ZnS, ou CdSe, têm sido muito usadas devido às suas propriedades ópticas (CHEN et al., 2002). Alguns dos exemplos mais citados na literatura são nanopartículas de TiO2 na preparação de
compósitos com aplicação na indústria de revestimentos e tintas (MA et al., 2010), e nanopartículas de SiO2, que podem conferir maior resistência mecânica ou
características retardadoras de chama aos nanocompósitos (BYRNE et al., 2007). Tem sido descrito na literatura um grande número de aplicações para os nanocompósitos, tais como em catálise, optoeletrônica, dispositivos magnéticos, tintas e revestimentos e como materiais retardadores de chama (HAMMING et al., 2009; MA et al., 2010; ZHU et al., 2008; XIE, MAI e ZHOU, 2005; BYRNE et al., 2007).
Nanocompósitos de polímero/TiO2 ainda vem sendo aplicado nos campos da
limpeza, farmacêuticos, higiene pessoal, cosméticos, alimentos e bebidas e geral (BERNARDO, CARVALHO e PESSAN, 2009).
Tem sido reportada a incorporação de partículas extremamente pequenas de TiO2 entre os planos da argila montmorilonita (SUN et al., 2002; MOGYORÓSI,
FARKAS e DEÁKANY, 2002). Afirma-se que esta classe de nanocompósitos propõe melhorias significativas na atividade catalítica, em relação ao dióxido de titânio puro, devido ao efeito sinérgico criado sobre a cinética do processo fotocatalítico. Efeito semelhante fora detectado no processo de obtenção fotocatalítica de hidrogênio utilizando-se os nanocompósitos TiO2/HNbWO6 ou Fe2O3/HNbWO6 (WU et al.,
1999).
Asghar et al (2011) testaram dois tipos de metais e uma mistura dos dois para averiguar se uma combinação de metais pode tornar o processo mais eficiente, analisando a perda de massa de acordo com a degradação dos filmes, para isso foi preparado quatro tipos de filmes diferentes: PE puro, PE+ TiO2 sem dopagem,
PE+TiO2 dopado com Fe, PE+TiO2 dopado com Ag e PE+TiO2 dopados com Fe+Ag
todos com 1 wt% de carga. Observaram que os filmes com as partículas de TiO2
dopados perderam muito mais peso do que os filmes de PE+TiO2 sem dopagem.
Silva (2011) observou que blendas de PLA/PEAD contendo TiO2
nanoparticulado, apresentando melhores propriedades mecânicas quando comparado com PLA puro, obtendo um material que combina a fotodegradação do PEAD/TiO2 com a biodegradabilidade do PLA, que apresenta uma maior flexibilidade
que o filme de PLA puro.
Atualmente, diversas matrizes poliméricas como poli(metacrilato de metila), poliamida, polietileno, polipropileno, poliestireno, poli(tereftalato de etileno), poli(cloreto de vinila), copoli(acrilonitrila/butadieno/estireno), polidimetilsiloxano (PDMS), entre outras são empregadas na preparação de nanocompósitos com o emprego de diversos tipos de nanoreforços.
2.5.1 Silicones: Polidimetilsiloxano (PDMS)
silício com um ou mais grupos orgânicos ligados a cada silício. A fórmula química geral é [R2SiO]n, onde R são grupamentos orgânicos, que podem ser metil, etil ou
fenil. Assim, esses materiais são constituídos de um esqueleto inorgânico formado por silício e oxigênio (-Si-O-Si-O-Si-O-) com grupos laterais orgânicos ligados aos átomos de silício (MARK et al., 2005).
As siliconas podem ser fluídas, borrachas ou resinas sólidas, dependendo do comprimento da cadeia e dos grupos orgânicos ligados a ela. Atualmente podem ser encontradas nas mais diversas aplicações (quadro 4).
Quadro 4: Aplicações das diferentes formas das siliconas.
Formas Aplicações
Fluídas Antiespumante, aqua-repelentes, fluídos hidráulicos, surfactantes, e aditivos para plásticos (como plasticizantes, antiaderentes).
Borrachas Selantes, espumas, tubos, e materiais cirúgicos.
Resina Vernizes, revestimento protetores, e encapsulamento adesivos.
Das siliconas mais comuns, o polidimetilsiloxano (PDMS), se destacam por ser um óleo ou borracha reticulada simples e acessível comercialmente, e por apresentar a matriz inorgânica formada por um núcleo de silício e oxigênio Si-O e dois substituintes metila por átomos de silício (figura 7) (NUNES, 2009; LEWICKI et al., 2009).
Figura 7: Representação da estrutura química do PDMS.
-45°C a +145°C, sem a perda significativa de suas propriedades físicas sendo biologicamente inerte. As propriedades das siliconas são, também, influenciadas pela possibilidade de variação no ângulo da ligação Si–O–Si (entre 100º e 180º), bem como pela possibilidade de ocorrência de rotação nas ligações Si–O (GENOVESE e SHANKS, 2008).
Devido suas fracas forças intermoleculares, as siliconas apresentam diversas características próprias: baixa temperatura de solidificação; polímeros não reticulados, mesmo os de alta massa molecular permanecem líquidos em baixas temperaturas; alta permeabilidade a gases em filmes finos; ausência de cristalinidade em baixíssimas temperaturas; resistência ao envelhecimento, à luz solar, à umidade e à exposição a produtos químicos e baixa resistência mecânica (ALEXANDRU et al., 2011).
As propriedades de superfície das siliconas têm sido abordadas considerando as cadeias laterais ou grupos laterais como o principal agente de superfície, com a cadeia principal controlando a disposição desses grupos. Em PDMS, a atividade superficial está relacionada, aos grupos metila, considerados hidrofóbicos e, portanto, bons repelentes de água (MARK et al., 2005).
No presente trabalho, além as produção de nanopartículas de TiO2 pelo
Capítulo III
3 MATERIAIS E MÉTODOS
No presente capítulo, serão apresentados os materiais de partida utilizados nas rotas de síntese para obtenção das nanopartículas de TiO2 e na preparação dos
nanocompósitos PDMS/ TiO2. Em seguida será feita a descrição da metodologia e
aparato experimental empregados para caracterização das nanopartículas, assim como sua aplicação no nanocompósito.
3.1 MATERIAIS
Os reagentes e materiais utilizados nas rotas A e B de sínteses apresentadas neste trabalho não foram submetidos a qualquer tratamento prévio e são mostrados nos quadros 5 e 6.
Quadro 5: Denominação, fórmula química e fabricante dos reagentes utilizados na rota A.
Denominação Fórmula Química Fabricante dos reagentes
Álcool etílico C
2H2OH Synth
Ácido nítrico HNO3 Vetec
Isopropóxido de titânio C12H28O4Ti Aldrich
TEOS SiC8H20O4 Synth
Água destilada H2O -
Quadro 6: Denominação, fórmula química, fabricante dos reagentes utilizados na rota B.
Denominação Fórmula Química Fabricante do reagente
Isopropóxido de titânio C
12H28O4Ti Aldrich
Álcool etílico C2H2OH Vetec
Ácido acético glacial C2H4O2 Vetec
Ácido sulfúrico H2SO4 Vetec
Na preparação dos nanocompósitos foram utilizados os materiais mostrados no quadro 7.
Quadro 7: Materiais utilizados na preparação dos nanocompósitos.
Materiais Fórmula Química Fabricante
PDMS
CH3
(
Si O)
nCH3
Dow Corning Ltda
Agente de cura - Dow Corning Ltda
Hexano C6H14 Dinâmica
3.2 MÉTODOS
Neste trabalho foram realizadas duas rotas de síntese A e B, com o objetivo de verificar qual a melhor rota para aplicação em nanocompósito de matriz polimérica.
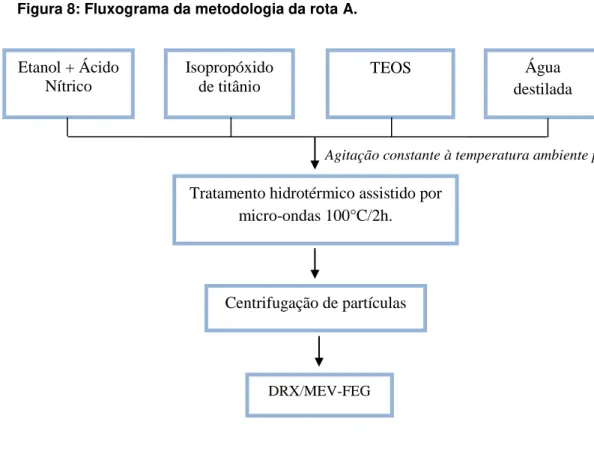
3.2.1 Metodologia experimental da Rota A
Na rota A, as nanopartículas de TiO2 foram sintetizados em meio ácido e com a
Figura 8: Fluxograma da metodologia da rota A.
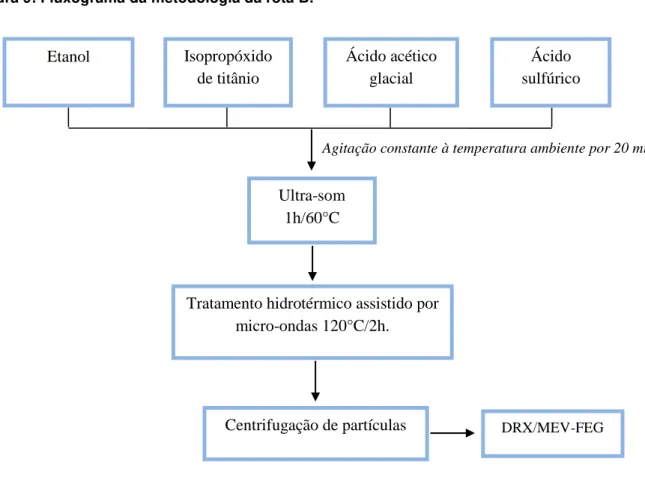
3.2.2 Metodologia experimental da Rota B
O procedimento da rota B foi iniciado com a diluição 10 ml de isopropróxido de titânio (IV) em 30 ml de etanol sob agitação constante por 5 minutos à temperatura ambiente. Em seguida adicionou-se gota a gota 20 ml de ácido acético, seguida pela adição de 1 ml de ácido sulfúrico sob agitação constante por 20 minutos. Posteriormente, a solução obtida de aspecto claro foi sonicada num ultra-som à 60°C durante 1 h, resultando na formação de uma solução coloidal leitosa, a qual foi transferida para uma autoclave revestido por teflon e iniciado o tratamento hidrotérmico irradiado por micro-ondas a 120°C durante 2 h. Após o resfriamento, o precipitado formado foi centrifugado e lavado com água destilada e etanol, esse procedimento foi repetido três vezes para diminui a acidez da solução, em seguida foi seco em temperatura ambiente. As amostras foram caracterizadas por DRX e MEV-FEG. As amostras foram nomeadas TiO2_B. Na figura 9 ilustra a metodologia
da rota B.
Etanol + Ácido Nítrico
Isopropóxido de titânio
TEOS Água
destilada
Agitação constante à temperatura ambiente por 20 minutos
Tratamento hidrotérmico assistido por micro-ondas 100°C/2h.
Centrifugação de partículas
Figura 9: Fluxograma da metodologia da rota B.
3.3 TÉCNICAS DE CARACTERIZAÇÃO DAS NANOPARTÍCULAS
As nanopartículas de TiO2 foram caracterizadas utilizando as técnicas de
análise, de difração de raios-X (DRX) e microscopia eletrônica de varredura com canhão com emissão por campo induzido (MEV-FEG). A partir dos dados do DRX foram feitos os cálculos do tamanho de cristalito.
3.3.1 Difração de raios X (DRX)
Os raios X possuem a propriedade de penetrar no material e de serem difratados pelos átomos. Esta técnica permite determinar os parâmetros cristalográficos e os arranjos dos átomos na rede cristalina. Os materiais cerâmicos apresentam, normalmente, microestruturas, podendo ser caracterizadas por tamanho de cristalitos, quantidades de fases cristalinas presentes, a existência de fases amorfas e orientação. A difração de raios-X (DRX) é um método que permite
Agitação constante à temperatura ambiente por 20 minutos
Etanol Isopropóxido
de titânio
Ácido acético glacial
Ácido sulfúrico
Ultra-som 1h/60°C
Tratamento hidrotérmico assistido por micro-ondas 120°C/2h.
caracterizar as fases cristalinas específicas presentes no material e para o estudo de análises estruturais de materiais policristalinos.
Neste trabalho, as nanopartículas de TiO2 foram caracterizadas quanto à sua
fase cristalina por DRX e as medidas foram realizadas em um difratômetro Shimadzu /XRD-7000, radiação CuKα ( = 1,54 Å), com 40 kV e 30 mA e 2θ de 5° a 70°. Os ensaios de difração de raios-X (DRX) foram realizados em amostras na forma de pó.
3.3.1.1 Determinação do tamanho de cristalito
A análise do tamanho de cristalito Dhkl para cada direção cristalográfica [hkl] foi realizada pelo uso da equação de Scherrer (Equação 3) (IKEZAWA e HOMYARA, 2001).
Equação 3
Em que, k é o coeficiente de forma do ponto da rede recíproca (0,9), é o
comprimento de onda da radiação a ser utilizada (1,54 Å), β é a largura a meia altura
do pico (FWHM) e θ o ângulo de difração. O parâmetro β é calculado utilizando a
seguinte equação:
Equação 4
Em que, βinst é a largura instrumental extraída de um pó padrão que tenha um tamanho de partícula muito grande (∼6 m), o material utilizado como padrão foi o silício, e βexp é a largura experimental da amostras a ser analisada.
3.3.2 Microscopia eletrônica de varredura com canhão de emissão por campo induzido
Com o objetivo de obter informações a respeito da morfologia e tamanho médio das partículas, as amostras foram submetidas à análise de microscopia eletrônica de
Dhkl = kλ
βcosθ
varredura (MEV-FEG), visto que esta técnica é capaz de estudar a morfologia, topografia e o aspecto da superfície das nanopartículas de TiO2.
A região da amostra a ser analisada é irradiada por um feixe de elétrons, resultando desta interação uma série de radiações emitidas pela superfície da amostra, entre outras, elétrons secundários e retroespalhados. A morfologia das amostras selecionadas foi obtida utilizando-se um microscópio eletrônico de alta resolução (FEG). Os pós das amostras foram dispersas em acetona e em seguida depositadas sobre um substrato de silício monocristalino.
3.4 CALCINAÇÃO EM FORNO MICRO-ONDAS DAS NANOPARTÍCULAS OBTIDAS PELA ROTA B
A partir dos resultados preliminares foi realizado um estudo do comportamento do material sintetizado pela rota B antes e após calcinação em forno micro-ondas, para observar se houve mudança de fase ou de morfologia, neste estudo as nanopartículas de TiO2 foram calcinadas a 200°C em diferentes patamares de 5, 15,
30, 45 e 60 minutos. E foram designadas de TiO2_x, em que x é o patamar de
calcinação. As amostras foram caracterizadas por DRX e MEV-FEG.
3.5 OTIMIZAÇÃO DA DEPOSIÇÃO DOS FILMES
Para esta etapa do trabalho, foi utilizado um aerógrafo comercial com bico médio (Badger 350, Badger Airbrush Co., Illinois, EUA), com capacidade de revestir uma área de aproximadamente 1 cm². Com o intuito de aumentar a área revestida e melhorar a reprodutibilidade, foi montado um sistema de deposição semelhante ao usado por Choonee et al. (2009), porém sem a opção de rotação da base. Nesse sistema o aerógrafo foi aclopado a um suporte como mostrado na figura 10, e com o auxílio de um compressor foi realizado a aplicação dos filmes. Esta etapa teve como objetivo um estudo da otimização da aplicação do nanocompósito (TiO2/polímero), já
Figura 10: Sistema de aplicação dos nanocompósitos.
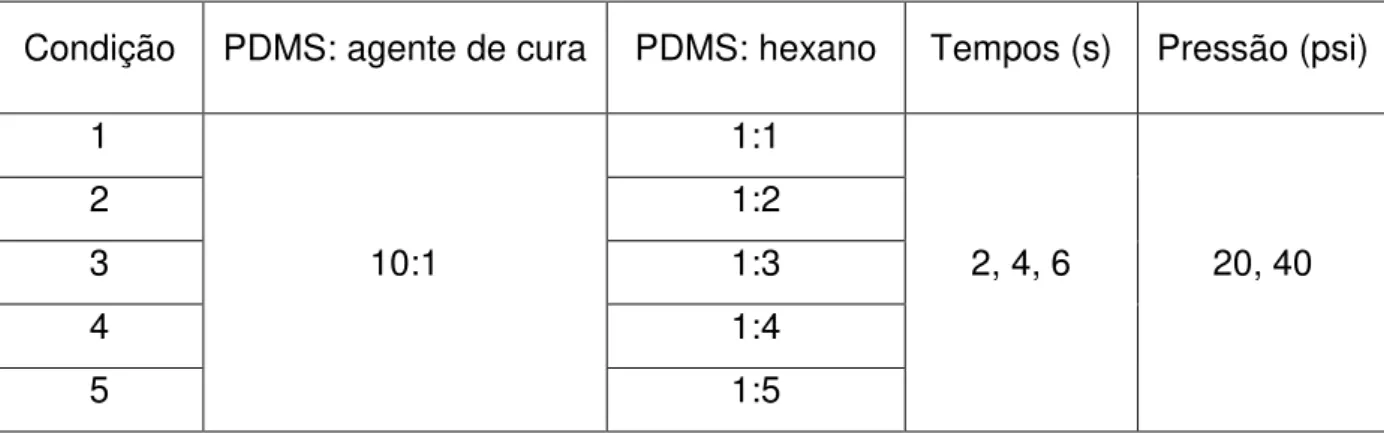
Com base em experimentos preliminares, foram testadas distância de 2,5 cm e 5 cm, em diferentes tempos (2, 4, 6, 10, 20, 30, 40 e 50 segundos), pressão de 20 psi e 40 psi, e variando a proporção PDMS:hexano como apresenta a tabela 3.Todos os testes foram realizados em pelo menos dez amostras com o propósito de reprodutibilidade da espessura. Os filmes foram criofraturados e a espessura da seção transversal foi determinada por microscopia eletrônica de varredura. Dentre os vários testes de aplicação, descreve-se a seguir apenas aquele que levou a resultados satisfatórios.
Tabela 3: Variáveis de composição e tempo de aplicação estudados.
Condição PDMS: agente de cura PDMS: hexano Tempos (s) Pressão (psi) 1
10:1
1:1
2, 4, 6 20, 40
2 1:2
3 1:3
4 1:4
5 1:5
Suporte Universal Pinça
Substrato
3.5.1 Teste satisfatório
Utilizando a condição 2 da tabela 3, foram depositados filmes com diferentes porcentagens de nanopartículas de TiO2, com tempo de aplicação de 2 segundos e
pressão de 20 psi. A composição da solução de PDMS com diferentes porcentagens em massa de nanopartículas de TiO2 estão mostrados na tabela 4.
Tabela 4: Formulações para confecção dos nanocompósitos.
Formulações PDMS: Agente de cura PDMS: Hexano TiO2 (% massa)
1
10:1 1:2
0
2 0,5
3 1
4 1,5
5 2
3.7 CARACTERIZAÇÕES DOS NANOCOMPÓSITOS
Para estudo da atividade fotocatalítica dos nanocompósitos, as amostras passaram por envelhecimento UV e foram caracterizadas antes e após o envelhecimento por pelas técnicas de caracterização: espectroscopia de UV-visível, espectrofotometria de infravermelho por transformada de Fourier (FTIR), nano-dureza e ensaio de molhabilidade para determinação do ângulo de contato das amostras.
3.7.1 Envelhecimento em câmara UV
Para análise da atividade fotocatalítica dos nanocompósitos, as amostras foram imersas em solução aquosa do corante azul de meliteno em concentração de 1,0.10-3 mol/L por 48 horas e passaram por envelhecimento UV durante 3 horas em
um reator com dimensões de h= 10cm, l= 1m e L= 20cm, com lâmpadas UVC (254
nm ≈ 4,9 eV) da marca SuperNiko, modelo ZG-30T8, com medições intermediárias
3.7.2 Espectroscopia de UV-Visível
As análises de espectroscopia na região do ultravioleta-visivel (UV-Vis) foram realizadas nos nanocompósitos e nos filmes de PDMS puro, para mensurar a diminuição da concentração relativa do corante azul nas amostras. O equipamento utilizado foi um espectrômetro UV-VIS, modelo UV-2550, da marca Shimadzu. Os
espectros de absorção dos filmes foram obtidos na faixa entre 400 e 800 nm, para observar se a adição de nanopartículas de TiO2 no polímero (PDMS) modifica a
atividade fotocatalítica dos filmes com relação a degradação do corante azul de metileno. Neste método, foi utilizada a intensidade de absorbância do pico principal a 660 nm. Todas as medidas foram realizadas à temperatura ambiente e em triplicata.
3.7.3 Espectrofotometria de Infravermelho por transformada de Fourier (FTIR)
A técnica de espectrofotometria de infravermelho por transformada de Fourier (FTIR) permite obter informações, tais como, a estrutura molecular e alterações nas ligações químicas. Esta técnica estuda a interação da radiação eletromagnética com a matéria, sendo um dos seus principais objetivos a determinação das bandas de energia das ligações químicas que compõem uma molécula.
Os espectros de absorção na região do infravermelho, foram obtidos através de um espectrofotômetro de infravermelho da Shimadzu, modelo IR-Prestige-21, utilizando 32 varreduras, resolução de 4 cm-1 e intervalo de 2 cm-1. Os experimentos
no modo de refletância total atenuada (ATR) foram realizados pela análise direta dos filmes depositados em laminas de vidro, na condição original e envelhecida, sobre cristal de seleneto de zinco.
3.7.4 Ensaio de nano-dureza