O NÚCLEO SUPRAQUIASMÁTICO E O FOLHETO INTERGENICULADO DO MORCEGO (Artibeus planirostris): PROJEÇÃO RETINIANA E
CARACTERIZAÇÃO NEUROQUÍMICA
NELYANE NAYARA MARTINS DE SANTANA
O NÚCLEO SUPRAQUIASMÁTICO E O FOLHETO INTERGENICULADO DO MORCEGO (Artibeus planirostris): PROJEÇÃO RETINIANA E
CARACTERIZAÇÃO NEUROQUÍMICA
Dissertação de Mestrado apresentada ao Programa de Pós-graduação em Psicobiologia da Universidade Federal do Rio Grande do Norte.
Orientador: Expedito Silva do Nascimento Jr. Co-Orientadora: Rovena C.G.J. Engelberth
planirostris): projeção retiniana e caracterização neuroquímica
Autor: Nelyane Nayara Martins de Santana
Data de defesa: 30/09/2015
Banca examinadora:
Prof. Dr. Eudes Euler de Souza Lucena
Universidade do Estado do Rio Grande do Norte - UERN
Prof. Dr. Fernando Vagner Lobo Ladd
Universidade Federal do Rio Grande do Norte - UFRN
Prof. Dr. Expedito Silva do Nascimento Júnior
“O conhecimento é orgulhoso por ter aprendido; a sabedoria é humilde por não saber mais. Saber o que é possível é o começo da felicidade.”
“A Deus por me dar o presente da vida.”
“Aos meus pais, Nely e Joaquim, por toda dedicação, esforço e
ensinamentos de princípios éticos e morais.”
“Aos meus familiares pelo apoio, incentivo e generosidade para alcançar os meus objetivos.”
“Aos meus colegas do Laboratório de neuroanatomia e do Laboratório de estudos neuroquímicos pela paciência e por me ensinarem técnicas de pesquisa”
“Ao Prof. DR. Expedito Silva do Nascimento Júnior por ter me aceitado como sua orientanda e pelos ensinamentos acadêmicos.”
“A Profª DRª Rovena C.J.G. Engelberth por ter me guiado nessa longa jornada, por nunca desistir de mim e me apoiar nos momentos difíceis. Obrigada!”
“Ao Prof. DR. Ruthnaldo Rodrigues Melo de Lima, pela ajuda na elaboração dos Charts”.
“Aos meus amigos Damião Diniz, Mariana Hortência, Fladjany Emanuelle, Lara Laíse e Renata Pêssoa, pelo carinho, apoio e pelos momentos de alegria.”
“Aos colegas da Secretaria de Planejamento e Finanças de Parnamirim por me proporcionarem um ambiente saudável de trabalho.”
“A Jamaranúbia de Melo Marinho pela compreensão, companherismo e inspiração que me fazem ser mais forte a cada dia, além de me ensinar que não existem barreiras para o amor.”
“A Maria Lúcia de Melo pelo acolhimento e por me permitir fazer parte da sua família.”
Figura 1: Representação esquemática simplificada do Sistema de Temporização Circadiana de mamíferos... 16
Figura 2: Representação esquemática simplificada das vias sincronizadoras... 18
Figura 3: Representação esquemática simplificada das vias eferentes, enfatizando as porções do NSQ... 23
Figura 4: Representação esquemática simplificada das vias aferentes do FIG... 25
Figura 5: Representação esquemática simplificada das vias eferentes do FIG em ratos... 26
Figura 6: Árvore molecular das famílias de morcegos existentes. Família do modelo experimental em destaque... 31
Figura 7: Macho adulto jovem do morcegoArtibeus planirostris... 32
Figura 8: Distribuição geográfica do Artibeus planirostris... 33
Figura 9: Fotomicrografias em campo claro de secções coronais do encéfalo do A. planirostris nos níveis rostral (A), médio (B) e caudal (C), mostrando a citoarquitetura do NSQ pelo método de Nissl... 41
A. planirostris, mostrando o padrão de imunorreatividade a VP (A) e VIP (B) no nível caudal; a NPY (C) no nível médio e 5-HT (D) no nível rostral... 44
Figura 12: Fotomicrografias em campo claro de secções coronais do NSQ do A. planirostris, mostrando o padrão de imunorreatividade a CB no nível caudal; a CR (B) e GFAP (D) no nível médio e PV (C) no nível rostral... 46
Figura 13: Esquemas obtidos a partir de fotomicrografias em campo claro de secções coronais do NSQ do A. planirostris, no nível rostral, médio e caudal, ilustrando o contorno citoarquitetônico; a distribuição de terminais retinianos imunorreativos a CTb; distribuição de pericários positivos para VP e VIP... 47
Figura 14: Esquemas obtidos a partir de fotomicrografias em campo claro de secções coronais do NSQ do A. planirostris, no nível rostral, médio e caudal, ilustrando a distribuição de fibras/terminais imunorreativos a NPY e 5-HT e pericários positivos para CB e CR... 48
Figura 15: Esquemas obtidos a partir de fotomicrografias em campo claro de secções coronais do NSQ do A. planirostris, no nível rostral, médio e caudal, ilustrando a distribuição de pericários positivos para PV e GFAP... 49
Figura 16: Fotomicrografias em campo claro de secções coronais do encéfalo do A. planirostris nos níveis rostral (A), médio (B) e caudal (C), mostrando a citoarquitetura do FIG pelo método de Nissl... 51
Figura 17: Fotomicrografias em campo claro de secções coronais do encéfalo do A. planirostris, no nível rostral (A), médio (B) e caudal (C), evidenciado a distribuição de terminais retinianos imunorreativos a Ctb no
complexo geniculado lateral do A. planirostris, mostrando o padrão de imunorreatividade a NPY (A) e GFAP (C) no nível caudal e 5-HT (B) no nível rostral... 54
Figura 19: Fotomicrografias em campo claro de secções coronais do complexo geniculado lateral do A. planirostris, mostrando o padrão de imunorreatividade a PLCa: CB (A) no nível rostral; CR (B) no nível médio e PV (C) no nível caudal... 56
Figura 20: Esquemas obtidos a partir de fotomicrografias em campo claro de secções coronais do complexo geniculado lateral do A. planirostris, no nível rostral, médio e caudal, ilustrando o contorno citoarquitetônico; a distribuição de terminais retinianos imunorreativos a CTb; distribuição de pericários positivos para NPY e fibras/terminais imunorreativas a 5-HT... 57
Figura 21: Esquemas obtidos a partir de fotomicrografias em campo claro de secções coronais do complexo geniculado lateral do A. planirostris, no nível rostral, médio e caudal, ilustrando a distribuição de pericários positivos para positivos para CB, CR, PV e GFAP... 58
Quadro 1: Especificações de anticorpos primários e anticorpos secundários utilizados no procedimento imuno-histoquímico com as suas referidas diluições e fabricantes... 39
Tabela 1: Conteúdo neuropeptidérgico e de PLCa no NSQ do Artibeus planirostris... 45
5-HT - Serotonina
5-HT - IR - Imunorretivo (a) a 5-HT BSA - Albumina de soro bovino CB - Calbindina
CB - IR- Imunorretivo (a) a CB CE - Ciclo claro/escuro CR - Calretinina
CRF - Curva de resposta dependente de fase CR - IR- Imunorretivo(a) a CR
CTb - Subunidade B da toxina colérica
DABtetra - Diaminobenzidina
DMH - Núcleo dorsomedial do hipotálamo DMSO - Dimetilsufúrico
ENK - Encefalina
FIG - Folheto intergeniculado Fos - Proteína do gene c-fos GABA - Ácido gama amino-butírico GFAP - Proteína acídica fribilar glial GFAP - IR Imunorreatividade a GFAP GLD - Núcleo geniculado lateral dorsal GLV - Núcleo geniculado lateral ventral GRP - Peptídeo liberador de gastrina
ipRGC - Células ganglionares intrinsecamente fotossensíveis da retina NEuN - Proteína nuclear neuronal
NPG - Núcleo pré-geniculado NPY - Neuropeptídeo Y NPY - IR - Imunorretivo (a) a NPY NSQ - Núcleo supraquiasmático NT - neurotensina
PBS - Tampão fosfato
PVT - Núcleo paraventricular do tálamo STC - Sistema de temporização circadiana TGH - Tracto geniculo-hipotalâmico
TRH - Tracto retino-hipotalâmico VIP - Polipeptídeo intestinal vasoativo VIP- IR - Imunorretivo (a) a VIP
VP - Vasopressina
RESUMO... 13
ABSTRACT... 14
1. INTRODUÇÃO... 15
1.1 Ritmos biológicos... 15
1.2 Sistema de temporização circadiana (STC)... 15
1.2.1 Vias sincronizadoras... 16
1.2.2 Núcleo supraquiasmático (NSQ)... 19
1.2.3 Vias eferentes... 22
1.2.4 Folheto intergeniculado (FIG)... 23
1.4 O morcego Artibeus planisrostris... 29
2. JUSTIFICATIVA... 31
3. OBJETIVOS... 32
3.1 Geral... 32
3.2 Específicos... 32
4. METODOLOGIA... 33
4.1 Sujeitos... 33
4.2 Procedimentos experimentais... 33
4.2.1 Anestesia... 33
4.2.2 Injeção intra-ocular de CTb... 34
4.2.3 Perfusão... 35
4.2.4 Remoção dos encéfalos... 36
4.2.5 Microtomia e Técnica de Nissl... 36
4.2.6 Imuno-histoquímica... 36
4.2.7 Montagem de lâminas e intensificação em Tetróxido de Ósmio... 38
4.3 Análise das lâminas... 38
5. RESULTADOS... 40
5.1 Núcleo supraquiasmático... 40
5.1.1 Citoarquitetura... 40
5.1.2 Projeção retiniana... 40
5.1.3 Neuroquímica... 43
5.2 Folheto intergeniculado... 50
5.2.1 Citoarquitetura... 50
6. DISCUSSÂO... 59
6.1 Núcleo supraquiasmático... 59
6.1.1 Citoarquitetura... 59
6.1.2 Projeção retiniana... 59
6.1.3 Neuroquímica... 61
6.1.4 Organização neuroquímica do NSQ do Artibeus planirostris... 66
6.2 Folheto intergeniculado... 67
6.2.1 Citoarquitetura... 67
6.2.2 Projeção retiniana... 67
6.2.3 Neuroquímica... 67
6.3 Discussão funcional e filogenética da organização neuroquímica do NSQ e FIG... 70
7. CONCLUSÃO... 71
7.1 Núcleo supraquiasmático... 71
7.2 Folheto intergeniculado... 71
7.3 Nicho temporal e os centros circadianos... 72
8. CONSIDERAÇÕES FINAIS... 73
REFERÊNCIAS... 74
RESUMO
O sistema de temporização circadiana (STC) compreende um conjunto de estruturas neurais, que incluem vias aferentes, como projeções retinianas, que permitem a sincronização dos ritmos biológicos aos ciclos ambientais; um marcapasso central que gera o sinal circadiano e vias eferentes, que conectam o marcapasso aos efetores comportamentais. Entre os componentes centrais do STC, destaca-se o núcleo supraquiasmático (NSQ), classicamente reconhecido como a estrutura neural que rege a ritmicidade biológica, e o folheto intergeniculado (FIG) do complexo geniculado lateral do tálamo, modulador do marcapasso. Nesse estudo, ambos os centros circadianos foram avaliados quanto a sua citoarquitetura, padrão de inervação retiniana e conteúdo neuroquímco por meio da técnica de Nissl, de traçador neural e técnicas imuno-histoquímicas no morcego Artibeus planirostris, microquiróptero comum no território brasileiro. Com base nessas técnicas foi possível observar que o NSQ, no nível rostral, exibe um formato aproximadamante triangular e no nível médio e caudal, assume um contorno arredondado, além de apresentar inervação retiniana bilateral, com leve predominância contralateral. O NSQ do Artibeus planirostris é dotado de células imunorreativas a vasopressina (VP), polipeptídeo intestinal vasoativo (VIP), calbindina (CB) e calretinina (CR); fibras/terminiais imunorreativos a neuropeptídeo Y (NPY) e serotonina (5-HT), além de marcação para proteína acídica fribilar glial (GFAP). O FIG recebe projeção retiniana bilateral e nos níveis rostral e médio exibe a forma de um fino folheto interposto entre o GLD e o GLV e a nível caudal expande-se medialmente contornando o GLV, além de conter células que expressam NPY, CB e CR; terminais imunorreativos a 5-HT e marcação para GFAP. Esse é o primeiro estudo a examinar o STC dessa espécie de quiróptero. Os dados indicam que o NSQ e FIG no Artibeus planirostris apresenta aferências retinianas e conteúdo neuroquímico similar a outras espécies de mamíferos. Em contrapartida, o NSQ desse morcego transcende os esquemas organizacionais clássicos descritos na literatura científica. Estudos moleculares e hodológicos são necessários para estabelecer uma divisão específica dessa estrutura nessa espécie de quiróptero.
ABSTRACT
The circadian timing system (CTS) comprises a set of neural structures that include input pathways, such retinal projections, which allow the synchronization of the biological rhythms to environmental cycles; a central circadian pacemaker, which generates the circadian signal and output pathways connecting the pacemaker to the behavioral effectors. Among the major components of the STC, highlight the suprachiasmatic nucleus (SCN), classically known as the neural structure that governs biological rhythmicity, and the intergeniculate leaflet (FIG) of the thalamic lateral geniculate complex, modulator pacemaker. In this study, both circadian centers were evaluated in respect to their cytoarchiteture, pattern of the retinal innervations and chemical content with a Nissl stain, neural tracer and imunohistochemical techniques in bat Artibeus planirostris, common microchiropteran in Brazil. Based on these techniques was observed in rostral sections, the SCN had an approximately triangular shape and in middle and caudal sections, this nucleus assumed an ellipsoidal contour. It receives bilateral retinal innervations, with discrete contralateral predominance and contains vasopressin (VP), vasoactive intestinal polypeptide (VIP), calbindin (CB) e calretinin (CR) immunoreactive cell bodies; neuropeptide Y (NPY) and serotonin (5-HT) imunopositive fibers/terminals, besides to glial fibrillary acidic protein (GFAP) labeling. The IGL contains NPY, CB and CR immunoreactive perikarya and receives a bilateral retinal projection. The rostral and middle IGL had a leaflet shape between the DLG and VLG. At a caudal level it had a descending portions which outlines de VLG medially. This is the first report examining the CTS of these species of chiropteran. The results indicate that retinal input and chemical content of the SCN and IGL in Artibeus planirostris are similar other mammalian species. In contrast, the SCN of these bat transcend the classical organizational schemes proposed in the scientific literature. Hodological and molecular studies are needed to stablish a specific division of this structure in these species of chiropteran
1. INTRODUÇÃO 1.1 Ritmos biológicos
Ao longo do processo evolutivo, os organismos desenvolveram diferentes estratégias para manter uma organização temporal interna em resposta as mais distintas oscilações ambientais (Rusak e Zucker, 1975; Hut e Beersma, 2011). Essa dimensão temporal se expressa na forma de oscilações nos parâmetros comportamentais e fisiológicos, denominada de ritmos biológicos (Cavalcante et al., 2006).
A ritmicidade biológica é geneticamente determinada (Lowrey e Takahashi, 2011) e apresenta propriedades bem definidas, com o oscilações endógenas que se repetem periodicamente (Tomotani e Oda, 2012), sincronização ao ciclo claro-escuro (CE), ritmo em livre-curso sob condições constantes e compensação interna da temperatura (Ukai e Ueda, 2010). Além disso, os ritmos biológicos são ubíquos, estando presentes em vários níveis de organização e complexidade dos seres vivos (Menna-Barreto e Díez-Noguera, 2011). Essa natureza ubíqua da ritmicidade biológica sugere que estas oscilações conferem uma vantagem adaptativa ao organismo, quanto ao ajustamento fisiológico e comportamental frente a alterações ambientais (Foster e Kreitzman, 2013).
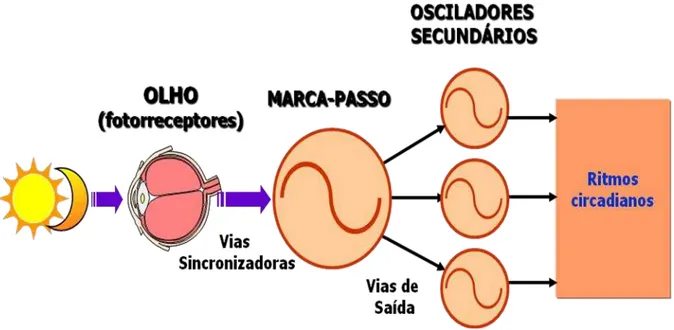
Para a adaptação dos organismos as flutuações ambientais, foi crucial o desenvolvimento de um sistema auto-sustentado, continuamente oscilante, com sincronização fótica ou não-fótica, responsável pela gênese e regulação dos ritmos biológicos, o Sistema de Temporização Circadiana (STC) (Cavalcante et al., 2006) (Fig.1). O STC é o aparato neural que orquestra os ritmos do corpo para coordenar ações e ajustá-las as pistas ambientais (Kronfeld-Schor et al., 2013). Dessa maneira, esse sistema aumentou a habilidade inata de organismos sobreviverem às constantes modificações do meio, possibilitando-os antecipar eficientemente aos mais diferentes eventos periódicos (Vitaterna et al., 2001; Panda et al., 2002).
1.2 Sistema de temporização circadiana (STC)
composto basicamente por 3 elementos distintos: (1) vias aferentes, também denominada de vias sincronizadoras, que permitem a sincronização dos ritmos biológicos aos ciclos ambientais, (2) marcapasso central, que gera o sinal circadiano e (3) vias eferentes, que conectam o marcapasso aos efetores comportamentais (Rosenwasser, 2009).
Contudo, várias evidências têm demonstrado que o STC apresenta uma configuração complexa, constituída de múltiplos osciladores hierarquicamente organizados e interativos (glândula adrenal, coração, fígado e rins), no qual, o marcapasso central coordenaria uma ampla rede de osciladores secundários, tanto a nível de sistema nervoso central, quanto a nível periférico (Albrech, 2012).
Figura 1: Representação esquemática simplificada do Sistema de Temporização Circadiana de mamíferos. Adaptado de Moore, 1999.
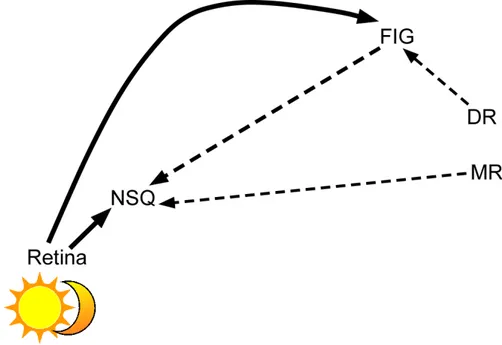
1.2.1 Vias sincronizadoras
O tracto retino-hipotalâmico (TRH) conduz informação luminosa, sendo formado por fibras originárias das células ganglionares intrinsecamente fotossensíveis da retina (ipRGC) do tipo M1 e M2 (Baver et al., 2008; Paul et al., 2009). Essas células expressam o fotopigmento melanopsina, sendo constituintes do sistema não-formador de imagem (Dibner, 2010; Albrecht, 2012). Essa via percorre o nervo óptico e destaca-se do quiasma óptico, ramificando-se bilateralmente no NSQ (Hendrickson et al., 1972; Moore e Lenn, 1972; Moore, 1973). O TRH é considerado a principal via sincronizadora dos ritmos circadianos ao ciclo claro/escuro, pois na ausência de todas as outras vias visuais, esse trato é suficiente para manter a sincronização comportamental (Klein e Moore, 1979) e a sua lesão resulta em perda da sincronização, com persistência dos ritmos em livre-curso (Johnson et al., 1988a). Embora o NSQ receba bilateralmente aferências retinianas através do TRH em todos os mamíferos, esse padrão de inervação varia consideravelmente entre as espécies, apresentando distribuição das projeções retinianas quase completamente contralateral em sagüi (Costa et al.,1999), predominantemente ipsilateral em mussaranho (Tokunaga et al.,1992) ou com quase completa simetria bilateral em carneiro (Tessonneaud et al.,1994). Adicionalmente, no rato (Canteras et al., 2011), gato (Murakami et al.,1989), rato-toupeira da Palestina (Negroni et al.,1997) e mocó (Nascimento Jr et al., 2010), o TRH se ramifica predominantemente na porção ventral do NSQ. Já no degus (Goel et al.,1999) e Arvicanthis niloticus (Smale e Boverhof, 1999), o referido trato apresenta inervação ventral e lateral. Em marsupiais, como o gambá-da-Virgínia (Didelphis virginiana) e Monodelphis
domestica (Cassone et al.,1988), o TRH ramifica-se dorsomedialmente. Já em
hamster (Johnson et al.,1988b) e camundongo esse trato preenche praticamente todo o núcleo (Carneiro, 2000; Abrahamson e Moore, 2001).
A segunda via é o tracto genículo-hipotalâmico (TGH). Essa projeção aferente ao NSQ é originada de neurônios retinorrecipientes do FIG e incide na porção
ventrolateral do NSQ (Harrington et al., 1987; Moga e Moore, 1997),
desempenhando a sua função através do NPY e do GABA (Harrington et al., 1985; Moore e Card, 1994). O TGH foi confirmado anatomicamente em rato (Takatsuji e Tohyama, 1989; Moore e Card, 1994), hamster (Harrington et al.,1985;1987; Morin e Blanchard, 1995), degus (Goel et al.,1999) e Arvicanthis niloticus (Gall et al., 2014).
A terceira fonte de aferências para o NSQ é representada pela projeção serotonérgica proveniente dos núcleos da rafe, mais especificamente, do núcleo mediano (Moga e Moore, 1997; Yamakawa e Antle, 2010). Além disso, projeções ascendentes serotonérgicas do núcleo dorsal da rafe inervam o FIG (Meyer-Bernstein e Morin, 1996; Hay-Schmidt et al., 2003; Blasiak e Lewandowisk, 2003).Evidências indicam que a 5-HT originária do núcleo mediano da rafe modula os efeitos fóticos do NSQ (Pontes et al., 2010) pelo controle da liberação de glutamato a partir do TRH (Morin, 1999).
1.2.2 Núcleo supraquiasmático (NSQ)
Dentre os componentes do STC de mamíferos, destaca-se um par de aglomerados neuronais localizados no hipotálamo anterior, imediatamente dorsal ao quiasma óptico e de cada lado do terceiro ventrículo, denominado de Núcleo Supraquiasmático (NSQ) (van den Pol, 1991). Embora apresente variações quanto a forma tridimensional, volume, densidade e tamanho de células, entre todas as espécies estudadas, como rato (van den Pol, 1980; Moore, 1982; Morin et al., 2006), camundongo (Abrahamsom e Moore, 2001; Morin et al., 2006), hamster (Card e Moore, 1984), mocó (Kerodon rupestris) (Nascimento Jr et al., 2010) e diferentes tipos de primatas (Moore, 1983; Bons et al., 1990; Mai et al., 1991; Costa et al., 1998; Rocha et al., 2014), essa estrutura é considerada o marcapasso mestre, responsável pelo controle da geração cíclica dos processos fisiológicos e consequentemente dos comportamentos expressos pelos indivíduos (Cavalcante et al., 2006; Golombek e Rosenstein, 2010).
Para corroborar a importância do NSQ, na geração dos ritmos biológicos, diferentes abordagens experimentais foram utilizadas, como técnicas de ablações (Moore e Eichler, 1972), eletrofisiológicas (Albus et al., 2005), neuroquímicas (Costa et al., 1998; Morin, 2007), moleculares (Albrecht et al., 2001; Ueda et al., 2005) e de transplante de tecido fetal (Lehman et al., 1987; Ralph et al., 1990).
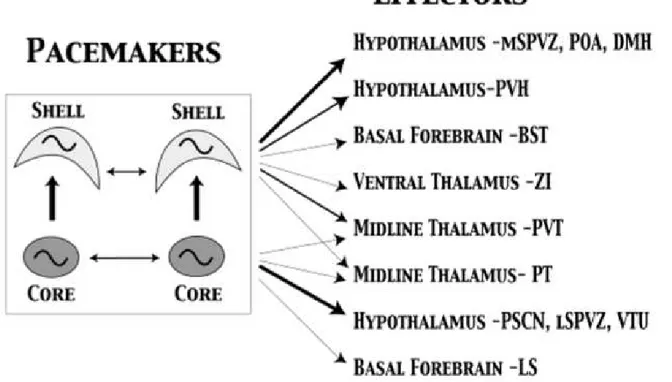
Classicamente, os NSQ´s são núcleos heterogêneos quanto a sua natureza neuroquímica e vias de projeções (aferentes e eferentes), sendo subdividido em duas subregiões distintas, o cerne ou porção ventrolateral e a casca ou porção dorsomedial (van den Pol, 1980; Mammen e Jagota, 2011). Essa subdivisão evidencia a compartimentalização funcional dessa estrutura, tanto na decodificação da informação fótica, quanto na geração da ritmicidade intrínseca de cada porção (Moore et al., 2002; de la Iglesia et al., 2004).
suas eferências, o cerne projeta para diferentes núcleos hipotalâmicos, como a área peri-supraquiasmática, a zona subparaventricular (SZPV) e a área tuberal ventral; talâmicos, incluindo o núcleo paratenial e o paraventricular (PVT) e prosencenfálicos, abrangendo o núcleo septal lateral (Leak e Moore, 2001). Acredita-se que a função do cerne pode ser usar informações visuais primárias e secundárias para sincronizar os mecanismos do NSQ e convergir essa informação para a casca e para regiões inervadas por essa própria porção (Leak e Moore, 2001).
A casca é caracterizada pela maciça presença de neurônios que expressam a arginina vasopressina (VP-IR), além de angiotensina II, encefalina (ENK) e CB (Abrahamson e Moore, 2001; Welsh et al., 2010). Além disso, essa porção recebe aferências do cerne (Morin, 2006), do tronco encefálico (Bina et al., 1993), hipotálamo (Panula et al., 1989; Wada et al., 1991), tálamo e sistema límbico (Moga e Moore, 1997) e enviam densamente projeções para a SZPV, núcleo dorsomedial (DMH) e paraventricular do hipotálamo (PVN), bem como, para o PVT (Abrahamson e Moore, 2001; Leak e Moore, 2001). Teoriza-se que o papel predominante dessa porção seria integrar as informações do cerne com aferências hipotalâmicas e límbicas, para fornecer um sinal temporal preciso para os efetores comportamentais (Leak e Moore, 2001).
A serotonina (5-HT), proveniente principalmente dos núcleos da rafe, também foi descrita em fibras/terminais em camundongo (Abrahamsom e Moore, 2001), hamster (Card e Moore, 1984), sagui (Costa et al., 1998; Cavalcante et al., 2002), gato (Ueda et al.,1983), rato (Ueda et al.,1983; van den Pol e Tsujimoto, 1985), rato-toupeira da Palestina (Negroni et al.,1997), rato-rato-toupeira da África do Sul (Negroni et al.,2003), Macaca fuscata (Ueda et al.,1983) e mocó (Nascimento Jr et al., 2010).
O ácido gama amino-butírico (GABA), que é sintetizado pela maioria dos neurônios do NSQ (Moore e Speh, 1993), apresenta co-localização com uma variedade de neuropeptídeos, evidenciando uma ampla distribuição espacial desse neurotransmissor (Antle e Silver, 2005; Buijs et al., 1995).
A proteína acídica fibrilar glial (GFAP), proteína estrutural de astrócitos, foi descrita no NSQ de hamster e rato (Morin et al., 1989), mocó (Nascimento Jr et al., 2010), Arvicanthis niloticus (Smale e Boverhof, 1999) e em humanos (Mai et al., 1991). Já a NeuN, proteína nuclear neuronal, foi observada no NSQ de macaco-prego (Cebus apella) (Nascimento et al., 2010), hamster e camundongo (Morin et al., 2011).
Além dessas substâncias supracitadas, elementos imunorreativos a substância P (Smale et al., 1991; Costa et al., 1998; Moore et al., 2002), somatostatina (Moore e Card, 1984; Abrahamsom e Moore, 2001; Moore et al., 2002), galanina (Mai et al., 1991; Abrahamsom e Moore, 2001), fator liberador de corticotrofina (Smale e Boverhof, 1999; Morin et al., 2006), colecistoquinina, bombesina, dopamina e hormônio liberador de tireotropina (van den Pol e Tsujimoto, 1985) também foram identificados no NSQ. Sugere-se que a variabilidade no conteúdo neuroquímico desse núcleo reflete o funcionamento diferenciado dos mecanismos de sincronização de cada espécie (Cavalcante et al., 2006).
Jr et al., 2010), camundongo (Ikeda e Allen, 2003) e rato (Résibois e Rogers, 1992). PV foi identificada no NSQ de gato (de Leon et al.,1995), contudo, está ausente no sagüi (Costa et al., 1998), rato (Celio, 1990), macaco de cheiro (Saimiri sciureus) (Fortin e Parent, 1997) e mocó (Nascimento Jr et al., 2010).
1.2.3 Vias eferentes
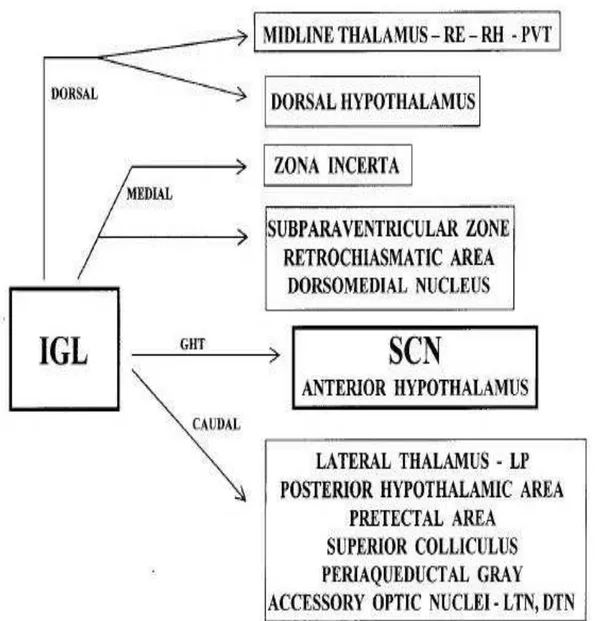
Figura 3: Representação esquemática simplificada das vias eferentes, enfatizando as porções do NSQ. Adaptado de Leak e Moore, 2001. MSPVZ, porção medial da zona subparaventricular; POA, área pré-óptica; DMH, núcleo dorsomedial do hipotálamo; PVH, núcleo paraventricular do hipotálamo; BST, núcleo intersticial da estria terminal; ZI, zona incerta; PVT, núcleo paraventricular do hipotálamo; PT, núcleo paratenial; PSCN, região perisupraquiasmática; LSPVZ, porção lateral da zona subparaventricular; VTU, área tuberal ventral e LS, núcleo septal lateral.
1.2.4 Folheto intergeniculado (FIG)
al., 2003) e no gato, é a divisão magnocelular do GLV (Pu e Pickard, 1996; Van der Gucht et al., 2003; Nakamura e Itoh, 2004).
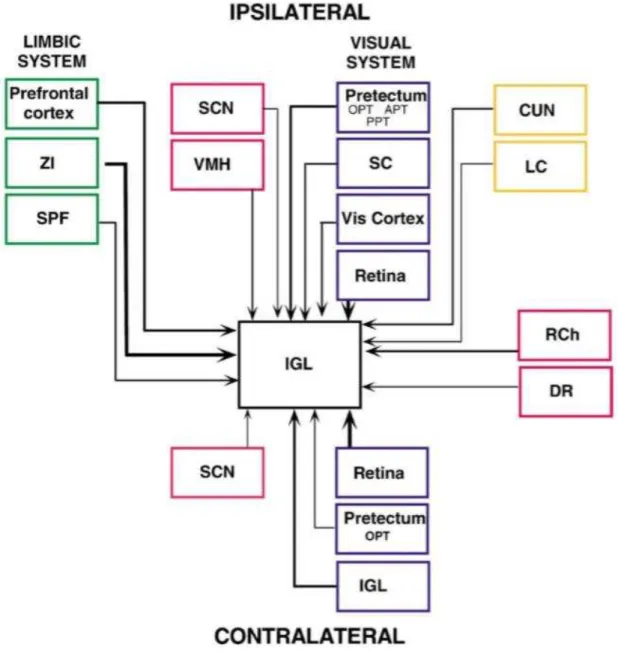
Como o NSQ, o FIG recebe aferência retiniana binocular direta das mesmas ipRGC que se projetam para o marcapasso circadiano, atingindo ambas as estruturas após a bifurcação dos seus axônios(Pickard, 1985; Morin et al., 2003). O TGH origina-se parcialmente de células que expressam NPY, que se projetam predominantemente a partir do FIG para o NSQ (Blasiak e Lewandowski, 2013). Essa característica foi confirmada por estudos de lesões do FIG, o que provoca uma drástica redução na quantidade de terminais NPY-érgicos no NSQ (Morin e Blanchard, 2001).
Quanto ao seu aspecto neuroquímico, o FIG é caracterizado pela presença de elementos imunorreativos a NPY (Card e Moore, 1989; Laemle et al.,1993; Harrington et al., 1985; 1987; Ueda et al.,1986; Hostetler et al., 2013), GABA (Moore e Speh, 1993; Agarwala et al., 1992a; 1992b), ENK (Mantyh e Kemp, 1983; Morin et al.,1992; Moore e Speh, 1993; Conley e Freiderich-Ecsy, 1993), óxido nítrico (Nascimento Jr et al., 2010) e Substância P (Takatsushi et al.,1989; Samuels et al., 2006). Fibras/terminais imunorreativos a 5-HT (5-HT-IR) também foram detectadas nessa estrutura (Morin et al.,1982; Card e Moore, 1984; Goel et al.,1999; Negroni et al., 2003). Além disso, foi observada imunorreatividade a GFAP (Morin et al., 1989; Smale e Boverhof, 1999; Nascimento Jr et al., 2010), CB (Celio, 1990; Carneiro, 2000; Cavalcante et al., 2008; Negroni et al.,2003) e CR (Arai et al., 1993; Carneiro, 2000; Cavalcante et al., 2008).
Em roedores, existem basicamente dois tipos populações celulares no FIG. A primeira é caracterizada pela co-localização de GABA e ENK e, se projeta exclusivamente para o FIG contralateral e a segunda, apresenta co-localização com GABA e NPY, projetando-se predominantemente para o NSQ através do TGH (Moore, 1992; Morin e Allen, 2006). Em hamster, ainda pode ser identificado um terceiro tipo subpopulação, com co-localização com neurotensina e NPY (Morin e Banchard, 1995).
profundas do colículo superior, núcleo cuneiforme e o locus coeruleus (Vrang et al., 2003) (Fig.4).
Em relação as suas eferências, o FIG, em ratos, se projeta para além do NSQ, inervando as áreas hipotalâmicas anterior, posterior e dorsal; a área retroquiasmática; a ZSPV; o núcleo dorsomedial; os núcleos talâmicos da linha média, incluindo o reuniens, rhomboide e paraventricular; o núcleo lateral posterior do tálamo; a substância cinzenta periaquedutal, a zona incerta; núcleo do tracto óptico; a área pré-tectal medial; o núcleo olivar pré-tectal, a camada cinzenta superficial do colículo superior e os núcleos terminais lateral e dorsal do sistema óptico acessório (Moore et al., 2000) (Fig. 5).
Em uma sequência de trabalhos, os pesquisadores Morin e Blanchard demonstraram as eferências do FIG em hamster. Em um estudo inicial, com o uso de fluorogold como traçador retrógrado, forma observadas projeções do FIG para o NSQ, para o FIG contralateral e para o núcleo talâmico limitante posterior (Morin e Blanchard, 1995). Em um trabalho posterior, esses autores descrevem conexões com todo o complexo geniculado lateral, núcleo lateral posterior do tálamo, núcleo limitante posterior, núcleo pré-tectal anterior, núcleo do tracto óptico, núcleo olivar pré-tectal, núcleo pré-tectal comissural, núcleo pré-tectal medial, núcleo pré-tectal posterior e colículo superior (Morin e Blanchard, 1998). A partir dos resultados desse trabalho aventou-se a hipótese da participação do FIG no controle motor ocular.
Posteriormente, com o uso do traçador anterógrado PHA-L foram descritas eferências do FIG para o prosencéfalo, incluindo a divisão anterior do núcleo intersticial da estria terminal, porção horizontal da banda diagonal de Broca e porção intermédia do núcleo septal (Morin e Blanchard, 1999). Áreas tronco-encefálicas, como núcleo do nervo óculo-motor, do nervo troclear, de Edinger-Westpal, do trato óptico, núcleo lateral e dorsal do pedúnculo-pontino, substância cinzenta periaquedutal supra-oculomotora, núcleo intersticial do fascículo longitudinal medial, oliva inferior, núcleo interpósito da rafe, os núcleos terminais e todas as camadas do colículo superior foram descritas como alvos de projeções do FIG. A presença dessa inervação no tronco encefálico permitiu a teorização da participação do FIG nos mecanismos de regulação de sono-vigília e vísuomotores (Morin e Blanchard, 2005). Quanto a sua funcionalidade, postula-se que o FIG participa da regulação do ciclo sono-vigília, do controle visuomotor e da ritmicidade circadiana (Harrington 1997; Morin e Blanchard, 2005). Nesse último aspecto, estudos farmacológicos e/ou de lesões revelam que o FIG não está diretamente envolvido com a sincronização dos ritmos endógenos ao CE, mas na verdade, é responsável pela modulação fótica e não fótica dos ritmos biológicos (Dark e Asdourian, 1975; Harrington e Rusak, 1986; Pickard et al., 1987; Johnson et al., 1989).
modifica a fase do ritmo de N-acetil-serotonina da pineal de ratos (Cipolla Neto et al., 1995).
Embora esses dados indiquem que o FIG não está diretamente envolvido com a sincronização fótica, diversos aspectos comportamentais corroboram a sua importância para a modulação da ritmicidade biológica. Em camundongos, a lesão bilateral do FIG alonga o período do ritmo de atividade em livre-curso sob escuro constante, mas não em claro constante (Pickard, 1994) e em rato, resulta na perturbação da sincronização a um fotoperíodo esqueleto (Edelstein e Amir, 1999). Em hamster, ablações do FIG prolongam o tempo de ressincronização a mudanças de fases em ciclo claro/escuro (Harrington e Rusak, 1986; Johson et al., 1989), modificam o ângulo de fase de sincronização a um ciclo escuro sinusoidal (Pickard, 1989).Também em hamsters, a lesão do FIG diminue a frequência do fenômeno de bipartição (spliting) dos NSQ em condições de claro constante (Harrington e Rusak, 1988), altera mudanças de fase a pulsos de luz agudos em escuro constante e suprime a resposta de alongamento do período normalmente provocado pelo claro constante (Pickard et al., 1987).
Em espécies diurnas, como o degus, a lesão bilateral do FIG resulta em um significativo avanço e alongamento da fase ativa do ciclo desse animal, sobre condições controladas de iluminação (CE 12:12) (Goel et al., 2000). No Arvicanthis niloticus, esse mesmo tipo de trauma induz o aumento do atividade locomotora após pulsos de escuro em claro constante e diminui esse mesmo tipo de atividade após pulsos de claro em escuro contante (Gall et al., 2013). Ablações do FIG também aumentam a atividade locomotora principalmente durante a fase escura (CE12:12) e, durante a noite subjetiva em condições constantes de iluminação nesse roedor diurno (Gall et al., 2013).
Adicionalmente, evidências fornecidas por diferentes abordagens
Outro indicador do papel do FIG na mediação de efeitos de mudança de fase a estímulos não fóticos é apoiado pela própria estimulação elétrica dessa estrutura (Rusak et al., 1989); por infusões de NPY (Albers et al., 1984; Huhman e Albers, 1994), anticorpos anti-NPY (Biello et al., 1994), N-metil-aspartato (Johson et al.,1988c) ou glutamato (Meijer e Harrington, 1993) dentro do NSQ e por micro-aplicações de NPY no NSQ in vitro (Medanic e Gillete, 1993; Shibata e Moore, 1993). Ambos os estímulos produzem uma curva de resposta dependente de fase (CRF) diferente daquela produzida pela luz, assemelhando-se, na verdade, a um CRF não-fótica. Essa similaridade nas CRF incluem o avanço de fase durante o dia subjetivo e o atraso de fase ao longo da noite subjetiva. Sugere-se que esse fenômeno é um mecanismo de retroalimentação, que regula a função do NSQ, de maneira diferente do que faz a luz (Cavalcante et al., 2006).
A hipótese do papel não-fótico do FIG na ritmicidade circadiana é corroborada pela expressão da proteína do gene c-fos (Fos) (Edelstein e Amir, 1995; Janik et al., 1995; Mikkelsen et al., 1998). Para esse tipo de estímulo foi observado a maior expressão de Fos no FIG durante o dia subjetivo (Mikkelsen et al., 1998), principalmente nas células NPY-érgicas (Janik et al., 1995).
1.4 O morcego Artibeus planirostris
Os morcegos, em sua maioria, são exclusivamente noturnos (Rydell e Speakman, 1995; Speakman, 2001) e constituem uma das ordens – Chiroptera – mais diversificadas dos mamíferos, sendo os únicos que apresentam real capacidade do vôo, como relata a denominação grega: cheir (mão) e pteron (asa) (Reis et al., 2007). O esqueleto desses animais é adaptado ao vôo, com ossos finos, tubulares e leves. A capacidade de voar e a ecolocalização são creditadas como as mais importantes características responsáveis pela dispersão desses indivíduos no planeta (Simmons, 2005). Essa ampla distribuição mundial não está apenas refletida na variedade de habitats explorados por esses animais (regiões temperadas e tropicais, com exceção de algumas ilhas oceânicas e a Antártica), mas também na riqueza de espécies, formando a segunda maior ordem de mamíferos, com cerca de 200 gêneros e 1100 espécies (Kunz e Lumsden, 2003; Simmons, 2005).
morfológicas (Simmons, 1994; Van Den Bussche et al., 1998). A primeira compreende as maiores formas de morcegos, agrupadas em uma única família (Pteropodidae), sendo encontrados em trópicos e subtrópicos apenas no Velho Mundo (Neuweiler, 2000). Devido ao seu porte (1,7m de envergadura e 1,5kg de peso) e as suas características faciais, os megaquirópteros são conhecidos popularmente como “raposas-voadoras” (Reis et al., 2007). Já a segunda, apresenta distribuição cosmopolita, não ocorrendo em regiões polares e ilhas muito afastadas das massas continentais, sendo formada por 17 famílias e 928 espécies (Hutson et al., 2000; Simmons, 2005). Esses animais pesam entre 2 e 196g (Aguiar e Taddei, 1995), com comprimento de antebraço variando de 22,5 a 115 mm (Hutson et al., 2000).
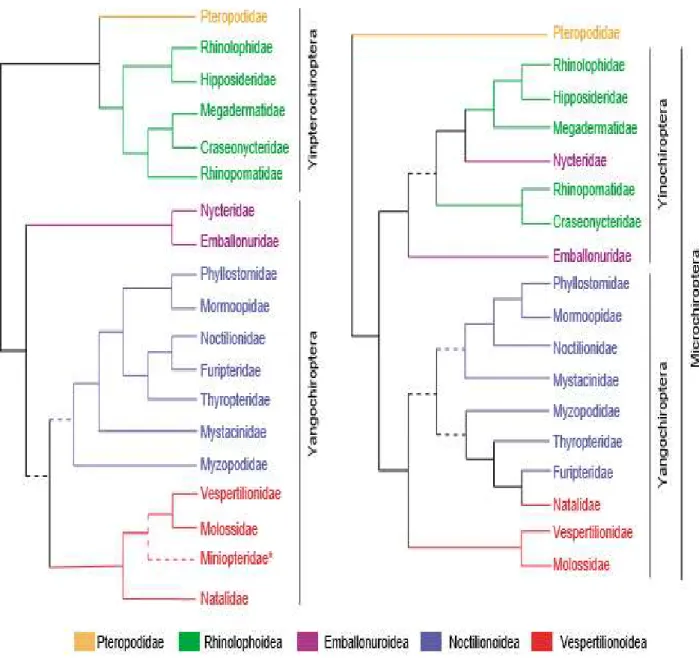
Entretanto, essa classificação tem sido contrariada por estudos filogenéticos baseados em dados moleculares (Van Den Bussche et al., 1998; Hutcheon et al.,1998). Estudos apontam que alguns grupos de morcegos com ecolocalização sofisticada compartilham um ancestral comum com as “raposas-voadoras”, sugerindo a parafilia dos quirópteros (Van Den Bussche e Hoofer, 2004; Teeling et al., 2005; Teeling, 2009). Dessa forma, a família Pteropodidae e mais cinco famílias de microquirópteros foram agrupados na subordem Yinpterochiroptera, e as famílias restantes, incluindo a Phyllostomidae, na subordem Yangochiroptera (Figura 3) (Jones e Teeling, 2006; Teeling et al., 2012). No território brasileiro, são conhecidas nove famílias de microquirópteros, dentre essas, a família Phyllostomidae, a qual pertence o Artibeus planirostris (Figura 4). Esse animal tem tamanho médio, com massa corporal entre 40 a 69 g, amplitude de braço de 62 a 73mm (Hollis, 2005) e comprimento do corpo variando de 7,5 a 11 cm (Reis et al.,2013).
Figura 6: Árvore molecular das famílias de morcegos existentes. Família do modelo experimental em destaque. Adaptado de Jones e Teeling, 2006
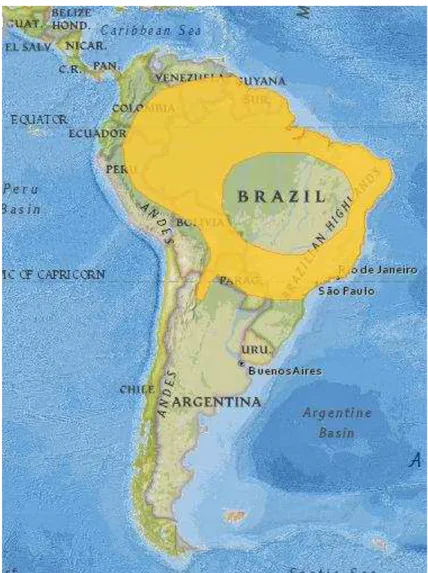
Figura 8: Distribuição geográfica do Artibeus planirostris (em amarelo). (Fonte: The IUCN Red List).
O mocego A. planirostris é solitário ou pode formar pequenas colônias de 6-15 indivíduos, apresentando dieta predominantemente frugívora, no entanto, a sua alimentação pode ser complementada com recursos florais (néctar e pólen) (Beguelini et al., 2013). Esse quiróptero é oportunista, utilizando principalmente habitats fechados, onde forrageia junto à vegetação (Bernard, 2002). Apresenta estratégia de forrageio do tipo “coletor” (gleaning), caracterizada pela captura de alimentos relativamente estacionários junto à superfície, diferentemente dos morcegos “aéreos” (aerial), que capturam presas durante o vôo (Kalko et al., 1996).
2. JUSTIFICATIVA
Considerando a importância do STC na adaptação temporal dos organismos vivos é fundamental conhecer a especificidade neuroquímica e das projeções retinianas desse sistema em uma maior variedade de espécies, com o intuito de melhor explorar sua função e elucidar muitas questões pertinentes a sua constituição e ao seu padrão de desenvolvimento evolutivo.
No que se refere a estudos de mapeamento anatômico cerebral, o morcego Artibeus planirostris é uma espécie pouco explorada, apresentando amplo campo de estudos e uma oportunidade única de perceber adaptações relativas ao voo em um mamífero voador.
Quanto a determinação do nicho temporal das espécies, esse estudo pode fornecer subsídios para o entendimento dos padrões temporais de atividade de animais diurnos, crepusculares e noturnos.
Em face ao cenário controverso quanto à monofilia dos quirópteros, a pesquisa visa contribuir para esclarecer as relações filogenéticas desses animais e também do próprio STC, oferecendo o substrato necessário para estudos comparativos desse grupo e do referido sistema.
3. OBJETIVOS
3.1 Geral
Caracterizar neuroquímica e morfologicamente o NSQ e o FIG do morcego Artibeus planirostris.
3.2 Específicos
Delimitar citoarquitetônicamente o NSQ e FIG;
Caracterizar o padrão de aferência retiniana para o NSQ e FIG;
4. METODOLOGIA 4.1 Sujeitos:
Para a realização deste projeto foram utilizados 13 (treze) exemplares machos do morcego Artibeus planirostris, pesando em média de 41,34g. Os morcegos foram classificados como adultos jovens baseados na coloração da pelagem, no desgaste dos dentes, na ossificação da articulação metacarpo-falangeana das asas e na evidência dos testículos.
Os animais foram obtidos por captura na borda de um fragmento de vegetação, no Centro de Biociências da Universidade Federal do Rio Grande do Norte (CB/UFRN) (Coordenadas em UTM: 25M 256251 / 9353764) e em um agrupamento arbóreo, nas proximidades da Reitoria da referida instituição de ensino (Coordenadas em UTM: 25M 256226 / 9354214), mediante autorização do Instituto Brasileiro do Meio Ambiente (IBAMA) (Licença SISBIO Nº 25233-2).
Para a captura dos animais foram utilizadas de uma a três redes de neblina Ecotone® de nylon, dimensões 12 x 3 m e tamanho de malha 19 x 19 mm. As redes foram armadas no nível do solo e, em cada noite de captura, foram abertas logo após o pôr do sol e permaneceram expostas por duas horas consecutivas.
Cada indivíduo capturado foi analisado quanto ao sexo e à faixa etária. Foram mantidos em sacos de algodão até o término da amostragem e transportados até o laboratório de Neuroanatomia. Os demais indivíduos que não eram caracterizados como adultos jovens foram soltos no mesmo local da captura.
Antes do procedimento experimental e após a injeção intra-ocular de traçador retrógrado, os animais foram acomodados no biotério do Departamento de Morfologia da referida instituição de ensino (DMOR/UFRN), em gaiolas medindo 0,50 x 0,70 x 0,35m, onde havia caixas ninho medindo 0,15 x 0,13 x 0,29m. Os animais foram expostos a condições naturais de luminosidade, temperatura e umidade, com comida e a água ad libitum. Os morcegos foram acompanhados durante a pesquisa por um médico veterinário, para atestar as boas condições de saúde desses animais.
Grande do Norte (CEUA/UFRN) (Protocolo nº 009/2012), sendo executados no laboratório de Neuroanatomia, vinculado ao DMOR/UFRN.
Todos os cuidados foram tomados no sentido de evitar dor e sofrimento aos animais durante os procedimentos experimentais, seguindo estritamente as normas e princípios estabelecidos pela Lei Arouca (11.794/08), para o uso científico de animais (Brasil, 2008) e pela National Research Council of the National Academy
publicadas no livro “Guidelines for the Care and Use of Mammals in Neuroscience
and Behavioral Research”. Esta última possui uma versão em formato pdf,
disponível gratuitamente no site da Sociedade de Neurociências e Comportamento (SBNeC) – http://www.sbnec.gov.br/links.
4.2 Procedimentos experimentais
4.2.1 Anestesia
Os animais foram anestesiados com uma combinação medicamentosa, de propriedades analgésicas, anestésicas e de relaxamento muscular. A administração dessa solução ocorreu por meio de injeção intramuscular, até que o sujeito experimental atingisse o plano anestésico. As substâncias utilizadas foram o cloridrato de tramadol (5mg/Kg), potente analgésico contra dores de intensidade moderada a grave; o diazepam (0,5mg/Kg), benzodiazepina de ação central, que induz ao estado de sedação, hipnose, amnésia e apresenta características anti-convulsionantes; o cloridrato de cetamina(5mg/Kg), anestésico dissociativo, que causa sedação, imobilidade e analgesia e o cloridrato de xilazina (0,5mg/Kg), um relaxante muscular, que potencializa a ação da maioria das drogas anestésicas. Acrescido a isso, foi instilado 1 gota de tetracaína oftalmológica, no olho submetido a infusão de CTb.
4.2.2 Injeção intra-ocular
conseqüentemente melhorar a captação do CTb. A injeção foi aplicada no olho esquerdo, utilizando-se uma agulha de calibre 30 (8,00mm x 0.3mm), lentamente, sob pressão, com auxílio de uma micro-bomba propulsora. Esse equipamento impulsiona a solução em um fluxo de 0,8 l/min. A agulha foi introduzida na junção esclero-corneal, atingindo o corpo vítreo, em um ângulo de aproximadamente 45º, sendo retirada 15 minutos após ter cessado o fluxo. Esse procedimento objetiva diminuir um possível refluxo da solução.
Durante o período de recuperação (5 dias) os animais retornaram para as gaiolas de origem onde receberam antibioticoterapia, com Cefalotina® e um antiinflamatório, Meloxican® por via intramuscular, além de suplementação com o complexo vitamínico Bionew® (Vetnil, Louveira, SP) pela via subcutânea. Após esse período de sobrevida, os animais foram novamente anestesiados, com o mesmo protocoloco anestésico do procedimento cirúrgico e, posteriormente foram perfundidos.
4.2.3 Perfusão
Ao atingir o plano anestésico, cada animal foi perfundido transcardiacamente, em capela de exaustão. O animal foi posicionado em decúbito dorsal, sobre tela de arame sob ponto de água e submetido à toracotomia, com incisão de pele, músculos e arco costal, sendo esses removidos em bloco, para exposição do coração. Logo em seguida, foi realizada a cardiopunção no ventrículo esquerdo, utilizando agulha de 16G (1,6 x 17 mm), a qual foi direcionada para a aorta ascendente e, logo após esse procedimento, seccionou-se o átrio direito para escoamento do líquido vascular. A agulha foi conectada a uma bomba peristáltica (Masterflex, Cole-Parmer, Niles, IL), infundindo-se pelo leito vascular 150 ml de solução salina a 0,9% em tampão fostato (PBS) 0,1M, pH 7,4, acrescida com heparina (Parinex, 5000 UI/ml, Hipolabor, Belo Horizonte, MG) na concentração de 2ml/L, à temperatura ambiente, com velocidade de 6 ml/minuto. Posteriormente, foram infundidos 300 ml de solução fixadora (formaldeído a 4%, Dinâmica, Diadema, SP) em PBS 0,1M, pH 7,4, passando-se a primeira metade dessa solução, a um fluxo de 6 ml/minuto e o restante a 3 ml/minuto. Todos os animais foram perfundindos durante a fotofase (ZT10-12).
4.2.4 Remoção dos encéfalos
Concluída a etapa da perfusão, os encéfalos foram retirados da cavidade craniana, por fratura dos ossos da calota craniana, com o uso de broca e trocater. Em seguida, foram pós-fixados na mesma solução fixadora por duas horas e posteriormente transferidos para uma solução de sacarose 30% (Dinâmica, Diadema, SP) em PBS 0,1 M, pH 7,4 a 4°C, até serem submetidos à microtomia.
4.2.5 Microtomia e Técnica de Nissl
Finalizada a etapa de pós-fixação e imersão em tampão sacarose a 30%, os encéfalos foram congelados em gelo seco e seccionados em um micrótomo horizontal de deslizamento, obtendo-se cortes coronais de 30 µm. Essas secções foram distribuidas sequencialmente em 6 compartimentos, em uma solução anti-congelante (PBS 0,05 M, pH 7,4, Etileno glicol e sacarose). Cada um desses compartimentos apresentava 1 de 6 secções, de modo que a distância entre uma secção e a seguinte seja de aproximadamente 180 µm.
De cada sujeito experimental, as secções contidas em um dos compartimentos foram submetidas à coloração citoarquitetônica pelo método de Nissl, utilizando o corante tionina. Através dessa técnica todas as células são marcadas, proporcionando a possibilidade de identificá-las através de seus tamanhos, formas e localizações. Esse procedimento é feito com cada um dos animais utilizados, uma vez, que podem ocorrer diferenças individuais nas estruturas encefálicas.
Os cortes dos demais compartimentos foram armazenados em solução anti-congelante e conservados a -20 ºC para posterior utilização em procedimentos imuno-histoquímicos.
4.2.6 Imuno-histoquímica
de CTb, com a finalidade de detectar-se os alvos das projeções retinianas e os compartimentos restantes foram expostos ao mesmo procedimento, para identificar a expressão de substâncias neuroativas, como VP, VIP, NPY, 5-HT, além de GFAP e das PLCa, CB, CR, e PV. A concentração dos anticorpos utilizados seguiu as especificações técnicas dos fabricantes.
Precedendo a técnica de imuno-histoquímica, foi necessário realizar um pré-tratamento dos cortes, na perspectiva de atenuar ou abolir a presença de artefatos As secções de um compartimento por vez foram submetidas a 5 lavagens, com duração de 5 minutos cada, em PBS 0,1M, pH 7,4. Posteriormente, os cortes foram submetidos à pré-tratamento, para inativação da peroxidade endógena do tecido, sendo colocados em contato com o peróxido de hidrogênio (H2O2) a 0,3% diluído em PBS 0,1M, pH 7,4 por 20 minutos. Em seguida, as secções foram lavadas novamente (5 vezes de 5 minutos), em PBS 0,1M, pH 7,4. Todos os procedimentos supracitados foram realizados em agitador orbital.
Após esse procedimento, os cortes foram incubados em uma solução de bloqueio, contendo albumina de soro bovino (BSA) (Ebram, Belezinho, SP) a 22% diluído em Triton X-100 a 0,4% (ICN Biomedical, Irvine, CA) durante 60 minutos, com o propósito de bloquear sítios inespecíficos ao anticorpo primário. Em seguida, as secções foram colocadas em contato com uma solução contendo o anticorpo primário específico (Tabela1), Triton X-100 a 0,4%, BSA a 2% por 16 horas em rotor com baixa velocidade (60 a 80rpm) a 24 °C. Finalizado esse processo, os cortes foram lavados (5 vezes de 5 minutos) em PBS 0,1M, pH 7,4.
Ao final dessa etapa, as secções foram colocadas em contato com o anticorpo secundário biotinilado (Quadro 1) em Triton X-100 a 0,4%, durante 90 minutos à 24 °C, sob agitação lenta (60 a 80 rpm), em rotor. Em seguida, os cortes passaram por uma sessão de lavagens novamente em PBS 0,1M, pH 7,4 e foram colocados na solução do complexo avidina-biotina-HRP (Protocolo ABC, Kit elite - Vector) em Triton X-100 a 0,4%, contendo NaCl por 90 minutos. Essa solução foi preparada anteriormente (30 minutos antes do procedimento com o anticorpo secundário), para que ocorresse a formação de complexos avidina-biotina-peroxidase. Ao fim da incubação nesse complexo, as secções foram lavadas novamente (5 vezes de 5 minutos) em PBS 0,1M, pH 7,4.
o cromógeno começa a ser utilizado, deixando reagir até que fique com coloração marrom. Por fim, os cortes foram submetidos uma série de lavagens com PBS 0,1M, pH 7,4 em agitador orbital.
4.2.7 Montagem de lâminas e intensificação com Tetróxido de Ósmio
Após o procedimento imuno-histoquímico, os cortes foram montados sequencialmente em lâminas gelatinizadas com gelatina-alúmen-cromo (VETEC Química Fina, Duque de Caxias, RJ), que após secarem a temperatura ambiente, foram imersas em solução de tetróxido de ósmio a 0,05% por 30 segundos, com o intuito de intensificar a reação. Após as etapas de desidratação, em baterias de álcool de graduação crescente até o álcool absoluto (70, 95 e 100%) (Cromato produtos químicos, Diadema, SP) e diafanização em xilol (Cromato produtos químicos, Diadema, SP), as secções foram cobertas com lamínulas usando-se DPX (Aldrich, Milwauke, WI).
4.3 Análise das lâminas
Quadro 1: Especificações de anticorpos primários e anticorpos secundários utilizados no procedimento imuno-histoquímico com as suas referidas diluições e fabricantes.
ANTÍGENO ANTICORPO
PRIMÁRIO
ANTICORPO SECUNDÁRIO
5-HT
α-5-HT obtido em coelho [1:5000]
Sigma-Aldrich
α-coelho obtido em cabra [1:1000]
Jackson Laboratories
CB
α-CB obtido em camundongo
[1:1000] Sigma-Aldrich
α-camundongo obtido em cabra
[1:1000]
Jackson Laboratories
CR
α-CR obtido em coelho [1:1000]
Sigma-Aldrich
α-coelho obtido em asno [1:1000]
Jackson Laboratories
CTb
α-CTb obtido em cabra [1:1000]
List Biological Laboratories
α-cabra obtido em asno [1:1000]
Jackson Laboratories
GFAP
α-GFAP obtido em camundongo
[1:1000] Sigma-Aldrich
α-camundongo obtido em cabra
[1:1000]
Jackson Laboratories
NPY
α-NPY obtido em coelho [1:8000]
Sigma-Aldrich
α-coelho obtido em cabra [1:1000]
Jackson Laboratories
PV
α-PV obtido em camundongo
[1:1000] Sigma-Aldrich
α-camundongo obtido em cabra
[1:1000]
Jackson Laboratories
VIP
α-VIP obtido em coelho [1:5000]
Península Laboratories
α-coelho obtido em cabra [1:1000]
Jackson Laboratories
VP
α-VP obtido em cobaia [1:1000]
Península Laboratories
α-cobaia obtido em cabra [1:1000]
5. RESULTADOS
5.1 Núcleo supraquiasmático
5.1.1 Citoarquitertura
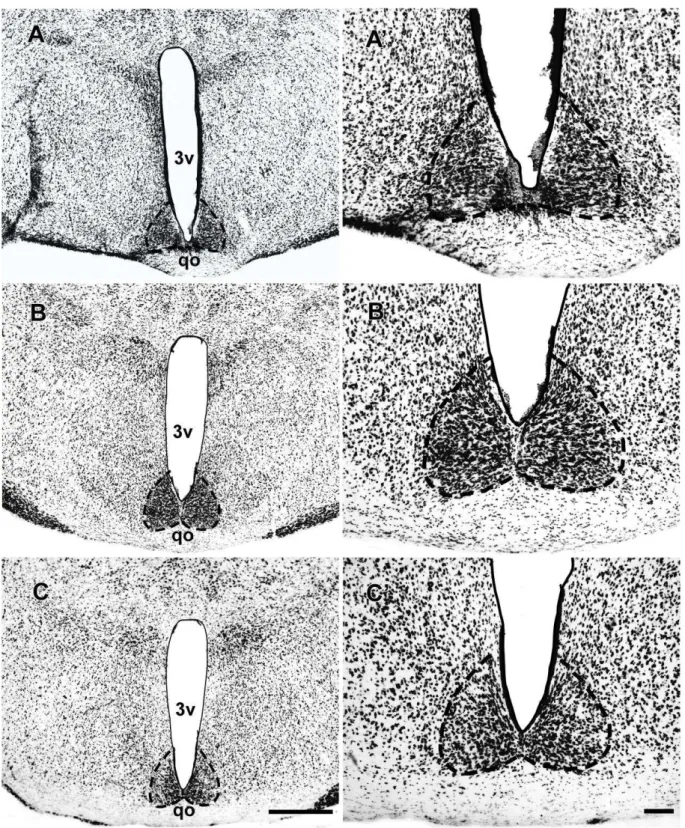
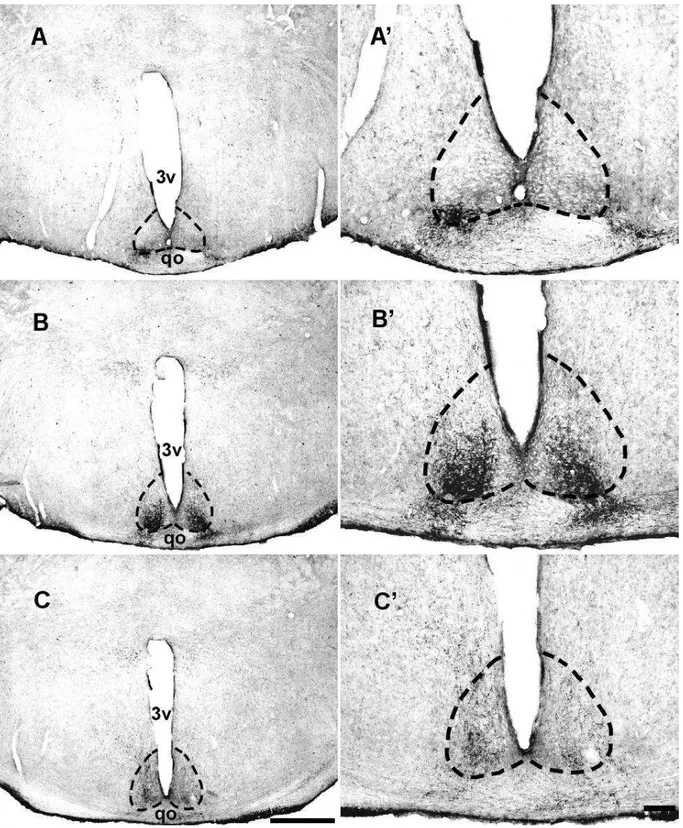
O método de Nissl, que utiliza o corante Thionina, mostrou-se eficiente para a marcação celular e delimitação do NSQ do Artibeus planirostris. Nas secções coronais coradas por esse método, o NSQ foi visualizado como uma estrutura distinta no hipotálamo anterior, sendo caracterizado pela forte afinidade tintorial das suas células, quando comparado aos grupos celulares adjacentes no hipotálamo. No nível rostral, o NSQ exibe um formato aproximadamente triangular e no nível médio e caudal, assume um contorno arredondado, com o seu maior eixo direcionado para o sentido dorsal (Fig.9 e 13).
5.1.2 Projeção retiniana
5.1.3 Neuroquímica
Vasopressina – VP
Foram visualizados neurônios parvocelulares imunorreativos a VP (VP-IR), imersos em uma moderada neurópila na porção dorsomedial do NSQ, nos seus níveis médio e caudal (Fig.11 e 13). A imunorreatividade a VP também foi evidenciada em outras regiões do hipotálamo anterior, como PVN e núcleo supra-óptico, apresentando pericários magnocelulares e um denso plexo de fibras/terminais.
Polipeptídeo Intestinal Vasoativo – VIP
Pericários VIP-IR foram identificados no NSQ do Artibeus planirostris, ao longo de toda a sua extensão rostrocaudal. Esses neurônios eram esparsos e estavam imersos em uma densa neurópila, sobretudo na porção ventrolateral desse núcleo (Fig.11 e 13).
Neuropeptídeo Y- NPY
Um denso plexo de fibras/terminais NPY-IR foi encontrado no NSQ nos níveis médio e caudal, com maior concentração na porção ventrolateral dessa estrutura (Fig.11 e 14).
Serotonina – 5HT
Figura 11: Fotomicrografias em campo claro de secções coronais do NSQ do A. planirostris, mostrando o padrão de imunorreatividade a VP (A) e VIP (B) no nível caudal; a NPY (C) no nível médio e 5-HT (D) no nível rostral. Abreviações: 3V,
Proteínas ligantes de cálcio - PLCa
No NSQ do Artibeus planirostris foi detectada a presença neurônios
imunorreativos a CB (CB-IR) apenas no seu nível caudal (Fig.12 e 14). Essas céluas foram mais abundantes na porção dorsal desse núcleo. A imunorreatividade a CR também foi visualizada no NSQ, com pericários predominantemente localizados na sua porção ventrolateral (Fig.12 e 14). Não foi observada imunorreatividade a PV na referida estrutura (Fig.12 e 15).
Proteína acídica fibrilar glial – GFAP
Foi observada a imunorreatividade a GFAP (GFAP-IR) nos processos, assim como, no corpo celular de astrócitos presentes no NSQ do Artibeus planirostris. Essa marcação foi evidente ao longo de toda a extensão rostrocaudal desse núcleo. A GFAP-IR é mais densa dentro do NSQ do que nas áreas hipotalâmicas adjascentes (Fig. 12 e 15).
Tabela 1: Conteúdo neuropeptidérgico e de PLCa no NSQ do Artibeus planirostris
Neuropeptídeo/PLCa Células Fibras/terminais
VP + +
VIP + +
NPY - +
5-HT - +
CB + +
CR + +
PV - -
GFAP + -
5.2 Folheto intergenicualdo
5.2.1 Citoarquitertura
Nos cortes frontais do tálamo dorsal, corados pelo método de Nissl, com o corante thionina, o complexo geniculado lateral apresenta o GLV e GLD. Entre essas estruturas, foi identificada uma região com menor densidade celular, com o formato de um fino folheto, a qual pela sua topografia foi identificada como FIG (Fig. 16 e 20).
5.2.2 Projeção retiniana
Figura 17: Fotomicrografias em campo claro de secções coronais do encéfalo do A. planirostris, no nível rostral (A), médio (B) e caudal (C), evidenciado a distribuição de terminais retinianos imunorreativos a Ctb no complexo geniculado lateral. Painel da esquerda mostra as projeções retinianas do lado ipsilateral em maior aumento; painel da direita mostra as projeções retinianas do lado contralateral em maior aumento. Abreviações: FIG, folheto intergeniculado; GLD, núcleo geniculado lateral dorsal; GLV, núcleo geniculado lateral ventral. Barra:
5.2.3 Neuroquímica
Vasopressina – VP
No FIG do Artibeus planirostris não foi observado elementos imunorreativos a VP. Esse mesmo padrão também foi visto no GLD e GLV.
Polipeptídeo Intestinal Vasoativo – VIP
Não foi visualizada imunorreatividade a VIP no FIG, assim como, no GLD e GLV do Artibeus planirostris.
Neuropeptídeo Y- NPY
Foram encontradas no FIG do Artibeus planirostris raras células imunorreativas a NPY (NPY-IR) ao longo de toda a sua extensão rostrocaudal. Esses neurônios estavam imersos em um esparso plexo de fibras/terminais. Esse padrão de distribuição de elementos NPY-érgicos não foi observado no GLD e GLV do referido sujeito experimental (Fig.18 e 20).
Serotonina – 5HT
Proteínas ligantes de cálcio - PLCa
Foram visualizados pericários e fibras/terminais CB-IR (Fig.16 e 18) e CR-IR (Fig.19 e 21) no FIG e no GLD do Artibeus planirostris, ao longo de toda a extensão rostrocaudal dessas estruturas. No GLV foi identificada esparsas células e fibras/terminais que expressam CR. A imunorreatividade a PV não foi observada no FIG, embora células marcadas para essa proteína foram vistas no GLD e GLV (Fig.19 e 21).
Proteína acídica fibrilar glial - GFAP
No FIG do Artibeus planirostris foi visualizada GFAP-IR ao longo de toda a sua extensão rostrocaudal. Essa marcação foi observada nos processos e no corpo celular de astrócitos presentes nessa estrutura. GFAP-IR também foi identificada no GLD e GLV. Essa marcação evidencia a atividade astrocitária nesses três núcleos (Fig.18 e 21).
Tabela 2: Conteúdo neuropeptidérgico e das PLCa no FIG do Artibeus planirostris.
Neuropeptídeo/PLCa Células Fibras/terminais
VP - -
VIP - -
NPY + +
5-HT - +
CB + +
CR + +
PV - -
GFAP + -
6. DISCUSSÃO
6.1 Núcleo supraquiasmático
6.1.1 Citoarquitetura
De acordo com os nossos resultados, o NSQ do morcego Artibeus
planirostris, assim como em outros mamíferos, é um par de núcleos celulares presente no hipotálamo anterior, localizado dorsalmente ao quiasma óptico e de cada lado do terceiro ventrículo. Quanto ao seu aspecto morfológico, essa estrutura apresenta forma semelhante a que é descrita no mocó (Nascimento Jr et al., 2010), considerando que esse núcleo em ambos os animais apresenta forma seccional triangular no nível rostral e um contorno arredondado no nível médio e caudal. A localização do NSQ no Artibeus planirostris está em conformidade com o padrão observado para todos os mamíferos estudados, como Rattus novergicus, hamster (Mesocricetus auratus), gato (Felix domesticus), Macaca mulatta e macaco de cheiro (Saimiri sciureus) (Lydic et al., 1982), cobaia (Cavia porcellus), gambá-da-Virgínia, Monodelphis domestica, (Cassone et al., 1988), sagui (Costa et al., 1998), rato espinhoso do Cairo (Acomys cahirinus), rato espinhoso dourado (Acomys russatus) (Cohen et al., 2010) e mocó (Nascimento Jr et al., 2010), o que corrobora a ideia de que o NSQ é um aparato neural filogeneticamente estável.
6.1.2 Projeção retiniana
(Ellobius lutescens, Ellobius talpinus) (Herbin et al.,1994), rato-toupeira da Palestina (Negroni et al., 1997),Tupaia glis (Moore, 1973; Magnin et al., 1989), furão (Mustela pustorius) (Magnin et al., 1989), gato (Murakami et al., 1989; Matteau, 2003), mocó (Nascimento Jr et al., 2010), Microtus montebelli (Uchiumi et al., 1995), coelho (Juárez et al., 2013), cobaia (Cassone et al., 1988), Spermophilus beecheyi (Major et al., 2003), hirace (Dendrohyrax dorsalis) (Magnin et al., 1989), gambá (Caluromys philander) e ouriço (Hemiechinus auritus) (Moore, 1973).Uma distribuição bilateral e quase simétrica das aferências retinianas sobre o NSQ foi descrita na preguiça (Bradypus pilosa) (Magnin et al., 1989), marmota (Mustela vison) (Martinet et al., 1992) e degus (Goel et al., 1999). Em mussaranho (Suncus murinus) (Tokunaga et al., 1992), mussaranho das árvores (Tupaia belangeri) (Reuss e Fuchs, 2000), Cryptomys anselli (Nemec et al., 2004), rato-toupeira da África do Sul (Negroni et al., 2003) e na toupeira japonesa (Mogera kobeae) (Kudo et al., 1991) foi observado uma predominância ipsilateral. Uma inervação bilateral e completamente simétrica ou predominantemente ipsilateral foi vista em ovelhas (Tenosseaud et al., 1994)
Em quirópteros, estudos autoradiográficos detectaram projeções retinianas bilaterais no NSQ do Pteropus giganteus, Myotis lucifugus (Cotter e Pentney, 1979), Eptesicus fuscus e Artibeus jamaicenses (Cotter, 1985). Nesses dois últimos morcegos, a maior concentração de aferências foi observada no lado contralateral. No E.fuscus, fibras foram visualizadas na porção ventral e no A. jamaicenses, foram encontradas na porção ventrolateral do lado contralateral e na porção ventromedial do lado ipsilateral do NSQ (Cotter, 1985). Em Rhinolophus rouxi, com o uso do traçador retrógrado peroxidade da raiz forte (HRP, do inglês, horseradish peroxidade), projeções retinianas foram descritas como esparsas e a citoarquitetura do NSQ não foi bem delimitada (Reimer, 1989). No Rousettus aegyptiacus e Carollia perspicillata, essas fibras inervam bilateralmente e simetricamente o NSQ (Magnin et al., 1989; Scalia et al., 2014).
Em hamters, camundongo e no Arvicantis niloticus existem registros divergentes quanto ao padrão de distribuição retiniana para o NSQ. No Arvicantis
niloticus foi relatado que as aferências retinianas são predominantemente
hamster (Mesocricetus auratus) foi observado uma tendência ipsilateral no nível rostral e quase simétrica no nível caudal (Pickard e Silverman, 1981; Youngstron e Nunez, 1986) ou aproximadamente simétrica em todos os níveis (Youngstron et al., 1991; Ling et al., 1998). Em camundongos foi vista uma distribuição bilateral, sendo quase simétrica no Mus musculus (Abrahamsom e Moore, 2001; Hattar et al., 2006) e com predominância contralateral no Peromyscus maniculatus bairdi e Peromyscus leucopus (Youngstron e Nunez, 1986).
Em primatas, o mesmo padrão de dominância contralateral observado no Artibeus planirostris foi encontrada em sagui (Costa et al., 1999), macaco-prego (Cebus apella) (Pinato et al., 2009) e Saguinus oedipus (Moore, 1973). Uma distribuição assimétrica ipsilateral foi visualizada em chimpanzé (Pan troglodytes) (Tigges et al., 1977), gibão (Hylobates concolor), potto (Peridictus potto), bush baby (Galago alleni, Galago demidovii) e Macaca fascicularis (Magnin et al., 1989; Hannibal et al., 2014). No lêmure Microcebus murinus (Magnin et al., 1989) e no macaco de cheiro (Tigges e O’Steen, 1974) foi descrita uma tendência bilateral e simétrica das fibras retinianas. Na Macaca mulatta, a inervação retiniana sobre o NSQ apresenta relatos contraditórios, sendo descrita como contralateral (Hendrikson et al., 1972; Moore, 1973) ou ipsilateral (Hannibal et al., 2014).
A relevância funcional da variabilidade na distribuição do TRH sobre o NSQ ainda não é completamente compreendida. Postula-se que essas divergências reflitam apenas variações individuais ou diferentes abordagens metodológicas (Major et al., 2003), como por exemplo, uma alta sensibilidade ao traçador por parte de determinados grupos de ipGRC nas diferentes espécies estudadas (Costa et al., 1999).
6.1.3 Neuroquímica