Estudo da participação das Espécies Fortemente Oxidantes produzidas durante a
oxidação eletroquímica de corantes usando eletrodo de diamante dopado com boro:
Função das propriedades eletroquímicas do eletrodo e condições experimentais
Danyelle Medeiros de Araújo
______________________________________________________
Tese de Doutorado
Natal/RN, agosto de 2014
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
1
DANYELLE MEDEIROS DE ARAÚJO
Estudo da participação das Espécies Fortemente Oxidantes produzidas durante a oxidação eletroquímica de corantes usando eletrodo de diamante dopado com boro:
Função das propriedades eletroquímicas do eletrodo e condições experimentais
Tese submetida ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, em cumprimento às exigências para obtenção do título de Doutor em Química.
Catalogação da Publicação na Fonte. UFRN / SISBI / Biblioteca Setorial Centro de Ciências Exatas e da Terra – CCET.
Araújo, Danyelle Medeiros de.
Estudo da participação das espécies fortemente oxidantes produzidas durante a oxidação eletroquímica de corantes usando eletrodo de diamante dopado com boro: função das propriedades eletroquímicas do eletrodo e condições experimentais / Danyelle Medeiros de Araújo. - Natal, 2014.
124 f. il.:
Orientador: Prof. Dr. Carlos Alberto Martinez-Huitle. Coorientador: Prof. Dr. Djalma Ribeiro da Silva.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Eletroquímica – Tese. 2. Oxidação – Tese. 3. Radicais hidroxilas – Tese. 4. Ativação por luz – Tese. 5. Efluentes reais e sintéticos – Tese. I. Martinez-Huitle, Carlos Alberto. II. Silva, Djalma Ribeiro da. III. Título.
3 Esta tese é dedicada a
Ailton e Zefinha, meus pais,
por preencherem minha vida
com muito amor e constante inspiração;
e a Gabriel, meu adorável filho,
4
AGRADECIMENTOS
Minha eterna gratidão!
A Deus, que através da sua presença me abençoa e capacita em tudo que me destina.
A meu filho, Gabriel, que nunca me questionou o porquê de tanto tempo na
universidade e pela força que sempre me tem dado para seguir em frente.
À minha mãe, Zefinha, pelas orações, pelo zelo; pelo amor; pelos cuidados, bem
como, pela atenção que ela e seu esposo deram ao meu rapaz, no período em que me ausentei
para Europa em função do Doutorado.
A meu pai, Ailton, do qual herdei o gosto pela honestidade, dignidade e justiça. É
minha referência de vida, ensina-me a não esperar a oportunidade para vencer, mas a vencer a
mim mesma para concretizar os meus sonhos. Nessa caminhada, sempre falava o quão
importante é a carreira de doutor. À sua esposa, Vera, que exige que eu escreva cada vez
melhor, ajudando-me a trocar as reticências por pontos finais, além de todo o seu carinho.
Ao meu irmão, Tanny, a sua esposa e ao meu sobrinho pelo apoio e carinho.
A meu namorado, Kleber, pela paciência, força e carinho durante essa caminhada.
Ao Professor Dr. Carlos Alberto Martinez, por ter me aceito como sua orientanda
nessa tese, pela dedicação incansável, estimulando-me a evidenciar um profundo senso de
propósito, inspirando-me a buscar o meu desenvolvimento e capacidade profissional.
Ao Professor Dr. Manuel Andrés Rodrigo, por ter me aceitado no período do
doutorado sanduíche na Espanha, por sua disponibilidade e por todas as oportunidades que me
foram proporcionadas.
Ao professor Dr. Djalma Ribeiro da Silva, que, desde o início da minha graduação me
incentivou a seguir a carreira acadêmica e oportunizou-me desenvolver essa tese.
À professora Dra. Nedja Suely Fernandes, pelos ensinamentos, por saber que podia
contar com ela quando necessitasse.
A todo o grupo do LEAA da UFRN, em especial às minhas amigas: Aline, Elisama,
Eliane e Carol, pela aprendizagem, amizade e carinho.
Ao grupo do laboratório de Castilla de La Mancha, em especial a: Salva, Conchi,
Sondos, Sara, Maria José, pelos ensinamentos.
Aos amigos que conquistei na Espanha e que fizeram os meus dias mais felizes, Diana,
5
6
RESUMO
ARAÚJO, D. M. Estudo da participação das Espécies Fortemente Oxidantes produzidas
durante a oxidação eletroquímica de corantes usando eletrodo de diamante dopado com boro: Função das propriedades eletroquímicas do eletrodo e condições experimentais.
2014, setembro. Tese de Doutorado – Universidade Federal do Rio Grande do Norte.
A indústria têxtil é uma das que mais polui no mundo (AHMEDCHEKKAT et al. 2011),
gerando efluentes com altos índices de carga orgânica. Entre os poluentes presentes nesses
efluentes encontram-se os corantes, substâncias muitas vezes com estruturas complexas, de
características tóxicas e carcinogênicas, além de possuir uma forte coloração. O descarte
incorreto dessas substâncias ao meio ambiente, sem realizar um pré-tratamento pode
ocasionar grandes impactos ambientais. Esta tese tem como objetivos utilizar uma técnica de
oxidação eletroquímica com ânodo de diamante dopado com boro, BDD (sigla em inglês),
para o tratamento de um corante sintético e de um efluente têxtil real. Além de estudar o
comportamento de diferentes eletrólitos (HClO4, H3PO4, NaCl e Na2SO4) e densidades de
correntes (15; 60; 90 e 120 mA.cm-2), com a Rodamina B (RhB) e comparar os métodos de
fotólise, eletrólise e fotoeletrólise utilizando o H3PO4 e o Na2SO4. Estudos de oxidação
eletroquímica foram efetuados em diferentes relações de BDD sp3/sp2 com solução de RhB.
Para alcançar esses objetivos, análises de pH, condutividade, UV-visível, COT, HPLC e
CG-MS foram desenvolvidas. Através dos resultados com a Rodamina B, observou-se que em
todos os casos ocorreu a sua mineralização, independente do eletrólito e da densidade de
corrente, porém esses parâmetros afetam na velocidade e a eficiência de mineralização. A
radiação com luz foi favorável durante a eletrólise da RhB com fosfato e sulfato. Em relação à
oxidação em ânodo de BDD com diferentes configurações sp3/sp2 (165, 176, 206, 220, 262 e
329), o com menor teor de carbono-sp3 teve um maior tempo favorecendo a conversão
eletroquímica da RhB, ao invés da combustão. O com maior teor de carbono sobre os anodos
de BDD levou o maior favorecimento da oxidação eletroquímica direta.
Palavras chave: eletroquímica, oxidação, radicais hidroxilas, ativação por luz, efluentes reais
7
ABSTRACT
ARAÚJO, D. M. Study of the involvement of strong oxidizing species produced during
the electrochemical oxidation of dye using boron-doped diamond electrode: Role of the electrochemical properties of the electrode and experimental conditions. 2014,
september. PhD thesis - Universidade Federal do Rio Grande do Norte.
The textile industry is one of the most polluting in the world (AHMEDCHEKKAT et al.
2011), generating wastewater with high organic loading. Among the pollutants present in
these effluents are dyes, substances with complex structures, toxic and carcinogenic
characteristics, besides having a strong staining. Improper disposal of these substances to the
environment, without performing a pre-treatment can cause major environmental impacts.
The objective this thesis to use a technique of electrochemical oxidation of boron doped
diamond anode, BDD, for the treatment of a synthetic dye and a textile real effluent. In
addition to studying the behavior of different electrolytes (HClO4, H3PO4, NaCl and Na2SO4)
and current densities (15, 60, 90 and 120 mA.cm-2), and compare the methods with
Rhodamine B (RhB) photolysis, electrolysis and photoelectrocatalytic using H3PO4 and
Na2SO4. Electrochemical oxidation studies were performed in different ratio sp3/sp2 of BDD
with solution of RhB. To achieve these objectives, analysis of pH, conductivity, UV-visible,
TOC, HPLC and GC-MS were developed. Based on the results with the Rhodamine B, it was
observed that in all cases occurred at mineralization, independent of electrolyte and current
density, but these parameters affect the speed and efficiency of mineralization. The radiation
of light was favorable during the electrolysis of RhB with phosphate and sulfate. Regarding
the oxidation in BDD anode with different ratio sp3/sp2 (165, 176, 206, 220, 262 e 329), with
lower carbon-sp3 had a longer favoring the electrochemical conversion of RhB, instead of
combustion. The greater the carbon content on the anodes BDD took the biggest favor of
direct electrochemical oxidation.
Keywords: electrochemical, oxidation, hydroxyl radicals, activation by light, real and
8
LISTA DE FIGURAS
CAPÍTULO 3
Figura 1 Cadeia têxtil simplificada... 26 Figura 2 Rio Jianhe em 2011, Luoyang/China... 27 Figura 3 Estrutura molecular da Rodamina B... 29 Figura 4 Degradação fotocatalítica por micro-ondas da RhB com TiO2 suportado em
carvão ativado... 30
Figura 5 Esquema de oxidação eletroquímica de compostos orgânicos em ânodos
ativos e não-ativos... 39
CAPÍTULO 4
Figure 1 BDD anode (left) and stainless steel cathode (right)………. 53
Figure 2 Mineralization of Rhodamine B, as a function of Q, during electrolysis in
different supporting electrolytes at two current densities (a) 60 mA cm-2 and (b) 120
mA cm-2: ▲ Na2SO4; HClO4; H3PO4; NaCl... 54
Figure 3 Changes in the COD, as a function of Q, during electrolysis of Rhodamine
solutions containing different supporting electrolytes at two current densities (a) 60
mA cm-2 and (b) 120 mA cm-2: ▲ Na2SO4; HClO4; H3PO4; NaCl... 55
Figure 4 Influence of the current density on the first order kinetic constants for the
CDEO of Rhodamine B: ▲ Na2SO4; HClO4; H3PO4; NaCl... 56
Figure 5 Instantanteous current efficiency constants for the electrolysis of Rhodamine
B solutions in different supporting electrolyte media: ▲ Na2SO4; HClO4; H3PO4;
NaCl……….. 57
Figure 6 Main intermediates detected, as a function of time, during the electrolysis of
Rhodamine B solutions containing different supporting electrolytes ((a) HClO4, (b)
NaCl, (c) H3PO4 and (d) Na2SO4 at 60 mA cm-2: phthalic acid (▲);
2,5-hydroxybenzoic acid (●); benzoic acid (); 3-dinitrobenzoic acid (♦); α- hidroxyglutaric acid (); intermediate 6 (○) and intermediate 7 (□)……… 58
9 intermediates detected during the electrolysis of Rhodamine B solutions containing
different supporting electrolytes, (a) HClO4, (b) NaCl, (c) H3PO4 and (d) Na2SO4:
phthalic acid (▲); 2,5-hydroxybenzoic acid (●); benzoic acid (■); 3-dinitrobenzoic
acid (♦); α- hidroxyglutaric acid (); intermediate 6 (○) and intermediate 7 (□)………. 60
Figure 8 Electrochemical pathways degradation for RhB as a function of supporting
electrolyte: blue pathway is according to the intermediates produced when HClO4,
H3PO4 and Na2SO4 were used while red pathway is followed when NaCl was used.
Intermediates detected: phthalic acid (I1); benzoic acid (I2); 3-dinitrobenzoic acid (I3);
2.5-hydroxybenzoic acid (I4); α- hidroxyglutaric acid (I5); oxalic acid (I6), intermediate
7 (I7) and chloroform (I8)……… 61
CAPÍTULO 5
Figure 1 Removal of color during the photolysis, electrolysis and photoelectrolysis of
solutions containing Rhodamine b in a) Na2SO4: 0 mA cm-2 no UV irradiation UV
irradiation; 15 mA cm-2 no UV irradiation UV irradiation; 90 mA cm-2 no UV
irradiation UV irradiation b) H3PO4:0 mA cm-2 no UV irradiation UV
irradiation; 15 mA cm-2 no UV irradiation UV irradiation; 90 mA cm-2 no UV
irradiation UV irradiation……… 75
Figure 2 Oxidation and mineralization during the electrolysis and photoelectrolysis of
solutions containing Rhodamine b in Na2SO4: 15 mA cm-2 no UV irradiation UV
irradiation; 90 mA cm-2 no UV irradiation UV irradiation……… 76
Figure 3 Oxidation and mineralization during the electrolysis and photoelectrolysis of
solutions containing Rhodamine b in H3PO4: 15 mA cm-2 no UV irradiation UV
irradiation; 90 mA cm-2 no UV irradiation UV irradiation………... 76
Figure 4 Production of oxidants by electrolyses with conductive-diamond of solutions
containing Na2SO4▲ no UV irradiation UV irradiation; H3PO4 no UV irradiation
UV irradiation……… 78
Figure 5 Oxidant consumed (initial – final) in chemical oxidation tests of Rhodamine with the oxidant produced electrolytically from Na2SO4▲ no UV irradiation UV
irradiation; H3PO4 no UV irradiation UV Irradiation………. 80
10 solutions with the oxidant solution produced by the electrolyses of Na2SO4▲ no UV
irradiation UV irradiation; H3PO4 no UV irradiation UV Irradiation………. 81
Figure 7 Mechanisms of the main processes occurring during photo-electrolysis of
Rhodamine B……… 83
CAPÍTULO 6
Figure 1 Effect of the sp3/sp2 ratio of the BDD anodes on the absorbance (a), TOC (b) and COD (c) removal, as a function of Q, during electrolysis of RhB solutions……… 98
Figure 2 Chromatographic areas of aromatic intermediates produced, as a function of
time, during RhB electro-oxidation using BDD6 (a) and BDD1 (b). I1, no identified
intermediate……… 99
Figure 3 Influence of sp3/sp2 ratio on the production of aliphatic acids, as a function of chromatographic areas and time, during RhB electro-oxidation using BDD6 (a) and
BDD1 (b). I1 and I2, no identified intermediates……… 100
CAPÍTULO 7
Figure 1 Electrochemical decolourisation process of a real textile effluent (effluent as
obtained), as a function of time, by applying different current densities (20, 40 and 60
mA cm-2) at 25° C and flow rate of 250 dm3 h-1. Inset: Decrease of HU, as a function
of time, at different applied current densities. Dashed line indicates the Brazilian limit
regulation in HU to discharge the effluent………. 111
Figure 2 Influence of applied current on the evolution of COD and TCE (inset), as a
function of time, during electrochemical treatment of actual textile effluent (as
discharged) on BDD anode at different current densities. Conditions: T = 25 °C and
flow rate of 250 dm3 h-1………. 112
Figure 3 Colour removal of a real effluent, as a function of time, applying different
current densities using BDD anode. Experimental conditions: T = 25° C, 5 g dm-3 of
Na2SO4 and flow rate = 250 dm3 h-1……… 113
Figure 4 Influence of applied current on the evolution of COD and TCE (inset), as a
11 Experimental conditions: T = 25°C, 5 g dm-3 of Na2SO4 and flow rate = 250 dm3 h-1…. 114
Figure 5 Influence of Na2SO4 concentration on the evolution of COD and %TCE
(inset), as a function of time, during electrochemical treatment of actual textile effluent
on BDD anode by applying 20 mA cm−2 of applied current density. Conditions: T = 25
°C, flow rate = 250 dm3 h-1……… 115
Figure 6 Comparison of the influence of temperature on the evolution of COD, as a
function of time and %TCE (inset) during oxidation of actual textile effluent on BDD
anode. Conditions: 40 mA cm-2 of current density; 5 g of Na2SO4 and flow rate = 250
dm3 h-1……… 116
Figure 7 Influence of flow rate on the evolution of COD, as a function of time and
%TCE (inset) during oxidation of actual textile effluent on BDD anode. Conditions: 40
mA cm-2 of current density; 5 g of Na2SO4 and T = 25 °C………... 118
Figure 8 Energy consumption of the electrochemical process, as a function of COD
removal and effluent conditions, during oxidation of actual textile effluent on BDD
12
LISTA DE TABELAS
CAPÍTULO 3
Tabela 1 Classificação segundo as classes químicas e por substrato... 28
Tabela 2 Produtos da degradação fotocatalítica da RhB por CG-MS... 31
Tabela 3 Exemplos de processos oxidativos avançados e as reações envolvidas na
produção de radicais hidroxilas... 33
13
LISTA DE SIGLAS
ABIQUIM Associação brasileira da indústria química
BDD Boron doped diamond anode
COT Carbono orgânico total
CG-MS Cromatografia gasosa acoplada à espectroscopia de massa
CL-MS Cromatografia líquida acoplada à espectroscopia de massa
CONAMA Conselho nacional do meio ambiente
DQO Demanda química de oxigênio
PEOA Processo eletroquímico oxidativo avançado
ELISA Ensaio imunoabsorvente ligado à enzima
HPLC High-performance liquid chromatography
OEA Oxidação eletroquímica avançada
OEDC Oxidação eletroquímica diamante condutor
ONU Organização das nações unidas
POA Processo oxidativo avançado
RhB Rodamina B
SISNAMA Sistema nacional do meio ambiente
14
SUMÁRIO
CAPÍTULO 1
1.1INTRODUÇÃO... 19
CAPÍTULO 2 2.1 OBJETIVOS... 23
2.1.1 Objetivos Gerais... 23
2.1.1 Objetivos Específicos... 23
CAPÍTULO 3 3.1REVISÃO BIBLIOGRÁFICA... 25
3.1.1 A Água... 25
3.1.2 Indústria Têxtil... 25
3.1.3 Corantes... 27
3.1.3.1 Rodamina B e sua Degradação... 28
3.1.4 Resolução Ambiental... 31
3.1.5 Tratamentos Convencionais de Efluentes... 32
3.1.6 Processos Oxidativos Avançados... 33
3.1.6.1 Processo de Oxidação Eletroquímica Avançada... 34
3.1.6.1.1 Influência da produção de oxidantes por eletrólise na oxidação anódica mediada... 35
3.1.6.1.2 Produção de oxidantes por processos de oxidação direta... 36
3.1.7 Ativação de Oxidantes... 38
3.1.8 Influência do Material Anódico – Eletrodos Ativos e Não-ativos... 39
3.1.9 Eletrodo de Diamante Dopado com Boro ... 41
3.1.9.1 Configuração sp3/sp2... 42
15
CAPÍTULO 4
INFLUENCE OF MEDIATED PROCESSES ON THE REMOVAL OF
RHODAMINE WITH CONDUCTIVE-DIAMOND ELECTROCHEMICAL
OXIDATION……… 49
4.1 Abstract………... 49
4.2 Introduction………... 51
4.3 Materials and Methods………. 51
4.3.1 Chemicals………. 52
4.3.2 Analytical procedures……….. 52
4.3.3 Electrochemical cells……… 52
4.3.4 Experimental procedures……….. 53
4.4 Results and Discussion………... 53
4.5 Conclusions………..…... 62
4.6 Acknowledgements……….... 62
4.7 References…………..……….... 62
CAPÍTULO 5 PEROXO- AIDED PHOTO-ELECTROLYSIS OF RHODAMINE B………….. 69
5.1 Abstract……….. 69
5.2 Introduction………... 69
5.3 Materials and Methods………. 72
5.3.1 Chemicals……….. 72
5.3.2 Analytical procedures………... 72
5.3.3 Bulk electrolysis……… 72
5.3.4 Chemical oxidation tests ……….. 73
5.3.5 Light irradiation……… 73
5.4 Results and Discussion………... 73
5.5 Conclusions………. 83
5.6 Acknowledgements………..... 84
16
CAPÍTULO 6
ELECTROCHEMICAL CONVERSION/COMBUSTION OF A MODEL
ORGANIC POLLUTANT ON BDD ANODE: ROLE OF sp3/sp2
RATIO……….. 93
6.1 Abstract……….. 93
6.2 Introduction……… 93
6.3 Methodology………... 95
6.3.1 Chemicals………. 95
6.3.2 Analytical procedures………... 95
6.3.3 Electrochemical cell and bulk electrolysis………... 96
6.4 Results and Discussion………... 96
6.5 Conclusions………. 101
6.6 Acknowledgements……… 101
6.7 References……….. 101
CAPÍTULO 7 APPLICABILITY OF DIAMOND ELECTRODE/ANODE TO THE ELECTROCHEMICAL TREATMENT OF A REAL TEXTILE EFFLUENT….. 105 7.1 Abstract……….. 105
7.2 Introduction……… 105
7.3 Materials and Methods……….. 107
7.3.1 Textile dye effluent characteristics………... 107
7.3.2 Anodic oxidation experiments……….. 108
7.3.3 Depuration monitoring methods………... 108
7.4 Results and discussion……….……….. 110
7.4.1 Preliminary electrochemical experiments of a real textile effluent………….. 110
7.4.2 Electrochemical decolourisation of a real textile effluent adding Na2SO4….. 113
7.4.3 COD removal by electrochemical treatment………. 114
7.4.4 Effect of Na2SO4 dissolved in the effluent……… 115
17
7.4.6 Effect of the flow rate……….. 116
7.4.7 Energy consumption and cost estimation……….. 117
7.5 Concluding Remarks………. 117
7.6 References………... 118
18
CAPÍTULO 1
19 1.1 INTRODUÇÃO
Nas últimas décadas, o rápido crescimento da consciência pública sobre os problemas
ambientais tem obrigado a muitos governos introduzir legislações que prescreva e limita a
emissão de poluentes no meio ambiente.
Dentro deste contexto, a indústria têxtil é considerada a indústria que mais polui o
meio ambiente. Os corantes, por exemplo, são um dos contaminantes mais amplamente
encontrados em ambientes aquáticos, devido ao seu enorme volume de produção nas
indústrias, biodegradação lenta, descoloração e toxicidade. Cerca de 800.000 toneladas de
corantes são produzidas anualmente no mundo, e cerca de 10-15% dos corantes têxteis
sintéticos usados se perdem nos fluxos de resíduos durante as operações de fabricação ou
processamento (AHMEDCHEKKAT et al. 2011).
A Rodamina, corante sintético estudado nesta tese, é geralmente utilizada como um
modelo de substância para degradação por se tratar de um importante representante dos
corantes xanteno, também conhecido como violeta básica 10. É altamente solúvel em água,
não volátil e possui coloração violeta avermelhado.
O lançamento deste corante em ambientes naturais não é apenas perigoso para a vida
aquática, mas também para os seres humanos, por se tratar de uma substância mutagênica
(MISHRA e GOGATE, 2011; DUA et al. 2012).
A fim de reduzir o impacto ambiental destes poluentes, diversas tecnologias
convencionais e não convencionais têm sido utilizadas, porém, as convencionais não
conseguem degradar todas as substâncias orgânicas presentes nos efluentes têxteis,
necessitando de tratamentos complementares.
A oxidação eletroquímica avançada, OEA, tem sido utilizada como um tratamento
eletroquímico não convencional para a degradação de poluentes orgânicos. Ela é considerada
como uma alternativa eficiente devido à sua facilidade de operação, ampla gama de condições
de tratamento e respeito ao meio ambiente (DUA et al. 2012).
A presente tese está dividida em oito capítulos e será apresentada em forma de quatro
artigos. A nosso ver, essa modalidade é muito mais objetiva que o modelo de tese tradicional,
uma vez que propicia uma divulgação mais prática e rápida dos resultados obtidos. No
primeiro Capítulo será abordada toda a parte introdutória do trabalho, justificando a
20 presentes os objetivos gerais e específicos que foram cumpridos no decorrer da tese; O
terceiro Capítulo, a revisão bibliográfica onde foram abordados temas como: oxidação
eletroquímica, tipos de ânodos, corantes, entre outros, tomando como base em artigos
renomados publicados desde 1994 até os dias atuais. Nos Capítulos 4, 5, 6 e 7 estão presentes
os artigos publicados e que foram enviados para publicação, como detalhados a seguir:
O Capítulo 4 teve como objetivo estudar um corante sintético, denominado por
Rodamina B (RhB), em diferentes eletrólitos (NaCl, HClO4, H3PO4 e Na2SO4) e densidades
de corrente (15, 60, 90 e 120 mA cm-2), através da Oxidação Eletroquímica com Diamante
Condutor, a fim de compreender o processo mediado para a sua degradação. Para isso fez-se
necessário realizar análises de Demanda Química de Oxigênio, Cromatografia Gasosa
acoplada a Espectrometria de Massa e Cromatografia Líquida de Alta Eficiência durante todo
o processo de degradação da RhB, bem como, o estudo cinético para observar para melhor
visualização da influência dos eletrólitos e das densidades de correntes estudadas. Este
Capítulo gerou o terceiro artigo desta tese e foi aceito recentemente no jornal científico
Applied Catalysis B: Environmental.
No Capítulo 5 estudou-se a oxidação da RhB em dois meios: fosfato e sulfato, através
do efeito do grupo peróxido por ativação de luz utilizando ânodo de Diamante Dopado com
Boro, onde comparou-se o processo dessa degradação por eletrólise, fotólise e fotoeletrólise,
sendo este o objetivo do Capítulo. Este estudo se fez necessário após ter sido realizado o
trabalho presente no Capítulo 4, onde se pode observar além da influência das diferentes
densidades de corrente a influência da ativação de luz em dois meios anteriormente estudados.
Análises de UV-Visível, Demanda Química de Oxigênio, Carbono Orgânico Total,
Cromatografia Líquida de Alta Eficiência foram efetuadas no decorrer da degradação da RhB,
além das análises de pH e Condutividade. Os resultados deste Capítulo foram submetidos no
jornal científico Environmental Science & Technology.
Todos os experimentos desenvolvidos nesta tese foram realizados com o ânodo de
Diamante Dopado com Boro por apresentar inúmeras vantagens, tais como: superfície inerte,
baixas propriedades de adsorção, estabilidade à corrosão mesmo em meio bastante ácido e
elevado sobrepotencial de oxigênio (PANIZZA; CERISOLA, 2007). Com o intuito de realizar
uma maior quantidade de experimentos em um menor tempo, se realizou experimentos em
paralelo utilizando diferentes ânodos de BDD nas mesmas condições experimentas para
21 assim, se fez necessário realizar um estudo com diferentes ânodos de BDD a fim de
apresentar evidências críticas sobre a influência da configuração sp3/sp2 do ânodo de BDD
através da oxidação eletroquímica da Rodamina B, um poluente orgânico modelo. Através
deste trabalho, surgiu o Capítulo 6 desta tese. Esse Capítulo gerou um artigo no jornal
científico Electrochemistry Communications publicado recentemente.
A aplicação de um método eletroquímico para um efluente real da indústria têxtil local
foi estudado e teve por objetivo a avaliação da aplicabilidade do processo de oxidação
eletroquímica através dos parâmetros: densidade de corrente, temperatura, adição de sais e
condições de fluxo, usando BDD como uma alternativa para tratamento de efluentes reais.
Análises de DQO, UV- Visível e de Custo Energético foram realizadas. Este trabalho
representou o Capítulo 7 desta tese. Os resultados deste Capítulo foram publicados no Journal
of Electroanalytical Chemistry.
Por fim, o Capítulo 8 apresenta as conclusões e as considerações finais de forma
22
CAPÍTULO 2
23 2.1 OBJETIVOS
2.1.1 Objetivos Gerais
Avaliar a produção de espécies fortemente oxidantes e condições experimentais
durante a OE de um corante sintético e um efluente têxtil real com ânodo de diamante
dopado com boro;
Estudar a influência das propriedades do material de BDD (composição do eletrodo
(diamante (sp3)/(grafite (sp2)) durante a OE.
2.1.2 Objetivos Específicos
Avaliar o efeito das variáveis experimentais: densidade de corrente elétrica e eletrólito
usados para cada experimento;
Aplicar o processo de OE na eliminação da matéria orgânica em corantes sintéticos e
reais;
Monitorar e comparar a eliminação dos compostos estudados mediante o uso de
técnicas analíticas (DQO, COT, UV-Visível e HPLC);
Estudar o comportamento da ativação das espécies oxidantes com e sem ativação de
luz UV para a degradação da RhB;
Analisar, através da ativação química, o comportamento dos agentes oxidantes;
Estudar um eletrólito e uma densidade de corrente aplicada a diferentes ânodos de
BDD;
Identificar intermediários gerados durante a degradação da RhB, através das técnicas
de HPLC e CG-MS;
24
CAPÍTULO 3
25 3.1 REVISÃO BIBIOGRÁFICA
3.1.1 A Água
A água, em termos químicos, é uma substância que possui em sua estrutura dois
átomos de hidrogênio e um átomo de oxigênio, apresentando uma massa molar de 18 g mol-1.
É uma substância indispensável ao planeta, responsável pelo funcionamento e manutenção do
corpo humano, irrigação na agricultura, geração de energia nas usinas hidrelétricas, entre
outras.
Cerca de 70% da superfície terrestre é composta por água, porém apenas 2,5% são de
água doce, onde 99,7% desse volume estão presentes na forma de geleiras, cobertas por neve
e em águas subterrâneas. Ou seja, apenas 0,3% desse recurso estão próprios para o consumo e
disponíveis em rios e lagos. Mesmo em pequena porcentagem seria suficiente para abastecer a
vida na terra se não fosse à ação predatória do homem, segundo a Organização das Nações
Unidas (ONU).
Pesquisas publicadas pela ONU mostram que todos os dias 2 milhões de toneladas de
dejetos humanos são eliminados nos cursos de água em todo o mundo, e que mais de 80% das
águas residuais do planeta não são coletadas, nem tratadas, além da poluição existente em rios
e lagos proveniente das indústrias.
3.1.2 Indústria Têxtil
A indústria têxtil é responsável pela transformação de fibra em fios, de fios em tecidos e
de tecidos em roupas. Esse tipo de processo industrial inicia-se a partir da divisão das fibras, a
fiação, tecelagem e ou/ malharia, beneficiamento e enobrecimento dos fios e tecidos, até o
processo de confecções, como presentes de forma simplificada na Figura 1 (BASTIAN et al.
2009).
No processo de fiação ocorre a obtenção do fio a partir das fibras têxteis, que pode ser
enviado para o beneficiamento ou diretamente para tecelagens e malharias. No
beneficiamento é realizada a preparação dos fios para seu uso final ou não, envolvendo
tingimento, engomagem, retorção (linhas, fios especiais, etc.) e tratamento especiais. Na
26 retilínea, a partir dos fios têxteis. Na etapa de enobrecimento segue a preparação, o
tingimento, a estamparia e o acabamento de tecidos, malhas ou artigos confeccionados. E no
setor de confecções ocorre a aplicação diversificada de tecnologias para os produtos têxteis,
acrescida de acessórios incorporados nas peças (BASTIAN et al. 2009). Em ambas as etapas
de beneficiamento e enobrecimento ocorrem o processo de tingimento, ou seja, necessitam da
aplicação de corantes nas fibras/ou tecidos.
Figura 1 – Cadeia têxtil simplificada.
Fonte: BASTIAN et al. (2009).
Ultimamente, existe uma grande preocupação com o descarte de efluentes produzidos
durante qualquer processo industrial, devido à escassez de recursos híbridos e os impactos
ambientais gerados pelos mesmos (DEGAKI et al. 2014).
A indústria têxtil é um dos exemplos de indústria que mais polui entre todos os setores
industriais, tanto em termos de volume, quanto em relação à composição.
Segundo Asgheret et al. (2009), até 2009 mais de 10.000 diferentes corantes e
pigmentos foram usados em indústrias de tingimento e impressão de todo o mundo. A
produção total de corante mundial está estimada em 800.000 toneladas por ano e, vale
ressaltar que pelo menos entre 10-15% do corante usado por essas indústrias entra no
ambiente através dos efluentes.
Os corantes são os compostos mais problemáticos nos efluentes têxteis devido a sua
alta solubilidade em água, baixa biodegradabilidade, além de possuir estruturas complexas,
muito delas com cadeias aromáticas, apresentando comportamentos tóxicos, cancerígenos e
27 adequado, além de provocar poluição visual, Figura 2, alteram os ciclos biológicos, mesmo
em baixas concentrações, 1 mg. L-1, impedindo a passagem da radiação solar e, assim,
afetando os seres vivos que habitam nestes ecossistemas (MARTÍNEZ-HUITLE et al. 2012;
DEGAKI et al. 2014).
Figura 2 - Rio Jianhe em 2011, Luoyang/China.
Fonte: Reuters/China Daily (2011).
Diante desse contexto, o tratamento de efluentes têxteis antes do descarte ao meio
ambiente é de extrema importância, uma vez que pode diminuir a sua coloração e reduzir o
índice de toxicidade.
3.1.3 Corantes
Segundo Guaratin; Zanoni (2000), a arte da tinturaria de tecidos iniciou-se há milhares
de anos. Hoje, a indústria de corantes desenvolve um importante papel na economia do
mundo, nos quais são bastantes aplicados em várias atividades fabris (PEIXOTO et al. 2013).
Corantes podem ser definidos como substâncias intensamente coloridas que lhes
conferem cor, quando aplicadas a um material. De acordo com a Associação Brasileira da
Indústria Química (ABIQUIM, 2014), eles podem ser fixados nos materiais por quatro vias:
adsorção, solução, retenção mecânica ou por ligações químicas covalentes ou iônicas.
Segundo ABIQUIM (2014), os corantes podem ser classificados de acordo com sua
28 Tabela 1 - Classificação segundo as classes químicas e por substrato.
CLASSE QUÍMICA POR SUBSTRATO
Acridina À Cuba Sulfurados
Azo À Tina
Azóico Ácidos
Bases de oxidação Ao Enxofre
Difenilmetano Azóicos
Ftalocianina Básicos
Nitroso Diretos
Oxazina Dispersos
Tiazol Reativos
Xanteno Solventes
Fonte: ABIQUIM (2014).
Entre as classes de corantes citadas anteriormente, o corante presente nessa tese está
classificado como: xanteno.
3.1.3.1 Rodamina B e sua Degradação
Dentre inúmeros corantes utilizados pela indústria têxtil, a Rodamina B, RhB, Figura
3, também conhecida por violeta básico 10, pertence à classe dos xantenos por ter como base
na sua estrutura o próprio xanteno. É um corante altamente solúvel em água, metanol e etanol
(XIAO et al. 2014).
A RhB é aplicada na biotecnologia, como por exemplo: em Ensaio Imunoadsorvente
Ligado à Enzima (ELISA) por apresentar características fluorescentes. Este ensaio permite a
detecção de anticorpos específicos, como por exemplo, no plasma sanguíneo (MISHRA et al.
2011). Além da biotecnologia, é utilizada na indústria têxtil (ALHAMEDI et al. 2009) e de
papel por apresentar boa solubilidade em água sendo assim, adsorvida sobre todos os tipos de
fibras naturais e sintéticas.
Apesar do seu vasto poder de aplicação, a RhB pode causar graves impactos ao meu
29 Figura 3 - Estrutura molecular da Rodamina B.
Fonte: Autor (2014).
Segundo Mallah et al. (2013), alguns derivados dos xantenos possuem características
tóxicas, afetando a parte neuronal, fazendo-se necessário a realização de eficientes
tratamentos dos efluentes que contêm esse tipo de corante para posteriores descartes.
A degradação da Rodamina B tem sido estudada utilizando vários métodos, como por
exemplo: foto-oxidação na presença de peróxido de hidrogênio (ALHAMEDI et al. 2009);
oxidação eletroquímica com ânodo de dióxido de chumbo dopado com cério em diferentes
densidades de corrente (LI et al. 2013); processo fotocatalítico por micro-ondas, usando o
TiO2 suportado em carvão ativado, entre outros (ZHONG et al. 2009b).
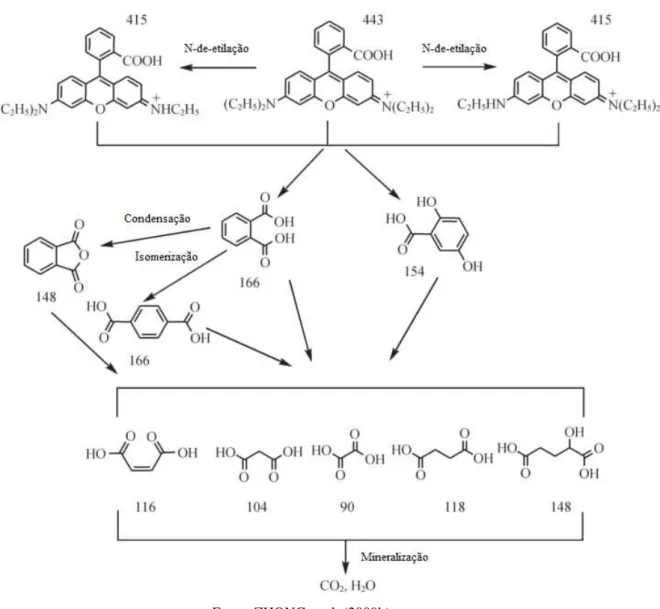
Zhong et al. (2009a; 2009b), diferentemente dos outros autores citados, propuseram
um mecanismo de reação durante a degradação da Rodamina B, como presente na Figura 4.
Esse mecanismo foi sugerido através de análises dos intermediários por cromatografia líquida
acoplada à espectroscopia de massa, bem como por cromatografia gasosa acoplada à
30 Figura 4 - Degradação fotocatalítica por micro-ondas da Rodamina B com TiO2 suportado em carvão ativado.
Fonte: ZHONG et al. (2009b).
De acordo com o mecanismo apresentado na Figura 4, a degradação da Rodamina B
ocorreu por meio de dois processos competitivos: o da N-etilação e outro referente à
destruição da estrutura do xanteno conjugado (LI et al. 2007).
Intermediários por meio da reação de N-etilação foram observados em pequena
proporção, como é o caso do N, N-dietil-N’-etil-rodamina por cromatografia líquida acoplada
à espectroscopia de massa, onde resultou da perda de um grupo etil do anel xanteno da
estrutura da Rodamina B bruta. Segundo Zhong et al. (2009a; 2009b) esta provável N-etilação
da Rodamina B pode estar presente no sistema, mas não é o processo dominante. Além disso,
foi destacada a presença de dois isômeros gerados a partir dos intermediários da N-etilação,
31 Após a destruição da estrutura do conjugado da Rodamina B, outros dois processos
foram observados: a abertura do anel e em seguida a mineralização. Algumas moléculas de
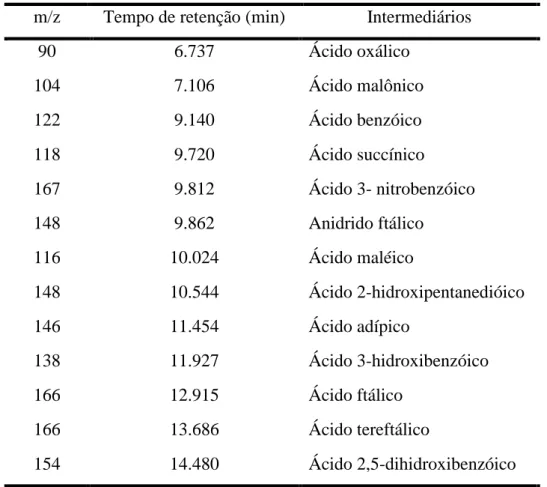
ácidos orgânicos foram produzidas e detectadas através da técnica de CG-MS, como
apresentadas na Tabela 2, que foram mineralizados a água e a gás carbônico.
Tabela 2 - Produtos da degradação fotocatalítica da Rodamina B através da técnica de CG-MS.
m/z Tempo de retenção (min) Intermediários
90 6.737 Ácido oxálico
104 7.106 Ácido malônico
122 9.140 Ácido benzóico
118 9.720 Ácido succínico
167 9.812 Ácido 3- nitrobenzóico
148 9.862 Anidrido ftálico
116 10.024 Ácido maléico
148 10.544 Ácido 2-hidroxipentanedióico
146 11.454 Ácido adípico
138 11.927 Ácido 3-hidroxibenzóico
166 12.915 Ácido ftálico
166 13.686 Ácido tereftálico
154 14.480 Ácido 2,5-dihidroxibenzóico
Fonte: ZHONG et al. (2009a; 2009b).
3.1.4 Resolução Ambiental
O Conselho Nacional do Meio Ambiente, CONAMA, é o órgão consultivo e
deliberativo do Sistema Nacional do Meio Ambiente, SISNAMA, onde foi instituído pela Lei
6.938/81, que dispõe sobre a Política Nacional do Meio Ambiente, regulamentado pelo
Decreto 99.274/90. No Brasil, o CONAMA é o órgão responsável pela fiscalização do
descarte de efluentes no meio ambiente.
De acordo com a resolução nº 430, de 13 de maio de 2011, do CONAMA, o
32 resolução, quando verificada a inexistência de legislação ou normas específicas, disposições
do órgão ambiental competente, bem como diretrizes da operadora dos sistemas de coleta e
tratamento de esgoto sanitário.
Como citado no Art. 3º, “os efluentes de qualquer fonte poluidora poderão ser
lançados diretamente nos corpos receptores depois de um devido tratamento e desde que
obedeçam às condições padrões e exigências dispostas nesta Resolução”. Parâmetros como
pH, temperatura e compostos inorgânicos são limitados por esta Resolução para lançamento
dos efluentes no meio ambiente. No caso dos efluentes têxteis não existe uma norma
específica para o descarte dos mesmos no meio ambiente, se fazendo necessário seguir a
Resolução citada anteriormente.
3.1.5 Tratamentos Convencionais de Efluentes
Os tratamentos convencionais de efluentes estão classificados em três grupos, são eles:
físicos, biológicos e químicos.
Os tratamentos físicos são processos de separação, onde não ocorre nenhum tipo de
reação. Nesses métodos, os contaminantes são separados do meio aquoso, sem degradá-los,
por precipitação, floculação, coagulação, sedimentação, adsorção sobre carvão ativo ou
filtração com membranas.
No método químico, faz-se necessário utilizar reagentes para que ocorra a oxidação do
material orgânico presente nos efluentes, eliminando ou modificando a sua estrutura química.
Nesse método, alguns oxidantes fortes são utilizados como, por exemplo: o cloro,
permanganato de potássio e o ozônio, porém, algumas desvantagens são observadas em
relação à escolha desses oxidantes. No caso do cloro, podem gerar intermediários mais
prejudiciais do que os contidos nos efluentes iniciais (SEGURA, 2014; SIRÉS et al. 2014). O
permanganato gera resíduos de dióxido de manganês, além de ser mais caro que o cloro. Já o
ozônio é pouco solúvel em água, instável, tóxico e de difícil manuseio.
A aplicação dos tratamentos físico-químicos em águas residuais da indústria têxtil
possui algumas limitações devido à formação de lodo durante o processo, a necessidade
periódica de regenerar os materiais adsorventes, baixa eficiência de remoção e a não
eliminação do material orgânico em baixas concentrações (PANIZZA; CERISOLA, 2007;
33 Já os métodos biológicos são os mais utilizados para o tratamento de efluentes devido
aos seus baixos custos, porém, quando se trata de efluentes contaminados com substâncias
orgânicas, a oxidação biológica pode ser dificultada devido à presença de compostos tóxicos e
moléculas refratárias ao tratamento biológico, além de requerer muito tempo e necessidade de
uma grande superfície de contato (SIRÉS et al. 2014).
3.1.6 Processos Oxidativos Avançados
Durante a última década, uma nova classe de tratamentos está sendo bastante estudada
por inúmeros grupos de pesquisas, que torna possível eliminar os poluentes presentes em
efluentes, usando técnicas de oxidação conhecidas como processos oxidativos avançados
(POA). Exemplos desse tipo de processo estão presentes na Tabela 3.
Tabela 3 – Exemplos de processos oxidativos avançados e as reações envolvidas na produção de radicais
hidroxila.
Processos Reações
Sem
luz
Ozônio com pH elevado
Ozônio + H2O2
Ozônio + catalisador
Fenton
Com luz
Ozônio + UV +
Ozônio + H2O2+ UV
A adição de H2O2 acelera a decomposição do ozônio,
favorecendo no aumento da geração de radicais
hidroxilas.
H2O2 + UV
Foto-Fenton
34 Os POA podem ser definidos como métodos de oxidação da fase aquosa, baseados na
intermediação de espécies altamente reativas em mecanismos que levam a destruição dos
poluentes (BRILLAS et al. 2009; SIRÉS et al. 2014), onde o radical hidroxila, considerado
um oxidante forte, é capaz de destruir a maior parte dos contaminantes orgânicos e
organometálicos até a sua completa mineralização em CO2, água e íons inorgânicos.
Esses radicais reagem rapidamente com os compostos orgânicos, representados pela
letra R, principalmente pela abstração de um átomo de hidrogênio (alifáticos) ou através da
adição de uma ligação insaturada (aromáticos) para iniciar uma oxidação radical em cadeia,
como presentes nas Equações de 1-6.
(1)
(2)
(3)
(4)
(5)
(6)
3.1.6.1 Processo de Oxidação Eletroquímica Avançada
As tecnologias eletroquímicas têm sido uma excelente opção para a remoção de cor e
para a redução da toxicidade de efluentes têxtil, oferecendo meios eficazes para resolver os
problemas ambientais relacionados aos efluentes gerados pelos processos industriais
(MARTINEZ-HUITLE et al. 2012; DIAGNE et al. 2014).
Dentre as tecnologias eletroquímicas, o processo de oxidação eletroquímica avançada
(POEA) apresenta características atraentes tais como: eficiência energética, fácil manuseio,
segurança (por operar em condições brandas) versatilidade (podendo ser aplicado aos
efluentes com demanda química de oxigênio no intervalo entre 0,1 a 100 g L-1) e
compatibilidade ambiental, tendo como principal reagente o elétron, um reagente limpo
(PANIZZA; CERISOLA, 2007; SIRÉS et al. 2014).
Os processos de oxidação eletroquímica avançada incluem métodos que geram
hidroxilas heterogêneas na superfície do ânodo, como é o caso da oxidação anódica e os que
35 citar os métodos de: eletron-Fenton, fotoeletron-Fenton (BRILLAS et al. 2009) e sono
eletroquímica (OTURON; BRILLAS, 2007; SIRÉS et al. 2014). Essas técnicas têm sido
bastante reportadas na literatura devido a sua eficiência e flexibilidade para tratamentos de
efluentes sintéticos (ANDRADE et al. 2009), descoloração de corantes (GONZÁLEZ et al.
2012; GARCIA et al. 2011, 2012; PANIZZA et al. 2011), degradação de herbicidas
(BRILLAS et al. 2007), entre outros.
As principais vantagens dos EAOPs para o tratamento de efluentes industriais estão
em relação à possibilidade de degradar a demanda química de oxigênio e o carbono orgânico
total a partir de um valor de várias centenas de gramas de O2 por litro para valores de
miligramas de O2 por litro ou de microgramas de O2 por litro, chegando à redução de 99%.
(BRILLAS et al. 2009; SIRÉS et al. 2014).
3.1.6.1.1 Influência da produção de oxidantes por eletrólise na oxidação anódica mediada
A oxidação anódica mediada é a oxidação dos poluentes contidos nos efluentes,
através da reação química entre estes compostos e os oxidantes produzidos na superfície do
eletrodo. Os oxidantes mais comuns são: os radicais hidroxilas, cloro, (per) bromato,
persulfato, peróxido de hidrogênio, percarbonato, entre outros (PANIZZA; CERISOLA 2009;
SIRÉS et al. 2014).
Dessa forma, a oxidação anódica, além de oxidar diretamente os poluentes orgânicos
na superfície do ânodo, também gera a formação de oxidantes que podem atuar tanto sobre a
superfície dos eletrodos, como também no processo de oxidação da solução em estudo
(PANIZZA; CERISOLA 2009).
Segundo SIRÉS et al. (2014), um dos exemplos mais apresentados na literatura em
relação a oxidação eletroquímica mediada está no efeito do cloreto na oxidação de compostos
orgânicos, como apresentados nas Equações de 7 a 10.
(7)
(meio ácido) (8) (meio alcalino)
36
(10)
O cloreto normalmente está presente em águas residuais, onde são facilmente oxidados
a cloro em diversos tipos de ânodos, Equação 7. Esse oxidante gasoso difunde-se em dois
meios, ácido e alcalino, nas águas residuais, formando ácido hipocloroso e íons cloreto, bem
como hipoclorito e íons cloreto respectivamente, Equações 8 e 9, no meio da reação em
grandes quantidades. A desprotonação do ácido hipocloroso produzindo hipoclorito está
presente na Equação 10. A mistura resultante de cloro, hipoclorito e ácido hipocloroso
tornam-se totalmente reativos com muitos compostos orgânicos levando a uma completa
mineralização (SIRÉS et al. 2014).
Embora a oxidação mediada por cloreto seja bastante conhecida, não é o único caso de
processo de oxidação mediada, três importantes aspectos devem ser levados em conta com
relação à oxidação mediada, são eles (SIRÉS et al. 2014):
(a) A produção eletroquímica direta de oxidantes na superfície do ânodo por espécies não
oxidante contida no resíduo e o transporte destas espécies em direção as águas residuais;
(b) O efeito das matérias oxidantes produzidas eletrodicamente sobre os poluentes orgânicos;
(c) A ativação dos oxidantes em grandes quantidades, isto é, a formação das espécies
altamente reativas a partir de oxidantes pouco reativos.
3.1.6.1.2 Produção de oxidantes por processos de oxidação direta
Três pontos principais devem ser considerados em relação à produção de oxidantes por
processos de oxidação direta, durante o tratamento eletroquímico de efluentes (SIRÉS et al.
2014):
a) A oxidação direta de espécies na superfície do ânodo, envolvendo a formação de espécies
de radicais que se combinam para produzir oxidantes estáveis;
b) A oxidação da água para radicais hidroxila e outros ataques deste poderoso oxidante para
espécies que promovem a formação de radicais, seguindo da combinação de radicais levando
a produção de oxidantes estáveis;
c) E a redução de oxigênio produzindo peróxido de hidrogênio na superfície do cátodo.
Na primeira maneira de produzir oxidantes, a oxidação direta ocorre em muitas
37 promovendo a formação de radicais (ânions) como sulfatos, fosfatos e cloretos. Esses radicais
podem se combinar e gerar oxidantes estáveis no meio da reação, incluindo peroxossulfatos,
peroxofosfatos e cloro, como presentes nas Equações de 11 a 13.
(11)
(12)
(13)
Referente à segunda forma de produzir oxidantes, os radicais hidroxilas são os
intermediários gerados através da oxidação anódica da água para oxigênio. Essa oxidação
pode ser vista de forma positiva ou negativa dependendo do ânodo a ser utilizado, ativo ou
não-ativo, classificação dada por Comninellis (1994).
Nos ânodos ativos, a oxidação da água em oxigênio ocorre através de uma reação
indesejável no tratamento eletroquímico dos poluentes, afetando seriamente a eficiência do
processo, gerando um aumento significativo nos custos de operação. Já nos ânodos
não-ativos, os radicais hidroxila ajudam o processo de mineralização dos compostos orgânicos,
contribuindo para explicar as suas altas eficiências nas eletrólises (SIRÉS et al. 2014).
Alguns exemplos de reações promovidas pelos radicais hidroxilas estão presentes nas
Equações 14 a 16, como também os novos oxidantes gerados a partir do produto dessas
reações com os radicais hidroxila, Equações de 17 e 18 (SIRÉS et al. 2014).
(14)
(15)
(16)
(17)
(18)
O terceiro processo de produção de oxidantes consiste na produção de peróxido de
hidrogênio por redução de oxigênio na superfície do cátodo. Nesse caso, é utilizado um tipo
38
3.1.7 Ativação de Oxidantes
Os métodos de ativação de oxidantes muitas vezes se faz necessário para aumentar a
reatividade das matérias oxidantes produzidas pelos processos de oxidação eletroquímica
avançada em compostos orgânicos. Três métodos são utilizados para ativar esses oxidantes: a
ativação química, a ativação por radiação de luz e a ativação por radiação ultrason. Dentre
esses métodos, serão abordados os dois primeiros nessa tese.
A ativação química é uma das maneiras mais importante para aumentar a eficiência de
um oxidante. Essa ativação envolve a combinação do oxidante produzido eletroquimicamente
com outra espécie, o que leva a produção de outra espécie bem mais reativa. Um exemplo
desse tipo de ativação é a combinação sinérgica de oxidantes que resulta quando o ozônio e o
peróxido de hidrogênio são combinados. Essa mistura resulta também no aumento da
produção de radicais hidroxila, ao qual se explica a melhor eficiência dos processos em que a
formação de ambos os oxidantes é promovida (SIRÉS et al. 2014).
A ativação por radiação de luz é um processo onde ocorre a formação de espécies
altamente ativas pela irradiação das mesmas. Esse tipo de radiação pode ser aplicado de forma
natural ou artificial. No processo natural utiliza-se luz solar (SALAZAR et al. 2011), já no
processo artificial lâmpadas do tipo UV. Essa foto ativação eletroquimicamente gera espécies
reativas, como é o caso do peróxido de hidrogênio e do ozônio, como presentes nas Equações
19 e 20, ajudando na degradação dos compostos orgânicos presentes em efluentes (SIRÉS et
al. 2014).
(19)
(20)
Além dos processos citados nas Equações 19 e 20, a ativação por luz aliada aos
processos de oxidação eletroquímica avançada podem decompor compostos peróxidos, como
peroxofosfatos, peroxossulfatos e peroxocarbonatos (SIRÉS et al. 2014).
3.1.8 Influência do Material Anódico – Eletrodos Ativos e Não-ativos
Inúmeros tipos de eletrodos têm sido utilizados como ânodos nos últimos anos em
39 SnO2, PbO2, Ti/Pt, Ti/Pt-Ir, Ti/PbO2, Ti revestido com óxido de Ru/Ir/Ta e os filmes de BDD
(MARTINEZ-HUITLE et al. 2012).
A natureza desses materiais influencia fortemente na eficiência de oxidação, onde
existem ânodos que favorecem a oxidação parcial e seletiva de poluentes, ocorrendo o
processo de conversão, conhecidos por ânodos ativos; Outros que favorecem a combustão
completa para o CO2, chamados de ânodos não-ativos (COMNINELLIS, 1994; PANIZZA e
CERISOLA, 2007). De acordo com o esquema de oxidação eletroquímica presente na Figura
5 pode-se entender o comportamento desses dois tipos de ânodos na oxidação de compostos
orgânicos em eletrodo de óxido metálico com evolução simultânea de oxigênio.
Figura 5 - Esquema de oxidação eletroquímica de compostos orgânicos em ânodos ativos e não-ativos.
Fonte: COMNINELLIS (1994).
Segundo Comninellis (1994), a primeira etapa que ocorre no esquema da Figura 5 é a
reação de transferência de oxigênio, ao qual, ocorre a descarga de moléculas de água para
formar radicais hidroxilas adsorvidos, conforme a Equação 21.
(21)
As seguintes etapas dependem da natureza do material de cada eletrodo, onde podem
ser ativos ou não-ativos:
Nos eletrodos "ativos", os estados de oxidação são mais elevados estando disponíveis
na sua superfície. Nesse caso os radicais hidroxilas adsorvidos podem interagir com o ânodo,
40
(22)
Nesse caso, o par redox presente na superfície MOx +1 / MOx, as vezes chamado de "oxigênio
ativo" quimissorvido, pode atuar como um mediador na conversão ou na oxidação seletiva de
orgânicos em eletrodos "ativos", Equação 23.
(23)
Em relação ao comportamento dos eletrodos “não-ativos”, diferente dos ativos, a formação de
um óxido superior é excluído. Esse processo é conhecido por adsorção do" oxigênio ativo",
podendo ajudar a oxidação não seletiva de produtos orgânicos, resultando na combustão
completa para CO2, presente na Equação 24.
(24)
Em ambos os casos, eletrodos ativos e não-ativos, ocorre paralelamente uma reação de
competição de evolução de oxigênio durante a oxidação eletroquímica de compostos
orgânicos, diminuindo a eficiência do processo anódico (PANIZZA; CERISOLA, 2009).
De acordo com os mecanismos de reação presentes nas Equações de 21 a 24, ânodos
com baixo sobrepotencial de oxigênio são considerados ativos. Como exemplos desses
ânodos pode-se citar os de grafite e platina, entre outros.
Já os ânodos que possuem um sobrepotencial elevado de oxigênio são considerados
não-ativos, como é o caso dos ânodos de PbO2 e BDD (CAÑIZARES et al. 2008;
MARTINEZ-HUITLE et al. 2012).
3.1.9 Eletrodo de Diamante Dopado com Boro (BDD)
O BDD é um eletrodo sintético de diamante dopado com boro, sendo considerado um
41 grande interesse de vários grupos de pesquisa nos últimos anos (COMNINELLIS; CHEN,
2010).
Tabela 4 - Poder de oxidação do material anódico em meio ácido.
Eletrodos
Potencial de
oxidação (V)
Sobre potencial de
evolução de O2 (V)
Poder de oxidação
do ânodo
RuO2– TiO2 1,4 – 1,7 0,18
IrO2– Ta2O5 1,5 – 1,8 0,25
Ti/Pt 1,7 – 1,9 0,3
Ti/`PbO2 1,8 – 2,0 0,5
Ti/SnO2-Sb2O5 1,9 – 2,2 0,7
p-Si/BDD 2,2 – 2,6 1,3
Fonte: COMNINELLIS; CHEN (2010).
O ânodo de BDD combinado a técnicas eletroquímicas possui uma alta eficiência para
tratamentos de efluentes reais (PANIZZA; CERISOLA, 2010; AQUINO et al. 2011; SILVA
et al. 2013) e sintéticos (JUANG et al. 2013), bem como corantes sintéticos (AQUINO et al.
2013), entre outros, por apresentar várias características tecnologicamente importantes, tais
como: possuir uma superfície inerte, apresentar baixas propriedades de adsorção e ter
estabilidade à corrosão mesmo em meio bastante ácido e em casos de elevado sobrepotencial
de oxigênio (PANIZZA; CERISOLA, 2007).
Muitos trabalhos estão sendo reportados pela literatura onde se tem demonstrado que
ânodos de BDD permitem uma mineralização completa, com alta eficiência de corrente em
vários tipos de compostos orgânicos, como por exemplo: em fenóis, naftol, ácidos
carboxílicos, corantes sintéticos e efluentes reais (PANIZZA; CERISOLA, 2007).
3.1.9.1 Configuração sp3/sp2
O eletrodo de BDD está sendo bastante utilizado juntamente com as técnicas
42 outros tipos de ânodos presentes na literatura. Porém estudos detalhados em relação ao efeito
de suas características, como por exemplo, da configuração sp3/sp2 em diferentes ânodos de
BDD não tem sido ainda bastante discutido (CAÑIZARES et al. 2008 a, 2008 b).
De acordo com Cañizares et al. (2008 a, 2008 b), o processo eletroquímico pode ser
bastante influenciado quando comparados as diferentes naturezas dos ânodos de BDD, onde
as diferentes características nesses ânodos afetam no processo de degradação dos efluentes em
estudo.
Cañizares et al. (2008a, 2008b) estudaram onze ânodos de BDD variando três
característica do diamante: a sua dopagem com boro (entre 100 a 8000 ppm), espessura da
camada (1,05 a 2,33 µm) e a relação sp3/sp2 (43 a 105), bem como outras duas características
referentes ao substrato p-Si, como rugosidade (< 0,1 e entre 0,3-0,5 µm) e resistividade (10 e 100 mΩ cm), utilizando a oxidação eletroquímica para o tratamento de efluentes sintéticos contendo fenol. Entre os parâmetros estudados, os que se destacaram através de um
tratamento estatístico para a oxidação do fenol foram à rugosidade e a relação sp3/sp2.
Observou-se, através da rugosidade, que quanto mais áspera à superfície do ânodo maior era a
eficiência do processo, favorecendo assim, a oxidação direta. Em relação à configuração
sp3/sp2, o aumento do valor dessa interação favoreceu numa maior eficiência no processo de
oxidação do fenol.
3.1.10 Referências
AHMEDCHEKKAT, F.; MEDJRAM, S. M.; CHIHA, M.; AL- BSOUL, A. M. A.
Sonophotocatalytic degradation of Rhodamine B using a novel reactor geometry: effect of operating conditions. Chemical Engineering Journal, v.178, p. 244-251, 2011. Disponível em: ˂ http://www.sciencedirect.com/science/article/pii/S1385894711013003#>. Acesso em: 06 de maio de 2012.
ALHAMEDI, F. H.; RAUF, A. M.; ASHRAF, S. S. Degradation studies of Rhodamine B in the presence of UV/H2O2. Desalination, v. 239, p. 159-166, 2009. Disponível em:
<http://www.sciencedirect.com/science/article/pii/S0011916409000319?np=y>Acesso em:06
de março de 2011.
43
Electrochimica Acta, v. 54, p. 2024-2030, 2009. Disponível em: ˂
http://www.sciencedirect.com/science/article/pii/S0013468608010359#> Acesso em: 06 de
maio de 2012.
AQUINO, J. M.; PEREIRA, G. F.; ROCHA-FILHO, R. C.; BOCCHI, N.; BIAGGIO, S. R. Electrochemical degradation of a real textile effluent using boron-doped diamond or β-PbO2
as anode. Journal of Hazardous Materials, v. 192, p. 1275-1282, 2011. Disponível em:
<http://www.sciencedirect.com/science/article/pii/S0304389411008016>Acesso em: 06 de
maio de 2012.
AQUINO, J. M.; ROCHA-FILHO, R. C.; RODRIGO, M. A.; SÁEZ, C.; CAÑIZARES, P. Electrochemical degradation of the reactive Red 141 dye using a boron-doped diamond anode. Water Air Soil Pollution,v. 224, p. 1-10, 2013. Disponível em:
http://download.springer.com/static/pdf/887/art%253A10.1007%252Fs11270-012-1397-9.pdf?auth66=1403999841_403e584cba8852b7d5623338412a60bc&ext=.pdf
Acesso em: 03 de fevereiro de 2014.
ASGHER, M.; AZIM, N.; BHATTI, H. N. Decolorization of practical textile industry
effluents by white rot fungus coriolus versicolor IBL-04. Biochemical Engineering Journal, v. 47, p. 61–65, 2009. Disponível em:
˂ http://www.sciencedirect.com/science/article/pii/S1369703X09002101>. Acesso em: 06 de
fevereiro de 2012.
BASTIAN, E. Y. O.; ROCCO, J. L. S.; MARTIN, E. S. Guia técnico ambiental da indústria têxtil. CETESB; SINDITÊXTIL- Sindicato das Indústrias Têxteis do Estado de São Paulo, 2009. Disponível em: <http://www.inovacao.usp.br/APL/pdf/docs/guia_textil.pdf>Acesso em: 10 de maio de 2012.
BRILLAS, E.; BAÑOS, M. A.; SKOUMAL, M.; CABOT, P. L.; GARRIDO, J. A.;
RODRÍGUEZ, R. M. Degradation of the herbicide 2,4-DP by anodic oxidation,electro-fenton and photoelectro-fenton using platinum and boron-doped diamond anodes. Chemosphere, v. 68, p. 199-209, 2007. Disponível
em:http://www.sciencedirect.com/science/article/pii/S0045653507001452>Acesso em: 06 de
fevereiro de 2012.
BRILLAS, E.; SIRE´S, I.; OTURAN, M. A. Electro-fenton process and related
electrochemical technologies based on fenton’s reaction chemistry. Chemical Reviews, v. 109, p. 6570–6631, 2009. Disponível em: <Doi: 10.1021/cr900136g.>. Acesso em: 06 de maio de 2012.
CAÑIZARES, P.; SAÉZ, C.; MARTÍNEZ, F.; RODRIGO, M. A. The role of the characteristics of p-Si BDD Anodes on the efficiency of wastewater electro-oxidation processes. Electrochemical and Solid-State Letters, v. 11, p. E15-E19, 2008 a. Disponível em: <http://esl.ecsdl.org/content/11/7/E15.abstract>Acesso em: 06 de maio de 2012.
44 electrosynthesis process. Electrochemistry Communications, v. 10, p. 602–606, 2008 b. Disponível em: <http://www.sciencedirect.com/science/article/pii/S1388248108000489> Acesso em: 06 de maio de 2012.
COMNINELLIS, C. Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment. Electrochimica Acta, vol. 39, p. 1857-1862, 1994. Disponível em:
<http://www.sciencedirect.com/science/article/pii/0013468694851751>Acesso em: 07 de
maio de 2012.
COMNINELLIS, C.; CHEN, C. Electrochemistry for the Environment, Ed. Spring, 1 ed, 2010.
GONZÁLEZ , K. C.; LOPEZ, O. T.; LEÓN, A. M. G.; BRILLAS, E.; RAMÍREZ, A. H.; HERNÁNDEZ, J. M. P. Optimization of electro-Fenton/BDD process for decolorization of a model azo dye waste water by means of response surface methodology. Desalination, v. 286, p. 63–68, 2012. Disponível em:
<http://www.sciencedirect.com/science/article/pii/S0011916411009209>Acesso em: 15 de
janeiro de 2013.
DEGAKI, A. H.; PEREIRA, G. F.; ROCHA-FILHO, R. C.; BOCCHI, N.; BIAGGIO, S. R. Effect of specific active chlorine species and temperature on the electrochemical degradation of the reactive Blue 19 dye using a boron-doped diamond or DSA anode in a flow reactor.
Electrocatalysis, v. 5, p. 8-15, 2014. Disponível em:
˂ http://link.springer.com/article/10.1007%2Fs12678-013-0156-z#page-1>. Acesso em: 03
de fevereiro de 2014.
DIAGNE, M.; SHARMA, V. K.; OTURAN, N.; OTURAN, M. A. Depollution of indigo dye by anodic oxidation and electro-Fenton using B-doped diamond anode. Environmental
Chemistry Letters, v. 12, p. 219-224, 2014. Disponível em:
<http://link.springer.com/article/10.1007%2Fs10311-013-0437-z#page-1>. Acesso em: 05 de
novembro de 2013.
DUA, L.; WUB, J.; HUA, C. Electrochemical oxidation of Rhodamine B on RuO2
-PdO-TiO2/Ti electrode. Electrochimica Acta,v.68, p. 69-73, 2012. Disponível em:
˂ http://www.sciencedirect.com/science/article/pii/S0013468612002319>. Acesso em: 07 de
maio de 2012.
GARCIA, S. S.; CENTELLAS, F.; ARIAS, C.; GARRIDO, J. A.; RODRÍGUEZ, R. M.; CABOT1, P. L.; BRILLAS, E. Comparative decolorization of monoazo, diazo and triazo dyes by electro-Fenton Process. Electrochimica Acta, v. 58, p. 303-311, 2011. Disponível em:
<http://www.sciencedirect.com/science/article/pii/S0013468611014307>
Acesso em: 10 de maio de 2012.