STEFÂNIA JERONIMO FERREIRA
Natal / RN
2015
AVALIAÇÃO DE POLIMORFISMOS FUNCIONAIS NOS
GENES DE REPARO XRCC1, APEX1, XPD E XPF EM
STEFÂNIA JERONIMO FERREIRA
AVALIAÇÃO DE POLIMORFISMOS FUNCIONAIS NOS GENES DE
REPARO XRCC1, APEX1, XPD E XPF EM CARCINOMAS DE
CÉLULAS ESCAMOSAS ORAIS
NATAL / RN
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
AVALIAÇÃO DE POLIMORFISMOS FUNCIONAIS NOS GENES DE
REPARO XRCC1, APEX1, XPD E XPF EM CARCINOMAS DE
CÉLULAS ESCAMOSAS ORAIS
Tese apresentada ao Colegiado do Programa de Pós-Graduação em Patologia Oral da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Doutor em Patologia Oral.
ORIENTADORA: PROFa. DRa. HÉBEL CAVALCANTI GALVÃO
NATAL / RN
Ferreira, Stefânia Jeronimo.
Avaliação de polimorfismos funcionais nos genes de reparo XRCC1, APEX1, XPD e XPF em carcinomas de células escamosas orais/Stefânia Jeronimo Ferreira. Natal, RN, 2015.
118 f. : il.
Orientadora: Profª. Drª. Hébel Cavalcanti Galvão.
Tese (Doutorado em Patologia Oral) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral.
1. Carcinoma de Células Escamosas Oral – Tese. 2. Polimorfismos de Nucleotídeo Único – Tese. 3. Reparo do DNA – Tese.
I. Galvão, Hébel Cavalcanti. II. Título.
RN/UF/BSO Black D65
DEDICATÓRIA
Dedico este trabalho aos pacientes com câncer, que com muita boa vontade, consentiram sua participação nesta pesquisa. Pessoas lindas, que colaboraram com a ciência, com a nobreza de trazer melhores perspectivas de vida ao próximo. Cada um deles, com experiências de vida, que além de colaborar com o meu crescimento profissional, me proporcionaram um crescimento pessoal. O MEU MUITO OBRIGADA a todos vocês: aqueles que estão curados, que Deus os abençoe; aos que ainda estão na luta, que Deus os proporcione força para continuar na batalha; e aos que descansaram, que Deus conforte os familiares com a certeza que eles são anjos do Senhor e estão descansando junto ao Pai.
AGRADECIMENTOS
A Deus, pelo dom da vida, por me fortalecer nos momentos difíceis, pelo sentimento de paz recebido na oração e por todas as graças recebidas. Obrigada, Senhor, pela conclusão de mais esta etapa. Sem a Tua presença em minha vida, eu nada seria.
Aos meus pais, Joel de Barros Ferreira e Marta Rosi Jeronimo Ferreira, que em nenhum momento mediram esforços para a realização dos meus sonhos, que me incentivaram e ensinaram a fazer as melhores escolhas, me mostraram que a honestidade e o respeito são essenciais à vida, e que devemos sempre lutar pelo que queremos. A eles devo tudo que sou e serei. Sou extremamente feliz e tenho muito orgulho por tê-los como painho e mainha. AMO VOCÊS!
Às minhas irmãs amadas, Rosielma Jeronimo Ferreira e Janyara Jeronimo Ferreira. Ró e Jany, obrigada pela amizade, companheirismo, por me apoiarem nas minhas escolhas e suprir a minha ausência junto aos nossos pais. Vocês são as melhores irmãs que eu poderia ter.
Ao meu sobrinho lindo, Alayn Kleber Freire da Silva Jr. Lan, obrigada pelo seu abraço acolhedor, e pela sua alegria, que me contagia. A tia ama muito!
Aos meus cunhados, Alayn Kleber Freire da Silva e Pedro Lucas Barros, pelo apoio e disponibilidade em ajudar, sempre que eu precisei.
À minha querida avó, Anita de Melo (In Memoriam), que nos deixou uma lição de vida e sempre estará em nossos pensamentos. E ao meu avô Josué do Vale, pelas suas palavras sábias.
À Ivonete, pelo cuidado e atenção que tem comigo, por me receber tão bem e pelas boas risadas que damos juntas.
À minha orientadora, Profª. Drª. Hébel Cavalcanti Galvão, pela sua contribuição para a minha formação. Obrigada pela sua amizade, paciência e por ter me ensinado além do que está nos livros e artigos científicos. A senhora é um exemplo de ser humano, pela sua generosidade, educação, humildade... Espero ter correspondido a sua confiança neste tempo em que trabalhamos juntas.
Aos professores do programa de pós-graduação em patologia oral, Dr. Leão Pereira Pinto, Dra. Lélia Batista de Souza, Dra. Roseana de Almeida Freitas, Dr. Antônio de Lisboa Lopes Costa, Dra. Lélia Maria Guedes Queiroz, Dra. Márcia Cristina da Costa Miguel, Dra. Éricka Janine Dantas da Silveira, Dra. Ana Miryam Costa de Medeiros e Dr. Bruno César de Vasconcelos Gurgel. A todos, agradeço pelo valioso conhecimento compartilhado e pela contribuição na minha formação. Irei levar um pouco de cada um de vocês comigo.
Aos professores da Faculdade de Odontologia de Piracicaba da Universidade Estadual de Campinas, pela contribuição para a conclusão deste trabalho. Em especial, agradeço aos professores Alan Roger dos Santos Silva, Márcio Ajudarte Lopes e Ricardo Della Colleta, pela excelente receptividade e disponibilidade em ajudar, mesmo quando nos ajudar significou mudar um pouco a rotina do laboratório e clínica.
À minha querida professora, tia, amiga, Sonia Maria Soares Ferreira, por ser um exemplo de profissional, por me encorajar a seguir a carreira acadêmica e, principalmente pelo seu carinho, atenção e confiança.
agradeço à Fernanda Braga Peixoto e Áurea Valéria, por tudo que me ensinaram, pela imensa ajuda e por terem sido tão compreensivas comigo.
Aos amigos de trabalho da Universidade de Pernambuco, Arine Lyra, Eduardo Duarte, Eudes Lorena, Fábio Andrey, Fernanda Ribeiro, Leonardo Carnut,
Lúcio Flávio, Luiz Gutenberg, Marconi Maciel, Marianne Carvalho, Paulo Reis e
Tereza Cristina, pela disponibilidade em ajudar nos momentos que precisei e pela agradável convivência.
Às amigas do Ap 201, Bárbara Vanessa, Natália Gumarães e Melka Sá. Babi, obrigada pela agradável convivência, pela parceria, por me encorajar e ter sido essencial em vários momentos de dúvidas; você é uma irmã que Deus me deu de presente. Natyzinha, obrigada pelos seus sábios conselhos, pela sua paciência e por cuidar da gente. Melkitxa, obrigada pela sua boa vontade e disponibilidade em ajudar; a sua alegria é contagiante. Meninas, com vocês a minha estadia em Natal tornou-se mais fácil. Obrigada pelo prazeroso convívio.
Aos amigos do EJAC, Amanda Moura, Emerson Silva, Edzângela Cunha, Lorena Macedo (In Memoriam), Clero Sena, Cíntia Délio, Gerisvaldo Filho, Elvistony Freitas, Danielle Torres, Emanuelle Alves, Kamila Bezerra, pela agradável convivência e pelos momentos alegres, regados de muitas risadas. Amandinha, vc e Lore, foram anjos que Deus me deu a graça de conhecer, amigas fiéis para todos os momentos. Ed, a minha amiga mais simpática, obrigada pela sua amizade e por se fazer tão presente.
À Vanessa Faria, amiga verdadeira, com quem eu posso sempre contar. Obrigada por se fazer tão presente e cultivar, de uma forma tão especial, a nossa amizade.
Aos meus colegas e amigos de curso, Adriana Costa, Emília Beatriz, Nazareno Aguiar, Rodrigo Gadelha, Joabe Pereira, Keila Marta, Cyntia Carvalho, Emeline Lima, Felipe Matos, Conceição Maia, Fernando Nóbrega, Maiara Moraes, Águida Henriques, Pedro Paulo, Bárbara Vanessa, Ana Luiza, Melka Sá, Denise Helen, Roseane Vasconcelos, Clarissa Demeda, Natália Guimarães, Pedro Carlos, Jamile Oliveira, Edilmar Santos, Francisco Jadson, Andréia do Carmo, Marcelo Nascimeto, Maria Luiza, Luciana Castro, Viviane Oliveira, Tiago João, Thâmara Bezerra, Thais Maciel e Luiz Juliasse, pelo conhecimento compartilhado e pelos agradáveis momentos de descontração.
Aos funcionários Lourdinha, Gracinha, Hévio, Idelzuíte, Ricardo e Sandrinha, pela simpatia e disponibilidade em ajudar sempre que precisei.
Á professora Telma Maria Araújo Moura Lemo, pela gentileza em disponibilizar parte do material utilizado para o desenvolvimento desta pesquisa.
RESUMO
As vias de reparo por excisão de base (BER) e por excisão de nucleotídeo (NER) desempenham um papel crucial na manutenção da integridade genômica. Polimorfismos em genes das vias BER e NER, que modulam a capacidade de reparo do DNA, podem estar relacionados ao risco de desenvolvimento e prognóstico do câncer oral. O presente trabalho teve como objetivo investigar a frequência de polimorfismos de nucleotídeos simples, em dois genes da via de reparo do DNA por excisão de base (XRCC1 – rs25487 e APEX1 – rs1130409) e dois genes da via de reparo por excisão de nucleotídeo (XPD – rs13181 e XPF – rs1799797), em pacientes com carcinoma de células escamosas oral (CCEO), buscando associações com o risco de desenvolver esta neoplasia maligna e o seu prognóstico. Um total de 92 amostras de DNA de pacientes com CCEO e 130 controles foram genotipadas utilizando o método da reação em cadeia da polimerase em tempo real. O software estatístico GraphPad Prism version 6.0.1. foi utilizado para a aplicação dos testes apropriados. Odds ratio (OR) e hazard ratio (HR), e seus intervalos de confiança (IC) de 95%, foram calculados pela regressão logística. A avaliação do prognóstico foi realizada por meio da curva de Kaplan-Meier e análise multivariada de Cox. A presença das variantes polimórficas nos genes XRCC1, APEX1, XPD, e XPF não foram associadas ao risco de desenvolver CCEO. A interação da presença da variante polimórfica com o hábito de fumar não foi significativa para nenhum dos polimorfismos analisados. Já a presença do polimorfismo em XPD, somada ao hábito de beber, aumentou o risco de desenvolver CCEO (OR 1,86, 95% IC: 0,86 – 4,01, p=0,03). Apenas o SNP do APEX1 (rs1130409) esteve associado a uma diminuição da sobrevida específica (HR 3,94, 95% IC: 1,31 – 11,88, p=0,01). O presente estudo sugere uma interação entre o consumo de álcool e a presença do polimorfismo estudado no gene XPD. Além disso, indica um pior prognóstico para pacientes que possuem o polimorfismo estudado em APEX1.
ABSTRACT
Base excision repair (BER) and nucleotide excision repair (NER) pathways play critical role in maintaining genome integrity. Polymorphisms in BER and NER genes which modulate the DNA repair capacity may affect the susceptibility and prognosis of oral cancer. This study was conducted with genomic DNA from 92 patients with oral squamous cell carcinomas (OSCC) and 130 controls. The cases were followed up to explore the associations between BER and NER genes polymorphisms and the risk and prognosis of OSCC. Four single-nucleotide polymorphisms (SNPs) in XRCC1 (rs25487), APEX1 (rs1130409), XPD (rs13181) and XPF (rs1799797) genes were tested by polymerase chain reaction – quantitative real time method. The GraphPad Prism version 6.0.1 statistical software was applied for statistical analysis of association. Odds ratio (OR), hazard ratio (HR), and their 95 % confidence intervals (CIs) were calculated by logistic regression. Kaplan-Meier curve and Cox proportional hazard model were used for prognostic analysis. The presence of polymorphic variants in XRCC1, APEX1, XPD and XPF genes were not associated with an increased risk of OSCC. Gene-environment interactions with smoking were not significant for any polymorphism. The presence of polymorphic variants of the XPD gene in association with alcohol consumption conferred an increased risk of 1.86 (95% CI: 0.86 – 4.01, p=0.03) for OSCC. Only APEX1 was associated with decreased specific survival (HR 3.94, 95% CI: 1.31 – 11.88, p=0.01). These results suggest an interaction between polymorphic variants of the XPF gene and alcohol consumption. Additionally APEX1 may represent a prognostic marker for OSCC.
LISTA DE ILUSTRAÇÕES
LISTA DE TABELAS
Tabela 1. Distribuição das características demográficas dos grupos controle e carcinoma de células escamosas oral. Natal/RN – 2015...65 Tabela 2. Distribuição dos genótipos nos grupos controle e carcinoma de células escamosas oral no modelo aditivo. Natal/RN – 2015...65 Tabela 3. Distribuição dos genótipos nos grupos controle e carcinoma de células escamosas oral no modelo dominante. Natal/RN – 2015...66 Tabela 4. Associação entre os genótipos e consumo de bebidas alcoólicas no risco de ocorrência do carcinoma de células escamosas oral (modelo dominante). Natal/RN – 2015...67 Tabela 5. Associação entre os genótipos e tabagismo no risco de ocorrência do carcinoma de células escamosas oral (modelo dominante). Natal/RN – 2015...68 Tabela 6. Associação entre os genótipos do XRCC1 (rs25487) e variáveis demográficas e clínicas dos pacientes com carcinoma de células escamosas oral. Natal/RN – 2015...69 Tabela 7. Associação entre os genótipos do APEX1 (rs1130409) e variáveis demográficas e clínicas dos pacientes com carcinoma de células escamosas oral. Natal/RN – 2015...70 Tabela 8. Associação entre os genótipos do XPD (rs13181) e variáveis demográficas e clínicas dos pacientes com carcinoma de células escamosas oral. Natal/RN – 2015...71
LISTA DE SIGLAS E ABREVIATURAS
APEX1 – do ingles, Apurinic/Apyrimidinic endonuclease 1 Arg – arginina
Asp – aspartato
ATP – trifosfato de adenosina (do inglês, adenosine triphosphate) BER – reparo por excisão de base (do inglês, Base Excision Repair) BRCT – do inglês, BRCA1 carboxy terminus
CCE – carcinoma de células escamosas CCEO – carcinoma de células escamosas oral CID – Classificação Internacional de Doenças CSA – do ingles, Cockayne syndrome group A CSB – do ingles, Cockayne syndrome group B
DNA – ácido desoxirribonucleico (do inglês, deoxyribonucleic acid)
DSB – quebra de fita dupla (do inglês, Double-Strand Break)
EGFR – receptor do fator de crescimento epidérmico (do inglês, Epidermal Growth Factor Receptor)
EBV – Epstein-Barr vírus
EDTA – ácido etilenodiamino tetra-acético (do inglês, Ethylenediamine tetraacetic acid) EORTC – Organização Européia para Pesquisa e Tratamento do Câncer (do inglês, European Organization for Research and treatment to Cancer)
ERCC2 – do ingles, excision repair cross-complementing rodent repair deficiency, complementation group 2
ERCC4 – do ingles, excision repair cross-complementing rodent repair deficiency, complementation group 4
FEN1 – do ingês, Flap endonuclease-1
Gln – glicina Glu – glutamina Gy – do inglês, Gray His - histidina
HPV – papiloma vírus humano (do inglês, human papiloma virus) HSV – vírus Herpes Simples (do ingês, human simple virus) IC – intervalo de confiança
INCA – Instituto Nacional do Câncer Lys – lisina (do inglês, Lysine)
MMR – reparo MISMATCH (do inglês, MISMATCH repair)
NER – reparo por excisão de nucleotídeo (do inglês nucleotide excision repair) OGG1 – do inglês, 8-oxoG-DNA glicosilase
OR –Odds ratio pb – pares de bases
PARP1 – do ingles, Poly (ADP-Ribose) Polymerase 1 PCNA – do inglês, proliferating cell nuclear antigen
PCR – reação em cadeia da polimerase (do inglês, Polymerase Chain Reaction)
q.s.p. – quantidade suficiente para
RNAm – ácido ribonucleico mensageiro (do inglês, messenger ribonucleic acid) RT – radioterapia
RTOG – Grupo de Oncologia e Radioterapia (do inglês, Radiotherapy Oncology Group)
SDS –do inglês, sodium dodecyl sulfate
SNP – polimorfismo de nucleotídeo simples (do inglês single nucleotide polymorphisms) TCLE - Termo de Consentimento Livre e Esclarecido
TDP1 – do inglês, Tyrosyl-DNA phosphodiesterase 1 TFIIH – do ingles, Transcription Factor II H
Thr – treonina (do inglês threonine) Tri – triptofano
XP – xeroderma pigmentoso
SUMÁRIO
1 INTRODUÇÃO ... 26 2. REVISÃO DA LITERATURA...
2.1 CARCINOMA DE CÉLULAS ESCAMOSAS ORAL... 2.2 GENES DO REPARO DO DNA... 2.3 REPARO POR EXCISÃO DE BASE... 2.4 REPARO POR EXCISÃO DE NUCLEOTÍDEO...
30 31 38 41 46 3. PROPOSIÇÃO... 53 4. MATERIAIS E MÉTODOS ...
4.1 IMPLICAÇÕES ÉTICAS... 4.2 CARACTERIZAÇÃO DO ESTUDO... 4.3 POPULAÇÃO ... 4.4 AMOSTRA... 4.5 PROCEDIMENTOS... 4.6 ANÁLISE ESTATÍSTICA...
26
27
1. INTRODUÇÃO
O câncer oral é o sexto tipo de câncer mais comum no mundo, e estima-se cerca de 275 mil novos casos por ano, nos paises em desenvolvimento, onde é considerado um problema de saúde pública (SAMAN, 2012). No Brasil, a estimativa para o ano de 2014, que também será válida para o ano de 2015, aponta a ocorrência de 11.280 casos novos de câncer da cavidade oral em homens e 4.010 em mulheres. Tais valores correspondem a um risco estimado de 11,54 casos novos a cada 100 mil homens e 3,92 a cada 100 mil mulheres. Nas regiões Sudeste e Nordeste, o câncer da cavidade oral em homens é o quarto mais frequente, já entre as mulheres é o nono mais frequente, nessas regiões (INCA, 2014).
As neoplasias malignas que acometem a cavidade oral são preferencialmente de origem epitelial, tecido que reveste a mucosa do trato aerodigestivo superior, e encontra-se mais exposto aos efeitos nocivos dos carcinógenos. Aproximadamente, 90% dos casos correspondem histologicamente ao carcinoma de células escamosas (CCE), também denominado de carcinoma epidermóide e carcinoma espinocelular (JEMAL et al., 2005; CORREA et al., 2011; ABRAM et al., 2012).
Alguns fatores de risco responsáveis pelo desenvolvimento do carcinoma de células escamosas oral (CCEO) já estão bem estabelecidos como, por exemplo, o tabaco (STURGIS et al., 2014). No entanto, o mecanismo da carcinogênese para o CCEO ainda é objeto de diversas investigações. Danos ao ácido desoxirribonucleico (DNA, do inglês deoxyribonucleic acid) desempenham um papel central na carcinogênese e, consequentemente, genes envolvidos no reparo desta molécula são considerados chaves, no desenvolvimento do câncer (KANAAR; WYMAN; ROTHSTEIN, 2008). Segundo Christman et al. (2003) são reconhecidos 5 mecanismos de ação distintos associados aos genes de reparo do DNA: (1) reparo de mismatch, (2) reparo por excisão de base, (3) reparo por excisão de nucleotídeo, (4) reparo por reversão direta do dano e (5) reparo da quebra de dupla fita.
28 na capacidade de reparo do DNA pode ser resultado de polimorfismos funcionais nestes genes, e alguns destes estudos sugerem que a presença de polimorfismos de nucleotídeos simples (SNPs, do inglês single-nucleotide polymorphisms), em genes de reparo, está relacionada ao desenvolvimento e evolução de vários cânceres, incluindo o CCEO (KIETTHUBTHEW et al., 2006; CANOVA et al., 2009; JELONEK et al., 2010; KUMAR et al., 2012; YUAN et al., 2012; HU et al., 2013; WU et al., 2014; CUI et al., 2014).
Atualmente, os estudos têm contribuído com grandes avanços científicos a respeito do carcinoma de células escamosas oral, no entanto o prognóstico para este tipo de câncer ainda é sombrio, com taxa de sobrevida estimada de 40%, em cinco anos (WARNAKULASURIYA, 2009). A imprevisibilidade em seu quadro evolutivo e as diferentes respostas do tumor diante de protocolos terapêuticos, por vezes equivalentes, traz à tona o importante papel que o organismo hospedeiro, com suas características genéticas, exerce na gênese e no comportamento biológico desta neoplasia. Polimorfismos genéticos levando a síntese de proteínas, por vezes, não funcionais ou com atuação modificada, têm demonstrado papel determinante no desenvolvimento e evolução de diversas neoplasias humanas (PEREZ-ORDONEZ; BEAUCHEMIN; JORDAN, 2006; HU et al., 2013). Desta forma, a identificação de biomarcadores que identifiquem indivíduos com maior predisposição ao CCEO é de extrema importância tanto para a prevenção primária, quanto para uma intervenção precoce e mais precisa (BAU et al., 2007).
30
31
2. REVISÃO DA LITERATURA
2.1 Carcinoma de Células Escamosas Oral
O câncer de cabeça e pescoço é um dos 10 tipos de câncer mais frequentes no mundo (CURADO; HASHIBE, 2009; VANDERWALDE et al., 2013; LARIZADEH et al., 2014), com uma estimativa de 500.000 novos casos diagnosticados anualmente (CHEN et al., 2008). Considerando todos os neoplasmas malignos, aproximadamente 5% dos mesmos ocorrem na região de cabeça e pescoço, e, destes, a metade envolve especificamente a cavidade oral, que ocupa a sexta posição dentre as neoplasias malignas mais comuns (KADEMANI et al., 2005; SCULLY; BAGAN, 2009; SAMAN, 2012).
De acordo com a 10ª revisão da Classificação Internacional de Doenças (CID), o termo câncer de cabeça e pescoço corresponde a neoplasias malignas de lábio (CID140), língua (CID141), gengiva (CID143), assoalho de boca (CID 144), mucosa jugal e outras partes não especificadas, orofaringe (CID146), hipofaringe (CID148) e outros sítios de cabeça e pescoço (CID149). Estudos epidemiológicos têm demonstrado uma grande variação de sua incidência nas diferentes áreas no mundo, sendo relatado que este neoplasma é mais comum no sudoeste da Ásia, compreendendo de 35 a 40% de todas as malignidades da Índia (CHEN et al., 2008). Ragin et al. (2007) mencionam que este tipo constitui um grupo heterogêneo de neoplasias que inclui tumores em diferentes sítios, cada um com características peculiares e particulares em relação a epidemiologia, características patológicas e tratamento. Sendo assim, na tentativa de buscar resultados mais consistentes, é importante focar em localizações menos amplas e em um único tipo histológico.
A última estimativa realizada no Brasil, pelo Instituto Nacional do Câncer (INCA), para os anos de 2014/2015, aponta o surgimento de 15.290 novos casos de câncer na cavidade oral, sendo que destes, 11.280 ocorrerão em homens e 4.010 em mulheres. Na região Nordeste, esta neoplasia maligna, ocupa o quarto lugar entre os cânceres mais frequentes em indivíduos do sexo masculino (INCA, 2014).
32 epidermóide e carcinoma espinocelular é o mais frequente, perfazendo mais de 90% de todos os casos neste sítio anatômico (ABRAM et al., 2012).
Conforme relatos de Frydrych et al. (2014), os carcinomas de células escamosas orais (CCEO) consituem uma doença de adultos com idade superior a 40 anos, do gênero masculino, embora alguns relatos recentes apontem um aumento de sua incidência em pacientes jovens abaixo de 40 anos. As características clínicas do CCEOs são bastante variáveis e o mesmo pode se apresentar com aspectos leucoplásicos, eritroplásicos, eritroleucoplásicos, exibindo ou não ulcerações com o tempo e crescimento exofítico, endofítico e/ou verrucoso. Tais lesões em geral são assintomáticas, embora nos casos mais avançados a dor possa estar presente. No entanto, em relação as suas características clínicas, o CCEO pode apresentar-se de modo similar a outras condições orais inflamatórias inócuas, sendo, desta forma, imprescindível a realização de biópsia para o estabelecimento do diagnóstico e posterior tratamento (KADEMANI et al., 2005; NEVILLE et al., 2009).
O principal sítio de acometimento desta neoplasia maligna, de acordo com a maioria dos estudos, é a língua (WARNAKULASURIYA, 2009; SAMAN, 2012; FRYDRYCH et al., 2014). No entanto, outras localizações podem ser atingidas, como assoalho bucal, mucosa jugal, lábios, gengiva e palato (NEVILLE et al., 2009). Ariyoshi et al. (2008) observaram que em 1816 casos de câncer oral, o carcinoma de células escamosas correspondia a 88,7% de todos os casos, e destes, 59,2% acometeram homens, com idade média de 65,2 anos, e a localização mais frequente foi a língua (40,2%), seguida pela gengiva (32,7%), mucosa jugal (10,1%) e assoalho bucal (9,0%). Mahimkar et al. (2012), avaliando 187 casos deste neoplasma, observaram que os homens com mais de 48 anos foram os mais acometidos e a língua foi a localização mais frequente. Na Índia, a mucosa jugal é a localização mais afetada em decorrência do hábito de mascar produtos derivados do tabaco (GHOSHAL et al., 2006).
33 replicação genética ou no processo de reparo do DNA. Mutações nos genes que controlam a progressão do ciclo celular e de genes de reparo de DNA são eventos iniciais no desenvolvimento do câncer de cabeça e pescoço (FELLER et al., 2010). Estes eventos podem ser desencadeados por fatores extrínsecos e/ou intrínsecos como estilo de vida, fatores ambientais e susceptibilidade individual (SCULLY; BAGAN, 2009). Dos fatores extrínsecos, o fumo e o álcool constituem os principais fatores de risco para o surgimento deste neoplasma (O'REGAN et al., 2006).
O fumo eleva a carga de acetaldeído, quando acompanhado do consumo de álcool; e a ingestão de bebidas álcoolicas favorece a ativação dos pró-cancerígenos presentes no tabaco, devido ao aumento da ativação metabólica, induzida por um citocromo P450, presente na mucosa oral e no fígado (SCULLY; BAGAN, 2009). O uso do tabaco gera substâncias cancerígenas, tais como as nitrosaminas específicas do tabaco [N-nitrosonornicotina, 4-(metilnitrosamino)-1-(3-piridil)-1-butanona] e radicais livres, resultando em alterações nas enzimas antioxidantes glutationa-S-transferase, glutationa redutase, superóxido dismutase, catalase e glutationa peroxidase, bem como peroxidação de lipídios e tiol total (SCULLY; BAGAN, 2009; STURGIS et al., 2014).
34 Nos dias atuais, muita atenção é reservada ao possível papel dos vírus com potencial oncogênico na carcinogênese de cabeça e pescoço (SCULLY; BAGAN, 2009). A relação do papiloma vírus humano (HPV, do inglês human papiloma virus) com o desenvolvimento do CCEO foi sugerida primeiramente por Syrjänen et al. (1983); entretanto, o papel do HPV e de outros vírus, tais como o Epstein-Barr vírus (EBV) e o vírus Herpes Simples (HSV, do ingês human simple virus), no desenvolvimento do câncer oral, não está totalmente elucidado, e, assim, parece que tais vírus, logo após sua integração irreversível ao DNA da célula infectada, atuariam como coadjuvantes neste processo (OLIVEIRA et al., 2009). Termine et al. (2008) realizaram uma meta-análise, com 62 estudos anteriormente publicados, com relação a participação do HPV em CCE de cabeça e pescoço. Do total da amostra de 4852 casos de CCE, o HPV foi detectado em 34,5% deles. Syrjanen (2010) relata que em região de cabeça e pescoço os sítios mais relacionados ao desenvolvimento de CCE associados ao HPV 16 são as tonsilas e a orofaringe, reforçando que o aumento da incidência dos cânceres nesta região tem sido associado ao aumento da infecção por este vírus.
A respeito da dieta, tem-se destacado o papel da mesma na incidência dos cânceres epiteliais. Fatores dietéticos parecem estar envolvidos em aproximadamente 30% dos cânceres em países ocidentais, pelo fato do alto consumo de produtos animais, gordura e açúcar. A contribuição da dieta como fator de risco do câncer em países em desenvolvimento é menor, provavelmente em torno de 20%, onde a dieta é baseada em um ou dois tipos de alimentos que têm como matéria-prima o amido, baixa ingestão de produtos animais, gordura e açúcar (LEITE; GUERRA; MELO, 2005).
35 microinvasivo. Em casos mais avançados as células malignas podem se estender profundamente atingindo tecido muscular, nervoso, adiposo e/ou ósseo, podendo ainda causar destruição de vasos sanguíneos (NEVILLE et al., 2009).
Uma ferramenta bastante útil para avaliação do prognóstico dos CCEOs, com o intuito de prever uma melhor abordagem no tratamento do mesmo, é o
estadiamento clínico através do sistema TNM. O parâmetro “T” refere-se ao
tamanho em centímetros do tumor, o “N” à presença ou não de metástase tumoral
em linfonodos regionais e o “M” à presença ou não de metástases distantes. Após a quantificação destes parâmetros, os tumores são classificados em estágios que variam de I a IV e já é bem estabelecido na literatura que os CCEOs classificados no estágio I exibem melhor prognóstico que aqueles no estágio IV (KADEMANI et al., 2005). Além destes parâmetros clínicos, Jerjes et al. (2010) reportam que, especificamente para os cânceres orais, o sítio do tumor primário, espessura tumoral, envolvimento nodal, comprometimento de margens cirúrgicas e o efeito acumulativo do tabaco e álcool constituem importantes fatores de prognóstico.
As taxas de incidência e mortalidade para o CCEO variam de um país para outro e mesmo dentro de cada país. Essas variações ocorrem, principalmente, pelas diferenças de hábitos, características socioeconômicas, expectativa de vida, fatores ambientais, raça, educação preventiva e qualidade da assistência médica nas diversas regiões. A distribuição das taxas de incidência e de mortalidade de tumores malignos tem sido, em muitos países, de grande importância para o estabelecimento de diretrizes de políticas públicas em âmbito nacional, estadual e municipal e para o planejamento de ações de prevenção e controle do câncer, além de formas de tratamento ou assistência terapêutica. Dados estatísticos são essenciais aos programas de vigilância em saúde pública, pois permitem estimar a magnitude relativa dos problemas de saúde na população, facilitando o estabelecimento de prioridades em ações preventivas e terapêuticas (LEITE; GUERRA; MELO, 2005; SCULLY; BAGAN, 2009).
36 mais avançados e, como consequência deste atraso no diagnóstico, menos de 30% dos indivíduos são curados (EMERICK et al., 2013). Rose et al. (2011) detectaram em sua pesquisa que idades avançadas, pacientes da raça negra e a utilização de tratamento não cirúrgico são fatores que contribuem para o aumento na mortalidade dos pacientes portadores destes tumores. Os protocolos de tratamentos instituídos para tumores na cavidade oral são baseados na realização de cirurgia, radioterapia e quimioterapia com cisplatina (KOBERLE et al., 2010).
A cirurgia é o método de tratamento de preferência para a maioria dos pacientes com CCEO. A ressecção local isolada é tratamento exclusivo para pacientes com tumores em estágios iniciais ressecados com margens livres. O tratamento cirúrgico tem como objetivo a ressecção total da lesão e dissecção linfonodal cervical de risco. Com a cirurgia existe a possibilidade de uma maior avaliação do tipo histológico, grau de invasão tumoral e metástases linfonodais. O resultado dessa avaliação histológica culmina em um estadiamento mais detalhado que poderá ser usado para avaliar a necessidade de tratamento adjuvante (SHIM et al., 2010).
O prognóstico de pacientes portadores de CCEO está significativamente relacionado com a presença de linfonodo cervical metastático. A condição linfática parece ser o maior determinante da evolução clínica do paciente (PREUSS et al., 2007). Segundo Dinshaw et al. (2005), o sítio primário e o status linfonodal são preditores independentes dos resultados após cirurgia e radioterapia adjuvante.
A radioterapia (RT) é um tratamento extremamente eficaz para tumores da cabeça e pescoço, tanto como modalidade primária, como adjuvante à cirurgia (BHIDE; NUTTING, 2010). A maioria dos pacientes em radioterapia recebe uma dose total de 50-70 Gy (do inglês, Gray) com objetivo curativo. Essa dose é fracionada durante um período de 5-7 semanas, uma vez por dia, cinco dias por semana, com uma dose diária de cerca de 1,8-2Gy. A justificativa para aplicações diárias de pequenas frações é que os tecidos normais sejam poupados e os efeitos colaterais da radioterapia minimizados (BERNIER et al., 2005).
37 radioterapia tenha melhorado as taxas de controle local os resultados em relação à cirurgia isolada não eram animadores, com sobrevida global de 30% em cinco anos. Na tentativa de melhorar estes resultados, a Organização Européia para Pesquisa e Tratamento do Câncer (EORTC, do inglês European Organization for Research and treatment to Cancer) e o Grupo de Oncologia e Radioterapia (RTOG, do inglês Radiotherapy Oncology Group) realizaram dois ensaios clínicos avaliando a inclusão de quimioterapia (BERNIER et al., 2004; BERNIER et al., 2005). Ambos os estudos encontraram melhora no controle loco-regional e sobrevida livre de doença nos pacientes que receberam cisplatina em relação aos que receberam radioterapia isolada. Com base nesses dois estudos, a cisplatina com radioterapia pós-operatória tornou-se padrão no cuidado para pacientes com alto risco.
Complicações orais da radioterapia são frequentes. As reações adversas irão depender do volume, da área a ser irradiada, da dose total, do fracionamento, da idade, das condições clínicas do paciente e dos tratamentos associados. Reações agudas ocorrem durante o tratamento e na maioria das vezes, são reversíveis. As complicações tardias são normalmente irreversíveis, levando à incapacidade permanente em geral com piora da qualidade de vida. Dentre as complicações pós-radioterapia, pode-se citar: 1) mucosite, que é definida como uma inflamação na mucosa e é um importante evento adverso que pode interferir no processo da radioterapia, alterar o controle local do tumor e, portanto, a sobrevida do paciente; 2) infecções bucais causadas por fungos e bactérias; 3) disfagia, que é a alteração do paladar e surge a partir da segunda ou terceira semana da radioterapia; 4) cárie de radiação, cujo principal causa é a diminuição da quantidade e alteração na qualidade da saliva; 5) osteorradionecrose, que é a necrose isquêmica do osso causadas pela radiação, sendo uma das mais graves consequências da radioterapia, causando dor, bem como possível perda substancial da estrutura óssea; e 6) xerostomia, que é a sensação de "boca seca”, uma das queixas mais frequentes entre os pacientes irradiados na região da cabeça e pescoço (JHAM; DA SILVA FREIRE, 2006; KIYOMOTO, 2007; KO; CITRIN, 2009; KRSTEVSKA, 2009; DIRIX; NUYTS, 2010).
38 quimioterapia de indução não demonstrou benefício quando comparado à quimioterapia concomitante, mesmo com a associação do 5-fluoracil, a cisplatina. A quimioterapia concomitante é o esquema padrão e está associada a um aumento de 8% na sobrevida quando comparado a esquemas com radioterapia exclusiva. A maioria dos estudos usa a Cisplatina com dose de 100 mg/m2, por três ciclos, durante o curso da radioterapia (BOURHIS et al., 2006).
Em resumo a adição da quimioterapia concomitante a radioterapia parece aumentar a taxa de controle e sobrevida, com um aumento aceitável da toxicidade (HARTLEY et al., 2010). No entanto, apesar dessas agressivas modalidades de tratamento, a recidiva local ou persistência da doença é vista em taxas que chegam a 50% e a sobrevida global em 5 anos não ultrapassa 45%, na maioria dos estudos (WARNAKULASURIYA, 2009; FRYDRYCH et al., 2014).
Nesse contexto, torna-se importante entender o papel que o organismo hospedeiro, com suas características genéticas, exerce na gênese e no comportamento biológico desta neoplasia. Para tal, tem sido demonstrado que a presença de polimorfismos em genes de reparo do DNA pode atuar tanto como fator de risco para o desenvolvimento de vários tipos de cânceres, quanto na evolução e prognóstico de neoplasias malignas de mama (GAO et al., 2011), da região colorretal (KRUPA et al., 2011) e da região de cabeça e pescoço (CARLES et al., 2006; SLIWINSKI et al., 2011; PRATESI et al., 2011).
2.2 Genes do Reparo do DNA
39 reconhecidos e corrigidos a fim de evitar erros sequenciais e acumulativos. (KANAAR; WYMAN; ROTHSTEIN, 2008).
O genoma humano, como outros genomas, tem a capacidade de codificar informações que protegem a sua própria integridade. As enzimas de reparo do DNA continuamente monitoram os cromossomos para corrigir danos aos resíduos de nucleotídeos gerados pela exposição à carcinógenos e compostos tóxicos. O dano é parcialmente uma consequência de fatores ambientais, como radiação ultravioleta, fumo de cigarro ou fatores da dieta ainda indefinidos, contudo, uma grande proporção de alteração do DNA é causada por fatores mutagênicos endógenos, como espécimes reativas do oxigênio e metabólitos que podem agir como agentes alquilantes (WOOD et al., 2001; KANAAR; WYMAN; ROTHSTEIN, 2008).
O processo de reparo a danos ao DNA depende da atuação de algumas dezenas de enzimas, que trabalham coletivamente reconhecendo uma base alterada, removendo-a ao cortar o filamento do DNA. Estima-se que esses mecanismos de reparo corrijam 99,9% dos erros iniciais. (EMANUEL; SCHEINFELD, 2007; KANAAR; WYMAN; ROTHSTEIN, 2008).
O reconhecimento e a correção apropriados de dano ao DNA requerem a integridade da maquinaria de reparo para manter a funcionalidade celular normal. Uma resposta ao dano do DNA defeituosa pode resultar em apoptose ou pode levar à instabilidade genômica, crescimento celular desregulado e um aumento no risco de câncer. Há uma considerável variação na resposta individual ao dano no DNA. Enquanto alguns indivíduos têm uma capacidade de reparo apropriada, pacientes com defeitos nestas vias, tais como aqueles com xeroderma pigmentoso (XP), são mais suscetíveis ao câncer (FLORES-OBANDO; GOLLIN; RAGIN, 2010).
40 BRCA, XRCC-3 e RAD51; e 2.5) reparo por reversão direta do dano, como o MGMT (CHRISTMANN et al., 2003).
Alterações nestes genes podem contribuir para o desenvolvimento de variadas doenças de naturezas diversas. Dentre estas alterações, a literatura tem destacado a presença de polimorfismos genéticos (ARAKAKI; MARQUES; SANTOS, 2009).
Segundo Kumar, Abbas, Fausto (2005), uma revelação surpreendente advinda do sequenciamento do genoma humano é de que a notável diversidade dos seres humanos é codificada em torno de 0,1% do DNA (cerca de 3 milhões de pares de bases), pois dois indivíduos diferentes compartilham, em média, aproximadamente 99,9% das suas sequências de DNA. Adicionalmente, citam que muito provavelmente os segredos da predisposição para doenças e para a resposta a agentes ambientais e a drogas deve residir nestas regiões variantes.
No campo dos estudos moleculares, atualmente tem-se buscado avaliar se o grande número de polimorfismos genéticos encontrados no genoma humano pode estar relacionado às diferenças de expressão proteica capaz de alterar o fenótipo celular e/ou tecidual, aumentando ou não o risco de desenvolvimento de vários distúrbios, condições e doenças de natureza variada, tais como as doenças cardiovasculares, neoplasias benignas e malignas (ARAKAKI; MARQUES; SANTOS, 2009).
41 atividade aumentada (YE, 2000). Estima-se que um milhão de SNPs (um para cada mil nucleotídeos) possa existir no genoma humano, dos quais 60 mil estão em regiões que codificam proteínas (RA; PARKS, 2007).
Os polimorfismos são responsáveis pela diversidade humana. Diferentes fenótipos são decorrentes de diferentes polimorfismos, como o sistema ABO. De outro modo, os polimorfismos podem influenciar diretamente sobre fatores de risco associados ao desenvolvimento e evolução de doenças (KUMAR; ABBAS; FAUSTO, 2005).
Diante do exposto, ressalta-se que apesar da importância dos fatores extrínsecos e hábitos deletérios relacionados à carcinogênese oral, um número relativamente baixo de pessoas expostas a tais fatores irão desenvolver o câncer oral. Assim, parece que a susceptibilidade genética individual tem papel fundamental no desenvolvimento deste tipo de câncer. Além disso, estratégias de prevenção e tratamento do câncer serão extremamente influenciadas quando for possível identificar na população, aqueles indivíduos considerados de risco ao desenvolvimento do câncer (LEITE; GUERRA; MELO, 2005). Sendo assim, torna-se necessária a realização de estudos que analisem a relevância funcional de SNPs, em especial, no carcinoma de células escamosas oral.
2.3 Reparo por Excisão de Base
42 Vários genes tais como o X-ray repair cross-complementing group 1 (XRCC1), apurinic/apyrimidinic endonuclease 1 (APEX1), 8-oxoG-DNA glicosilase (OGG1) e Poly (ADP-Ribose) Polymerase 1 (PARP1) possuem fundamental importância na via BER e estudos no campo da genética verificaram que esses genes possuem polimorfismos com potencial para modular a função e alterar a capacidade do reparo (CHRISTMANN et al., 2003; CHEADLE; SAMPSON, 2007).
A XRCC1 é conhecida como uma importante proteína envolvida no BER, participando como uma proteína multidomínio que serve como âncora desse mecanismo, interagindo com e estimulando a maioria das enzimas envolvidas nesse processo. Sua importância na estabilidade genética está indicada pela alta frequência de aberrações cromossômicas espontâneas e deleções em células XRCC1 mutantes e pela letalidade embrionária em camundongos nocaute XRCC1 (GINSBERG et al., 2011; JAREMKO et al., 2007).
O gene da proteína XRCC1 está localizado no cromossomo 19q13.2 com um comprimento de 32 kb, incluindo 17 éxons. A proteína caracteriza-se pela presença de 633 aminoácidos e um peso de 70 kDa. A XRCC1 não possui atividade catalítica por si própria, mas age tanto como uma plataforma como um modulador de diferentes atividades envolvidas no BER e na quebra de fita simples do DNA (LOU et al., 2013; GINSBERG et al., 2011). Há interação e formação de complexo com as
proteínas DNA polimerase β (Pol β), DNA ligase III e PARP1 através das regiões
N-terminal, C-terminal e central da XRCC1, respectivamente, e com a polinucleotídeo quinase humana, trazendo estas ao sítio de dano ao DNA. Dessa forma, a XRCC1 fornece uma ligação física nas etapas de incisão e ligação do BER (GINSBERG et al., 2011; JAREMKO et al., 2007).
43 diretos, como a oxidação ou alquilação, a BER segue a via longa, pois a Pol β não
pode remover a porção terminal 5’-dRP porque ela está oxidada ou reduzida, sendo
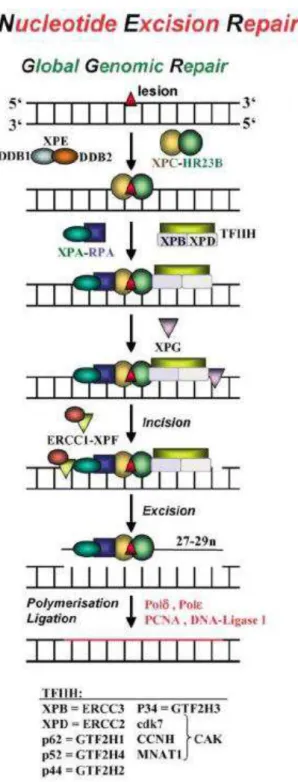
necessário recrutamento de outras proteínas como a PCNA (do inglês, proliferating cell nuclear antigen) e FEN1 (do inglês, Flap endonuclease-1) (GINSBERG et al., 2011) (Figura 1).
44 Alguns polimorfismos de um único nucleotídeo no gene da XRCC1 foram descritos. Os mais comuns são os que correspondem ao códon 194 (mudança de arginina para triptofano – Arg194Tri), ao códon 280 (arginina para histidina – Arg280His), e ao códon 399 (arginina para glicina – Arg399Gln). Estes SNPs podem influenciar a interação da proteína com outras enzimas do BER, pois ocorrem em regiões evolutivamente conservadas que são importantes para a função da XRCC1. Como consequência, podem alterar a eficiência da atividade de reparo, pois alteram a interação proteína-proteína (JAREMKO et al., 2007; HAKEM, 2008; GINSBERG et al., 2011).
O SNP XRCC1 Arg399Gln no domínio de ligação PARP pode afetar a montagem deste domínio e a eficiência do reparo, o que embasa a correlação e associação com a susceptibilidade a vários cânceres (HAKEM, 2008; ZHAO et al., 2011). Assim, estudos moleculares têm verificado resultados interessantes e controversos a respeito da associação de polimorfismos do gene XRCC1 em carcinoma de células escamosas de cabeça e pescoço. Matullo et al. (2006) verificaram que o SNP XRCC1 Agr399Gln modificou os efeitos do fumo, mas não do álcool, sendo um risco de 3,9 para os fumantes. Esses dados foram consistentes com os apresentados por Ramachandran et al. (2006). Neste último estudo, eles notaram um risco duas vezes maior do hábito de fumar com este polimorfismo para o desenvolvimento do câncer. Khlifi et al. (2013) constataram um risco aumentado de câncer na região de cabeça e pescoço em uma população da Tunísia, enquanto Tae et al. (2004), Lou et al. (2013) e Wu et al. (2014) não evidenciaram associação significante entre a presença do polimorfismo XRCC1 (Arg399Gln) e o risco de desenvolver câncer de cabeça e pescoço
45 oxigênio, como o peróxido de hidrogênio e ácido hipocloroso e a expressão do APEX1 parece correlacionar com a sensibilidade celular ao estresse oxidativo (KUASNE et al., 2011; ZHAO et al., 2011).
Tem sido relado que a desregulação do gene APEX1 possa estar relacionada ao risco aumentado de câncer de cabeça e pescoço (MAHJABEEN et al., 2013); além disso sua superexpressão possui uma relação com a resistência de células tumorais às drogas alquilantes, enquanto a baixa expressão está associada com sensibilidade a etoposida ou cisplastina (BHAKAT; MANTHA; MITRA, 2009). Um recente estudo imuno-histoquímico verificou que houve um aumento de expressão progressivo em epitélio de mucosa oral para o neoplásico em carcinoma de células escamosas de lábio, sugerindo que o APEX1 pode contribuir em eventos precoces da carcinogênese de lábio. Os autores acreditam que a alta expressão dessa proteína nesse câncer esteja envolvida com alguma alteração da via do APEX1, sendo necessário mais estudos clínicos para elucidar o potencial valor prognóstico da mesma (SOUZA et al., 2011).
Quanto ao risco de desenvolver carcinoma de células escamosas de cabeça e pescoço, Li et al. (2007) analisaram o SNP APEX1 Asp148Glu (mudança de aspartato para glutamina no códon 148) em 830 pacientes e não observaram evidência de uma interação entre esse polimorfismo e a etiologia do câncer. Yuan et al. (2012) não constataram associação desse SNP com o risco para o carcinoma de células escamosas de cabeça e pescoço nem de forma isolado, nem somado ao hábito de beber ou fumar. Diferenças étnicas e de tipos de cânceres podem ofuscar as conclusões, pois em pacientes japoneses o SNP APEX1 Asp148Glu aumentou o risco de câncer de pulmão (ITO et al., 2004), enquanto em pacientes caucasianos houve uma redução no risco de desenvolvimento de melanoma (LI et al., 2006).
46 2.4 Reparo por Excisão de Nucleotídeo
A via de reparo de DNA por excisão de nucleotídeo (NER, do inglês nucleotide excision repair) inclui mais de 35 genes e possui a função de remover danos induzidos por raios ultravioleta (dímeros de pirimidina) e adutos de DNA associados com exposição a agentes químicos (WOGAN et al., 2004).
NER é um dos principais meios pelo qual as células de mamíferos removem as lesões de DNA causadas por agentes endógenos e exógenos. A via NER repara lesões volumosas, como dímeros de pirimidina, outros fotoprodutos ultravioletas, adutos químicos volumosos e cross-links. No processo de reparo, os produtos de mais de uma dúzia de genes estão envolvidos nesta via, que envolve pelo menos quatro etapas: (a) o reconhecimento do dano por um complexo de proteínas ligadas incluindo XPC (do inglês, Xeroderma pigmentosum complementation group C), (b) anulação do DNA pelo complexo TFIIH (do inglês, transcription factor II H) que inclui XPD (do inglês, Xeroderma pigmentosum complementation group D); (c) remoção do fragmento danificado single-stranded (geralmente cerca de 27-30 pb) por moléculas incluindo ERCC1 (do ingles, excision repair cross-complementing rodent repair deficiency, complementation group 1) e complexo XPF (do inglês, Xeroderma pigmentosum complementation group F) e (d) a ligadura para restaurar a estrutura de DNA normal. Proteínas envolvidas nestes quatro passos foram identificadas por meio de estudos de reparo ao DNA em indivíduos com xeroderma pigmentoso (XP) (HAKEM, 2008).
47 DNA. Ocasionalmente, a enzima DNA-ligase III une as extremidades formadas pela remoção dos nucleotídeos (CHRISTMANN et al., 2003; JENSEN et al., 2011) (Figura 2).
48 A via de reconhecimento que envolve o complexo XP é denominada Reparo de Genoma Global (global genome repair) e corrige falhas em todo o genoma. O reconhecimento do dano pelo Reparo de Transcrição Unida (transcription-coupled repair), que repara genes ativamente transcritos, envolve o retardo da RNA-polimerase, seguido pelo recrutamento de moléculas sinalizantes, como as proteínas CSA (Cockayne syndrome group A) ou CSB (Cockayne syndrome group B) (JENSEN et al., 2011).
O XPD, também conhecido como ERCC2 (excision repair cross-complementing rodent repair deficiency, complementation group 2) é um tipo de gene de reparo de DNA por excisão de nucleotídeos. Esta via é uma das mais importantes na remoção de danos no DNA causados por carcinógenos do tabaco, bem como de distorções na dupla hélice que podem interferir no pareamento das bases obstruindo a replicação e a transcrição, além de reparar danos causados por drogas alquilantes, análogos da platina e radiação (AN et al., 2007).
O produto do XPD é uma helicase dependente de trifosfato de adenosina (ATP, do inglês adenosine triphosphate), constituindo uma subunidade do complexo do fator de reparo de transcrição TFIIH. Um dos polimorfismos do XPD mais pesquisados é o Lys751Gln (mudança de Lisina por glicina no códon 751), ocasionado pela troca C/A, sendo relacionado com a ocorrência de carcinomas de mama de baixo grau (DUFLOTH et al., 2008).
Pesquisas têm sido realizadas almejando associação de polimorfismos neste gene com o desenvolvimento de neoplasias humanas, citando Liu et al. (2007) que observaram um aumento na frequência de adenocarcinoma de esôfago em associação com o XPD Lys751Gln em uma população caucasiana da américa do norte. Ye et al. (2006) sugeriram em seu estudo que o polimorfismo anteriormente citado seria um marcador genético em potencial para avaliar a susceptibilidade para o adenocarcinoma de esôfago, encontrando uma correlação positiva para o polimorfismo e esta neoplasia em uma população escandinava.
49 Lys751Lys resulta em um reparo inadequado de danos no DNA induzidos por raios-X. Os autores verificaram que o polimorfismo XPD Lys751Gln estava relacionado a um efeito protetor contra a doença de refluxo gastro-esofágico, esofagite de Barret e adenocarcinoma de esôfago. Para estes, o fenótipo maligno estava relacionado com um desequilíbrio em polimorfismos em genes de reparo de excisão de nucleotídeos: um aumento de risco com o XPC e uma diminuição com o XPD.
Sliwinski et al. (2011) em seu estudo avaliaram a frequência de diversos polimorfismos em CCE de cabeça e pescoço. Estes autores observaram uma maior frequência do genótipo heterozigoto do XPD Lys751Gln (58%) e não encontraram diferença estatística na distribuição dos genótipos entre os grupos de pacientes estudados. Neste estudo, houve uma associação estatística significante do polimorfismo do XPD com uma maior ocorrência de câncer de cabeça e pescoço apenas quando este foi correlacionado com outros polimorfismos estudados, como OGG1 Ser326Cys. Em uma meta-análise, Yuan et al. (2011) demontraram que polimorfismo no gene XPD Lys751Gln pode ser um marcador preditivo para o risco de câncer de cabeça e pescoço. Já Kumar et al. (2012) encontraram resultados semelhantes em um grupo de pacientes com carcinoma de células escamosas de cabeça e pescoço, entre os quais, foi observado um aumento do risco tanto na análise isolada, quanto associada ao hábito de beber ou fumar.
Dentre os genes envolvidos no reparo do DNA na via NER, também se menciona o gene XPF ou ERCC4 (do ingles, excision repair cross-complementing rodent repair deficiency, complementation group 4), que foi inicialmente identificado a partir de indivíduos com xeroderma pigmentoso do grupo F. Esse gene possui uma sequência de 2751 pb de comprimento, é composto por 11 exons e codifica uma proteína chave de mesmo nome (ERCC4 ou XPF) que forma um complexo estável com a proteína ERCC1 e realiza uma incisão na terminação 5’ da lesão reconhecida do DNA, enquanto que a proteína XPG realiza uma incisão na terminação 3’ da lesão (FAN et al., 1999).
50 A compreensão do mecanismo de resistência a drogas na terapia do câncer é necessária para o desenvolvimento de novas estratégias terapêuticas, e pesquisadores têm correlacionado uma sobrerregulação de vários genes bem conhecidos de reparo de DNA com resistência às drogas (KOBERLE et al., 2010). A relação do XPF com resistência a drogas pode ser deduzida a partir de estudos sobre seu parceiro ERCC1. Sua expressão nunca foi concordante quando observadas juntamente com a expressão de TDP1 (do inglês, Tyrosyl-DNA phosphodiesterase 1) em carcinoma de pulmão. Conhecimento da situação destes genes pode ajudar a compreender que via pode contribuir para a resistência às drogas em terapias inibidoras TDP1, e podem ser candidatos à terapia combinada. No estudo realizado por Spitz et al. (2003) constatou-se que a expressão de TDP1 e XPF esteve aumentada em mais de 50% das amostras de câncer de pulmão, e a atividade de TDP1 tinha aumentado em conformidade. Superexpressão de TDP1 e XPF é comum em câncer de pulmão e é, portanto, de interesse como um possível contribuinte de resistência a drogas.
51 média foi de 88,3 meses para pacientes com XPF/ERCC1 Lys259Lys e 89,9 meses para aqueles com Lys259Thr, em contraste com os 27,9 meses para pacientes com Thr259Thr. Além disso, foi constatado que a combinação de SNP em mais de um gene pode afetar em maior escala a capacidade de reparo do DNA do que um SNP em um gene sozinho.
Tem sido demonstrado que um risco aumentado de CCE de cabeça e pescoço está associado com redução da capacidade de reparo do DNA. Na pesquisa de Wei et al. (2005), foi verificado que os casos de CCE tinham níveis mais baixos de expressão para todas as proteínas NER, particularmente XPC e XPF, com redução em cerca de 25%. Além disso, houve associação da baixa expressão XPF com um maior risco para o desenvolvimento de CCE de cabeça e pescoço (OR, 5,29; IC 95%, 2,01-13,9).
Estudos têm relatado que a via NER pode estar associada à resistência de células tumorais à cisplatina na terapia do câncer. Tumores testiculares de células germinativas têm mostrado menor sensibilidade a cisplatina, e isso tem sido correlacionado a baixos níveis do complexo de proteína NER, ERCC1/XPF (WELSH et al., 2004). Pouco se sabe sobre os níveis de ERCC1-XPF em tecidos e em linhagens de células de CCE de cabeça e pescoço. Koberle et al. (2010) investigaram mRNA e níveis da proteína ERCC1 e XPF em linhagens de células de CCE de cabeça e pescoço e linhagens de células tumorais de testículos e examinou a correlação entre níveis de ERCC1 e XPF e a resistência celular à cisplatina. Esse estudo não revelou diferença significativa na expressão de mRNA do ERCC1 ou XPF nas linhagens analisadas; no entanto, os resultados indicaram uma contribuição da proteína XPF com a resistência à cisplatina. Posteriormente, a expressão da proteína XPF e ERCC1 foi investigada em tecido de CCE de cabeça e pescoço e foram encontrados níveis significativamente maiores de XPF em pacientes com metástases. Estes resultados indicam uma contribuição da proteína XPF a quimiorresistência à cisplatina, além de sugerir que o CCE de cabeça e pescoço com metástases possuem menor capacidade de resposta à cisplatina.
53
54
3. PROPOSIÇÃO
55
56
4. MATERIAIS E MÉTODOS
4.1 Implicações éticas
O presente trabalho é parte integrante da pesquisa intitulada “Correlações clinicopatológicas, imuno-histoquímicas e de resposta ao tratamento quimioterápico e radioterápico com polimorfismos em genes do reparo do DNA em pacientes com
Carcinoma de Células Escamosas de Cabeça e Pescoço”, que foi aprovado pelo
Comitê de Ética em Pesquisa do Hospital Dr. Luiz Antônio da Liga Norte-riograndense Contra o Câncer sob protocolo número 022/022/2014. Todos os pacientes selecionados para participar do estudo foram devidamente esclarecidos quanto aos seus objetivos e, caso concordassem em participar, foram convidados a assinar o Termo de Consentimento Livre e Esclarecido (TCLE – APÊNDICE A).
4.2 Caracterização do estudo
O presente trabalho representou um estudo coorte longitudinal prospectivo. E foi constituído pela análise e registro de polimorfismos nos genes das proteínas de reparo de DNA (XRCC1, APEX1, XPD e XPF) em uma série de casos de carcinoma de células escamosas oral (CCEO).
4.3 População
57 4.4 Amostra
A amostra desta pesquisa foi constituída de pacientes com CCEO, maiores de 18 anos de idade. Os critérios de inclusão, para a avaliação de risco de desenvolver CCEO, foram os seguintes: ter diagnóstico histopatológico de CCEO e ser maior de 18 anos de idade. Já para a avaliação do prognóstico, foram considerados os seguintes critérios de inclusão: ter diagnóstico histopatológico de CCEO nos anos de 2011 a 2013; ter iniciado o tratamento antineoplásico; e ter as informações, sobre o desfecho clínico da neoplasia, registradas no prontuário. Critérios de inclusão que viabilizavam a realização das técnicas de biologia molecular também foram considerados: ter uma quantidade suficiente de sangue coletado do paciente e ter quantidade suficiente e qualidade adequada de DNA extraído. Os casos que não se enquadraram aos critérios de inclusão, citados anteriormente, foram excluídos da pesquisa.
Adicionalmente, para verificar se os polimorfismos em estudo, nos pacientes com carcinoma de células escamosas oral, encontravam-se em consonância com a Lei de Hardy-Weinberg, foram utilizadas amostras de DNA armazenadas no Laboratório de Análises Clínicas da Faculdade de Farmácia da Universidade Federal do Rio Grande do Norte. Estas amostras eram de indivíduos que, de acordo com a história médica pregressa, não possuíam relato de câncer, sendo um material armazenado, previamente utilizado em projeto de pesquisa já executado e aprovado pelo Comitê de Ética e Pesquisa da Universidade Federal do Rio Grande do Norte.
4.5 Procedimentos
4.5.1 Coleta dos dados clínicos
58 foram, inicialmente, anotados em fichas clínicas elaboradas para a pesquisa (APÊNDICE B, C e D).
4.5.2 Coleta de sangue
Após a entrevista, procedeu-se a coletada de sangue (4 ml) em tubos a vácuo contendo EDTA (vacutainer®), de onde, posteriormente, foi realizada a extração do DNA. Esta amostra de sangue era obtida no mesmo momento da coleta de sangue, para resultados de exames complementares solicitados pelos médicos do hospital. Desta forma, em única punção era coletado o sangue para a pesquisa e para a realização dos exames complementares.
4.5.3 Extração do DNA
As amostras sanguíneas foram coletadas em tubos a vácuo com EDTA (sistema Vacutainer®) e transferidas para um tubo falcon de 15 ml para serem centrifugadas a 2000 rpm, por 10 minutos, a 4ºC. Após a centrifugação, o plasma foi separado do pellet de células, e o sobrenadante de plasma foi descartado. Ao pellet foram acrescidos 5 volumes de tampão para lise de hemácias (0.1M cloreto de amônio, 0.01M bicarbonato de amônio e água MiliQ qsp 1 litro). Após a adição, a amostra foi agitada vigorosamente por 30 segundos, em seguida incubada em gelo por 15 minutos, sendo agitada por 30 segundos a cada 5 minutos. Após este procedimento, a amostra foi centrifugada a 2000 rpm, por 15 minutos, a 4ºC, e o sobrenadante foi descartado. Novamente, foram adicionados 5 volumes do tampão de lise de hemácias e o passo foi repetido. Ao fim, após a obtenção do pellet de leucócitos, foi realizado o procedimento de precipitação salina de acordo com o protocolo descrito por Miller et al. (1988).
59 solução saturada de NaCl (6M) que, em seguida, foi mantida no vórtex, em velocidade média, por 15 minutos. Logo após, a amostra foi centrifugada a 2500 rpm, por 15 minutos, a 20 ºC. O sobrenadante foi transferido para outro tubo falcon de 15 ml onde foi acrescido 2 volumes de etanol absoluto a -20ºC. O tubo foi invertido diversas vezes até a precipitação do DNA. As fitas de DNA foram coletadas com auxílio de microponteiras e transferidas para microtubos contendo 200 µl de tampão TE (10mM Tris-HCl, 0.2 mM Na2EDTA pH 7.5). O material foi incubado por 2 horas a 37 ºC antes de ser quantificado e analisados em gel de agarose.
4.5.4 Avaliação da eficiência da extração do DNA
O DNA extraído do sangue foi avaliado quantitativa e qualitativamente. Para verificar sua eficácia, todas as amostras foram submetidas à análise por espectrofotometria e por eletroforese em gel de agarose a 1% corado com SYBR Green®. A espectrofotometria para quantificação da concentração e pureza do DNA extraído foi realizada através de aparelho de precisão (Nanovue, GE Healthcare Life Sciences, UK) pela razão A260nm/A280nm.
4.4.5 Genotipagem da amostra
60 foram anotados em fichas (APÊNDICE E). A genotipagem foi repetida aleatoriamente em 10% das amostras.
4.6 Análise estatística
As informações demográficas, clínicas, as referentes ao seguimento e a análise da genotipagem dos SNPs das proteínas de reparo nos casos de carcinoma de células escamosas oral e grupo controle foram tabuladas no software Microsoft Excel (Microsoft Corporation, USA) e posteriormente transferidas para o software GraphPad Prism version 6.0.1 para análise estatística.
As frequências alélicas para cada polimorfismo das proteínas de reparo nos grupos foram determinadas por contagem gênica direta. Foi aplicado o binômio p2 + 2pq + q2 para definição da frequência genotípica da Lei de Hardy-Weinberg (frequência esperada) através das frequências alélicas encontradas nos indivíduos com carcinoma de células escamosas oral, grupo controle e amostra total. De posse dos percentuais das frequências esperadas, foi utilizado o teste 2 para associá-las com os percentuais das frequências observadas. Dessa forma, foi verificado se a distribuição dos alelos na amostra estudada encontrava-se dentro do equilíbrio de Hardy-Weinberg.
Na caracterização da amostra – teste do qui-quadrado (gênero, consumo do álcool e tabagismo) e o de Levene (idade);
61 prognóstico, a relação entre os genótipos dos SNPs com sobrevida livre de doença e sobrevida específica foi analisada por meio da curva de Kaplan-Meier (Logrank test). Além disso, a análise multivariada de Cox foi realizada para verificar todos os parâmetros estudados com sobrevida livre de doença e sobrevida específica.
62
63
5. RESULTADOS
5.1 Caracterização da amostra
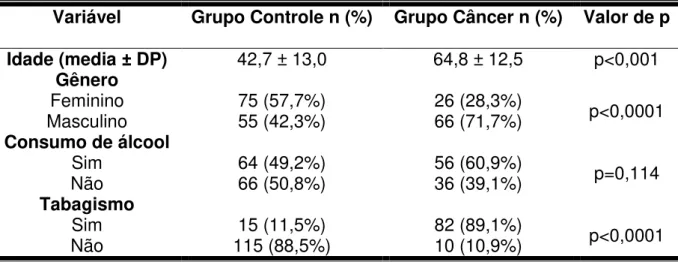
A amostra deste estudo foi composta de 92 casos de pacientes com carcinoma de células escamosas oral (CCEO) e 130 casos de controle. A média de idade dos pacientes com CCEO foi de 64,8 ± 12,5 (mínimo de 41 e máximo de 94 anos). De acordo com o gênero, a maioria foi composta por homens (n=66, 71,7%). Em relação ao álcool e tabaco, percebeu-se um consumo mais expressivo entre os pacientes com CCEO (n=56, 60,9% para o álcool; n=82, 89,1% para o tabaco). As características demográficas dos pacientes, com CCEO e controle, encontram-se listadas na tabela 1. Houve associação estatisticamente significativa para a idade, gênero e hábito de fumar.
5.2 Distribuição da frequência dos polimorfismos
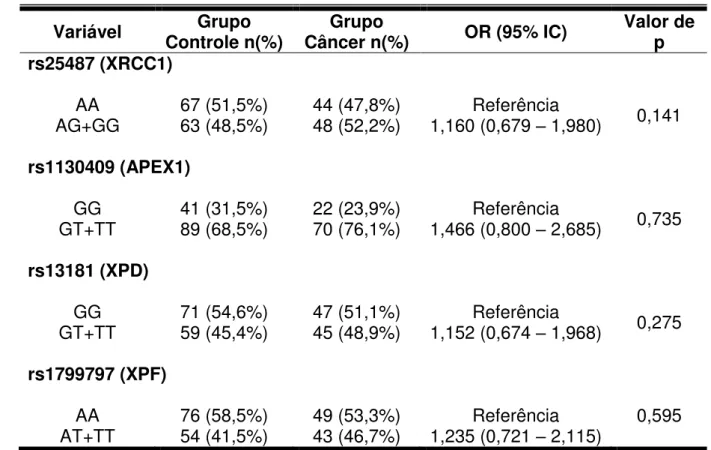
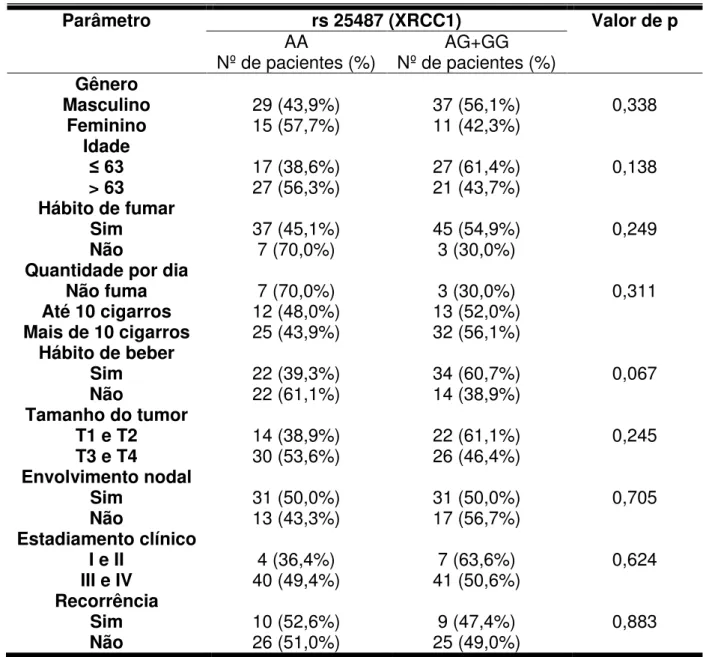
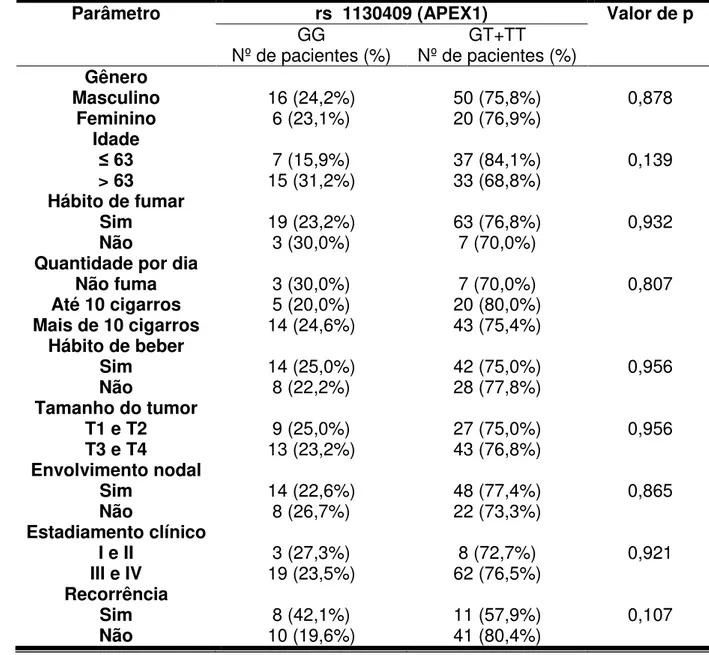
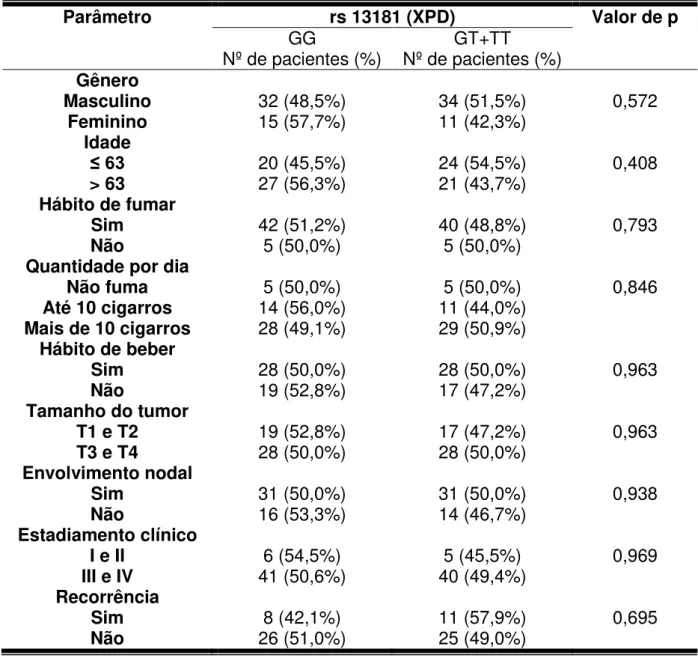
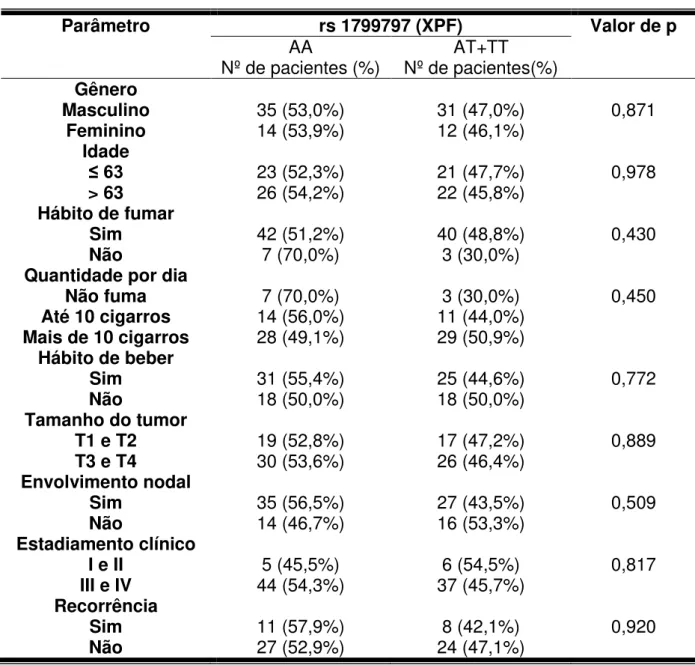
Todos os polimorfismos analisados encontravam-se em equilíbrio de Hardy-Weinberg. A tabela 2 mostra a distribuição dos genótipos nos grupos controle e CCEO no modelo aditivo. No entanto, para as análises posteriores, foi utilizado o modelo dominante (tabela 3). Nesse modelo, considera-se um grupo sem alelos polimórficos (referência) e outro grupo que representa a soma dos casos com um ou dois alelos polimórficos (heterozigoto e homozigoto variante, respectivamente). A presença dos SNPs analisados em XRCC1 (Arg399Gln – rs 25487), APEX1 (Asp148Glu – rs 1130409), XPD (Lys751Gln – rs 13181) ou XPF (rs 1799797), nos casos estudados, não revelou ser um fator de risco para o desenvolvimento do CCEO (tabela 3).
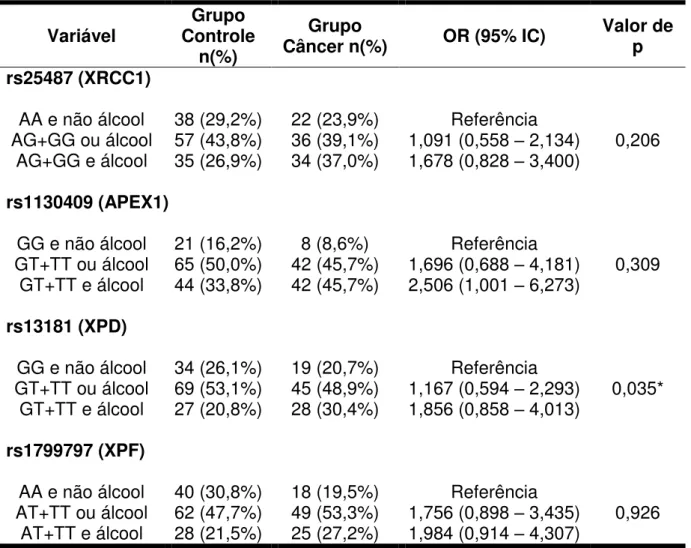
5.3 Distribuição da frequência dos polimorfismos associado ao hábito de beber ou fumar