Cegueira Central em Cães
Inês Paiva Pires da Silva Pinto
Orientador: Professor Doutor Artur Severo Proença Varejão
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO VILA REAL, 2011
Cegueira Central em Cães
Inês Paiva Pires da Silva Pinto
Orientador: Professor Doutor Artur Severo Proença Varejão
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO VILA REAL, 2011
"Este Trás-os-Montes da minha alma! Atravessa-se o Marão, e entra-se logo no paraíso!"
In Diário I
iv
A cegueira é definida como a ausência de visão e acontece quando há um problema nas vias visuais aferentes. As vias visuais aferentes são constituídas pelas estruturas do globo ocular que conduzem a luz até à retina, e por todas as estruturas que vão participar na transmissão dos impulsos eléctricos fomados na retina, até ao seu centro de interpretação e processamento no córtex visual. A cegueira central ocorre quando o problema está localizado numa qualquer porção da via pós-retiniana, contituída pelo nervo óptico, quiasma e tracto óptico, núcleo geniculado lateral, radiação óptica e córtex visual. Para a avaliação do animal com cegueira central, é fundamental um bom conhecimento das vias e estruturas anatómicas envolvidas no processo visual, pois vai permitir localizar correctamente a lesão. A cegueira central pode ser parcial ou total e apresentar manifestações uni ou bilaterais, sendo várias as suas etiologias. Nesta dissertação serão abordadas as mais frequentes, sendo elas as congénitas, inflamatórias, infecciosas, vasculares, traumáticas e neoplásicas. A abordagem diagnóstica dos casos clínicos foi feita por ressonância magnética. Dentro dos quatro casos clínicos descritos, o primeiro trata de um animal com diagnóstico de hidrocefalia congénita, o segundo o de um animal com diagnóstico presuntivo de doença vascular cerebral múltipla e o terceiro e quarto casos, descrevem dois animais com neoplasia cerebral com diagnóstico presuntivo de glioma.
v
Blindness is defined as the absence of vision and it occurs when there is a problem in the afferent visual pathways. The afferent visual pathways include the structures that conduct the light trough the eye until the retina, and also all the structures that participate in the transmission of the electrical impulses, generated in the retina, until they reach the visual cortex, where they are interpreted and processed. Central blindness occurs when the problem is located in the post retinal pathway, which includes the optic nerve, quiasm and tract, the lateral geniculate nucleus, the optic radiation and the visual cortex. For the evaluation of the patient with central blindness, in depth knowledge of the anatomical pathways and structures is essential, since it enables an accurate localization of the lesion. Central blindness can be partial or total and can have unilateral or bilateral presentations, with several possible etiologies. In this dissertation the most common etiologies will be approached, and those are congenital, inflammatory, infeccious, vascular, traumatic and neoplastic. The diagnostical approach of the clinical cases was made by magnetic resonance imaging. Within the four clinical cases presented, the first describes an animal with congenital hydrocephalus, the second case describes an animal with presumed cerebrovascular accidents and the third and forth cases, describe animals with brain tumors, presumed gliomas.
vi
CAPÍTULO I – REVISÃO BIBLIOGRÁFICA ... 1
1 - MÉTODOS DE PESQUISA E SELECÇÃO ... 1
2 - CONCEITOS ... 1
2.1 - Cegueira ... 1
2.2 - Visão ... 1
3 - VIA VISUAL CONSCIENTE ... 2
3.1 - Retina ... 2
3.1.1 - Epitélio pigmentado da retina ... 2
3.1.2 - Retina neurossensorial ... 3
3.2 - Disco Óptico ... 5
3.3 - Nervo óptico ... 6
3.4 - Quiasma óptico ... 7
3.5 - Tracto óptico e núcleo geniculado lateral ... 8
3.6 - Córtex visual ... 9
4 - OUTRAS VIAS IMPORTANTES NA AVALIAÇÃO NEURO-OFTALMOLÓGICA ... 11
4.1 - Reflexo pupilar à luz ... 11
4.2 - Reflexo de encandeamento ... 12
4.3 - Inervação simpática da pupila ... 12
4.4 - Via do Teste da Ameaça ... 13
5 - DOENÇAS DAS VIAS CENTRAIS DA VISÂO ... 14
5.1 - Anomalias congénitas ... 14
5.1.1 - Aplasia do nervo óptico ... 14
5.1.2 - Hipoplasia do nervo óptico ... 15
5.1.3 - Coloboma ... 16 5.1.4 - Hidrocefalia ... 17 5.2 - Doenças inflamatórias ... 18 5.2.1 - Neurite óptica ... 18 5.2.2 - Meningoencefalite granulomatosa ... 19 5.2.3 - Encefalites necrosantes ... 20 5.3 - Doenças infecciosas ... 21 5.3.1 - Esgana ... 21
vii
5.5 - Trauma... 24
5.5.1 - Trauma craniano ... 24
5.5.2 - Trauma do nervo óptico ... 25
5.5.3 - Trauma do quiasma óptico... 26
5.6 - Neoplasias ... 26
5.6.1 - Meningioma ... 27
5.6.2 - Glioma ... 28
5.6.3 - Tumores secundários do SNC ... 28
5.6.4 - Tumores da glândula pituitária ... 29
6 - DIAGNÓSTICO ... 29 6.1 - Anamnese ... 30 6.2 - Exame físico ... 30 6.3 - Exame neuro-oftalmológico ... 30 6.4 - Análises laboratoriais ... 31 6.5 - Diagnóstico imagiológico ... 32 6.5.1 - Ressonância Magnética ... 32 6.5.2 - Tomografia computorizada ... 33 6.6 - Líquido cefalorraquidiano ... 34 6.7 - Electroretinografia ... 34
CAPÍTULO II – APRESENTAÇÃO DOS CASOS CLÍNICOS ... 35
Material e Métodos ... 35
Caso clínico nº 1 ... 35
Caso clínico nº 2 ... 38
Caso clínico nº 3 ... 43
Caso clínico nº 4 ... 49
CAPÍTULO III - DISCUSSÃO ... 53
viii
Tabela 1. Alteração da intensidade de sinal de hemorragias intracranianas ao longo do tempo. ... 24
ÍNDICE DE ILUSTRAÇÕES
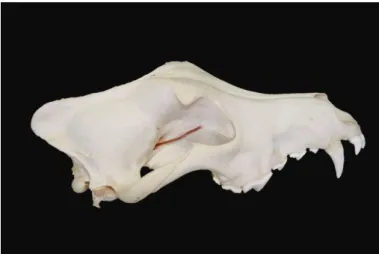
Figura 1. Crânio de cão sem mandíbula: Representação esquemática do nervo óptico
intraorbital e sua entrada no canal óptico originando a porção intracanalicular. Após atravessar o canal passará a designar-se por porção intracraniana até atingir o quiasma óptico (vista lateral). ... . 7
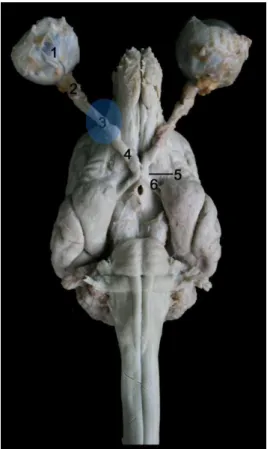
Figura 2. Encéfalo de cão, após remoção do crânio com os nervos óptico intactos até aos
globos oculares (vista ventral). Porção inicial das vias centrais da visão: 1 – globo ocular; 2 – nervo óptico intraorbital; 3 – representação esquemática do nervo óptico intracanalicular; 4 – nervo óptico intracraniano; 5 – quiasma óptico; 6 – tracto óptico. ... ..8
Figura 3. Corte transversal do encéfalo de cão com inclinação cranio-caudal, a nível do
corpo geniculado lateral: 1 – Corpo caloso; 2 – Sistema hipocampo-fórnix; 3 – Corpo geniculado lateral; 4 – tracto óptico; 5 – Colículo rostral; 6 – Braço do colículo caudal. ...9
Figura 4. Encéfalo de cão após remoção de ambos os hemisférios e do sistema
hipocampo-fórnix. Vias centrais da visão: 1 – globo ocular; 2 – nervo óptico; 3 – representação esquemática do canal óptico; 4 – quiasma óptico; 5 – tracto óptico; 6 – corpo geniculado lateral; 7 – colículo rostral; 8 – representação esquemática da radiação óptica; 9 – localização topográfica do córtex visual. ... 10
Figura 5. Encéfalo de cão após ter sido removido do crânio ainda com as meninges
intactas. Áreas a vermelho, representam a localização topográfica do córtex visual canino: à esquerda vista lateral e à direita vista dorso-ventral. ... 10
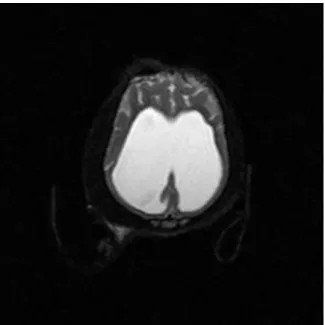
Figura 6. Imagem transversal de RM ponderada T2 onde é possível ver a grave dilatação
dos ventrículos laterais direito e esquerdo, que levou à ruptura so septo pelúcido que os separa. Ventralmente encontra-se o diencéfalo comprimido pelos ventrículos laterais – típica imagem em asas de borboleta. ... 36
Figura 7. Imagem transversal de RM ponderada T2 de um animal saudável. Plano de corte
feito ao mesmo nível da Figura 6. ... 36
Figura 8. Imagem sagital de RM ponderada em T1 onde é possível observar a extensão da
dilatação dos ventrículos laterais. Também é possível observar uma dilatação moderada do quarro ventrículo. ... 37
ix
Figura 10. Imagem paradorsal de RM ponderada em T2 onde se observa a dilatação severa
de ambos os ventrículos laterais e a fina espessura do cortéx cerebral que os envolve. .... 37
Figura 11. Imagem transversal de RM ponderada em T1 onde apenas se visualiza uma
moderada dilatação dos ventrículos laterais (imagem gentilmente cedida pela UTCVM). ... 39
Figura 12. Imagem transversal de RM ponderada em T2, plano da Figura 11, onde é
possível observar uma ligeira hiperintensidade na zona dorso-medial da porção caudal do lobo parietal/porção cranial do lobo occipital do hemisfério esquerdo, indicada pela seta (imagem gentilmente cedida pela UTCVM). ... 39
Figura 13. Imagem transversal de RM em FLAIR, plano da Figura 11, onde se consegue
observar a lesão hiperintensa, indicada pela seta (imagem gentilmente cedida pela UTCVM). ... 40
Figura 14. Imagem transversal de RM ponderada em T2*, plano cranial ao da Figura 11,
onde se observa uma lesão hipointensa indicada pela seta. Esta é uma das várias susceptibilidades magnéticas presentes em todo o telencéfalo (imagem gentilmente cedida pela UTCVM). ... 40
Figura 15. Imagem transversal de RM ponderada em T1, onde se observa uma ligeira
hipointensidade a nível do núcleo caudado direito, indicada pela seta. Para além desta lesão é possível observar a moderada dilatação dos ventrículos laterais (imagem gentilmente cedida pela UTCVM). ... 40
Figura 16. Imagem tranversal de RM ponderada em T2, plano da Figura 15, onde se
observa a lesão descrita na figura anterior que nesta sequência se apresenta hiperintensa, indicada pela seta (imagem gentilmente cedida pela UTCVM). ... 40
Figura 17. Imagem transversal de RM em FLAIR, plano da Figura 15, onde se observa a
lesão já descrita, indicada pela seta (imagem gentilmente cedida pela UTCVM). ... 41
Figura 18. Imagem transversal de RM ponderada em T1, plano da Figura 15, após
administração de contraste, onde se nota um ligeiro reforço hiperintenso da lesão, indicado pela seta (imagem gentilmente cedida pela UTCVM). ... 41
Figura 19. Imagem dorsal de RM ponderada em T1, após administração de contraste, onde
é possível visualizar o reforço da lesão a nível do núcleo caudado direito, anteriormente descrito, indicado pela seta, e também algum grau de dilatação dos ventrículos laterais (imagem gentilmente cedida pela UTCVM). ... 41
Figura 20. Imagem transversal de RM ponderada em T2, onde é possível visualizar uma
x
restante parênquima cerebral (imagem gentilmente cedida pela UTCVM). ... 45
Figura 22. Imagem transversal de RM ponderada em T2, plano caudal ao da Figura 21,
onde se observa o aplanamento por compressão do mesencéfalo (imagem gentilmente cedida pela UTCVM). ... 45
Figura 23. Imagem transversal de RM em FLAIR, plano da Figura 21, onde se observa a
massa intra-axial (imagem gentilmente cedida pela UTCVM). ... 45
Figura 24. Imagem transversal de RM ponderada em T1, após administração de contraste,
plano da Figura 21. De notar o anel de reforço a envolver a massa e o facto de a zona hiperintensa da substância branca não mostrar qualquer reforço, sendo assim considerada edema vagogénico (imagem gentilmente cedida pela UTCVM). ... 46
Figura 25. Imagem parasagital de RM ponderada em T2, onde é possível visualizar a
massa intra-axial e edema que lhe está associado. Não há sinal de herniação transtentorial do cerebelo (imagem gentilmente cedida pela UTCVM). ... 46
Figura 26. Imagem de ultrassonografia com sonda linear, da glândula adrenal esquerda,
onde é possível visualizar a massa adrenal e as suas dimensões (imagem gentilmente cedida pela UTCVM). ... 47
Figura 27. Imagem transversal de RM ponderada em T2, plano a nível do núcleo caudado,
onde é possível visualizar uma hiperintensidade difusa na substância branca do hemisfério direito, correspondente edema vasogénico que rodeia a massa tumoral, indicado pela seta (imagem gentilmente cedida pela UTCVM). ... 50
Figura 28. Imagem transversal de RM ponderada em T1, onde é possível observar a massa
tumoral intra-axial, de grandes dimensões e o seu efeito de compressão pressionando as estruturas envolventes: ventralmente comprimindo o mesencéfalo e desviando para a esquerda a linha média e o ventrículo lateral esquerdo. Nesta sequência, a lesão apresenta-se hipointensa e heterogénea em relação aos tecidos que a rodeiam (imagem gentilmente cedida pela UTCVM). ... 50
Figura 29. Imagem transversal de RM ponderada em T2, plano da Figura 28, onde se
observa a massa intra-axial que nesta sequencência se apresenta hiperintensa e heterogénea em relação aos tecidos que a rodeiam. É novamente possível observar o elevado grau de compressão que exerce sobre as estruturas que a envolvem (imagem gentilmente cedida pela UTCVM). ... 51
Figura 30. Imagem transversal de RM em FLAIR, plano da Figura 28, onde é possível
observar duas áreas com supressão de sinal, correspondendo a zonas císticas repletas de fluído (imagem gentilmente cedida pela UTCVM). ... 51
xi
lesão. De reparar que as zonas nulas em FLAIR não apresentam reforço após contraste (imagem gentilmente cedida pela UTCVM). ... 51
Figura 32. Imagem dorsal de RM ponderada em T1, após administração de contraste, onde
se visualiza o reforço em anel já referido. Nesta imagem é também possível observar o grau de compressão que a massa exercer nas restantes estruturas cerebrais (imagem gentilmente cedida pela UTCVM). ... 51
xii ALT – alanina aminotransferase
AVC – acidente vascular cerebral AIT – acidente isquémico transitório BID – duas vezes ao dia
BUN - azoto ureíco não proteíco CK – creatinina quinase
cm – centímetro dL - decilitro
DVC – doença vascular cerebral EN – encefalite necrosante
EPR – epitélio pigmentado da retina ERG – electroretinografia
FC – frequência cardíaca
FLAIR – “fluid attenuated inversion recovery” g - grama h – hora(s) Hg - mercúrio IV – intravenoso kg – quilograma L - litro LCR – líquido cefalorraquidiano LEN – leucoencefalite necrosante
MEG – meningoencefalite granulomatosa MEN – meningoencefalite necrosante mg – miligrama
mL – mililitro min - minuto
mm – milímetro mmol – milosmol
NGL – núcleo geniculado lateral NPT – núcleo pré-tectal
OD – globo ocular direito OS – globo ocular esquerdo OU – ambos os globos oculares PCR – reacção de cadeia polimerase PD – pressão diastólica
PO – per os
PS – pressão sistólica
RM – ressonância magnética RPL – reflexo pupilar à luz SID – uma vez ao dia
SNC – sistema nervoso central T1-W – imagem ponderada em T1 T2-W – imagem ponderada em T2 T2*-W – imagem ponderada em T2* T4 – tirosina
TC – tomografia computorizada TID – três vezes ao dia
TSH – hormona estimulante da tiróide UH – unidades de Hounsfield
UI – unidades internacionais < – menor
≥ – maior ou igual % – percentagem
xiii
A tese de mestrado é o ponto final em mais um capítulo da minha vida. Capítulo esse que foi preenchido com aventuras e desventuras, sucessos e insucessos, bons e maus momentos, gargalhadas e lágrimas, mas acima de tudo crescimento e amadurecimento.
As minhas primeiras palavras de agradecimento destinam-se ao Prof. Doutor Artur Varejão, meu orientador, pelo acompanhamento, críticas e sugestões relevantes feitas a este trabalho durante a orientação. E não podia deixar de agradecer as inúmeras conversas sobre ténis e ténis de mesa, já que os momentos de descontracção são tão importantes como os momentos de trabalho.
Secondly I would like to thank Dr. Jill Narak and also Dr. Silke Hecht for all the help and support from the other side of the Atlantic. Without all of those emails, filled with information, suggestions and opinions, I could not have finished this dissertation.
Agradeço ao Hospital Veterinário da Universidade de Trás-os-Montes e Alto Douro pelas óptimas condições de trabalho, aprendizagem e convívio que me proporcionaram. A todos os técnicos, internos, professores e funcionários, um grande obrigada.
Quero agradecer ao pessoal da Clínica +Ani+ que tão bem me recebeu e me proporcionou a oportunidade de aumentar a minha experiência prática e de contactar com a realidade médico-veterinária diária.
Agradeço ao Prof. Bruno Colaço e ao Sr. Filipe pela imensa ajuda no laboratório de anatomia, foi mais fácil trabalhar e legendar as imagens do que conseguir as fotografias.
Aos amigos que ficaram no Porto enquanto viajei para terras transmontanas, agradeço todo o apoio, amizade e carinho. Não é fácil estar longe e é bom voltar a estarmos juntos nos nossos cafezinhos, sem parecer que se passaram semanas ou meses.
Aos amigos da Bila, vocês sabem quem são, um obrigada do fundo do coração por fazerem parte de páginas e páginas deste capítulo. São tantos os momentos maravilhosos que vou – vamos – recordar durante todas as nossas vidas.
Quero agradecer aos meus gatos, o Floko e a Nita, porque cada dia passado na sua companhia me faz gostar mais de animais e maior é a minha certeza de que escolhi o curso perfeito para mim.
Quero agradecer à minha irmã por me chatear a cabeça como só uma irmã pode e deve fazer! E claro, por ser a minha companheira de sessões e sessões de cinema.
E claro, um agradecimento profundo aos responsáveis por ter chegado aqui, os meus pais! Obrigada pelo vosso apoio, pela educação que me deram, pelas oportunidades que tornaram possíveis e por terem acreditado sempre em mim.
E agora venha um novo capítulo que ainda há muitas páginas em branco para preencher!
1
CAPÍTULO I – REVISÃO BIBLIOGRÁFICA 1 - MÉTODOS DE PESQUISA E SELECÇÃO
As publicações clínicas relacionadas com o tema “Cegueira central em cães” foram pesquisas na “Medline”, com “palavras-chave” adequadas como “cegueira”, “deficits visuais”, “vias centrais da visão”, “ressonância magnética”, “tomografia computorizada”, “hidrocefalia”, “glioma” e “acidente vascular” com maior incidência na última década. Os títulos e resumos em inglês foram examinados, tendo sido feita uma selecção adequada dos respectivos conteúdos. A pesquisa nas ciência básicas foi restrita aos artigos que se aproximassem das aplicações
2 - CONCEITOS 2.1 - Cegueira
A cegueira é definida como a ausência de visão resultante de patologia das vias visuais aferentes (Fitzmaurice, 2010). Esta ausência pode ser total ou parcial.
2.2 - Visão
A visão é a percepção consciente das radiações luminosas (Lorenz et al., 2011). Compreende todo o conjunto de mecanismos fisiológicos e neurológicos pelos quais essas radiações determinam impressões sensoriais variadas como formas, cores, movimentos, profundidade e intensidade luminosa.
A visão é um fenómeno complexo no qual a luz reflectida pelos objectos no ambiente é captada pelo globo ocular incidindo na retina. Na retina estão presentes fotorreceptores que são responsáveis por converter esta energia luminosa em impulsos eléctricos. Estes vão ser transmitidos por vários tipos celulares diferentes, ao longo do seu trajecto desde a retina até ao córtex visual localizado no sistema nervoso central (SNC), onde ocorre a sensação de visão (Ofri, 2007, Miller, 2008).
O acto de ver depreende da conjugação de múltiplos factores. A percepção de luz, cor, forma, espaço e movimento. A percepção luminosa e das suas diferentes intensidades é o factor fundamental para que a visão seja possível, estando bem desenvolvida em vertebrados (Ollivier et al., 2004).
2
Os vertebrados podem, por isso, ser divididos em animais diurnos (adaptados a luz intensa), nocturnos (adaptados à reduzida luz da noite) e animais adaptados a ambas as condições. As diferenças anatómicas na captação luminosa podem ser encontradas na organização do globo ocular e retina (Ollivier et al., 2004).
3 - VIA VISUAL CONSCIENTE
O processo visual tem início na conversão da energia luminosa em impulsos eléctricos a nível da retina. Estes impulsos são conduzidos pelos axónios das células ganglionares retinais, axónios estes que convergem para o disco óptico, onde originam o nervo óptico. Os nervos ópticos convergem num ponto designado quiasma óptico, onde uma parte destes axónios cruzam para o tracto óptico contralateral ao globo ocular de onde tiveram origem. Estes tractos ópticos são a continuação dos axónios das células ganglionares, estão envolvidos na percepção consciente de visão e fazem sinapse a nível do núcleo geniculado lateral (NGL). As fibras pós-sinápticas formam a radiação óptica para o córtex visual, onde ocorre a interpretação da imagem (Jones, 1995).
3.1 - Retina
A retina estende-se desde a papila óptica até à ora serrata. A ora serrata é uma franja denteada que demarca a terminação anterior da retina e a transição entre esta e o corpo ciliar. Neste ponto, as camadas celulares retinais tornam-se mais finas e fundem-se na ora serrata (Dubielzig et al., 2010).
A retina é considerada como uma complexa extensão do diencéfalo altamente organizada e composta por dez camadas de células especializadas. As camadas mais interiores são aquelas que estão localizadas na face vítrea da retina, mais próximas do centro do globo ocular. As camadas mais externas são estruturas situadas na face escleral da retina. Estas dez camadas dividem-se em retina neurossensorial, constituída pelas nove camadas mais internas, e epitélio pigmentado da retina (EPR) (Cook et al., 2009; Dubielzig et al., 2010).
3.1.1 - Epitélio pigmentado da retina
O EPR da retina é composto por uma única camada de células cubóides. A sua membrana basal está aposta à camada coriocapilar da coróide e o seu ápex dirigido para a camada fotossensível. O citoplasma apical destas células está repleto de grânulos de melanina ao longo da retina excepto na zona do tapete lúcido, onde a ausência de grânulos
3
faz com que esta camada não possa ser clinicamente observada neste ponto. A presença destes grânulos confere a cor escura à zona não tapetal quando se observa o fundo do olho por oftalmoscopia (De Lahunta et al., 2009; Dubielzig et al., 2010).
O EPR tem duas funções importantes. A primeira é servir de interface entre a coróide e os fotorreceptores, ajudando na sua nutrição e na remoção de produtos do seu metabolismo. A segunda é a reciclagem dos fotopigmentos usados pelos fotorreceptores (Ofri, 2008).
3.1.2 - Retina neurossensorial
3.1.2.1 - Camada fotossensível
A camada fotossensível divide-se em dois segmentos, o externo e o interno. (De Lahunta et al., 2009).
O segmento externo é constituído por discos membranares resultantes do pregueamento da membrana celular em camadas sucessivas. Estas estruturas lamelares formam-se a partir de um cílio modificado na base do segmento externo. Nestas lamelas encontram-se proteínas estruturais, os fotopigmentos. No caso dos bastonetes o pigmento visual neles presente é a rodopsina, nos cones é a iodopsina. A presença de diferentes pigmentos, determina diferenças funcionais na sensibilidade destas células à luz (Ofri, 2007; Ofri, 2008; De Lahunta et al., 2009).
O sistema de bastonetes caracteriza-se pela sua alta sensibilidade a mudanças nos níveis de iluminação e detecção de movimentos, apresentando pouca resolução e ausência da percepção de cor. O sistema de cones é caracterizado pela baixa sensibilidade a mudanças de iluminação, a sua alta resolução e capacidade de visão a cores. A abundância de cada um destes tipos celulares na retina de uma espécie animal, depende do nicho ecológico do animal. Animais nocturnos têm maior quantidade de bastonetes e os animais diurnos maior quantidade de cones. Os cones e os bastonetes são das células metabolicamente mais activas do organismo, não só em termos de consumo de oxigénio mas também a nível de produção proteica (Ofri, 2007; Ofri, 2008; Dubielzig et al., 2010).
O segmento interno encontra-se separado do externo por um estrangulamento que contém o cílio modificado. Este segmento apresenta uma forma mais alongada nos bastonestes e uma forma oval nos cones. A este nível é composto maioritariamente por organelas celulares, nomeadamente mitocôndrias e retículos endoplasmáticos rugosos (De Lahunta et al., 2009).
4 3.1.2.2 - Membrana limitante externa
A membrana limitante externa consiste da complexa junção entre os neurónios fotorreceptores e as prolongações terminais das células de Müller. Estas células da glia especiais, envolvem e suportam todas as células neurvosas entre a membrana limitante externa e a interna (Cook et al., 2009; De Lahunta et al., 2009).
3.1.2.3 - Camada nuclear externa
A camada nuclear externa é composta pelos núcleos das células fotorreceptoras. Os núcleos celulares dos cones, de maiores dimensões que os dos bastonetes, estão localizados na periferia desta camada próximos da membrana limitante externa. Os núcleos dos bastonetes, constituem grande parte desta camada retinal uma vez que, nos mamíferos domésticos o número de bastonetes é superior ao número de cones. A zona mais interna desta camada é constituída pelos axónios dos cones e bastonetes que se dirigem para a camada seguinte (De Lahunta et al., 2009; Dubielzig et al., 2010).
3.1.2.4 - Camada plexiforme externa
A camada plexiforme externa é constituída pelas sinapses entre os axónios das células fotorreceptoras e as dendrites e axónios das células horizontais e neurónios bipolares, cujos núcleos se encontram na camada nuclear interna (McLellan, 2002; Dubielzig et al., 2010).
3.1.2.5 - Camada nuclear interna
A camada nuclear interna contém os núcleos de quatro tipos celulares. Na zona mais periférica estão situados os núcleos das células horizontais. Na zona mais central estão os núcleos das células de Müller e dos neurónios bipolares, sendo estes o segundo neurónio na via visual. Na zona mais interna da camada nuclear estão os núcleos das células amácrinas (McLellan, 2002; Dubielzig et al., 2010).
3.1.2.6 - Camada plexiforme interna
A camada plexiforme interna é uma segunda camada sináptica, constituída pelos axónios das células horizontais, amácrimas e bipolares e as dendrites das células ganglionares. Inúmeras sinapses ocorrem entre os neurónios bipolares e as células
5
ganglionares, mas também lateralmente entre os quatro tipos celulares. Estas comunicações laterais ajudam a coordenar e a integrar toda a função retiniana (Ofri, 2008; De Lahunta et al., 2009; Dubielzig et al., 2010;).
3.1.2.7 - Camada ganglionar
A camada ganglionar contém os corpos celulares e núcleos dos neurónios ganglionares, o terceiro neurónio na via visual. As células ganglionares são classificadas em vários tipos de acordo com a sua dimensão e fisiologia, mas todas apresentam citoplasma abundante contendo corpos de Nissl (De Lahunta et al., 2009; Dubielzig et al., 2010).
As células ganglionares com corpos celulares de menor tamanho predominam numa zona denominada área central, onde há um maior número de células ganglionares (De Lahunta et al., 2009).
3.1.2.8 - Camada de fibras nervosas
Esta camada é composta pelos axónios das células ganglionares que cursam paralelamente à superfície da retina em direcção ao disco óptico, estando suportados por células de Müller. A espessura desta camada é maior na zona que rodeia o disco óptico, sendo mais fina na área central. Os axónios atravessam a esclera na placa cribosa, onde as fibras de colagéneo escleral se separam para permitir a passagem dos axónios. A mielinização das fibras nervosas confere-lhe a sua típica cor branca (Ofri, 2008; De Lahunta et al., 2009).
3.1.2.9 - Membrana limitante interna
A décima camada, a membrana limitante interna, é formada pela união dos processos terminais das células de Müller e pela membrana basal adjacente ao humor vítreo (McLellan, 2002; Dubielzig et al., 2010).
3.2 - Disco Óptico
O disco óptico marca o início do nervo óptico e é facilmente visualizado por oftalmoscopia. O disco óptico juntamente com a retina, são os únicos componentes do sistema nervoso que são possíveis de serem observados directamente em pacientes normais (Penderis, 2004; Fernández, 2007).
6
O tamanho e forma do disco óptico na retina variam de espécie para espécie. O tamanho e a forma estão dependentes do grau de mielinização do disco óptico. É a mielina que lhe confere a sua típica cor branca (McLellan, 2002; Barnett, 2006)
Normalmente, o disco óptico localiza-se na zona ventrolateral da retina e a sua posição relativamente à zona tapetal varia entre espécies mas também entre raças, no caso dos canídeos (Barnett, 2006; Ofri, 2008; De Lahunta et al., 2009).
Nos cães de raça grande, pode estar totalmente na zona tapetal. Em raças médias, normalmente encontra-se no bordo de transição entre o tapete lúcido e a zona não tapetal. Em raças miniatura, é muitas vezes encontrado na zona não tapetal, ventralmente ao bordo de transição. No gato o disco óptico encontra-se sempre na zona tapetal apresentando uma forma circular. O tamanho e a disposição dos vasos sanguíneos que rodeiam o disco óptico também variam de espécie para espécie, sendo pouco proeminentes no cavalo, onde quase não se visualizam (Barnett, 2006; De Lahunta et al., 2009; Dubielzig et al., 2010).
3.3 - Nervo óptico
O nervo óptico é constituído pelos axónios das células ganglionares da retina da retina, oligodendrócitos e astrócitos. A sua origem está nos axónios das células ganglionares que convergem centriptamente na retina até ao disco óptico, dirigindo-se posteriormente para atravessar a esclera na placa cribosa (Brooks, et al., 1999; Jeffery et al., 2005; De Lahunta et al., 2009;).
Este nervo está dividido em quatro regiões: intraocular, intraorbital, intracanicular e intracraniana, Figura 1 e Figura 2. Os axónios são organizados em fascículos separados por fibras de colagéneo, permitindo assim que a sua estrutura se mantenha integra durante o movimento do globo ocular (Brooks, et al., 1999; Jeffery et al., 2005; Barnett, 2006; Dubielzig et al., 2010).
A denominação nervo óptico é errada, uma vez que um nervo é defenido como sendo um conjunto de axónios fora do SNC e mielianizado por células de Schwann. O nervo óptico é por isso um tracto de substância branca do diencéfalo. Como qualquer outro componente do SNC contém astrócitos e é envolvido pelas três meninges, incluindo um espaço subaracnóide. Extensões da piamáter formam septos pelo interior do nervo, septos esses, que contêm vasos sanguíneos. A sua mielinização não é feita por células de Schwann mas por oligodendrócitos (Brooks et al., 1999; Shamir et al., 2007; De Lahunta et al., 2009).
7
A posição dos axónios das células ganglionares no nervo óptico não é aleatória. Dentro do nervo, as fibras cumprem o arranjo espacial retinal que lhes deu origem (organização retinotópica), ou seja, fibras que se iniciam na da porção ventral da retina vão originar a metade inferior o nervo óptico e fibras da porção dorsal constituem a metade superior do nervo óptico. A localização destas fibras vai-se alterando gradualmente na aproximação ao quiasma óptico preparando-se para a decussação (Brooks et al., 1999; Jeffery et al., 2005; Ofri, 2007; Shamir et al., 2007).
O nervo óptico intraorbital apresenta uma forma em “S” que lhe permite acomodar-se à movimentação do globo ocular na órbita (Brooks et al., 1999). A saída da órbita pelos nervos ópticos direito e esquerdo, ocorre pelo canal óptico de cada órbita dirigindo-se posteriormente para se cruzarem no quiasma óptico (Cook et al., 2009; De Lahunta et al., 2009; Dubielzig et al., 2010).
3.4 - Quiasma óptico
O quiasma óptico localiza-se na face rostroventral do tronco do encéfalo e marca a superfície rostral do diencéfalo, mantendo uma relação anatómica próxima com o terceiro ventrículo, o hipotálamo e a hipófise, Fig (Brooks et al., 1999).
A decussação dos axónios do nervo óptico foi descrita pela primeira vez por Isaac Newton em 1704 (Brook et al., 1999). Nos animais domésticos, a maior parte dos axónios de cada nervo óptico cruzam o quiasma seguindo pelo tracto óptico até ao núcleo geniculado contralateral, ao globo ocular onde teve origem. O grau de decussação de fibras no quiasma varia de espécie para espécie (Jeffery et al., 2005; Cook et al., 2009; De Lahunta et al., 2009).
Figura 1. Crânio de cão sem mandíbula: Representação esquemática do nervo óptico intraorbital e sua
entrada no canal óptico originando a porção intracanalicular. Após atravessar o canal passará a designar-se por porção intracraniana até atingir o quiasma óptico (vista lateral).
8
Em seres humanos e primatas 50% das fibras cruzam a nível do quiasma óptico (Brooks, et al., 1999; Cook et al., 2009; Dubielzig et al., 2010).
Nos gatos a percentagem atinge os 65% (Fernández et al., 2007; Falzone el al; 2011). Em canídeos a decussação é de cerca 75% dos axónios e em grandes animais na ordem dos 80-90% (Brooks, et al., 1999; De Lahunta et al., 2009; Lorenz et al., 2011).
O grau de decussação está relacionado com a posição laterofrontal do globo ocular na órbita e com a área de visão binocular. Animais com olhos laterais apresentam decussação completa das fibras nervosas. Animais que conseguem observar objectos com ambos os globos oculares apresentam algum grau de decussação para que a informação partilhada pelos dois olhos chegue ao córtex cerebral para interpretação (Jeffery et al., 2005; Shamir et al., 2007; De Lahunta et al., 2009). Os axónios que cruzam a nível do quiasma podem ter origem em qualquer ponto da retina, sendo que normalmente pertencem à retina medial (nasal), enquanto os axónios da retina lateral (temporal) permanecem na sua maioria ipsilaterais (Reese et al., 1987; Jeffery et al., 2005; Fernández et al., 2007; Dewey, 2008).
3.5 - Tracto óptico e núcleo geniculado lateral
Os tractos ópticos emergem do quiasma óptico e dirigem-se caudodorsolateralmente lateralmente ao diencéfalo até ao NGL no hipotálamo (Figura 3 e 4), onde a maioria dos axónios fazem a terceira sinapse da via da visão e que irá originar os axónios que vão chegar ao córtex visual (Brooks et al., 1999; Miller, 2008; De Lahunta et al., 2009)
Figura 2. Encéfalo de cão, após
remoção do crânio com os nervos óptico intactos até aos globos oculares (vista ventral). Porção inicial das vias centrais da visão: 1 – globo ocular;
2 – nervo óptico intraorbital; 3 – representação esquemática do nervo óptico intracanalicular; 4 – nervo óptico intracraniano; 5 – quiasma óptico;
9
O NGL apresenta uma forma em curva sigmóide em carnívoros e encontra-se organizado em camadas laminares. No cão e no gato a sua organização é em três camadas e três subcamadas (Brooks et al., 1999). A estrutura funcional deste núcleo passa pela organização retinotópica na qual cada camada representa de forma precisa o hemicampo visual contralateral (Ofri, 2007; Ferreira et al., 2002; Shamir et al., 2007).
Inicialmente pensava-se que este núcleo tinha apenas função de reencaminhar informação dos tractos ópticos para o córtex visual. Trabalhos mais recentes sugerem que o NGL assume um papel importante no processamento e percepção da informação visual (Zhang et al., 2010).
Ao chegarem ao NGL, os axónios seguem duas vias possíveis. A primeira é constituída por aproximadamente 80% dos axónios que, após sinapse no NGL, continuam para o córtex visual, onde ocorre a percepção consciente da visão. Na segunda via, os restantes 20% não fazem sinapse no NGL, seguindo para o núcleo pré-tectal (NPT) constituindo a via do reflexo pupilar à luz (RPL) (Bjerkås et al., 2009; Falzone et al., 2011).
3.6 - Córtex visual
Como já foi referido, a organização retinotópica vai-se mantendo ao longo das vias centrais da visão. Dos corpos celulares dos neurónios do NGL, originam-se axónios que se projectam pela cápsula interna dirigindo-se caudalmente num arranjo em leque designado a radiação óptica e que forma a parede lateral dos ventrículos laterais. Um aumento dos ventrículos laterais pode, por compressão, afectar a via visual neste ponto. Estes axónios
Figura 3. Corte transversal do encéfalo de cão com inclinação cranio-caudal, a nível do corpo
geniculado lateral: 1 – Corpo caloso; 2 – Sistema hipocampo-fórnix; 3 – Corpo geniculado lateral; 4 – tracto óptico; 5 – Colículo rostral; 6 – Braço do colículo caudal.
10
terminam no córtex visual do cérebro localizado na zona medial, lateral e caudal do lobo occipital (Shamir et al., 2007; Cook et al., 2009; De Lahunta et al., 2009).
Os limites anatómicos do córtex visual são compostos pelo giro esplénio medialmente, o giro occipital caudalmente e a porção caudal do giro marginal e o giro ectomarginal lateralmente, Figura 5 (Shamir et al., 2007; Bjerkås et al., 2009; De Lahunta et al., 2009).
Figura 4. Encéfalo de cão após remoção de ambos os hemisférios e do sistema hipocampo-fórnix.
Vias centrais da visão: 1 – globo ocular; 2 – nervo óptico; 3 – representação esquemática do canal óptico; 4 – quiasma óptico; 5 – tracto óptico; 6 – corpo geniculado lateral; 7 – colículo rostral; 8 – representação esquemática da radiação óptica; 9 – localização topográfica do córtex visual.
Figura 5.Encéfalo de cão após ter sido removido do crânio ainda com as meninges intactas. Áreas a vermelho, representam a localização topográfica do córtex visual canino: à esquerda vista lateral e à direita vista dorso-ventral.
11
O córtex visual tem várias conecções não só com o córtex visual do hemisfério oposto via corpo caloso, mas também com o córtex motor de ambos os hemisférios, com o cerebelo através da ponte, com o colículo rostral e núcleos dos pares cranianos III, IV e VI (Ofri, 2007; Miller, 2008; Cook et al., 2009; De Lahunta et al., 2009).
4 - OUTRAS VIAS IMPORTANTES NA AVALIAÇÃO NEURO-OFTALMOLÓGICA 4.1 - Reflexo pupilar à luz
A via do reflexo pupilar à luz é comum à via da visão consciente até os axónios provenientes das células ganglionares da retina chegarem ao NGL. A este nível, cerca de 20% dos axónios seguem até ao no NPT do mesencéfalo, localizado na área entre o tálamo e o colículo rostral, e é aí que ocorre sinapse. A maioria dos axónios dos corpos celulares dos neurónios que se encontram no NPT cruza a nível da comissura caudal, fazendo sinapse no núcleo parassimpático contralateral do nervo oculomotor. Este núcleo geral visceral eferente do oculomotor, está localizado próximo do plano médio na porção ventral da substância cinzenta central do mesencéfalo. Um pequeno número de axónios do NPT segue para o núcleo parassimpático oculomotor ipsilateral (Penderis, 2004; Shamir et al., 2007; De Lahunta et al., 2009; Lorenz et al., 2011).
Como as fibras nervosas de cada NPT se dirigirem para ambos os núcleos parassimpáticos, ambas as pupilas vão responder ao estímulo luminoso de cada globo ocular. A resposta da pupila sobre a qual se está a incidir a fonte luminosa, designa-se resposta directa, enquanto a resposta da pupila contralateral se designa por resposta consensual ou indirecta. Como a via aferente do RPL contém duas decussações, uma a nível do quiasma e outra após sinapse no NPT a nível da comissura caudal, em que a maioria dos neurónios cruzam a ambos os níveis, leva a que resposta pupilar directa maior que a indirecta. A resposta directa é mais pronunciada em todas as espécies em que o grau de decussação das fibras a nível do quiasma óptico é superior a 50%, sendo que em humanos a resposta de ambas as pupilas apresenta igual grau (Jones, 1995; Fernández et al., 2007; De Lahunta et al., 2009).
No núcleo parassimpático, também conhecido por núcleo Edinger-Westphal, iniciam-se fibras nervosas parassimpáticas pré-ganglionares, que inicialmente iniciam-seguem com as fibras gerais motoras eferentes do nervo oculomotor. Devido à sua localização mais superficial no nervo, são susceptíveis a compressão por massas tumorais ou edema. Estes axónios pré-ganglionares atingem a órbita através da fissura orbital. É no gânglio ciliar, que está localizado no ponto onde o nervo oculomotor se ramifica se para inervar diferentes
12
músculos extra-oculares, que as fibras parassimpáticas fazem sinapse com os corpos celulares dos axónios pós-ganglionares. Os axónios pós-ganglionares formam entre 5-8 nervos ciliares curtos no cão e entram no globo ocular adjacentes ao nervo óptico inervando o corpo ciliar e os músculos contrictores da pupila. No gato existem apenas dois nervos ciliares curtos, o nasal e o malar, isto explica a típica abertura pupilar dos felinos domésticos (Penderis, 2004; Cook et al., 2009; Fitzmaurice, 2010; Lorenz et al., 2011).
A dilatação e constricção dos músculos pupilares resultam de um equilíbrio entre o controlo parassimpático e o simpático. (Bjerkås et al., 2009). A inervação simpática da pupila está a cargo de uma via nervosa completamente diferente, a ser abordada mais à frente.
4.2 - Reflexo de encandeamento
Tal como o reflexo pupilar à luz, o reflexo de encadeamento ou dazzle reflex, não requer qualquer envolvimento do cérebro. Trata-se de um reflexo subcortical que se manifesta por um encerramento rápido da pálpebra ipsilateral ou de ambas, em resposta a uma luz intensa a ser incidida no globo ocular. O reflexo de encadeamento, está, portanto, presente em animais cegos por lesões corticais mas ausente em animais com doença subcortical. (Penderis, 2004; De Lahunta et al., 2009; Irby, 2011; Lorenz et al., 2011).
A via responsável por este reflexo não está completamente estudada, mas sabe-se que envolve axónios da retina, nervo e tractos ópticos até ao nível do NGL. Daqui, axónios projectam-se até aos colículos rostrais e/ou núcleo supraóptico do hipotálamo. Após esta primeira fase, fibras de associação fazem a ligação entre estes núcleos e o núcleo do nervo facial, que é responsável pela resposta motora palpebral. Devido à falta de informação no que toca à localização anatómica precisa desta via, a sua avaliação isolada não deve ser utilizada como meio de diagnóstico de lesões subcorticais da via visual. No entanto trata-se de uma ferramenta útil, particularmente em casos nos quais a observação das pupilas é difícil, casos de edemas da córnea significativos ou hifema (Shamir et al., 2007; Ofri, 2008; De Lahunta et al., 2009; Lorenz et al., 2011).
4.3 - Inervação simpática da pupila
A inervação simpática da pupila tem por função principal modificar a abertura pupilar mediante o estado emocional do animal. A via eferente é contituída por um sistema de três neurónios (Penderis, 2004; Fernández et al., 2007).
O primeiro, designado neurónio de primeira ordem, com origem no hipotálamo caudal e mesencéfalo cranial, e cujos axónios se dirigem caudalmente através do tronco do encéfalo e medula cervical pelo tracto tectotegmental lateral. Esta primeira via por estar
13
situada a nível central, pode ser considerada como uma via de neurónio motor superior. Ao chegar aos primeiros 3-4 segmentos espinhais torácicos, fazem sinapse na coluna lateral da substância cinzenta intermédia onde se encontram os corpos celulares dos neurónios pré-ganglionares, também designados neurónios de segunda ordem (Jones, 1995; Bjerkås et al., 2009; De Lahunta et al., 2009).
As fibras com origem nestes neurónios acompanham as raízes dos nervos do plexo braquial, saindo da medula espinhal pelas raízes ventrais destes segmentos. Após emergirem pelo foramen intervertebral mas antes do início da ramificação nervosa, as fibras simpáticas por via de ramos comunicantes formam o tronco simpático cranial e deixam de acompanhar os nervos do plexo braquial. O tronco simpático segue cranialmente pelo pescoço, associando-se ao nervo vago formando, assim, o tronco vagosimpático que, juntamente com a artéria carótida interna, é envolvido pela baínha carotídea (Fernández et al., 2007; De Lahunta et al., 2009; Lorenz et al., 2011).
O tronco simpático separa-se do nervo vago na zona ventromedial à bolha timpânica e termina no gânglio cervical cranial. Aqui têm origem os axónios pós-ganglionares, ou de terceira ordem, que após atravessarem a bolha timpânica, entram na caixa craniana com o nervo glossofaríngeo, passam perto do seio cavernoso com a artéria carótida e saem da fossa craniana pela fissura orbitária, seguindo com as fibras do nervo trigémio, mais precisamente, do seu ramo oftálmico, em direcção ao globo ocular. Estes neurónios de terceira ordem fazem inervação do músculo dilatador da pupila e musculatura lisa da órbita, das pálpebras superior e inferior, e terceira pálpebra (Penderis, 2004; Ofri, 2008; Lorenz et al., 2011).
Uma lesão num destes neurónios causa miose, ptose da pálpebra superior, enoftalmia com consequente elevação da terceira pálpebra e vasodilatação periférica. Em equinos, para além dos sinais clínicos já descritos, também ocorre, sudação da face e da tábua do pescoço ipsilaterais à lesão, aumento da temperatura da pele e hiperémia da narina e conjuntiva. Este conjunto de sinais clínicos é designado por Síndrome de Horner. Dependendo da zona da via afectada, o Síndrome de Horner pode ser classificado como sendo de primeira, segunda ou terceira ordem (Fernández et al., 2007; Dewey, 2008; Fitzmaurice, 2010; Irby, 2011).
4.4 - Via do Teste da Ameaça
A resposta à ameaça é uma resposta aprendida que envolve todas as componentes periféricas e centrais do sistema visual, bem como conexões entre o cérebro e o tronco do encéfalo com activação do nervo facial a nível da medula oblonga. Por envolver integração
14
cortical é considerada uma resposta e não um reflexo (Shamir et al., 2007; Ofri, 2008; De Lahunta et al., 2009).
Dado que é uma resposta que necessita de aprendizagem, esta encontra-se ausente em animais muito jovens, sendo que em cães e gatos está presente a partir das 10-12 semanas de idade. O teste da ameaça pode portanto, resultar em falsos negativos em animais demasiado jovens (Shamir et al., 2007; De Lahunta et al., 2009; Lorenz et al., 2011). A inervação dos músculos motores responsáveis pelo encerrar da pálpebra, está a cargo do nervo facial. Assim, o teste da ameaça permite avaliar a sua integridade. Em animais com suspeita parelisia do nervo facial, este teste deve ser avaliado de forma cuidadosa para evitar falsos negativos. Para isso, deve-se procurar sinais de retracção ocular e protusão da terceira pálpebra (Penderis, 2004; Shamir et al., 2007; Ofri, 2008; De Lahunta et al., 2009; Lorenz et al., 2011).
A via aferente responsável pela resposta do teste da ameaça é comum à via responsável pela visão. Inicia-se na retina e via nervo óptico, quiasma e tractos ópticos, chega ao NGL e daqui atinge o córtex cerebral via radiação óptica.
A via eferente, ainda não está completamente descrita dada a sua complexidade. Acredita-se que o córtex visual conecta-se com o córtex motor, via fibras de associação da cápsula interna. Este primeiro neurónio no córtex motor, via fibras de projecção da cápsula interna e via crus cerebri, faz sinapse com o segundo neurónio localizado no núcleo pontino. Este tracto é por isso designado de tracto corticopontinocerebelar. Daqui os axónios vão decussar a nível da ponte e chegam ao córtex do cerebelo por via do pedúnculo cerebelar médio. A informação é integrada pelo cerebelo que vai transmitir o sinal ao núcleo do nervo facial. Doença cerebelar difusa vai eliminar a resposta ao teste da ameaça em animais com visão inalterada. Como existe decussação de fibras nervosas na transmissão do córtex visual até ao cerebelo, lesões unilaterais cerebelares afectam a resposta à ameça ipsilateralmente (Penderis, 2004; Shamir et al., 2007; Ofri, 2008; De Lahunta et al., 2009; Lorenz et al., 2011).
5 - DOENÇAS DAS VIAS CENTRAIS DA VISÂO 5.1 - Anomalias congénitas
5.1.1 - Aplasia do nervo óptico
O desenvolvimento embrionário do nervo óptico está dependente de uma sequência de eventos durante a formação e o encerramento da fissura óptica (Silva et al., 2008). A aplasia do nervo, ou seja, a completa ausência do disco óptico, nervo óptico, células
15
ganglionares retinais e vasos retinais, é uma condição rara. (Ofri, 2008; Silva et al., 2008). Têm sido avançadas teorias para a aplasia e hipoplasia do nervo óptico que envolvem uma falha do desenvolvimento do segmento posterior, falha do controlo genético, ausência de sinal pelas células ganglionares e também degenerescência de fibras nervosas, associada à normal morte celular durante o desenvolvimento embrionário do olho (Silva et al., 2008).
Não se conhece pré-disposição racial desta condição, sendo que pode ser uni ou bilateral (Silva et al., 2008; Dubielzig et al., 2010). Segundo Silva et al. (2008), a aplasia é normalmente unilateral. O animal é cego desde a nascença, apresentando pupilas dilatadas e não responsivas (Ofri, 2008).
A total ausência de células ganglionares na retina é uma das características morfológicas encontrada na aplasia do nervo óptico (Dubielzig et al., 2010). Outra característica encontrada é a ausência de vasculatura retinal, já que o seu desenvolvimento depende do normal desenvolvimento da retina (Lorenz et al., 2011).
5.1.2 - Hipoplasia do nervo óptico
A hipoplasia do nervo óptico é uma anomalia congénita hereditária não progressiva que afecta várias raças (Silva et al., 2008; Grahn et al., 2009). Apesar de não haver uma clara pré-disposição racial, segundo Dubielzig et al. (2010), raças como Teckel, Poodle e Shih Tzu estarão entre as raças associadas a esta patologia e, segundo Grahn et al. (2009), o Poodle miniatura e o Labrador Retriever (Grahn et al., 2009; Dubielzig et al., 2010).
Em casos de hipoplasia do nervo óptico, existem alguns achados significaticos como o reduzido número de células ganglionares retinais, uma diminuíção na espessura da camada de fibras nervosas, discos ópticos de tamanho reduzido e nervos ópticos intraorbitais e/ou intracraniais de tamanho e espessura reduzida (Gelatt et al., 1971; Silva et al., 2008; Bjerkås et al., 2009). A diminuição do número de células ganglionares vai contribuir para uma menor espessura da camada de fibras nervosas da retina (Ofri, 2008; Bjerkås et al., 2009; Grahn et al., 2009).
O disco óptico apresenta uma grande variedade de formas e tamanhos entre canídeos e até no mesmo animal. Isto acontece devido à variação na quantidade de mielina presente. Este facto torna difícil o diagnóstico desta condição em canídeos, fazendo com que casos moderados não sejam diagnosticados (Grahn et al., 2009).
Em animais com hipoplasia do nervo óptico, este apresenta-se pequeno, cinzento e por vezes muito pigmentado (Jones, 1995; Penderis, 2004; Bjerkås et al., 2009). A presença de uma papila pequena não deve ser confundida com uma variação fisiológica designada micropapila, na qual o animal apresenta uma papila óptica de menor tamanho que o normal, mas perfeitamente funcional (Ofri, 2008).
16
Esta condição é muito variável nos animais domésticos sendo que já foram documentados casos de hipoplasia uni e bilaterais (Grahn et al., 2009; Lorenz et al., 2011). Os animais apresentam visão normal, diminuída ou ausente, midríase e anomalias na resposta pupilar à luz, mas estas alterações variam em extensão dependendo do grau de hipoplasia presente (Penderis, 2004; Ofri, 2008; Silva et al., 2008). Quanto às restantes estruturas oculares, estas podem ser perfeitamente normais ou apresentar alterações variadas do segmento posterior (Gelatt et al., 1971; Lorenz et al., 2011).
Não existe qualquer tratamento para esta condição. Animais que apresentem hipoplasia do nervo óptico não devem ser cruzados para evitar que os animais das ninhadas herdem este problema (Penderis, 2004; Bjerkås et al., 2009; Grahn et al., 2009).
5.1.3 - Coloboma
Coloboma, do grego koloboma, que significa mutilado, refere-se a uma malformação na qual um orifício, falha, defeito ou fissura surge numa estrutura ocular, devido ao incompleto encerramento da fissura embrionária (Onwochei, 2000; Ninomiya et al., 2005; Ofri, 2008).
Qualquer estrutura do globo ocular que seja atravessada por esta fissura pode ser afectada, ou seja, todas as estruturas desde a íris até ao nervo óptico (Onwochei, 2000). Apesar de não ser frequente, é um problema importante encontrado na prática clínica (Ninomiya et al., 2005).
O coloboma é classificado como típico se está localizado na porção média ventral do disco óptico, também designada posição “às 6 horas”, local onde se localiza a fissura embrionária aquando do desenvolvimento embrionário. O coloboma atípico é aquele que tem uma localização diferente da descrita como típica (Onwochei, 2000; Stades et al., 2007; Dubielzig et al., 2010).
No coloboma do nervo óptico, este apresenta-se como uma estrutura branca e cinzenta, escavada no disco óptico. Os vasos sanguíneos atingem a sua margem e parecem mergulhar para o seu interior (Ofri, 2008). Segundo Onwochei (2000), os colobomas em canídeos são mais comuns no globo ocular esquerdo que no direito (Onwochei, 2000).
Os colobomas são mais comuns em Collies e Shetland sheepdogs, como parte integrante da chamada Anomalia do olho do Collie (McLellan, 2002; Rapazzo et al., 2005; Stade et al., 2007).
A visão e o reflexo pupilar à luz destes animais pode ser afectado, já que o coloboma afecta a organização da camada de fibras nervosas caso apresente dimensão suficiente para tal. Colobomas de pequenas dimensões têm um efeito mínimo na visão (Ofri, 2008).
17
5.1.4 - Hidrocefalia
A hidrocefalia pode ser definida como uma distensão activa do sistema ventricular do cérebro, relacionada com um problema na passagem do líquido cefalorraquidiano (LCR) desde que é produzido, a ritmo constante no sistema ventricular, até ao ponto em que é absorvido para a circulação sistémica pelas vilosidades do espaço subaracnóide cranial e espinhal (Terlizzi et al., 2005a; Thomas, 2010b).
A hidrocefalia pode ser classificada como compensatória ou obstructiva, sendo que esta última se divide em congénita ou adquirida (Higginbottham et al., 2011). A hidrocefalia compensatória ocorre quando o LCR ocupa zonas onde ocorreu perda de parênquima cerebral. Esta perda pode ter origem em problemas no desenvolvimento embrionário, enfarte ou necrose por trauma (Thomas, 1999; De Lahunta et al., 2009). Thomas (2010b), refere que a hidrocefalia compensatória, por ser causada por perda de parênquima e não por uma dilatação ventricular, não deve ser classificada como hidrocefalia (Thomas, 2010b).
Em medicina veterinária, a hidrocefalia congénita é mais frequente que a adquirida (Figueiras et al., 2009.) Na hidrocefalia congénita, a obstrução ocorre devido à presença de malformações que interferem com o fluxo de LCR, sendo a mais comum a estenose do aqueduto mesencefálico. Existe uma maior incidência em raças como o Yorkshire terrier, Chihuahua, Pomeranian, Toy poodle, Boston terrier, Pug, Maltês, Bulldog inglês e Pequinês (Bagley, 2004; De Lahunta et al., 2009). As causas de hidrocafalia congénita são variadas e incluem factores genéticos, anomalias do desenvolvimento e infecções intrauterinas ou perinatais (Thomas, 1999).
Animais com hidrocefalia congénita apresentam um crânio aumentado em forma de redoma, persistência das fontanelas e suturas cranianas abertas. No entanto nem todos os animais com persistência de fontanelas têm hidrocefalia e nem todos os animais com esta patologia apressentam persistência das fontanelas. É também frequente que estes animais apresentarem um atraso no desenvolvimento corporal em relação aos restantes animais da ninhada (Bagley, 2004; Penderis, 2004; Lorenz et al., 2011).
No caso da adquirida, esta pode-se desenvolver em qualquer idade, tendo como causas mais comuns massas tumorais primárias ou secundárias, hipoplasia do osso occipital e inflamação (Zabka et al., 2004; De Lahunta et al., 2009; Thomas, 2010b).
Os sinais clínicos de hidrocefalia dependem das estruturas anatómicas envolvidas. Os mais comuns são alterações comportamentais e de consciência, convulsões, ataxia, realização de círculos, sinais vestibulares, problemas de aprendizagem, estrabismo ventro-lateral e cegueira sem alterações do RPL. O curso da doença é incerto, podendo progredir, manter-se estática ou até melhorar com o tempo (Figueiras et al., 2009; MacKillop, 2011).
18
O diagnóstico de hidrocefalia pode ser feito por ultrassonografia através das fontanelas abertas. Os ventrículos aumentados são facilmente visualizados como duas grandes zonas anecóicas (Bagley, 2004; Thomas, 2010b).
O método imagiológico mais aconselhado é a ressonância magnética (RM) na qual se observa uma dilatação de um ou mais ventrículos ou dilatação do espaço subaracnóide. A acumulação anormal de LCR aparece hiperintenso nas imagens com ponderação em T2 (T2-W), hipointenso nas imagens com ponderação T1 (T1-W) e atenuado nas imagens FLAIR (fluid attenuated inversion recovery). São comuns achados concorrentes que variam com a causa da hidrocefalia: anomalias estruturais, massas e trauma (Hecht et al., 2010a). O aumento dos ventrículos, causa uma diminuição na espessura do córtex cerebral. É frequente em casos de hidrocefalia severa, observar atrofia ou até ruptura do septo pepúcido (MacKillop, 2011).
A dilatação dos ventrículos laterais que é observada é responsável por uma elevada pressão e pela distenção da cápsula interna. A radiação óptica constitui a porção caudal da cápsula interna e como tal pode ser afectada pela dilatação dos ventrículos, causando deficits visuais ou mesmo cegueira (Shamir et al., 2007; Ofri, 2008).
O tratamento desta patologia pode ser médico ou cirúrgico. O tratamento médico com glucocorticóides ou diuréticos, não apresenta uma resolução a longo termo dos sinais clínicos. Já o tratamento cirúrgico através da colocação de um shunt é a forma mais efectiva para resolução da hidrocefalia. Este shunt vai drenar o excesso de LCR para uma cavidade corporal, sendo a cavidade abdominal, o espaço pleural e o átrio direito, as mais utilizadas (de Stefani et al., 2011; Higginbotham et al., 2011).
5.2 - Doenças inflamatórias 5.2.1 - Neurite óptica
Como o próprio nome indica, a neurite óptica ou papilite é a inflamação do nervo óptico (Ofri, 2008; Bjerkås et al., 2009; Dubielzig et al., 2010). Apresenta-se normalmente como um processo bilateral, com perda de visão aguda, podendo ou não estar presentes alterações a nível do disco óptico (Penderis, 2004; Bjerkås et al., 2009). Se a inflamação estiver localizada apenas no nervo óptico retrobulbar as alterações não são observadas por oftalmoscopia (Ferreira et al., 2002; Nell, 2008; De Lahunta et al., 2009).
Em animais com neurite óptica, a pupila apresenta-se dilatada e não responsiva (Seruca et al., 2010). Em casos unilaterais, pode-se encontrar deficits no reflexo pupilar à luz directo e consensual aquando da estimulação do globo afectado, sendo que ao estimular o globo ocular não afectado o contralateral apresenta reflexo pupilar consensual (Shamir,
19
2007; Nell, 2008). O disco óptico parece edematoso com margens pouco distintas, hiperémico e elevado, podendo estar presentes hemorragias e exsudados no disco ou rodeando este. A retina peripapilar pode apresentar-se descolada (Penderis, 2004; Montgomery et al., 2008; Dubielzig et al., 2010).
Os casos de neurite óptica devem ser diferenciados de edema da papila, que é quase sempre bilateral, não estando associado a deficits visuais inicialmente e que normalmente resulta de uma elevação na pressão intracraniana (Nell, 2008; Ofri, 2008; Fitzmaurice, 2010). O papiloedema ocorre por compressão das fibras do nervo óptico intraorbital, devido a uma elevação da pressão do LCR no espaço subaracnóide. O papiloedema é por isso um processo mecânico e não um processo vascular (Nell, 2008).
Entre as possíveis causas de neurite óptica estão as doenças infecciosas, sobretudo a esgana, toxoplasmose, micoses sistémicas e doenças transmitidas por carraças (Stadtbäumer et al., 2004; Lavely et al., 2005; Shamir, 2007). No caso de associação ao vírus da esgana (paramixovirus), os sinais podem ser detectados antes, durante ou depois dos sinais clínicos de doença sistémica (Dubielzig et al., 2010).
Doenças inflamatórias como a meningoencefalite granulomatosa (MEG), esta patologia é descrita em pormenor mais à frente. Processos neoplásicos do globo ocular ou da órbita, acção de toxinas e fármacos, abcessos, trauma e deficits de vitamina A também já foram associados (Stadtbäumer et al., 2004; Montgomery et al., 2008; Ofri, 2008).
No entanto, na grande maioria dos casos, a etiologia desta patologia fica por diagnosticar, acabando os casos por serem classificados como idiopáticos (Jones, 1995; Ofri, 2008; Dubielzig et al., 2010; Lorenz, 2011).
5.2.2 - Meningoencefalite granulomatosa
A MEG é definida como uma doença inflamatória não supurativa do SNC que afecta principalmente a substância branca do cérebro e medula espinhal. Teorias sobre causas infecciosas têm sido avançadas mas para já ainda não foi isolado qualquer agente (Thomas, 1998; Nuhsbaum et al., 2002; Schwab et al., 2007).
A apresentação típica de MEG é aguda, progressiva e multifocal, sendo fatal se não for tratada (De Lahunta et al., 2009; Schatzberg, 2010; Talarico et al., 2010). Afecta sobretudo fêmeas, de meia-idade ou jovens, de raças toy e Terrier, mas pode afectar qualquer animal de qualquer sexo, raça ou idade entre os 6 meses a 12 anos (Granger et al., 2009; Schatzberg, 2010).
Esta patologia apresenta três formas: focal, multifocal e ocular (Nuhsbaum et al., 2002; Schatzberg, 2010). A forma focal é menos comum. A sua evolução pode ser
20
progressiva e lenta, ou pode manifestar-se de forma aguda, com sinais sugestivos de uma lesão tipo massa (Schatzberg, 2010).
A forma multifocal é a mais comum. Manifesta-se de forma aguda, com progressão rápida e sinais neurológicos variados que envolvem o cérebro, tronco cerebral caudal, cerebelo e medula espinhal cervical (Schatzberg, 2010).
A forma ocular manifesta-se por uma cegueira súbita, com alterações pupilares e edema do disco óptico variáveis (Schatzberg, 2010; Talarico et al., 2010).
Os sinais clínicos mais comuns são dor cervical e ataxia ou paresia. Outros sinais frequentemente encontrados são comportamento anormal, convulsões, cegueira e sinais vestibulares (Thomas, 1998; Talarico et al., 2010).
O diagnóstico antemortem é um desafio, visto ser necessária a confirmação histopatológica para um diagnóstico definitivo. Normalmente é feito um diagnóstico presuntivo baseado na história clínica, sinais clínicos, análise de LCR e imagiologia avançada (Talarico et al., 2010).
A recolha de LCR para o diagnóstico desta patologia nem sempre é útil já que, pode por vezes, apresentar-se dentro dos valores normais (Schatzberg, 2010). Quando há envolvimento das leptomeninges, pode apresentar uma pleocitose mononuclear leve a moderada, com elevação da proteína total. Mas também uma pleocitose linfocítica, neutrofílica ou mista (Terlizzi et al., 2005b; Vernau et al., 2008).
O diagnóstico imagiológico por RM é o que melhor revela a presença de lesões particularmente quando são focais (De Lahunta et al., 2009). Apesar de apresentar uma predilecção pela substância branca, a MEG não apresenta uma distribuição topográfica distinta. Tipicamente, as lesões apresentam-se hiperintensas em imagens T2-W e em FLAIR, iso ou hipointensas em T1-W, com grande variação no grau de reforço após administração de contraste (Hecht et al., 2010b).
5.2.3 - Encefalites necrosantes
A encefalite necrosante (EN) é uma doença intracranial, idiopática e específica de determinadas raças de cães. O seu diagnóstico é feito predominantemente em animais jovens. Em termos histológicos, o cérebro apresenta inflamação não supurativa com necrose extensa (Levine et al., 2008; De Lahunta et al., 2009; Young et al., 2009).
Dentro das raças afectadas, foram identificados dois padrões de localização das lesões. A primeira variante designada por meningoencefalite necrozante (MEN) é encontrada em cães da raça Pug e Maltês. A MEN tem predilecção pelos hemisférios cerebrais com necrose assimétrica e inflamação da substância cinzenta cortical, substância branca subcortical e envolvimento das meninges adjacentes. Também é possível