D
Caraterização
estrutural de
novos pigmentos
responsáveis pela
cor de vinhos do
Porto
envelhecidos
Frederico João Marques Nave
Doutoramento em Química
Departamento de Química 2014Orientador
Victor Armando Pereira de Freitas, Professor Catedrático, Faculdade de Ciências da Universidade do Porto
Agradecimentos
Em primeiro lugar quero expressar a minha gratidão ao Professor Doutor Victor A. P. Freitas, meu orientador de doutoramento. A amizade e ensinamentos que me dispensou foram imprescindíveis para crescer e conseguir terminar este empreendimento. Obrigado por acreditar até ao fim.
Ao Prof. Dr. Nuno Mateus, também pela amizade e apoios dispensados ao longo dos anos.
Ao Professor Doutor Fernando Pina, da Universidade Nova de Lisboa (e todos os colegas do Grupo de Fotoquímica, em especial ao Doutor Vesselin Petrov que pacientemente me acompanhou nos pH jumps e Prof. Dr. António Parola) pela simpatia, conhecimentos e amizade oferecidos.
À Professora Doutora Maria João Ramos e Dr.ª Natércia Brás pelos cálculos quânticos para determinação da geometria das moléculas.
Ao Prof. Dr. Olivier Dangles da Université d’Avignon pelos conhecimentos de matemática e termodinâmica que partilhou comigo.
Ao Prof. Dr. Patrick Trouillas e Florent di Meo pelos cálculos em TD-DFT.
Aos meus colegas de laboratório, Natércia (e Duarte), Rui, Luís, Joana, Joaninha, Ana Luísa, André, Susana e Iva, agradeço a amizade (e saberes e laboratório e compostos) partilhados.
Ao Prof. Dr. Enrique Borges pelas ideias em síntese orgânica e simpatia.
Ao Professor Doutor Artur Silva, da Universidade de Aveiro pelas facilidades concedidas na espectroscopia de RMN.
À Dr.ª Adelina Macedo pela assistência técnica e amizade demonstrada.
Aos meus amigos Rafi, Peixe (e Bárbara), Alex e Marina, André e Catarina (João e Francisco), Sofia e Daniel (e João) e Marco e Eunice me acompanharem.
Aos meus amigos Rute, Alexandre, Marina, Vera, Telma, Filipa, Catarina e Ana Teresa pelas oportunidades de aprendizagem e crescimento.
À minha mãe por ter estado presente todos estes anos.
À minha restante família por me acompanhar desde o início.
À minha família mais recente, em especial Ana Isabel, Maria José, Maria de Lurdes e Artur, por também estarem comigo.
À equipa do hospital Francisco Gentil, bem como como aos Dr. José Balcão, Maria João, Augusto pela dedicação e amizade.
Ao José Patrão, turma 9A e resto do dojo Murakami pelo companheirismo.
À Andreia por ter sido a primeira pessoa a acreditar neste projeto.
Por fim, à FCT (Fundação para Ciência e Tecnologia) pelo financiamento concedido através da bolsa de doutoramento (SFRH/BD/30294/2006).
À Andreia À Maria Antónia
“… we live in an era of perfect methods and confused aims.
For example in organic chemistry the known synthetic methods allow us to prepare an astronomical number of compounds; the gap between the possible and the relevant becomes larger every day.”
Resumo
Os adutos do tipo F-A+ (flavan-3-olantocianina) são pigmentos resultantes da evolução de antocianinas durante o processo de envelhecimento do vinho. A sua natureza antociânica torna-os sensíveis à alteração as suas propriedades cromáticas (traduzidas em mudança de cor) em função do pH da solução. Os trabalhos desenvolvidos permitiram não só compreender o comportamento das adutos F-A+ em vinhos como também estabelecer as condições para a sua utilização como corantes alimentares ou pigmentos noutro tipo de matrizes.
Iniciaram-se os trabalhos estabelecendo técnicas de síntese que permitiram obter as quantidades necessárias para fases subsequentes do projeto. Concomitantemente foram desenvolvidos métodos de análise e quantificação (por HPLC-DAD e espectrometria de massa) dos adutos em soluções hidroalcoólicas.
De seguida procedeu-se à caracterização cromática dos adutos F-A+ determinando os equilíbrios termodinâmicos e cinéticos das suas reações ácido-base com recurso a técnicas de relaxação, nomeadamente pH jumps. Estabeleceram-se assim os valores de pH que governam as cores de soluções hidroalcoólicas destes compostos.
Posteriormente estudou-se a reatividade da unidade flavan-3-ólica dos adutos através da execução de reações de condensação flavanólica direta e mediada por acetaldeído. Os polímeros resultantes de ambas as reações foram caracterizados por espectroscopia de UV/Vis e massa. Também se verificou a sua existência em vinhos do Porto envelhecidos.
A reatividade da unidade antociânica também foi estudada através da formação de adutos flavan-3-olvitisina e flavan-3-olpinotina. Os compostos resultantes foram caracterizados por espectroscopia de UV/Vis e massa. Foi também detetada a existência de alguns adutos flavanol-vitisina em vinhos do Douro DOC.
Por fim, estudou-se a capacidade destes pigmentos resistirem à descoloração através de reações de copigmentação. Verificou-se que, ao contrário de antocianinas simples, a capacidade copigmentativa dos adutos F-A+ não é afetada negativamente pelo aumento de temperatura. Estabeleceu-se ainda que, no caso destes adutos, a copigmentação se efetua essencialmente através de pontes de hidrogénio e que os copigmentos deverão possuir dimensões reduzidas para compensar o impedimento estéreo adicional.
Abstract
F-A+ (flavan-3-olanthocyanin) adducts are pigments that appear during wine ageing. Their anthocyanic nature makes them prone to chromatic changes (perceived as colour changes) as result of the pH of the solution. This work allowed a better understanding the behavior of F-A+ adducts in wines and the establishment of the basis for their use as food colorants or dyes in other matrices.
This work started by creating synthetic routes that allowed the preparation of F-A+ adducts in the necessary quantities to perform further studies. At the same time, methodologies for analysis and quantification of these adducts in hydroalcoholic solutions were established.
Afterwards, a chromatic characterization was performed by determining the thermodynamic and kinetic acid-base equilibria undergone by the adducts using relaxation techniques such as pH jumps.
The reactivity of the flavan-3-olic moiety of the adducts was tested by performing direct and (acetaldehyde) mediated condensation reactions with flavanols. The resulting polymers were characterized by HPLC-DAD and mass spectrometry (MS). Their existence in aged Port wines was also demonstrated.
The reactivity of the anthocyanic moiety was also tested by preparing flavanvitisin and flavanolpinotin adducts. These compounds were also characterized by HPLC-DAD and MS. Some flavanolvitisin adducts were detected in Douro DOC wines.
Finally, the ability of these pigments resist to bleaching through copigmentation was also studied. Contrary to simple anthocyanins, the F-A+ adduct copigmentation phenomenon is resistant to temperature rising. It was established that for this type of adducts the copigmentation is mainly driven by hydrogen bonding. Also, the best copigments should present reduced size in order to compensate the additional steric hindrance of the adduct.
Resummé
Les adduits du tipe F-A+ (flavan-3-olanthocyane) sont des pigments qui résultent de l’évolution des anthocyanes au cours du vieillissement du vin. Leur nature anthocyanique les rendent sensibles de changer leurs propriétés chromatiques en fonction du pH du milieu. Les résultats obtenus ont permis de comprendre le comportement des adduits dans le vin et aussi d’établir les conditions de leur utilisation comme colorants alimentaires.
Dans un premier temps, nous nous avons consacré à obtenir des techniques de synthèse des adduits pour produire les quantités nécessaires aux phases suivantes. Au même temps, nous avons développé des méthodes d’analyse des adduits (par HPLC-DAD et spectrométrie de masse) en solutions hydro-alcooliques.
Dans un deuxième temps, nous avons effectué la caractérisation des adduits du type F-A+ en determinant leurs équilibres thermodynamiques et cinétiques des reactions (acide-base) de ces composés grâce à des techniques de relaxation (dans ce cas, pH
jumps). Les résultats ont permis de connaître les valeurs de pH qui régissent les
couleurs des solutions hydro-alcooliques des adduits F-A+.
La réactivité de l’unité flavan-3-olique des adduits a été étudié postérieurement par des réactions de condensation directe (et par l’intermédiaire d’acétaldéhyde) entre les flavan-3-ols et les adduits. Les polymères obtenus ont été caractérisés par HPLC-DAD et spectrométrie de masse et son existence a été également vérifié dans les vins du Porto vieillis.
Nous avons également étudié la réactivité de l’unité d'anthocyane des adduits F-A+ par
la synthèse des adduits flavan-3-olvitisine et flavan-3-olpinotine. Ces substances ont été analysées par HPLC-DAD et par spectrométrie de masse. L’existence de quelques adduits flavan-3-olvitisine dans les vins du Douro AOC a aussi été confirmée.
Finalement, nous avons étudié la capacité de ces pigments de résister à la décoloration grâce a des réactions de copigmentation. On a constaté que, au contraire des anthocyanes simples, pour les adduits F-A+, la réaction de copigmentation n'est pas affecté par l’augmentation de la température. Nous avons aussi conclu que pour ces composés la copigmentation est faite principalement par des liaisons d’hydrogène et que les copigments devront possédé une taille réduite pour compenser l’encombrement stérique supplémentaire.
Palavras-chave
Adutos F-A+; Cat-Mv3Glc, pigmentos do vinho, constante de acidez; Ka; constante de
hidratação; Kh; constante de copigmentação; Kcop; polimerização de procianidinas;
polimerização mediada por acetaldeído; ponte metil-metino; vitisinas; piranoantocianinas; pinotinas; fenol-piranoantocaninas; antocianinas.
Keywords
F-A+adducts; Cat-Mv3Glc; wine pigments; acid dissociation constant; Ka; hydration
equilibrium constant; Kh; copigmentation constant; Kcop; procyanidin polymerization;
aldehyde mediated polymerization; methyl-methyne bridge; vitisins; pyranoanthocyanins; pinotins; phenol-pyranoanthocyanins; anthocyanins
Mots-clefs
Adduits F-A+; Cat-Mv3Glc, pigments du vin; constante d'acidité; Ka; constante
d'équilibre de l’hydratation; Kh; constante de copigmentation; Kcop; polymerisation de
procyanidines; condensation par l’intermédiaire d'acétaldéhyde; ponts d’hydrogène; pont d’éthyle; vitisines; pyranoanthocyanes; hydroxyphénilpyranoanthocyanes; anthocyanes.
Índice
Lista de quadros………..iii Lista de equações………v Lista de figuras……….x Lista de abreviaturas……….xx 1 Preâmbulo ... 1 2 Revisão bibliográfica ... 32.1 Definição dos compostos fenólicos ... 3
2.2 Classificação dos compostos fenólicos ... 3
2.2.1 Flavonoides ... 4
2.3 Evolução dos compostos fenólicos do vinho ... 47
2.3.1 Evolução dos compostos fenólicos na uva ... 47
2.3.2 Evolução dos compostos fenólicos durante o fabrico do vinho ... 49
2.3.3 Evolução dos compostos fenólicos durante o envelhecimento do vinho ... 50
3 Obtenção e análise de adutos F-A+... 55
3.1 Introdução... 55
3.2 Modos de preparação ... 55
3.2.1 Material e procedimentos experimentais ... 55
3.2.2 Resultados e discussão ... 58
3.3 Métodos de análise ... 64
3.3.1 Material e procedimentos experimentais ... 65
3.3.2 Resultados e discussão ... 67
3.4 Conclusão... 80
4 Estudo das propriedades físicas e químicas dos adutos F-A+ ... 82
4.1 Introdução... 82
4.2 Material e procedimentos experimentais ... 85
4.2.1 Potenciometria ... 86
4.2.2 Espectroscopia de absorção ... 86
4.2.3 Espectroscopia de absorção com equipamento de stopped flow ... 86
4.3 Resultados e discussão ... 86
4.3.1 Equilíbrios termodinâmicos ... 89
4.3.2 Equilíbrios cinéticos ... 102
4.3.3 Diagramas de níveis de energia ... 109
4.3.4 Equilíbrios em meio hidroalcoólico da Mv3Glc ... 111
4.4 Conclusão... 114
5.1 Introdução... 116
5.2 Produtos da reação direta entre flavan-3-óis e adutos diméricos F-A+. ... 122
5.2.1 Material e procedimentos experimentais ... 123
5.2.2 Resultados e discussão ... 126
5.3 Formação de adutos com pontes metil-metino ... 134
5.3.1 Material e procedimentos experimentais ... 135
5.3.2 Resultados e discussão ... 137
5.4 Conclusão... 148
6 Reatividade da unidade antociânica dos adutos F-A+ ... 150
6.1 Introdução... 150
6.2 Formação de Catequina-PiranoMalvidinas ... 154
6.2.1 Material e procedimentos experimentais ... 154
6.2.2 Resultados e discussão ... 157
6.3 Formação de Catequina-PiranoMalvidina-Fenol………. 164
6.3.1 Material e procedimentos experimentais ... 165
6.3.2 Resultados e discussão ... 165
6.4 Conclusão... 169
7 Copigmentação ... 171
7.1 Introdução... 172
7.2 Material e procedimentos experimentais ... 178
7.2.1 Espectroscopia UV/Vis ... 179
7.2.2 Estudos da hidratação aparente (pK’h) do aduto Cat-(48)-Mv-3-Glc ... 179
7.2.3 Estudos de copigmentação ... 180
7.3 Resultados e discussão ... 180
7.3.1 Estudos da hidratação aparente (pK’h) da Cat-(48)-Mv3Glc ... 181
7.3.2 Estudos da copigmentação (Kcop) do aduto Cat-(48)-Mv3Glc ... 187
7.4 Conclusão... 196
8 Conclusão geral ... 199
Referências bibliográficas ... 202
Anexo I ... 236
Lista de quadros
Quadro 2.1 Classes de falvan-3-óis. Os substituintes indicados referem-se aos das estruturas representadas na Fig.2.2……… 6 Quadro 2.2 Propriedades físicas das subclasses de flavan-3-óis………... 8 Quadro 2.3 Valores dos desvios padrão, em ppm, dos sinais de protão e de carbono
para a catequina. Adaptado de Bond et al.[56]……… 12 Quadro 2.4 Nomenclatura das procianidinas mais comuns………. 17 Quadro 2.5 Estrutura de algumas antocianinas………. 27 Quadro 2.6 Valores dos desvios padrão, em ppm, dos sinais de protão e carbono
para a Mv3Glc.[114]………... 38 Quadro 2.7 Teor em antocianinas de alguns alimentos.[104, 174]………... 39 Quadro 2.8 Valores dos desvios padrão, em ppm, dos sinais de protão e carbono
para os aduto F-A+ (Cat-Mv3Glc).[207]………... 46 Quadro 3.1 Rendimentos e resultados das várias abordagens de síntese de dímeros
F-A+ via decomposição ácida de procianidinas………. 61 Quadro 3.2 Rendimentos das reações de síntese de adutos F-A+ a partir da redução
da taxifolina. Estão registados o efeito da despolimerização por decomposição ácida bem como as sínteses com melhor e pior
rendimento………... 62
Quadro 3.3 Tempos de retenção dos adutos F-F-A+, F-A+ e respetivos precursores antociânicos reportados por diversos autores………... 67 Quadro 3.4 Equações das curvas de calibração e respetivos coeficientes de
correlação, limites de deteção e quantificação……….. 69 Quadro 3.5 Quadro de atribuições de RMN (1H e 13C) relativo à Cat-(48)-Mv3Glc….. 79 Quadro 4.1 Valores determinados das constantes termodinâmicas de equilíbrio
(representadas sob função p) do aduto dimérico Cat-Mv3Glc……… 100 Quadro 4.2 Expressões dos numeradores das equações das frações molares de
algumas formas de equilíbrio do aduto dimérico. Para obtenção das expressões completas deve ser usado em conjunto com a Equação 4.32.. 101
Quadro 4.3 Valores determinados das constantes cinéticas do aduto dimérico
Quadro 4.4 Valores das constantes de equilíbrio das interconversões antociânicas referentes a oenina. São apresentados os valores determinados durante este trabalho e os publicados por outros autores………. 112 Quadro 4.5 Valores determinados e tabelados das constantes cinéticas da oenina
(Mv3Glc)………... 113 Quadro 5.1 Quadro de atribuições de RMN (1H e 13C) relativo ao aduto trimérico
Cat-(48)-Cat-(48)-Mv3Glc……….. 132 Quadro 7.1 Variação dos valores de pK'h do aduto dimérico e da oenina com a
temperatura………. 185
Quadro 7.2 Valores determinados das constantes de copigmentação a 25 °C (através da Equação 7.2) e energia de Gibbs, entalpia e entropia molar padrão de copigmentação determinados por projeções de Van’t Hoff (Equação 7.20 e Equação 7.21) das reações entre o aduto dimérico (1 × 10-4 M) e os copigmentos CP1 a CP3 (rácio molar 1:20) em soluções hidroetanólicas tamponizadas a pH 3,5……….. 193
Lista de equações
Equação 2.1 Determinação do teor em antocianinas totais. A é a absorvância corrigida, PM representa o peso molecular da antocianina que existe em maior quantidade na amostra, F o fator de diluição, o coeficiente de absortividade molar da antocianina principal da amostra e l o percurso óptico. Caso essa antocianina seja desconhecida, normalmente utilizam os valores da cianidina-3-glucósido (PM = 449,2 g·mol-1 e = 26900 mol-1·L·cm-1) e expressam-se os valores obtidos
em equivalentes desta molécula.[152]………. 34
Equação 3.1 Expressão para determinação do limite de deteção. Sa corresponde ao desvio padrão da resposta e m ao declive da regressão linear………… 69
Equação 3.2 Expressão para determinação do limite de quantificação. Neste caso, Sa corresponde ao desvio padrão da resposta e m ao declive da regressão linear………. 69
Equação 4.1 Reação de transferência protónica (Ka1)………... 87
Equação 4.2 Reação de hidratação (Kh)……….. 87
Equação 4.3 Reação de tautomerização (Kt)……….. 87
Equação 4.4 Reação de isomerização (Ki)……….. 87
Equação 4.5 Reação de transferência protónica (Ka2)………... 87
Equação 4.6 Reação de transferência protónica (Kh-)………... 87
Equação 4.7 Reação de transferência protónica (Kt-)……… 87
Equação 4.8 Reação de transferência protónica (Ki-)……… 87
Equação 4.9 Reação de equilíbrio ácido base simplificada para o catião flavílio a valores de pH levemente ácidos (K’a)……… 87
Equação 4.10 Relação entra a concentração da base conjugada e as várias formas antociânicas em equilíbrio com o catião flavílio………... 87
Equação 4.11 Constante de equilíbrio (aparente ou térmica) para a reação de equilíbrio ácido-base simplificada……….. 88
Equação 4.12 Relação entre a constante de equilíbrio aparente e as restantes constantes de equilíbrio………... 88
Equação 4.13 Reação de equilíbrio ácido base simplificada para o catião flavílio para valores de pH moderadamente ácidos a moderadamente básicos (K’’a)………. 88
Equação 4.14 Relação entra a concentração da base conjugada aniónica e as várias formas antociânicas aniónicas em equilíbrio……….... 88
Equação 4.15 Constante de equilíbrio (aparente ou térmica) para a segunda reação de equilíbrio ácido-base simplificada (K’’a).…….………. 88
Equação 4.16 Relação entre a segunda constante de equilíbrio aparente e as restantes constantes de equilíbrio..………... 88 Equação 4.17 Relação entre a fração molar de [AH+] e a constante de acidez
aparente K’a……… 88
Equação 4.18 Expressão para a determinação da fração molar experimental………… 89 Equação 4.19 Fração molar (global) de AH+ ignorando as reações de hidratação,
tautomerização e isomerização……….. 92 Equação 4.20 Fração molar (global) de A ignorando as reações de hidratação,
tautomerização e isomerização……….. 92 Equação 4.21 Fração molar (global) de A- ignorando as reações de hidratação,
tautomerização e isomerização……….. 92 Equação 4.22 Fração molar da forma flavílio considerando as constantes de acidez
aparente……….. 94
Equação 4.23 Fração molar da base conjugada neutra considerando as constantes
de acidez aparente……… 94
Equação 4.24 Fração molar da base conjugada aniónica considerando as constantes
de acidez aparente……… 94
Equação 4.25 Expressão para o fitting aos pontos experimentais obtidos através das constantes de acidez aparente………... 95 Equação 4.26 Definição da constante de pseudoequilíbrio aparente (K^a)………... 96
Equação 4.27 Relação entre a fração molar de AH+ e a constante de pseudoequilíbrio (K^a)………... 97
Equação 4.28 Relação entre a fração molar de A e (K^a)……… 98
Equação 4.29 Relação entre a fração molar de B e (K^a)……… 98
Equação 4.30 Relação entre a fração molar de Cc e (K^a)……….. 98
Equação 4.31 Relação entre α^ e β^……… 98 Equação 4.32 Equação tipo para definição das frações molares das formas
antociânicas (Cat-(48)-Mv3Glc) em equilíbrio em solução hidroalcoólica. Os numeradores variam em função da forma de equilíbrio pretendida (consultar o Quadro 4.2)………. 100 Equação 4.33 Relação entre a constante de reação observada do processo de
hidratação (kobs) e as constantes de reação de hidratação (kh) e de
Equação 4.34 Equação usada para ajuste aos pontos experimentais das constantes de reação observadas para o processo de hidratação do aduto
Cat-Mv3Glc……….... 106
Equação 4.35 Relação entre a constante de equilíbrio (de hidratação) e as constantes de reação do seu processo direto e reverso……… 107 Equação 4.36 Relação entre a constante de reação observável de isomerização e as
constantes de reação do processo direto e inverso de isomerização….. 108 Equação 4.37 Equação usada para ajuste aos pontos experimentais das constantes
de reação observadas para o processo de hidratação da oenina
(Mv3Glc)………. 113
Equação 4.38 Equação usada para cálculo da constante de reação direta da tautomerização da oenina……… 113 Equação 7.1 Equação usada para o cálculo da constante de hidratação aparente
(resultado do equilíbrio entre a constante de acidez e a constante de hidratação) do aduto Cat-Mv3Glc (1 × 10-4 M) em soluções hidroetanólicas (9:1). 𝐴0𝑟𝑒𝑓é o valor de absorvância de uma solução de
pigmento a pH << 1, a 535 nm e 𝐴 o valor de absorvância da solução de pigmento a pH 3,5, a 535 nm. A expressão foi adaptada de Galland
et al.[107]………... 180
Equação 7.2 Equação usada para o cálculo da constante de copigmentação estabelecida entre o aduto Cat-Mv3Glc (1 × 10-4 M) e os vários copigmentos (CP1 a CP3) em soluções hidroetanólicas (9:1). 𝐶𝑃𝑡 representa a concentração total de copigmento, a = 1 + Kh/(10-pH), H = (A – A0)/A0 e r = εAHCP+/εAH+. Adaptado de Brouillard et al.[144]
Dangles et al.[302] e Galland et al.[107]………. 180 Equação 7.3 Equação de Van't Hoff, usada para calcular por regressão linear, a
entalpia e entropia de copigmentação do aduto Cat-Mv3Glc (1 × 10 -4 M) e os vários copigmentos (CP1 a CP3) em soluções hidroetanólicas (9:1, v/v). O valor de entalpia relaciona-se com o declive da reta enquanto o valor da entropia se pode extrair da ordenada na origem da reta determinada pela regressão linear dos pontos experimentais (constante de copigmentação calculada às várias temperaturas)……... 180 Equação 7.4 Absorvância (A0) da solução antociânica para valores de pH << 1. C
representa a concentração total da antocianina e ε[AH+] a absortividade
molar da forma flavílio da antocianina. Está assumido que o percurso óptico corresponde a 1 cm……….. 181
Equação 7.5 Concentração total da antocianina em solução como função das concentrações molares das suas formas de equilíbrio (desprezando as formas aniónicas)……….. 181 Equação 7.6 Absorvância de uma solução antociânica a valores de pH
moderadamente ácidos (2 < pH < 4). Os parâmetros e ε[X] e [X]
representam, respetivamente, a absortividade molar e a concentração das espécies (X) envolvidas no equilíbrio………. 182 Equação 7.7 Reação de hidratação da forma catiónica (AH+) da antocianina. A base
conjugada (B’) é definida como a soma das espécies resultantes direta e indiretamente da reação: A, B, Cc e Ct………... 182
Equação 7.8 Absorvância de uma solução antociânica a valores de pH moderadamente ácidos, considerando como espécies existentes a forma catiónica (AH+) e a base conjugada (B’) da hidratação…………... 182 Equação 7.9 Equação simplificada para a absorvância de uma solução antociânica
a valores de pH moderadamente ácidos……….. 182 Equação 7.10 Constante aparente de hidratação. B' representa a base conjugada
definida ut supra. A relação pode também ser apresentada em função da concentração de B’, útil para conceber a expressão da Equação 7.1……….... 183 Equação 7.11 Expressão para a concentração da forma catiónica (AH+) de uma
solução de antocianina a valores de pH moderadamente ácidos em função do pH da solução e da concentração total de antocianina……... 183 Equação 7.12 Expressão para a constante de hidratação aparente de uma solução
de antocianina a valores de pH moderadamente ácidos, dada em função do valor de pH da solução e dos valores de absorvância da solução ao pH de medição e a um valor pH bastante baixo (absorvância de referência, notada como A0)……….. 183
Equação 7.13 Reação de copigmentação da forma catiónica (AH+) da antocianina com copigmento genérico (CP). Assume-se uma estequiometria de complexação de 1:1……….. 190 Equação 7.14 Constante de copigmentação da reação indicada na Equação 7.13. A
relação pode também ser apresentada em função da concentração do complexo de copigmentação, AHCP+……… 189 Equação 7.15 Equação da absorvância de uma solução antociânica sem
copigmentos, a valores de pH moderadamente ácidos (3,5). C refere a concentração total de antocianina, quer em forma catiónica (AH+) quer na forma de base conjugada incolor (B’). A concentração da forma catiónica é dependente do valor de pH da solução e da constante de hidratação aparente K’h……… 189
Equação 7.16 Concentração total da antocianina (C) em solução como função das concentrações molares das suas formas de equilíbrio (forma catiónica e base conjugada) e o complexo antocianina-copigmento……… 189 Equação 7.17 Expressão para a concentração da forma catiónica (AH+) de uma
solução de antocianina na presença de copigmento, a valores de pH moderadamente ácidos refletindo o pH da solução, a hidratação aparente da antocianina e o equilíbrio de copigmentação………. 190 Equação 7.18 Equação da absorvância de uma solução antociânica com copigmento
a valores de pH moderadamente ácidos (3,5), refletindo os equilíbrios de hidratação aparente e copigmentação………. 190 Equação 7.19 Expressão para determinar o valor da constante de copigmentação de
soluções hidroetanólicas de antocianinas moderadamente ácidas na presença de excesso de copigmento (1:20) relacionando as respetivas concentrações, constante de hidratação e pH da solução………. 191 Equação 7.20 Equação de Van't Hoff para variação da energia de Gibbs padrão de
uma reação com constante K………. 192 Equação 7.21 Equação de Van't Hoff dada em função da constante de reação
(copigmentação) e as respetivas entalpia e entropia padrão de reação. 192
Equação 7.22 Equação de Benesi-Hildebrand para determinar a constante de copigmentação (m) e/ou coeficiente de absortividade molar do complexo de copigmentação (b), tendo como abcissa o inverso da concentração do copigmento (fator variável) e como ordenada a razão entre concentração de antocianina catiónica (fator fixo) e o valor de absorvância da solução a um dado comprimento de onda (no sistema estudado seria de 535 nm)……….. 196
Lista de figuras
Fig. 2.1 Estrutura do núcleo flavânico. É apresentada a numeração dos carbonos e a
designação dos anéis………. 5
Fig. 2.2 Estrutura dos vários flavan-3-óis. Os substituíntes (R1 – 10) de alguns exemplos
das várias subclasses estão descritas no Quadro 2.1………..…… 6 Fig. 2.3 Rotação da estrutura tridimensional da (+)-catequina. Os carbonos
assimétricos estão assinalados com asterisco bem como os anéis A, B e C. A conformação exibida é simultaneamente equatorial (anel B) e em sofá C3. Os átomos de carbono estão assinalados a azul, os de oxigénio a vermelho e os de hidrogénio a branco………... 7 Fig. 2.4 Padrão de fragmentação típico dos flavan-3-óis exemplificado com a catequina
em modo de fragmentação positivo. Parcialmente adaptado de Benavides[59] e Cren-Olivé[63]……….…... 11 Fig. 2.5 Esquema geral das proantocianidinas com ligações tipo B (46 e 48) e grau
de polimerização variado, de diméricas (n = 0) a oligoméricas ( 1 ≤ n ≤ 2) a poliméricas (n ≥ 2). Adaptado de Mateus, Haslam e Tarascou.[39, 43, 73]………….
14 Fig. 2.6 Estrutura da procianidina A2. Adaptado de Tarascou[73]……….. 16 Fig. 2.7 Estrutura e estereoquímica absoluta das 8 procianidinas (PC) diméricas do tipo
B. Adaptado de Mateus e Tarascou[40, 74]……….… 17 Fig. 2.8 Estruras tridimensionais dos rotâmeros compactos e extendidos da
procianidina C2 (Cat-Cat-Cat) e da procianidina B2 (Epicat-Epicat). Imagens retiradas de [76, 77]………. 18 Fig. 2.9 Reação de Bate-Smith para as procianidinas. Uma solução de procianidinas,
em meio ácido a quente origina cianidina, que apresenta cor vermelha………... 19 Fig. 2.10 Unidades glucosídicas ligadas às antocianinas mais frequentemente descritas
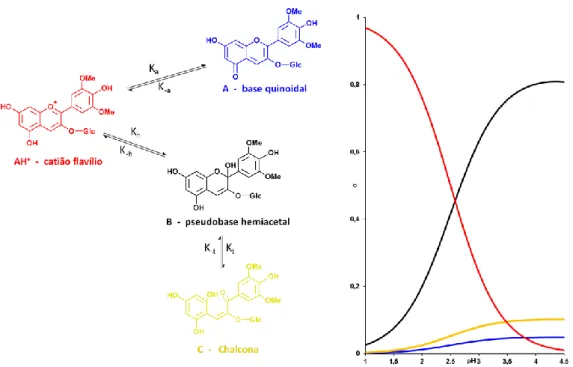
na literatura.[94]………. 28 Fig. 2.11 Ácidos fenólicos mais comuns que se encontram ligados às antocianinas.[118]... 28 Fig. 2.12 Esquema da reatividade das antocianinas………. 29 Fig. 2.13 Formas gerais de equilíbrio das antocianinas em função do pH do meio. A
forma chalcona não é diretamente dependente do pH, embora a sua forma precursora (hemiacetal) seja. Com exceção do hemiacetal que é incolor, as outras formas estão representadas na sua cor caraterística. À direita, está um gráfico da fração molar de cada forma em função do pH da solução.[34, 124]A cor de cada molécula de antocianina é influenciada pela padrão de hidroxilação e metoxilação da própria molécula. Foi demonstrado que um aumento do número de grupos hidroxilo tem como resultado a intensificação da cor azul ao passo que o número de grupos metoxilo influencia a intensidade da cor vermelha das soluções de antocianinas.[125]……….. 30
Fig. 2.14 Mecanismo geral de degradação das antocianinas.[95]………. 31 Fig. 2.15 Diferentes tipos de interação entre antocianinas. Adaptado de Rein.[123]……….. 33 Fig. 2.16 Características espetrais de antocianinas purificadas de rabanete (derivados
de pelargonidina-3-soforósido-5-glucósido) a pH 1,0 e a pH 4,5.[152]………. 34 Fig. 2.17 Fragmentação das antocianinas utilizando condições suaves de ionização (25
V de energia de colisão em quadrupolo da Waters). A cisão da ligação OR4
ocorre se R4 = glucosilo. Adaptado de Alberts et al.[168]…….……… 36
Fig. 2.18 Fragmentação típica do anel C utilizando energias de colisão elevadas (50 V de energia de colisão em quadrupolo da Waters). Adaptado de Aberts et al. (2012).[168]………...………... 37 Fig. 2.19 Estrutura geral das piranoantocianinas e o equilíbrio entre as diferentes formas
do catião flavílio. Os grupos R1 e R2 podem ser H, OH, OCH3. O grupo R3 pode
ser glucose ou uma sua forma acetilada. R4 poderá ser H, COOH, CH3,
(vinil)fenol ou (vinil)flavonol……… 41 Fig. 2.20 Classes de piranoantocianinas. Adaptado de Rentzsch et al.[186]………... 42 Fig. 2.21 Mecanismo de formação de adutos F-A+. Parcialmente adaptado de Salas et
al.[201]……….. 44
Fig. 2.22 Mecanismo de formação de adutos A+-F. Parcialmente adaptado de Salas et
al.[201]………. 45
Fig. 2.23 Esquema biossintético simplificado dos flavonoides. CHS - chalcona sintase; CHI – chalcona isomerase; FS – flavona sintase; IFS – isoflavona sintase; FNR – flavona redutase; F3H – flavanona-3-hidroxilase; FLS – flavanol sintase; DFR – dihidroflavonol redutase; ANS – antocianidina sintase; GT – glucosil transferase.[218]………. 48 Fig. 2.24 Distribuição dos principais compostos fenólicos encontrados na uva à vindima.
De salientar que, nas variedades tintureiras (ex.: Alicante Bouchet) também se encontram antocianinas na polpa………. 49 Fig. 2.25 Cinéticas de extração dos compostos fenólicos.[224]………. 50 Fig. 2.26 Reação entre as antocianinas e os iões bissulfito. O produto é um flaveno
incolor………... 51
Fig. 2.27 Principais reações que envolvem as antocianinas durante o fabrico e envelhecimento do vinho.[194, 226]……….. 53 Fig. 3.1 Cromatogramas de uma síntese de Cat-Mv3Glc antes e após o aquecimento
em 10% de ácido fórmico (v/v) a 85 °C por 3 horas. De notar o aumento da área dos picos do dímero e trímero……….. 62
Fig. 3.2 Justaposição dos espectros da Mv3Glc () e do aduto Cat-Mv3Glc () entre
200 e 800 nm………... 70
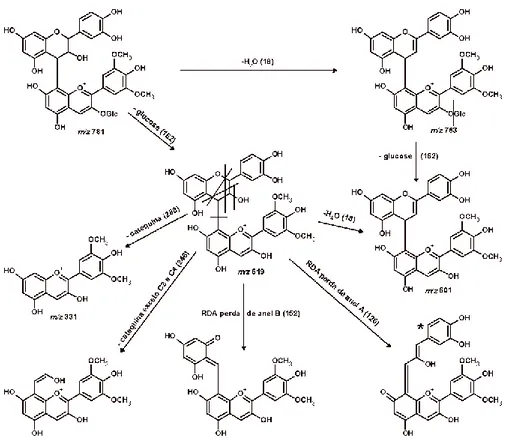
Fig. 3.3 Espectros da análise por HPLC-DAD-MS do aduto Cat-Mv3Glc. O varrimento de massa total (entre 250 e 2000 Da) está à esquerda. O pico com razão massa/carga correspondente ao aduto (m/z = 781) está assinalado a negrito. À direita estão o segundo (acima) e terceiro (abaixo) varrimentos de ampliação (MS2 e MS3, respetivamente)……….... 73 Fig. 3.4 Padrão de fragmentação proposto para a molécula Cat-(48)-Mv3Glc em
modo positivo. A molécula assinalada com um asterisco é um híbrido de ressonância entre o anel A da molécula de malvidina e o anel B do fragmento restante de catequina………. 74 Fig. 3.5 Espectro de RMN 1H para o aduto Cat-Mv3Glc com as respetivas atribuições.
Os sinais marcados com asterisco referem-se a uma impureza (ambos apresentam relação no 1H-COSY)………... 75 Fig. 3.6 Acoplamentos detetados no espectro de 1H-13C HMBC da
Cat-(48)--Mv3Glc………... 80 Fig. 4.1 Esquema proposto para as transformações estruturais do aduto dimérico
Cat-Mv3Glc em soluções aquosas e hidroalcoólicas. As estruturas estão representadas com a coloração aproximada da que apresentam em solução exceto as formas hemiacetal, que são incolores. Parcialmente adaptado de Nave et al.[279]………... 83 Fig. 4.2 Espectros de absorção do aduto Cat-Mv3Glc obtidos através de pH jumps de
soluções equilibradas de pH 1 para (2,45; 3,00; 3,59; 4,50; 5,70; 5,90; 6,00; 6,25; 7,15 e 7,20) 10 ms após a mistura, medidos em aparato de stopped flow. Abaixo dos 450 nm de os espectros apresentam comportamento errático devido aos limites do aparelho……….. 90 Fig. 4.3 Valores de absorvância (535 nm à esquerda e 620 nm ao centro) em função do
pH, medidas nos pH jumps monitorizados por stopped flow e respetivos fittings. À direita estão as frações molares (α) das espécies AH+
, A e A-, traçadas com os pKa1 e pKa2 determinados através dos fittings………..………. 90
Fig. 4.4 Processo de obtenção do fitting aos pontos medidos para determinação das constantes de acidez (pKa1 e pKa2) do aduto Cat-Mv3Glc usando o suplemento Solver no programa Microsoft Excel® 2007………. 91 Fig. 4.5 Espectros (região visível) das formas AH+, A e A- do aduto Cat-Mv3Glc obtidos
Fig. 4.6 Espectros de absorção do aduto Cat-Mv3Glc obtidos por pH jumps de soluções equilibradas a pH 1 para (1,65; 2,03; 2,47; 3,08; 3,34; 4,21; 5,19; e 6,39) até à obtenção de equilíbrio (tempo variável). A medição foi efetuada em espectrofotómetro Variant-Cary 5000i. A caixa inserida no canto superior direito é uma ampliação focada sobre os espectros de pH jumps superiores para permitir a distinção das diferenças……… 94 Fig. 4.7 Valores de absorvância a 535 nm em função do pH obtidos através dos pH
jumps monitorizados por espectroscopia UV/Vis. Os pontos representam os valores experimentais. A Linha representa o fitting obtido através da função
solver do Microsoft Excel 2007. A caixa no canto superior direito representa as
frações molares da forma flavílio (AH+) e das bases conjugadas neutra (CB) e aniónica (CB-) calculadas de acordo com as equações 4.22 a 4.24 e os K’a e
K’’a determinados………. 95
Fig. 4.8 Valores de absorvância ( = 535nm) de soluções de aduto dimérico em função do tempo obtidos através de pH jumps reversos. O gráfico à esquerda representa o pH jump de uma solução pseudoequilibrada (10 minutos) a pH 4 para um valor inferior a 1. O gráfico da direita representa um pH jump de 6,9 para valores inferiores a 1. Em ambos os gráficos os pontos medidos estão representados a preto enquanto a vermelho está representado a função monoexponencial e a azul a função biexponencial, obtidas através do fitting biexponencial (y = A1.e (-k 1 x) + A2.e (-k 2
x) + B) dos dados experimentais...………….
98
Fig. 4.9 Representação das frações molares das formas de equilíbrio do aduto dimérico Cat-(48)-Mv3Glc em função do pH……… 101 Fig. 4.10 Evolução dos espectros do aduto dimérico nos pH jumps de pH 1 para 2,45
(esquerda, topo), 4,50 (direita, topo) e 5,92 (em baixo). A evolução dos valores de absorvância (a 535 nm) em função do tempo encontra-se representada ao lado dos respetivos espectros. Os valores das constantes cinéticas observáveis resultantes dos fittings encontram-se junto dos pontos experimentais. Só no caso do pH jump de 1 para 5,92 a função ajustada foi biexponencial e por isso apresenta duas constantes cinéticas observáveis. A segunda constante cinética é muito mais lenta e o seguimento da reação foi efetuado num período de várias horas num espectrofotómetro sem stopped
flow mas de sensibilidade mais elevada. As constantes k1 das três curvas foram atribuídas ao processo de hidratação. À partida deveria verificar-se a diminuição da constante k1 (declive inicial das curvas) em função do aumento
do valor de pH final, mas à medida que o valor de pH da solução se torna mais básico, a hidratação passa a sofrer influência da presença de iões OH- e consequentemente a sua velocidade torna a aumentar (ver Equação
Fig. 4.11 Esquema de equilíbrios reacionais do dímero Cat-Mv3Glc agrupados em função das cinéticas reacionais. O pseudoequilíbrio A foi definido devido ao facto da reação de isomerização ter uma cinética muito mais lenta (horas em comparação com minutos) que o resto dos equilíbrios reacionais. O pseudoequilíbrio B ocorre relativamente à reação de tautomerização (a cinética reacional da reação de tautomerização torna-se a muito mais rápida que a cinética da reação de hidratação para valores de pH superiores a 1,2 e inferiores a 7,4)………... 104 Fig. 4.12 Constantes de reação observadas para os processos de hidratação (a rosa) e
tautomerização (a cinzento). As constantes medidas com pH jumps diretos estão representadas com quadrados e as constantes medidas com pH jumps reversos estão são representadas com círculos. A projeção da constante observada de tautomerização é efetuada pela reta cinzenta a tracejado. Na caixa está a ampliação dos pontos obtidos por pH jumps diretos com valores finais de pH entre 2,00 e 6,50. A curva ajustada para a variação da constante observável do processo de hidratação, por ajuste em Microsoft Excel® 2007 com suplemento solver, está representada a rosa. A sua expressão, baseada na Equação 4.34, com ajustes relacionados ao ataque do hemiacetal pela água, permite calcular os valores de kh e k-h……….. 106
Fig. 4.13 Constante de reação observável para o processo de isomerização. Os valores experimentais foram obtidos através de experiências de pH jump direto e posterior determinação por ajuste com suplemento solver em Microsoft Excel®
2007……… 108
Fig. 4.14 Diagrama de níveis de energia para o aduto dimérico Cat-Mv3Glc com os valores/expressões das constantes de reação. As constantes de reação das transferências protónicas são aproximações dos valores correspondentes para a Mv3Glc, descritos por Maçanita e colaboradores.[280] O diagrama só é válido para valores de pH que variam entre o ácido e o moderadamente ácido……….. 110 Fig. 4.15 Diagrama de Pina tridimensional para o aduto dimérico Cat-Mv3Glc. Na figura
apresenta-se a rotação da base do diagrama………..……….. 111 Fig. 4.16 Constantes de reação observáveis para os processos de hidratação (a
vermelho) e tautomerização (a cinzento) da Mv3Glc. Os valores das constantes foram determinados através de dados adquiridos por medições de pH jumps reversos. As curvas foram obtidas através da utilização do suplemento solver.. 112 Fig. 5.1 Mecanismos reacionais propostos para as reações de oxidação química de
flavonoides (flavan-3-óis e antocianinas) em mostos e vinho. Parcialmente adaptados de Monagas[2], Dueñas[57], Cheynier[320] e Sarni-Manchado[321]. R corresponde ao resto do éster hidroxicinâmico do ácido tartárico (-CHCHCOO-C[CO2H]COHCO2H)……….... 118
Fig. 5.2 Reações mediadas entre flavan-3-óis e antocianinas. Adaptado de Monagas et
al.[2], Drinkine et al.[327] A molécula inicial pode ser acetaldeído se R1 for CH3,
ácido glioxílico se R1 for COOH ou gliceraldeído se R1 for CHOH-CH2OH. R2 e
R4 podem ser um hidrogénio (nesse caso a molécula é um flavan-3-ol
monomérico) ou um flavan-3-ol (monomérico e/ou polimérico e, nesse caso a molécula trata-se de uma procianidina ou um tanino) ou uma antocianina (nesse caso a molécula é um aduto do tipo F-(A+)n). Igualmente, R3 também
pode ser um hidrogénio (antocianina monomérica), um flavan-3-ol (aduto do tipo A+-(F)n) ou antocianina (antocianinas poliméricas). O polímero resultante
da condensação mediada entre a antocianina e o flavan-3-ol é estabilizado resultando num composto de cor violeta. Para o caso do ácido glioxílico (R1 = COOH), o polímero resultante da condensação mediada de flavan-3-óis
evolui para catião xantílio, de cor amarela……….. 121 Fig. 5.3 Cromatograma, a 520 nm, da mistura reacional da síntese de adutos diméricos
(e triméricos) após decomposição ácida a quente (80 ºC durante 3 horas). Os picos cuja indicação se refere ao aduto trimérico possuem uma razão massa/carga de 1069……….. 127 Fig. 5.4 Sobreposição dos espectros do aduto dimérico Cat-Mv3Glc (a preto) e do
aduto trimérico Cat-Cat-Mv3Glc (a rosa) normalizadas para = 280 nm. Os máximos das bandas I e II são similares, embora existam variações entre as intensidades das bandas……… 128 Fig. 5.5 Espectros da análise por HPLC-DAD-MS do aduto trimérico Cat-Cat-Mv3Glc. O
varrimento de massa total (250 a 2000 Da) está à esquerda. O pico com razão massa/carga correspondente ao aduto (1069) está assinalado a negrito. À direita estão apresentados o MS2 (acima) e MS3 (abaixo)………... 128 Fig. 5.6 Padrão de fragmentação proposto para a molécula Cat-Cat-(48)-Mv3Glc em
modo positivo. O asterisco indica que as moléculas representadas são híbridos
de ressonância………. 130
Fig. 5.7 Espectro de RMN 1H para o aduto Cat-Cat-Mv3Glc com as repetivas
atribuições………. 131
Fig. 5.8 Mecanismo proposto para a síntese de adutos com ponte metil-metino (mm). R1, R2 = H ou Mv-3-O-Glc. Os carbonos flavânicos ligados por ponte mm estão numerados. O asterisco (*) denota carbono quiral, responsável pela existência de estereoisómeros nos adutos sintetizados……… 137 Fig. 5.9 Da esquerda para a direita: espectros UV/Vis do aduto dimérico
Cat-(48)-Mv3Glc e de polímeros por pontes metil-metino: Cat-mm-Cat-(48)-Mv3Glc e mm-(Cat-(48)-Mv3Glc)2………..……… 138
Fig. 5.10 Cromatograma (HPLC-DAD) da reação entre a catequina, acetaldeído e aduto dimérico. O pico do aduto é eluído aos 28 minutos. A partir dos 30 minutos ocorre uma "bossa" de material polimérico mal resolvido. Entre os 40 e os 60 minutos existem 4 picos (assinalados de A a D) que correspondem a isómeros de Cat-mm-Cat-(48)-Mv3Glc. Aos 42 e 53 minutos, ocorrem picos correspondentes a isómeros dos adutos mm-(Cat-(48)-Mv3Glc)2. Aos 68
minutos existe um pico correspondente a um isómero de (Cat-mm)2
-Cat--(48)-Mv3Glc e que possui quantidade suficiente para fragmentar………. 139 Fig. 5.11 Espectros de massa da análise por HPLC-DAD-MS do composto
Cat-mm-Cat--Mv3Glc. O varrimento de massa total (250 a 2000) está à esquerda. O composto apresenta uma razão massa/carga de 1097. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)………. 140 Fig. 5.12 Padrão de fragmentação proposto para a molécula Cat-mm-Cat-(48)-Mv3Glc
em modo positivo……… 141
Fig. 5.13 Espectros de massa da análise por HPLC-DAD-MS do composto (Cat-mm)2-Cat-(48)-Mv3Glc. O varrimento de massa total (250 a 2000) está
à esquerda. O composto apresenta uma razão massa/carga de 1413. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)…….. 142 Fig. 5.14 Zoom Scan a um dos sinais correspondentes à molécula de
(Cat-Mv3Glc)-mm--(Cat-Mv3Glc), m/z = 794 ou seja m/z =1588/2……….. 144 Fig. 5.15 Cromatograma (HPLC-DAD) da reação entre o acetaldeído e aduto dimérico. O
pico do aduto é eluído aos 27 minutos. A partir dos 20 minutos ocorre uma "bossa" de material polimérico mal resolvido. Entre os 40 e os 55 minutos existem 4 picos (assinalados de A a D) que correspondem a isómeros de mm- -(Cat-(4,8)-Mv3Glc)2………...………. 144
Fig. 5.16 Padrão de fragmentação proposto para a molécula (Cat-(48)-Mv3Glc)2-mm
em modo positivo………. 145
Fig. 5.17 Espectros de massa da análise por HPLC-DAD-MS do composto mm-(Cat- -(48)-Mv3Glc)2. O varrimento de massa total (250 a 2000) está à esquerda.
O composto apresenta uma razão massa/carga de 794. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)………. 146 Fig. 5.18 Cromatogramas (HPLC-MS) de frações do vinho de mesa com 2 anos
(esquerda, em modo SIM para m/z = 1097) e do vinho do Porto com 10 anos (direita, SIM para m/z = 794). Os picos estão assinalados com as letras de A a H para compostos com m/z = 1097 e I e J para compostos com m/z = 794……. 147
Fig. 6.1 Tipos de piranoantocianinas. R1, R2 = H, OH ou OCH3 (independentes um do
outro); R3 = O-glucose, O-cumaroílglucose ou O-acetilglucose; R4 = COOH (Vitisina A) ou H (Vitisina B); R5, R6, R8 ou R9 = H, OH ou OCH3
(independentes uns dos outros) e R7 = H ou flavan-3-ol………. 151 Fig. 6.2 Mecanismos genéricos de síntese de piranoantocianinas-fenóis: condensação
com vinilfenol (1) e condensação com ácido hidroxicinâmico (2). De notar que os produtos de ambas as reações (hidroxifenil-piranomalvidinas) são híbridos de ressonância com a distribuição de carga entre os átomos de oxigénio dos anéis pirânicos (C e D). Mecanismos parcialmente adaptados de Monagas et
al.[2]……….. 153
Fig. 6.3 Estrutura das Catequina-(48)-PiranoMalvidinas (Catequina-Vitisina A e B)….. 154 Fig. 6.4 Cromatogramas de HPLC-DAD (cima) e HPLC-MS-SIM (centro e baixo) da
reação entre o aduto Cat-Mv3Glc e o ácido pirúvico. O cromatograma do topo mostra o sinal a = 520 nm. O pico a 27,03 minutos corresponde ao aduto Cat-Mv3Glc. O cromatograma do centro mostra a visualização SIM a m/z = 849 (correspondendo o pico A ao aduto Cat-Vit A) enquanto o cromatograma inferior mostra uma visualização a m/z = 851 (correspondendo os picos B1 a B3 a aduto Cat-Mv3Glc substituído com radical ácido vinilmetanoico, ver Fig.
6.7)……… 158
Fig. 6.5 Espectros de massa da análise por HPLC-DAD-MS do composto Cat-Vit A (assinalado com letra A na Fig. 6.4). O varrimento de massa total (250 a 2000) está à esquerda. Está presente o aduto Cat-Mv3Glc (m/z = 781) porque não se conseguiu resolução cromatográfica entre os dois compostos. O composto apresenta uma razão massa/carga de 849. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)……… 159 Fig. 6.6 Padrões de fragmentação apresentados pelas moléculas Cat-Vit A (m/z = 849,
R = COOH) e Cat-Vit B (m/z = 805, R = H) em modo de fragmentação positivo. 159
Fig. 6.7 Mecanismo proposto para a formação de um aduto Cat-Mv3Glc substituído com radical ácido vinilmetanoico, que corresponde aos picos B1 a B3 assinalados na Fig. 6.4. Parcialmente adaptado de Drinkine et al.[333]…………... 160 Fig. 6.8 Espectros de massa da análise por HPLC-DAD-MS do composto Cat-Vit B. O
composto apresenta uma razão massa/carga de 805. O varrimento de massa total (250 a 2000) está à esquerda. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)……….. 162 Fig. 6.9 Cromatograma de massa (SIM, a m/z = 849) da fração de metanol acidificado a
Fig. 6.10 Cromatograma de massa (SIM, a m/z = 805) da fração de metanol acidificado a 40% (v/v) da amostra de vinho tinto Douro DOC……….... 163 Fig. 6.11 Cromatogramas de HPLC-DAD (topo) e HPLC-MS-SIM (centro e baixo) da
reação entre o aduto Cat-Mv3Glc e o 4-vinlfenol. O cromatograma do topo mostra o sinal a = 520 nm. O pico a 26,07 min corresponde ao aduto Cat-Mv3Glc. Existem outros sinais com m/z = 781 (31,71 e 35,98 min). O cromatograma ao centro mostra a visualização a m/z = 897, onde aparece o pico A (corresponde ao aduto Cat-PyMv3Glc10Ph) e o cromatograma inferior mostra uma visualização a m/z = 899 (picos B1 e B2 que apresentam fragmentação consistente com a estrutura do aduto Cat-PyMv3Glc10Ph). Aos cromatogramas SIM foram aplicadas funções gaussianas smoothing type de 7
pontos……… 166
Fig. 6.12 Espectros UV/Vis dos compostos correspondentes aos picos A (esquerda) e B1 (direita) dos cromatogramas de HPLC-DAD-MS SIM (897 e 899) de seguimento da reação entre o aduto Cat-Mv3Glc e o 4-vinilfenol (ver Fig. 6.11). 167
Fig. 6.13 Espectros de massa da análise por HPLC-DAD-MS do composto Cat-PyMv3Glc10Ph. O composto apresenta uma razão massa/carga de 897. O varrimento de massa total (250 a 2000) está à esquerda. À direita estão apresentadas as suas fragmentações: MS2 (acima) e MS3 (abaixo)……….. 167 Fig. 6.14 Padrão de fragmentação da molécula Cat-PyMv3Glc10Ph (m/z = 897) em
modo de fragmentação positivo……… 168 Fig.7.1 Esquema simplificado das transformações estruturais do aduto dimérico
Cat-Mv3Glc em soluções aquosas e hidroalcoólicas. A cor das estruturas (exceto o hemiacetal, que é incolor) reflete a cor que as moléculas apresentam em solução. Também está representada a série de equilíbrios que as várias formas estruturais estabelecem entre si e a sua relação com o pH da solução. Parcialmente adaptado de Nave et al.[279, 364]……….. 172 Fig.7.2 Estruturas dos copigmentos (CP 1 - 3) usados nos estudos de copigmentação.. 177
Fig.7.3 Espectros (visível) da solução hidroetanólica (9:1 v/v) tamponizada a pH 3,5 com concentração 1 × 10-4 M do aduto dimérico Cat-Mv3Glc a temperaturas entre os 25 e 50 °C. Pode notar-se uma redução da hidratação aparente com o aumento de temperatura, ou seja, a solução intensifica a cor (aumento do valor de absorvância máxima)……….... 184
Fig.7.4 Espectros (visível) da solução hidroetanólica (9:1 v/v) tamponizada a pH 3,5 com concentração 1 × 10-4 M de oenina (Mv3Glc) a temperaturas entre os 25 e 50 °C. Pode notar-se um aumento diretamente proporcional entre a hidratação aparente e a temperatura………... 184 Fig.7.5 Justaposição dos espectros de absorvância de soluções 1 × 10-4 M do aduto
dimérico Cat-Mv3Glc na ausência (linha contínua) e presença dos respetivos copigmentos (linha tracejada) com razões molares 1:20, em soluções hidroetanólicas com valores de pH < 1……… 188 Fig.7.6 Espectros de absorvância (região visível) de soluções hidroetanólicas (9:1 v/v)
tamponizadas a pH 3,5 de Cat-Mv3Glc 1 × 10-4 M na ausência e presença dos três copigmentos (rácio molar 1:20). As soluções copigmentadas são apresentadas a diversas temperaturas (25, 30, 35, 40, 45 e 50 °C) para demonstrar o efeito da temperatura na copigmentação……… 192 Fig.7.7 Projeções de Van't Hoff para as constantes de copigmentação de soluções
hidroetanólicas tamponizadas a pH 3,5 do aduto dimérico (1 × 10-4 M) com os 3 copigmentos utilizados (rácio molar 1:20)……… 194
Lista de abreviaturas
A-(O)-F aduto com duas ligações interflavânicas (uma C–C [tipo
B] e outra C–O–C [tipo A]) entre uma antocianina (unidade superior) e um flavan-3-ol (unidade inferior).
Abs ou A absorvância
A- forma básica quinoidal aniónica da antocianina A forma básica quinoidal da antocianina
A+-F aduto Antocianina-(46/8)-Flavanol, sendo a unidade
superior antociânica (estando esta na forma catiónica) e a unidade terminal flavan-3-ólica. A ligação é do tipo B (C–C)
A0 absorvância de referência
ACN acetonitrilo
ADN ácido desoxirribonucleico
AH+ forma catiónica da antocianina (catião flavílio) AU unidades de área arbitrárias
ARN ácido ribonucleico
B forma pseudobásica hemicetal da antocianina B-H método Benesi-Hildebrand
c.d.o. comprimento de onda
C concentração total
C18 octadecilsilano
Cat catequina
Cat-mm-(Cat-Mv3Glc) aduto entre catequina e o aduto Cat-Mv3Glc por ponte
metil-metino entre as unidades de catequina
(Cat)n-mm-(Cat-Mv3Glc) aduto oligomérico entre n unidades catequina e o aduto Cat-Mv3Glc por ponte metil-metino
(Cat-Mv3Glc)2-mm aduto dimérico entre dois adutos Cat-Mv3Glc por ponte metil-metino entre as unidades de catequina
Cat-Mv3Glc aduto dimérico Catequina-(46/8)-Malvidina-3-O- -Glucósido
Cat-PyMv3Glc10Ph aduto dimérico por ligação tipo B: Cat-(46/8)-
-PiranoMalvidina-3-O-Glucósido-10-fenol (Cat-Pinotina)
Cat-Vit A aduto dimérico por ligação tipo B: Cat-(46/8)-Vitisina
A. Caso particular dos adutos Flavanol-(46/8)- -Piranoantocianina
Cat-Vit B aduto dimérico por ligação tipo B: Cat-(46/8)-Vitisina B CB base conjugada
Cc forma cis-chalcona (anel pirânico aberto) da antocianina
CCC cromatografia em contracorrente CD dicroísmo circular
CI ionização química
COSY COrrelation SpectroscopY, espectroscopia de correlação
entre protões acoplados
CP copigmento
Ct forma cis-chalcona (anel pirânico aberto) da antocianina
d.i. diâmetro interno d dupleto
D2O água deuterada
DCl ácido clorídrico deuterado dd duplo dupleto
DMACA 4-(dimetilamino)cinamaldeído DMSO dimetilsulfóxido
DMSO-d6 dimetilsulfóxido hexadeuterado
DP grau de polimerização médio EC eletroforese capilar
EI impacto eletrónico ELL extração líquido-líquido Epicat epicatequina
Epicat-Mv3Glc aduto dimérico Epicatequina-(46/8)-Malvidina-3-O-
-Glucósido
ESI ionização por eletrospray
F-A+ aduto Flavanol-(46/8)-Antocianina, sendo a unidade
superior flavan-3-ólica e a unidade terminal antociânica (estando esta na forma catiónica). A ligação é do tipo B (C–C)
F-F dímero flavan-3-ólido
F-mm-A+ aduto entre flavan-3-óis e antocianinas por ponte metil-
F-mm-F aduto entre flavan-3-óis por ponte metil-metino GC cromatografia gasosa
Glu glucose H entalpia
HMBC Heteronuclear Multiple Bond Coherence, espectroscopia
de correlação heteronucleares entre 2 e 4 ligações: protão e os carbonos geminais e vicinais ao qual está ligado
HPLC cromatografia líquida de elevada eficiência
HPLC-DAD cromatografia líquida de elevada eficiência com deteção
de díodos
HPLC-DAD-MS cromatografia líquida de elevada eficiência com deteção
de díodos e espectrometria de massa
HPVE eletroforese de alta voltagem em papel
HSQC Heteronuclear Single Quantum Coherence,
espectroscopia de correlação entre os protões e os carbonos aos quais estão ligados
ICH International Conference of Harmonization IT armadilha de iões (ion trap)
J constante de acoplamento (em Hz)
K^a constante de pseudoequilíbrio de reação de acidez
K’a constante de equilíbrio de reação de acidez aparente
Ka constante de equilíbrio de reação de acidez
ka constante de velocidade da reação de doação de protão
(acidez)
k-a constante de velocidade da reação de ganho de protão
(inverso de acidez)
Kcop constante de equilíbrio de copigmentação
Kh constante de equilíbrio de reação de hidratação
k-h constante de velocidade da reação de desidratação
(inverso da hidratação)
kh constante de velocidade da reação de hidratação
Ki constante de equilíbrio de reação de isomerização
ki constante de velocidade da reação de isomerização
k-i constante de velocidade da reação inversa de
isomerização
Kt constante de equilíbrio de reação de tautomerização
kt constante de velocidade da reação de tautomerização
k-t constante de velocidade da reação inversa de
LOD limite de deteção LOQ limite de quantificação
m/z razão massa/carga
m multipleto
MALDI-TOF ionização e dessorção a laser assistida por matriz
combinada a deteção por tempo de voo
MeOH metanol
mm ponte metil-metino
MSn espectro de fragmentação encadeado a ordem n
Mv-3,5-diGlc malvidina-3,5-O-diglucósido, vulgarmente designada por
malvina
Mv3Glc malvidina-3-O-glucósido, vulgarmente designada por
oenina
n.d. não determinado
NOESY Nuclear Overhauser Effect Spectroscopy, espectrocopia
de efeito Overhauser, que mostra as correlações entre protões no espaço a menos de 0,4 nm
PA proantocianidinas PC procianidinas
pH Potencial hidrogeniónico
pKx função –log da constante de equilíbrio da reação x ppm Partes por milhão
PPO polifenoloxidase q quadrupleto
Quer3Glc Quercetina-3-Glucósido RDA Retro Diels-Alder
RMN ressonância magnética nuclear RP-C18 fase reversa de octadecilsilano
rpm rotações por minuto S entropia
s singleto
SIM monitorização de ião selecionado SPE extração sólido-líquido
t tripleto
T-A+ adutos entre oligómeros de flavan-3-óis e antocianinas
por ligação tipo B
TD-DFT teoria da densidade funcional em função do tempo TFA ácido trifluoroacético
TLC cromatografia de camada fina TMS tetrametilsilano
u.m.a. unidade de massa atómica UV ultravioleta
UV/Vis ultravioleta (próximo) e visível
ε coeficiente de extinção (ou absortividade) molar λmax comprimento de onda máximo
fração molar
desvio químico relativo ao TMS (em ppm ou Hz)
G variação da energia de Gibbs padrão [x] concentração da espécie x em solução
1 Preâmbulo
Para se conhecerem os compostos envolvidos na cor de vinhos existem, de acordo com Brouillard[1], três estratégias:
permitir a reação de compostos selecionados em soluções modelo de vinho durante dias, semanas ou meses;
separar e purificar compostos de amostras de vinho;
sintetizar os pigmentos ou análogos a partir de precursores orgânicos selecionados.
A última estratégia permite em alguns casos a obtenção de quantidades razoáveis de compostos, pelo que permite proceder à sua caraterização físico-química e posterior quantificação em vinhos e frutos.
Partindo deste pressuposto, o objetivo deste trabalho foi identificar, estabelecer métodos de análise, vias de síntese (Capítulo 3) e estudar as propriedades principais de alguns pigmentos de ocorrência natural em frutos e vinhos envelhecidos: os adutos do tipo flavanol-antocianina (F-A+) e seus produtos (Capítulos 4 a 7).
A sua relevância não foi determinada embora se possam antever aplicações na área vitivinícola, como possíveis marcadores de identidade ou idade de vinhos, na área alimentar, através da utilização como pigmentos alimentares em diversas matrizes e na área energética, como conversores de energia solar. A caraterização das suas propriedades físico-químicas permite estabelecer os fundamentos necessários para a utilização posterior destes compostos nas áreas referidas.
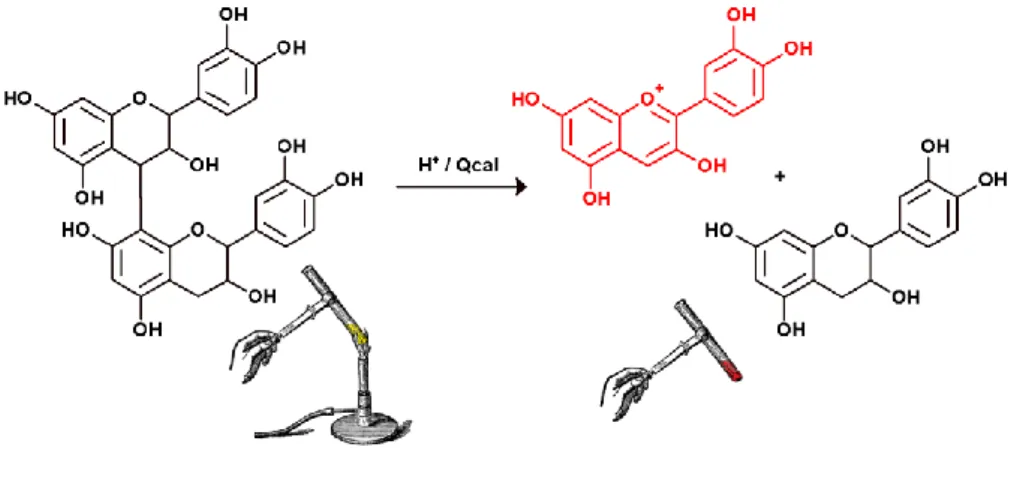
Os adutos do tipo flavanol-antocianina (F-A+) são compostos poliméricos constituídos por uma unidade flavânica e outra antociânica ligadas por uma ligação interflavânica do tipo B (entre o carbono C4 do flavan-3-ol e o carbono C8 da unidade antociânica). Tendo em conta a sua estrutura é expectável que estes compostos apresentem as reatividades típicas dos flavan-3-óis e das antocianinas, ou seja, que possuam caráter nucleófilo no carbonos C6 e C8 da unidade flavânica e eletrófilo nos carbonos C2 e C4
da unidade antociânica.
A estrutura deste trabalho compreende sete capítulos semi-independentes. Trata-se de uma organização formal que não reflete a ordem do trabalho experimental desenvolvido e é uma opção do autor de forma a tornar a exposição ao mesmo tempo coesa e independente.
O capítulo 2 é uma revisão bibliográfica sobre os compostos em estudo (compreendendo a sua estrutura, reatividades, estereoquímica – se aplicável –, ocorrência natural e importância para a saúde) e uma perspetiva global sobre a sua
formação e evolução no vinho. O capítulo 3 trata da obtenção e análise dos adutos F-A+, focando-se na hemissíntese destes compostos bem como no aperfeiçoamento de uma metodologia analítica para a sua determinação.
No capítulo 4 encontra-se o estudo efetuado em colaboração com a FCT/UNL das propriedades físico-químicas dos adutos F-A+, utilizando uma metodologia de pH
jumps de forma a abordar os equilíbrios termodinâmicos e cinéticos (constantes de
acidez, hidratação, tautomerização e isomerização) das diversas formas dos adutos em solução.
Nos capítulos 5 e 6 estuda-se, respetivamente, a reatividade das unidades flavânica e antociânica.
A reatividade da unidade flavânica compreende algumas reações típicas dos flavan-3-óis em vinhos (condensação direta e condensação mediada por acetaldeído entre flavan-3-óis e antocianinas) e a forma como a substituição com uma unidade antociânica afeta essas reações. Os compostos obtidos a partir destas reações foram identificados e caracterizados e a sua ocorrência em vinhos do Porto evidenciada. No capítulo 6 apresenta-se o estudo da formação de piranoantocianinas, nomeadamente vitisinas e hidroxifenilpiranoantocianinas bem como a deteção da sua presença em vinhos do Douro.
Após a análise das reatividades de cada uma das unidades dos adutos F-A+, apresenta-se, no capítulo 7, uma abordagem geral à reatividade do aduto como um todo. Estudou-se o fenómeno de copigmentação avaliando o modo como a forma e distribuição das orbitais moleculares influencia o estabelecimento de interações fracas entre os adutos F-A+, solventes e copigmentos. Este estudo foi efetuado em colaboração com o Grupo de Pesquisa de Bioquímica Teórica e Computacional da Faculdade de Ciências da Universidade do Porto, a UMR – Unité Mixte de Recherche da Université d’Avignon et des Pays de Vaucluse e a equipe EA 4021 (Biomolecules Thérapies anti-tumorales) da Faculté de Pharmacie da Université de Limoges.
Por fim, no capítulo 8 são propostos desenvolvimentos futuros a este trabalho, nomeadamente possíveis novos compostos derivados destes e respetivas vias de síntese, bem como potenciais aplicações ou estudos para determinar a sua relevância.