UNIVERSIDADE FEDERAL DE OURO PRETO
P
ROGRAMA DEP
ÓS-
GRADUAÇÃO EMB
IOTECNOLOGIA,
N
ÚCLEO DEP
ESQUISA EMC
IÊNCIASB
IOLÓGICASDiversidade e bioprospecção de fungos associados às
macroalgas antárticas
Monostroma hariotti
Gain e
Porphyra endiviifolia
(A. Gepp & E.S Gepp) Y.M.
Chamberlain
Laura Esteves Furbino
Diversidade e bioprospecção de fungos associados às macroalgas
antárticas
Monostroma hariotti
Gain e
Porphyra endiviifolia
(A.
Gepp & E.S Gepp) Y.M. Chamberlain
Laura Esteves Furbino
Diversidade e bioprospecção de fungos associados às macroalgas
antárticas
Monostroma hariotti
Gain e
Porphyra endiviifolia
(A.
Gepp & E.S Gepp) Y.M. Chamberlain
Dissertação apresentada ao Programa de Pós-graduação em Biotecnologia, Núcleo de Pesquisa em Ciências Biológicas da Universidade Federal de Ouro Preto, como requisito parcial à obtenção do título de Mestre em Biotecnologia.
Área de concentração: Biotecnologia Aplicada a Processos
Linha de pesquisa: Bioprospecção de fungos
Orientador: Luiz Henrique Rosa Co-orientador: Carlos Augusto Rosa
Catalogação: sisbin@sisbin.ufop.br F983D FURBINO, LAURA ESTEVES.
Diversidade e bioprospecção de fungos associados às macroalgas antárticas Monostroma hariotti Gain e Porphyra endiviifolia (A. Gepp & E.S Gepp) Y. M. Chamberlain [manuscrito] / Laura Esteves Furbino - 2012.
ix, 64f.: il., color; grafs.; tabs.
Orientador: Prof. Dr. Luiz Henrique Rosa.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Programa de Pós-Graduação em Biotecnologia. Área de concentração: Biotecnologia Aplicada a Processos e
ao Tratamento de Doenças.
1. Antártida - Teses. 2. Antártica (Região) - Teses. 3. Bioprospecção - Teses. 4. Fungos - Teses. 5. Alga - Teses. 6. Biodiversidade - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Colaboradores:
1Carlos Leomar Zani 2Franciane Maria Pellizzari 3Nair Sumie Yokoya
4Tânia Maria de Almeida Alves.
1Laboratório de Química de Produtos Naturais. Centro de Pesquisa René Rachou, Fundação Oswaldo Cruz. Belo Horizonte, Minas Gerais.
2Laboratório de Ficologia e Qualidade de Água do Mar (LAQUAMAR). Universidade Estadual do Paraná. Paranaguá, Paraná.
3Instituto de Botânica, Secretaria de Estado do Meio Ambiente, Seção de Ficologia. Universidade de São Paulo. São Paulo, São Paulo.
i
AGRADECIMENTOS
À Deus, tão fiel mesmo tendo filhos tão infiéis. À Umbanda por me devolver a crença e a espiritualidade. Às entidades pelas palavras simples mas nem por isso menos sábias.
Aos meus pais pela certeza do amor e por apoiarem as minhas escolhas. A Ni, pelo privilégio de se ter duas mães.
Aos meus irmãos, Rena e Fá, pela relação que transcende os laços sanguíneos. Ao meu marido, meu amor e melhor amigo.
Aos meus familiares, avó, tios e primos pela torcida.
Ao orientador Luiz Henrique Rosa agradeço pelo exemplo, paciência e credibilidade. Obrigada por estar sempre presente e por ter me confiado um projeto de grande responsabilidade.
Ao Carlos Augusto Rosa pela co-orientação, disponibilidade e acolhida. Obrigada pelos ensinamentos.
À Silvana Queiroz e Susana Johann, por aceitarem compor a banca.
Aos amigos do laboratório de Biodiversidade, Taxonomia e Biotecnologia de Fungos pela acolhida, e pela oportunidade de aprendizado e convivência.
Ao CNPq pela bolsa de mestrado concedida. A FAPEMIG pelo apoio financeiro;
Ao Programa de Pós-Graduação em Biotecnologia da Universidade Federal de Ouro Preto. Aos amigos da biologia e às flores...é sempre bom contar com vocês.
ii
RESUMO
iii avaliados, oito apresentaram atividade antimicrobiana; destes, seis contra C. krusei, um contra C. albicans e um contra C. sphaerospermum. O extrato do fungo Geomyces pannorum UFMGCB 5987 apresentou atividade antimicrobiana considerada promissora (95,2%) frente aos esporos de C. sphaerospermum. Além dos ensaios antimicrobianos os fungos foram avaliados quanto à capacidade de degradar amido, carboximetilcelulose, xilana, proteína (caseína) e éster. Setenta e um por centos dos isolados apresentaram pelo menos um tipo de atividade enzimática, sendo a esterásica predominante (68%), seguida pelas atividades amilásica (43%), proteásica (38%), celulolítica (13%) e xilanolítica (0,16%). Os resultados obtidos neste trabalho sugerem a presença de uma comunidade de fungos adaptada às condições extremas da Antártica, a qual pode exercer um papel ecológico significativo na decomposição de matéria orgânica e na ciclagem de nutrientes; além disso, alguns destes fungos podem representar uma fonte promissora de metabólitos bioativos de interesse biotecnológico.
iv
ABSTRACT
v
SUMÁRIO
LISTA DE ABREVIATURAS E SÍMBOLOS...vi
LISTA DE FIGURAS...viii
LISTA DE TABELAS...ix
1 RELEVÂNCIA E JUSTIFICATIVA ... 1
2 REVISÃO DA LITERATURA... 2
2.2 ANTÁRTICA ... 2
2.3 MACROALGAS ANTÁRTICAS ... 3
2.3.1 Monostroma hariotti Gain ... 4
2.3.2 Porphyra endiviifolia(A. Gepp & E.S Gepp) Y.M. Chamberlain ... 4
2.4 DIVERSIDADE DE FUNGOS NA ANTÁRTICA ... 5
2.4.1 Fungos algícolas... 6
2.4.1.1 Fungos marinhos como fontesde metabólitos biotivos ... 8
2.4.1.2 Fungos marinhos como fonte de enzimas ... 11
3 OBJETIVOS ... 12
3.1 OBJETIVO GERAL ... 12
3.2 OBJETIVOS ESPECÍFICOS ... 12
4 MATERIAL E MÉTODOS ... 13
4.1COLETAS DAS MACROALGAS ... 13
4.2 ISOLAMENTO E PRESERVAÇÃO DOS FUNGOS ... 15
4.3 CULTIVO DOS FUNGOS E PREPARO DOS EXTRATOS ... 15
4.3.1 Fungos filamentosos ... 15
4.3.2 Leveduras ... 16
4.4 ENSAIOS ANTIMICROBIANOS ... 16
4.4.1 Determinação da atividade antifúngica ... 16
4.4.2 Determinação da atividade antibacteriana ... 18
4.5 ENSAIOS ENZIMÁTICOS ... 19
4.6 IDENTIFICAÇÃO DOS FUNGOS ... 20
4.6.1 Extração do DNA total dos fungos filamentosos ... 20
4.6.2 Extração do DNA total das leveduras ... 21
4.6.3 PCR com iniciador (GTG)5 ... 22
4.7 OBTENÇÃO DOS AMPLICONS ... 22
4.7.1 Purificação dos amplicons ... 23
4.7.2 Reação de sequenciamento ... 24
4.7.3 Precipitação da reação de sequenciamento ... 24
4.7.4 Análise computacional das sequências ... 25
4.7.5 Diversidade da comunidade fúngica: abundância, riqueza e equitabilidade ... 25
5 RESULTADOS E DISCUSSÃO... 26
5.1 COLETA E ISOLAMENTO DOS FUNGOS ALGÍCOLAS ... 26
5.2 CULTIVO E OBTENÇÃO DOS EXTRATOS ETANÓLICOS ... 28
5.3 IDENTIFICAÇÃO DOS FUNGOS ... 28
5.4 DIVERSIDADE DA COMUNIDADE FÚNGICA ALGÍCOLA ... 34
5.4 DETERMINAÇÃO DA ATIVIDADE ANTIMICROBIANA ... 45
5.5 ATIVIDADE ENZIMÁTICA EXTRACELULAR ... 51
6 CONCLUSÕES ... 54
vi
LISTA DE ABREVIATURAS E SÍMBOLOS
AM: agar marinho
BLAST: Basic Local Alignment Search Tool CM: caldo marinho
cm: centímetro
CTAB: Brometo de cetil trimetilamonio DMSO: Dimetilsulfóxido
DNA: Ácido desoxirribonucléico
dNTP: Desoxirribonucleotídeos fosfatados EACF: Estação Antártica Comandante Ferraz EDTA: Ácido etilenodiamino tetra-acético EUA: Estados Unidos da América
g: grama
g/L: grama por litro
GPS: Global Positioning System h: Hora
H2O: água
HCl: Ácido clorídrico
ICB: Instituto de Ciências Biológicas
IRR/FIOCRUZ: Instituto René Rachou/Fundação Oswaldo Cruz ITS: Região transcrita interna
KH2PO4: Dihidrogenofosfato de potássio
LBEM: Laboratório de Biodiversidade e Evolução Molecular LQPN: Laboratório de Química de Produtos Naturais
m: metro M: molar
MgCl2: cloreto de magnésio MgSO4: Sulfato de magnésio mg: miligrama
vii mL: Mililitro
mm: Milímetro mM: Milimolar mol/L : mol por litro
MTT: Brometo Tiazolil Azul de Tetrazólico
μg: Micrograma
μg/mL: micrograma/mililitro μl: Microlitro
Na2HPO4: dihidrogenofosfato de sódio NaCl: Cloreto de sódio
NCBI: National Center for Biotechnology Information ng: nanograma
nm: Nanômetro
PCR: Reação em cadeia da polimerase PEG: polietilenoglicol
pH: potencial hidrogeniônico p.p.m: partes por milhão pmol: Pico mol
p/v: peso por volume rRNA: RNA ribossomal r.p.m.: Rotações por minuto s: Segundo
SDS: Dodecil sulfato de sódio TBE: Tris borato
U: Unidade
UFMG: Universidade Federal de Minas Gerais
UFMGCB : Coleção de Micro-organismos e Células da Universidade Federal de Minas Gerais
UFOP: Universidade Federal de Ouro Preto V: Volts
viii
LISTA DE FIGURAS
Figura 1 Monostromahariotti Gain em substratos rochosos antárticos. ... 4
Figura 2 Porphyraendiviifolia (A. Gepp & E.S Gepp) Y.M. Chamberlain em substratos
rochosos antárticos. ... 5
Figura 3 Estruturas moleculares (A) cefalosporina C e (B) ziconotida. ... 9
Figura 4 Modelo da disposição dos extratos e controles na placa de 96 poços utilizada
nos ensaios antifúngicos. ... 18
Figura 5 Modelo da disposição dos extratos e controles na placa de 96 poços utilizada
nos ensaios antibacterianos. ... 19
Figura 6 Fungos isolados das macroalgas antárticas Monostroma hariotti e Porphyra
endiviifolia. ... 26
Figura 7 Porcentagem de fungos isolados por área de coleta. ... 27
Figura 8 Dendograma representando a similaridade entre a comunidade fúngica de
Porphyra endiviifolia das três ilhas antárticas. DE, Deception; EL, Elefante; RG,
Rei George. ... 42
Figura 9 Dendograma representado a similaridade da comunidade fúngica entre as ilhas
antárticas. DE, Deception; EL, Elefante; RG, Rei George. ... 43
Figura 10 Dendograma representando a similaridade fúngica entre a comunidade
fúngicas de Monostroma hariotti das três ilhas antárticas. DE, Deception; EL,
Elefante; RG, Rei George. ... 44
ix
LISTA DE TABELAS
Tabela 1 Localização, número de espécimes, dados físico-químicos da água e
coordenadas onde Porphyra endiviifolia e Monostroma hariotti foram coletadas. .... 14
Tabela 2 Número de isolados de fungos algícolas obtidos por macroalgas e áreas de
coleta. ... 27
Tabela 3 Identificação molecular dos fungos algícolas, por meio da análise das
sequências da região ITS e dos domínios D1/D2 do gene do rRNA. ... 30
Tabela 4 Número de isolados e porcentagem de abundância dos fungos isolados. ... 37
Tabela 5 Dados físico-químicos, abundância e diversidade dos fungos associados às
macroalgas Porphyra endiviifolia e Monostroma hariotii coletadas nas ilhas
antárticas. ... 39
Tabela 6 Atividade antimicrobiana dos extratos brutos obtidos dos fungos associados às
macroalgas antárticas. ... 49
ii
1
RELEVÂNCIA E JUSTIFICATIVA
Apesar das condições extremas e desafiadoras à sobrevivência dos organismos, o continente antártico é conhecido por abrigar micro-organismos extremófilos em seus diferentes habitats, como solo, rochas, lagos, aves, mamíferos e plantas. Embora nos últimos anos tenha aumentado os estudos sobre micro-organismos nos ecossistemas antárticos e os estudos sobre fungos derivados do ambiente marinho, a diversidade microbiana de fungos associados às macroalgas é praticamente desconhecida. As algas desempenham um papel importante na vida costeira marinha, na ciclagem de nutriente e na produção de metabólitos bioativos. Para uma melhor compreensão sobre as macroalgas marinhas é necessário entender as interações com outros componentes do ecossistema, tais como os fungos. Informações sobre a diversidade e natureza das associações com os fungos são muito limitadas.
2
2
REVISÃO DA LITERATURA
2.1 Antártica
A Antártica é o continente mais meridional do planeta, localizado quase inteiramente dentro do Círculo Polar Antártico. Possui uma superfície de 14 milhões de Km2, equivalente a 1,6 vezes a área do Brasil ou 10% das áreas emersas do globo. Seu território é circundado por um tempestuoso oceano com milhares de icebergs e por onde se formam plataformas de gelo que confundem com o contorno continental (BISCHOFF, 1996; FERREIRA, 2009). Compreende um dos ambientes mais extremos da Terra. É um continente remoto e inóspito e o clima é o mais frio e seco conhecido no planeta. Os ventos ultrapassam a velocidade de 100 km/h e a temperatura anual varia de 15˚C no verão a -80˚C no inverno (CHILD & KELLY, 1990; FERREIRA; 2009).
O continente Antártico é caracterizado pelo isolamento geográfico e climático e a maior parte possui pouca ou nenhuma influência antrópica (RUISI et al., 2007; BRUNATI et al., 2009). As condições que prevalecem são de baixas temperaturas, ciclos de congelamento e degelo, alta incidência de radiação ultravioleta, baixa precipitação anual, fortes ventos e baixa disponibilidade de água (ONOFRI et al., 2007; RUISI et al., 2007; SHIVAJI & PRASAD, 2009), fatores considerados limitantes para a vida animal e vegetal (ONOFRI et al., 2007).
3
2.2 Macroalgas antárticas
As macroalgas são organismos multicelulares clorofilados que apresentam ampla distribuição nas regiões litorâneas de todo o planeta (SILVA et al., 2008; GAMAL, 2010). De hábito predominantemente aquático, podem apresentar-se como formas móveis ou sésseis, em condição de vida livre ou em forma de colônias, com espécies epífitas ou parasitas. A grande maioria das algas vive fixa a um substrato sólido, tais como rochas ou corais mortos, embora algumas espécies apresentem adaptações para crescerem sobre o substrato não consolidado como fundos areno-lodosos (SILVA et al., 2008). Elas representam uma parte altamente produtiva do ecossistema marinho; além disso, incorporam energia solar, produzem o oxigênio que é dissolvido na água e utilizado por outros organismos aquáticos, atuam no ciclo dos elementos químicos, constituem fonte alimentar para animais onívoros e herbívoros, fornecem habitat, refúgio e ambiente para reprodução de diversos organismos da biota marinha, desempenhando funções ecológicas essenciais (ZUCCARO et al., 2008).
A diversidade e abundância das algas dependem de muitos fatores ambientais, tais como temperaturas da água, penetração da luz e declinação sazonal solar (DHARGALKAR & VERLECAR, 2009). Normalmente as algas são expostas a uma variedade de mudanças simultâneas dos fatores abióticos, e estes são fundamentais para compreender o sucesso da colonização destes organismos no ambiente antártico (GOMEZ et al., 2009).
As estações do ano em regiões polares são caracterizadas por curtos períodos de luz e longos períodos de noite. A radiação solar anual é 30-50% menor do que em regiões de clima temperado e a noite polar tem a duração de cerca de quatro meses em latitudes mais baixas. As condições encontradas nesse ambiente são consideradas hostis para a maioria dos organismos vivos. Apesar de apresentar baixa riqueza de espécies em comparação com as regiões temperadas e tropicais (WIENCKE & CLAYTON, 2002), as macroalgas presentes na Antártica são caracterizadas por uma extrema abundância dominadas principalmente por algas pardas (GOMEZ et al., 2009; ZACHER et al., 2009) o que contrasta com a ausência de uma flora terrestre diversificada no continente (ZIELINSKI, 1990). O forte isolamento da flora ficológica do Oceano Antártico resultou em um alto grau de endemismo na Antártica e cerca de 30% das espécies da região são endêmicas.
4 Acrosiphonia, Adenocystis, Ascoseira, Ballia, Cystosphaera, Curdiea, Desmarestia, Enteromorpha, Georgiella, Gigartina, Gymnogongrus, Hildenbrandia, Himantothallus, Iridaea, Leptophytum, Monostroma, Neuroglossum, Palmaria, Pantoneura, Phaeurus, Phyllophora, Picconiella, Plocamium, Porphyra, Prasiola, Trematocarpus e Urospora (WULLF et al., 2009).
2.2.1 Monostroma hariotti Gain
O gênero Monostroma Thuret (Chlorophyta) possui ampla distribuição mundial, com biomassa concentrada em zonas subtropicais, temperadas e polares e inclui 28 espécies de difícil identificação visual e de difícil taxonomia (PELLIZZARI et al., 2009). A maioria das espécies deste gênero possui ampla utilização na indústria alimentícia, cosmética e farmacêutica. Monostroma hariotii Gain é uma espécie com ocorrências para Argentina, Ilhas Falkland e Ilhas Antárticas (OLIVEIRA et al., 2009). Monostroma hariotii (Figura 1) é uma das algas mais conspícuas durante o verão da Baía do Almirantado, Ilha Rei George (Península Antártica) e, como as demais macroalgas, faz parte do hábito alimentar ou serve de substrato para muitas espécies de invertebrados bênticos (PELLIZZARI et al., 2009).
Figura 1 Monostroma hariotti Gain em substratos rochosos antárticos.
2.2.2 Porphyra endiviifolia (A. Gepp & E.S Gepp) Y.M. Chamberlain
5 dessecação. O gênero inclui espécies de grande importância econômica e que são consumidas como alimento humano em vários países. Assim, tolerância à dessecação juntamente com seu alto valor econômico fazem deste gênero um alvo atraente para estudos (BRODIE et al., 2008) (Figura 2).
Figura 2 Porphyra endiviifolia (A. Gepp & E.S Gepp) Y.M. Chamberlain em substratos rochosos antárticos.
2.3 Diversidade de fungos na Antártica
Nos últimos anos, os ecossistemas antárticos têm sido investigados quanto à presença de micro-organismos, como bactérias, arquéias, microalgas e, raramente, fungos (RUISI et al., 2007). Os micro-organismos que se desenvolvem no ambiente extremo da Antártica são considerados psicrófilos ou psicrotolerantes. Os psicrófilos são definidos como organismos
que possuem temperatura ótima de crescimento a ≥15°C e a temperatura máxima de crescimento de 20°C (MORITA, 1975). Os psicrotolerantes são capazes de crescer a ≥5°C,
mesmo a temperatura ótima de crescimento sendo a 15°C ou mais. Apesar da maior parte dos fungos antárticos ser considerada psicrófila (BRUNATI et al., 2009), acredita-se que ambos desempenham um papel chave na biodegradação de matéria orgânica e ciclagem de nutrientes neste ambiente (SHIVAJI & PRASAD, 2009), os quais são, frequentemente, estudados pelo seu papel ecológico e potencial biotecnológico (KOGEJ et al., 2006; DE GARCÍA et al., 2007).
6 registro de 1.604 fungos na península Antártica, pertencentes a 135 gêneros e 232 espécies. De acordo com Ruisi e cols (2007), a maioria dos fungos registrados nessa área são anamórficos, têm ciclos de vida curtos, os quais limitam os custos metabólicos associados com a reprodução sexual.
Estudos sobre fungos conduzidos na Antártica incluem principalmente espécies que vivem no solo ou em madeiras históricas introduzidas na Antártica (ARENZ et al., 2006; RUISI et al., 2007). Algumas espécies de fungos foram obtidas a partir de musgos (BRADNER et al., 2000; TOSI et al., 2002) e associadas com as raízes das espécies de plantas vasculares Deschampsia antarctica Desv.(Poaceae) e Colobanthus quitensis (Kunth) Bartl. (Caryophyllaceae), únicas espécies de angiospermas existentes no continente.
A biota antártica, mais do que em outros continentes, é dominada e colonizada por micro-organismos com diferentes níveis de adaptação. A habilidade dos micro-organismos crescer e sobreviver nesses ambientes extremos da Antártica é resultado de uma série de adaptações fisiológicas e moleculares, que refletem nas características estruturais e bioquímicas desses organismos (FENICE et al., 1997; COWAN & TOW, 2004). Novas espécies de fungos vêm sendo descritas a partir de amostras coletadas na Antártica, as quais são consideradas endêmicas para este ecossistema. No entanto, há poucas informações ainda sobre o papel ecológico desses fungos nesse ecossistema. De acordo com Rosa e cols (2010), as condições climáticas extremas e o isolamento geográfico do continente antártico fazem desse habitat um alvo de estudo bastante promissor, pois além de informações ecológicas e taxonômicas, os fungos podem constituir uma fonte potencial de produtos biotecnológicos.
2.3.1 Fungos algícolas
7 em uma forma dormente e que nas condições de cultivo em laboratório tornam-se viáveis (JENSEN & FENICAL, 2002).
A ecologia dos fungos marinhos ainda é pouco conhecida quando comparada ao papel ecológico dos fungos terrestres. No entanto, sabe-se que estes fungos são importantes na ciclagem de nutrientes, principalmente, na decomposição de substratos lenhosos, herbáceos e até mesmo de animais mortos nos oceanos (HYDE et al., 1998). Além disso, alguns são capazes de estabelecer relações ecológicas com outros grupos, e outros são responsáveis por doenças em animais marinhos e plantas (HYDE et al., 1998; BUGNI & IRELAND, 2004).
Fungos marinhos podem crescer em uma ampla variedade de substratos, como madeira, sedimentos, areia, manguezais, corais, conchas de moluscos, invertebrados marinhos, na superfície e na superfície e interior das algas (HYDE et al., 1998). Fungos associados à macroalgas constituem um grupo diverso que inclui espécies simbiontes, sapróbias, parasitas e patogênicas (KOLHMEYER & VOLKMANN-KOHLMEYER, 2003; RAGHUKUMAR, 2006; SURYANARAYANAN, 2012). A parte externa das algas oferece uma área protegida em um ambiente continuamente exposto a fatores de estresse como a baixa concentração de nutrientes, dessecamento, salinidade e radiação UV. Macroalgas saudáveis liberam parte do carbono fixado durante a fotossíntese na forma de uma secreção chamada mucilagem, um substrato rico em carboidratos, lipídeos e peptídeos, o qual age como um fator atrativo para os micro-organismos colonizadores (ZUCCARO & MITCHELL, 2005), como por exemplo, fungos. É neste ambiente que as interações entre fungos e macroalgas têm início, a partir da ligação dos esporos e da invasão das hifas, levando à colonização da alga. A invasão ocorre principalmente pela formação de hifas especializadas com extremidade bifurcada que são capazes de penetrar na alga por meio da degradação enzimática da parede celular ou exercendo pressão no ponto de contato. Outro ponto de entrada de hifas inclui partes danificadas pela ação de animais epifíticos como anelídeos e poliquetos (ZUCCARO & MITCHELL, 2005).
8 Chadefaudia, Cladosporium, Cryptococcus, Fusarium, Geomyces, Haloguignardia, Histopidicarpomyces, Leucosporidium, Metschnikowia, Oidiodendron, Penicillium, Phaeosphaeria,Phoma, Retrostium,Rhodotorula, Spathulospora, Trichoderma e Pontogenia (ZUCCARO et al., 2003; ZUCCARO & MITCHELL, 2005; LOQUE et al., 2010). Considerando a diversidade de algas marinhas (número estimado de espécies de 9.500 para 12.500), um número muito maior pode ser esperado (JONES, 2011).
2.3.1.1Fungos marinhos como fonte de metabólitos bioativos
Uma das propriedades mais importantes dos micro-organismos está associada à sua capacidade metabólica de produzir uma grande variedade de moléculas bioativas com potencial biotecnológico (SINGH et al., 2011). A necessidade por medicamentos capazes de combater novas doenças e o aumento de linhagens resistentes a drogas antimicrobianas estimulou a procura de novas fontes não convencionais de produtos naturais bioativos. Os oceanos, que compreendem aproximadamente três quartos da superfície terrestre, representam uma rica fonte de diversidade biológica e química, o qual acabou se tornando um ambiente atraente para descoberta de organismos produtores de metabólitos biativos. O ambiente marinho oferece uma grande variedade de fontes potenciais de fungos, incluindo sedimentos, areia, troncos, madeira de mangue, água do mar, esponjas e outros invertebrados e macroalgas (JENSEN & FENICAL, 2002).
Com os interesses voltados para os micro-organismos marinhos, fungos marinhos têm se mostrado uma fonte rica e promissora de novos produtos naturais bioativos. A maioria desses micro-organismos cresce em um habitat único e extremo e, portanto, têm a capacidade de produzir metabólitos secundários incomuns. Acredita-se que estes metabólitos sejam uma adaptação química pela competição por substrato. A produção desses metabólitos únicos por fungos marinhos é mais provável devido à adaptação a um conjunto distinto de pressões ambientais (BADHURY et al., 2006)
A utilização dos recursos marinhos permaneceu adormecida até meados dos anos de 1960, quando pesquisadores dos Estados Unidos, Europa e Japão começaram a coletar, extrair e explorar a diversidade química da vida marinha (FENICAL, 2006). Desde então, têm sido realizado esforços em todo o mundo visando o isolamento de novos metabólitos de organismos marinhos (KELECOM, 2002).
9 (Figura 3) foi o primeiro composto obtido a partir do fungo marinho Cephalosporium sp., obtido de água marinha (BURTON & ABRAHAM, 1951, KELECOM, 2002).
Figura 3 Estruturas moleculares (A) cefalosporina C e (B) ziconotida.
Segundo Bugni e Ireland (2004), fungos derivados de esponjas detêm 33% do total de metabólitos marinhos descobertos, seguidos pelos fungos algícolas com 24%. No entanto os fungos algícolas superam os de poríferos em relação ao número de novos metabólitos descobertos.
11
2.3.1.2Fungos marinhos como fonte de enzimas
Com o advento da biotecnologia tem havido uma crescente procura por enzimas com novas propriedades de relevância industrial (ZHANG & KIM, 2011). Apesar das enzimas ocorrerem em abundância em plantas e animais, as de origem microbiana representam atualmente a fonte mais atraente devido à ampla diversidade bioquímica e variedade de atividades catalíticas disponíveis, facilidade de manipulação genética, rendimentos elevados e fornecimento regular (NIEHAUS et al., 1999; BUZZINI & MARTINI, 2002, ZHANG & KIM, 2011; KASANA & GULATI, 2011). Enzimas microbianas são também mais estáveis e a produção é relativamente mais conveniente e segura (KASANA & GULATI, 2011).
Pesquisas recentes têm destacado o potencial de ambientes extremos e não convencionais como fonte de isolamento e seleção de micro-organismos úteis para a indústria. Estes micro-organismos são capazes de usar biopolímeros complexos como fonte de carbono, pois são capazes de sintetizar enzimas extracelulares ativas em baixas temperaturas. A complexidade de ambientes extremos, como o marinho e antártico, envolvendo alta salinidade, alta pressão, baixas temperaturas e alta incidência de radiação UV, podem contribuir para as diferenças significativas e características fisiológicas únicas entre as enzimas geradas por micro-organismos marinhos psicrófilos e seus homólogos terrestres (ZHANG & KIM, 2011).
12
3
OBJETIVOS
3.1 Objetivo Geral
Caracterizar a comunidade de fungos associados à macroalgas Monostroma hariotti e Porphyra endiviifolia presentes nas ilhas Rei George, Elefante e Deception, e avaliar o potencial destes fungos em relação à produção de metabólitos com atividades biológicas e enzimas de interesse industrial.
3.2 Objetivos específicos
Isolar fungos algícolas associados à Monostroma hariotti e Porphyra endiviifolia presentes em três ilhas antárticas;
Depositar todos os isolados de fungos algícolas obtidos em uma coleção de cultura de micro-organismos para preservação ex-situ da biodiversidade fúngica da Antártica;
Identificar todos os fungos por meio de metodologias moleculares;
Determinar os índices de diversidade e similaridade da comunidade de fungos associados às macroalgas antárticas;
Cultivar todos os fungos obtidos, preparar seus extratos brutos e depositá-los em uma coleção de extratos;
Avaliar a atividade antimicrobiana de todos os extratos em ensaios biológicos utilizando bactéria e fungos de interesse clínico;
13
4
MATERIAL E MÉTODOS
4.1 Coletas das macroalgas
14 Tabela 1 Localização, número de espécimes, dados físico-químicos da água e coordenadas onde Porphyra endiviifolia e Monostromahariotti foram coletadas.
Local de coleta/Macroalga N° de espécimes Sal EC (µS) Temp (°C) pH OD Coordenadas
Elefante
Porphyra endiviifolia 60 33,0 50,6 2,1 7,74 34,6 61°13.879’S; 055°21.613’W
Monostroma hariotii 60 35,2 55,4 2,1 8,24 100 61°07.935'S; 055°25.997'W
Rei George
Porphyra endiviifolia 60 32,8 27,23 0,5 7,74 100 62°05.163'S; 058°24.784'W
Monostroma hariotii 60 32,8 27,23 0,5 7,74 100 62°05.454'S; 058°24.334'W
Deception
Porphyra endiviifolia 90 32,1 49,89 3,7 7,49 79,9 62°55.192'S; 060°39.797'W
Monostroma hariotii 60 32,1 49,89 3,7 7,49 79,9 62°55.192'S; 060°39.797'W
15
4.2 Isolamento e preservação dos fungos
Os talos das macroalgas foram lavados três vezes com água destilada esterilizada. Cinco fragmentos de cada talo foram retirados com auxílio de pinça e tesoura esterilizadas e posteriormente transferidos para placas de Petri contendo Agar Marinho (Marine Broth/Himedia, Agar 2%, Glicose 2%) suplementado com 100 μg/mL de cloranfenicol (Sigma/EUA) para inibir o crescimento de bactérias contaminantes. As placas foram incubadas a 15ºC por um período de até 60 dias e os isolados foram purificados em novas placas de Petri contendo meio Agar Marinho (AM).
Os isolados de fungos filamentosos obtidos foram preservados em duplicata em glicerol 20% e armazenados a –80ºC. As leveduras obtidas, após 48h de crescimento em Caldo Marinho (Marine Broth 2216/Himedia, 2% glicose), também foram preservadas em glicerol 20 % e armazenadas a -80ºC. Todos os isolados foram depositados na Coleção de Micro-organismos e Células do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais.
4.3 Cultivo dos fungos e preparo dos extratos
4.3.1 Fungos filamentosos
16
4.3.2 Leveduras
As leveduras foram previamente crescidas em placas de Petri contendo AM a 15ºC e transferidas para tubos contendo 3 mL de Caldo Marinho (CM) acrescido de 2% glicose e incubados a 15ºC por 48h. Para obtenção dos extratos foram utilizadas microplacas de 24 poços contendo em cada poço 1 ml do meio AM. Em cada poço foram inoculados 100 μL do CM com o crescimento das leveduras e incubadas a 15ºC por 15 dias. Após o período de incubação, o meio de cultura com crescimento das leveduras foi macerado com auxílio de um pistilo esterilizado e adicionado 1,5 mL de etanol PA em cada poço. Todas as microplacas foram incubadas por 48 horas e o sobrenadante de cada poço foi transferido para tubos de 1,5 mL após serem filtrados com o auxílio de algodão. Os extratos obtidos foram secos em estufa a 37ºC e em seguida solubilizados em DMSO, a uma concentração de 20 mg/mL e 100 mg/mL e mantidos a -20ºC até utilização nos ensaios biológicos. Todos os extratos obtidos (fungos filamentosos e leveduras) foram depositados nas Extratotecas do Laboratório de Química de Produtos Naturais do CPqRR/FIOCRUZ e do Laboratório de Biodiversidade, Taxonomia e Biotecnologia de Fungos para os estudos de bioprospecção.
4.4 Ensaios antimicrobianos
A determinação da atividade antimicrobiana dos extratos foi avaliada pelo método de microdiluição em placa de acordo com metodologia descrita no manual da Clinical and Laboratory Standards Institute- CLSI, 2002 e 2005.
4.4.1 Determinação da atividade antifúngica
As linhagens de Candida krusei ATCC 6258 e Candida albicans ATCC 60193 foram crescidos em agar Sabouraud (Difco/EUA) a 35oC por 24 horas. Cinco colônias foram suspensas em solução salina (0,85%) esterilizada. A suspensão resultante foi homogeneizada em agitador tipo vórtex e a absorbância foi medida em espectrofotômetro em comprimento de onda de 530 nm ajustada a 70% de transmitância. Posteriormente a suspensão obtida foi diluída 10 vezes em RPMI 1640 (INLAB Diagnostica) acrescido de 2% de glicose. O fungo filamentoso Cladosporium sphaerospermum CCT 1740 foi crescido em BDA por 7-10 dias. Preparou-se uma solução de esporos, a 15% de transmitância em salina (620 nm). Posteriormente a solução foi diluída 50 vezes em RPMI 1640.
17 divididos como mostrado nas Figuras 4. Utilizou-se o meio de cultura sintético RPMI 1640 tamponado com ácido morfolinepropano sulfônico (MOPS) (Sigma/EUA), suplementado com 2% glicose, para as leveduras. Como controle positivo foi utilizado o antifúngico anfotericina B (Sigma/EUA) para as leveduras e Benomyl para o fungo filamentoso. Em cada poço usado para teste foi inoculado 25 µL de cada extrato dissolvido em DMSO e água deionizada esterilizada, 25 µL de RPMI 1640 e 50 µL de inóculo. Ao final, o volume de cada poço foi de 100 µL, e as concentrações de DMSO de 0,25%; as drogas controle de 2 µg/mL para anfotericina B e 1,16 µg /mL pra benomyl; e os extratos de 250 µg/mL.
As placas foram incubadas a 35oC para as leveduras por 24 horas e 25oC para C. sphaerospermum por 48 horas. Após a incubação das leveduras, em cada poço foi acrescentado 10 µL de brometo tiazolil azul de tetrazólico (MTT/ AMRESCO – 5 mg/mL), o conteúdo homogeneizado e as placas novamente incubadas a 35oC por 4 horas. Nas mitocôndrias das células alvos, o MTT é metabolizado em formazan, revelando a presença de células metabolicamente ativas. Após o metabolismo do MTT, foram adicionados 100 µL/poço de SDS/isopropanol (5%), que rompe a membrana celular dos micro-organismos alvos e disponibiliza no meio o formazan. A leitura foi realizada por meio do método colorimétrico do MTT em um leitor de microplaca VERSAmax (Molecular Devices) pelo programa SoftmaxR Pro 5 (Molecular Devices), com a absorbância de 570 nm para leveduras. Já para o fungo filamentoso não se utiliza MTT e a leitura é realizada em um leitor de microplaca VERSAmax (Molecular Devices) pelo programa SoftmaxR Pro 5 (Molecular Devices), com a absorbância de 620 nm. A absorbância dos poços testes foi comparada com a absorbância do poço controle contendo apenas o microrganismo, sendo a porcentagem de inibição calculada pela seguinte fórmula:
Porcentagem de Inibição:
Densidade óptica poço controle – DO poço tratado X 100 Densidade óptica do poço controle
18
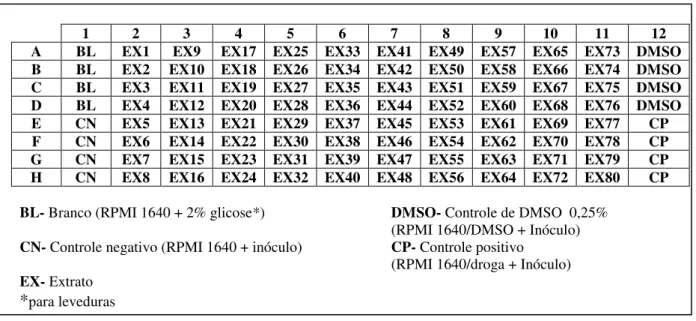
1 2 3 4 5 6 7 8 9 10 11 12
A BL EX1 EX9 EX17 EX25 EX33 EX41 EX49 EX57 EX65 EX73 DMSO B BL EX2 EX10 EX18 EX26 EX34 EX42 EX50 EX58 EX66 EX74 DMSO C BL EX3 EX11 EX19 EX27 EX35 EX43 EX51 EX59 EX67 EX75 DMSO D BL EX4 EX12 EX20 EX28 EX36 EX44 EX52 EX60 EX68 EX76 DMSO E CN EX5 EX13 EX21 EX29 EX37 EX45 EX53 EX61 EX69 EX77 CP F CN EX6 EX14 EX22 EX30 EX38 EX46 EX54 EX62 EX70 EX78 CP G CN EX7 EX15 EX23 EX31 EX39 EX47 EX55 EX63 EX71 EX79 CP H CN EX8 EX16 EX24 EX32 EX40 EX48 EX56 EX64 EX72 EX80 CP
BL- Branco (RPMI 1640 + 2% glicose*) DMSO- Controle de DMSO 0,25% (RPMI 1640/DMSO + Inóculo)
CN- Controle negativo (RPMI 1640 + inóculo) CP- Controle positivo (RPMI 1640/droga + Inóculo)
EX- Extrato
*para leveduras
Figura 4 Modelo da disposição dos extratos e controles na placa de 96 poços utilizada nos ensaios antifúngicos.
4.4.2 Determinação da atividade antibacteriana
Os isolados de Escherichia coli ATCC 11775, Staphylococcus aureus ATCC 12600 e Pseudomonas aeruginosa ATCC 10145 foram crescidos em agar Muller-Hinton (Difco/EUA) a 35oC por 24 horas. Uma alçada foi suspensa em solução salina 0,85% esterilizada. A suspensão resultante foi homogeneizada em agitador tipo vórtex e a absorbância foi medida em espectrofotômetro em comprimento de onda de 625 nm o que equivale a 0,08-0,1 de transmitância. Posteriormente a suspensão obtida foi diluída 10 vezes em caldo Muller-Hinton.
Para a realização dos ensaios antibacterianos foram utilizadas placas de 96 poços de fundo chato (TPP/Suíça). Todos os testes foram realizados em duplicata e os 96 poços divididos como mostrado na Figura 5. Utilizou-se o caldo Muller-Hinton. Como controle positivo foi utilizado o antibacteriano cloranfenicol (Sigma/EUA). Em cada poço usado para teste foi inoculado 25µL de cada extrato dissolvido em DMSO e água deionizada esterilizada, 25 µL de caldo Muller-Hinton e 50 µL de inóculo. Ao final, o volume de cada poço foi de 100 µL, e as concentrações de DMSO de 0,25%; a droga controle a 32 µg /mL e os extratos a 250 µg /mL.
19 conteúdo homogeneizado e as placas novamente incubadas a 35oC por 4 horas. Após o metabolismo do MTT, foram adicionados 100 µL/poço de SDS/isopropanol (5%). A leitura foi realizada por meio do método colorimétrico do MTT em um leitor de microplaca VERSAmax (Molecular Devices) pelo programa SoftmaxR Pro 5 (Molecular Devices), com a absorbância de 570 nm. A porcentagem de inibição foi calculada da mesma forma que nos ensaios antifúngico. Foram considerados promissores os extratos com valor de inibição igual ou maior que 60.
1 2 3 4 5 6 7 8 9 10 11 12
A BL EX1 EX9 EX17 EX25 EX33 EX41 EX49 EX57 EX65 EX73 DMSO B BL EX2 EX10 EX18 EX26 EX34 EX42 EX50 EX58 EX66 EX74 DMSO C BL EX3 EX11 EX19 EX27 EX35 EX43 EX51 EX59 EX67 EX75 DMSO D BL EX4 EX12 EX20 EX28 EX36 EX44 EX52 EX60 EX68 EX76 DMSO E CN EX5 EX13 EX21 EX29 EX37 EX45 EX53 EX61 EX69 EX77 CP F CN EX6 EX14 EX22 EX30 EX38 EX46 EX54 EX62 EX70 EX78 CP G CN EX7 EX15 EX23 EX31 EX39 EX47 EX55 EX63 EX71 EX79 CP H CN EX8 EX16 EX24 EX32 EX40 EX48 EX56 EX64 EX72 EX80 CP
BL- Branco (Mueller-Hinton) DMSO- Controle de DMSO ,25% (Mueller-Hinton /DMSO +inóculo)
CN- Controle negativo (Mueller-Hinton + inóculo) CP- Controle positivo
(Mueller-Hinton /droga + Inóculo)
EX- Extrato
Figura 5 Modelo da disposição dos extratos e controles na placa de 96 poços utilizada nos ensaios antibacterianos.
4.5 Ensaios enzimáticos
Todos os fungos algícolas foram avaliados quanto à capacidade de degradar amido, carboximetilcelulose, xilana, proteína (caseína) e éster de acordo com os procedimentos descritos por Buzzini e Martini (2002). As leveduras foram crescidas em AM a 15ºC por aproximadamente 7 dias, a seguir cerca de cinco colônias foram suspensas em água deionizada esterilizada. Em cada meio sólido foram inoculados 10 µl da solução. Para os fungos filamentosos um disco de 5 mm do crescimento micelial de cada fungo foi inoculado nos meios de cultivo. As placas foram incubadas a 15ºC e após 14 dias de cultivo, a presença da atividade enzimática foi observada por meio da formação de halo ao redor da colônia. Todos os ensaios foram realizados em triplicata.
20 A presença da atividade esterásica foi notada por meio da formação de um halo precipitado em torno da colônia.
Atividade amilásica (AmA). A capacidade de hidrolisar amido foi avaliada no seguinte meio (g/L): YNB, 6,7; amido, 2; Agar, 20. Após o crescimento celular, as placas de Petri foram cobertas com lugol. A formação de uma zona amarela em torno da colônia envolta por uma coloração azul indica a atividade amilásica.
Atividade xilanásica (XiA). A capacidade de hidrolisar xilana foi avaliada em meio contendo (g/L): YNB, 6,7; xilana, 10; Agar, 20. A atividade extracelular da enzima foi avaliada por meio da formação de um halo mais claro em torno da colônia.
Atividade proteásica (PrA). A produção de protease extracelular foi determinada em meio YEPG contendo caseína 20 g/L, pH 6,5. Uma zona clara em torno da colônia indica a atividade proteásica.
Atividade celulásica (CeA). A produção de celulase foi detectada em meio contendo (g/L): YEPG, 6,7; carboximetilcelulose, 5. Após o crescimento celular, a presença de celulase extracelular foi detectada pelo método do vermelho Congo.
4.6 Identificação dos fungos
Todos os isolados de fungos foram agrupados de acordo com as características macromorfológicas da colônia (coloração da colônia, borda, relevo, coloração do meio). Para confirmação do agrupamento macromorfológico, os isolados foram submetidos à análise molecular, por meio de PCR utilizando o iniciador (GTG)5. Entre os fungos que apresentaram perfis moleculares distintos, um isolado foi selecionado para identificação molecular. Os fungos filamentosos foram identificados por meio do sequenciamento da região espaçadora transcrita interna (ITS1-5.8S- ITS2) do gene do RNA ribossomal e as leveduras, pelo seqüenciamento dos domínios D1/D2 da subunidade maior do gene do RNA ribossomal.
4.6.1 Extração do DNA total dos fungos filamentosos
21 NaCL 0,1M e SDS – sódio dodecil sulfato 1%) e deixado a – 20ºC por aproximadamente 10 minutos. O micélio foi triturado com auxílio de esferas de aço (beads) e foram acrescidos 5
μL de Proteinase K (50 μg/mL). Após homogeneização, o tubo foi colocado por 30 minutos a 60ºC em banho seco. Após esta etapa, foram adicionados 162 μL de CTAB de Hoog (Tris 2M, NaCl 8,2%, EDTA 2M e CTAB 0,2%), seguido de homogeneização em vórtex e incubação por 10 minutos a 65ºC. Em seguida, foram acrescentados 570 μL da mistura clorofórmio/álcool isoamílico (24:1). Após homogeneização, o tubo foi incubado por 30 minutos em gelo. Em seguida, o conteúdo foi centrifugado a 13.200 rpm por 10 minutos e o sobrenadante foi transferido para um novo tudo de 1,5 mL, e acrescentado 10% do volume de uma solução de acetato de sódio 3M. O tubo foi vertido para homogeneização, incubado a 0ºC por 30 minutos e centrifugado a 13.200 rpm por 10 minutos. O sobrenadante foi transferido para um novo tubo, onde foi adicionado 50% do volume de isopropanol e centrifugado a 13.200 rpm por 5 minutos. O sobrenadante foi desprezado por inversão. A seguir, foram adicionados 200 μL de etanol (Merck) 70% e a suspensão foi gentilmente homogeneizada. Após este procedimento, a amostra foi centrifugada a 13.200 rpm por 5 minutos e o sobrenadante desprezado por inversão, seguido de nova homogeneização com etanol 70% e centrifugação. A amostra foi seca em temperatura ambiente, para evaporação do etanol, e 50
μL de Tris-EDTA (Tris-HCL 0,01M e EDTA 0,001M) foram adicionados e a mesma foi incubada a 65ºC por 60 minutos para hidratação do DNA. As amostras foram armazenadas em freezer a -20ºC.
4.6.2 Extração do DNA total das leveduras
22 evaporação do etanol. O DNA total foi ressuspendido em 50 μL de Tris-EDTA (Tris-HCL 0,01M e EDTA 0,001M) e armazenado em freezer a -20ºC.
4.6.3 PCR com iniciador (GTG)5
Para confirmação do agrupamento macromorfológico os isolados foram submetidos à análise molecular, por meio de PCR utilizando o iniciador (GTG)5. A reação de PCR foi realizada em um volume final de 25 μL contendo 1 μL de DNA (aproximadamente 100 ng/mL), 2 μL do iniciador (GTG)5 μmol-1 (MWG Biotech), 2,5 μL de tampão de PCR 5X (Fermentas), 1,5 μL de MgCl2 25mM, 1 μL de dNTP 10 mM, 0,3 μL de TaqDNA polimerase 5U (Fermentas) e o volume final completado com água destilada estéril. As reações de PCR foram realizadas utilizando o termociclador PCR (Eppendorf) sob as seguintes condições: desnaturação inicial a 94ºC por 2 minutos, seguido por 40 ciclos de 45 segundos de desnaturação a 93ºC, 1 minuto da anelamento a 50ºC e 1 minuto de extensão a 72ºC, e uma extensão final por 6 minutos a 72ºC. Os produtos de PCR foram analisados por eletroforese em gel de agarose 1,5%, em tampão TBE 0,5X, eluídos, em tampão de corrida 6X e Gel Red, durante aproximadamente 80 minutos a 80V. Os géis foram visualizados sob luz ultravioleta e fotografados pelo sistema de foto-documentação de gel (Vilber Lourmat, France).
4.7 Obtenção dos amplicons
23 ultravioleta e fotografados pelo sistema de foto-documentação de gel (Vilber Lourmat, France).
Dentre as leveduras que apresentaram perfis moleculares distintos, um isolado foi selecionado para o seqüenciamento da região D1/D2 da subunidade maior do gene do rRNA utilizando os iniciadores NL-1 (5’- GCATATCAATAAGCGGAGGAAAAG-3’) e NL-4 (5’ -GGTCCGTGTTTCAAGACGG-3’) segundo Lachance e colaboradores (1999). A reação de PCR foi realizada em um volume final de 50 μL contendo: 2,0 μL de DNA, 1,0 μL de cada iniciador NL1 e NL4 10 μmol-1 (MWG Biotech), 5,0 μL de tampão de PCR 5X (Fermentas), 2,0 μL de MgCl2 25 mM, 2,0 μL de dNTP 10mM, 0,2 μL de Taq DNA polimerase 5U
(Fermentas) e o volume final completado com água destilada estéril. As reações de PCR foram realizadas sob as seguintes condições: desnaturação inicial a 95ºC por 2 min, seguida por 35 ciclos de: desnaturação a 95ºC por 15 segundos, anelamento a 54ºC por 25 segundos e extensão a 72ºC por 20 segundos, seguida por extensão final a 72ºC por 10 min. Os produtos de PCR foram analisados por eletroforese em gel de agarose 1%, em tampão TBE 0,5X, corados em tampão de corrida 6X e Gel Red, durante aproximadamente 20 minutos a 120V. Os géis visualizados sob luz ultravioleta e fotografados em um sistema de foto-documentação de gel (Vilber Lourmat, France).
4.7.1 Purificação dos amplicons
24
4.7.2 Reação de sequenciamento
O sequenciamento foi realizado utilizando o Kit DYEnamicTM (Amersham Biosciences, USA) em combinação com o sistema de sequenciamento automatizado MegaBACETM 1000, no Laboratório de Biodiversidade e Evolução Molecular (LBEM- UFMG). Para a reação de sequenciamento formam utilizados 100-150 ng do DNA purificado, os reagentes presentes no
kit e iniciadores. A reação de PCR foi realizada em um volume final de 10 μL contendo 4 μL
do pré-mix (presente no kit de sequenciamento) e 1 μL do iniciador (5 μmol-1), completando-se o volume final com água deionizada estéril. O programa consistiu de 36 ciclos de uma desnaturação inicial a 95ºC por 25 minutos, seguido por 15 segundos de anelamento a 50ºC e 3 minutos de extensão a 60ºC. em seguida, os produtos da reação foram transferidos para uma placa de sequenciamento de 96 poços para serem precipitados.
4.7.3 Precipitação da reação de sequenciamento
Para precipitação das reações de sequenciamento, 1 μL de acetato de amônio 7,5 M foi
adicionado em cada poço da placa de 96 poços. A solução de acetato de amônio foi dispensada na parede lateral dos poços e a placa levemente batida sobre a bancada para que as
gotas do acetato de amônio se misturassem à reação. Em seguida, foram adicionados 28 μL de etanol absoluto (Merck/EUA). A placa foi submetida à agitação em vórtex e incubada por 20 minutos à temperatura ambiente, protegida da luz. Após período de incubação, a placa foi centrifugada por 45 minutos a 4000 rpm. O sobrenadante foi descartado virando-se a palca
sobre um papel absorvente. Em seguida, foram adicionados 150 μL de etanol 70%
(Merck/EUA). A placa foi novamente centrifugada por 15 minutos a 4000 rpm e o sobrenadante foi então descartado. Para remoção do excesso de etanol, a placa foi invertida sobre um papel absorvente, e submetida a um pulso em centrifuga a 900 rpm durante 1 segundo. Em seguida a placa foi mantida em repouso durante 20 minutos, protegida da luz, para evaporação do etanol. O DNA das amostras precipitado em cada poço da placa foi então
25
4.7.4 Análise computacional das sequências
As seqüências de DNA foram analisadas, comparando com as seqüências de cultura tipo depositadas no GenBank, utilizando o programa BLASTn (Basic Local Alignment Search Tool- versão 2.215 do BLAST 2.0) disponível no portal NCBI (http://www.ncbi.nlm.nih.gov/blast/) desenvolvido pelo Nacional Center For Biotechnology. Os isolados que apresentaram as sequências analisadas com similaridade ≥98% em relação às
sequências já depositadas no GenBank, foram considerados como pertencentes à mesma
espécie ou gênero; já aqueles que apresentaram sequências com similaridade ≤97%, foram
considerados como pertencentes ao mesmo gênero (ROSA et al., 2010).
4.7.5 Diversidade da comunidade fúngica: abundância, riqueza e equitabilidade
A porcentagem de abundância de cada táxon foi calculada e utilizada para determinar a prevalência de cada táxon. Para avaliar a diversidade de espécies fúngicas foram utilizados os índices de riqueza e equitabilidade de: (i) Shannon H = -Σ ni/n ln (ni/n) e (ii) Simpson’s = Σ
26
5
RESULTADOS E DISCUSSÃO
5.1 Coleta e isolamento dos fungos algícolas
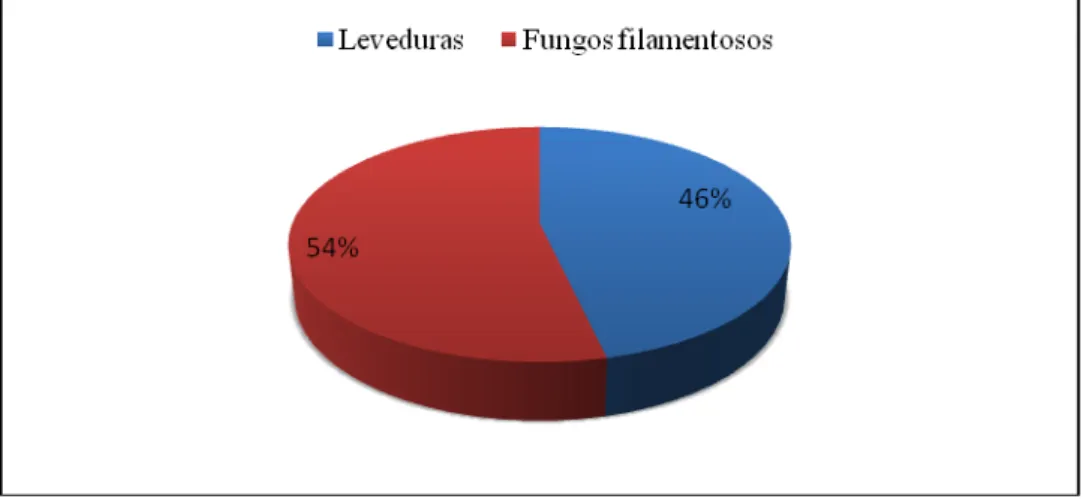
Um total de 390 espécimes de macroalgas foi amostrado (180 de Monostroma hariotti e 210 de Porphyra endiviifolia), totalizando 1.950 fragmentos de talos algais (5 fragmentos por espécime). Todos os fragmentos foram lavados superficialmente com água do mar esterilizada e transferidos para placas de Petri contendo agar marinho. Ao final do processo de isolamento foram obtidos 278 isolados fúngicos, 149 fungos filamentosos e 129 leveduras (Figura 6).
Figura 6 Fungos isolados das macroalgas antárticas Monostroma hariotti e Porphyra
endiviifolia.
27
Figura 7 Porcentagem de fungos isolados por área de coleta.
Tabela 2 Número de isolados de fungos algícolas obtidos por macroalgas e áreas de coleta. Local da coleta(Ilhas)
Espécie de macroalga Deception Elefante Rei George Total
Porphyra endiviifolia 21 70 18 109
Monostroma hariotti 10 30 129 169
Total 31 100 147 278
28 obtiveram 144 isolados fúngicos. Suryanarayanan e cols (2010) estudaram a micobiota de 25 macroalgas da costa de Tamilnadu, na Índia e obtiveram 75 espécies fúngicas. Considerando o alto número de espécimes amostradas no presente estudo, o número de isolados obtidos é menor que o número de isolados obtidos por Loque e cols (2010) e em estudos de regiões temperadas.
5.2 Cultivo e obtenção dos extratos etanólicos
O processo de produção de extratos brutos de micro-organismos constitui uma etapa importante para detecção de substâncias bioativas. Diferentes técnicas de cultivo e produção de extratos microbianos já foram descritas. Entre estas etapas destacam-se o tipo de meio de cultura e o processo fermentativo utilizado (cultivos em condições de fermentação líquida e sólida). A utilização de técnicas de fermentação em meio sólido (Solid State Fermentation - SSF), a qual foi utilizada neste estudo, possui a vantagem da maior facilidade na recuperação dos metabólitos produzidos e aumento do rendimento (ROSA et. al., 2011). Além disso, diferentes solventes com diferentes polaridades são utilizados para extração dos metabólitos secundários bioativos, tais como acetato de etila (ROSA et al., 2003; PHONGPAICHIT et al., 2006), diclorometano (SETTE et al., 2006; MACÍAS- RUBALCAVA et al., 2010), metanol (BRUNATI et al., 2009; VAZ et al., 2009), hexano (MUTHUVELAN & RAJA, 2008) e etanol (GAMBOA et al., 2001).
No presente trabalho, os fungos foram cultivados em meio sólido (Agar Marinho) para obtenção dos extratos dos fungos algícolas. O etanol foi utilizado como solvente para obtenção dos extratos dos fungos algícolas devido à sua polaridade e afinidade por moléculas de baixo peso molecular (metabólitos secundários) e alguns metabólitos de médio peso molecular, tais como peptídeos. Além disto, o etanol possui baixa toxicidade quando comparado a outros solventes.
5.3 Identificação dos fungos
29 Microbotrymycetes e Tremellomycetes. Zuccaro e cols (2008) relataram que a macroalga Fucus serratus abriga fungos pertencentes às classes Halosphaeriaceae (Ascomycota), Lulworthiaceae (Ascomycota), Hypocreales (Ascomycota) e Dothideomycetes (Ascomycota). De acordo com Adams e cols (2006) os fungos isolados com maior frequência na Antártica são os fungos Ascomycota assim como nas macroalgas (SURYANARAYANAN, 2012). A recorrência do isolamento de fungos ascomicetos tem como hipótese principal a adaptação dos esporos ao ambiente aquático, que pode facilitar a sua flutuabilidade na coluna d’água e a
aderência aos substratos, atribuindo aos fungos desse filo uma alta recuperação em técnicas dependentes de cultura (MENEZES et al., 2010).
30 Tabela 1 Identificação molecular dos fungos algícolas, por meio da análise das sequências da região ITS e dos domínios D1/D2 do gene do rRNA. Hospedeiro/Ilha UFMGCBa N°de
isolados
Espécie referência [GenBank accession number]
Identidade (%)
Gaps Sugestão de identificação
Elefante
Porphyra endiviifolia 5976 1 Aspergillus sydowii [JN851041] 99 2/261 Aspergillus sp.
5973 1 Antarctomyces psychrotrophicus
[GU004189]
93 21/509 A. psychrotrophicus
5966 24 Cadophora malorum [GU004209] 99 2/250 C. malorum
5946 1 Cladosporium cucumerinum [HM148071] 96 16/495 Cladosporium sp.
5940 1 Emericella nidulans [AY452983] 99 0/382 E. nidulans
5943 15 Geomyces pannorum [DQ189229] 99 0/494 G. pannorum
6025 1 Mortierella sp. [HQ533829] 99 2/562 Mortierella sp.
5937 1 Oidiodendron truncatum [FJ914713] 99 2/458 O. truncatum
5925 17 Penicillium chrysogenum [JN561259] 100 0/439 P. chrysogenum
31
5938 5 Penicillium commune [JN676122] 99 1/505 P. commune
6286 6 Penicillium steckii [HM469415] 99 5/416 P. steckii
6027 2 Thelebolus microsporus [GU004196] 96 2/319 Thelebolus sp.
Monostroma hariotii
6002 2 Aspergillus versicolor [HM776414] 98 5/500 Aspergillus sp.2
6008 1 Cladosporium sp. [HM999949] 99 0/483 Cladosporium sp.
6000 2 Geomyces pannorum [DQ189229] 99 0/493 G. pannorum
5998 4 Penicillium chrysogenum [JN561259] 99 2/495 P. chrysogenum
6020 1 Penicillium citrinum [EU645682] 99 2/491 Penicillium sp2.
6001 3 Penicillium commune [JN368450] 99 1/527 P. commune
6024 1 Penicillium crustosum [JN021543] 99 1/491 Penicillium sp3.
6023 1 Penicillium islandicum [FJ872071] 97 3/510 Penicillium sp4.
6006 12 Penicillium steckii [HM469415] 100 0/514 P. steckii
Rei George
Porphyra endiviifolia 6031 1 Dipodascus australiensis [HQ115737] 99 3/329 D. australiensis
32
GP46L1 5 Metschnikowia australis [MAU76526] 99 0/490 M. australis
6033 2 Penicillium chrysogenum [JN561259] 100 0/512 P. chrysogenum
Monostroma hariotii MH-57.1 1 Candida sake [FR819699] 98 4/209 C. sake
MH-3.3 1 Cryptococcus adeliensis [JN400752] 97 8/401 C. adeliensis
MH-1.2 18 Cryptococcus albidosimilis [GU460168] 100 0/558 C. albidosimilis
MH-11.2 5 Cryptococcus victoriae [JN544032] 99 4/566 C. victoriae
MH-50.2 2 Cystofilobasidium infirmominiatum
[JN181013]
99 0/564 C. infirmominiatum
MH-33.1 22 Guehomyces pullulans [GQ202976] 99 1/578 G. pullulans
MH-34.1 1 Leucosporidium scottii [JN544033] 99 1/342 L. scottii
MH-47.1 35 Metschnikowia australis [MAU76526] 99 3/458 M. australis
MH-23.1 2 Meyerozyma guilliermondii [JF766631] 98 5/249 M. guilliermondii
MH-38.2 7 Rhodotorula laryngis [DQ640477] 99 1/571 R. laryngis
MH-24.3 1 Rhodotorula minuta [FJ515244] 98 2/573 Rhodotorula sp.
MH-1.3 3 Rhodotorula mucilaginosa [JN417631] 99 3/541 R. mucilaginosa
Deception
33
5955 1 Geomyces pannorum [JF311913] 99 4/477 G. pannorum
P172.L1 3 Meyerozyma guilliermondii [JF766631] 100 10/569 M. guilliermondii
5932 1 Penicillium chrysogenum [JN561259] 100 0/439 P. chrysogenum
5958 4 Penicillium commune [JN676122] 99 1/510 P. commune
Monostroma hariotii 5995 1 Geomyces pannorum [DQ189229] 99 3/517 G. pannorum
6311 Verticillium antillanum [AJ292392] 96 7/278 Verticillium sp.
6292 2 Verticillium leptobactrum [AB214657] 98 0/461 V. leptobactrum
34
5.4 Diversidade da comunidade fúngica algícola
A abundância dos táxons fúngicos associados as macroalgas P. endiviifolia e M. hariotii mostrada na Tabela 4. O cálculo da abundância de cada táxon foi realizado a partir do total de 232 fungos identificados. Os gêneros encontrados com maior freqüência foram Cadophora, Cryptococcus, Geomyces, Guehomyces, Metschnikowia e Penicillium. O gênero Penicillium foi prevalente com 25,4% do total de isolados identificados. A espécie Penicillium chrysogenum foi a mais isolada deste gênero (40,7%), seguida por Penicilliumsteckii (30,5%); ambas as espécies foram encontradas nas duas macroalgas estudadas, no entanto apenas P. chrysogenum foi encontrado nas algas coletadas nas três ilhas. O gênero Penicillium é encontrado desde os trópicos até regiões polares e é considerado cosmopolita (MCRAE et al., 1999). Algumas espécies de Penicillium têm sido isoladas de diferentes amostras antárticas, como solo, sedimento de lagos, musgos e aves, além de amostras de água de glaciais e gelo do Ártico (BAUBLIS et al., 1991; MCRAE et al., 1999; GUNDE-CIMERMAN et al., 2003; BRUNATI et al., 2009). As espécies do gênero Penicillium são consideradas generalistas, o pode que explicar a colonização de diferentes macroalgas não relacionadas taxonomicamente (ZUCCARO et al., 2008, SURYANARAYANAN, 2012). No continente antártico, uma espécie do gênero (Penicillium sp.) foi obtida também a partir do talo da macroalga Adenocystis utricularis (LOQUE et al., 2010). Estes resultados mostram que espécies do genero Penicillium são encontradas comumente colonizando os talos de algas da Antártica.
A espécie mais abundante foi Metschnikowia australis (17,2%). Metschnikowia australis é uma levedura indígena do continente antártico e já foi encontrada na água do mar e sedimento marinho da Antártica (FELL et al., 1968, VAZ et al., 2011), associada aos talos das macroalgas A. utricularis, D. anceps e P. decipiens (LOQUE et al., 2010) e do estômago do krill antártico Euphausia superba (DONACHIE & ZDANOWSKI, 1998). Esta espécie foi obtida em ambas as macroalgas amostradas no presente estudo, mas apenas nas amostras da ilha Rei George.
35 diferentes fontes de carbono. Estes fungos foram isolados como os mais abundantes em amostras de madeira em decomposição da Antártica por Blanchette e cols (2010). Geomyces pannorum é um dos fungos mais freqüentemente relatados da Antártica (ARENZ et al.; 2011). Loque e cols (2010) obtiveram 21 isolados de G. pannorum dentre os 27 fungos filamentosos isolados de três macroalgas antárticas. A espécie também foi isolada por Zuccaro e cols (2008) a partir da macroalga Fucus serratus coletada no nordeste da ilha de Helgoland, Alemanha. A presença de G. pannorum em diferentes macroalgas pode ser explicada pela capacidade de tolerância deste fungo às condições extremas encontradas na Antártica. Além disso, a associação com algas na Antártica pode indicar que este fungo tem um papel importante na decomposição e ciclagem de nutrientes destas espécies de algas (LOQUE et al., 2010). Geomyces pannorum foi a espécie comum a ambas macroalgas, e, juntamente com P. chrysogenum foram as únicas espécies isoladas das três ilhas antárticas.
A espécie Cadophora malorum foi isolada apenas da macroalga P. endiviifolia oriunda da ilha Elefante e representou 10% do total de isolados identificados. Espécies de Cadophora são amplamente distribuídas no continente Antártico (ARENZ & BLANCHETTE, 2011) e já foram isoladas a partir de diferentes substratos antárticos tais como sítios históricos (ARENZ & BLANCHETTE, 2011), em associação com líquens e musgos (MÖLLER & DREYFUSS, 1996; TOSI et al, 2002), madeira e papel (ARENZ et al., 2006.) e angiospermas antárticas (SANTIAGO et al., 2012). De acordo com Blanchette e cols. (2010), algumas espécies de Cadophora parecem ter uma distribuição circumpolar na Antártica e no Ártico sugerindo uma adaptação ao ambiente polar.De acordo com Shivaji & Prasad (2009), Cryptococcus é o gênero de levedura mais abundante no continente antártico e frequente em diferentes locais e substratos.No presente estudo, o gênero Cryptococcus representou 10,4% das espécies identificadas e foi o gênero de levedura basidiomicética mais frequente. O gênero foi representado pelas espécies C. adeliensis, C. albidosimilis e C. victoriae. sendo que todas estas espécies já foram isoladas de vários substratos da Antártica (LOQUE et al. 2010, VAZ et al. 2011).
37 Tabela 4 Número de isolados e porcentagem de abundância dos fungos isolados.
A diversidade de espécies nos diferentes locais de coleta foi avaliada pelos índices de diversidade: Shannon (H’) e Simpson (Tabela 5). O índice de Shannon relaciona dois componentes de diversidade, a riqueza de espécies e a equitabilidade, atribuindo maior peso ao primeiro componente (SHANNON & WEAVER, 1949). De forma que, quanto maior for o valor do índice, maior a riqueza de espécies e, quanto menor o valor do índice, menor a riqueza de espécies. As macroalgas da ilha Elefante
Local de coleta e número de isolados
Deception Elefante Rei George Abundância (%)
Antarctomyces sp. - 1 - 0,4
Aspergillus sp - 1 - 0,4
Aspergillus sp.2 - 2 - 0,8
Aspergillus sp.3 1 - - 0,4
Cadophora malorum - 24 - 10
Candida sake - - 1 0,4
Cladosporium sp. - 1 - 0,4
Cladosporium sp.1 - 1 - 0,4
Cryptococcus adeliensis 1 - - 0,4
Cryptococcus albidosimilis - - 18 7,8
Cystofilobasidium infirmominiatum
- - 2 0,8
Cryptococcus victoriae - - 5 2,2
Dipodascus australiensis - - 1 0,4
Emericella nidulans - 1 - 0,4
Geomyces pannorum 2 17 8 11,6
Guehomyces pullulans - - 22 9,5
Leucosporidium scotti - - 1 0,4
Metschnikowia australis - - 40 17,2
Meyerozyma guilliermondii 3 - 2 2,2
Mortierella sp. - 1 - 0,4
Oidiodendron truncatum - 1 - 0,4
Penicillium commune 4 8 - 5,2
Penicillium chrysogenum 1 21 2 10,3
Penicillium steckii - 18 - 7,8
Penicillium sp. - 2 - 0,8
Penicillium sp.2 - 1 - 0,4
Penicillium sp.3 - 1 - 0,4
Penicillium sp.4 - 1 - 0,4
Rhodotorula laryngis - - 7 3
Rhodotorula mucilaginosa - - 3 1,3
Rhodotorula sp. - - 1 0,4
Thelebolus sp. - 2 - 0,8
Verticillium leptobactrum 2 - - 0,8
Verticillium sp. 1 - - 0,4