VANESSA MARA CHAPLA
Bioprospecção dos fungos endofíticos associados à espécie
vegetal
Eugenia jambolana
e utilização de modificador epigenético no
cultivo do fungo
Lecythophora
sp.
Araraquara 2014
Bioprospecção dos fungos endofíticos associados à espécie
vegetal
Eugenia jambolana
e utilização de modificador epigenético no
cultivo do fungo
Lecythophora
sp.
Orientadora: Prof. Dra Angela Regina Araujo
Araraquara 2014
Dados Pessoais:
Nome: Vanessa Mara Chapla e-mail: vanessachapla@gmail.com
Formação Acadêmica:
(1) Doutorado em Química – Universidade Estadual Paulista “Júlio de Mesquita Filho” (UNESP) – Instituto de Química – Araraquara – SP (2010 - 2014), com período sanduíche na University of Arizona (2012-2013 - Orientador: Leslie A. A. Gunatilaka)
(2) Mestrado em Química – Universidade Estadual Paulista “Júlio de Mesquita Filho” (UNESP) – Instituto de Química – Araraquara – SP (2008 - 2010).
(3) Graduação em Química Bacharelado - Universidade Estadual do Oeste do Paraná (UNIOESTE) – Centro de Engenharias e Ciências Exatas – Toledo – PR (2003 - 2007).
Bolsas Concedidas
(1) Bolsista de Doutorado – CAPES (2010-2014)
Título do projeto: Avaliação química e biológica dos fungos endofiticos associados a especie vegetal Eugenia jambolana.
Orientação: Angela Regina Araujo
(2) Bolsista de estagio de doutoramento – CAPES (2012-2013)
Título do projeto: Maximizando a diversidade metabólica de endófitos de plantas e de liquens utilizando moduladores epigenéticos
isolado da Senna spectabilis.
Orientação: Angela Regina Araujo
Artigos completos publicados em periódicos
1. CHAPLA, V. M., BIASETTO, C. R., ARAUJO, A. R.
Fungos endofiticos: uma fonte inexplorada e sustentável de novos e bioativos produtos naturais. Revista Virtual de Química. v. 5, p. 421-437, 2013.
2. SILVA, Cristiana Da, SAVARIZ, Franciele Cristina, FOLLMANN, Heveline Dal Magro, NUÑES, Luciana, CHAPLA, Vanessa, Mara; SILVA Classius Ferreira da,. Análise físico-química de salames coloniais comercializados no município de Toledo, Estado do Paraná. Acta Scientiarum. Technology (Online). v.33, p.331 - 336, 2011.
Trabalhos Apresentados em Congressos
1. CHAPLA, V. M., CAVALHEIRO, A. J., BOLZONI, V.S., FERREIRA, P. M. P., PESSOA, C., ARAUJO, A. R. Two new compounds isolated from saccharicola sp. An endophytic fungus in Eugenia jambolana (MYRTACEAE). 4th Brazilian Conference of Natural Products. Natal-RN, 2013.
2. ARAUJO, A. R., CHAPLA, V. M., LOPES, M.N., SILVA, D.H.S., CAVALHEIRO, A. J., BOLZONI, V.S. Two new metabolites from Saccharicola sp. an endophytic fungus in Eugenia jambolana (Myrtaceae) In: The American Society of Pharmacognosy Annual Meeting, Saint Louis. 2013.
R., CAVALHEIRO, A. J. Saccharicola sp. um endófito de Eugenia jambolana, um prolífico produtor de metabólitos bioativos. 36ª Reunião Anual da Sociedade Brasileira de Química, Águas de Lindóia - SP. 2013.
5. ARAUJO, A. R., MONFARDINI, J. D., CHAPLA, V. M., LOPES, M.N., SILVA, D.H.S., CAVALHEIRO, A. J., BOLZANI, V.S. Dihydroisocoumarins produced by
Botryosphaeria parva an endophytic fungus from Eugenia jambolana In: The International Congress on Natual Products Research, 2012.
6. CHAPLA, V. M., SOMENSI, A., CAVALHEIRO, A. J., BOLZANI, V. S., ARAUJO, A. R. Substâncias acetilênicas produzidas por Saccharicola sp. um fungo endofítico isolado de Eugenia jambolana, 35ª Reunião Anual da Sociedade Brasileira de Química, Águas de Lindóia - SP, 2012.
7. CHAPLA, V. M., SILVA, D.H.S., BOLZONI, V.S., FERREIRA, LIMA, D., J., B., PESSOA, C., MORAES, M. O., ARAUJO, A. R. Bioprospection in endophytes associated with Eugenia jambolana, Brazilian Conference of Natural Products, Ouro Preto-MG, 2011.
8. CHAPLA, V. M., ZANARDI, M. L., LOPES, M.N., SILVA, D.H.S., YOUNG, M. C. M., BOLZANI, V. S., ARAUJO, A. R. Metabólitos secundários produzidos pelo endófito
Phomopsis sp. associado a Senna spectabilis In: 33a Reunião Anual da Sociedade Brasileira de Químcia, Águas de Lindóia – SP, 2010.
2nd Brasilian Conference on Natural Products and XXVIII Annual Meeting on Micromolecular Evolution, Systematics and Ecology, São Pedro. 2009.
11. PELLEGRINI, M. M.; CHAPLA, V. M.; BIASETTO, C. R.; ZANARDI, L. M.; SILVA, D. H. S.; BOLZANI, V. S.; ARAUJO, A. R. Prospecção Química do fungo endofítco
Nigrospora shaerica isolado de Alchornea glandulosa. 17-Encontro da SBQ-Regional Interior Paulista Waldemar Saffioti, Araraquara, 2009.
12. CHAPLA, V. M.; OLGUIN, C. F. A.; BRAUN, G.; CORNELIUS T. F. M. Estudo fitoquímico biomonitorado do extrato hexânico da parte aérea da macrófita
Eichornia crassipes. In: XX Simpósio de Plantas Medicinais do Brasil e X International Congress of Ethnopharmacology, São Paulo, 2008.
13. CHAPLA, V. M.; OLGUIN, C. F. A.; BRAUN, G. Avaliação da atividade citotóxica e antimicrobiana do extrato da parte aérea da macrófita Eichhornia crassipes. In: XV Encontro de Química da Região Sul, Ponta Grossa, 2007.
14. SILVA, C.; CHAPLA, V. M.; CAMPOS, S. D. Substituição e modificação do cimento odontológico a base de fosfato de zinco. In: XV Encontro de Química da Região Sul, Ponta Grossa, 2007.
15. CHAPLA, V. M.; OLGUIN, C. F. A. Investigação fitoquímica do extrato hexânico da parte aérea da Eichhornia crassipes. In: XVI Encontro Anual de Iniciação Científica, Maringá, 2007.
16. CHAPLA, V. M.; OLGUIN, C. F. A.; FOLLMANN, H. D. M.; NUNES, D.; SONE, A. P.; HAMERSKI, L. Toxicidade frente à Artemia salina e germinação de Lactuca sativa
CHAPLA, V. M. Palestra Intitulada: Avaliação Química e biológica do fungo endofítico
Phomopsis sp. isolado de Senna spectabilis. In: IV Workshop NuBBE, 2009, Araraquara.
Orientações e supervisões
Monografias de conclusão de curso de aperfeiçoamento/especialização
1. André Paulesini Iagalo. Estudo da variação metabólica do fungo endofítico
Saccharicola sp. associado a espécie vegetal Eugenia jambolana. 2012. Monografia (Química) - Universidade Estadual Paulista Júlio de Mesquita Filho
Iniciação científica
2. Julia Dietsche Monfardini. Estudo químico e biológico do fungo endofítico
Botryosphaeria parva isolado de Eugenia jambolana. 2012. Iniciação científica (Química) - Universidade Estadual Paulista Júlio de Mesquita Filho
Atividades extracurriculares
Participou da comissão organizadora do I Encontro Paranaense de Estudantes de Química e de VIII Semana Acadêmica, realizado na Universidade Estadual do Oeste do Paraná- UNIOESTE, Campus de Toledo, totalizando 20 horas.
Estágio docente em Química Orgânica Experimental II - UNESP (março de 2009 a junho de 2009);
Bolsista didático – Professora da disciplica de Química Orgânica I (4 horas/semana, 2011), e disciplina de Química Orgânica Experimental I (4horas/semanis, 2011).
A UNESP e ao Departamento de Química Orgânica do Instituto de Química- Araraquara, pela possibilidade do desenvolvimento deste trabalho e por ter sido cenário importante de uma
etapa da minha vida.
A University of Arizona pela possibilidade da realização do estágio de doutoramento. A prof. Dra. Angela R. Araujo pela orientação, dedicação, compreensão, carinho, amizade,
muito obrigada pela confiança, sabedoria e apoio.
Ao prof. Dr. Leslie A. A. Gunatilaka pela orientação, pelos ensinamentos, compreensão e amizade.
A prof. Dr. Lúcia M. Xavier Lopes e ao prof. Dr. Ian Castro Gamboa que participaram do exame de qualificação, e contribuíram para a finalização deste trabalho.
Aos professores membros da banca que gentilmente aceitaram o convite para avaliação desta tese.
Aos professores do departamento de Química Orgânica, por seus ensinamentos e amizade. A todos os funcionários do IQ da Unesp.
Ao querido Nivaldo Boralle pela realização dos espectros de RMN, por estar sempre disposto a compartilhar os seus conhecimentos.
Ao técnico Marquinhos, por ser tão prestativo. Aos técnicos João e Juliana. Ao Thomaz pelos espectros de massas, pelas discussões e dúvidas esclarecidas. A prof. Dr. Maria Cláudia M. Young e ao prof. Dr. Paulo Michel P. Ferreira pela realização dos
ensaios biológicos.
A todos os meus amigos em especial a Cristiana (Mer) e Juliana (Piri) que não foram apenas amigas mas sim grandes irmãs, não esquecendo e claro das demais bandidas: Adriana,
Juzona, Raquel, Dani, Lorena, Thais, Aline, Andrea, Mariana, amo vocês.
Aos grandes amigos Nerilson, Luciana, Néia, Cláudio Rodrigo, Alessandra, Caio, Andre e a Merilu.
Aos meus queridos alunos de IC Julia e Andre.
Aos amigos da turma da micose Carolina, Andressa, Miller, Fernandinho, Renato, Patrícia, Alana, Felipe pela convivência dentro e fora do laboratório.
Ao Dr. Kitshiri pelos ensinamento, amizade e carinho.
Aos funcionários e colegas do NPC (Natural Product Center) pela dedicação e disposição em ajudar, em especial a May pelas conversas nos corredores e amizade.
Ao Kamal e Hementha pela amizade e carinho.
Aos a igos ue ga hei os EUA e especial a Co ceição, Jai , B illa e a gale a do CsF. A minha família, mesmo que de longe sempre me apoiou. Pai, Mãe, Sirlei, Tati, Angélica,
Chicão, Heraldo, Charles e a pequena Annabelle. Amo essa família buscapé!!
A todos que direta ou indiretamente contribuíram para o desenvolvimento deste trabalho.
Eu preciso encontrar Um lugar legal pra mim
Dançar e me escabelar Tem que ter um som legal
Tem que ter gente legal E ter cerveja barata
Um lugar onde as pessoas Sejam mesmo afudê Um lugar onde as pessoas Sejam loucas e super chapadas
Um lugar do caralho
Sozinho pelas ruas de São Paulo Eu quero achar alguém pra mim
Um alguém tipo assim Que goste de beber e falar
LSD queira tomar E curta Syd Barrett e os Beatles
Um lugar e um alguém Que tornarão-me mais feliz
Um lugar onde as pessoas Sejam loucas e super chapadas
Um lugar do caralho Lugar do caralho
RESUMO
Os produtos naturais têm desempenhado um papel importante pela humanidade, no uso da medicina popular e na geração da descoberta de novos fármacos. Fungos endofíticos são micro-organismos que vivem em associação mutualística com a espécie hospedeira trazendo benefícios a ambos, e são uma promissora fonte de produtos naturais. A espécie vegetal Eugenia jambolana tem sido intensamente explorada química e biologicamente devido a seus usos populares e por apresentar diversas atividades biológicas. No intuito de explorar a potencionalidade dessa espécie vegetal, E. jambolana foi submetida ao isolamento dos fungos endofíticos presentes nas folhas, caule e frutos, dos quais foram isolados treze fungos endofíticos. Estes endófitos foram cultivados em escala reduzida em Czapek (400 mL) para obtenção dos extratos brutos AcOEt. Os extratos brutos AcOEt foram submetidos a análises químicas (cromatografia em camada delgada comparativa, cromatografia líquida de alta eficiência e ressonância magnética nuclear de 1H) e biológicas (ensaios antioxidante, antifúngico, anticolinesterásico e citotóxico). Todos os extratos brutos apresentaram pelo menos uma atividade biológica positiva, o que adicionado as análises químicas permitiram selecionar dois fungos endofíticos para crescimento em escala ampliada, e isolamento dos metabólitos secundários. Destes, o fungo endofítico isolado do caule de E. jambolana codificado como Ej-c3 foi identificado como Saccharicola sp., foi possível isolar 7 substâncias das quais 4 são inéditas (4-7), os compostos 4 e 5 foram inativo nos ensaios realizados. Do estudo químico do fungo endofítico Botryosphaeria parva (Ej-f1), isolado das folhas, foram isolados 4 substâncias da classe das isocumarinas [meleina (3), 4-hidroximeleina (11), 5-hidroximeleina (13), 7-5-hidroximeleina (12)], as substâncias 3 e 13 foram ativas no ensaio antifúngico contra C. sphaerospermum.
No intuito de aumentar a produção metabólica e ativar as vias biossintéticas silenciosas, a epigenética surge como uma ferramenta útil e simples para expressar diferentes genes biossintéticos. Lecythophora sp., um fungo endofítico proveniente do líquen Parmotrema tinctorum, foi submetido ao estudo químico utilizando no cultivo o modificador epigenético 5-azacetidina (500 µM). No cultivo em escala reduzida (MDB 1 L) o modificador epigenético aumentou o rendimento do extrato bruto em 9,2 vezes, e pela análise em CLAE foi possível observar a produção de dois compostos diferentes. Este fungo foi cultivado em escala ampliada (10 L) na presença de 5-azacetidina (500 µM). Após realizar o isolamento dos metabólitos secundários foi possível identificar 5 compostos da classe dos oxaspirois (14-18), sendo dois compostos inéditos (14-15). A estereoquimica absoluta das substâncias 16 (oxaspirol E) e 17 (oxaspirol C) foi determinada utilizando-se o método de esteres de Moscher. As substâncias inéditas foram produzidos somente no cultivo do fungo com o modificador epigenético, demonstrando que esta técnica é eficaz na modificação da produção metabólica. Os oxaspirois E, C e B foram inativos no ensaio citotóxico realizado. As estruturas das substâncias isoladas foram elucidadas pelo uso de técnicas espectrométricas como RMN 1 e 2D, espectrometria de massas, e espectros de absorção na região do infravermelho.
Palavras-chave: Fungos endofíticos, Eugenia jambolana, epigenética, Saccharicola
Abstract
The natural products have occuped an important role for humanity, in the use of folk medicine and in the generation of drug discovery. Endophytic fungi are microorganism that living in a mutualist association with host species, refleting benefits to both, and they are a promising source for natural products. The vegetal species Eugenia jambolana has been intensively explored chemically and biologically, because of its popular uses and it has several biological activities. In order to explore the potencionality of this plant species, E. jambolana was submitted to isolation of endophytic fungi in the leaves stems and fruits, of which thirteen endophytic fungi were isolated. The endophytes were cultived in small scale in Czapek (400 mL) to give the EtOAc crude extract. The EtOAc crude extract were submited to chemistry (thin layer chromatography, high performace liquid chromatography and 1H nuclear magnetic ressonance) and biological (antioxidant, antifungal, anticholinesterase and cytotoxic activities) analysis. All of crude extract showed at least one positive biological activity, which added the chemical analyzes allowed us to select two endophytic fungi to growing on a larger scale, and isolation of secondary metabolites. The endophytic fungus isolated from stems of E. jambolana encoded Ej-c3 was identified as
Saccharicola sp. it was isolated 7 substances of which 4 are new (4-7). The substances 4 e 5 were inactive in the biological assays. Chemical study of Botryosphaeria parva
(Ej-f1) isolated from leaves, was isolated 4 isocoumains [melein (3), 4-hidroxymelein (11), 5-hidroxymelein (13), 7-hidroxymelein (12)]. The substances 3 and 13 were active in antifungal assay agains the fungus C. sphaerospermum.
In order to increase the metabolite production and activate the silent biossintetic pathway, the epigenetic appear as a useful and simple tool to gene expression.
Lecythophora sp. an endolichenic fungus from Parmotrema tinctorum, was submited to chemical study using the epigenetic modifier 5-azacytidine (500 µM). In small scale culture (PDB 1L) the epigenetic modifier increase the yield of the crude extract in 9.2 times. The HPLC analyses was observed the production of two diferent compounds. The grow up scale culture (10 L) in the presence of 5-azacytidine (500 µM) were isolated 5 oxaspirois compounds (14-18), which two are new compounds (14 and 15). The absolute stereochemistry of the substances 16 (oxaspirol E) and 17 (oxaspirol C) were obtained using the Mosher’s ester method. The new substances were produced just in the culture using epigenetic modifier, showing that this technique is efficient in modifier the metabolic production in fungi. The oxaspirol E, C and B were inactive in the cytotoxic assay. The structure of the substances were determinted by spectrometric 1D and 2D techniques, mass spectrometry and IR.
Keywords: Endophytic fungi, Eugenia jambolana, epigenetic, Saccharicola sp.,
LISTA DE FIGURAS
Figura 1: Substâncias bioativas isoladas de fungos endofíticos ... 38
Figura 2: Eugenia jambolana ... 41
Figura 3: Fitoquímicos presentes em Eugenia jambolana ... 42
Figura 4: Antocianinas presentes em Eugenia jambolana ... 44
Figura 5: Substâncias produzidas por fungos endofíticos do gênero Botryosphaeria ... 47
Figura 6: Foto do líquen Parmotrema tinctorum ... 49
Figura 7: Substâncias isoladas do líquen Parmotrema tinctorum ... 50
Figura 8: Itens publicados por ano contendo “endolichenic”... 51
Figura 9: Substâncias isoladas de fungos do gênero Lecythophora ... 52
Figura 10: Metilação do resíduo citosina do DNA ... 54
Figura 11: Acetilação do resíduo lisina encontrado nas histonas e sua interação com o DNA ... 55
Figura 12: Exemplos de moléculas utilizadas como modificadores epigenéticos ... 56
Figura 13: Compostos isolados do cultivo de fungos com modificadores epigenéticos. ... 57
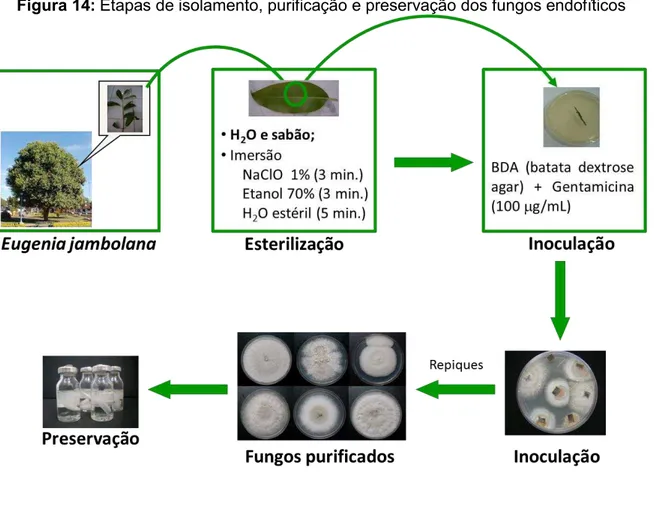
Figura 14: Etapas de isolamento, purificação e preservação dos fungos endofíticos ... 66
Figura 15: Fluxograma da obtenção e triagem dos extratos brutos obtidos de E. jambolana ... 67
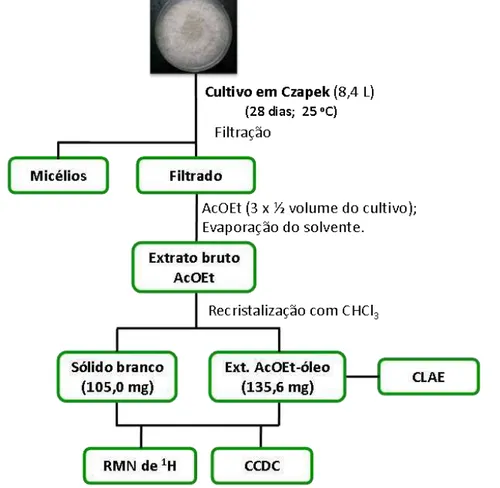
Figura 16: Obtenção do extrato bruto produzido por Saccharicola sp. ... 68
Figura 17: Fracionamento do extrato bruto e isolamento dos metabólitos secundários produzidos pelo fungo Saccharicola sp. ... 70
Figura 18: Fluxograma de cultivo e obtenção do extrato bruto produzido por B.parva ... 71
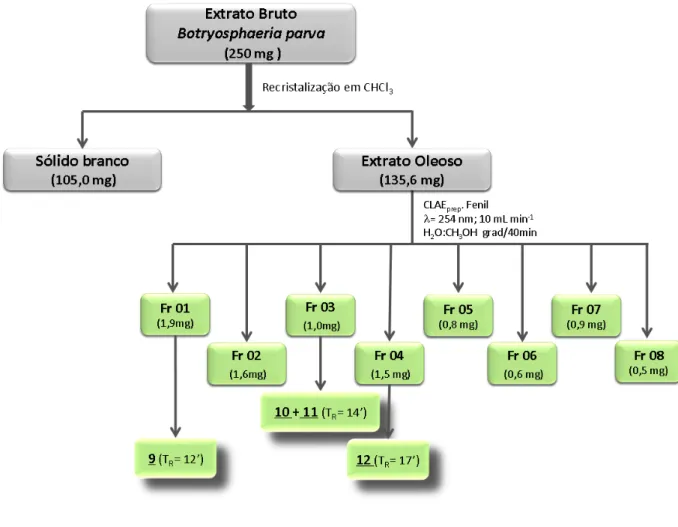
Figura 19: Isolamento dos metabólitos secundários produzidos pelo fungo B. parva ... 72
Figura 20: Fungos endofíticos isolados de Eugenia jambolana... 77
Figura 21: CCDC dos extratos brutos obtidos dos fungos ... 79
Figura 23: Espectro de absorção na região do UV para: pico a (a) pico b (b) e pico c (c) do cromatograma do fungo Ej-f1 (Figura 22) ... 81 Figura 24: Espectro de absorção na região do UV para: pico a (a) e pico b (b) do cromatograma do fungo Ej-f2 (Figura 22)... 81 Figura 25: Espectro de absorção na região do UV para: o pico d (a) e pico e (b) do cromatograma do fungo Ej-f3 (Figura 22)... 81 Figura 26: Cromatogramas dos extratos bruto dos fungos endofíticos isolados dos caules ... 82 Figura 27: Espectros de absorção na região do UV para o pico f (a), pico g (b) do extrato bruto do fungo Ej-c3 ... 83 Figura 28: Cromatogramas dos extratos produzidos pelos fungos isolados do fruto de E.jambolana. ... 84 Figura 29:Espectro de RMN de 1H do extrato bruto do fungo Ej-f1 (CDCl3, 500 MHz) ... 85 Figura 30: Espectro de RMN de 1H do extrato bruto do fungo Ej-f2 (CDCl3, 500 MHz) ... 86 Figura 31: Espectro de RMN de 1H do extrato bruto do fungo Ej-f3 (CDCl3, 500 MHz) ... 87 Figura 32: Espectro de RMN de 1H do extrato bruto do fungo Ej-c1 (CDCl3, 500 MHz) ... 89 Figura 33: Espectro de RMN de 1H do extrato bruto do fungo Ej-c2 (CDCl3, 500 MHz) ... 90 Figura 34: Espectro de RMN de 1H do extrato bruto do fungo Ej-c3 (CDCl3, 500 MHz) ... 90 Figura 35: Espectro de RMN de 1H do extrato bruto do fungo Ej-c4 (CDCl3, 500MHz) ... 91 Figura 36: Espectro de RMN de 1H do extrato do fungo Ej-fm1 em DMSO-d6
(500MHz) ... 92 Figura 37: Espectro de RMN de 1H do extrato do fungo Ej-fv1 em DMSO-d6
Figura 40: Espectro de RMN de 1H do extrato do fungo Ej-fv4 em DMSO-d6 (500
MHz) ... 97
Figura 41: Espectro de RMN de 1H do extrato do fungo Ej-fv5 em DMSO-d6 (500MHz) ... 97
Figura 42: Placa de CCDC obtida no ensaio antifúngico para os extratos obtidos dos fungos endofíticos ... 102
Figura 43: Espectro de RMN de 1H da substância 4 (DMSO-d6, 500 MHz) ... 106
Figura 44: Estrutura parcial A da substância 4 ... 107
Figura 45: Estrutura parcial B da substância 4 ... 107
Figura 46: Estrutura parcial C da substância 4 ... 108
Figura 47: Estrutura parcial D da substância 4 ... 108
Figura 48: Principais correlações observadas no espectro de HMBC para 4 ... 109
Figura 49: Correlações observadas em NOE para a substância 4 ... 109
Figura 50: Configuração relativa proposta para a substância 4 ... 110
Figura 51: Principais correlações observadas em HMBC para a substância 5 (500 MHz) ... 112
Figura 52: Correlações observadas em ROESY para a substância 5 ... 112
Figura 53: Configuração relativa proposta para 5 ... 113
Figura 54: Principais correlações observadas no experimento HMBC para a substância 6 ... 115
Figura 55: Principais correlações observadas no experimento de HMBC para 7 ... 117
Figura 56: Espectro de RMN de 1H da substância 8 (500 MHz) ... 120
Figura 57: Espectro de RMN de 1H da substância 9 (500 MHz) ... 122
Figura 58: Correlações observadas no experimento HMBC para 10. ... 124
Figura 59: Espectro de RMN de 1H da substância 10 (500 MHz) ... 125
Figura 60: Proposta biossintética para a substância 8, 9 e 10 ... 127
Figura 61: Espectro de RMN de 1H do sólido em DMSO-d6 (500 MHz). ... 128
Figura 62: Espectro de RMN de 1H do Ext. AcOEt-óleo em CDCl3 (500 MHz). ... 129
Figura 63: Proposta biossintética para as isocumarinas... 135
Figura 64: Resultados obtidos para as substâncias testadas no ensaios antifúngico ... 137
Figura 66: Fluxograma da obtenção e triagem dos extratos brutos obtidos de
Lecythophora sp. ... 145
Figura 67: Obtenção do extrato bruto produzido por Lecythophora sp. ... 146
Figura 68: Fluxograma da partição líquido/líquido do extrato bruto AcOEt ... 147
Figura 69: Fluxograma de fracionamento da fração CHCl3 ... 147
Figura 70: CCDC obtida dos extratos brutos ... 153
Figura 71: CCDC obtida dos extratos brutos ... 154
Figura 72: Cromatogramas obtidos do cultivo em 1L do fungo Lecythosphora sp. (A) cultivo em MDB (B) cultivo em MDB contendo 500 µM de 5-azacitidina (= 254 nm) ... 154
Figura 73: Correlações HMBC e 1H-1H COSY para 14 ... 158
Figura 74: Correlações observadas por ROESY para a substância 14 ... 159
Figura 75: Correlações HMBC e 1H-1H COSY para a substância 15 ... 161
Figura 76: Conformação cadeira para o composto 15 ... 162
Figura 77: Correlações observadas em ROESY para o composto 16 ... 164
Figura 78: Valores de [(em ppm) = S - R] para 16 ... 164
Figura 79: Correlações ROESY observadas para 17 ... 167
Figura 80: Valores de [(em ppm) = S - R] para 17 ... 167
Figura 81: Proposta biossintética para o oxaspirol E e C ... 170
Figura 82: Proposta biossintética para os derivados do oxaspirol ... 171
Figura 83: Espectro de Massas de alta resolução para a substância 1 (Ej-f3) ... 187
Figura 84: Espectro de Massas de alta resolução para a substância 1 (Ej-fv2) ... 188
Figura 85: Espectro de Massas de alta resolução para a substância 4 ... 189
Figura 86: Espectro de RMN de 1H da substância 4 (DMSO-d6, 500MHz) ... 190
Figura 87: Espectro de RMN de 13C da substância 4 (DMSO- d6, 125 MHz) ... 191
Figura 88: Espectro de HMQC da substância 4 (DMSO-d6) ... 192
Figura 89: Espectro de HMBC da substância 4 (DMSO-d6) ... 193
Figura 90: Espectro de COSY 1H-1H da substância 4 (DMSO-d6) ... 194
Figura 91: Espectro de Massas de alta resolução para a substância 5 ... 195
Figura 92: Espectro de RMN de 1H da substância 5 e 6 (DMSO-d6, 500 MHz)... 196
Figura 93: Espectro de RMN de 13C da substância 5 e 6 (DMSO-d6, 125 MHz) .... 197
Figura 94: Espectro de HMQC da substância 5 e 6 (DMSO-d6) ... 198
Figura 96: Espectro de COSY da substância 5 e 6 (DMSO-d6) ... 200
Figura 97: Espectro de ROESY da substância 5 e 6 (DMSO-d6) ... 201
Figura 98: Espectro de Massas de alta resolução para a substância 7 ... 202
Figura 99: Espectro de RMN de 1H para a substância 7 ... 203
Figura 100: Espectro de HMQC para a substância 7 ... 204
Figura 101: Espectro de HMBC para a substância 7 ... 205
Figura 102: Espectro de Massas de baixa resolução para a substância 8 ... 206
Figura 103: Espectro de RMN de 1H da substância 8 (DMSO-d6) ... 207
Figura 104: Espectro de HMBC da substância 8 (DMSO-d6) ... 208
Figura 105: Espectro de COSY da substância 8 (DMSO-d6) ... 209
Figura 106: Espectro de massas de baixa resolução para 9 ... 210
Figura 107: Espectro de RMN de 1H da substância 9 (DMSO-d6) ... 211
Figura 108: Espectro de HMQC da substância 9 (DMSO-d6, 500 MHz)... 212
Figura 109: Espectro de HMBC da substância 9 (DMSO-d6, 500 MHz) ... 213
Figura 110: Espectro de COSY da substância 9 (DMSO-d6, 500 MHz) ... 214
Figura 111: Espectro de massas de baixa resolução para a substância 10 ... 215
Figura 112: Espectro de RMN de 1H da substância 10 (DMSO-d6, 500 MHz) ... 216
Figura 113: Espectro de HMQC da substância 10 (DMSO-d6) ... 217
Figura 114: Espectro de HMBC da substância 10 (DMSO-d6) ... 218
Figura 115: Espectro de COSY da substância 10 (DMSO-d6) ... 219
Figura 116: Espectro de NOESY da substância 10 (DMSO-d6) ... 220
Figura 117: Espectro de Massas de alta resolução para a substância 11 ... 221
Figura 118: Espectro de RMN de 1H da substância 11 (CDCl3, 500 MHz) ... 222
Figura 119: Espectro de HMQC da substância 11 (CDCl3, 500 MHz) ... 223
Figura 120: Espectro de HMBC da substância 11 (CDCl3, 500 MHz) ... 224
Figura 121: Espectro de COSY da substância 11 (CDCl3, 500 MHz) ... 225
Figura 122: Espectro de RMN de 1H da substância 12 e 13 (CDCl3, 500 MHz) ... 226
Figura 123: Espectro de Massas de alta resolução para a substância 12 e 13 ... 227
Figura 124: Espectro de RMN de 1H da substância 12 e 13 (CDCl3, 500 MHz) ... 228
Figura 125: Espectro de RMN de 1H da substância 14 (CDCl3) ... 229
Figura 126: Espectro de RMN de 13C da substância 14 (CDCl3) ... 230
Figura 127: Espectro de HMQC da substância 14 (CDCl3) ... 231
Figura 128: Espectro de HMBC da substância 14 (CDCl3) ... 232
Figura 130: Espectro de ROESY da substância 14 (CDCl3) ... 234
Figura 131: Espectro de RMN de 1H da substância 15 (CDCl3) ... 235
Figura 132: Espectro de RMN de 13C da substância 15 (CDCl3) ... 236
Figura 133: Espectro de HMQC da substância 15 (CDCl3) ... 237
Figura 134: Espectro de HMBC da substância 15 (CDCl3) ... 238
Figura 135: Espectro de COSY da substância 15 (CDCl3) ... 239
Figura 136: Espectro de RMN de 1H da substância 16 (400 MHz, CDCl3) ... 240
Figura 137: Espectro de RMN de 13C da substância 16 (CDCl3) ... 241
Figura 138: Espectro de HMQC da substância 16 (CDCl3) ... 242
Figura 139: Espectro de COSY da substância 16 (CDCl3) ... 243
Figura 140: Espectro de ROESY da substância 16 (CDCl3) ... 244
Figura 141: Espectro de RMN de 1H da substância 17 (CDCl3) ... 245
Figura 142: Espectro de RMN de 13C da substância 17 (CDCl3) ... 246
Figura 143: Espectro de HMQC da substância 17 (CDCl3) ... 247
Figura 144: Espectro de HMBC da substância 17 (CDCl3) ... 248
Figura 145: Espectro de COSY da substância 17 (CDCl3) ... 249
Figura 146: Espectro de ROESY da substância 17 (CDCl3) ... 250
LISTA DE TABELAS
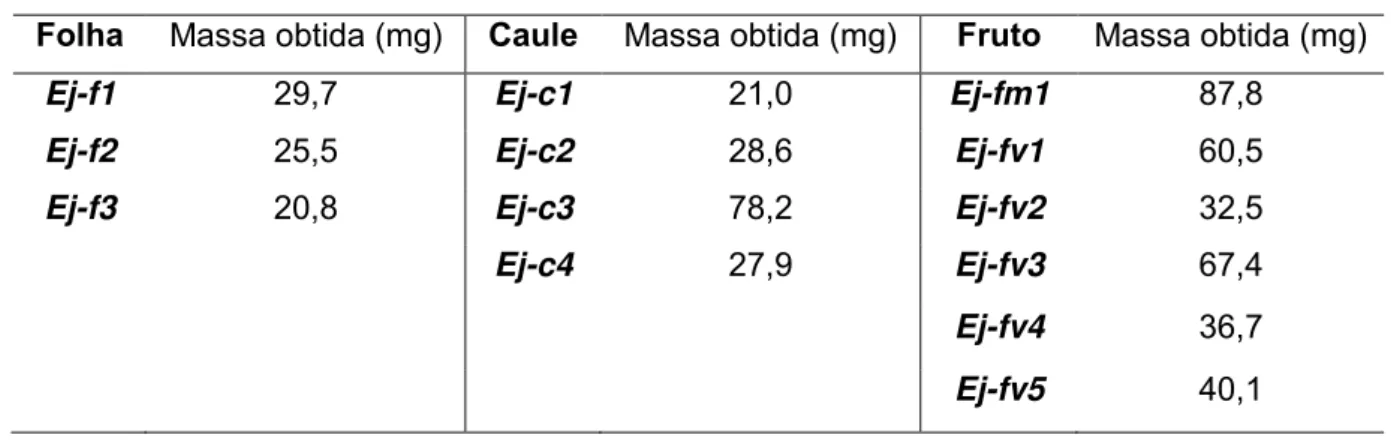
Tabela 1: Rendimento obtido dos extratos brutos dos endófitos fermentados em 400
mL ... 78
Tabela 2: Dados de RMN de 1H e 13C para a substância 3 (DMSO-d6) ... 96
Tabela 3: Percentual de inibição do crescimento celular (IC%) das amostras em três linhagens tumorais testadas na dose única de 50 µg mL-1 Valores são média ± DPM. ... 99
Tabela 4: Fator de Retenção das substâncias que apresentaram inibição da enzima acetilcolinesterase (sílica gel – eluente Hex:AcOEt 3:7) ... 100
Tabela 5: Fator de Retenção das substâncias que apresentaram inibição no crescimento dos fungos fitopatógenos (sílica gel – eluente Hex:AcOEt 3:7) ... 101
Tabela 6: Tempo de Retenção das substâncias que apresentaram potencial antioxidante (sílica gel – eluente Hex:AcOEt 3:7) ... 103
Tabela 7: Valores de 1H e 13C para a substância 4 (DMSO-d6, 500 MHz) ... 110
Tabela 8: Valores de 1H e 13C para a substância 5 (DMSO-d6, 500 e 125 MHz) .... 113
Tabela 9: Valores de 1H e 13C para a substância 6 (DMSO-d6, 500 MHz e 125 MHz) ... 115
Tabela 10: Valores de 1H e 13C para a substância 7 (DMSO-d6, 500 MHz) ... 117
Tabela 11: Dados de RMN de 1H e 13C para a substância 8 (DMSO-d6) ... 120
Tabela 12: Dados de RMN de 1H e 13C para a substância 9 (DMSO-d6) ... 123
Tabela 13:Valores de 1H e 13C (500 e 125 MHz, DMDO-d6) para a substância 10. 125 Tabela 14: Dados obtidos de RMN de 1H (500 MHz) e 13C (125 MHz) da substância 11 (CDCl3). ... 131
Tabela 15: Dados obtidos de RMN de 1H (500 MHz) das substâncias 12 e 13 (CDCl3). ... 133
Tabela 16: Resultado das substâncias para o ensaio antifúngico contra a linhagem C. sphaerospermum ... 136
Tabela 17: Fração obtidas da CC reunidas de acordo com o perfil em CCDC ... 148
Tabela 18: Resultados obtidos para os dois extratos brutos nos ensaios biológicos testados ... 155
Tabela 19: Dados de RMN obtidos para a substância 14 (CDCl3, 400 MHz) ... 159
Tabela 20: Dados de RMN obtidos para a substância 15 (400 MHz) ... 161
Tabela 21: Dados de RMN obtidos para a substância 16 (CDCl3, 400 MHz) ... 165
LISTA DE ABREVIATURAS E SIGLAS
AChE Enzima Acetilcolinesterase
AcOEt Acetato de Etila
BDA Batata Dextrose Agar
CCDC Cromatografia em Camada Delgada Comparativa
CC Cromatografia em Coluna
CDCl3 Clorofórmio Deuterado
CLAE Cromatografia Líquida de Alta Eficiência
COSY Correlation spectroscopy
CpG Citosina-fosfina-guanidina
CPQBA Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas
DAD Detector de Arranjo de Diodos
DMSO Dimetilsulfóxido
DMSO-d6 Dimetilsulfóxido Deuterado
DNA Ácido desoxirribonucleico
DNMTs DNA metiltransferases
DPPH 2,2-difenil-1-picrilhidrazil
Ej-c Fungos endofíticos isolados do caule de Eugenia jambolana
Ej-f Fungos endofíticos isolados da folha de Eugenia jambolana
Ej-fm Fungos endofíticos isolados do fruto maduro de Eugenia jambolana
Ej-fv Fungos endofíticos isolados do fruto verde de Eugenia jambolana
EM Espectrometria de Massas
ESI-TOF electrospray ionization – Time of flight HATs Histonas acetiltransferases
HDAC Histonas deacetilases
Hex Hexano
HMQC Heteronuclear Multiple Quantum Coherence
HSQC Heteronuclear Single-Quantum Coherence
IV Espectroscopia na região do Infravermelho
MBD Meio de Batata Dextrose
NuBBE Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais
NOESY Nuclear Overhauser effect spectroscopy
OSMAC One Strain Many Compounds
RMN Ressonância Magnética Nuclear
RNA Ácido Ribonucleico
ROESY Rotating frame nuclear Overhauser effect spectroscopy
SAHA Ácido suberoilanilide hidroxamico
SBHA Ácido Suberohidroxamico
TMS Tretrametilsilano
LISTA DE SÍMBOLOS
Deslocamento químico
Comprimento de onda
Variação do deslocamento químico
μ Micro
[M]+ Íon molecular
J Constante de acoplamento
s Simpleto
sl Simpleto Largo
d Dupleto
dd Duplo dupleto
dt Duplo tripleto
m Multipleto
m/z Relação massa-carga
p para
t Tripleto
q Quarteto
quin Quinteto
sext Sexteto
LISTA DE SUBSTÂNCIAS IDENTIFICADAS
Saccharicola sp.
O O H OH OH OH O O H OH OH H O H O OH OH H O O OH OH OH OH O H O OH O H O O O O H
4 5 6
7 8 9
SUMÁRIO
1 INTRODUÇÃO ... 31 1.1 Produtos naturais ... 31 1.2 Fungos ... 33 1.3 Fungos endofíticos ... 34 1.3.1 Interação com o hospedeiro ... 35 1.3.2 Produtos naturais obtidos de fungos endofíticos ... 36 1.4 Espécie hospedeira - Eugenia jambolana ... 40
1.5 Botryosphaeria parva ... 45 1.6 Saccharicola sp. ... 47 1.7 Líquen ... 47
1.8 Parmotrema tinctorum ... 48 1.9 Fungos endofíticos de liquens ... 50 1.10 Lecythosphora sp. ... 51 1.11 Epigenética e moduladores epigenômicos ... 52 2 Objetivos ... 60 2.1 Objetivos Gerais ... 60 2.2 Objetivos Específicos ... 60 BIOPROSPECÇÃO DOS FUNGOS ENDOFITICOS ASSOCIADOS A EUGENIA JAMBOLANA
3.3 Isolamento das cepas fúngicas ... 64 3.4 Cultivo dos fungos endofíticos em pequena escala para obtenção dos
extratos brutos ... 66 3.5 Cultivo em escala ampliada do fungo Saccharicola sp. e obtenção do extrato bruto... ... 67 3.6 Fracionamento do extrato bruto obtido do fungo Saccharicola sp. ... 68 3.7 Isolamento dos metabólitos secundários produzidos pelo fungo Saccharicola
sp... ... ..69 3.8 Cultivo em escala ampliada do fungo Botryosphaeria parva e obtenção do extrato bruto ... 70 3.9 Isolamento dos metabólitos secundários produzidos pelo fungo
Botryosphaeria parva ... 72 3.10 Avaliação biológica ... 73 3.10.1 Ensaio citotóxico* (MTT) ... 73 3.10.2 Ensaio anticolinesterásico**... 74 3.10.3 Ensaio antifúngico** ... 74 3.10.4 Ensaio antioxidante ... 75 4 Resultados e Discussão ... 76 4.1 Isolamento, purificação e cultivo dos endófitos ... 76 4.2 Classificação das linhagens fúngicas ... 77 4.3 Triagem química dos extratos brutos dos endófitos ... 78 4.3.1 Obtenção do extrato bruto ... 78 4.4 Análise química ... 79 4.4.1 Cromatografia em camada delgada comparativa (CCDC) ... 79 4.4.2 Cromatografia líquida de alta eficiência com detector de arranjo de diodos (CLAE): ... 79 4.4.3 Ressonância magnética nuclear de 1H: ... 85 4.5 Triagem Biológica ... 98 4.5.1 Ensaio citotóxico ... 98 4.5.2 Ensaio anticolinesterásico ... 99 4.5.3 Ensaio antifúngico ... 101 4.5.4 Ensaio antioxidante ... 102 4.6 Identificação estrutural das substâncias produzidas pelo endófito
4.6.2 Determinação estrutural da substância 5 ... 111 4.6.3 Determinação estrutura da substância 6 ... 114 4.6.4 Determinação estrutural da substância 7 ... 116 4.6.5 Determinação estrutural da substância 8 ... 118 4.6.6 Determinação estrutural da substância 9 ... 121 4.6.7 Determinação estrutural da substância 10 ... 123 4.7 Identificação estrutural das substâncias produzidas pelo endófito
Botryosphaeria parva ... 128 4.7.1 Determinação estrutural da substância 11 ... 129 4.7.2 Determinação estrutural da substância 12 e 13 ... 131 4.7.3 Determinação estrutural da substância 3 ... 133 4.7.4 Biossíntese das isocumarinas ... 134 4.8 Resultados dos ensaio biológicos realizados com as substâncias
isoladas... ... 136 5 Conclusão ... 138 AVALIAÇÃO DA PRODUÇÃO METABOLICA DO FUNGO LECYTHOPHORA SP. UTILIZANDO MODIFICADOR EPIGENETICO
6 Parte experimental ... 140 6.1 Materiais, equipamentos e técnicas utilizadas ... 140 6.1.1 Solventes ... 140 6.1.2 Cromatografia em Camada Delgada Comparativa (CCDC) ... 140 6.1.3 Cromatografia em Coluna (CC) ... 140 6.1.4 Cromatografia Líquida de Alta Eficiência (CLAE) ... 140 6.1.5 Ressonância Magnética Nuclear de 1H e 13C (RMN de 1H e 13C)... 141 6.1.6 Espectrometria de massas ... 141 6.1.7 Espectroscopia vibracional na região do infravermelho (IV) ... 141 6.1.8 Cultivo dos fungos endofíticos ... 141 6.1.9 Outros Equipamentos ... 141 6.2 Cepa fúngica ... 142 6.3 Cultivo dos fungos endofíticos em pequena escala para obtenção dos
extratos brutos ... 142 6.4 Cultivo dos fungos endofíticos em pequena escala para obtenção dos
1 INTRODUÇÃO
1.1 Produtos naturais
Os produtos naturais são em geral, de origem pré-biótica ou originam-se de micro-organismos, plantas ou animais e incluem classes de compostos tais como terpenos, policetídeos, aminoácidos, peptídeos, proteínas, carboidratos, lipídios, ácidos nucleicos, ácido ribonucleico (RNA), ácido desoxirribonucleico (DNA), e assim por diante. Produtos naturais não são apenas acidentes ou produtos de conveniência de natureza, mais do que provável, uma expressão natural do aumento da complexidade dos organismos (SPAINHOUR, 2005).
Os produtos naturais são utilizados pela humanidade há milhares de anos, e estão associados à medicina por igual período, pela utilização de medicamentos populares e venenos naturais (BUTLER, 2004; STROBEL; DAISY, 2003). A organização mundial da saúde estima que aproximadamente 80% da população terrestre recorrem à medicina popular como fonte dos primeiros tratamentos farmacológicos (SPAINHOUR, 2005).
Estudos químicos, farmacológicos e clínicos dos medicamentos populares, derivados principalmente de plantas, foram à base de uma grande parte de medicamentos, tais como, a Aspirina (ácido acetil salicílico) derivada da salicina, encontrada em diversas plantas do gênero Salix, a quinina, um antimalárico encontrado nas espécies de Cinchona, a morfina, proveniente do opium (Papaver somniferum) nomeada em homenagem ao Deus Grego Morfeu, Deus do sono e dos sonhos, e os medicamentos digitoxina e pilocarpina (BUTLER, 2004; STROBEL; DAISY, 2003; STROBEL et al., 2004).
A descoberta dos antibióticos sulfonamidas e β-lactâmicos na década de 1930 levou a um profundo impacto na saúde humana, por tornar possível o tratamento rápido de pacientes com infecções bacterianas, que previamente eram consideradas fatais (BUTLER; COOPER, 2011).
entidades químicas introduzidas no mercado entre 1981 a 2002, cerca da metade (48%) eram produtos naturais, análogos naturais semi-sintéticos ou compostos sintéticos baseados em produtos naturais. Apesar deste sucesso, a procura farmacêutica nos produtos naturais tem evidenciado um lento declínio nos últimos anos (KOEHN; CARTER, 2005).
Apesar da concorrência com outros métodos de descoberta de novos medicamentos, os produtos naturais ainda desempenham um papel significativo na descoberta de novas drogas e no desenvolvimento desta área. Isto foi demonstrado por Newman e Cragg(2012) que analisaram os agentes terapêuticos aprovados no mundo, nos últimos 30 anos (1981 a 2010). Das novas entidades químicas aprovadas, 29% foram obtidas de origem natural. Dos medicamentos anticancerígenos, 48,6% são obtidos de produtos naturais ou derivados diretamente destes, e dos medicamentos aprovados para tratamento de infecções contra bactérias, fungos, parasitas e vírus, 33,7% são obtidos a partir de fontes naturais. Esta constatação mostra como os produtos naturais são uma fonte expressiva para a obtenção de medicamentos, e que estes foram e ainda são valorizados como fonte de protótipos para a descoberta de novos fármacos (NEWMAN; CRAGG, 2012; NEWMAN; CRAGG,2007; GUO et al., 2008; CARTER, 2011).
Os produtos naturais são produzidos em um específico estágio de desenvolvimento da planta, condições específicas do ambiente, estresse ou disponibilidade de nutrientes, dificultando a extração de uma quantidade suficiente dos produtos de interesse. Indiscriminado desmatamento de plantas medicinais para extração dos mesmos, tem ameaçado de extinção algumas espécies, tornando-as vulneráveis ou em perigo de extinção (CHANDRA, 2012).
são considerados uma fonte importante de metabólitos bioativos com atividades antibacteriana, antimicótica e antiviral (CHANDRA, 2012).
1.2 Fungos
Estima-se que o Reino Fungi apresente, aproximadamente, 1,5 milhões de espécies com representantes habitando praticamente todos os ecossistemas existentes no planeta (HAWKSWORTH, 2001). Os fungos constituem um grupo de micro-organismos eucarióticos, uni ou multicelulares, em geral, com parede celular e cujas estruturas reprodutivas apresentam uma variedade de formas. São organismos que não possuem pigmentos fotossintetizantes, sendo heterotróficos com nutrição por absorção. Os fungos podem ser filamentosos, constituídos por filamentos longos e ramificados denominados hifas; leveduriformes, constituídos por células individuais que se reproduzem por brotamento ou fissão binária; ou dimórficos, podendo ser filamentoso ou leveduriforme dependendo das condições ambientais, principalmente a temperatura (ARAUJO et al., 2010; ESPOSITO; AZEVEDO, 2010).
Os fungos em geral são benéficos, sendo importantes na cadeia alimentar por decomporem matéria vegetal morta, reciclando elementos vitais, pelo uso de enzimas extracelulares como a celulase. A maioria das plantas depende das simbioses com fungos, conhecidas como micorrizas, que auxiliam as raízes das plantas a absorverem minerais e água do solo. Os fungos são utilizados pelo homem como alimentos e também para a produção de drogas. Das mais de 100 mil espécies conhecidas de fungos, apenas cerca de 200 são patogênicas ao homem e aos animais (TORTORA; FUNKE; CASE, 2012).
A descoberta acidental da penicilina, por Fleming em 1928, isolada do fungo
classes de substâncias que podem ser utilizadas na indústria farmacêutica (humana e animal), alimentícia e agrícola (GREVE et al., 2010; GUO et al., 2008).
Dentro das classes de organismos investigados como fonte de produtos naturais, existem os fungos que vivem em associação com espécies vegetais. Estes são classificados como epifíticos, que são os fungos que vivem na superfície do material vegetal, os fitopatógenos, que causam doenças, os da micorriza que vivem nas raízes e os endofíticos que vivem dentro dos tecidos vegetais. Neste trabalho foram selecionados, como objeto de estudo, os fungos endofíticos de planta e líquen, pois esses micro-organismos vêm desempenhando um importante papel na descoberta de novos e bioativos produtos naturais.
1.3 Fungos endofíticos
O termo endófitos, originalmente descrito por De Bary em 1866, refere-se a qualquer micro-organismo que vive nos tecidos das plantas, distinguindo-se dos epifíticos que vivem na superficie. São encontradas diferentes definições de endófitos na literatura (ESPOSITO; AZEVEDO, 2010), mas a definida por Bacon e Write, amplamente aceita e utilizada, é que endófitos são micro-organismos que colonizam os tecidos internos das plantas sem causar efeitos negativos imediatos (KHARWAR et al., 2011).
Os fungos endofíticos são um grupo diversificado de ascomicetos definidos por sua ocorrência assintomática dentro dos tecidos vegetais. Ocorrem em todo o território terrestre, nas comunidades naturais e antrópicas, colonizando plantas no Ártico, Antártica, solos geotérmicos, desertos, oceanos, florestas tropicais, mangues e florestas costeiras (JALGAONWALA et al., 2011; ARNOLD, 2007). Em quase todas as plantas vasculares, algas marinhas, musgos e samambaias, estudadas até o momento, foram encontradas bactérias e fungos endofíticos. Normalmente, centenas de espécies de endófitos podem ser isolados de uma única espécie vegetal, sendo que pelo menos um é específico ao hospedeiro (TAN; ZOU, 2001).
micro-organismos endofíticos de plantas de diferentes ecossistemas (KUSARI; SPITELLER, 2011; ESPOSITO; AZEVEDO, 2010).
A espécie hospedeira pode ser infectada pelos endófitos horizontalmente por lesões naturais, como estômatos ou crescimento das raízes, e artificiais, como injúrias causadas por práticas agrícolas. A infecção também pode ocorrer verticalmente pelas sementes do hospedeiro, neste caso, o endófito pode se instalar em uma planta por toda sua vida. O modo com que o fungo infecta uma espécie vegetal pode alterar o tipo de interação endófito-hospedeiro. Na transmissão vertical é predominante a interação mutualística, enquanto que na transmissão horizontal (não-sistêmica) essa interação tende a ser antagônica. Uma vez no hospedeiro o endófito permanece, geralmente, em um estado latente por toda sua vida ou por um período prolongado, até que as condições ambientais lhe sejam favoráveis. Neste caso, o endófito pode assumir uma função patogênica (MELO; AZEVEDO, 1998; ALY; DEBBAB; PROKSCH, 2011).
Comunidades endofíticas variam com a espécie hospedeira, tipo de órgão e ontogenia. As folhas são os órgãos mais ricos em endófitos e os níveis aumentam durante o desenvolvimento das folhas, provavelmente devido a mudanças nas propriedades estruturais e químicas, que mudam durante o ciclo de vida das folhas (SANCHEZ-AZEFEIFA et al., 2012).
1.3.1 Interação com o hospedeiro
Apesar de espécies dos gêneros Phomopsis, Phoma, Colletotrichum e
ventos fortes, salinidade, etc.) (CHANDRA, 2012; ARNOLD, 2007; ALY; DEBBAB; PROKSCH, 2011; GUNATILAKA, 2006).
A presença dos endófitos pode alterar o metabolismo de muitas plantas. Alguns endófitos produzem enzimas, como as celulases e ligninases que auxiliam na degradação das folhas, hormônios de plantas, metabólitos secundários, ou até mesmo melhorar a fotossíntese (SANCHEZ- AZEFEIFA et al., 2012).
1.3.2 Produtos naturais obtidos de fungos endofíticos
Os micro-organismos endófitos associados a plantas representam uma fonte inexplorada de produtos naturais novos e bioativos, com mais de 20000 substâncias descritas, sendo que destas 51% apresentam estruturas inéditas e 80% atividade biológica. Isto pode ser explicado pela teoria ecológica, que estabelece que esta produção metabólica depende do nicho ecológico no qual o micro-organismo está inserido e das consequentes interações bióticas e abióticas. Estes relatos sugerem que a seleção do endófito para estudo deve ser realizada com espécies vegetais de diferentes biotas, principalmente as que enfrentam frequentes e intensas interações no ambiente como plantas de regiões áridas, florestas tropicais, entre outras (CHAPLA; BIASETTO; ARAUJO, 2013).
Apesar de poucos estudos químicos dos fungos endofíticos, foi isolado um número considerável de substâncias com atividade biológica, como por exemplo, com atividade antimicrobiana (I-VII) (ALY; DEBBAB; PROKSCH, 2011; WANG et al., 2012), antiparasitária (VIII-XI) (ALY; DEBBAB; PROKSCH, 2011; ONDEYKA et al., 1997), neuroprotetiva (XII) (ALY et al., 2010), antioxidante (XIII-XIV) (JALGAONWALA et al., 2011), antidiabética (XV) (ZHANG et al., 1999), propriedades imunossupressoras (XVI) (STROBEL; DAISY, 2003),antiviral (XVII-XVIII) (STROBEL; DAISY, 2003; GUO et al., 2000), anticolinesterásica (XIX) (ALY; DEBBAB; PROKSCH, 2011), antineoplásicos (XX- XXVII) (ZHANG; SONG; TAN, 2006; SHWETA et al., 2010)e citotóxica (XXVIII) (ALY; DEBBAB; PROKSCH, 2011; ALY et al., 2010) (Figura 1).
é a produção do Taxol, um importante fármaco anticancerígeno, pelo fungo endofítico
Taxomyces andreanae, isolado da planta Taxus brevifolia, que também produz esta substância. Outro importante anticancerígeno é a vincristina isolada da planta
Catharanthus roseus, e isolada do fungo endofítico Fusarium oxysporum, obtido da mesma planta (ARNOLD, 2007). Podofilotoxina, também utilizada no tratamento de câncer, é encontrada em espécies vegetais do gênero Podophylum e também relatada nos endófitos Trametes hirsuta e Phialocephala fortinii (JALGAONWALA et al., 2011). Existem outros exemplos de compostos de origem vegetal que são produzidos por fungos que habitam os mesmos (JALGAONWALA et al. 2011; ALY; DEBBAB; PROKSCH, 2011), sugerindo haver uma transposição de genes entre as plantas e os fungos em uma verdadeira engenharia genética in vivo (ZHANG; SONG; TAN, 2006)
Figura 1: Substâncias bioativas isoladas de fungos endofíticos O O R O OH OH O HO OH O O O OH O OH OH H2N O O HO O O OH O O O O OH H O OH HO HO HO O O OCOCH3 O O OH OH O O O O O O O OH O OH R O H HN O N NH O O OH O OH HO O OHHO OH O R=OH; pestaloteol A (I)
R=H; pestaloteol B (II) pestaloteol C (III) pesteloteaol D (IV)
cercosporamida (V)
enfumagina (VI) tricodemina (VII)
palmarumicina CP17 (VIII) palmarumicina CP18 (IX)
R=OH; ácido nodulispórico A (X)
R=NH2; terc-butil nodulisporamida (XI)
crisogenamida A (XII) isopestacina (XIII) pestacina (XIV)
NH O
O HN
L 783.281 (XV)
O H H H O OH O O H
subglutinol A (XVI) O
H
HO
Fungos endofíticos são relativamente inexplorados e incompreendidos em comparação com os fungos isolados do solo e os fitopatogênicos. Apesar disso, os fungos endofíticos tem um papel ecológico, devido às diversas interações dos fungos com o hospedeiro. Alguns autores (TAN; ZOU, 2001; SCHULZ et al., 2002; TEJESVI et al., 2007) têm revisado a diversidade dos metabólicos secundários produzidos por fungos endofíticos enfatizando esse potencial ecológico. Eles têm evidenciado a produção de metabólitos secundários por diversas vias metabólicas, como policetídea,
OH HO O O OH O O OH O OH OH HO O O OH O O OH O OH N N N N O OH O O H N O
N HO O
O
OH O
AcO O OH
O OAc H O Ph O O HN Ph OH Ph O O OCH3 OCH3 CH3O
O OH O O N N OAc HO
O OCH3 O
CH3O N H
N OH
CH3O O
ácido citônico A (XVII) ácido citônico B (XVIII) 16--hidroxi-5-N-acetilardimina (XIX)
camptotecina (XXVIII) taxol (XXIX)
podofilotoxina (XXXI)
vincristina (XXX)
N O
N HO O
O
HO
10-hidroxicamptotecina (XX)
O O O R1 R2 O O OH O R1 R2 R3 OH R4 OH R5
(XXI) R1=R2=H
(XXII) R1=H, R2=OH (XXIII) R1=OH, R2=H antraquinonas XXI-XXIII
(XXIV) R1=R2=R3=R4=R5=H
(XXV) R1=OH, R2=R3=R4=R5=H
(XXVI) R1=R2=R3=R4=H, R5=OH
(XXVII) R1=H, R2=R3=R4=R5=OH antraquinonas XXIV-XXVII
H
isopreno, derivados de amino ácidos etc., e uma grande diversidade de classes estruturais, como xantonas, esteroides, isocumarinas, fenóis, terpenos, citocalasinas, etc. (CHANDRA, 2012).
1.4 Espécie hospedeira - Eugenia jambolana
Eugenia jambolana (syn Syzygium cumini, Figura 2) pertence à família Myrtaceae, é encontrada em todo o subcontinente Asiático, na África Oriental, América do Sul, Madagascar, e também nas regiões mais quentes dos Estados Unidos da América (Flórida e Havaí). É famosa devido aos seus frutos, que são considerados uma iguaria. A árvore pode chegar até 15 metros de altura e possui grande copa, as folhas são elípticas, longas, lisa de natureza fibrosa, as flores aparecem uma vez ao ano, e estas são pequenas (7-12 mm) de coloração branca e com finas pétalas membranosas. Os frutos são encontrados em grupos de 4-20 e não amadurecem simultaneamente, estes são redondos ou elipsóides, e possuem uma semente no centro. Os frutos são inicialmente de coloração verde, à medida que amadurecem tornam-se vermelhos e quando maduros possuem coloração roxa escura ou preta, o fruto possui uma combinação de sabor doce, levemente amargo e adstringente (BALIGA et al., 2011; LI et al., 2009).
No Brasil é conhecida principalmente como jambolão, mas também é popularmente chamada de jamelão, cereja, jalão, kambol, jambú, azeitona-do-nordeste, ameixa roxa, murta, baga de freira, guapê, jambuí, azeitona-da-terra, entre outros nomes. Tem sido usada na medicina tradicional brasileira e em outros países tropicais principalmente devido as suas propriedades hipoglicêmica e antidiabética (VIZZOTO; FETER, 2009; VASI; AUSTIN, 2009).
Figura 2: Eugenia jambolana
Das folhas são conhecidos diferentes flavonoides, terpenoides como também o β-sitosterol, ácido betulínico, ácido crategolico, n-heptacosane, n-nonacosane, n -hentriacontane, noctacosanol, n-triacontanol, quercetina, miricetina, miricitrina e o flavonoide glicosilado miricetina 3-O-(4″-acetil)-α-L-ramnopiranosídeo (LOGUERCIO et al., 2005; SANTOS et al., 2012; BALIGA et al., 2011).
O óleo essencial das folhas é conhecido por conter as substâncias pinocarveol,
α-terpineol, mirtenol, eucarvone, muurolol, α-mirtenal, cineole, geranil acetona, α -cadinol e pinocarvone (BALIGA et al., 2011).
No caule é reportado a presença de friedelina, friedelina-3-α-ol, ácido betulínico, β-sistosterol, β-sistosterol-D-glicosideo, kaempferol, kaempferol-3-glicosídeo, ácido gálico, ácido elagico, galotanina, elagitanina, quercetina e miricetina (BALIGA et al., 2011; SRIVASTAVA; CHANDRA, 2013).
culinária em tortas, sucos, drinques e vinhos (SANTOS et al., 2012; BALIGA et al., 2011).
Figura 4: Antocianinas presentes em Eugenia jambolana
Os estudos realizados até o momento com o jambolão indicam que este apresenta diversos benefícios à saúde e é descrito como importante produto alimentício. Estudos têm demonstrado inúmeras atividades biológicas dos extratos de jambolão, justificando seu uso na medicina tradicional. No entanto, o efeito mais estudado são os efeitos antidiabéticos das sementes de jambolão, em diferentes modelos experimentais e em pacientes. Os benefícios observados a saúde foi atribuído à presença de várias substâncias como os polifenóis, terpenos, antocianinas e flavonoides (BALIGA et al., 2011).
foram selecionados para o estudo mais aprofundado, o fungo endofítico isolado das folhas classificado como Botryosphaeria parva, e o fungo endofítico isolado dos caules classificado como Saccharicola sp.
1.5 Botryosphaeria parva
Membros da família Botryosphaeriaceae foram descritos pela primeira vez na década de 1820 como espécies de Shaeria, conhecidos como patógenos de plantas. Apenas em meados de 1980, fungos dessa família foram descritos como endófitos. Desde então, foram isoladas diversas espécies como fungos endofíticos. Com base na alta distribuição taxonômica e na alta frequência de infecções dos fungos endofíticos dessa família em diferentes hospedeiros, sugere-se que a maioria, ou todos os fungos da família Botryosphaeriaceae, pode ter uma fase endófita (SLIPPERS; WINGFIELD, 2007).
A família Botryosphaeriaceae representa um diverso e proeminente componente de muitas comunidades endofíticas. No entanto, o reconhecimento de sua importância econômica, a sua presença e o papel ecológico em comunidades vegetais são pouca estudadas. Fatores que influenciam a patogenicidade não são claros e, consequentemente, sua importância como fungos endofíticos não é bem definida (SLIPPERS; WINGFIELD, 2007).
A maioria dos gêneros na família Botryosphaeriaceae, é descrita como endófitos, como os gêneros Guignardia, Botryosphaeria (anamorfo Fusicoccum),
Dothidotthia (anamorfo Dothiorella), Neofusicoccum, Pseudofusicoccum,
Lasiodiplodia e Diplodia. Alguns destes endófitos são muito comuns, dominando comunidades endofiticas em Eucaliptus e Pinus em diferentes ambientes (SLIPPERS; WINGFIELD, 2007).
O gênero Botryosphaeria foi descrito apenas em 1863. Esses ascomicetos foram observados como saprófitas sobre o tecido morto de plantas lenhosas, posteriormente esse gênero na sua forma anamorfa foi descrito como patógeno, principalmente em viveiros, plantios agrícolas e florestas.
podendo se tornar um fungo saprófita ou patogênico. Sintomas típicos de doença desses patógenos incluem cancros, necrose da madeira, podridão, entre outros. (GURE; SLIPPERS; STENLID, 2005; NIEKERK et al., 2006). Botryosphaeria tem ganhado destaque como um agente patogênico de diversas espécies de uvas, devido ao fato dos fungos deste gênero serem encontrados em plantas que apresentavam diversos sintomas de doenças.
O fungo Botryosphaeria parva foi isolado de Vitis vinifera (uva utilizada na produção de vinho) e de outras difierentes especies de uvas como em fungo fitopatogênico, causador de apodrecimento do tronco, morte dos brotos e necrose (NIERKEK et al., 2004; PHILLIPS, 2002).
Em uma busca realizada na literatura (Scifinder e Web of Science) não foram encontrados trabalhos referentes ao estudo químico do fungo Botryosphaeria parva;
mas em relação ao gênero, podemos destacar a produção de policetídeos (XXIX-XXXVI) pelo fungo endofítico Botryosphaeria australis (XU et al., 2011), e uma variedade de isocumarinas, fenólicos e lactona (XXXVII-XLIII) produzidos pelos fungos endofíticos Botryosphaeria rhodina (RUKACHAISIRIKUL et al., 2009) e
Figura 5: Substâncias produzidas por fungos endofíticos do gênero Botryosphaeria
1.6 Saccharicola sp.
Saccharicola é um gênero de fungo pertencente à família Massarinaceae. Esse gênero surgiu para re-classificar duas espécies fitopatogênicas encontradas em cana-de-açúcar, Leptosphaeria bicolor e Leptosphaeria taiwanensis, como Saccharicola bicolor e Saccharicola taiwanensis, respectivamente (ERIKSSON; HAWKSWORTH, 2003). Não há relatos na literatura sobre o estudo químico dos fungos deste gênero.
1.7 Líquen
e são depositados nas hifas externas. Os metabólitos de liquens ocorrem em ampla gama de cores, como amarelo, laranja, vermelho e marrom. Os liquens possuem um importante papel na ciclagem mineral por capturar os nutrientes que serão liberados no ambiente por precipitação e também pela morte e decomposição do talo (PODTEROB, 2008; BOUSTIE; TOMASI; GRUBE, 2011).
Os metabólitos de liquens possuem diferentes funções na natureza, pois filtram a luz para proteger os liquens da radiação, podem impedir o ataque de herbívoros e outros possuem propriedades antibióticas para a proteção contra a degradação microbiana. Podem ainda estar envolvidos no equilíbrio simbiótico ou na degradação das rochas para melhorar a fixação dos liquens ao substrato (MUGGIA; SCHMITT; GRUBE, 2009).
As substâncias isoladas dos liquens apresentam um gama de atividades biológicas incluindo antimicrobiana, anti-inflamatória, antioxidante, antiproliferativa e citotóxica. Um aumento crescente nas propriedades farmacêuticas dos metabólitos de liquens vem sendo observado. No entanto, relativamente poucos liquens foram estudados quimica e biologicamente, devido principalmente as dificuldades na obtenção de quantidades e pureza suficiente para a elucidação estrutural e testes farmacológicos. Consequentemente, muito poucos medicamentos comercializados são provenientes de líquen. Exemplos de medicamentos comercias de sucesso são os antibióticos da classe das riminofenazina, como clofazimina (Lampren®), que foi desenvolvida como um fármaco antimicobacteriano (BOUSTIE; TOMASI; GRUBE, 2011).
1.8 Parmotrema tinctorum
aproximadamente um terço é citado para o Brasil (BLANCO et al., 2005; MARCELLI; BENATTI, 2010).
Muitos liquens são sensíveis a poluição do ar e são utilizados para avaliar o ambiente, como é o caso de Parmotrema tinctorum (Figura 6). Este líquen é sensível ao dióxido de enxofre (SO2) e tem sido usado como um bioindicador da qualidade do ar tanto no Japão quanto no Brasil (OHMURA et al., 2009; KAFFER et al., 2012).
Figura 6: Foto do líquen Parmotrema tinctorum
Fonte: http://parmotrema.lifedesks.org/node/4
Estudos químicos de Parmotrema tinctorum revelaram que o extrato acetônico contem grande quantidade de compostos fenólicos. Este extrato apresentou alta atividade antioxidante (STANLY et al., 2011). Estudos químicos relatam do P. tinctorum o ácido salazinico (EIFLER-LIMA et al., 2000), atranorina e o ácido lecanorico. Atranorina apresentou baixa atividade contra Micobacterium tuberculosis
Figura 7: Substâncias isoladas do líquen Parmotrema tinctorum O O O O H OHC OH OH O O O H ácido salizínico O OH CHO O H OH COOCH3 O atranorina O OH O H OH COOH O ácido lecanórico O OH O H OH O O OH O H OH O O O OH OH O O H OH O H OCH3 O lecanorina
haematomato de metila
ácido girofórico
1.9 Fungos endofíticos de liquens
Cerca de 8% do território terrestre é dominado por liquens (LOGESH et al., 2012). Trabalhos mostram que os liquens podem abrigar numerosos fungos, que são chamados de endófitos de líquen ou “endolichenic fungi”. Estes vivem assintomaticamente no talo do líquen assim como endófitos vivem no interior de plantas (PARANAGAMA; WIJERATNE; GUNATILAKA, 2007; KANNANGARA; RAJAPAKSHA; PARANAGAMA, 2009; U’REN et al., 2010). A comunidade dos fungos endofíticos de liquens é tão diversa quanto a comunidade endófita de fungos provenientes de plantas (PARANAGAMA; WIJERATNE; GUNATILAKA, 2007).
evidencia, sendo observado um aumento no número de publicações nos últimos anos (Figura 8), na maioria dos casos sendo descritas substâncias inéditas com potencial biológico (WANG et al., 2013a; 2013b; CHEN et al., 2013; HE et al., 2012; LI et al., 2012; ZHANG et al., 2009; 2012; WANG et al., 2012; LOGESH et al., 2012). Estas observações demonstram a importância do estudo desta classe de micro-organismos para obtenção de novas entidades químicas, que possam ser utilizadas na agricultura e terapêutica.
Figura 8: Itens publicados por ano contendo “endolichenic”
Fonte: Web of Science (5/12/2013)
1.10 Lecythosphora sp.
O gênero de fungo Lecythophora é caracterizado por colônias úmidas com abundante adelofialides (fiálides reduzidos), contudo essas células conidiogênicas mostram colaretes visíveis, e as colônias geralmente são rosa-salmão ao marrom escuro, embora fiálides discretas, como as de Acremonium podem estar presentes. Embora esses fungos sejam sapróbios, algumas espécies são consideradas patógenos humanos. Lecythophora hoffmannii tem sido associado a casos de infecções subcutâneas, ceratite, sinusite, peritonite e osteomielite canino.
Lecythophora mutabilis tem sido descrito como sendo o agente causador da peritonite humana, endocardite, endoftalmite, e ceratite, entre outros (PERDOMO et al., 2011).