UNIVERSIDADE FEDERAL DO CEARÁ
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
PÓS-GRADUAÇÃO EM QUÍMICA INORGÂNICA
Estudos eletroquímico e de teoria do funcional da
densidade(DFT) de nitrosilocomplexos de rutênio
Sérgio Xavier Barbosa Araújo
Orientador: Luiz Gonzaga de França Lopes
Dissertação submetida à
Coordenação do Curso de
Pós-Graduação em Química
Inorgânica como requisito
parcial para a obtenção do grau
de mestre.
Ficha catalográfica elaborada pela Bibliotecária Ana Cristina Azevedo U. Melo CRB-3/572
A691e Araújo, Sérgio Barbosa
Estudos eletroquímico e de teoria do funcional da densidade (DFT) de nitrosilo complexos de rutênio / Sérgio Xavier Barbosa Araújo.
88f., il. color. enc.
Dissertação (Mestrado) - Universidade Federal do Ceará, Fortaleza, 2007. Área de Concentração : Química Inorgânica
Orientador: Prof. Dr. Luiz Gonzaga de França Lopes
1.Compostos de coordenação 2. Cronoamperometria 3. Química teórica I.Lopes, Luiz Gonzaga de França (orient.) II.Universidade Federal do Ceará – Pós-Graduação em Química Inorgânica III. Título
Agradecimentos
Ao professor Luiz Gonzaga de França Lopes pela orientação desde a iniciação científica até agora.
A todos os professores que de algum modo contribuíram para minha formação. Ao Ordelei por tudo que aprendi no laboratório desde o início.
A Régia, Elisane e Pedro pela companhia, amizade, paciência, etc, não necessariamente nesta ordem.
(Ok, agora sem citar nomes porque se o fizer vou esquecer alguém)
A todos que fizeram ou fazem parte do grupo de bioinorgânica, pela amizade, convivência diária e conversas, sérias ou não.
Resumo
Neste trabalho foi realizado o estudo de liberação de NO por meio de processos eletroquímicos e cálculos de DFT de nitrosilocomplexos de rutênio do tipo cis,trans-[Ru(bpy)2LNO]3+, onde L= isonicotinamida, imidazol e sulfito, e do tipo trans-[Ru(NH3)4LNO]3+, onde L= imidazol, cafeína e teofileno coordenados via carbono, com o objetivo de relacionar propriedades experimentais a resultados de cálculos teóricos para identificar tendências e contribuir para a modulação de novos compostos.
O estudo eletroquímico das espécies mostrou que os compostos podem liberar o NO após redução do NO no complexo e que a constante de liberação é dependente do ligante L coordenado ao centro metálico. As constantes foram calculadas pela cronoamperometria de dupla varredura e variaram de 0,183 s-1 para o complexo cis-[Ru(bpy)2ImNNO]3+ a 3 s-1 para o complexo trans -[Ru(NH3)4(teofileno)NO]3+.
O estudo por DFT foi realizado com dois funcionais, LDA – PWC e GGA – BLYP, de modo a verificar a relação entre as condições de cálculo e proximidade dos dados obtidos com os resultados experimentais.
O funcional LDA – PWC mostrou menores comprimentos de ligação e maiores valores de carga no grupo NO e na banda de estiramento NO no espectro calculado de infravermelho que o funcional GGA- BLYP.
Abstract
In this work was performed the study of electrochemical NO release and DFT calculations of nitrosylcomplexes of ruthenium like
cis,trans-[Ru(bpy)2LNO]3+, where L= isonicotinamide, imidazole e sulfite, and trans -[Ru(NH3)4LNO]3+, where L= caffeine e theophylline bound by the carbon atom, with the purpose of identify trends and contribute to modulation of new compounds.
The electrochemical study of the species has shown that the compounds can release NO after reduction and the rate constant is dependent of the L ligand coordinated to the metallic center. The rates were calculated by double step chronoamperometry and range from 0,183 s-1 for cis-[Ru(bpy)2ImNNO]3+ to 3 s-1 for trans-[Ru(NH3)4(theophylline)NO]3+.
The DFT study was performed with two functionals, LDA – PWC and GGA – BLYP, to verify the relationship between the theorical calculation conditions and the proximity to the experimental data.
The LDA – PWC functional has shown shorter bond lengths and larger charges in NO group and larges NO stretching frequency in FT-IR calculated spectra as well, than the GGA – BLYP functional.
Sumário
Introdução
01
O óxido nítrico
01
Funções biológicas do óxido nítrico
03
O óxido nítrico e o sistema circulatório
04
O óxido nítrico e o sistema nervoso central
05
O óxido nítrico e o sistema imunológico
05
Doadores de óxido nítrico
05
Complexos metálicos como possíveis doadores de óxido nítrico
07
Justificativa e objetivos
08
Metodologia
09
Reagentes
09
Síntese dos complexos
09
Equipamentos e técnicas experimentais
12
Voltametria Cíclica e Voltametria de Onda Quadrada
12
Medidas de cronoamperometria
13
Cálculos teóricos
13
Espectroscopia Vibracional
Resultados e Discussão
15
1.0 - Estudo eletroquímico dos complexos.
15
1.1 – Complexos cis-[Ru(bpy)2LNO] e trans-[Ru(bpy)2SO3NO],
onde L= ImN, isn e SO32- 16
1.2 Complexos trans-[Ru(NH3)4LNO]Cl3 , onde L = cafeína ou
teofileno 26
2.0 – Correlação dos cálculos de DFT e resultados
experimentais 30
2.1 – Complexos [Ru(bpy)2LNO]3+ e funcional LDA - PWC 30 2.2 – Complexos [Ru(bpy)2LNO]3+ e funcional GGA – BLYP 42 2.3 – Complexos [Ru(NH3)4LNO]3+, onde L=imdidazol, cafeína e
teofileno coordenados via carbono 52
Considerações Finais
65
Índice de Figuras
Figura 1 – Diagrama simplificado de orbitais Moleculares para o radical
NO. 01
Figura 2 – Geometrias de coordenação do NO a um centro metálico. 02
Figura 3 - Biossíntese do NO. 04
Figura 4 – Liberação de NO no nitroprussiato de sódio. 06 Figura 5 – Voltamograma cíclico do íon complexo cis
-[Ru(bpy)2IsnNO]3+ em solução aquosa de NaCF3COO 1 Mol L-1 pH=1. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 17 Figura 6 – Voltamograma cíclico do íon complexo cis
-[Ru(bpy)2ImNNO]3+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 17 Figura 7 – Voltamograma cíclico do íon complexo cis
-[Ru(bpy)2SO3NO]+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência 18 Figura 8 – Voltamograma cíclico do íon complexo trans
-[Ru(bpy)2SO3NO]+ em solução aquosa de NaCF3COO 1 Mol L-1, pH3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência 18 Figura 9 – Voltamograma de onda quadrada do íon complexo cis
-[Ru(bpy)2isnNO]3+ em solução aquosa de NaCF3COO 1 Mol L-1. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 20 Figura 10 – Voltamograma de onda quadrada do íon complexo cis
Figura 11 – Voltamograma de onda quadrada do íon complexo cis -[Ru(bpy)2SO3NO]+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 21 Figura 12 – Voltamograma de onda quadrada do íon complexo trans
-[Ru(bpy)2SO3NO]+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 21 Figura 13 – Cronoamperograma do íon complexo cis
-[Ru(bpy)2SO3NO]+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. Tempo de troca 1250ms, potencial de redução -290mV, potencial de
oxidação 10mV. 23
Figura 14 – Correlação entre a constante k-NO e o potencial
eletroquímico do NO coordenado. 24
Figura 15 – Correlação entre a constante k-NO e o potencial eletroquímico do aquacomplexo formado. 24 Figura 16 – Correlação entre a constante k-NO e a banda de
estiramento NO no infravermelho. 25 Figura 17 – Correlação entre a constante k-NO e o somátorio dos
parâmetros de Lever. 26
Figura 18 – Voltamograma cíclico do íon complexo trans -[Ru(NH3)4cafeínaNO]3+ em solução aquosa de NaCF3COO 1 Mol L-1 pH=3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 26 Figura 19 – Voltamograma cíclico do íon complexo trans
-[Ru(NH3)4teofilenoNO]3+ em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. 27 Figura 20 – Correlação entre a constante k-NO e o potencial do NO
Figura 21 – Correlação entre a constante k-NO e o potencial do NO
coordenado. 28
Figura 22 – Estrutura otimizada com o funcional LDA - PWC do íon complexo cis-[Ru(bpy)2isnNO]3+. 31 Figura 23 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo cis-[Ru(bpy)2ImNNO]3+. 31 Figura 24 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo cis-[Ru(bpy)2SO3NO]+. 32 Figura 25 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo trans-[Ru(bpy)2SO3NO]+. 32 Figura 26 – Correlação entre o potencial do NO coordenado e a
distância Ru-N. 33
Figura 27 – Correlação entre o potencial do NO coordenado e a
distância N-O. 34
Figura 28 – Correlação entre o potencial do NO coordenado e o ângulo
Ru-N-O. 34
Figura 29 – Orbital LUMO do íon complexo cis-[Ru(bpy)2isnNO]3+. 35 Figura 30 – Orbital LUMO do íon complexo cis-[Ru(bpy)2ImNNO]3+. 36 Figura 31 – Orbital LUMO do íon complexo cis-[Ru(bpy)2SO3NO]+. 36 Figura 32 – Orbital LUMO do íon complexo trans-[Ru(bpy)2SO3NO]+. 36 Figura 33 – Correlação entre a energia do orbital LUMO e o potencial
redox do NO coordenado. 37
Figura 34 – Espectro vibracional do íon complexo cis -[Ru(bpy)2isnNO]3+ em pastilha de KBr (sal de PF6) (-) e o calculado por DFT (-) entre 3750 e 400cm-1. 39 Figura 35 – Espectro vibracional do íon complexo cis
-[Ru(bpy)2ImNNO]3+ em pastilha de KBr (sal de PF6) (-) e o calculado por DFT (-) entre 3500 e 400cm-1. 39 Figura 36 – Espectro vibracional do íon complexo cis
Figura 37 – Espectro vibracional do íon complexo trans -[Ru(bpy)2SO3NO]+ em pastilha de KBr (sal de PF6) (-) e o calculado por DFT (-) entre 3500 e 400cm-1. 40 Figura 38 – Correlação entre os valores experimentais e teóricos das
bandas de estiramento NO para os complexos trabalhados. 41 Figura 39 – Correlação entre o valor teórico das bandas de estiramento
NO e a constante k-NO para os complexos trabalhados. 41 Figura 40 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo cis-[Ru(bpy)2isnNO]3+. 42 Figura 41 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo cis-[Ru(bpy)2ImNNO]3+. 42 Figura 42 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo cis-[Ru(bpy)2SO3NO]+. 43 Figura 43 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo trans-[Ru(bpy)2SO3NO]+. 43 Figura 44 – Correlação entre o potencial do NO coordenado e a
distância Ru-N. 44
Figura 45 – Correlação entre o potencial do NO coordenado e a
distância N-O. 45
Figura 46 – Orbital LUMO do íon complexo cis-[Ru(bpy)2isnNO]3+. 45 Figura 47 – Orbital LUMO do íon complexo cis-[Ru(bpy)2ImNNO]3+. 46 Figura 48 – Orbital LUMO do íon complexo cis-[Ru(bpy)2SO3NO]+. 46 Figura 49 – Orbital LUMO do íon complexo trans-[Ru(bpy)2SO3NO]+. 46 Figura 50 – Correlação entre a energia do orbital LUMO e o potencial
redox do NO coordenado. 47
Figura 51 – Correlação entre a carga do grupo NO e o potencial redox
do NO coordenado. 48
Figura 52 – Correlação entre a carga do grupo NO e o pKNO. 48 Figura 53 – Espectro vibracional do íon complexo cis
Figura 54 – Espectro vibracional do íon complexo cis -[Ru(bpy)2ImNNO]3+ em pastilha de KBr (sal de PF6) (-) e o calculado por DFT (-) entre 3500 e 400cm-1. 49 Figura 55 – Espectro vibracional do íon complexo cis
-[Ru(bpy)2SO3NO]+ em pastilha de KBr (sal de PF6) (-) e o calculado por DFT (-) entre 3500 e 400cm-1. 50 Figura 56 – Espectro vibracional do íon complexo trans
-[Ru(bpy)2SO3NO]+ e o calculado por DFT e em pastilha de KBr(-)(sal de PF6) (-) entre 3500 e 400cm-1. 50 Figura 57 – Correlação entre os valores experimentais e teóricos das
bandas de estiramento NO para os complexos trabalhados. 51 Figura 58 – Correlação entre o valor teórico das bandas de estiramento
NO e a constante k-NO para os complexos trabalhados. 51 Figura 59 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo trans-[Ru(NH3)4cafNO]3+. 52 Figura 60 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo trans-[Ru(NH3)4teoNO]3+. 53 Figura 61 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo trans-[Ru(NH3)4Imk2NO]3+. 53 Figura 62 – Estrutura otimizada com o funcional LDA - PWC do íon
complexo trans-[Ru(NH3)4cafNO]3+. 53 Figura 63 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo trans-[Ru(NH3)4teoNO]3+. 54 Figura 64 – Estrutura otimizada com o funcional GGA - BLYP do íon
complexo trans-[Ru(NH3)4Imk2NO]3+. 54 Figura 65 – Correlação entre o potencial do NO e a distância N-O nos
complexos. 55
Figura 66 – Correlação entre o potencial do NO e a distância Ru-N nos
complexos. 56
Figura 67 – Orbital LUMO do íon complexo trans-[Ru(NH3)4cafNO]3+,
Figura 69 – Orbital LUMO do íon complexo trans-[Ru(NH3)4Imk2NO]3+,
funcional LDA - PWC. 57
Figura 70 – Orbital LUMO do íon complexo trans-[Ru(NH3)4cafNO]3+,
funcional GGA - BLYP. 58
Figura 71 – Orbital LUMO do íon complexo trans-[Ru(NH3)4teoNO]3+,
funcional GGA - BLYP. 58
Figura 72 – Orbital LUMO do íon complexo trans-[Ru(NH3)4Imk2NO]3+,
funcional GGA - BLYP. 58
Figura 73 – Correlação entre o potencial do NO e a energia do orbital
LUMO. 59
Figura 74 – Espectro vibracional do íon complexo trans -[Ru(NH3)4cafNO]3+, em pastilha de KBr (sal de Cl-) (-) e o calculado com o funcional LDA - PWC (-) entre 3500 e
400cm-1. 61
Figura 75 – Espectro vibracional do íon complexo trans -[Ru(NH3)4teoNO]3+, em pastilha de KBr (sal de Cl-) (-) e o calculado com o funcional LDA - PWC (-) entre 3500 e
400cm-1. 61
Figura 76 – Espectro vibracional do íon complexo trans -[Ru(NH3)4Imk2NO]3+ calculado com o funcional LDA - PWC (-) e em pastilha de KBr (sal de Cl-) (-) entre 3500 e 400cm-1.
61 Figura 77 – Espectro vibracional do íon complexo trans
-[Ru(NH3)4cafNO]3+, em pastilha de KBr (sal de Cl-) (-) e o calculado com o funcional GGA - BLYP (-) entre 3500 e
400cm-1. 62
Figura 78 – Espectro vibracional do íon complexo trans -[Ru(NH3)4teoNO]3+ calculado com o funcional GGA – BLYP (-) e em pastilha de KBr (sal de Cl-) (-) entre 3500 e 400cm-1. 62 Figura 79 – Espectro vibracional do íon complexo trans
Figura 80 – Correlação entre a posição da banda de estiramento NO no infravermelho experimental e teórica para os complexos. 63 Figura 81 – Correlação entre o potencial do NO e a posição da banda
Índice de Tabelas
Tabela 1 – Valores de potencial de meia onda para o processo
NO+/NO0 para os complexos. 16
Tabela 2 – Valores de potencial de meia onda para o processo
Ru2+/Ru3+ para os complexos. 22
Tabela 3 – Valores de k-NO para os complexos. 23 Tabela 4 – Valores teóricos para as distâncias de ligação N-O e o
ângulo Ru-N-O para os complexos. 32
Tabela 5 - Energia do orbital LUMO para os complexos. 35 Tabela 6 - Carga teórica no grupo NO pela análise de Mulliken e pKNO
experimental para os complexos. 38
Tabela 7 - Posição da banda de estiramento da ligação N-O experimental e teórica para os complexos. 40 Tabela 8 – Valores teóricos para as distâncias de ligação Ru-N, N-O e
o ângulo Ru-N-O para os complexos. 44 Tabela 9 - Energia do orbital LUMO para os complexos. 47 Tabela 10 - Carga teórica no grupo NO pela análise de Mulliken e pKNO
experimental para os complexos. 48
Tabela 11 - Posição da banda de estiramento da ligação N-O experimental e teórica para os complexos. 50 Tabela 12 – Valores teóricos para as distâncias de ligação Ru-N e N-O
para os complexos. 55
Tabela 13 - Energia do orbital LUMO para os complexos. 59 Tabela 14 - Carga teórica no grupo NO pela análise de Mulliken para
os complexos. 60
Lista de abreviaturas
BLYP Funcional de Becke-Lee-Yang-Parr bpy 2,2’-bipiridina
caf Cafeína
cGMP Guanosilmonofosfato cíclico
DFT Density Functional Theory – Teoria do Funcional da Densidade E1/2 Potencial de meia-onda
ECE electrochemical-chemical-electrochemical / eletroquímico-químico-eletroquímico
EDRF Endothelium Derived Relaxing Factor – Fator Relaxante Derivado do Endotélio
FT-IR Espectroscopia vibracional na região do infravermelho com transformada de Fourier
GGA Generalized Gradient Approximation – Aproximação por gradiente generalizado
ImN Imidazol coordenado via Nitrogênio Imk2 Imidazol coordenado via carbono 2 isn Isonicotinamida
LDA Local Density Approximation – Aproximação por densida local LUMO lowest unoccupied molecular orbital – orbital molecular desocupado
de energia mais baixa
NANC Non-Adrenergic, Non-Cholinergic – Não Adrenérgica, Não Colinérgica
NaTFA Trifluoracetato de Sódio NO Óxido Nítrico NOS Nitric Oxide Synthase
pKNO pH de interconversão das formas NO+ e NO2 -PWC Funcional de
SNAP S-nitroso-N-acetil-D-penicilamina
Introdução
O óxido nítrico
O óxido nítrico(NO) é um gás incolor[1] que possui em sua estrutura apenas
um átomo de nitrogênio e um de oxigênio, o que acarreta um número impar de
elétrons e o torna um radical.[2, 3] Tal fato faz com que possua elevada reatividade.
Observando o diagrama simplificado de orbital molecular do NO (Figura 1)
verifica-se que o elétron deverifica-semparelhado ocupa um orbital π*, o que leva a ligação N-O a
possuir um caráter intermediário entre uma ligação dupla e uma tripla.[2] A
distância de ligação da espécie neutra é de 1,15 Å, e a banda de estiramento para
a ligação N-O no infravermelho é observada em 1840 cm-1.[2]
Figura 1 – Diagrama simplificado de orbitais Moleculares para o radical NO.[3]
É possível tanto haver a oxidação do NO a NO+ (nitrosônio) quanto sua
redução a NO- (nitroxila), assim como a reação com o oxigênio pode levar à
formação de NO2.[3] A distância de ligação para o NO+ é de 1,06 Å e sua banda de
estiramento quando livre de coordenação ocorre entre 2150 e 2400 cm-1, a
depender do contra-íon.[2] Tal fato é importante para o entendimento da química
do mesmo afeta suas características, podendo vir a desestabilizar ou estabilizar a
ligação metal-NO.
A coordenação do NO a um centro metálico pode se dar em duas
geometrias (Figura 2), angular e linear, sendo a coordenação linear associada à
forma NO+ e a forma angular às formas reduzidas NO0 e NO-.[4]
M
N
O
M
N
O
M
N
O
Linear
Angular
Figura 2 – Geometrias de coordenação do NO a um centro metálico.
A geometria linear é na verdade um híbrido das estruturas mostradas, onde
a ligação π entre o metal e o NO enfraquece a tripla ligação do N≡O. Isso se deve
ao orbital envolvido na ligação π M-NO ser um orbital π* da molécula de NO. Uma
vez que existe uma diminuição da ordem de ligação N-O, a banda do estiramento
desta ligação é observada em valores de número de onda inferiores a 2000 cm-1.
A caracterização do estado de oxidação do NO coordenado apenas em função da
sua banda de estiramento é difícil, devido à grande superposição entre as regiões
do estiramento da ligação do NO coordenado em seus diferentes estados de
oxidação, embora freqüências acima de 1900 cm-1 sejam indicadoras da forma
NO+.[5]
O NO+ é isoeletrônico ao cianeto e monóxido de carbono, ligantes fortes
com grande poder π-receptor, e assim pode formar complexos estáveis com
centros metálicos no estado reduzido. Isso torna possível uma transferência
eletrônica intramolecular, conforme mostrada pelas equações I e II.[4]
Mn+ + NO0→ Mn+-NO0 (Equação I)
Como as espécies possuem mesma carga e ocorre grande sobreposição da
banda de estiramento do NO no infravermelho, em alguns casos é difícil a
identificação da formulação correta do composto. Para que mesmo nos casos
duvidosos fosse possível haver uma idéia do tipo de composto obtido, Enemark e
Feltham propuseram uma notação[3] onde a espécie seria representada por
{M(NO)x}n, onde x designa a quantidade de moléculas de NO coordenadas ao
metal e n é a soma do número de elétrons d do metal e o número de elétrons nos
orbitais π* do NO.
Funções biológicas do óxido nítrico
Até a década de 1980 acreditava-se que o NO+, tal qual cianeto e monóxido
de carbono, ligava-se irreversivelmente a centros metálicos, sendo ele então visto
unicamente como veneno, uma vez poderia levar a uma paralisação do transporte
de oxigênio e da cadeia respiratória.[3] Tal visão mudou a partir do momento que
as funções biológicas do NO foram descobertas onde em concentrações
adequadas ele possui ações benéficas, embora em grandes quantidades seus
malefícios sejam predominantes.
A descoberta das diferentes funções do NO no organismo foi resultado de
quatro estudos independentes:[6]
• nitratos endógenos e toxidade dos macrófagos;
• atividade da azida de sódio no metabolismo ativo dos nitratos;
• descoberta e caracterização do fator relaxante derivado do endotélio
(EDRF – endothelium derived relaxing factor);
• identificação da natureza da transmissão Adrenérgica,
Não-Colinérgica (NANC).
O resultado destas pesquisas foi a identificação do NO como responsável
pelos efeitos biológicos observados. A biossíntese do NO é realizada a partir da
L-arginina, em um ciclo que não só regenera a L-arginina como consome o excesso
de nitrogênio proveniente do metabolismo celular.[6, 7] Esta síntese, mostrada na
Figura 3, requer a participação de uma das isoformas da enzima NOS (nitric oxide
Figura 3 - Biossíntese do NO.
Uma vez produzido, o NO por possuir polaridade moderada pode se difundir
através da membrana celular,[1, 2, 6] o que leva a um não armazenamento do NO
pela célula, sendo sua síntese iniciada quando é preciso e sua ação rápida e in
situ. Ainda assim, quando a produção de NO é realizada em excesso, tióis
existentes in vivo, por exemplo, cisteína, podem atuar como carreadores do
mesmo, capturando-o, podendo líberá-lo depois, deste modo prolongando a ação
do mesmo,[2, 6] como apresentado de forma genérica e não-balanceada na
equação III.
RSH + NO → RSNO (Equação III)
O óxido nítrico e o sistema circulatório
A principal atuação do NO dentro do sistema circulatório é sua participação
na relaxação dos vasos, causando assim uma diminuição da pressão arterial. Tal
ação é realizada indiretamente com o NO estimulando a síntese de cGMP, que
musculatura que envolve os vasos sangüíneos. Esta relaxação leva a uma
diminuição da pressão arterial.[2, 6]
Além da regulação da pressão, o NO inibe a agregação plaquetária[6, 8] e o
depósito de lipídios como o colesterol na parede das artérias. Deste modo uma
diminuição na produção de NO pode levar a aterosclerose. [8] A presença de um
ateroma reduz a capacidade de relaxação da artéria, assim como reduz o espaço
onde se dá o fluxo sangüíneo, levando então a um quadro hipertensivo. [6, 8]
O óxido nítrico e o sistema nervoso central
O NO satisfaz a maior parte dos critérios associados a
neurotransmissores[2, 6]. Sua ação como tal está associada a respostas sinápticas
de longa duração e como modulador no hipocampo, na memória e no
aprendizado[1, 2, 6].
O óxido nítrico e o sistema imunológico
Óxido nítrico é produzido em larga escala nos macrófagos como gerador de
espécies radicalares como peróxido ou peróxinitrito, para o combate a fungos,
bactérias, tumores, entre outros[2, 6, 9].
Devido ao NO poder gerar tais espécies danosas quando em alta
concentração, sua síntese necessita de grande controle pelo organismo.
Doadores de óxido nítrico
Existem diversas classes de compostos que podem atuar como doadores
de NO.[10] Historicamente, as primeiras classes de compostos utilizados com tal
função, ainda que seu mecanismo de ação fosse desconhecido à época foram
nitratos orgânicos, como por exemplo, a nitroglicerina,[9, 10] ou complexos
O nitroprussiato de sódio é o principal agente vasodilatador utilizado
clinicamente, porém como desvantagem possui liberação de cianeto concomitante
à liberação de NO,[12] mostrada na Figura 4, que torna seu uso limitado a uma
dose máxima de 10mg/kg/min, sendo que após 10 minutos a esta dose o uso deve
ser suspenso devido a risco de toxicidade.[13] Simultaneamente ao uso do
nitroprussiato é utilizado tiossulfato de sódio como capturador de cianeto, gerando
tiocianato.[14]
Figura 4 – Liberação de NO no nitroprussiato de sódio.[12]
Atualmente outras importantes classes de doadores de NO são constituídas
por S-nitroso-tióis, tendo como um de seus principais compostos o
S-nitroso-N-acetil-D-penicilamina (SNAP) e seus derivados,[10] N-nitrosaminas, normalmente
Complexos metálicos como possíveis doadores de óxido nítrico
O sucesso do nitroprussiato de sódio como composto vasodilatador, mesmo
com sua toxidez, motivou o estudo de outros complexos metálicos que poderiam
atuar como doadores de NO in vivo ainda havendo a possibilidade de modular
esta liberação, de modo a obter maior controle na vasodilatação ou um efeito mais
duradouro.
Em complexos do tipo trans-[Ru(NH3)4LNO]n+ é reportado que o NO
coordenado possui o ligante NO na forma NO+, o que possibilita a liberação de NO
via redução, química ou eletroquímica, ou fotoquimicamente.[16-21] É reportado que
se este ligante L possui um forte efeito trans labilizante, a liberação de NO se dá
de forma mais rápida.[21, 22] Dentre estes complexos, o que possui L=trietilfosfito
(P(OCH2CH3)3) mostrou um ligante fortemente trans labilizante aliado a um
Justificativa e objetivos
No desenvolvimento de compostos que possam atuar como doadores de
NO in vivo faz-se necessário um estudo das diversas propriedades dos compostos
existentes e relacioná-las às propriedades do NO coordenado. Assim sendo, este
trabalho tem por objetivo estudar propriedades de nitrosilo-complexos, sejam elas
determinadas teoricamente por DFT ou experimentalmente como a cinética de
liberação do NO, por exemplo, e correlacioná-las de modo a identificar tendências
Metodologia
Reagentes
Os reagentes RuCl3.XH2O (Aldrich), imidazol (Aldrich), isonicotinamida
(Aldrich), 2,2’-bipiridina (bpy) (Aldrich), hexafluorfosfato de amônio (Aldrich), iodeto
de sódio (Vetec), ácido clorídrico (Synth), cafeína (Aldrich), teofileno (ICN
biomedicals), nitrito de sódio (Fluka) sulfito de sódio (Vetec) foram utilizados sem
qualquer tratamento prévio.
Os solventes etanol (Merck), metanol (Merck), acetona (Merck) e ácido
trifluoracético (Aldrich) foram utilizados nas sínteses dos compostos e também não
passaram por nenhum tratamento prévio.
Todos os procedimentos foram realizados sob atmosfera de argônio,
quando necessário.
Síntese dos complexos
Os compostos [Ru(NH3)5Cl]Cl2[23], trans-[Ru(NH3)4SO2Cl]Cl[23] e
cis-[Ru(bpy)2Cl2].2H2O[24, 25], trans-[Ru(NH3)4LCl]Cl2, onde L=cafeína e teofileno
coordenados via carbono[26] foram sintetizados conforme descrito na literatura.
A caracterização dos complexos sintetizados foi condizente com os dados
encontrados na literatura.
• cis-[Ru(bpy)2LNO2]PF6,(L=isonicotinamida e imidazol)[27]
150 mg (0,20 mmol) do complexo cis-[Ru(bpy)2Cl2].2H2O são dissolvidos
em 20mL de uma solução água/etanol 50%, sendo adicionado o ligante L
em proporção de 1:1,4 (0,28 mmol do ligante) e a reação é mantida em
refluxo por 1 hora, ao abrigo da luz. É adicionado, então, nitrito de sódio na
proporção molar de 1:1,4 (0,28mmol do ligante) e o refluxo mantido por
mais 2 horas, ainda ao abrigo da luz. A solução tem seu volume reduzido à
ocorrendo a precipitação do composto. Rendimento >75%. cis
-[Ru(bpy)2ImNNO2]PF6 : UV-VIS, H2O 243 nm (ε = 2,19 x 104), 286 nm (ε =
4,45 x 104), 412 nm (ε = 7,3 x 103); E1/2 = 745 mV, Ag/AgCl; cis
-[Ru(bpy)2isnNO2]PF6 : UV-VIS, H2O 243 nm (ε = 1,80 x 104), 285 nm (ε =
3,75 x 104), 408 nm (ε = 9,04 x 103); E1/2 = 965 mV, Ag/AgCl;
• cis-Na[Ru(bpy)2SO3NO2][28]
150mg (0,20mmol) do complexo cis-[Ru(bpy)2Cl2].2H2O são dissolvidos em
20mL de uma solução água/etanol 50%, sendo adicionado sulfito de sódio
em proporção de 1:1,4 (0,28 mmol) e a reação é mantida em refluxo por 1
hora, ao abrigo da luz. É adicionado, então, 0,28 mmol de nitrito de sódio e
o refluxo mantido por mais 2 horas, ainda ao abrigo da luz. A solução tem
seu volume reduzido à metade por meio de um rotaevaporador e é
adicionado 1 g de iodeto de sódio, ocorrendo a precipitação do composto.
Rendimento >75%. UV-VIS, H2O 242 nm (ε = 1,25 x 104), 286 nm (ε = 6,20
x 104), 405 nm (ε = 1,02 x 103); E1/2 = 450 mV, Ag/AgCl;
• cis-[Ru(bpy)2LNO](PF6)3, (L=isonicotinamida, imidazol)[27]
0,20 mmol (192 mg para L=imidazol e 203 mg para L=isonicotinamida) do
complexo cis-[Ru(bpy)2LNO2]PF6 são dissolvidos em 7mL de metanol e 1mL
de ácido trifluoracético 70% e a reação prossegue sob agitação e atmosfera
inerte por 1hora. Para a precipitação é adicionado 1 g de NH4PF6.
Rendimento >80%. cis-[Ru(bpy)2ImNNO](PF6)3 : UV-VIS, H2O 296 nm (ε =
2,45 x 104), 325 nm (ε = 8,92 x 103); E1/2 = 208 mV, Ag/AgCl; FT-IR νNO
1944 cm-1cis-[Ru(bpy)2isnNO](PF6)3 : UV-VIS, H2O 298 nm (ε = 1,45 x 104),
326 nm (ε = 8,27 x 103); E1/2 = 340 mV, Ag/AgCl; FT-IR νNO 1948 cm-1
• cis-[Ru(bpy)2SO3NO]PF6[28]
150mg (0,27mmol) do complexo cis-Na[Ru(bpy)2SO3NO2] são dissolvidos
prossegue sob agitação e atmosfera inerte por 1hora. Para a precipitação é
adicionado 1 g de NH4PF6. Rendimento >80%. UV-VIS, H2O 294 nm (ε =
1,37 x 104), 321 nm (ε = 1,11 x 104); E1/2 = -140 mV, Ag/AgCl; FT-IR νNO
1911 cm-1
• cis-[Ru(bpy)2SO3H2O][28]
80mg (0,26mmol) de trans-[Ru(NH3)4SO2Cl]Cl são dissolvidos em 5,0mL de
água, sob fluxo de argônio. Em seguida, adicionam-se 82,25mg (0,52mmol)
de bipiridina (bpy), deixando reagir por 2 horas. Após este tempo
evapora-se com auxílio de um rotaevaporador o solvente até a evapora-secura e adiciona-evapora-se
para a precipitação etanol. Rendimento >80%. UV-VIS, H2O 243 nm (ε =
1,67 x 104), 294 nm (ε = 4,18 x 104), 345 nm (ε = 5,32 x 103), 474 nm (ε =
3,78 x 103); E1/2 = 380 mV, Ag/AgCl;
• trans-[Ru(bpy)2SO3NO]PF6[28]
60mg (0,12mmol) de cis-[Ru(bipy)2SO3H2O] são dissolvidos em 5,0mL de
ácido trifluoracético 2mol.L-1, sob fluxo de argônio. Em seguida
adicionam-se 40mg (0,58mmol) de NaNO2, deixando reagir por 2 horas. Após este
tempo evapora-se o solvente até a secura com um rotaevaporador e
adiciona-se, para a precipitação, 1mL de uma solução aquosa saturada
com NH4PF6. Rendimento >80%. UV-VIS, H2O 284 nm (ε = 4,7 x 104), 310
nm (ε = 3,08 x 104); E1/2 = -340 mV, Ag/AgCl; FT-IR νNO 1887 cm-1
• trans-[Ru(NH3)4LNO]Cl3, onde L=cafeína e teofileno coordenados via
carbono.[29]
100mg (0,23mmol) do complexo trans-[Ru(NH3)4LCl]Cl2 são dissolvidos em
5mL de água pH≈5,0 em um borbulhador e adiciona-se amálgama de zinco
e mercúrio. Após 1 hora, transfere-se para um balão contendo 2mL de
ácido clorídrico 2mol.L-1. A este adiciona-se 200mg (2,89mmol) de nitrito de
sódio, com o tempo de reação igual a 30 minutos. Evapora-se até próximo à
trans-[Ru(NH3)4(teofileno)NO]Cl3: UV-VIS, H2O pH 1,0: 214 nm (ε = 4,58 x
104), 265 nm (ε = 2,07 x 104), 326 nm (ε = 7,61 x 103), 362 nm (ε = 5,56 x
103); E1/2 = -440 mV, Ag/AgCl; FT-IR ν NO 1916 cm-1 trans
-[Ru(NH3)4(cafeína)NO]Cl3 : UV-VIS, H2O 235 nm (ε = 8,9 x 103), 270 nm (ε
= 5,06 x 103), 334 nm (ε = 4,97 x 102), 374 nm (ε = 1,53 x 103); E1/2 = -345
mV, Ag/AgCl; FT-IR ν NO 1916 cm-1
Equipamentos e técnicas experimentais
Voltametria Cíclica e Voltametria de Onda Quadrada
A voltametria cíclica foi utilizada para avaliar o comportamento
eletroquímico dos complexos. A análise consiste na aplicação de um potencial que
varia a uma velocidade constante em função do tempo, nos sentidos de oxidação
e redução em um mesmo experimento e mede-se a resposta de corrente a esta
variação de potencial. A existência de processos redox causa um incremento de
corrente. A partir da análise dos seguimentos anódicos e catódicos pode-se
avaliar a reversibilidade do processo eletroquímico.
A voltametria de onda quadrada foi utilizada para investigar a existência de
reações paralelas às reações redox na superfície do eletrodo. Ela difere da
voltametria cíclica por 1) a varredura de dá apenas no sentido de oxidação ou
redução, não em ambos; 2) a variação do potencial não se dá de forma linear,
havendo a aplicação de pulsos e a medida de corrente é feita no início e no final
do pulso, sendo a resposta a diferença da corrente em um pulso; 3) A
sensibilidade é superior, ao utilizar como resultado esta variação de corrente,
elimina-se a corrente residual não envolvida no processo redox.
Para a obtenção dos voltamogramas foi utilizado um sistema eletroquímico
da Bioanalytical System Inc., modelo BAS100B. Utilizou-se uma cela três
de referência de Ag/AgCl. Como eletrólito suporte foi utilizada uma solução de
trifluoracetato de sódio (NaTFA) 1 mol.L-1 pH 3,4.
Medidas de cronoamperometria
Foi utilizada para determinar as constantes de velocidade das reações
acopladas vistas pela voltametria de onda quadrada. A cronoamperometria se
baseia na aplicação de um pulso de potencial constante durante certo período de
tempo e acompanha-se a corrente em função do tempo. Ao se realizar uma
medida de dupla varredura aplica-se durante certo tempo um primeiro pulso de
potencial obtendo-se uma resposta de corrente e a seguir aplica-se um segundo
pulso de potencial, no sentido contrário, obtendo-se uma segunda resposta. Na
ausência de reações acopladas a carga transportada nos sentidos de ida e volta é
a mesma, sendo que na presença de reações acopladas a resposta de corrente
na volta é menor e a partir deste decréscimo é possível de terminar a constante de
velocidade da reação acoplada.
Para obtenção do cronoamperogramas foi utilizado um potenciostato
Microquimica MQPG-1, uma cela de três eletrodos sendo o de trabalho de
carbono vítreo, o auxiliar de platina e o de referência Ag/AgCl. Foi utilizada como
eletrólito suporte uma solução aquosa de trifluoracetato de sódio (NaTFA)
1 mol.L-1, pH 3,4 e concentração do complexo de 10-3 mol.L-1. A temperatura
utilizada foi de 25ºC, controlada por um banho termostático e para desoxigenar a
solução utilizou-se argônio como gás inerte. Os potenciais de redução e oxidação
aplicados foram 150 mV a mais e a menos que o potencial de meia onda do
processo de redox do NO, quando possível, de modo a evitar a aquisição de
quaisquer correntes que interferissem com a do processo redox em questão.
Cálculos teóricos
Para obtenção das propriedades teóricas dos compostos foi utilizado o
programa Material Studio Modeling, versão 3.2, no modo DMol3 (baseado na
funcionais LDA – PWC e GGA-BLYP, com um sistema de bases numéricas para
otimização de estrutura e cálculo de propriedades dos complexos.[30]
O cálculo foi realizado com spin irrestritos, devido à possibilidade do arranjo
emparelhado (Ru2+ e NO+) um birradicalar (Ru3+ e NO0). As bases utilizadas foram
bases numéricas DND e DNP, com um critério de convergência da densidade
eletrônica de 10-6.
Espectroscopia Vibracional
A espectroscopia vibracional é utilizada para obter informações a respeito
das ligações encontradas no composto em estudo ao avaliar a absorção de
energia na região do infravermelho, onde estão os níveis vibracionais das
ligações. Ela foi utilizada de modo a correlacionar de modo direto os resultados
teóricos a resultados experimentais.
Para a obtenção dos espectros vibracionais na região do infravermelho
foram utilizadas pastilhas de KBr na região de 400 a 4000 cm-1. Foi utilizado o
Resultados e Discussão
1.0 - Estudo eletroquímico dos complexos.
O estudo de nitrosilocomplexos de rutênio utilizando técnicas voltamétricas
exibe, de modo geral, um processo reversível, referente ao processo redox
NO+/NO0 do óxido nítrico coordenado ao centro metálico e caso a varredura se
estenda a valores mais negativos de potencial é observado um processo
irreversível referente a reduções multieletrônicas do NO, podendo gerar uma série
de espécies até amônia(a redução de NO+ a amônia envolve 6 elétrons).[31]
O processo do metal Ru3+/Ru2+ normalmente não é observado em meio
aquoso devido à estabilização dos elétrons do metal em seu estado reduzido
causada pela ligação com o NO+.
Além dos processos eletroquímicos gerados pelo composto em análise,
citados anteriormente, é possível a ocorrência de outros processos, que
evidenciam espécies geradas a partir da liberação do NO e sua substituição por
água, de acordo com o mecanismo EQE (eletroquímico-químico-eletroquímico /
electrochemical-chemical-electrochemical) mostrado abaixo.[19, 21, 22, 28, 32, 33]
cis-[RuII(bpy)2L(NO+)]3+ + e–
rápida
cis-[RuII(bpy)2LNO0]2+ (Equação IV)
cis-[Ru(bpy)2LNO]2+ + H2O k-NO(lenta) cis-[Ru(bpy)2(H2O)L]2+ + NO0 (Equação V)
cis-[Ru(bpy)2(H2O)L]2+ rápida cis-[Ru(bpy)2(H2O)L]3+ + e– (Equação VI)
A aquação do composto reduzido gerado na superfície do eletrodo,
representada pela equação V, causa uma diminuição da resposta de corrente do
processo referente à oxidação do composto com NO0 a NO+ coordenado, em
relação à corrente no processo de redução, e ao aparecimento de um processo
O potencial do processo NO+/NO0 é influenciado pela densidade eletrônica existente no grupo NO coordenado e esta é função da intensidade da retrodoação
do metal para o NO via ligação π. A presença de ligantes que possuam uma forte
acidez π causa uma diminuição de densidade eletrônica no metal e, por
conseguinte diminuem a capacidade do metal em realizar a retrodoação para o
NO. Com a retrodoação deficiente, o grupo NO possui menor densidade eletrônica
e assim, maior tendência de este se apresentar em seu estado oxidado frente ao
reduzido e apresentando o par redox NO+/NO0 em maiores valores de E1/2.[33-35]
1.1 – Complexos cis-[Ru(bpy)2LNO] e trans-[Ru(bpy)2SO3NO], onde L=
ImN, isn e SO3
2-Os voltamogramas cíclicos dos complexos cis-[Ru(bpy)2LNO](PF6)n e
trans-[Ru(bpy)2SO3NO]PF6 (Figuras 5 - 8) exibem um processo reversível atribuído ao
processo redox NO+/NO0 do óxido nítrico coordenado ao centro metálico, sendo
os valores listados na Tabela 1. Os complexos estudados são do tipo [RuNO]6,
com o centro metálico no estado reduzido o e ligante NO na forma NO+.
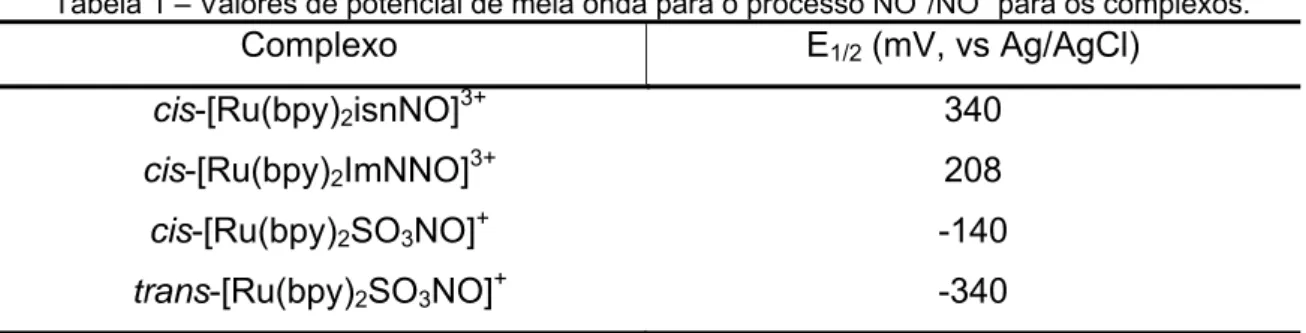
Tabela 1 – Valores de potencial de meia onda para o processo NO+/NO0 para os complexos.
Complexo E1/2 (mV, vs Ag/AgCl)
cis-[Ru(bpy)2isnNO]3+ 340
cis-[Ru(bpy)2ImNNO]3+ 208
cis-[Ru(bpy)2SO3NO]+ -140
800 600 400 200 0 -8
-6 -4 -2 0 2 4 6 8 10
Corr
en
te
(
μΑ
)
Potencial (mV)
Figura 5 – Voltamograma cíclico do íon complexo cis-[Ru(bpy)2IsnNO]3+ em solução aquosa de
NaCF3COO 1 Mol L -1
pH=1. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência.
1000 800 600 400 200 0
-10 -5 0 5 10
Co
rren
te (
μ
A)
Potencial (mV)
Figura 6 – Voltamograma cíclico do íon complexo cis-[Ru(bpy)2ImNNO]3+ em solução aquosa de
NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho
1000 800 600 400 200 0 -200 -400 -15
-10 -5 0 5 10 15 20 25 30
Co
rr
e
n
te
(
μ
A)
Potencial (mV)
Figura 7 – Voltamograma cíclico do íon complexo cis-[Ru(bpy)2SO3NO] +
em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho
e Ag/AgCl como referência.
600 400 200 0 -200 -400
-5 0 5 10 15 20 25 30
Co
rren
te (
μΑ
)
Potencial (mV)
Figura 8 – Voltamograma cíclico do íon complexo trans-[Ru(bpy)2SO3NO]+ em solução aquosa de
NaCF3COO 1 Mol L-1, pH3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho
A partir dos potenciais apresentados pelos complexos de geometria cis
verifica-se que quando o ligante L é a isonicotinamida o complexo possui um
maior potencial de oxidação do NO coordenado, seguido de L = imidazol
coordenado via nitrogênio e por fim observa-se que o menor potencial é do ligante
sulfito. Pode-se então sugerir que a isonicotinamida liga-se mais fortemente ao
metal, diminuindo a retrodoação para o NO, sendo seguido pelo imidazol, sendo
ambos os N-heterociclos com características de π−retiradores.[33]
O ligante sulfito por possuir característica apenas de σ-doador, devido a
não haver orbitais de simetria apropriada para uma ligação π, não compete com o
NO em termos de retrodoação, o que leva a uma ligação mais forte entre o centro
metálico e o NO, o que deste modo amplia a densidade eletrônica sobre o NO e
facilitaria sua oxidação, o que causa o menor potencial observado para o par
redox NO+/0.
O complexo trans tem um menor potencial para o processo redox no NO
em relação aos complexos cis, sendo seu valor consistente com a diferença entre
os complexos cis e trans consistente com a observada na literatura para
bis-bipiridinas de rutênio.[36, 37]
Para estudar o comportamento da viabilidade de liberação eletroquímica do
NO, foram realizadas medidas de voltametria de onda quadrada, variando-se o
tempo de repouso onde é aplicado o potencial inicial é aplicado. Os
voltamogramas de onda quadrada a diferentes tempos de repouso do eletrodo são
Figura 9 – Voltamograma de onda quadrada do íon complexo cis-[Ru(bpy)2isnNO] 3+
em solução aquosa de NaCF3COO 1 Mol L-1. Potencial aplicado usando eletrodo de carbono vítreo como
trabalho e Ag/AgCl como referência.
Figura 10 – Voltamograma de onda quadrada do íon complexo cis-[Ru(bpy)2ImNNO]3+ em solução
aquosa de NaCF3COO 1 Mol L -1
, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência.
1000 800 600 400 200 0
-90 -80 -70 -60 -50 -40 -30 -20
Corren
te (
μΑ
)
Potencial (mV) 0 s
60 s 240 s 600 s
1000 800 600 400 200
-25 -20 -15 -10 -5
Corr
ente (
μΑ
)
Potencial (mV)
Figura 11 – Voltamograma de onda quadrada do íon complexo cis-[Ru(bpy)2SO3NO] +
em solução aquosa de NaCF3COO 1 Mol L
-1
, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência.
Figura 12 – Voltamograma de onda quadrada do íon complexo trans-[Ru(bpy)2SO3NO] +
em solução aquosa de NaCF3COO 1 Mol L
-1
, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência.
Nos voltamogramas observa-se que um aumento no tempo de repouso leva
a uma diminuição da corrente do processo a direita nos gráficos e um aumento da
corrente relativa aos processos à esquerda. Com base no mecanismo EQE
representado pelas equações IV a VI(página 15),a diferença nos voltamogramas
pode ser explicada por o processo em menores valores de potencial ser referente
à equação IV e o processo em maiores valores de potencial(na Figura 9 o
600 400 200 0 -200 -400
-24 -22 -20 -18 -16 -14 -12 -10 -8 -6 -4 Cor rent e ( μΑ ) Potencial (mV) 0 s 15 s 30 s 60 s 90 s 120 s
800 600 400 200 0 -200
processo em ~700mV) ser referente à equação VI. O tempo de repouso reflete o
tempo que a reação representada pela equação V ocorre. Quanto maior o tempo
de repouso, maior a ocorrência da reação de aquação, menor a resposta do
nitrosilocomplexo, pois sua concentração na superfície do eletrodo diminuiu e
maior a resposta do aquacomplexo, pois sua concentração na superfície do
eletrodo é aumentada. Os potenciais dos aquacomplexos são mostrados na
Tabela 2.
Tabela 2 – Valores de potencial de meia onda para o processo Ru2+/Ru3+ para os complexos.
Complexo E1/2 (mV, vs Ag/AgCl)
cis-[Ru(bpy)2isnH2O]2+ 710
cis-[Ru(bpy)2ImNH2O]2+ 690
cis-[Ru(bpy)2SO3H2O]0 616
Trans-[Ru(bpy)2SO3H2O]0 376
Observa-se que o complexo cis com isonicotinamida possui o maior valor
de E1/2, seguido por imidazol, sulfito em cis e sulfito em trans, sendo esta a mesma
ordem de potenciais para os nitrosilocomplexos, conforme discutido anteriormente,
uma interação π mais forte leva a uma maior estabilização dos orbitais π ligante,
requerendo assim uma maior energia para oxidá-lo e por fim aumentando o
potencial de oxidação.
Verificam-se ainda nos voltamogramas que ao variar-se o complexo é
necessário um tempo diferenciado para alcançar determinada diminuição da
corrente do nitrosilocomplexo. Isto se deve à diferença da constante de velocidade
k-NO da equação V. Para a determinação da constante de velocidade de liberação
do NO, utilizou-se a cronoamperometria de dupla varredura,[32, 33, 38, 39] onde a
razão entre as correntes catódicas e anódicas em certos valores de tempo no
cronoamperograma é relacionada à constante de velocidade da reação, a partir de
curvas trabalho encontradas na literatura[39]. Um cronoamperograma típico é
mostrado na Figura 13. Os valores determinados de k-NO observados para os
complexos são mostrados na Tabela 3., e estão dentro dos limites de
constante de velocidade para o complexo com isonicotinamida não foi calculada
devido ao fato de no pH do eletrólito utilizado para as medidas(3,4) o complexo
encontrar-se majoritariamente na forma nitro[27].
0 500 1000 1500 2000 2500
-300 -200 -100 0 100 200 300 400
C
o
rr
e
n
te
(
μ
A)
Tempo (ms)
Figura 13 – Cronoamperograma do íon complexo cis-[Ru(bpy)2SO3NO]+ em solução aquosa de
NaCF3COO 1 Mol L -1
, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo como trabalho e Ag/AgCl como referência. Tempo de troca 1250ms, potencial de redução -290mV, potencial de
oxidação 10mV.
Tabela 3 – Valores de k-NO para os complexos.
Complexo k-NO(s-1)
cis-[Ru(bpy)2ImNNO]3+ 0,183
cis-[Ru(bpy)2SO3NO]+ 0,347
trans-[Ru(bpy)2SO3NO]+ 1,015
Observa-se que a constante de velocidade de aquação cresce em ordem
inversa ao potencial redox tanto do aquacomplexo quanto do nitrosilocomplexo.
A labilização do NO se dá por dois fatores: 1) o orbital que recebe o elétron
no processo eletroquímico é um orbital com características de orbital π* da ligação
metal-NO, o que leva a um enfraquecimento da ligação; 2) troca do caráter
fortemente π-retirador do ligante NO+ por um caráter predominantemente σ-doador
Se o centro metálico está ligado a outro ligante com característica de ácido
π, este está mais apto a acomodar os elétrons que agora passa a receber do NO,
que outro centro metálico ligado apenas a ligantes de características doadoras,
onde a acomodação da densidade eletrônica será “pior” e, portanto desestabiliza a
ligação M-NO em relação ao primeiro caso. As Figuras 14 e 15 ilustram o
comportamento da constante de aquação em função dos potenciais de meia onda
dos nitrosilo-complexos e dos aqua complexos formados após a liberação do NO.
0,0 0,2 0,4 0,6 0,8 1,0 1,2
-500 -400 -300 -200 -100 0 100 200 300 E1 /2 N O 0
/+ (mV
, v s Ag /Ag C l)
k-NO (s-1)
y = 195 -554x r2 = 0,77 ImN
SO32-(cis)
SO32-(trans)
Figura 14 – Correlação entre a constante k-NO e o potencial eletroquímico do NO coordenado.
0,0 0,2 0,4 0,6 0,8 1,0 1,2 300 350 400 450 500 550 600 650 700 750 EH 2 O (mV , v s Ag /A g C l) k
-NO (s
-1)
Y = 752 -372*X r2= 0,99 ImN
SO32-(cis)
SO32-(trans)
Figura 15 – Correlação entre a constante k-NO e o potencial eletroquímico do aquacomplexo
É notável ainda a grande diferença entre as constantes de velocidade dos
complexos cis e o complexo trans, que pode ser atribuída em parte ao forte efeito
trans-labilizante do ligante sulfito em relação aos complexos cis que possuem a
bipiridina em trans ao NO.[21, 40, 41]
Além do potencial redox do NO, uma outra característica facilmente obtida
experimentalmente, a freqüência de estiramento da ligação NO também pode ser
usada para buscar uma tendência em relação à liberação do NO
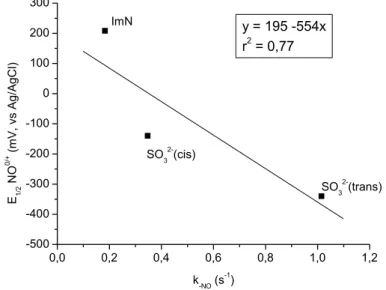
eletroquimicamente. O resultado é mostrado na Figura 16 e verifica-se que o
coeficiente de correlação é melhor que o obtido na relação do potencial
eletroquímico do NO versus k-NO.
0,0 0,2 0,4 0,6 0,8 1,0 1,2
1870 1880 1890 1900 1910 1920 1930 1940 1950
SO32-(cis) νNO
(c
m
-1 )
k-NO (s-1)
Y = 1946 -65,5*X r2 = 0.86
ImN
SO32-(trans)
Figura 16 – Correlação entre a constante k-NO e a banda de estiramento NO no infravermelho.
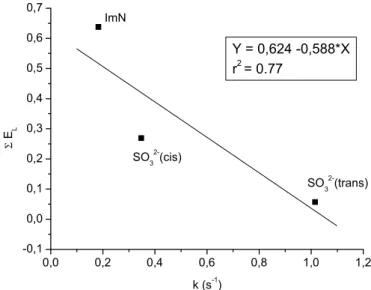
Para modulação de complexos de rutênio, Lever introduziu uma série de
parâmetros[33, 42] dependentes dos ligantes coordenados aos centro meálicoa partir
dos quais era possível estimar o potencial redox do centro metálico no complexo
formado. Utilizando este tipo de parâmetro(ΣEL), uma vez que o potencial redox do
NO é dependente dos outros ligantes, e sua relação com a constante k-NO
verifica-se uma relação verifica-semelhante à do potencial do NO, verifica-sendo ela mostrada na figura
0,0 0,2 0,4 0,6 0,8 1,0 1,2 -0,1
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
SO32-(trans) SO32-(cis)
Σ
EL
k (s-1)
Y = 0,624 -0,588*X r2 = 0.77
ImN
Figura 17 – Correlação entre a constante k-NO e o somátorio dos parâmetros de Lever.
1.2 Complexos trans-[Ru(NH3)4LNO]Cl3 , onde L = cafeína ou teofileno
O comportamento eletroquímico dos complexos trans-[Ru(NH3)4LNO]3+, onde
L = cafeína e teofileno é semelhante aos complexos anteriores, com a ocorrência
de um processo reversível referente ao NO+ coordenado, sendo o potencial de
pico catódico em -345 mV para o complexo com cafeína e -440 mV para o
complexo com teofileno, potenciais em relação a Ag/AgCl. Os voltamogramas
cíclicos são mostrados nas Figuras 18 e 19.
1000 500 0 -500 -1000
20 10 0 -10 -20 -30
i
(
μ
A)
E (mV, vs Ag/AgCl)
Figura 18 – Voltamograma cíclico do íon complexo trans-[Ru(NH3)4cafeínaNO]3+ em solução
aquosa de NaCF3COO 1 Mol L -1
600 400 200 0 -200 -400 -600 -800 -10
0 10 20 30 40
i
(
μ
A)
E (mV, vs Ag/AgCl)
Figura 19 – Voltamograma cíclico do íon complexo trans-[Ru(NH3)4teofilenoNO] 3+
em solução aquosa de NaCF3COO 1 Mol L-1, pH 3,4. Potencial aplicado usando eletrodo de carbono vítreo
como trabalho e Ag/AgCl como referência.
Era de se esperar que os potenciais de redução dos complexos com os
ligantes cafeína e teofileno fossem próximos, com o valor de potencial do ligante
cafeína ligeiramente menor. Agrega-se a isso a informação retirada do espectro
vibracional na região do infravermelho, onde as bandas de estiramento da ligação
N-O ocorrem em regiões próximas. A discrepância entre os potenciais pode ser
creditada à existência de uma ionização no ligante teofileno (pKa = 3,2) no meio
utilizado para a caracterização eletroquímica (pH = 3,4), enquanto na cafeína esta
ionização possui um pka de 6,6.[29] A perda do próton leva uma melhor capacidade
de doação de elétrons do ligante, causando assim uma melhora na retrodoação
para o NO e por conseguinte levando seu potencial de redução para valores mais
negativos.
A constante de velocidade k-NO calculada para os complexos foi de 0,543 s-1
para o complexo de cafeína e em torno de 3 s-1 para o complexo com teofileno. Se
adicionarmos a estes o complexo trans-[Ru(NH3)4Imk2NO]3+ que possui um
potencial de meia onda de –503 mV e constante de aquação de 4 s-1 [29, 32, 33]
obteremos um gráfico de correlação, mostrado na Figura 20, onde a tendência de
k-NO decrescer com aumento do potencial redox do NO coordenado também é
-600 -550 -500 -450 -400 -350 0,5
1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5
Y = -4,39 -0,035*X r2 =0,90
k-N
O
(s
-1 )
ENO (mV, vs Ag/AgCl) Imk2
teo
caf
Figura 20 – Correlação entre a constante k-NO e o potencial do NO coordenado.
Ao comparar-se os dados obtidos de valores de potencial de meia onda do
NO em relação à constante k-NO para os complexos de tetraaminas de rutênio com
ligantes imidazólicos coordenados via carbono, bipiridinas de rutênio mostrados
anteriormente com complexos de tetraaminas de rutênio com ligantes
N-heterocíclicos[33] são obtidas retas, mostradas na figura 21.
-0,5 -0,4 -0,3 -0,2 -0,1 0,0 0,1 0,2 0,0
0,5 1,0 1,5 2,0 2,5 3,0 3,5
4,0 N-heterocíclos
k-N
O
,
s
-1
ENO , V vs Ag/AgCl
bipiridinas
Imidazólicos via carbono
Observa-se que as inclinações das retas são diferentes, o que reflete a
diferente densidade eletrônica no metal criada pela retrodoação nas bipiridinas,
inexistente nas tetraaminas, e pelo caráter π retirador dos N-heterocíclos em
relação ao caráter π doador dos imidazóis via carbono. A boa linearidade
encontrada para os complexos de imidazóis via carbono é algo a ser destacado
uma vez que o composto [Ru(NH3)4Imk2NO]3+ era agrupado na literatura
juntamente com as tetraaminas com N-heterocíclos e consistia em um ponto fora
da correlação, o que leva-se a concluir que as comparações devem ser realizadas
apenas entre sistemas semelhantes, em todas as características, mesmo que
2.0 – Correlação dos cálculos de DFT e resultados experimentais
O estudo de DFT (density functional theory – teoria do funcional da
densidade) foi dividido em três partes. Inicialmente realizou-se uma otimização da
geometria do complexo até a ausência de freqüências imaginárias. O base
utilizada para os complexos com bipiridinas foi a DND e para os complexos de
tetraaminas foi a DNP. A partir desta geometria otimizada retirou-se informações
de comprimento e ângulos de ligações, energia e forma de orbitais, para veirificar
alguma tendência entre estas propriedades calculadas e os resultados
experimentais.
Em um segundo momento realizou-se uma análise populacional de
Mulliken, de onde a partir da carga nuclear e da densidade eletrônica sobre ele e
sua participação em ligações químicas obtém-se um valor de carga no qual quanto
mais positiva, maior a deficiência de elétrons.
Por fim obteve-se o espectro vibracional na região do infravermelho e
realizou-se a comparação do espectro experimental, obtido em pastilha de KBr e o
teórico de modo a comparar os resultados e assim ter uma noção da proximidade
entre os resultados teóricos e experimentais por comparação direta de uma
mesma propriedade.
2.1 – Complexos [Ru(bpy)2LNO]
3+
e funcional LDA - PWC
As estruturas resultantes das otimizações de geometria para os complexos
são mostradas nas Figuras 22 a 25. Observou-se para as estruturas que os anéis
das bipiridinas encontram-se não se encontram no mesmo plano, o que contribui
para sua não equivalência química, observada no espectro de ressonância
magnética nuclear obtido experimentalmente. [27, 43] Experimentalmente é sabido
que todos os complexos estão na forma NO+ e, portanto seria esperada uma
[Ru(bpy)2SO3NO]+ possui o NO coordenado em sua forma angular, o que é o
oposto do esperado pelos dados experimentais.[28]
Figura 22 – Estrutura otimizada com o funcional LDA - PWC do íon complexo cis -[Ru(bpy)2isnNO]3+.
Figura 24 – Estrutura otimizada com o funcional LDA - PWC do íon complexo cis -[Ru(bpy)2SO3NO]
+
.
Figura 25 – Estrutura otimizada com o funcional LDA - PWC do íon complexo trans -[Ru(bpy)2SO3NO]+.
A partir das estruturas otimizadas foram obtidos o ângulo Ru-N-O e os
valores das distâncias das ligações Ru-N e N-O sendo seus valores mostrados na
Tabela 4.
Tabela 4 – Valores teóricos para as distâncias de ligação N-O e o ângulo Ru-N-O para os complexos.
Complexo Distância da
ligação Ru-N
Distância da
ligação N-O
Ângulo Ru-N-O
cis-[Ru(bpy)2isnNO]3+ 1,807 1,14 179,3º
Cis-[Ru(bpy)2ImNNO]3+ 1,79 1,136 175,8º
As distâncias de ligação Ru-N e N-O para os complexos cis são coerentes
com as encontradas em estruturas de raios X de complexos semelhantes, que
possuem em sua formulação o ligante em sua forma NO+.[44-47] O complexo trans
apresentou ligações mais longas, portanto mais fracas em relação os demais
complexos.
Para os complexos cis ao observar-se a distância da ligação Ru-N(do NO)
obtém-se uma ordem de força da ligação semelhante à deduzida pelos dados
eletroquímicos, de onde se havia sugerido que a ligação entre o NO e o centro
metálico seria mais forte para o complexo com sulfito e mais fraca para o
complexo com isonicotinamida. Ao realizar-se a mesma comparação com a
ligação N-O, porém verifica-se que o complexo com isonicotinamida que deveria
possuir o menor valor possui uma distância de ligação intermediária, deste modo
comprometendo a linearidade da correlação(a explicação para este
comportamento pode estar nas considerações realizadas para o cálculo não
serem adequadas para o complexo com isonicotinamida). (Figuras 26 e 27)
-200 -100 0 100 200 300 400 1,770 1,775 1,780 1,785 1,790 1,795 1,800 1,805 1,810
dRu-n = 1,78 + 4,6*10-5E1/2
r2 = 0,80
D ist â n c ia R u -N (d o N O ) (A n g s tr o n )
ENO (mV, vs Ag/AgCl) SO3
2-ImN
isn
-200 -100 0 100 200 300 400 1,136 1,138 1,140 1,142 1,144 1,146 1,148
y = 1,441 - 2,030*10-4*X r2 = 0,67
D ist â n ci a N -O (An g st ro n )
ENO (mV, vs Ag/AgCl) SO3
2-ImN
isn
Figura 27 – Correlação entre o potencial do NO coordenado e a distância N-O.
Ao comparar-se o ângulo Ru-N-O com a ordem de caráter da forma NO+
retirada dos potenciais redox do NO, verifica-se que quanto maior o caráter de
NO+ (tendo assim um maior valor de potencial) mais próximo de 180º é o ângulo.
Na Figura 28 é mostrada a correlações entre o potencial do NO experimental e o
ângulo Ru-N-O para os complexos cis.
-200 -100 0 100 200 300 400
171 172 173 174 175 176 177 178 179 180 Ân g u lo R u -N -O ( g ra u s )
ENO (mV, vs Ag/AgCl) Y = 175,1 + 9,68*10-3*X
r2 = 0,82
SO3
2-ImN isn
A análise dos orbitais dos complexos mostrou primeiramente que os orbitais
LUMO (lowest unoccupied molecular orbital – orbital molecular desocupado de
energia mais baixa) estão distribuídos como correspondentes ao orbital
antiligantes da ligação π entre os orbitais π* do NO e d do metal, embora outros
orbitais dos outros ligantes também possam fazer parte da combinação que deu
origem ao LUMO.O caráter π* deste orbital faz com que sua ocupação diminua a
ligação π entre o metal e o NO.[48] As Figuras 29 a 32 mostram os orbitais LUMO
dos complexos e a Tabela 5 as energias relativas destes orbitais.
Tabela 5 - Energia do orbital LUMO para os complexos.
Complexo Energia do LUMO
cis-[Ru(bpy)2isnNO]3+ -0,4909
cis-[Ru(bpy)2ImNNO]3+ -0,5043
cis-[Ru(bpy)2SO3NO]+ -0,2527
trans-[Ru(bpy)2SO3NO]+ -0,2442
Figura 30 – Orbital LUMO do íon complexo cis-[Ru(bpy)2ImNNO] 3+
.
Figura 31 – Orbital LUMO do íon complexo cis-[Ru(bpy)2SO3NO] +
Ao analisar-se as energias dos orbitais LUMO e relaciona-las ao potencial
de redução do NO (uma vez que o elétron da redução é colocado neste orbital)
verifica-se um comportamento semelhante ao obtido com a comparação da
distância da ligação N-O. O complexo com isonicotinamida apresentou um valor
intermediário, conforme mostrado na Figura 33, quando o esperado seria um
menor valor, devido ao maior potencial de redução do complexo.
-200 -100 0 100 200 300 400 -0,60 -0,55 -0,50 -0,45 -0,40 -0,35 -0,30 -0,25 -0,20 -0,15 -0,10
Y = -0,34 -5,4*10-4*X
r2 =0,90
En e rg ia d o L U MO
ENO (mV, vs Ag/AgCl) SO3
2-ImN
isn
Figura 33 – Correlação entre a energia do orbital LUMO e o potencial redox do NO coordenado.
A análise de população de Mulliken foi utilizada para verificar a carga
relativa do grupo NO. É importante lembrar que um valor positivo para a carga de
um átomo não necessariamente diz que a carga deste átomo está carregado
positivamente uma vez que a mudança do funcional ou da base pode levar a uma
troca de sinal da carga(comparar por exemplo os resultados com o funcional GGA
– BLYP mostrado adiante). Além disso, para o presente estudo as cargas
individuais doa átomos de N e O do NO foram somadas para avaliar-se o grupo
NO como um todo. Quanto maior o valor da carga de Mulliken, maior será a
deficiência de elétrons do grupo NO. Essa análise é necessária por o grupo NO+
ser susceptível a ataques nucleofílicos,[49, 50] havendo a possibilidade, por
exemplo, de ele reagir com íons hidróxidos presentes na água formando o
respectivo nitrocomplexo de acordo com a reação química mostrada na equação
[Ru(bpy)2LNO]n+ + 2OH-→[Ru(bpy)2LNO2](n-2)+ + H2O (Equação VII)
A constante de equilíbrio da reação acima limita o pH onde o
nitrosilocomplexo é encontrado em solução. O valor de pKNO é o valor de pH onde
o nitrosilocomplexo e nitrocomplexo encontram-se em iguais quantidades em
solução, sendo o nitrosilocomplexo majoritário em valores de pH inferiores a pKNO.
Os valores de carga estão listados na Tabela 6.
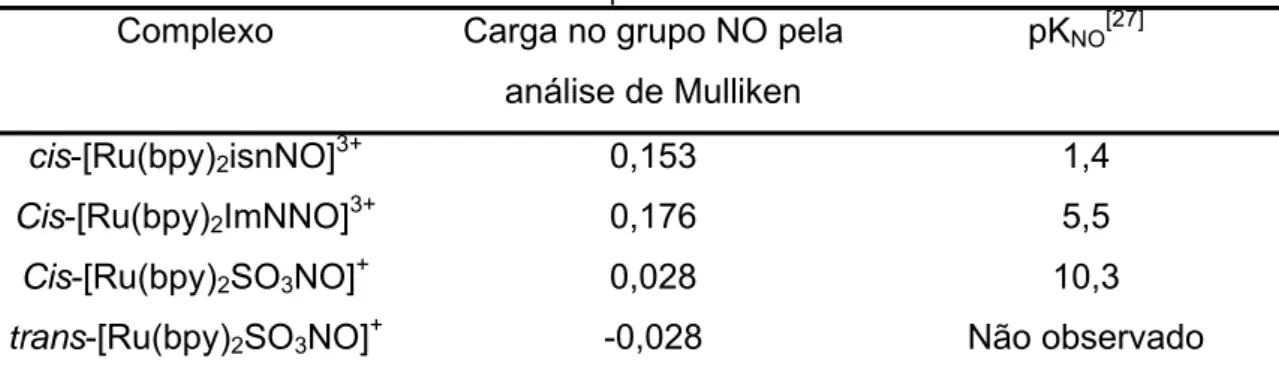
Tabela 6 - Carga teórica no grupo NO pela análise de Mulliken e pKNO experimental para os
complexos.
Complexo Carga no grupo NO pela
análise de Mulliken
pKNO[27]
cis-[Ru(bpy)2isnNO]3+ 0,153 1,4
Cis-[Ru(bpy)2ImNNO]3+ 0,176 5,5
Cis-[Ru(bpy)2SO3NO]+ 0,028 10,3
trans-[Ru(bpy)2SO3NO]+ -0,028 Não observado
Pelos potenciais de redução do NO nos complexos e pelos valores de pKNO
apresentados esperava-se que o complexo com isonicotinamida possuísse um
maior valor de carga no NO, o que não foi observado. Porém essa inversão entre
isonicotinamida e imidazol é concordante com os resultados calculados de
comprimento de ligação N-O e energia do orbital LUMO, o que reforça a idéia que
as condições de cálculo utilizadas neste método não são adequadas para exprimir
o comportamento do NO no complexo com isonicotinamida. O complexo trans
mostrou possuir uma maior densidade eletrônica em torno do NO, mostrado por
sua baixa carga e tal resultado era esperado por seu baixo potencial de redução
eletroquímica e sua não reação com OH- mesmo a altas concentrações do
mesmo, o que indica uma baixa carga positiva em relação aos demais.
Os espectros vibracionais na região do infravermelho calculados e
experimentais são mostrados nas Figuras 34 a 37. De modo geral é observada

![Figura 23 – Estrutura otimizada com o funcional LDA - PWC do íon complexo cis- cis-[Ru(bpy) 2 ImNNO] 3+](https://thumb-eu.123doks.com/thumbv2/123dok_br/15320249.553395/48.892.302.590.525.882/figura-estrutura-otimizada-funcional-lda-pwc-complexo-imnno.webp)