Universidade de Trás-os-Montes e Alto Douro
Avaliação histopatológica e
imunohistoquímica da implantação
subcutânea de membrana de colagénio em
ratos diabéticos
Dissertação de Mestrado em Bioquímica
Vanessa Natália dos Santos Silva
Orientador: Profª. Doutora Adelina Gama Quaresma
Co-orientador: Prof. Doutor Bruno Colaço
Universidade de Trás-os-Montes e Alto Douro
Avaliação histopatológica e
imunohistoquímica da implantação
subcutânea de membrana de colagénio em
ratos diabéticos
Dissertação de Mestrado em Bioquímica
Vanessa Natália dos Santos Silva
Orientador: Profª. Doutora Adelina Gama Quaresma
Co-orientador: Prof. Doutor Bruno Colaço
Composição do Júri:
________________________________________________________
________________________________________________________
________________________________________________________
“The great thing in this world is not so much where we stand, as in what direction we are moving.”
AGRADECIMENTOS
Ao concluir este trabalho não poderia deixar de expressar o meu agradecimento a um conjunto de pessoas que tornaram possível a sua realização.
À minha orientadora, Professora Doutora Adelina Gama, gostaria de expressar os meus sinceros agradecimentos pela colaboração, ensinamentos e disponibilidade que sempre revelou ao longo da execução deste trabalho.
Ao meu co-orientador, Professor Doutor Bruno Colaço, os meus sinceros agradecimentos pela preocupação, disponibilidade, paciência e ensinamentos ao longo de todo o trabalho.
Ao Professor Doutor Jorge Colaço, pela ajuda no tratamento estatístico dos dados, pela simpatia e boa disposição.
Às doutorandas Ana Faustino e Antonieta, pela disponibilidade e colaboração, pela amizade, ensinamento e ajuda na execução de algumas técnicas.
Ao Laboratório de Histologia e Anatomia Patológica da Universidade de Trás- os-Montes e Alto Douro, pela cedência do espaço e reagentes para a realização deste estudo.
À direção do Mestrado em Bioquímica, pela simpatia e prontidão em esclarecer dúvidas. Aos meus pais, Manuel Silva e Natália Silva, por todo apoio, carinho e paciência, que sempre manifestaram, nos bons e maus momentos, por acreditarem em mim e me incentivarem a seguir os meus sonhos, sem eles nada disto teria sido possível.
Ao João Pedro Batista, pelo apoio, pela paciência, pelos momentos de alegria, por acreditar em mim e nas minhas capacidades.
Aos meus amigos de sempre pela amizade, companheirismo, bons momentos e por todo o apoio que sempre manifestaram ao longo destes anos.
Aos meus amigos e companheiros de Mestrado e de Vila Real que me proporcionaram excelentes vivências, pela amizade, apoio e prontidão em ajudar.
RESUMO
A diabetes mellitus é uma doença complexa e potencialmente debilitante, que afeta milhões de indivíduos em todo o mundo e é já considerada um problema de saúde pública pela Organização Mundial de Saúde (OMS). A diabetes tipo 1 é caraterizada pela destruição autoimune das células β pancreáticas dos ilhéus de Langerhans e a diabetes tipo 2 pela resistência periférica à insulina levando ao desenvolvimento da hiperglicemia. A hiperglicemia crónica afeta negativamente a regeneração e remodelação óssea, atrasando assim, a cicatrização óssea e aumentando a suscetibilidade de doenças periodontais. Deste modo, na regeneração guiada de tecidos, é necessária a utilização de um biomaterial adequado que promova a regeneração tecidular em condições diabéticas. Neste estudo, avaliou-se a biocompatibilidade in vivo de uma membrana de colagénio num modelo animal diabético, particularmente, a reação inflamatória aguda (48 h) e crónica (3 semanas) após implantação subcutânea.
Neste trabalho foram utilizados 14 ratos machos da estirpe Wistar, divididos em 4 grupos: Controlo (n=3) e Diabetes (n=3) 48h e Controlo (n=3) e Diabetes (n=5) 3 semanas. A condição diabética foi introduzida através da administração intraperitoneal de 50 mg/kg de estreptozotocina (STZ). Foi realizada uma cirurgia no dorso dos animais onde foi efetuada a implantação subcutânea de membranas de colagénio. Um grupo controlo e um grupo com animais diabéticos foram sacrificados 48 horas após a implantação do biomaterial, e os animais dos restantes grupos foram sacrificados 3 semanas após a implantação. Foram recolhidas amostras de pele dos locais de implantação que foram avaliadas por histopatologia, com contagem total e diferencial das células inflamatórias, através da coloração de hematoxilina e eosina (H&E). Para caracterizar o infiltrado inflamatório linfocitário, foi efetuada a técnica de imunohistoquímica (IHQ) com os anticorpos CD3, BLA e CD79.
Observamos que o número total de células inflamatórias foi superior nos animais controlo, sendo esta diferença mais acentuada às 48h após implantação. Relativamente à contagem diferencial, verificou-se que às 48h se observa uma maior percentagem de neutrófilos, enquanto nos grupos sacrificados às 3 semanas se obteve uma percentagem superior de linfócitos e macrófagos. Relativamente aos resultados obtidos na IHQ, os animais controlo apresentaram maior percentagem de linfócitos marcados com CD3 (linfócitos T) e menor percentagem de linfócitos marcados com BLA e CD79 (linfócitos B), do que os animais diabéticos.
A membrana de colagénio demonstrou ser bastante biocompatível, apresentando uma resposta inflamatória moderada às 3 semanas. Os grupos diabéticos (48h e 3 semanas) apresentaram diferenças na resposta inflamatória em relação aos grupos controlo, nomeadamente no que se refere ao número de células e à sua tipologia. O STZ administrado para induzir a diabetes possui um efeito imunossupressor que pode estar na origem do menor número de células inflamatórias nos animais diabéticos. Ainda não são claros os mecanismos subjacentes ao tipo celular presente no infiltrado inflamatório após implantação da membrana de colagénio em condições diabéticas. No entanto, é possível que a hiperglicemia possa estar na origem do menor número de linfócitos T observado na condição diabética, não afetando a presença de linfócitos B. Deste modo, a diminuição da resposta imune em condições diabéticas pode estar associada fundamentalmente a uma diminuição dos linfócitos T.
ABSTRACT
Diabetes mellitus is a complex and potentially debilitating disease that affects millions of individuals worldwide and it is considered a public health problem by the World Health Organization (WHO). Type 1 diabetes is characterized by autoimmune destruction of pancreatic β cells of the islets of Langerhans, and type 2 diabetes by peripheral insulin resistance leading to the development of hyperglycemia. Chronic hyperglycemia negatively affects bone remodeling and regeneration, delaying bone healing and increasing the susceptibility of periodontal diseases. Therefore, in guided tissue regeneration, the use of a suitable material that promotes tissue regeneration in diabetic conditions is required. In this study, we evaluated the in vivo biocompatibility of a collagen membrane in a diabetic animal model, particularly the acute (48 hours) and chronic (3 weeks) inflammatory reaction after subcutaneous implantation.
In this study, 14 male Wistar rats were used, divided into four groups: Control (n=3) and Diabetes (n=3) 48h and Control (n=3) and Diabetes (n=5) 3 weeks. The diabetic condition was introduced via intraperitoneal administration of 50 mg/kg of streptozotocin (STZ). A surgery was performed on the back of the animals, where the implantation of collagen membranes was subcutaneously performed. A control group and one group of diabetic animals were sacrificed 48 hours after the implantation of the biomaterial and the other two groups were sacrificed 3 weeks after implantation. Skin samples of the implantation sites were collected and evaluated by histopathology, with total and differential counts of inflammatory cells, after staining with hematoxylin and eosin (H&E). To characterize the lymphocytic inflammatory infiltrate, immunohistochemistry (IHC) was performed with CD3, CD79 and BLA antibodies.
The total number of inflammatory cells was higher in the control animals, with a more evident difference at 48h after implantation. Regarding the differential counts, it was found that at 48h a higher percentage of neutrophils was present, while in the animals sacrificed at 3 weeks, a higher percentage of lymphocytes and macrophages was observed. Regarding the results obtained in IHC, control animals showed a higher percentage of CD3-positive lymphocytes (T lymphocytes) and a lower percentage of BLA and CD79-positive lymphocytes (B lymphocytes) than diabetic animals.
The collagen membrane was shown to be highly biocompatible, having a moderate inflammatory response at 3 weeks post implantation. The diabetic groups (48 hours and 3 weeks) showed differences in the inflammatory response compared to control groups, in
particular regarding the number of inflammatory cells and their type. STZ has an immunosuppressive effect that may be associated with fewer inflammatory cells in the diabetic animals. The mechanisms underlying cell type presence in the inflammatory infiltrate in diabetic conditions are not yet clear. However, it is possible that hyperglycemia can cause the smaller number of T lymphocytes observed in the diabetic condition, without affecting the presence of B lymphocytes. Therefore, the decrease of the immune response in diabetic conditions might be mainly associated with a decrease in T lymphocytes.
ÍNDICE
I. REVISÃO BIBLIOGRÁFICA ...1 1. Introdução ... 1 2. Diabetes ... 2 2.1. Classificação da diabetes ... 2 2.2. Fisiopatologia da diabetes ... 42.3. Modelos animais da diabetes ... 5
2.3.1. Modelos animais para diabetes tipo 1 ... 5
2.3.2. Modelos animais para diabetes tipo 2 ... 8
3. Biomateriais ... 8
3.1. Classificação dos biomateriais ... 9
3.1.1. Materiais bioinertes ... 9 3.1.2. Materiais bioativos ... 10 3.1.3. Materiais bioabsorvíveis ... 10 3.2. Tipos de biomateriais ... 10 3.2.1. Metais ... 10 3.2.2. Cerâmicos ... 10 3.2.3. Polímeros ... 11 3.2.4. Compósitos ... 11 3.3. Biodegrabilidade ... 11 3.4. Biocompatibilidade ... 13
4. Resposta do hospedeiro após implantação ... 14
4.1. Aspetos Gerais ... 14
4.2. Lesão, interação sangue/material e formação da matriz provisória ... 15
4.2.1. Adsorção proteica ... 16
4.2.2. Adesão celular ... 17
4.2.3. Integrinas ... 17
4.2.4. Sistema do complemento ... 18
4.3. Inflamação ... 20
4.3.1. Resposta inflamatória aguda ... 21
4.3.1.1. Mediadores químicos na resposta inflamatória ... 23
4.3.2. Resposta inflamatória crónica ... 25
4.4. Tecido de granulação ... 27
4.5. Resposta de corpo estranho ... 28
4.6. Formação do encapsulamento fibroso ... 28
4.7. Resposta inflamatória na diabetes ... 29
5. Regeneração guiada de tecidos ... 29
5.1. RGT em condições diabéticas ... 30
5.2. Membranas ... 31
5.2.1. Membranas não reabsorvíveis ... 31
5.2.2. Membranas reabsorvíveis ... 32
5.3. Colagénio ... 32
5.3.1. Estrutura e biossíntese do colagénio ... 33
5.4. Membranas de colagénio ... 36
II. OBJETIVOS ...38
III. MATERIAL E MÉTODOS ...39
1.Animais ... 39 2. Protocolo experimental ... 40 2.1. Indução da diabetes ... 40 2.2. Implantação de biomateriais ... 41 2.3. Sacrifício ... 41 3. Avaliação histopatológica ... 42
3.1. Coloração de Hematoxilina-Eosina (H&E) ... 42
3.1.1. Avaliação quantitativa de células inflamatórias ... 43
3.2. Técnica de Imunohistoquímica (IHQ) ... 43
3.2.1 Avaliação quantitativa de linfócitos ... 44
4. Análise estatística ... 45
IV. RESULTADOS ...46
1. Experimentação animal ... 46
1.1. Variação do peso corporal ... 46
1.2. Consumo médio de água e comida ... 46
1.3. Peso absoluto dos órgãos ... 47
1.4. Peso relativo dos órgãos ... 47
2. Análise histopatológica ... 49
2.1. Contagem e diferenciação das células inflamatórias ... 49
2.2. Imunohistoquímica ... 52 2.2.1. CD3 ... 52 2.2.2. BLA ... 54 2.2.3. CD79 ... 56 V. DISCUSSÃO ...59 VI. CONCLUSÕES ...66
VII. PERSPETIVAS FUTURAS ...67
ÍNDICE DE FIGURAS
Figura 1 - Mecanismo de secreção de insulina pelas células β pancreáticas . ...5
Figura 2 - Processos que ocorrem depois da implantação de um biomaterial ao longo do tempo. ...16
Figura 3 –Vias de ativação do Sistema do complemento: via clássica, via alternativa e via da lectina ...20
Figura 4 - Variação temporal da inflamação aguda, crónica e tecido de granulação em resposta ao implante de biomateriais ...22
Figura 5 - Processo da biossíntese do colagénio.. ...36
Figura 6 - Padrão de marcação dos animais. ...39
Figura 7 - Cronograma do protocolo experimental ...40
Figura 8 - Sacrifício dos animais através da técnica de exsanguinação cardíaca. ...42
Figura 9 - Média do peso corporal inicial e final dos 4 grupos de animais ...46
Figura 10 - Média da comida e água consumida por grupo por semana. ...47
Figura 12 - Média do peso relativo dos órgãos dos animais de cada grupo.. ...48
Figura 11 - Média do peso absoluto dos órgãos dos animais de cada grupo. ...48
Figura 13 – Média do número total de células inflamatórias contadas em 10 campos, com objetiva de 40x, nos diferentes grupos.. ...49
Figura 14 - Percentagem da media de neutrófilos, linfócitos, plasmócitos e macrófagos visualizados em cada campo ao microscópio com objetiva de 40x presentes nas amostras de pele de cada um dos grupos de animais ...51
Figura 15 - Análise histológica da pele dos animais diabéticos e controlo que foram eutanasiados 48 horas (A e B) e 3 semanas (C e D) após a implantação, observando-se o implante de membrana de colagénio e infiltrado inflamatório adjacente... ...52
Figura 16 – Valores da percentagem de células CD3-positivas, obtidos a partir da contagem de células marcadas e o total de células presentes em cada campo, para os diferentes grupos experimentais.. ...53
Figura 17 - Análise imunohistoquímica anti-CD3, sendo observada positividade maior no grupo CTR 48h. ...54
Figura 18 – Valores da percentagem de células BLA-positivas, obtido a partir da contagem de células marcadas e o total de células presentes em cada campo, para os diferentes grupos experimentais.. ...55
Figura 19 - Análise imunohistoquímica anti-BLA na periferia do implante em cada um dos grupos experimentais ...56
Figura 20 - Valores da percentagem de células CD79-positivas, obtido a partir da contagem de células marcadas e o total de células presentes em cada campo, para os diferentes grupos experimentais ...57
Figura 21 - Análise imunohistoquímica anti-CD79 na periferia do implante em cada um dos grupos experimentais. ...58
ÍNDICE DE TABELAS
Tabela 1 - Modelos animais da diabets tipo1 e tipo 2 . ...6
Tabela 2 - Tipos de biomateriais, alguns exemplos e aplicações. ...12
Tabela 3 - Conteúdo da ISO 10933: Avaliação biológica de dispositivos médicos. ...14
Tabela 4 - Sequência da resposta do hospedeiro após implantação do biomaterial . ...15
Tabela 5 - Citocinas e quimiocinas envolvidas na inflamação. ...24
Tabela 6 - Exemplos de alguns marcadores de linfócitos ...27
Tabela 7 – Algumas aplicações médicas do colagénio. ...33
Tabela 8 - Caraterização dos tipos de colagénio e a sua distribuição nos tecidos. ...34
Tabela 9 - Anticorpos utilizados na IHQ e as diferentes adaptações ao protoloco para cada um deles. ...44
Tabela 10 - Média do número total de cada tipo celular observado por campo. ...50
Tabela 11 - Média das células CD3-positivas visualizadas por campo referentes a cada um dos diferentes grupos. ...53
Tabela 12 - Média das células BLA-positivas visualizadas por campo referentes a cada um dos diferentes grupos. ...55
Tabela 13 - Média das células CD79-positivas visualizadas por campo referentes a cada um dos diferentes grupos. ...57
LISTA DE SIGLAS E ABREVIATURAS
ATP – trifosfato de adenosina BSA – albumina sérica bovina Ca2+ – catião cálcio
CD – clusters de diferenciação
CGM – células gigantes multinucleadas CoA – coenzima A CTR – controlo DM – diabetes mellitus h – horas H&E – Hematoxilina-Eosina IFN – interferão IHQ – imunohistoquímica IP – intraperitoneal IV – intravenosa IL – interleucina K+ – ião potássio
LFA-1 – antigénio 1 associado à função leucocitária MCP – proteína quimiotátita de monócitos
mL – mililitro
MIP – proteína inflamatória de macrófagos OMS – Organização Mundial de Saúde PBS – tampão fosfato salino
PCL – poli(e-caprolactona) PGA – poli(ácido glicólico) PLA – poli(ácido lático)
PMN – células polimorfonucleares PTFE – politetrafluoroetileno
RGT – Regeneração Guiada de Tecidos S – semana
STZ – estreptozotocina
Apresentações Orais:
Desta dissertação de mestrado foi apresentada uma comunicação oral nas
IX Jornadas de Bioquímica, realizadas nos dias 13 e 14 de Abril de 2016, na
Universidade de Trás-os-Montes e Alto Douro, intitulada:
"Avaliação histopatológica e imunohistoquímica de membrana de colagénio
em ratos diabéticos"
I. REVISÃO BIBLIOGRÁFICA
1. Introdução
A diabetes mellitus é uma doença sistémica que se divide em vários grupos: diabetes tipo 1, diabetes tipo 2, diabetes gestacional e outros tipos de diabetes. A diabetes tipo 1 está associada com a destruição das células β pancreáticas, responsáveis pela produção de insulina, e a diabetes tipo 2 é caraterizada pela resistência à insulina. Ambos os casos estão associados a um aumento dos níveis de glicose na corrente sanguínea que frequentemente remete para complicações crónicas (Heydari et al., 2010). Desta forma, o desenvolvimento de novos biomateriais, bem como a melhoria dos já existentes, em condições diabéticas reveste-se de grande relevância para a melhoria da qualidade de vida dos pacientes com diabetes.
Um biomaterial pode ser definido como um material ou dispositivo médico que pode substituir, executar ou aumentar uma função do corpo de um indivíduo. Assim, os biomateriais devem possuir determinadas características que possibilitem a sua integração e o desenvolvimento da sua função nos sistemas vivos. A biocompatibilidade é uma das características principais dos biomateriais uma vez que consiste na capacidade do material para desencadear uma resposta apropriada por parte do hospedeiro (Schmalz e Bindslev, 2009). No entanto, o processo de implantação de um biomaterial provoca uma lesão do tecido local que desencadeia uma resposta inflamatória localizada. A severidade da resposta inflamatória é influenciada pela biocompatibilidade do material que pode mesmo vir a ser rejeitado pelo organismo. A cicatrização do tecido lesado é um processo complexo onde participam uma grande variedade de componentes celulares que atuam de modo a restabelecer a integridade do tecido. Embora a cicatrização seja um processo natural, pode ser influenciada negativamente por vários fatores como a hiperglicemia crónica desenvolvida em pacientes diabéticos (Marchand et al., 2012). Deste modo, é necessário o desenvolvimento de novas terapias que possam atenuar os efeitos provocados pela diabetes.
A Regeneração Guiada de Tecidos (RGT) consiste num procedimento cirúrgico que utiliza membranas como barreiras com o fim de auxiliar o crescimento do osso e impedir a migração do tecido conjuntivo e epitelial para o defeito; no entanto, em condições diabéticas este processo é dificultado devido à hiperglicemia. Assim, é necessária a utilização de um biomaterial adequado que possa fornecer um ambiente favorável à regeneração óssea em condições diabéticas (Eliezer et al., 2013). As membranas de colagénio são utilizadas em procedimentos de reparação óssea orais. Estas membranas podem ser utilizadas na RGT
promovendo a cicatrização do tecido (Almazrooa et al., 2014). O colagénio foi já extensivamente estudado como biomaterial em condições normais, porém não são conhecidos todos os mecanismos subjacentes à sua implantação em condições diabéticas.
2. Diabetes
A diabetes mellitus pertence a um grupo de doenças metabólicas e é caracterizada por elevados níveis de glicose no sangue (Malecki, 2005). Esta hiperglicemia resulta da incapacidade do organismo para produzir insulina, na falha do efeito da insulina nos tecidos alvo ou de ambas as situações. Deste modo, se a diabetes não for tratada ou diagnosticada precocemente, pode levar a um estado de hiperglicemia persistente que tem como resultado o dano de alguns tecidos e órgãos, reduzindo assim a esperança média de vida dos pacientes com diabetes (Zimmet, 2001).
A diabetes é reconhecida como um problema de Saúde Pública. Segundo a Organização Mundial de Saúde (OMS), a diabetes afeta cerca de 10% de indivíduos adultos mundialmente e se as tendências atuais se mantiveram, prevê-se que mais de meio bilião de indivíduos desenvolvam diabetes até 2030 (Narayan et al., 2000; Whiting et al., 2011). Segundo o Observatório Nacional da Diabetes, em Portugal, cerca de 13,4% da população (mais de um milhão de pessoas) foi diagnosticada com esta patologia (OMS, 2014).
Os primeiros sintomas da diabetes são hiperglicemia, poliúria, polidipsia, polifagia e perda de peso (Okon et al., 2012).
A diabetes mellitus é uma doença crónica que desencadeia diversas alterações a longo prazo e que pode mesmo levar à morte do indivíduo. O tratamento da diabetes destina-se a regular e otimizar a hiperglicemia, que se não for tratada contribui para complicações micro e macrovasculares. No caso das microvasculares destacam-se neuropatia, aterosclerose, nefropatia, retinopatia, disfunção eréctil e doenças periodontais. A doença vascular periférica, doenças cardiovasculares e doenças cerebrovasculares são exemplos de complicações macrovasculares (Javed e Romanos, 2009; Navarro-González et al., 2011; Bassi et al., 2012; Katakami et al., 2014; Semeraro et al., 2015; Sun et al., 2015).
2.1. Classificação da diabetes
A diabetes mellitus é normalmente classificada como: tipo 1, tipo 2, gestacional ou outros tipos específicos de diabetes (ADA, 2015).
A diabetes tipo 1, ou insulinodependente, é uma doença autoimune pois carateriza-se por uma destruição progressiva das células β pancreáticas através de uma resposta inflamatória, celular e humoral mediada por linfócitos T e B (Devendra, 2004; Daneman, 2006). Existem alguns marcadores da destruição imune das células β, como por exemplo auto-anticorpos de insulina e auto-anticorpos das células dos ilhéus de Langerhans. Estes e outros anticorpos característicos desta doença podem ser detetados no soro dos indivíduos portadores desta condição meses ou anos antes da manifestação da doença (Couper, 2009; Vermeulen et al., 2011). O desenvolvimento deste tipo de diabetes está relacionado com a predisposição genética; no entanto, fatores ambientais podem acelerar ou retardar a lesão das células β (Boettler e von Herrath, 2011; Ghazarian et al., 2013). Este tipo de diabetes tem maior prevalência em crianças e adolescentes, sendo a cetoacidose (níveis elevados de corpos cetónicos) o primeiro sintoma, seguido de hiperglicemia (Dabelea et al., 2014). Devido à destruição das células β ocorre uma supressão da secreção de insulina sendo por isso necessário, para indivíduos com esta doença, uma suplementação de insulina exógena (DeWitt e Hirsch, 2003).
A diabetes tipo 2 é caraterizada por uma deficiência relativa de insulina assim como, a sua resistência por parte dos tecidos. Existem vários fatores associados ao desenvolvimento desta doença, como a predisposição genética e fatores ambientais; no entanto, a obesidade é a maior causa da resistência à insulina. Os ácidos gordos livres estão presentes em maiores concentrações em indivíduos obesos e como consequência a oxidação de ácidos gordos livres aumenta nos orgãos-alvo, o que leva a uma redução na utilização da glicose levando, deste modo, a uma resistência à insulina (Dandona et al., 2004; Bilan et al., 2009; Ginter e Simko, 2013). Devido à resistência à insulina, os tecidos alvo não recebem insulina suficiente, o que leva a um aumento da produção de insulina por parte das células β. Esta sobreprodução de insulina resulta numa disfunção das células β que posteriormente leva a uma produção deficiente de insulina, contudo não ocorre destruição completa destas células. A diabetes tipo 2 não tem sintomas clínicos visíveis no início da doença, pelo que pode estar presente durante um longo período sem ser detetada (Rhodes, 2005).
A diabetes gestacional pode ser definida como intolerância à glicose, que surge durante a gravidez (Ferrara, 2007). A diabetes gestacional está associada a complicações a curto ou longo prazo, tanto para a mãe como para o filho. Normalmente, este tipo de diabetes desaparece com o fim da gravidez; no entanto, se não for devidamente tratada, pode evoluir para diabetes tipo 2 (Jovanovic e Pettitt, 2001; Nehring et al., 2013).
Existem outros tipos específicos de diabetes, embora tenham uma incidência muito menor do que os anteriores, que podem surgir devido a defeitos genéticos das células β, defeitos genéticos na ação da insulina, outras doenças ao nível do pâncreas, infeções ou causados por drogas ou químicos (Thomas e Philipson, 2015).
2.2. Fisiopatologia da diabetes
As células necessitam de glicose pois é uma fonte de energia imediata. As células cerebrais e os eritrócitos dependem quase exclusivamente da glicose. Para um normal funcionamento do organismo é necessário uma concentração constante de glicose entre 90 a 100 mg/dl na corrente sanguínea (Basu et al., 2009).
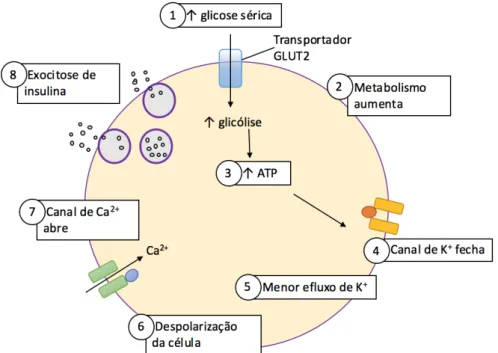
A insulina é uma hormona que é produzida pelas células β dos ilhéus de Langerhans do pâncreas e degradada predominantemente no fígado. Esta hormona controla a homeostase da glicose uma vez que promove a sua absorção nos tecidos periféricos e suprime a gluconeogénese no fígado (Muoio e Newgard, 2008). A libertação da insulina é regulada por vários fatores e intermediários metabólicos e é desencadeada em resposta ao aumento da concentração de glicose na corrente sanguínea. A glicose penetra nas células β através de um transportador de glicose (GLUT 2) presente na superfície da membrana destas células dando início à glicólise. A enzima glicocinase fosforila a glicose levando à formação da acetil-coenzima A (CoA) de trifosfato de adenosina (ATP). Devido ao aumento dos níveis de ATP dentro da célula, os canais de K+ sensíveis ao ATP vão ser inibidos diminuindo assim o efluxo de K+ que vai levar à despolarização da membrana. Deste modo, ocorre a abertura dos canais de Ca2+ e o influxo destes iões. O aumento da concentração de Ca2+ no interior das células β desencadeia a libertação de insulina para o espaço extracelular e para a circulação (Figura 1) (Miolina, 2007).
A insulina chega aos tecidos alvo e liga-se aos recetores de insulina presentes na superfície das células (o recetor mais comum é o GLUT 4) o que permite a captação da glicose para o interior das células onde é posteriormente convertida em energia. Quando os níveis de glicose na corrente sanguínea baixam, a secreção de insulina cessa. A resistência periférica à insulina é devida a um decréscimo no número de recetores da insulina ou a um mau funcionamento dos mesmos. Deste modo, a glicose não é captada para o interior das células alvo resultando em hiperglicemia. No entanto, a diabetes tipo 2 só se verifica aquando da falência das células β pancreáticas, uma vez que estas continuam a secretar insulina em resposta aos elevados níveis de glicose no plasma, o que leva à morte destas células e que
resulta numa diminuição de secreção de insulina. Na diabetes tipo 1, com a destruição das células β, a secreção de insulina é inexistente (Kim et al., 2008; Lin e Sun, 2010).
2.3. Modelos animais da diabetes
Os modelos animais têm sido largamente utilizados no estudo da diabetes. Existe uma grande variedade de animais que representam bons modelos para a indução da diabetes, bem como diferentes métodos para a indução (Rees e Alcolado, 2005).
2.3.1. Modelos animais para diabetes tipo 1
A diabetes tipo 1 consiste na destruição autoimune das células β pancreáticas. Este tipo de diabetes pode ser desencadeado por diversos mecanismos como a destruição das células β por agentes químicos, modelos que desenvolvam a diabetes espontaneamente, modelos induzidos geneticamente ou por vírus (Tabela 1).
Tabela 1 - Modelos animais da diabets tipo1 e tipo 2 (adaptada de King, 2012).
Método de
Indução Modelo Caraterísticas principais Possíveis utilizações
Diabetes tipo 1
Indução Química Dose única de STZ Modelo simples para hiperglicemia
Novas formulações de insulina
Aloxano Modelos para transplantação
Várias doses de STZ Modelo de indução de
insúlite Tratamentos para prevenção da destruição das células β
Modelo espontâneo Murganho NOD Rato BB Ratos LEW.1AR1/iddm
Destruição das células β devido ao processo
auto-imune
Perceber a genética e mecanismo da diabetes tipo 1 Tratamentos para prevenção da
destruição das células β Tratamentos que possam manipular o processo auto-imune Rato BB
Ratos LEW.1AR1/iddm
Induzido
geneticamente Murganho AKITA
Destruição das células β Dependente de insulina
Novas formulações da insulina Modelos de transplantação
Induzido por vírus
Vírus Coxsackie B Destruição das células β induzida por infeções
víricas Estabelecer o papel do vírus no desenvolvimento da diabetes tipo
1 Vírus da
encefalomiocardite Vírus de rato Kilham
Vírus LCMV Diabetes tipo 2 Modelos obesos Murganho Lepob/ob Murganho Leprdb/db Rsto ZDF Hiperglicemia induzida por obesidade
Tratamentos para melhorar a resistência à insulina Tratamentos para melhorar o funcionamento das células β Alguns modelos demonstram
complicações da diabetes Murganho KK Murganho NZO Murganho Tally/Jng Murganho NoncNZO10/LtJ Obesidade induzida Alimentação com elevada gordura Hiperglicemia induzida por obesidade
Tratamentos para melhorar a resistência à insulina
Gerbilo do deserto Tratamentos para melhorar o
funcionamento das células β Tratamentos para prevenir a obesedidade induzida pela dieta Rato Nile Grass
Modelos não
obesos Rato GK
Hiperglicemia induzida por funcionamento insuficiente das células β
Tratamentos para melhorar o funcionamento e sobrevivência das células β Modelos da disfunção das células geneticamente induzida Murganho AKITA
Deposição amilóide dos ilhéus
Tratamentos para evitar a deposição amilóide Tratamentos para melhorar a
sobrevivência das células β Murganho hIAPP Destruição das células β Tratamentos para melhorar a
Relativamente à utilização de agentes químicos para a indução da diabetes, este é um método bastante eficaz, que pode ser utilizado tanto em animais pequenos como de grande porte. Os dois agentes mais utilizados são a estreptozotocina (STZ) e o aloxano, que se incorporam seletivamente no interior das células β através dos recetores GLUT 2 e induzem a diabetes através de dois mecanismos: inibem a glicocinase (enzima responsável pela fosforilação de glicose) e induzem a formação de espécies reativas de oxigénio que provocam a morte das células β (Lenzen, 2008). O método de indução química possui a desvantagem de os agentes químicos utilizados serem tóxicos para outros órgãos do animal, nomeadamente fígado, pulmão, rim, intestino e cérebro (King, 2012). O STZ pode ser administrado numa dose única ou em várias doses através de uma injeção intraperitoneal ou intravenosa. Quando se utiliza uma única dose (100 a 200 mg/kg em murganhos e 35 a 65 mg/kg em ratos) ocorre, num curto espaço de tempo, uma depleção das células β e consequentemente hiperglicemia. No entanto, o STZ pode levar também a uma diminuição de linfócitos e um aumento das células T reguladoras (Muller et al., 2011). Doses múltiplas de STZ são utilizadas para induzir a diabetes com o objetivo principal de estudar as vias imunológicas que levam à morte das células β e à inflamação dos ilhéus de Langerhans (Rees e Alcolado, 2005). As doses de aloxano utilizadas variam desde 50 a 200 mg/kg em murganhos e 40 a 200 mg/kg em ratos (King, 2012).
Alguns modelos animais desenvolvem a diabetes tipo 1 espontaneamente. Estes animais são obtidos por criação seletiva em laboratório e os mais utilizados na investigação são o murganho NOD, os ratos BB, LETL, KDP e LEW-iddm (Chatzigeorgiou et al., 2009).
As infeções provocadas por vírus podem aumentar ou desencadear doenças auto-imunes como a diabetes tipo 1. Alguns tipos de vírus podem levar à destruição direta das células β pancreáticas ou ao desenvolvimento de uma resposta auto-imune contra as células β levando ao aparecimento da diabetes tipo 1. Alguns vírus foram utilizados para induzir a diabetes em roedores wild-type e ratos BB (Jun e Yoon, 2003; Filippi e von Herrath, 2008; Chatzigeorgiou et al., 2009). No entanto, a indução da diabetes por vírus ainda não está bem esclarecida, uma vez que foi demonstrado que embora os vírus possam desencadear uma resposta auto-imune também são responsáveis pela prevenção de doenças auto-imunes dependendo das circunstâncias (Filippi e von Herrath, 2008; von Herrath et al., 2011).
2.3.2. Modelos animais para diabetes tipo 2
A diabetes tipo 2 é caracterizada pela resistência à insulina pelos tecidos, acompanhada pela progressiva deficiência na secreção de insulina que consequentemente leva à hiperglicemia. Os modelos animais utilizados para o estudo da diabetes tipo 2 são maioritariamente animais obesos uma vez que a obesidade está diretamente relacionada com este tipo de diabetes. Outros modelos animais incluem obesidade induzida, modelos não obesos e modelos da disfunção das células geneticamente induzida (Tabela 1).
A obesidade pode ocorrer naturalmente nos animais ou pode ser conseguida através de manipulação genética. Algumas estirpes de modelos animais obesos desenvolvem rapidamente a hiperglicemia, outras conseguem manter os níveis de glicose normais compensados por uma resposta elevada das células β na secreção de insulina. Este tipo de modelos é utilizado para estudar o mecanismo do desenvolvimento da diabetes em indivíduos obesos (Rees e Alcolado, 2005). A obesidade pode também ser induzida através de uma alimentação rica em gordura fornecida aos animais (Hariri e Thibault, 2010).
Estes modelos animais permitem também a avaliação de biomateriais, nomeadamente, a sua biocompatibilidade. A utilização de modelos animais no estudo de biomateriais permite avaliar o tecido circundante do implante assim como de outros tecidos (importante para o estudo de migração de detritos derivados do material) que não seria possível em pacientes humanos (Pearce et al., 2007; Cavalu et al., 2014). Animais de pequeno porte são os mais utlizados no estudo de biomateriais poliméricos, de modo minimizar os custos e as questões éticas do uso de animais de maior porte, sendo o rato o animal escolhido com mais frequência (Wang et al., 2010).
3. Biomateriais
Um biomaterial é um qualquer material ou dispositivo médico que executa, aumenta ou substitui uma função natural de um organismo de modo a melhorar a qualidade de vida dos indivíduos (Tathe et al., 2010).
A primeira evidência da utilização de um biomaterial data do ano 600 com o uso de conchas como dentes artificiais. Embora não houvesse conhecimento de biocompatibilidade, infeção ou esterilidade nesse tempo, os dentes de conchas conseguiram obter a osteointegração. Ao longo dos anos os materiais de origem natural foram utilizados em implantes, principalmente para substituir tecido perdido. Só no século XX é que os materiais
de origem natural começaram a ser substituídos por materiais sintéticos tais como polímeros, cerâmicos e metais (Ratner, 2004).
A área dos biomateriais estuda as interações entre os materiais e os sistemas biológicos. Esta área tem vindo a evoluir a um grande ritmo nestes últimos anos e têm-se criado biomateriais para vários fins, desde implantes simples, como lentes intra-oculares para restaurar a visão a indivíduos com cataratas, até materiais mais complexos que executam tarefas mecânicas no corpo. Recentemente, os investigadores têm desenvolvido biomateriais que não se limitam a mimetizar partes do corpo mas a integrarem-se tão fielmente no corpo que este os aceita como parte dele, podendo gerar novos vasos da pele, cartilagem e sangue (Seal et al., 2001). Os biomateriais podem ser implantes ou dispositivos médicos. Dentro dos implantes podemos ter: válvulas cardíacas, placas ósseas e próteses. São exemplos de dispositivos médicos os pacemakers, órgãos artificiais e biossensores (Ramakrishna, 2001).
Os biomateriais podem ser classificados quanto às suas características, ao modo como reagem quando são implantados, biocompatibilidade e biodegradabilidade.
3.1. Classificação dos biomateriais
Quando um biomaterial é implantado no organismo, os tecidos reagem de variadas formas, dependendo do tipo de material implantado. Essa reação é provocada pelo contacto direto entre o tecido e a superfície do implante. Deste modo, existem três categorias distintas para classificar os vários tipos de biomateriais: materiais bioinertes, bioativos e bioreabsorvíveis.
3.1.1. Materiais bioinertes
Os materiais bioinertes, quando implantados, não iniciam uma resposta ou têm uma interação mínima com o tecido envolvente. Este tipo de materiais foi desenvolvido porque os materiais que iniciam resposta no organismo podem futuramente ser rejeitados pelo hospedeiro (Blokhuis, 2007).
Vulgarmente, ocorre a formação de uma cápsula fibrosa à volta de um implante bioinerte, assim a biofuncionalidade do material depende da integração do implante no tecido. Alguns exemplos de biomateriais bioinertes são titânio, carbono, zircórnia e aço (Tur, 2009).
3.1.2. Materiais bioativos
Um biomaterial bioativo pode ser definido como: “aquele que provoca uma resposta biológica específica na interface do material, que resulta na formação de uma ligação entre o tecido e o material” (Hench et al., 1972). Por conseguinte, um material bioativo, depois de ser implantado, interage com o osso ou tecidos envolventes. A hidroxiapatite, vidro e óxido de alumínio são alguns exemplos de materiais bioativos (Heness e Ben-Nissan, 2004).
3.1.3. Materiais bioabsorvíveis
Os biomateriais bioabsorvíveis são materiais que, depois de implantados, começam a dissolver-se e são substituídos por tecido. Os implantes bioabsorvíveis são degradados e eventualmente são excretados ou reabsorvidos. Isto ocorre com uma perda de peso molecular, perda de força e posteriormente o material acaba por desaparecer completamente. Exemplos de biomateriais bioabsorvíveis são o colagénio e o fosfato tricálcico (Maurus e Kaeding, 2004).
3.2. Tipos de biomateriais
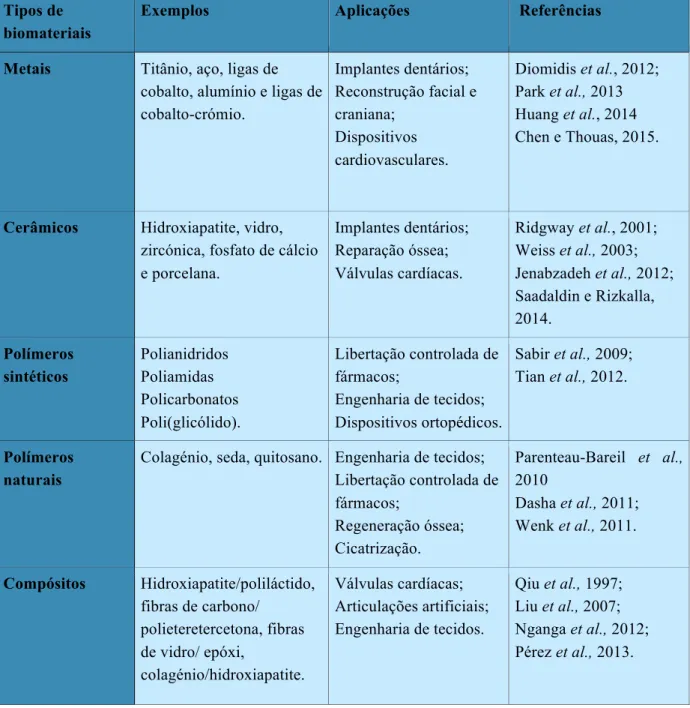
Os biomateriais podem ser organizados em grupos de acordo com as suas características físicas e químicas. Deste modo, os biomateriais podem dividir-se em: metais, cerâmicas, polímeros (sintéticos e naturais) e compósitos (Tabela 2) (Parida, 2012).
3.2.1. Metais
Os biomateriais metálicos têm elevado interesse devido à sua função estrutural, à sua elevada resistência e ao facto de serem inertes. Este material garante também um implante a longo prazo mesmo em situações de suporte de carga. No entanto, estes biomateriais não possuem algumas funcionalidades como bioatividade, resistência à corrosão, boa biocompatibilidade. Desta forma, para ultrapassar estas limitações, os materiais metálicos devem ser sujeitos a algumas modificações na sua superfície. O tipo de metal utilizado em implantes varia de acordo com o local do implante (Yang et al., 2004; Pilliar, 2009; Nasab e Hassan, 2010).
3.2.2. Cerâmicos
Um biomaterial cerâmico apresenta uma elevada resistência à corrosão, tem uma baixa condutividade elétrica e térmica e possui uma biocompatibilidade elevada. Todos estes
requisitos tornam os biomateriais cerâmicos adequados para implantes (Thamaraiselvi e Rajeswari, 2004).
3.2.3. Polímeros
Os materiais à base de polímeros são bastante utilizados na área da biomedicina. Existem dois tipos de polímeros: os sintéticos e os naturais. Os polímeros sintéticos derivam petróleo e os naturais têm origem na natureza. Apesar de os polímeros naturais apresentarem uma elevada biocompatibilidade, os polímeros sintéticos são mais utilizados, isto porque os sintéticos possuem melhores propriedades mecânicas e estabilidade térmica e podem ser produzidos em variadas formas (Leclerc et al., 2004; Sionkowska, 2011).
3.2.4. Compósitos
Os biomateriais compósitos consistem na junção de dois materiais distintos numa escala microscópica ou macroscópica. Este termo é normalmente utilizado para biomateriais em que os dois materiais que constituem o compósito estão separados numa escala maior do que a molecular e diferem significativamente nas suas propriedades (Christensen, 1979; Agarwal e Broutman, 1980).
3.3. Biodegrabilidade
A biodegradação é um processo que pode ser resultado de interações químicas, físicas e biológicas. Os biomateriais em contacto com os tecidos biológicos sofrem degradação progressiva mediada por uma atividade biológica específica, ou seja, quando os biomateriais estão em contacto com os fluidos corporais, devido às interações biológicas, químicas, físicas e mecânicas entre o material e o ambiente circundante, podem sofrer alterações nas suas propriedades físicas e químicas. O principal fator da degradação de biomateriais é a sua interação com os componentes do sistema imunitário. Polímeros naturais, como por exemplo o colagénio, sofrem degradação nos sistemas biológicos por oxidação e hidrólise (Kyrikou e Briassoulis, 2007).
Tabela 2 - Tipos de biomateriais, alguns exemplos e aplicações.
Tipos de biomateriais
Exemplos Aplicações Referências
Metais Titânio, aço, ligas de cobalto, alumínio e ligas de cobalto-crómio. Implantes dentários; Reconstrução facial e craniana; Dispositivos cardiovasculares. Diomidis et al., 2012; Park et al., 2013 Huang et al., 2014 Chen e Thouas, 2015.
Cerâmicos Hidroxiapatite, vidro, zircónica, fosfato de cálcio e porcelana. Implantes dentários; Reparação óssea; Válvulas cardíacas. Ridgway et al., 2001; Weiss et al., 2003; Jenabzadeh et al., 2012; Saadaldin e Rizkalla, 2014. Polímeros sintéticos Polianidridos Poliamidas Policarbonatos Poli(glicólido). Libertação controlada de fármacos; Engenharia de tecidos; Dispositivos ortopédicos. Sabir et al., 2009; Tian et al., 2012. Polímeros naturais
Colagénio, seda, quitosano. Engenharia de tecidos; Libertação controlada de fármacos; Regeneração óssea; Cicatrização. Parenteau-Bareil et al., 2010 Dasha et al., 2011; Wenk et al., 2011. Compósitos Hidroxiapatite/poliláctido, fibras de carbono/ polieteretercetona, fibras de vidro/ epóxi, colagénio/hidroxiapatite. Válvulas cardíacas; Articulações artificiais; Engenharia de tecidos. Qiu et al., 1997; Liu et al., 2007; Nganga et al., 2012; Pérez et al., 2013.
Os materiais biodegradáveis devem possuir algumas propriedades importantes para que possam funcionar corretamente nos sistemas biológicos, como: os seus produtos de degradação devem poder ser metabolizados e eliminados do organismo e não devem ser tóxicos, deve ter uma duração aceitável, não deve provocar uma reação inflamatória exagerada no organismo, o seu tempo de degradação deve estar de acordo com o tempo de regeneração ou de cura, deve apresentar propriedades mecânicas adequadas, permeabilidade e capacidade de processamento adequado para a aplicação pretendida (Lloyd, 2002; Naira e Laurencin, 2007).
3.4. Biocompatibilidade
O principal fator para distinguir um biomaterial de qualquer outro material é a capacidade do material estar em contato com os tecidos sem causar danos ao organismo. O termo biocompatibilidade é relativamente recente, uma vez que só nas últimas duas décadas é que foi formalmente descrito como “a capacidade de um material desempenhar uma função com uma resposta apropriada do hospedeiro numa situação específica” (Williams, 2008).
A biocompatibilidade consiste basicamente em segurança biológica e em biofuncionalidade. A segurança biológica consiste numa resposta apropriada do hospedeiro, não só sistémica mas também local. A biofuncionalidade traduz-se na capacidade do material para realizar uma função específica (Arshady, 2003; Schoen e Anderson, 2004). Deste modo, um biomaterial biocompatível não pode ser carcinogénico, tóxico ou alérgico, deve ser compatível com os tecidos envolventes e não deve provocar resposta inflamatória exagerada. Um material biocompatível é utilizado para fazer a interface com o sistema biológico para avaliar, tratar, aumentar ou substituir qualquer tecido, órgão ou função do corpo (Bauer et al., 2013).
Existem requisitos essenciais para que um material seja compatível (Ravaglioli, 1988):
-
O biomaterial não deve ser degradado pelos tecidos (se não for esse o objetivo);-
O biomaterial deve ter as características adequadas para produzir o efeito desejado;-
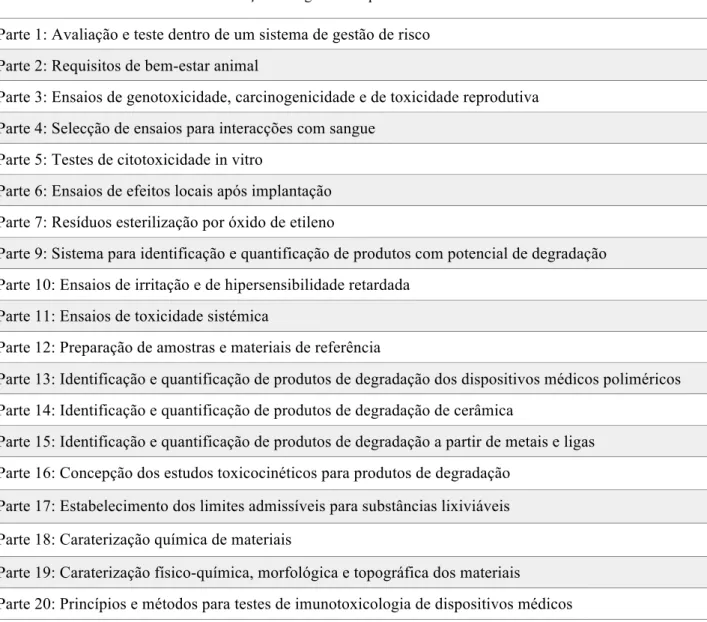
O biomaterial não deve provocar efeitos nocivos no sistema biológico.A avaliação da capacidade dos biomateriais realizarem as funções requeridas, com uma resposta adequada do hospedeiro, requer testes específicos e adaptados para compreender a resposta do hospedeiro. Deste modo, a avaliação dos biomateriais utilizados como dispositivos médicos deve cumprir as orientações definidas na norma ISO 10993 (EN 30993): Avaliação Biológica de Dispositivos Médicos (Tabela 3), aprovadas pelo Comité Europeu de Estandardização (ISO 10993-6, 2009).
Tabela 3 - Conteúdo da ISO 10933: Avaliação biológica de dispositivos médicos.
Parte 1: Avaliação e teste dentro de um sistema de gestão de risco Parte 2: Requisitos de bem-estar animal
Parte 3: Ensaios de genotoxicidade, carcinogenicidade e de toxicidade reprodutiva Parte 4: Selecção de ensaios para interacções com sangue
Parte 5: Testes de citotoxicidade in vitro
Parte 6: Ensaios de efeitos locais após implantação Parte 7: Resíduos esterilização por óxido de etileno
Parte 9: Sistema para identificação e quantificação de produtos com potencial de degradação Parte 10: Ensaios de irritação e de hipersensibilidade retardada
Parte 11: Ensaios de toxicidade sistémica
Parte 12: Preparação de amostras e materiais de referência
Parte 13: Identificação e quantificação de produtos de degradação dos dispositivos médicos poliméricos Parte 14: Identificação e quantificação de produtos de degradação de cerâmica
Parte 15: Identificação e quantificação de produtos de degradação a partir de metais e ligas Parte 16: Concepção dos estudos toxicocinéticos para produtos de degradação
Parte 17: Estabelecimento dos limites admissíveis para substâncias lixiviáveis Parte 18: Caraterização química de materiais
Parte 19: Caraterização físico-química, morfológica e topográfica dos materiais
Parte 20: Princípios e métodos para testes de imunotoxicologia de dispositivos médicos
A avaliação da biocompatibilidade de implantes e biomateriais requer um conhecimento da resposta inflamatória e da cicatrização aos materiais implantados. A inflamação, cicatrização e a reação ao corpo estranho são consequências da resposta do tecido à lesão provocada pelo implante.
4. Resposta do hospedeiro após implantação
4.1. Aspetos Gerais
Quando um biomaterial é implantado, as respostas adversas que surgem por parte do hospedeiro estão associadas com as interações entre os tecidos e a superfície do biomaterial. Além disso, produtos resultantes da degradação do material podem provocar uma reação mais adversa do hospedeiro. Assim, a implantação de um material desencadeia uma resposta dos
tecidos, que se baseia numa sequência de eventos num processo contínuo (Tabela 4) (Anderson, 2015).
O grau de compatibilidade do biomaterial pode ser determinado pela severidade da perturbação dos mecanismos homeostáticos, pelas condições fisiopatológicas criadas e pelo grau da resposta inflamatória (Morais et al., 2010).
Tabela 4 - Sequência da resposta do hospedeiro após implantação do biomaterial (adaptada de Anderson, 2015).
Dano/lesão
Interação sangue/material Formação provisória da matriz Inflamação aguda
Inflamação crónica Tecido de granulação Reação ao corpo estranho
Desenvolvimento da fibrose ou encapsulamento fibroso
4.2. Lesão, interação sangue/material e formação da matriz provisória
A lesão tem início com a cirurgia, ou seja, ocorre rutura dos vasos sanguíneos. Logo após a lesão, inicia-se a resposta inflamatória aguda, ativada pela saída das células sanguíneas, dos fluidos e proteínas da componente vascular e pelas interações destes com o material. Esta perturbação na homeostasia origina cascatas celulares do processo de cicatrização (Clark e Henson, 1996; Kumar et al., 2013).
A lesão originada pelo implante leva ao desenvolvimento da matriz provisória, responsável pelo processo de resolução, reorganização e reparação do tecido. É constituída por fibrina, células inflamatórias, plaquetas e células endoteliais. A fibrina é o componente mais abundante e desempenha o papel principal no desenvolvimento de neovascularização, ou seja, na formação de novos vasos (Shaw e Martin, 2009; Villar et al., 2011).
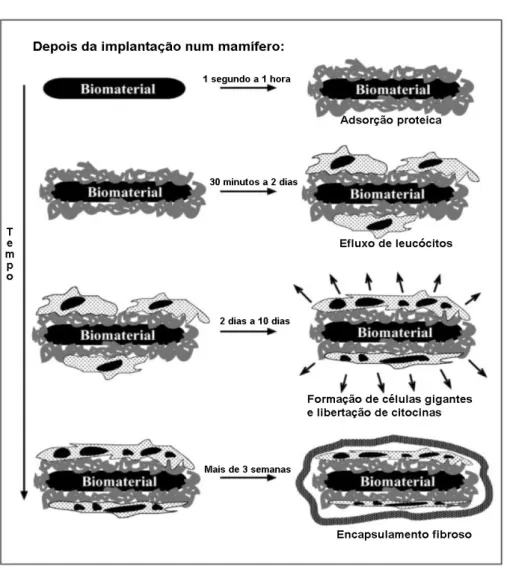
As interações biológicas com biomateriais são desencadeadas quando ocorre o contacto do biomaterial com o sangue. A interação entre ambos inclui a adsorção de proteínas, a adesão de leucócitos e a ativação do sistema de complemento, seguida depois pela inflamação e processos subsequentes (Figura 2). Poucos segundos após a implantação do biomaterial, as proteínas do sangue começam a adsorver à superfície do biomaterial. Estas
proteínas estão envolvidas na adesão molecular de leucócitos que são recrutados até ao local da inflamação.
4.2.1. Adsorção proteica
Quando um biomaterial entra em contato com o sangue ou fluidos intersticiais, as proteínas plasmáticas adsorvem imediatamente na superfície do material, uma vez que as proteínas são mais pequenas que as células inflamatórias e são as primeiras a chegar ao local do implante. A adsorção proteica é um processo importante na aceitação ou rejeição do biomaterial (Nonckreman et al., 2010; Franz, 2011). Quando as proteínas adsorvem na superfície do material, a sua estrutura tridimensional muda, o que permite a exposição de alguns epitopos na superfície, que antes não se encontravam expostos. Estes epitopos são
Figura 2 - Processos que ocorrem depois da implantação de um biomaterial ao longo do
locais de ligação de determinadas células que reconhecem o local e podem ligar-se através de recetores específicos presentes na superfície das células (Anderson et al., 2008; Franz, 2011). A reação do tecido vai depender do tipo, da quantidade, da conformação e orientação das proteínas adsorvidas, e estes dependem das características da superfície do material implantado. A adsorção de certas proteínas como a albumina, o fibrogénio, as globulinas e outras vai influenciar o processo de reação inflamatória e de cicatrização, uma vez que a interação das células inflamatórias é afetada pelo tipo de proteínas adsorvidas na superfície do implante (Allen et al., 2006; Anderson et al., 2008).
As interações entre as proteínas e a superfície do material envolvem forças de van der Waals, ligações de hidrogénio e interações hidrofóbicas e eletrostáticas (Roach et al., 2005; Xu e Siedlecki, 2007). A hidrofobicidade da superfície do biomaterial é o principal fator na adsorção proteica e mostrou influenciar vários processos como a ativação do complemento. Assim, a adsorção proteica pode ser vista como a capacidade das proteínas para a remoção da água na superfície do implante (Anderson, 2005).
4.2.2. Adesão celular
A adesão celular e a sua ativação em biomateriais ocorre devido à interação entre as proteínas adsorvidas na superfície do biomaterial e recetores de adesão. As células aderem utilizando um dos quatro grandes grupos de moléculas de adesão: integrinas, seletinas, mucinas e caderinas. A principal classe de recetores de adesão dos leucócitos são as integrinas, que regulam a migração celular, a deposição na matriz e as funções imunológicas. A ligação das integrinas a leucócitos promove a sobrevivência, diferenciação e ativação destas células (Norton et al., 2009; Lotfi et al., 2013).
4.2.3. Integrinas
As integrinas são os principais recetores de adesão e pertencem a uma grande família de proteínas transmembranares de superfície, heterodiméricas α β, que mediam tanto as interações célula-célula como célula-matriz (Lotfi et al., 2013). As integrinas desempenham um papel fundamental na organização, manutenção e reparação de vários tecidos, uma vez que proporcionam ancoragem e desencadeiam sinais que auxiliam a sobrevivência e migração celular e a expressão de fenótipos diferenciados (Danen e Sonnenberg, 2003).
O antigénio de superfície LFA-1 (antigénio 1 associado à função leucocitária) é expresso em todos os leucócitos e consiste numa subunidade α, também definida como CD11a. A integrina β2, também denominada CD18, é expressa especificamente nos leucócitos. A subunidade β2 pode associar-se com a subunidade α para formar heterodímeros como por exemplo a integrina Mac-1 e CD11c, ambas expressas em monócitos e macrófagos. As integrinas estão, normalmente, no estado de repouso e são ativadas por citocinas fazendo com que se liguem aos seus recetores (Hynes, 2002; Danen e Sonnenberg, 2003).
A CD11a está envolvida na adesão de leucócitos durante a resposta inflamatória e a Mac-1 é responsável pela adesão dos neutrófilos e monócitos. Já as integrinas β1 são responsáveis pela adesão de macrófagos e pela indução da fusão de macrófagos para formarem célula gigantes de corpo estranho, mediada pela Interleucina (IL) - 4 (Brodbeck et
al., 2003; Marques et al., 2005).
4.2.4. Sistema do complemento
O contacto do biomaterial com o sangue leva a ativação de vários sistemas sanguíneos, nomeadamente a coagulação e o sistema do complemento (Ekdahl et al., 2011).
O sistema do complemento faz parte da imunidade inata e é considerado um dos principais sistemas de defesa do hospedeiro na interação e remoção de substâncias estranhas. O sistema do complemento é constituído por mais de 60 componentes e fragmentos de ativação, que participam no processo de fagocitose das substâncias estranhas, na libertação de mediadores químicos da inflamação e no processo de lise celular. A ativação do sistema do complemento acontece alguns segundos após a lesão (Merle et al., 2015).
As funções principais do sistema do complemento ativado são:
• libertação de mediadores químicos da inflamação e de anafilatoxinas (por exemplo: C3a e C5a);
• formação do complexo de ataque à membrana; • opsonização da superfície do alvo;
• remoção de imunocomplexos (Kohl, 2006).
O complemento participa na remoção de complexos imunes e de células do próprio organismo que se encontram danificadas, contribuindo assim para a regeneração de órgãos. Este sistema interage também com as células B e T da resposta imune adaptativa (Sarma e Ward, 2011). A via alternativa é a mais relevante para os biomateriais, uma vez que é ativada
pela presença de superfícies estranhas. Uma vez ativado, o sistema de complemento participa no recrutamento e ativação de leucócitos (Nilsson et al., 2007).
A ativação do complemento faz parte do processo de inflamação desencadeado pela implantação de biomateriais e ocorre em 4 etapas:
1. ativação de uma das principais vias; 2. ativação da C3 convertase e amplificação; 3. ativação da C5 convertase;
4. atividade da via terminal (Zipfel e Skerka, 2009).
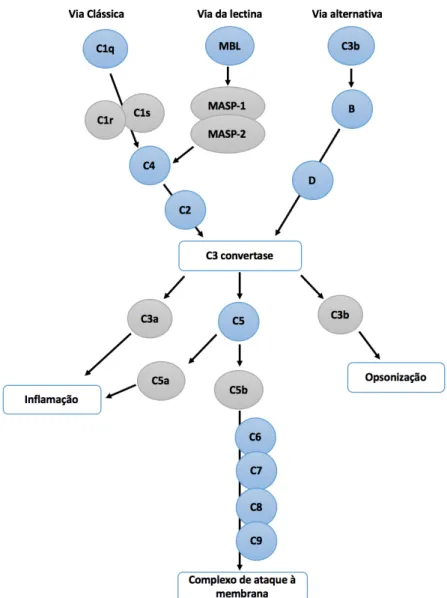
Existem 3 vias para a ativação do complemento: a via clássica, a via alternativa e a via da lectina (Figura 3). Todas as vias convergem na formação da C3 convertase, que é responsável pela clivagem do componente C3 em dois fragmentos C3a e C3b. A via clássica pode ser ativada pelos complexos imunes através da ligação da molécula de reconhecimento C1q. Após a ligação ocorre uma mudança na conformação da C1q que leva à ativação das proteases de serina C1r e C1s. Estas proteases estão localizadas na região da cauda da C1q. Ocorre a formação do complexo C4b2a, que consiste na convertase da via clássica, através da clivagem de C4 e C2 pela C1s. Nas 3 vias de ativação ocorre a formação de convertases C5 pela inclusão de uma molécula C3b na C3 convertase (Janeway et al., 2001; Merle et al., 2015).
A partir do nível da C5 convertase todas as vias seguem uma via terminal comum resultando na formação do complexo de ataque à membrana C5b-9 que ocorre através da ativação da C5 e ligação dos componentes do complemento C6, C7, C8 e C9. Este complexo possui a capacidade de formar poros nas membranas das células levando assim à perda de permeabilidade e consequentemente à lise celular (Ram et al., 2010; Merle et al., 2015).
C3a e C5a são dois fatores quimiotáticos que, quando interagem com os seus recetores, promovem a ativação celular e a quimiotaxia. As células alvo podem ser opsonizadas pelo C4b e C3b, o que leva à fagocitose e indução da imunidade adquirida (Monsinjon et al., 2003; Dunkelberger e Song, 2010).
4.3. Inflamação
A inflamação é originada pelo efluxo de leucócitos e moléculas do plasma ao local lesado, onde são desencadeados mecanismos reacionais característicos da inflamação. As primeiras células da linhagem branca a migrar para o foco da inflamação são os neutrófilos e permanecem durante vários dias. Mais tarde, começam a afluir ao local linfócitos T e quase simultaneamente linfócitos B. A migração dos linfócitos ativados, do sangue periférico para o local da inflamação, é dependente da expressão de moléculas localizadas à superfície, que são responsáveis pela adesão dos linfócitos a outras moléculas de adesão expressas no tecido endotelial. Estas moléculas de adesão pertencem à família das moléculas de adesão celular, das seletinas e integrinas. O processo de inflamação tem a função de neutralizar, conter, diluir
Figura 3 –Vias de ativação do Sistema do complemento: via clássica, via alternativa e via da lectina
ou isolar o corpo estranho que perturbou o sistema de homeostasia, como também dar início a processos de cura e reconstituição do tecido lesado. A duração da inflamação é influenciada pelas características químicas e físicas do biomaterial implantado assim como as suas dimensões. No entanto, a duração da inflamação também está relacionada com a biocompatibilidade, uma vez que se o biomaterial não for compatível, a reação inflamatória terá uma maior duração e intensidade até à rejeição do material (Tang e Eaton, 1995; Anderson, 2001; Bridges et al., 2010).
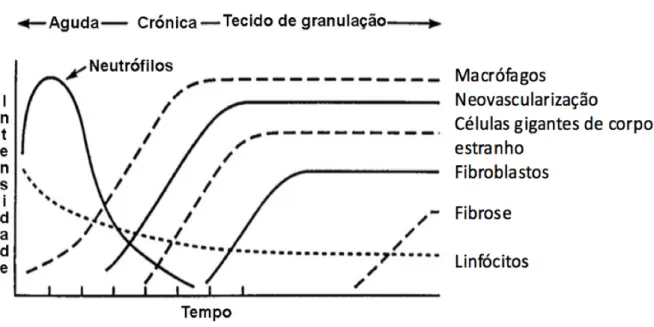
A resposta inflamatória aguda verifica-se alguns minutos após a lesão e pode durar até alguns dias (Figura 4). É durante a fase de inflamação aguda que se forma a matriz provisória e que ocorre a limpeza da lesão. Os vasos sanguíneos dilatam e ficam permeáveis a sais, água e proteínas, resultando em edema que tem como principal função diluir o agente nocivo (Onuki et al., 2008). Os leucócitos acumulam-se no local lesado através de vários processos que incluem migração, adesão, fagocitose e libertação extracelular de produtos. As principais células brancas da inflamação aguda são os neutrófilos e os monócitos. Estas células fagocíticas atuam de modo a remover material estranho (Kumar et al., 2013). Graças a estas células, pode ocorrer a degradação do biomaterial dependendo das suas características e propriedades; no entanto, os materiais não são geralmente fagocitados devido à disparidade de tamanho (Ratner et al., 2013). Uma reação inflamatória persistente dá origem a uma reação inflamatória crónica. A presença de linfócitos, plasmócitos e macrófagos no local do implante indicam uma reação inflamatória crónica. Os macrófagos desempenham um papel importante nesta fase da inflamação, uma vez que os macrófagos apresentam o antigénio às células imunocompetentes, iniciando assim a resposta imune (Bridges et al., 2010).
4.3.1. Resposta inflamatória aguda
Logo após a implantação de um biomaterial, são desencadeadas uma série de reações com o propósito de prevenir o dano do tecido, isolar e destruir o material estranho e iniciar o processo de reparação. Um dos primeiros processos é a resposta de fase aguda, que pode levar à destruição ou rejeição do material, ou à inflamação crónica (Anderson, 2001).
A interação entre o biomaterial e o sangue leva a uma alteração na concentração de alguns componentes do plasma como a proteína amilóide A sérica, proteína C-reativa, fibrinogénio ou alfa-1-antitripsina (Fournier et al., 2003). O sangue começa a coagular à volta do implante, consequentemente as proteínas sanguíneas e do tecido (imunoglobulinas, componentes do complemento, transferrina, albumina) entram em contacto com o material (Rihova, 2000). Posto isto, ocorre a adsorção de proteínas à superfície do biomaterial (Wilson
et al., 2005). Durante esta fase, sinais de estímulo no local do implante, mediados pelas
integrinas, dão início ao recrutamento de leucócitos, bem como a sua adesão na superfície do implante e à sua ativação (McNally e Anderson, 2002).
As células polimorfonucleares (neutrófilos, eosinófilos e basófilos) são o principal tipo de leucócitos presentes na fase aguda, sendo os neutrófilos os mais representativos pelo facto de serem as células brancas mais numerosas e por isso serem rapidamente recrutadas para o local do implante. Estas células migram dos vasos sanguíneos para os tecidos perivasculares e para o local do implante (Anderson, 2001; Anderson et al., 2008).
As células polimorfonucleares (PMNs) e as plaquetas associadas ao extravasamento sanguíneo libertam vários fatores que amplificam a resposta inflamatória e que são responsáveis pelo recrutamento de outras células da inflamação (Szpaderska et al., 2003).
Figura 4 - Variação temporal da inflamação aguda, crónica e tecido de granulação em resposta ao implante de
Algumas citocinas pro-inflamatórias ativam neutrófilos que migram através da parede de células endoteliais para o local da lesão, levando à expressão de vários tipos de moléculas fundamentais para a adesão e diapedese de leucócitos. Quando as PMNs entram em contacto com as proteínas e integrinas que revestem a superfície do implante iniciam o processo de fagocitose, libertando vários tipos de substâncias ativas e proteases (Nimeri et al., 2003; Eming et al., 2007). Normalmente, alguns dias depois da lesão o número de PMNs reduz-se significativamente sendo gradualmente substituídas por macrófagos e monócitos (Anderson et
al., 2008).
O efeito da lesão e do biomaterial in situ conduz as células a produzir fatores químicos que medeiam as respostas celulares da inflamação. Os principais mediadores químicos responsáveis pela fase aguda da inflamação são as citocinas IL-1, IL-6 e o factor de necrose tumoral (TNF)-α (Preshaw e Taylor, 2011).
4.3.1.1. Mediadores químicos na resposta inflamatória
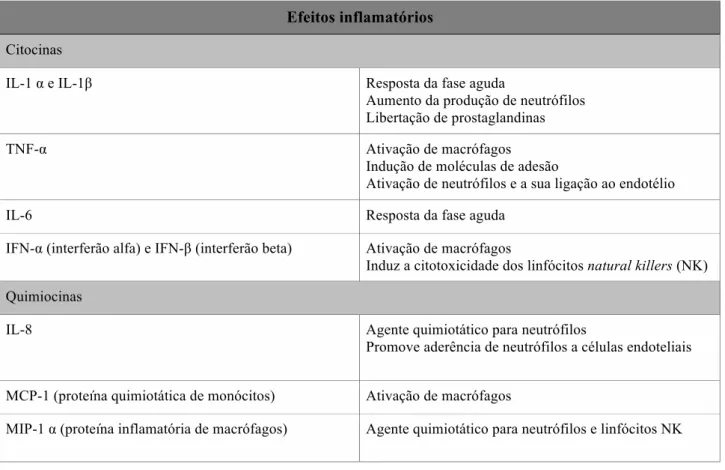
Os mediadores químicos possuem a capacidade de guiar a resposta do tecido após o implante de um biomaterial, ou seja, ajudam a direccionar a ação das células inflamatórias e de cicatrização. Os principais mediadores químicos envolvidos nestes processos são as citocinas, as quimiocinas e os fatores de crescimento. O progresso da inflamação e o sucesso da cicatrização dependem destes mediadores químicos que consistem em polipéptidos biologicamente ativos que alteram o crescimento, diferenciação e metabolismo das células alvo (Barrientos et al., 2008).
As citocinas são uma grande família de proteínas, péptidos e glicoproteínas que desempenham um papel de sinalização intercelular (Gonzales-Simon e Eniola-Adefeso, 2012). As citocinas são produzidas por uma grande diversidade de células como macrófagos, linfócitos, fibroblastos, células endoteliais e monócitos, e influenciam o comportamento de outras células através da sua ligação a recetores específicos. As quimiocinas são citocinas que possuem propriedades quimioatrativas e juntamente com as citocinas desempenham um papel fundamental na iniciação e manutenção da resposta inflamatória e no processo de cicatrização (Tabela 5) (Esche et al., 2005; Gonzales-Simon e Eniola-Adefeso, 2012). Os fatores de crescimento atuam como moléculas de sinalização entre células e estimulam o crescimento celular, a proliferação, a cicatrização e a diferenciação celular (Barrientos et al., 2008).