UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
KRISTIANA CERQUEIRA MOUSINHO
ESTUDO DO POTENCIAL ANTICÂNCER DE UM DERIVADO DE
CHALCONA, 1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona, IN VITRO E
IN VIVO
Universidade Federal do Ceará
Faculdade de Medicina
Departamento de Fisiologia e Farmacologia
Programa de Pós-Graduação em Farmacologia
ESTUDO DO POTENCIAL ANTICÂNCER DE UM DERIVADO DE
CHALCONA, 1
-(4-Nitrofenil)-3-fenilprop-2-en-1-ona
,
IN VITRO E IN
VIVO
Kristiana Cerqueira Mousinho
Tese submetida à Coordenação do programa de Pós-Graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará como requisito parcial para a obtenção do grau de Doutor em Farmacologia.
Orientador:
Prof
o.Dr
o. Manoel Odorico de Moraes Filho
Co-Orientadora:
Prof
a. Dr
a. Ivone Antônia de Souza
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
M892e Mousinho, Kristiana Cerqueira.
Estudo do potencial anticâncer de um derivado de chalcona, 1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona, in vitro e in vivo / Kristiana Cerqueira Mousinho. – 2010.
167 f. : il.
Tese (Doutorado) - Universidade Federal do Ceará. Faculdade de Medicina. Programa de Pós-Graduação em Farmacologia, Fortaleza, 2010.
Área de concentração: Oncologia Experimental. Orientação: Prof. Dr. Manoel Odorico de Moraes Filho.
1. Chalcona. 2. Toxicidade. 3. Antineoplásicos. I. Título.
ESTUDO DO POTENCIAL ANTICÂNCER DE UM DERIVADO DE CHALCONA, 1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona, IN VITRO E IN VIVO
KRISTIANA CERQUEIRA MOUSINHO
Tese submetida à coordenação do programa de Pós-graduação em Farmacologia como parte dos requisitos necessários para a obtenção do grau de Doutor em Farmacologia outorgado pela Universidade Federal do Ceará. A citação de qualquer trecho deste trabalho é permitida, desde que seja feita em conformidade com as normas da ética científica.
BANCA EXAMINADORA
__________________________________________________
Prof. Dr. Manoel Odorico de Moraes Filho (Orientador)Universidade Federal do Ceará – UFC
__________________________________________________
Profa. Dra. Ivone Antônia de Souza (Co-Orientadora)Universidade Federal de Pernambuco – UFPE
________________________________________________________ Profa. Dra. Caridad Noda Pérez
Universidade Estadual de Goiás – UEG
__________________________________________________
Profa. Dra. Marne Carvalho de VasconcellosUniversidade Federal do Amazonas - UFAM
__________________________________________________
Profa. Dra. Ana Paula Negreiros Nunes AlvesÀ minha Vovó Nadege (in memorian),
Que não conseguiu esperar o término
Desta etapa da minha vida,
Mas sei que está feliz por isso em
Algum lugar da esfera espiritual,
“Tudo é do Pai, toda honra e toda glória, é Dele a vitória alcançada em minha vida, tudo é do Pai se sou fraco e pecador, bem mais forte é o meu Senhor, que me cura por Amor”.
“Honra o teu médico por causa da necessidade, Pois foi o Altíssimo quem o criou, Porque toda a medicina provém de Deus, A ciência do médico o eleva em honra; Ele é admirado na presença dos grandes, O Senhor fez a terra produzir os medicamentos,
Agradecimentos
O câncer é uma doença grave e assustadora. Receber um diagnóstico de câncer é algo que ninguém consegue imaginar. Mas o que é ruim pode ser o início de uma mudança boa. E quando o exemplo dado não combina com a natureza, surge o momento da definição. O momento pede calma (quase que impossível) para olhar o que é preciso fazer adiante; prudência, para perceber as mudanças e coragem para enfrentar os desafios. Para os pacientes só resta recolher os cacos, organizar as idéias e simplesmente aceitar talvez a tarefa mais intensa de uma existência.
Quando trabalhamos com pessoas que sofrem desse mal, passamos a tentar compreender o que se tem por dentro de cada um. Agora eu vejo o imenso valor dos “Doutores da Alegria”, fazer alguém sorrir onde se tem muitos motivos para chorar é DIVINO. Quando se acredita, o belo surge e o verdadeiro permanece. O maior significado está nas pessoas e não nas palavras.
Foi por isso que resolvi sair um pouco de cena (da área clínica) e estudar muito para entender melhor o tratamento desses pacientes baseado nas substâncias antineoplásicas. Tratamento esse que compromete a qualidade de vida das pessoas. E como todo pesquisador dessa área passei a sonhar em testar substâncias que destruam o tumor e não o paciente, eis-me aqui concluindo o eis-meu doutorado.
Agradecer, neste momento, faz-se tão necessário quanto defender esta tese. As pessoas passam pela nossa vida nos dando sempre alguma lição, até o que não se fazer com os outros. Tudo é aprendizado.
Em primeiro lugar, como sempre em minha vida, agradeço a Deus, onipresente, onisciente e indefinível. Agradeço pela vida, pelos ensinamentos constantes e principalmente por ter desenhado a minha caminhada com perfeição, com o objetivo de me mostrar o real valor do AMOR, da CARIDADE e da FÉ.
A minha Virgem Santíssima, por me colocar no colo sempre que preciso. Por interceder junto a Jesus Cristo, por mim. E como mãe me consolar nos momentos de aflição. Também por me fazer sentir que eu nunca estou só.
Aos meus pais Gabriel e Nádja, aos meus anjos da guarda terrenos, por terem aceitado a missão de serem meus pais, e brilhantemente com ela, me ensinado valores essenciais a vida: AMOR, CARINHO, RESPONSABILIDADE e CARÁTER. Por terem acreditado na minha capacidade e sonhado comigo para que este dia chegasse. Agradeço a Deus por vocês serem à base da minha sustentação. Amo vocês.
A minha Titia Nazaré, minha segunda mãe e outro anjo que Deus pôs em minha vida, o meu sincero agradecimento. Por cuidar sempre de mim, sorrir e chorar comigo.
Aos meus irmãos Karinne e Diogo, amigos também, simplesmente uma parte de mim. Obrigada por existirem e fazerem a minha vida mais feliz. Agradeço também aos meus cunhados: Luciano e Julliany, pelos momentos de alegria vividos. As minhas sobrinhas Lívian
meu coração transbordando de amor cada vez que as encontro, sem vocês o meu mundo seria em preto e branco.
Ao Dr. Manoel Odorico de Moraes, pelo exemplo de competência e inteligência; por ter me aceitado como orientanda e me recebido no LOE sem se quer saber quem eu era, com uma importante acolhida que conforta, retira o medo e a ansiedade perante tudo o que é novo. Por ser a pessoa mais prática que eu conheço, tornado tudo mais simples. Agradeço por acreditar na minha capacidade intelectual, passando suas aulas para que eu pudesse ministrá-las.
A Dra. Ivone Antônia de Souza, um exemplo de Mestre. Agradeço por tudo, principalmente pelo apoio emocional que sempre tive na calmaria de sua voz e quando me dizes: “Kristiana, no final tudo dá certo”. Sem você eu não estaria aqui. Faltam palavras para dizer o que você representa na minha vida acadêmica.
A Dra. Letícia Lotufo, pelo carinho constante, apoio emocional e científico. Pelo exemplo de profissional, equilíbrio e atenção mesmo a quem não eram seus orientandos, mostrando sempre como se trabalhar em equipe.
A Dra. Claúdia Pessoa, pelo apoio, amizade e disponibilidades diárias. Pela organização dos seminários do LOE, enriquecedores de conhecimentos.
A Dra. Raquel Montenegro, pela amizade, disponibilidade e ajuda neste trabalho, com sugestões e orientações. Agradeço pela atenção nos momentos de desespero.
A Dra. Ana Paula Negreiros, pela ajuda nas análises das lâminas, disponibilidade e carinho com que sempre me tratou.
Em especial aos amigos: Arinice, Gabriela, Hemerson, Igor (Boy do LOE) e Washington Araújo, pela contribuição, paciência, aprendizado, disponibilidade e companheirismo, que me compreenderam nos momentos de aflição e os quais têm méritos junto a mim na realização desta tese.
Aos demais amigos do LOE: Adriana Carvalho (companheira das brincadeiras, dos experimentos e até das baixarias), Aline, Aline Sbardeloto, Ana Jérsia, Assuero, Bruno Cavalcante (pelos ensinamentos e contribuição nos experimentos), Bruninho (IC), Daisy (IC), Danilão, Delano Marinho, Diego, Daniel, Elthon Goés (pelos experimentos do BrdU nos finais de semana e feriados serem a maior descontração), Evelyne, Felipe, Gardênia, Hidemburgo (comedor de pipocas, porque a culpa é da Coca-cola), Kézia, Miller, Patrícia Marçal, Paula Abreu, Paula Jimenez, Paulo Michel, Rafael, Vanessa, Venúncia, pela companhia, risadas e colaboração nessa tese.
Agradeço ainda a Silvana (Sil), Erivanda, D. Rogéria e D. Fátima por todo apoio no que era necessário para a realização dos experimentos, pelas conversas “in off” altamente
reveladoras. A Flávia pelo imenso esforço em providenciar o material necessário para a conclusão desta tese e pelas conversas diárias.
Existem pessoas que foram imprescindíveis para a minha saúde física e psíquica nesta tese, pessoas que sempre deram desde o apoio logístico ao emocional. Pessoas que transpassam o limite da amizade e se tornam família, estrelas e não cometas, pérolas que Deus coloca no nosso caminho para rir, chorar, aprender coisas que jamais aprenderíamos sozinhos, fazer com que as batalhas sejam mais leves e curtas, são companheiros de toda uma vida. Deus me deu esta bênção de norte ao sul deste país. São eles: Cecília (minha irmã morena), José Roberto (caça e pesca Papicu, via Praia do Futuro, iieeiii), Vanesca, Cínthya e Cia, Silvéria e Alexandre, Deisy e Roberto César (Letícia), Roberta e Otacílio (Limoeiro, iiieeiii), Ana Carla e Júlio, Fabíola e Marne. Obrigada por vocês existirem.
Ao meu médico, Dr. Carlos Windson, por me atender sempre que precisei principalmente nas mazelas pré-tese. Valeu pelas amostras grátis!
A toda a minha família e amigos que sempre torceram por mim.
As secretárias do Programa de Pós-Graduação em Farmacologia, Aura Rhanes e Márcia, pela dedicação com o que fazem e por me ajudar em tudo o que precisei.
Aos servidores Alana, Ana Paula, Íris, Chiquinho, agradeço as conversas, cumplicidade e disponibilidade em sempre ajudar.
E por fim, a todos aqueles que padecem de algum tipo de câncer, onde a luta para se obter a cura ou o alívio é uma constante, torna-se incansável e infinitamente dolorosa no corpo e na alma. A Icla da Silva (in memorian), que me fez despertar a vontade de trabalhar nessa
área. A Iara da Silva e Ianara que me fizeram acreditar que a cura do câncer é possível. Ao
Ayrton Plácido (in memorian), Tia Yelda (in memorian), Tio Dilson Simões (in memorian),
Marcelinho (in memorian) e a todos os outros pacientes e amigos que padeceram dessa
doença e nos quais aprendi o valor da VIDA e do AMOR.
Enfim:
“O câncer pode roubar-lhe aquela alegre ignorância que um dia levou a acreditar que o amanhã se estenderia para sempre. Cada dia é para ser vivido sabiamente”.
Este trabalho foi realizado com o auxílio das seguintes instituições:
Banco do Nordeste do Brasil - BNB
Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES Financiadora de Estudos e Projetos - FINEP
Índice
Lista de Figuras
Lista de Tabelas
Lista de Símbolos e Abreviaturas
Resumo
Abstract
1 INTRODUÇÃO... 29
1.1 O Câncer e sua formação... 29
1.2 Incidência do Câncer... 31
1.3 O ciclo celular e o Câncer... 33
1.4 Morte celular: Apoptose e Necrose... 36
1.5 Princípios da Quimioterapia Antineoplásica... 41
1.6 Chalconas... 46
2 RELEVÂNCIA E JUSTIFICATIVA... 52
3 OBJETIVOS... 54
3.1 Geral... 54
3.2 Específicos... 54
4 MATERIAIS E MÉTODOS... 57
4.1 Materiais utilizados... 57
4.1.1 Equipamentos... 57
4.1.2 Reagentes, Soluções e Fármacos... 58
4.2 Células... 64
4.2.1 Manutenção das células em cultura... 65
4.2.2 Obtenção de células PBMC... 66
4.3 Manutenção do tumor sarcoma 180 em camundongos... 66
4.4 Animais... 67
4.5.1 Obtenção da Chalcona... 67
4.5.2 Estudo da atividade citotóxica... 4.5.2.1 Ensaio de citotoxicidade em células tumorais... 68 79 4.5.2.1.1 Princípio do teste... 69
4.5.2.1.2 Procedimento experimental... 69
4.5.2.1.3 Análise dos dados... 70
4.5.2.2 Ensaio de citotoxicidade em células normais... 70
4.5.2.2.1 Princípio do teste... 70
4.5.2.2.2 Procedimento experimental... 70
4.5.2.2.3 Análise dos dados... 71
4.5.2.3 Determinação da Atividade Hemolítica... 71
4.5.2.3.1 Princípio do Teste... 71
4.5.2.3.2 Procedimento experimental... 71
4.5.2.3.3 Análise dos dados... 72
4.5.3 Estudo do mecanismo de ação citotóxico em células HL-60 (leucemia promielocítica)... 72
4.5.3.1 Viabilidade celular - Exclusão por Azul de Tripan (Curva)... 72
4.5.3.1.1 Princípio do Teste... 72
4.5.3.1.2 Procedimento Experimental... 72
4.5.3.1.3 Análise dos dados... 73
4.5.3.2 Teste da Acridina- Coloração diferencial por BE/LA... 73
4.5.3.2.1 Princípio do Teste... 73
4.5.3.2.2 Procedimento Experimental... 74
4.5.3.2.3 Análise dos dados... 74
4.5.3.3 Teste do BrdU- Inibição da síntese de DNA – Ensaio do BrdU... 74
4.5.3.3.1 Princípio do Teste... 74
4.5.3.3.2 Procedimento Experimental... 75
4.5.3.3.3 Análise dos dados... 75
May-Grunwald-Giemsa...
4.5.3.4.1 Princípio do teste... 4.5.3.4.2 Procedimento experimental...
75 75 76
4.5.3.4.3 Análise dos dados... 76
4.5.3.5 Determinação da Integridade de membrana- viabilidade celular... 76
4.5.3.5.1 Princípio do teste... 76
4.5.3.5.2 Procedimento experimental... 76
4.5.3.5.3 Análise dos dados... 77
4.5.3.6 Análise do ciclo celular... 77
4.5.3.6.1 Princípio do Teste... 77
4.5.3.6.2 Procedimento experimental... 78
4.5.3.6.3 Análise dos dados... 78
4.5.3.7 Ensaio da Externalização da Fosfatidilserina- Anexina V... 78
4.5.3.7.1 Princípio do teste... 78
4.5.3.7. 2 Procedimento experimental... 79
4.5.3.7.3 Análise dos dados... 79
4.5.3.8 Determinação da ativação das caspases- 3e 7... 79
4.5.3.8.1 Princípio do teste... 79
4.5.3.8.2 Procedimento Experimental... 80
4.5.3.8.3 Análise dos dados... 80
4.5.3.9 Determinação da ativação da caspase-8... 80
4.5.3.9.1 Princípio do teste... 80
4.5.3.9.2 Procedimento Experimental... 81
4.5.3.9.3 Análise dos dados... 81
4.5.3.10 Determinação da ativação da caspase-9... 81
4.5.3.10.1 Princípio do teste... 81
4.5.3.10.2 Procedimento Experimental... 82
4.5.3.10.3 Análise dos dados... 82
4.5.3.11.1 Princípio do teste... 82
4.5.3.11.2 Procedimento Experimental... 83
4.5.3.11.2.1 Extração de Proteínas... 83
4.5.3.11.2.2 Quantificação de Proteínas... 83
4.5.3.11.2.3 Eletroforese em gel de poliacrilamida... 84
4.5.3.11.2.4 Eletrotransferência... 84
4.5.3.11.2.5 Imunodetecção... 84
4.5.3.11.2.6 Análise dos dados... 85
4.5.4 Estudo da atividade genotóxica e mutagênica ... 85
4.5.4.1 Ensaio de genotoxicidade in vitro - Dano ao DNA - Ensaio do cometa... 85 4.5.4.1.1 Princípio do teste... 85
4.5.4.1.2 Procedimento experimental... 86
4.5.4.1.3 Análise dos dados... 86
4.5.4.2 Avaliação da genotoxicidade/mutagenicidade em linfócitos humanos – Teste do micronúcleo in vitro... 87
4.5.4.2.1 Princípio do teste... 87
4.5.4.2.2 Procedimento experimental... 88
4.5.4.2.3 Análise dos dados... 88
4.5.5 Avaliação da Atividade Antitumoral em camundongos transplantados com tumor Sarcoma 180... 89
4.5.5.1 Princípio do teste... 89
4.5.5.2 Procedimento experimental... 90
4.5.5.3 Análise dos dados... 91
4.5.5.4 Parâmetros toxicológicos avaliados... 91
4.5.5.4.1 Avaliação dos parâmetros bioquímicos... 91
4.5.5.4.2 Princípio do teste...
4.5.5.4.3 Procedimento experimental...
4.5.5.4.4 Análise dos dados... 92
4.5.5.4.2 Avaliação dos parâmetros hematológicos... 93
4.5.5.4.2.1 Princípio do teste... 93
4.5.5.4.2.2 Procedimento experimental... 93
4.5.5.4.2.3 Análise dos dados... 93
4.5.5.5 Análise histopatológica... 93
4.5.5.5.1 Princípio do teste... 93
4.5.5.5.2 Procedimento experimental... 94
4.5.5.5.3 Análise dos dados... 94
5 RESULTADOS... 96
5.1 Estudo da atividade citotóxica... 96
5.1.1 Avaliação da atividade citotóxica da CG em células tumorais humanas... 96
5.1.2 Avaliação da atividade citotóxica da CG em células normais humanas (PBMC)... 97
5.2 Atividade hemolítica... 98
5.3 Estudo do mecanismo de ação citotóxica em células HL-60... 99
5.3.1 Determinação da viabilidade celular por exclusão do azul de Tripan... 99
5.3.2 Coloração diferencial por Laranja de Acridina / Brometo de Etídio... 100
5.3.3 Inibição da proliferação celular através da incorporação de BrdU... 101
5.3.4 Coloração diferencial por May-Grunwald-Giemsa... 103
5.3.5 Análises da citometria de fluxo... 104
5.3.5.1 Integridade de membrana celular e concentração de células... 104
5.3.5.2 Análise do ciclo celular e da fragmentação de DNA... 105
5.3.5.3 Determinação da Externalização da Fosfatidilserina- Anexina V... 5.3.5.4 Detecção da ativação de Caspases Efetoras – 3 e 7... 108 110 5.3.5.5 Detecção da ativação de Caspases Iniciadoras -8/-9... 111
5.3.6.1 Avaliação da genotoxicidade in vitro - Dano ao DNA - Ensaio do
cometa... 116
5.3.6.2 Avaliação da genotoxicidade/mutagenicidade – Teste do micronúcleo in vitro... 117
5.3.7 Estudo in vivo... 118
5.3.7.1 Estudo da Atividade Antitumoral em camundongos transplantados com Sarcoma 180... 118
5.3.7.2 Avaliação dos aspectos toxicológicos nos órgãos dos camundongos transplantados com Sarcoma 180... 120
5.3.7.2 Análise bioquímica e hematológica dos camundongos saudáveis ou transplantados com Sarcoma 180... 127
6 DISCUSSÃO... 134
7 CONSIDERAÇÕES FINAIS... 151
8 REFERÊNCIAS BIBLIOGRÁFICAS………..………..………….…... 153
ANEXO 1- Aprovação do Comitê de Ética de Pesquisa em Seres Humanos (COMEPE)... 168
LISTA DE FIGURAS
Figura 1: Fluxograma mostrando um esquema simplificado da base molecular do câncer... 31
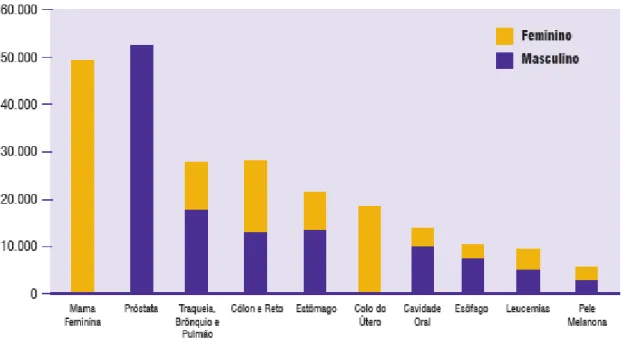
Figura 2: Tipos de câncer mais incidentes estimados para 2010, exceto pele não melanoma, na população brasileira... 32
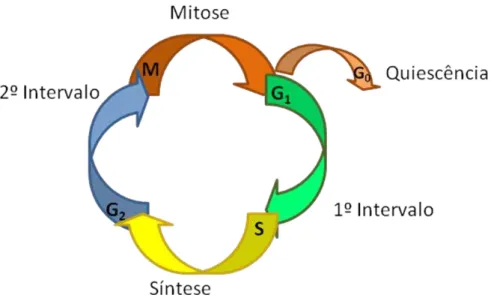
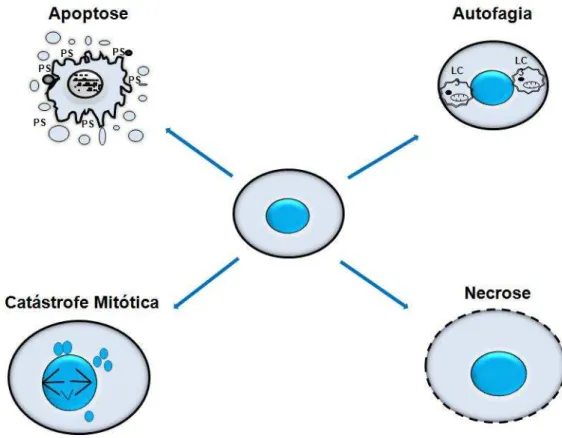
Figura 3: Esquema das fases do ciclo celular... 34 Figura 4: Esquema dos pontos de checagem do ciclo celular... 36 Figura 5: Características morfológicas dos principais tipos de morte celular. PS: fosfatidilserina; LC3: proteína citoplasmática que é considerada um marcador da macroautofagia... 37
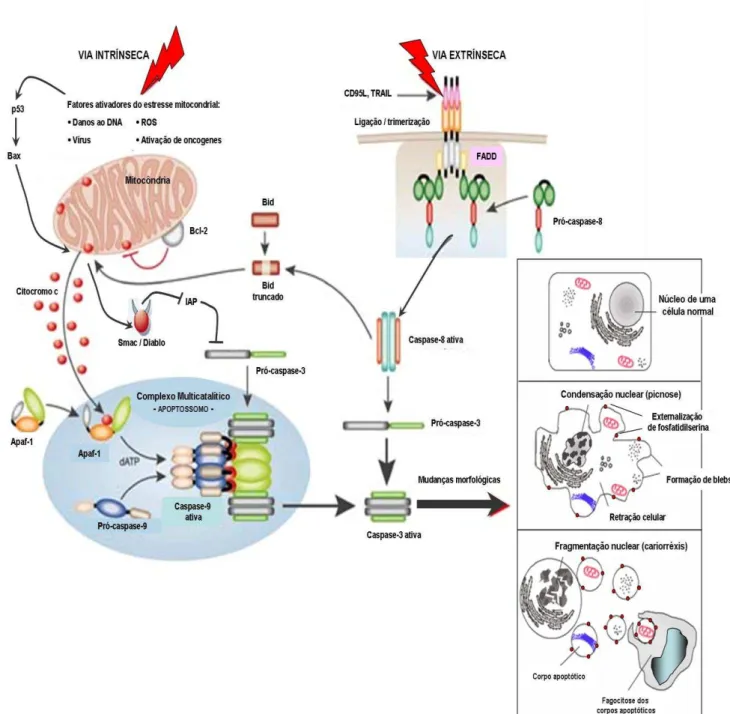
Figura 6: Esquema demonstrando as principais vias de ativação da apoptose, suas interconexões e as alterações morfológicas mais características... 40
Figura 7: Distribuição da origem dos medicamentos antineoplásicos que estão no mercado nos últimos 25 anos... 43
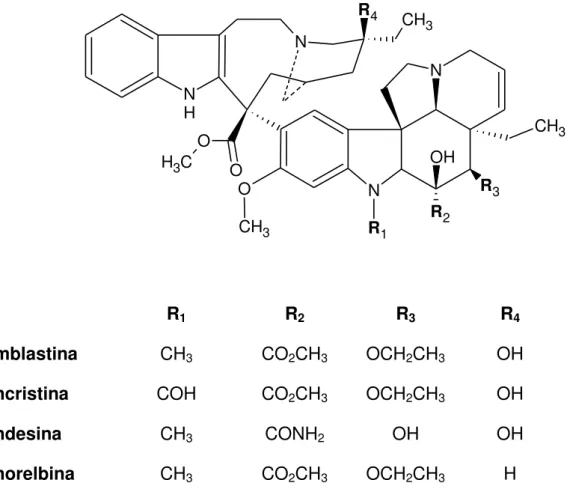
Figura 8: Estrutura química da vimblastina, da vincristina, da vindesina e da vinorelbina... 44
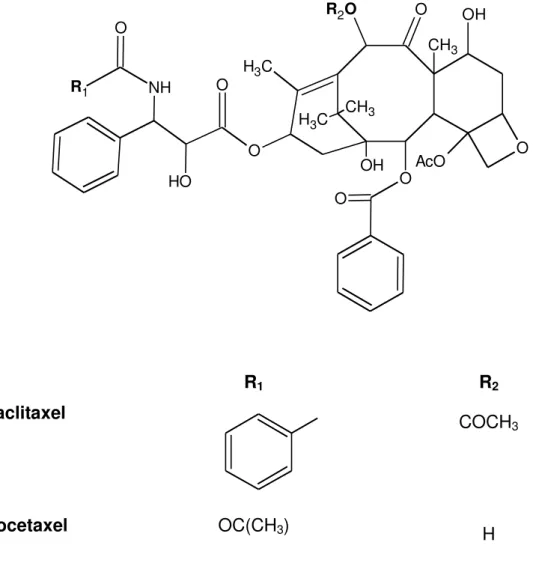
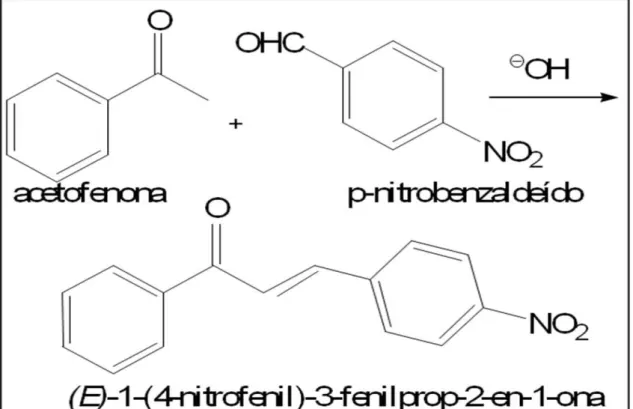
Figura 9: Estrutura química do paclitaxel e do docetaxel... 45 Figura 10: Núcleo fundamental das chalconas... 46 Figura 11: Esquema da reação de condensação de Claisen-Schmidt entre acetofenona e p-nitrobenzaldeído. Estrutura do derivado de chalcona, (E)
-1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona... 49
Figura 12: Esquema da reação de condensação de Claisen-Schmidt* entre acetofenona e p-nitrobenzaldeído. Estrutura do (E)-1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona, molécula do
estudo... 68
Figura 13: Representação dos tipos de cometas corados com prata e visualizados em microscópio óptico, sendo indicado o escore atribuído para cada cometa de acordo com o dano. a) tipos 0 (verde) e 1 (amarelo); b) tipos 2 (vermelho) e 3 (azul); c) tipo 4... 87 Figura 14: Representação da formação de micronúcleos a partir de um fragmento cromossômico acêntrico e cromossomo inteiro em uma célula binucleada pelo uso de Citocalasina B... 89
Figura 15: Curva de crescimento em células leucêmicas humanas (HL-60), tratadas com o composto CG nas concentrações 0,04 µM; 0,2 µM; 0,4 µM; 2,0 µM e 4,0 µM. A viabilidade das células leucêmicas foi determinada por exclusão de azul de tripan em 3, 6, 12 e 24 horas de incubação. O controle negativo (C) foi tratado com o veículo utilizado para a diluição da substância (DMSO). Os dados correspondem à média ± EPM de experimentos independentes (n=3), * p< 0,05; ** p<0,001 comparado ao controle por
ANOVA seguido pelo teste Student
Newman-Keuls...
diluição da substância (DMSO). A doxorrubicina – 0,5 µM – foi utilizada como controle positivo (DOX). Os dados correspondem à média ± EPM de experimentos independentes (n=3), **p< 0,001 comparado ao controle por ANOVA seguido pelo teste Student Newman-Keuls... 101
Figura 17: Determinação do percentual de síntese do DNA. Foi avaliado pela incorporação de bromodeoxiuridina (BrdU) nas células HL-60, após 24 horas de incubação. As células foram tratadas com o composto CG nas concentrações 1,0 µM e 2,0 µM. O controle negativo (C) foi tratado com o veículo utilizado para a diluição da substância (DMSO). A doxorrubicina – 0,5 µM – foi utilizada como controle positivo (Dox). Os dados correspondem à média ± EPM de experimentos independentes (n=2), *p< 0,05 comparado ao controle por ANOVA seguido pelo teste Student Newman-Keuls...
102 Figura 18: Fotomicrografias das lâminas das células de HL-60, tratadas e não tratadas, após 24 horas de incubação com a doxorrubicina e CG. A- Controle negativo (DMSO), B- tratadas com Doxorrubicina (0,5 µM), C- 1,0 µM e D- 2,0 µM. A contagem foi realizada através da incorporação de bromodeoxiuridina (BrdU), células com núcleos de coloração marrom. O aumento foi de 400X...
102 Figura 19: Fotomicrografias das células de HL-60 tratadas e não tratadas, após 24 h de incubação com a CG e coradas com May-Grunwald-Giemsa. O aumento foi de 400X. A- Controle negativo, B- doxorrubicina a 0,5 µM, C- 1,0 µM (CG), D- 2,0 µM (CG) e E- 4,0 µM (CG). As setas pretas indicam redução de volume celular, condensação de cromatina,
fragmentação nuclear e formação de corpos apoptóticos
“blebs”... 103
Figura 20: A- Avaliação da integridade de membrana plasmática e B- Avaliação do número de células viáveis, analisados por citometria de fluxo. Células de HL-60 incubadas com a CG nas concentrações 1,0; 2,0 e 4,0 µM e com o controle doxorrubicina a 0,5 µM. Os dados foram analisados a partir da média ± EPM de 3 experimentos. Para a verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida pelo teste Student Newman-Keuls, com significância estatística (**p<0,001), no programa GraphPad Prism versão 5.0...
105 Figura 21: Efeito da CG no ciclo celular após 24 h de incubação. Os histogramas do ciclo celular foram analisados no ModFit LT 3.1. Eixo x: intensidade de fluorescência e eixo y: números de células de HL-60, determinadas por citometria de fluxo utilizando iodeto de propídeo. A- Controle negativo; B- Doxorrubicina (0,5 µM); C, D e E- CG nas concentrações 1,0; 2,0 e 4,0 µM...
108 Figura 22: A- Determinação da fragmentação do DNA; B- Análise do efeito sobre o ciclo celular. Células de HL-60 incubadas com a CG nas concentrações de 1,0; 2,0 e 4,0 µM, após 24 h de incubação e analisados por citometria de fluxo utilizando iodeto de propídeo. (C-) representa o controle negativo; (DOX) controle positivo com Doxorrubicina (0,5 µM). Os dados foram analisados a partir da média ± EPM de 3 experimentos. Para a verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida pelo teste Student Newman-Keuls, com significância estatística (*p<0,05), no programa GraphPad Prism versão 5.0... 107 Figura 23: Análise da externalização da fosfatidilserina por citometria de fluxo em células HL-60. No histograma (A): 1- Controle negativo; 2- tratadas com doxorrubicina (0,5 µM) e CG nas concentrações de 1,0; 2,0 e 4,0 µM (respectivamente 3, 4 e 5) com 24 horas de incubação. Percentagem de células em: Verde- quadrante inferior esquerdo – viáveis; Azul- quadrante inferior direito- apoptose inical; Rosa- quadrante superior direito- apoptose tardia; e Roxo- quadrante superior esquerdo- necrose. Gráfico (B): % de células
5.0... 109 Figura 24: Análise da detecção das Caspases Efetoras 3 e 7 por citometria de fluxo em células HL-60. (A) percentual de células viáveis, (B) percentual de células em apoptose incial, (C) percentual de células em apoptose tardia, (D) percentual de células em necrose. A doxorrubicina (0,5 µM) foi utilizada como controle positivo. A CG foi testada nas concentrações de 1,0; 2,0 e 4,0 µM com 24h de incubação. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística (**p<0,001), no programa GraphPad Prism versão 5.0...
110 Figura 25: Histograma referente ao teste das Caspases Efetoras 3 e 7. (A): 1- Controle negativo; 2- tratadas com doxorrubicina (0,5 µM) e CG nas concentrações de 1,0; 2,0 e 4,0 µM (respectivamente 3, 4 e 5) com 24 horas de incubação. Percentagem de células em: Verde- quadrante inferior esquerdo – viáveis; Azul- quadrante inferior direito- apoptose inical; Rosa- quadrante superior direito- apoptose tardia; e Roxo- quadrante
superior esquerdo- necrose. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística
(*p<0,05), no programa GraphPad Prism versão
5.0... 111
Figura 26: Análise da detecção da Caspase Iniciadora 8, por citometria de fluxo em células HL-60. (A) percentual de células viáveis, (B) percentual de células em apoptose incial, (C) percentual de células em apoptose tardia, (D) percentual de células em necrose. A doxorrubicina (0,5 µM) foi utilizada como controle positivo. A CG foi testada nas concentrações de 1,0; 2,0 e 4,0 µM com 24h de incubação. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística (*p< 0,05, **p<0,001), no programa GraphPad Prism versão 5.0...
112 Figura 27: Histograma referente ao teste da Caspase Iniciadora 8. (A): 1- Controle negativo; 2- tratadas com doxorrubicina (0,5 µM) e CG nas concentrações de 1,0; 2,0 e 4,0 µM (respectivamente 3, 4 e 5) com 24 horas de incubação. Percentagem de células em: Verde- quadrante inferior esquerdo – viáveis; Azul- quadrante inferior direito-
apoptose inical; Rosa- quadrante superior direito- apoptose tardia; e Roxo- quadrante superior esquerdo- necrose. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística (*p<0,05, **p<0,001), no programa GraphPad Prism versão 5.0... 113
Figura 28: Análise da detecção da Caspase Iniciadora 9, por citometria de fluxo em células HL-60. (A) percentual de células viáveis, (B) percentual de células em apoptose incial, (C) percentual de células em apoptose tardia, (D) percentual de células em necrose. A doxorrubicina (0,5 µM) foi utilizada como controle positivo. A CG foi testada nas concentrações de 1,0; 2,0 e 4,0 µM com 24h de incubação. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística (*p< 0,05, **p<0,001), no programa GraphPad Prism versão 5.0...
114 Figura 29: Histograma referente ao teste da Caspase Iniciadora 9. (A): 1- Controle negativo; 2- tratadas com doxorrubicina (0,5 µM) e CG nas concentrações de 1,0; 2,0 e 4,0 µM (respectivamente 3, 4 e 5) com 24 horas de incubação. Percentagem de células em: Verde- quadrante inferior esquerdo – viáveis; Azul- quadrante inferior direito-
apoptose inical; Rosa- quadrante superior direito- apoptose tardia; e Roxo- quadrante
superior esquerdo- necrose. Os dados foram comparados por análise de variância (ANOVA) seguido pelo teste Student Newman-Keuls, com significância estatística (*p<0,05, **p<0,001), no programa GraphPad Prism versão 5.0... 114
Figura 30: Expressão das procaspase e caspase-9, citocromo c em células de HL-60, contro
blot... 115 Figura 31: Freqüência de dano ao DNA. O derivado de chalcona (CG) nas concentrações de 1,0; 2,0 e 4,0 µM sobre PBMC, analisado pelo teste do cometa após 24 horas de incubação. C-: controle negativo. Os dados correspondem à média ± EPM de dois experimentos independentes (**p<0,001), comparado com o controle negativo por ANOVA seguido pelo teste Student Newman-Keuls... 116 Figura 32: Índice de dano ao DNA. A substância CG nas concentrações 1,0; 2,0 e 4,0 µM sobre PBMC, analisado pelo teste do cometa após 24 horas de incubação. C-: controle negativo. Os valores foram obtidos pela multiplicação do número de células de classe de dano, variando de 0 (sem dano) a 400 (dano máximo). Os dados correspondem à média ± EPM de dois experimentos independentes (**p<0,001), comparado com o controle
negativo por ANOVA seguido pelo teste Student
Newman-Keuls...
117
Figura 33: Micronúcleo por 2000 células binucleadas. A substância CG nas concentrações 1,0; 2,0 e 4,0 µM sobre PBMC, analisado pelo teste do micronúcleo após 24 horas de incubação. C: controle negativo. Os dados correspondem à média ± EPM de dois experimentos independentes (**p<0,001), comparado com o controle negativo por ANOVA seguido pelo teste Student Newman-Keuls... 118 Figura 34: Fotomicrografia do tumor Sarcoma 180 transplantados em camundongos e percentual de inibição tumoral dos animais submetidos ao protocolo de avaliação da atividade antitumoral. A substância CG foi testada nas concentrações 25 mg/Kg e 50 mg/Kg; 5-FU, 25 mg/Kg, controle positivo . Controle negativo (DMSO 10%). Os dados correspondem à média ± EPM de dois experimentos independentes (**p<0,001), comparado com o controle negativo por ANOVA seguido pelo teste Student Newman-Keuls...
119
Figura 35: Fotomicrografia do tumor Sarcoma 180 transplantados em camundongos. O controle negativo (A) foi tratado com o veiculo usado para diluir a droga (DMSO 10%). Os animais foram tratados com o 5-fluorouracil (25 mg/Kg, B), CG (25 mg/Kg, C) e (D) CG (50 mg/Kg). Aumento de 400X... 120 Figura 36: Diferença de peso corpóreo dos camundongos com Sarcoma 180, em gramas. Os valores correspondentes à média ± E.P.M. de dez animais, **p<0,00, quando comparado com o grupo controle negativo (DMSO 10%) experimental por ANOVA (análise da variância) seguido por Student Newman-Keuls... 121 Figura 37: Fotomicrografia dos fígados de camundongos transplantados com o tumor Sarcoma 180. O controle negativo (A e B) foi tratado com o veiculo usado para diluir a droga (DMSO 10%). Os animais foram tratados com o 5-fluorouracil (25 mg/Kg, C e D), CG (25 mg/Kg, E e F) e (G e H) CG (50 mg/Kg). Aumento de 400X... 123
droga (DMSO 10%). Os animais foram tratados com o 5-fluorouracil (25 mg/Kg, C e D), CG (25 mg/Kg, E e F) e (G e H) CG (50 mg/Kg). Aumento de 100X e 400X... 124 Figura 39: Fotomicrografia dos rins de camundongos transplantados com o tumor Sarcoma 180. O controle negativo (A) foi tratado com o veiculo usado para diluir a droga (DMSO 10%). Os animais foram tratados com o 5-fluorouracil (25 mg/Kg,B), CG (25 mg/Kg, C) e (D) CG (50 mg/Kg). Aumento de 400X... 125 Figura 40: Fotomicrografia dos estômagos de camundongos transplantados com o tumor Sarcoma 180. O controle negativo (A e B) foi tratado com o veiculo usado para diluir a droga (DMSO 10%). Os animais foram tratados com CG (25 mg/Kg, C e D) e (E e F) CG (50 mg/Kg). Aumento de 100X... 126 Figura 41: Resumo dos resultados dos estudos de avaliação da atividade citotóxica e antitumoral da chalcona (E)-1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona,
(CG)... 131
Figura 42: Resumo dos resultados dos estudos genotóxico/mutagênico, antitumoral e toxicológica da chalcona (E)-1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona,
LISTA DE TABELAS
Tabela 1: Exemplos de alguns flavonóides e suas fontes... 47
Tabela 2 - Células utilizadas nos ensaios de citotoxicidade, genotoxicidade e antitumoral... 65
Tabela 3: Atividade citotóxica da CG frente às linhagens tumorais. Células humanas de leucemias (HL-60, K562), carcinoma de cólon (HCT-8), glioblastoma (SF-295) e carcinoma de mama (MDA-MB-435). A Doxorrubicina foi usada como controle positivo... 97 Tabela 4: Atividade citotóxica da CG frente à linhagem normal obtida de cultura primária (PBMC) após 24, 48 e 72 horas de incubação... 98
Tabela 5: Avaliação do potencial hemolítico da CG frente a eritrócitos de camundongos Swiss (Mus musculus)... 98 Tabela 6: Efeito da CG sobre a massa corpórea e a massa úmida dos órgãos (fígado, baço, rins e estômago) de camundongos transplantados com o tumor Sarcoma 180... 121
LISTA DE SÍMBOLOS E ABREVIATURAS
5-FU
Dox
CG
5-Fluorouracil
Doxorrubicina
1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona
ALT Alanina aminotransferase
AST Aspartato aminotransferase
ANOVA Analisys of Variance (Análise de variância)
CI50 Concentração inibitória mínima
CO2
PBMC
Dióxido de carbono
Células mononucleares do sangue periférico
BrdU Bromodeoxiuridina
DMSO Dimetilsulfóxido
DNA Ácido desoxirribonucléico
E.P.M. Erro padrão da média
IC Intervalo de confiança
IM Índice de mutagenicidade
MTT Brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio
PBS Phosphate buffer solution (Tampão fosfato)
TBS Tris buffer solution (Tampão tris)
US-NCI United States National Cancer Institute (Instituto Nacional do Câncer dos Estados Unidos)
UI
COMEPE
CEPA
Unidades internacionais
Comitê de Ética em Pesquisas Humanas
ESTUDO DO POTENCIAL ANTICÂNCER DE UM DERIVADO DE CHALCONA, 1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona, IN VITRO E IN VIVO. Kristiana Cerqueira Mousinho. Orientador: Dr. Manoel Odorico de Moraes Filho. Co-orientadora: Dra. Ivone Antônia de Souza. Tese de Doutorado. Programa de Pós-Graduação em Farmacologia. Departamento de Fisiologia e Farmacologia, UFC, 2010.
A substância 1-(4-Nitrofenil)-3-fenilprop-2-en-1-ona (CG) é um derivado de chalcona, sintetizado a partir da reação química entre a acetofenona e para-nitro benzaldeído. Para avaliar o seu potencial anticâncer foi realizado um estudo farmacológico de suas propriedades antitumorais em vários modelos biológicos in vitro e in vivo. A CG apresentou potente atividade citotóxica nas 5 linhagens tumorais testadas, inibindo a proliferação das células tumorais pelo ensaio do MTT e em células mononucleares do sangue periférico (PMCB) humano através do ensaio do Alamar blue. Todas as linhagens mostraram sensibilidade ao tratamento com a CG, e a CI50variou de 1,18µM em HCT-8 a 3,32µM em SF-295. O composto apresentou fraca citotoxicidade (CI50 igual a 7,07µM) nas células PBMC, com exposição a CG em 72h, em relação às células de HL-60, utilizada como modelo nos demais testes biológicos. O tempo de encubação com o composto foi de 24h na maioria dos experimentos. Adicionalmente, a CG não induziu efeitos hemolíticos. O ensaio de exclusão por azul de Tripan revelou diminuição da viabilidade celular principalmente após 24h na maior concentração testada (4µM) com 58,4%. Para os testes de atividade antiproliferativa, LA/BE mostrou em sua morfologia células em apoptose nas duas maiores concentrações, enquanto que o BrdU, apresentou incorporação do mesmo nas concentrações testadas. A morfologia analisada por May-Grunwald-Giemsa mostrou redução do volume celular, condensação da cromatina e fragmentação nuclear. Adicionalmente, a CG induziu apoptose em células leucêmicas HL-60, com participação das vias intrínseca e maior estímulo da via extrínseca, de maneira concentração-dependente, como observado na integridade da membrana citoplasmática, aumento da fragmentação do DNA e externalização da fosfatidilserina. Na análise do ciclo celular, foi observado parada na fase G2/M, sendo ativada as caspases 3, 7, 8 e 9 (a última na maior concentração e confirmada pelo teste do Western blot). Não houve ativação do Citocromo c. A CG não foi capaz de induzir processos genotóxicos/ mutagênicos (testes do cometa e micronúcleo in vitro). No ensaio de atividade antitumoral in vivo, observou-se inibição tumoral nas doses testadas (25 e 50mg/Kg/dia, via oral) de 54,85 e 69,11% respectivamente. As doses de CG causaram tumefação celular e o surgimento de focos inflamatórios no parênquima ou estroma hepático/renal, necrose nefrotóxica focal, esteatose microvesicular, pigmentos de hemossiderina, hiperplasia das células de Kupffer, congestão da polpa vermelha e desorganização dos folículos linfóides esplênicos. Além disso, os índices bioquímicos mostraram aumento do AST e diminuição da uréia (CG 25mg/Kg/dia), diminuição do ALT (5-FU e CG 25mg/Kg/dia); as alterações hematológicas mostraram leucopenia e plaquetopenia (5-FU), aumento dos leucócitos totais (CG 50mg/Kg/dia), aumento de neutrófilos e linfócitos em todos os grupos tratados. Todos os resultados nos levam a enfatizar que a CG possui grande potencialidade como molécula promissora por suas propriedades anticâncer.
IN VITRO AND IN VIVO STUDY OF THE ANTICANCER POTENTIAL OF A CHALCONA DERIVED SUBSTANCE, 1- (4-Nitrofenil)-3- fenilprop-2- en-1-ona.
Kristiana Cerqueira Mousinho. Advisor: Dr. Manoel Odorico de Moraes Filho. Co-advisor: Dra. Ivone Antônia de Souza. Doctorate Thesis. Graduate Program on Pharmacology. Departamento f Phisyology and Pharmacology, UFC, 2010.
The substance 1- (4-Nitrofenil)-3- fenilprop-2- en-1-ona (CG) is a chalcone derivative, synthesized from a chemical reaction between acetophenone and p-nitro benzaldehyde. To evaluate its anticancer potential a pharmacological study of its antitumor properties in selected biological models in vitro e in vivo. CG presented a powerful cytotoxic activity in the 5 tested tumor lines evaluated, inhibiting cell proliferation of the tumor lines in the MTT assay and human peripheral mononuclear blood cells (PMBC) through the Alamar Blue assay. All cell lines showed sensitivity to the treatment with the CG, and the IC50varied from 1,18µM in HCT-8 to 3,32 µMin SF-295.The sample presented weak cytotoxic effect (IC50 of 7,07 µM)in cells PMBC, with 72h exposure to CG, compared to HL-60 cells (leukemic cell line), used in the next biological tests. The sample was incubated with the cells during 24h for the majority of the experiments. Additionally, CG did not induce hemolytic effects. The Tripan Blue assay showed a decrease of the cellular viability especially after 24h of incubation of the higher tested concentration (4 µM) with 58,4%. In assays for antiproliferative activity, OA/BE showed in its morphology cells going under apoptosis in the two higher concentrations, whereas the BrdU assay, presented incorporation of the same in the tested concentrations. The morphology analyzed with the May-Grunwald-Giemsa stain showed a decrease of the cellular volume, chromatin condensation and nuclear fragmentation.CG induced apoptosis in HL-60 cells, with participation of the intrinsic pathway and major stimulation of the extrinsic pathway, in a concentration-dependent manner, as observed in the cytoplasmatic membrane integrity, increase of DNA fragmentation and outsourcing of phosphatidylserine. In the cellular cycle analysis, it was observed a stop in the G2/M phase, activating caspases 3, 7, 8 and 9 (the last one in the highest concentration and confirmed by the Western blot assay). It was not observed activation of Cytochrome c. CG was not capable to induce mutagenic/genotoxic processes (comet assay and micronucleus in vitro). In the in vivo antitumor activity assay, tumor inhibition was observed in the tested doses (25 and 50mg/Kg/day, oral intake) of 54,85 and 69,11%, respectively . The doses of CG caused cellular swelling and the arise of inflammatory focus in the parenchyma or hepatic/renal stroma, focal nephrotoxic necrosis, microvesicular steatosis, hemosiderin pigments, hyperplasia of Kupffer cells, congestion of the red pulp and disorganization of the splenic lymphoid follicles. Furthermore, the biochemical indices had shown increase of AST and reduction of urea (25mg/Kg/day of CG), reduction of ALT (25mg/Kg/day of 5-FU and CG); hematologic alterations showed leukopenia and thrombocytopenia (5-FU), increase of total leukocytes (50mg/Kg/day of CG), increase of neutrophils and lymphocytes in all treated groups. All results led us to emphasize that CG possesses great potential as a promising molecule for its anticancer properties.
30
1 INTRODUÇÃO
1.1 O Câncer e sua formação
O termo câncer vem do latim “cancer”, que significa “carangueijo”, no qual deve ter sido empregado em analogia entre a morfologia do crustáceo e ao modo de crescimento infiltrante do tumor (DE ALMEIDA, 2005). Representa um conjunto de mais de 100 doenças e é definido como enfermidades complexas de caráter mutacional, proliferativo, de crescimento celular aberrante e descontrolado, em que células em um mesmo microambiente, invadem os tecidos e órgãos adjacentes, podendo migrar para regiões distantes do organismo, evento este conhecido como metástase (KUMAR et al., 2004; INCA, 2010).
As células do câncer possuem defeitos nos mecanismos que governam a proliferação normal. Entre as características do tumor maligno estão à auto-suficiência da sinalização de fatores de crescimento, insensibilidade a inibidores do crescimento, inibição da morte celular não seguida de autólise (apoptose), potencial replicativo ilimitado, angiogênese, poder de invasão e capacidade de metastatizar-se (HANAHAN & WEINGER, 2000).
A célula neoplásica passa a ser considerada nesta condição quando ela adquire vantagens metabólicas e capacidades biológicas quando comparadas às células não transformadas: a) perda do controle da proliferação e divisão celular; b) imortalização celular devido à ativação da enzima telomerase; c) alterações cromossômicas (de forma e número); d) perda das propriedades adesivas da membrana plasmática, que permite o reconhecimento célula-célula e a inibição por contato do movimento e crescimento celular; e) perda de função e da capacidade de diferenciação ou especialização; f) capacidade para invadir tecidos vizinhos ou distantes e formar metástases; g) capacidade de induzir a formação de novos vasos sangüíneos (angiogênese). Observa-se, no entanto, que todos os casos de câncer estão envolvidos com as vias de transmissão de sinais biológicos, no controle positivo e negativo do ciclo celular e da morte celular programada (LIOTTA & KOHN, 2001; RIBEIRO et al., 2003).
31
progressão (SPANDIDOS, 1985; CHABNER & LONGO, 1996; SPENCE & JONHSTON, 2001; KUMMAR et al., 2004; SPANDIDOS, 2007).O primeiro estágio da carcinogênese é o da iniciação. As células sofrem o efeito de um agente carcinogênico, também chamado de agente oncoiniciador, que provocamodificações em alguns de seus genes. Nesta fase as células encontram-se geneticamente alteradas, mas ainda não é possível se detectar um tumor clinicamente. Como exemplo de substâncias químicas carcinógenas tem sido descrito o sulfato de dimetila, metilnitrossuréia, cloreto de vinila, aflatoxinas, dimetilnitrosamina e benzopireno, entre outros agentes não químicos, como: exposição por vírus, hepatite B, HTLV, HPV, radiação ionizante (CHABNER & LONGO, 1996; SPENCE & JONHSTON, 2001;KUMMAR et al., 2004;JUNG et al., 2006).
Na fase seguinte, denominada de promoção, as células geneticamente alteradas (iniciadas) sofrem um efeito prolongado dos agentes oncopromotores, induzindo a expressão de proto-oncogenes.A célula iniciada é transformada em célula maligna, de forma lenta e gradual. A suspensão do contato com o agente muitas vezes interrompe o processo nesse estágio. Sendo assim, a promoção pode compreender pelo menos dois mecanismos independentes: a ativação gênica e a atividade mitótica (SPENCE & JONHSTON, 2001; KUMMAR et al., 2004; KLAUNING & KAMENDULIS, 2008).
O terceiro e último estágio é o da progressão e caracteriza-se pela multiplicação descontrolada, sendo um processo irreversível. O tumor maligno já está em fase de desenvolvimento no microambiente favorável, evoluindo até o surgimento das primeiras manifestações clínicas da doença. Os fatores que promovem a iniciação ou progressão da carcinogênese são chamados de carcinógenos. Existe um grande número de agentes que causam lesão e induzem a transformação neoplásica das células, são eles: os carcinógenos químicos, energia radioativa, vírus oncogênicos e alguns agentes microbianos. O fumo, por exemplo, é um agente carcinógeno completo, pois possui componentes que atuam nos três estágios da carcinogênese. (SPENCE & JONHSTON, 2001; KUMMAR et al., 2004; JUNG et al., 2006; SPANDIDOS, 2007).
32
A série de anormalidades metabólicas decorrentes do câncer, bem como os processos invasivos e metastáticos, provoca doença e morte eventual do paciente, a não ser que a neoplasia maligna possa ser erradicada com o tratamento (KATZUNG, 2003; BEZERRA, 2008b).Agentes adquiridos
(ambientais) que lesão o DNA: Químicos, radiação, vírus
Incapacidade de recuperação DNA
Mutações hereditárias em:
Genes que afetam a recuperação do DNA;
Genes que afetam o crescimento celular ou apoptose.
Célula Normal
Reparo do DNA Bem -sucedido Lesão do DNA
Mutações no genoma das células somáticas
Ativação dos oncogenes promotores do crescimento
Inativação do gene supressor de tumor
Alterações nos genes que regulam a apoptose Proliferação celular desregulada Diminuição da apoptose
Expansão clonal Angiogênese
Escapa da imunidade Mutações adicionais Progressão do tumor
Neoplasia maligna Invasão e Metástase
Figura 1: Fluxograma mostrando um esquema simplificado da base molecular do câncer (Adaptado de KUMMAR et al., 2004).
1.2 Incidência do Câncer
33
câncer, podem fornecer dados sobre a patogênese da malignidade (KUMAR et al., 2004).Desde 2003 o câncer tem sido a segunda causa de morte por doença, atrás apenas de mortes relacionadas a doenças cardiovasculares, com uma incidência anual estimada em 6 milhões de casos (SRIVASTAVA et al., 2005). O câncer atemoriza a sociedade atual por ter se tornado um estigma de mortalidade e dor, sendo responsável por 25 % das mortes. Acredita-se que até 2020 mais 20 milhões de novos casos irão surgir (ALMEIDA et al., 2005; INCA, 2010).
No Brasil, as estimativas para o ano de 2010 apontam que ocorrerá um total de 489.270 novos casos de câncer, sendo 236.240 casos para o sexo masculino e 253.030 para o sexo feminino e serão válidas para o ano de 2011. Estima-se que o câncer de pele do tipo não melanoma (114.000 novos casos) será o mais incidente na população brasileira, seguido pelos tumores de próstata (52.000), mama feminina (49.000), cólon e reto (28.000), pulmão (28.000), estômago (21.000) e colo do útero (18.000) (Figura 2) (INCA, 2010).
Alguns fatores estão associados ao desenvolvimento de alguns tipos de câncer, entre eles os geográficos e ambientais, idade, sexo, hábitos de vida, predisposição genética ao câncer, condições predisponentes não hereditárias, como inflamação crônica e condições pré-cancerosas (KUMAR et al., 2004).
34
1.3 O Ciclo celular e o Câncer
A célula surge quando ocorre a fusão ou divisão de duas células. Esse processo dinâmico celular, que ocorre de forma ordenada, pode ser mais bem avaliado através do curso de vida desta célula. Esses eventos se iniciam por ocasião de um processo de replicação, que envolve um período de crescimento seguido pela
divisão, sendo denominado de ciclo celular (ALMEIDA et al., 2005).
O ciclo celular é utilizado para controlar o crescimento e a divisão celular, portanto trata-se de um processo evolutivo e ao mesmo tempo conservativo da célula. A estimulação para o crescimento inicia-se com a liberação de fatores, que se ligam aos receptores de membrana da célula e desencadeiam uma cascata de proteínas transdutoras de sinal. Em G0 o DNA apresenta-se enovelado, com atividade nuclear baixa. Existem duas fases de intervalo chamadas de G1 e G2, em que ocorre a síntese de RNA e de proteínas; uma fase S, onde acontece à formação e replicação do DNA, e uma fase denominada M, onde a célula executa o processo de divisão em duas células filhas, conhecida como mitose (CRECZYNSKI-PASA; PEDROSA, 2001; FOSTER, 2008).
35
Figura 3: Esquema das fases do ciclo celular, adapatado de VERMEULEN et al., 2003.Todo esse processo requer um intenso controle por retroalimentação com o objetivo de assegurar que todas as etapas moleculares sejam seqüenciais e orientadas corretamente. Essa progressão ordenada através das diversas fases do ciclo é orquestrada pelas ciclinas, quinases ciclina-dependentes (CDK’s) e por seus inibidores (FISCHER et al., 2004; KUMAR et al., 2004).
Cada fase do ciclo possui os chamados checkpoints, que podem levar a parada da progressão do ciclo celular e a ativação de mecanismos de reparo (Figura 4)(MALUMBRES et al., 2007). As células vão para a fase seguinte do ciclo celular, de forma irreversível, se passar pelos checkpoints. O dano ao DNA e/ou mal funcionamento de organelas e estruturas (falha no fuso mitótico) pode ativar a parada do ciclo e a célula pode entrar em morte celular, caso o dano não seja reparado (FOSTER, 2008). Os pontos de checagem da integridade do DNA operam através do ciclo, especialmente na transição G1 –S, durante e depois da fase de síntese do DNA, e antes das células entrarem em mitose (G2 - M) (FISCHER et al., 2004).
Nas células tumorais, os checkpoints são freqüentemente ignorados, resultando em instabilidade genética e conseqüente vantagem proliferativa de células cancerosas, quando comparadas com as células normais (FISCHER et al., 2004).
36
modificações nos seus níveis de expressão de RNAm, quanto nos níveis de proteínas. Assim as ciclinas são produzidas em cada uma das fases do ciclo (FOSTER, 2008).A proteína do retinoblastoma, pRb, controla a expressão de genes que comprometem as ciclinas que estão no checkpoint na interseção G1-S. No início de G1, ela está hipofosforilada, o que reprime o avanço do ciclo celular, porque impede a atividade do fator de transcrição E2F. Próximo ao ponto de restrição, os pontos de restrição, os complexos ciclina D – CDK4 e 6 e o complexo ciclina E – CDK2, hiperfosforila pRb, liberando E2F, promovendo desta forma a entrada em S (ALMEIDA
et al., 2005). Quando ocorre mutação no gene pRB, o ciclo celular fica desregulado, e mesmo que a célula não esteja preparada para entrar em S ou tenha ocorrido erros, o ciclo progride (MADDIKA et al., 2007). Isto porque o gene pRb é reconhecido como supressor tumoral, pois é capaz de parar o ciclo celular, caso erros sejam detectados. Por isso, mutações no pRB são freqüentemente encontradas em tumores (ALMEIDA et al., 2005).
As células tumorais mostram uma perda no controle da proliferação celular (ponto de restrição) e, muitas vezes, tornam-se independentes de sinais mitogênicos para a sua progressão através das diferentes fases do ciclo celular (HANAHAN & WEINBERG, 2000; LOURO et al., 2002). A perda do controle da proliferação celular envolve mutações em genes reguladores do ciclo celular, os proto-oncogenes e genes supressores tumorais, o que caracteriza o câncer como uma doença genética (LOURO
37
Figura 4: Esquema dos pontos de checagem do ciclo celular, adapatado de VERMEULEN et al., 2003.1.4 Morte celular: Apoptose e Necrose
O equilíbrio entre a proliferação e a morte celular regula e controla o número de células no organismo. A cascata de eventos, bioquímicos e fisiológicos, que leva a mudanças na síntese de macromoléculas, na homeostase celular, na regulação do volume celular, e finalmente na perda da viabilidade celular está intimamente relacionada às mudanças morfológicas características de cada tipo de morte celular (BRASILEIRO-FILHO, 2006; TINARI et al., 2008).
38
A morte celular pode ser classificada de acordo com sua aparência morfológica (apoptose, necrose, autofagia ou catástrofe mitótica – Figura 5), critérios com base em enzimas (com ou sem o envolvimento de nucleases ou de classes distintas de proteases, tais como caspases, catepsinas e glutaminases), aspectos funcionais (programada ou acidental, fisiológica ou patológica) ou características imunológicas (imunogênicas ou não imunogênicas) (MELINO, 2001; OKADA & MAK, 2004; GALLUZZI et al., 2007).Figura 5: Características morfológicas dos principais tipos de morte celular. PS: fosfatidilserina; LC3: proteína citoplasmática que é considerada um marcador da macroautofagia. Fonte: Bruin & Medema, 2008.
A autofagia é uma resposta ativa a falta de nutrientes, diferenciação e desenvolvimento, sendo então um processo adaptativo de resposta ao estresse metabólico, que resulta na degradação de proteínas e organelas. A autofagia é definida como um processo em que proteínas e organelas são degradadas por proteases lisossomais (RICCI & ZONG, 2006).
39
apresentam-se como células aumentadas e multinucleadas, e com defeitos mitóticos, como condensação nuclear incompleta, defeito no alinhamento dos cromossomos e dano DNA (BRUIN & MEDEMA, 2008).O dano que leva a catástrofe mitótica pode ser induzido por fármacos quimioterápicos como agentes da hiperpolimerização dos microtúbulos (paclitaxel), agentes despolimeralizantes de microtubulos (vinblastina e vincristina) e inibidores de checkpoint quinase 1 (Chk1) (7-hidroxiestaurosporina) (RICCI & ZONG, 2006).
As principais características da necrose incluem: depleção energética, danos a membrana lipídica e perda da função homeostática de canais e bombas de íons. É bem caracterizada pela vacuolização do citoplasma, perda de integridade de membrana e aumento do volume celular (KRYSKO et al., 2008). A necrose é induzida por inibidores da produção de energia celular, desbalanço no fluxo de cálcio, geração de ROS e ativação de proteases não apoptóticas, cada um destes eventos potencializa o outro. A β-lapachona e o honokiol são exemplos de compostos que induzem necrose em células tumorais (BRASILEIRO-FILHO, 2006; RICCI & ZONG, 2006).
A apoptose é um importante fenômeno, bem caracterizado, na citotoxicidade induzida por fármacos anticâncer (KIM et al., 2002; MADDIKA et al., 2007;), sendo também um processo seletivo de deleção celular fisiológica (HENGARTNER, 2000), visto que ocorre para o controle da população celular e do tecido (VERMES et al., 2000), desenvolvimento embrionário ( ZIEGLER & GROSCURTH, 2004), dentre outros processos fisiológicos e patológicos. Foi primeiramente descrita por Kerr e colaboradores em 1972.
40
A ativação da apoptose ocorre por duas vias gerais: via extrínseca eintrínseca (Figura 6).
Quando a via intrínseca é ativada (Figura 6), o primeiro passo é o aumento da permeabilidade da membrana mitocondrial seguida da liberação de proteínas que normalmente estavam localizadas no espaço intermembranar [citocromo c, fator de indução da apoptose, Smac/DIABLO (Second Mitochondria-derived Activator of
Caspases/Direct IAP Binding Protein with Low Propidium iodideI), entre outros]. O citocromo c se liga a Apaf-1 (Apoptotic peptidase activating factor 1) e forma um complexo multicatalítico chamado apoptossomo. Este complexo ativa a caspase-9 a partir de sua forma zimogênica pró-caspase-9. Então, a caspase-9 cliva as caspases efetoras -3, -6 e -7, ativando-as para realizar a fragmentação do DNA (KUMAR et al., 2004; ZIEGLER & GROSCURTH, 2004; BRASILEIRO-FILHO, 2006).
A via de receptor de morte ou via extrínseca (Figura 6)envolve a ativação de receptores de membrana. Eles são membros da superfamília de receptores de fatores de necrose tumoral (Tumor Necrosis Factor receptor - rTNF). Estão inclusos nessa família os receptores de membrana rTNF-1, FAS (CD95), TRAIL (TNF-related
42
1.5 Princípios de Quimioterapia Antineoplásica
A utilização de agentes químicos, isolados ou em combinação com o objetivo de tratar os tumores malignos, denomina-se de quimioterapia antineoplásica. Difere da radioterapia e da terapia cirúrgica por ser um tratamento sistêmico e cada vez mais tem se tornado uma das mais importantes e promissoras ferramentas de combate ao câncer no mundo (BONASSA & SANTANA, 2005). Existem as terapias com fotorradiação (KUSUZAKI et al., 2007) e a imunoterapia (HERR & MORALES, 2008).
A proposta do tratamento com os agentes antineoplásicos é de impedir a multiplicação de células cancerosas, a metastização e de proporcionar a destruição do tumor existente (SKEEL, 2007).
No entanto, apesar do considerável arsenal de drogas já existentes para o tratamento do câncer, em muitos casos, o sucesso terapêutico não é alcançado por causa de falhas nos esquemas terapêuticos, altos índices de recidivas, redução da sobrevida dos pacientes e dos efeitos adversos, o que leva a uma contínua busca por novos fármacos (SALGALLER & LODGER, 1998). O fármaco ideal deve aumentar a especificidade, protegendo tecidos normais, minimizar o desconforto dos pacientes e aumentar a eficácia, resultando na erradicação da massa heterogênea do tumor (BRANNON-PEPPAS & BLANCHETTE, 2004).
Diante do exposto anteriormente, é importante que novas estratégias como o restabelecimento do controle do ciclo celular com drogas que agem nos pontos de checagem, possam ser disponibilizadas como uma estratégia viável na terapia anticâncer (FISCHER et al., 2004).
Dentre as substâncias isoladas de produtos naturais encontramos os chamados metabólitos secundários, uma classe química que se destaca pelo grande potencial farmacológico. Estes são produtos de vias condicionais que são ativadas em contextos ou situações particulares. Eles podem ser divididos em diversas classes estruturais: terpenos, lignanas, taninos, lactonas, esteróides, chalconas, flavonas, flavanonas, alcalóides e quinonas, dentre outros (CLARDY & WALSH, 2004).
43
racional de drogas e química combinatória (YUNES et al., 2001; MANN, 2002; ROTHENBERG et al., 2003; BUTLER, 2004; GANESAN, 2004; WESTWELL & STEVENS, 2004; CRAGG & NEWMAN, 2005; CRAGG et al., 2006; NEWMAN & CRAGG, 2007).Diversos fármacos, nas fases do ciclo celular, irão atuar inibindo a multiplicação celular. Esses fármacos que exercem a sua ação interferindo no ciclo celular são chamados de ciclo-celular específicos. Entretanto, os antineoplásicos que tem a capacidade de agir sobre as células tumorais independentes de estarem atravessando o ciclo ou de estarem em repouso (Fase G0), são denominados de ciclo-celular não-específicos (VASCONCELLOS apud ALMEIDA et al, 2005).
Muitas dessas substâncias constituem-se, sobretudo, em modelos para o desenvolvimento de medicamentos sintéticos modernos, tais como os fármacos anticâncer utilizados atualmente: a vimblastina (Velban®) e a vincristina (Oncovin®) e
os análogos vindesina (Eldisine®) e vinorelbina (Navelbine®); o paclitaxel (Taxol®) e o análogo docetaxel (Taxotere®); a podofilotoxina e os análogos, etoposídeo (Etopophos®) e teniposídeo (Vumon®); e a camptotecina e os análogos, topotecano
(Hycamtin®) e irinotecano (Camptosar®). Esses medicamentos apresentam uma
participação no mercado que movimenta cerca de 50 bilhões de dólares anualmente (CRAGG & NEWMAN, 2000; CRAGG & NEWMAN, 2005; PINTO et al., 2002).
A importância da síntese química das moléculas que possuem atividade antitumoral torna-se um atrativo e um processo viável para a indústria farmacêutica (Figura 7), visto que com relação à produção de substâncias extraídas de fontes naturais, que requer muito material para a extração e obtenção da dose necessária para o paciente, torna-se também um caminho longo até o isolamento do princípio ativo com menos toxicidade ao paciente.