ISSN 1517-7076 http://www.materia.coppe.ufrj.br/sarra/artigos/artigo10722Revista Matéria, v. 12, n. 3, pp. 428 – 437, 2007
Autor Responsável: Rubens Chiba Data de envio: 16/03/06 Data de aceite: 01/09/06
Catodo para célula a combustível de óxido sólido: Síntese e
caracterização de manganito de lantânio dopado com estrôncio
Chiba, R.I; Vargas, R.A.I; Andreoli, M.I; Seo, E.S.M.II
Laboratório de SOFC - Insumos e Componentes Centro de Ciência e Tecnologia de Materiais (CCTM) Instituto de Pesquisas Energéticas e Nucleares (IPEN) Av. Prof. Lineu Prestes, 2242 - Cidade Universitária
CEP 05508-000 - São Paulo - SP - Brasil
e-mail: rchiba@ipen.br, ravargas@ipen.br, mandreol@ipen.br, esmiyseo@ipen.br RESUMO
As células a combustível (CaC) destacam-se como geradoras de energia distribuída, nas quais são dispositivos eletroquímicos de baixo impacto ambiental, que são basicamente alimentadas pelo combustível hidrogênio e pelo oxidante oxigênio, tendo como principais produtos, a eletricidade e a água. Estes dispositivos vêm sendo considerados como uma opção real para a geração de energia elétrica distribuída de maioria dos países, devido à possibilidade de construção modular, baixo nível de ruídos, produção simultânea de energia elétrica e térmica, baixa restrição quanto à localização e elevada eficiência de conversão, dependendo do tipo de CaC. As aplicações da CaC em demonstrações significativas têm atestado a viabilidade em unidades estacionárias, móveis e portáteis.
Neste contexto, o manganito de lantânio dopado com estrôncio (La1-xSrxMnO3), é um material
cerâmico de grande importância, devido principalmente ao seu uso como catodo em células a combustível de óxido sólido (Solid Oxide Fuel Cells - SOFCs). Nos últimos anos, o grande interesse dos pesquisadores em relação a este material se deve principalmente às suas características tais como: boa estabilidade química e térmica, alta atividade catalítica na redução do oxigênio, coeficiente de expansão térmica razoavelmente similar ao eletrólito sólido (zircônia estabilizada com ítria) e alta condutividade elétrica.
No presente trabalho apresenta-se uma contribuição ao estudo das composições químicas e estruturais de La1-xSrxMnO3 com concentrações de estrôncio (15 e 50 % em mol) pela técnica dos citratos. As
resinas foram caracterizadas por análise termogravimétrica (ATG) e análise térmica diferencial (ATD); e os pós sintetizados foram caracterizados por absorção gasosa (LECO), espectrometria de fluorescência de raios X (FRX), granulometria por espalhamento de feixe de laser (CILAS), adsorção gasosa (BET), picnometria por gás hélio, difratometria de raios X (DRX) e microscopia eletrônica de varredura (MEV). As características dos pós de La1-XSrXMnO3 foram avaliadas visando a utilização na preparação de suspensões
catódicas de filmes finos das SOFCs.
Palavras chaves: Célula a combustível de óxido sólido, manganito de lantânio dopado com estrôncio, catodo, técnica dos citratos.
Cathode for solid oxide fuel cell: Synthesis and characterization of
strontium-doped lanthanum manganite
ABSTRACT
The fuel cells (FC) are distinguished as generating of distributed energy and are electrochemical devices of low environmental impact. These devices are fed by hydrogen and oxygen, having as main products, the electricity and the water. Fuel Cells are considered as a real option for the generation of electric energy distributed of many countries, due to possibility of modular construction, low noises level, potential for cogeneration, minimal siting and substantially higher conversion efficiency. Its applications have been detached in stationary and mobile segments, and portable units.
In this context, the strontium-doped lanthanum manganite (La1-XSrXMnO3) is a ceramic material
429 activity in the oxygen reduction reaction, thermal expansion coefficient similar to the electrolyte (yttria stabilized zirconia) and high electrical conductivity.
In this work is presented a contribution to the study of the chemical compositions and structural of La1-XSrXMnO3 with strontium concentrations (15 and 50 mol %) by the citrate technique. The resins have
been characterized by Thermal Gravimetric Analysis (TGA) and Thermal Differential Analysis (TDA); and the powders have been characterized by Gas Absorption (LECO), X-Ray Fluorescence Spectroscopy (XRF), Granulometry by Laser Scattering (CILAS), Gas Adsorption (BET), Picnometry by Gas Helium, X-Ray Diffractometry (XRD) and Scanning Electron Microscopy (SEM). The characteristics of La1-XSrXMnO3
powders have been evaluated aiming at the use in the preparation of cathodic suspensions of thin films of the SOFCs.
Keywords: Solid oxide fuel cell, strontium-doped lanthanum manganite, cathode, citrate technique.
1 INTRODUÇÃO
Nos últimos anos, os problemas ambientais como a falta de energia e a poluição do ar vêm aumentando mundialmente. Neste sentido, as pesquisas vêm sendo desenvolvidas para solucionar estes problemas, desafiando as novas tecnologias que envolvam processos de geração e distribuição de energia, associados a baixo impacto ambiental. Neste cenário, podem-se destacar as células a combustível [4].
As células a combustível (CaC) são dispositivos que convertem diretamente a energia de reações químicas em água e em energias elétrica e térmica. Esta conversão ocorre por meio de reações de oxidações e reduções eletroquímicas do combustível com o oxigênio, e a sua eficiência de conversão não está limitada pelo Ciclo de Carnot, pois ocorrem diretamente, sem a necessidade da produção intermediária de energia térmica.
As vantagens das CaC em relação a outros dispositivos conversores de energia são a elevada eficiência de conversão (40 a 60 %), possibilidade de construção modular, baixa emissão de poluentes, baixo nível de ruídos, produção simultânea de energia elétrica e térmica e baixa restrição quanto à localização [6,
13].
Os 4 componentes básicos necessários para fabricação de uma CaC são: o anodo, catodo, eletrólito e interconector. Esses componentes apresentam funções diferentes, apresentando para cada qual, propriedades particulares e específicas, sendo, portanto importante estudá-las individualmente.
As CaC são classificadas de acordo com o tipo de eletrólito e conseqüentemente, a temperatura de operação é uma variável determinante [9, 10, 12]. Em particular, as células a combustível de óxido sólido (SOFCs) têm as seguintes vantagens como alta eficiência (cinética favorável) e a reforma interna na célula. Sendo assim, de grande importância na aplicação em unidades estacionárias e em cogeração de eletricidade/calor. Entretanto, ainda apresenta desafios com relação à compatibilidade de materiais e estabilidade química entre os componentes que as constituem como uma célula unitária.
A aplicação das SOFCs em demonstrações significativas tem atestado a viabilidade em unidades estacionárias na faixa de dezenas de KW a alguns MW de potência em hospitais, condomínios residenciais, repartições públicas e outros[6, 13]. Devido a sua alta temperatura de operação (800 a 1000 °C), o processo gera também certa quantidade de energia térmica e vapor d’água condensado. O calor liberado, como o vapor d’água, pode ser reaproveitado no processo de geração de energia em turbina a gás, aumentando seu rendimento global acima de 80% [15].
O estado da arte dos componentes de uma SOFC de alta temperatura são zircônia estabilizada com ítria (ZrO2/Y2O3 - YSZ) como eletrólito, manganito de lantânio dopado com estrôncio (La1-XSrXMnO3 -
LSM) como catodo e cermet de zircônia - ítria - níquel (ZrO2/Y2O3/Ni - YSZ/Ni) como anodo [14, 18].
O estudo e o desenvolvimento do material catódico cerâmico da SOFC, La1-xSrxMnO3, de estrutura
pseudo peroviskita ou peroviskita distorcida tem mostrado que este composto é bastante viável para ser utilizado como material catódico, pois exibe boa estabilidade química e térmica, alta atividade catalítica na redução do oxigênio, coeficiente de expansão térmica razoavelmente similar ao eletrólito sólido e alta condutividade elétrica, obtida com o aumento de formação de cátions Mn4+ e pela substituição de cátions La3+ por cátions Sr2+ [13, 20].
A literatura técnica mostra diferentes rotas de síntese para obtenção de La1-xSrxMnO3 [1, 8] e bem
como verificou que as concentrações molares de estrôncio mais estudados foram os valores de x = 0,20; 0,30 e 0,40 [17, 21].
Dentre estas rotas, cita-se que na síntese do LSM pela técnica de sol-gel por GAUDON, LABERTY-ROBERT, ANSART et al. (2002) [7], há formação do La2O3, para concentrações de lantânio
430 enfatiza que este óxido reage facilmente com o eletrólito YSZ formando zirconato de lantânio (La2Zr2O7)
comprometendo no desempenho das SOFCs.
No presente trabalho é dada a ênfase na síntese do material catódico de La1-xSrxMnO3 para valores
de x = 0,15 e 0,50 (15 e 50% em mol de Sr) utilizando a técnica dos citratos. Esta técnica envolve fases líquidas, permitindo o controle da composição química, distribuição granulométrica e homogeneidade química da mistura.
Este trabalho permite contribuir para o desenvolvimento tecnológico do processo de obtenção do material catódico para uso em SOFC e para o avanço da tecnologia de energia renovável no âmbito nacional. 2 MATERIAIS E MÉTODOS
As matérias-primas utilizadas para a obtenção do manganito de lantânio dopado com estrôncio a partir da técnica dos citratos são:
nitrato de lantânio hexahidratado, La(NO3)3.6H2O, com 99,99 % de pureza (Aldrich);
nitrato de estrôncio, Sr(NO3)2, com 99,93 % de pureza (Aldrich);
nitrato de manganês tetrahidratado, Mn(NO3)2.4H2O, com 99,99 % de pureza (Aldrich);
ácido cítrico, HOC3H4(COOH)3, P. A. (Merck); e
etileno glicol, HOCH2CH2OH, P. A. (Merck).
Os compostos de La1-XSrXMnO3 foram sintetizados pela técnica dos citratos e posteriormente
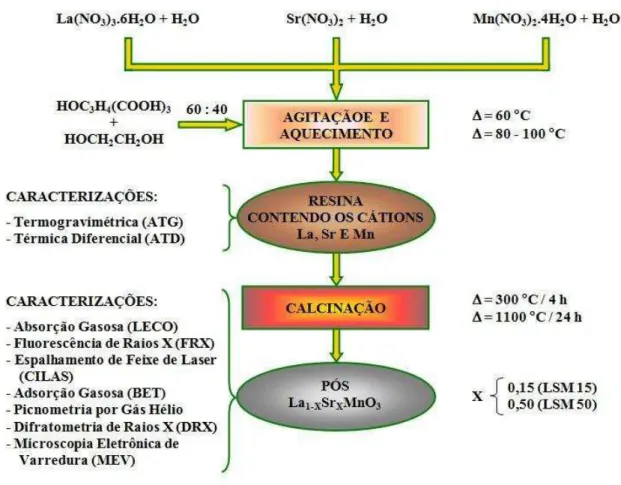
caracterizados por diferentes técnicas de análise, como apresenta o fluxograma na Figura 1.
Figura 1: Seqüência experimental para preparação e caracterização dos pós de La1-xSrxMnO3.
431 mais etileno glicol sob agitação e aquecimento à temperatura entre 80 e 110 oC. Nesta fase, a água é evaporada até a obtenção de um líquido viscoso. O nitrato na forma de NO2 é inicialmente evaporado,
ocorrendo uma poliesterificação, fixando e distribuindo os cátions ao longo da cadeia orgânica e, obtendo-se uma resina de cor marrom. A etapa seguinte consiste na evaporação do nitrato residual e a de transformação da resina em pó de La1-xSrxMnO3, calcinando o material resinoso à temperatura de 300 oC por 4 horas e
posteriormente a 1100 oC ao ar por 24 horas para uma síntese completa da reação e eliminação do carbono residual.
Os pós de La1-xSrxMnO3 foram sintetizados para diferentes concentrações de estrôncio. Os
experimentos estão direcionados para obtenção de compostos para x iguais a 15 e 50% em mol de Sr. 3 RESULTADOS E DISCUSSÃO
Para análise termogravimétrica (ATG) e análise térmica diferencial (ATD), avaliou-se os compostos voláteis da reação. Partiu-se da amostra La0,50Sr0,50MnO3 (LSM 50) constituída de resina previamente seca a
90 °C.
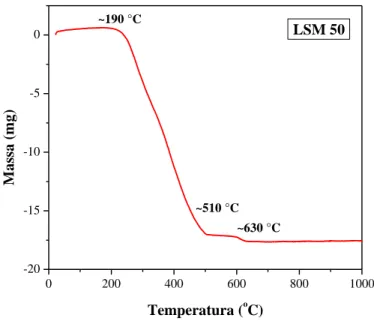
Os resultados apresentados na ATG (Figura 2), mostra o processo de decomposição em duas regiões bem distintas para temperaturas até 1000 ºC.
Na Figura 2, verifica-se que na faixa de temperatura de 25 a ~190 ºC, não há variação de perda de massa. Tal resultado pode estar possivelmente relacionado com a calibração do instrumento de medida. Entretanto, nesta faixa de temperatura, experimentalmente observou-se uma ligeira perda de massa de vapor d’água e início da liberação de íons NO
2-;
De ~190 a ~510 ºC, uma perda acentuada de 62,7 % em massa constituída da liberação de íons NO2- e de carbono na forma de CO2. Nessa fase há formação de resina polimérica composta de
elementos La, Sr, Mn, C, H e O;
De ~510 a ~630 ºC, correspondente a perda de 2,2 % em massa, resultante da quebra de polímero e liberação do carbono residual na forma de CO2;
A partir de 630 ºC o composto mostrou-se estável.
Na transformação dos nitratos correspondente ao LSM 50, houve perda de massa total em torno de 64,9% em peso na faixa de 190 a 630 ºC.
0 200 400 600 800 1000
-20 -15 -10 -5 0
~630 °C ~510 °C ~190 °C
M
a
ss
a
(
m
g
)
Temperatura (oC)
LSM 50
Figura 2: Curva da ATG para LSM 50 na forma de gel polimérico.
432 temperatura de ~270 a ~530 °C ocorre a formação da fase manganita (LESSING, 1989), com a cristalização do material na temperatura de ~440 °C, apresentado como pico exotérmico mais intenso na curva de ATD.
0 200 400 600 800 1000
-50 -40 -30 -20 -10 0
~530 °C ~130 °C
~270 °C
~440 °C EXO
LSM 50
A
T
D
(
V
)
Temperatura (oC)
Figura 3: Curva da ATD para LSM 50 na forma de gel polimérico.
Na análise de espectrometria de fluorescência de raios X (FRX), as amostras La0,85Sr0,15MnO3 (LSM
15) e La0,50Sr0,50MnO3 (LSM 50) apresentaram os teores dos elementos em percentagem massa, que por meio
de cálculos, obtiveram-se os valores em percentagem molar para os compostos de La1-XSrXMnO3, como
mostra a Tabela 1.
Os valores das concentrações dos elementos constituintes das amostras calculados estequiometricamente antes da reação estão próximos com os determinados e obtidos por esta análise.
Tabela 1: Valores obtidos pela análise FRX.
Amostras Elementos (% massa) Compostos
LSM 15 La = 49,52 ± 0,02 Sr = 7,15 ± 0,04 MnO3 = 43,33 ± 0,06
La0,81Sr0,19MnO3
LSM 50
La = 30,2 ± 0,1 Sr = 23,70 ± 0,05 MnO3 = 46,1 ± 0,1
La0,45Sr0,55MnO3
Para análise do carbono residual nas amostras proveniente da adição de ácido cítrico e etileno glicol como reagentes da reação, utilizou a técnica de cromatografia de absorção gasosa.
Os resultados estão mostrados na Tabela 2 em percentagem das quantidades de carbono residuais contidas nas amostras LSM 15 e LSM 50 após calcinação a 1100 ºC por 12 e 24 horas.
Tabela 2: Quantidade residual de carbono presente nas amostras LSM 15 e LSM 50 após calcinação a 1100 ºC / 12 e 24 h.
Amostras %C após calcinação a 1100 ºC
12 h 24 h
433 Segundo BAYTHOUN e SALE (1982) [3], temperaturas superiores a 1000 °C são necessárias para remover carbono do produto, pois em temperaturas mais baixas de calcinação, observa-se a presença de carbono na forma de carbonatos ou carbono livre resultante da decomposição do citrato. Conforme estes autores, abaixo desta temperatura, há uma forte influência do tempo de calcinação.
Os resultados da calcinação a 1100 ºC por 12 e 24 horas, conforme os dados da Tabela 2, apresentam valores bastante próximos de teor de carbono residual e observando-se que a remoção do carbono não é influenciado pelo tempo de calcinação nesta temperatura adotada. Os teores de carbono residuais a 1100 ºC / 24 h mostraram abaixo da temperatura de 1400 °C / 4 h, utilizado por BAYTHOUN e SALE (1982) [3].
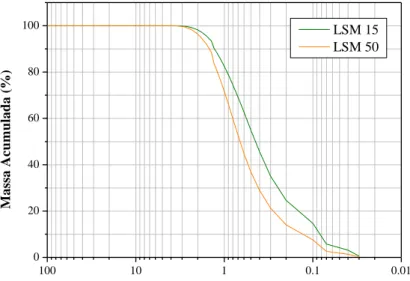
Na análise granulométrica por espalhamento de feixe de laser, o diâmetro médio equivalente por massa acumulada é apresentado na Figura 4.
Os resultados obtidos mostram que para a amostra LSM 15 (sem a moagem após a calcinação) foi identificado um diâmetro médio equivalente de 0,68 m e para LSM 50 (com a moagem de 4 h da amostra calcinada) foi de 0,88 m. Tais granulometrias obtidas são adequadas para o processamento cerâmico dos pós, conforme a literatura. Observou-se que a amostra LSM 50 calcinada sofreu uma moagem, devido esta amostra apresentar um diâmetro médio de 4,27 m, que na etapa de processamento não obteve resultados satisfatórios.
100 10 1 0.1 0.01
0 20 40 60 80
100 LSM 15
LSM 50
M
a
ss
a
A
c
u
m
u
la
d
a
(%
)
Diâmetro Médio Equivalente (m)
Figura 4: Curvas de distribuição granulométrica dos pós LSM 15 e LSM 50.
Na análise de adsorção gasosa (BET), os valores da área superficial específica (S) das amostras estão apresentados na Tabela 3. Os pós submetidos para esta análise foram calcinados a 1100 °C por 24h e submetidos à moagem em moinho atritor por 4 horas (para amostra LSM 50).
O diâmetro médio de partículas (D) foi possível calcular, utilizando os valores da área superficial específica (S) e da densidade teórica (ρ) do material calculado através dos parâmetros de rede refinados disponíveis em microfichas JCPDS desses materiais. Os resultados estão apresentados na Tabela 3.
Tabela 3: Área superficial específica das amostras LSM 15 e LSM 50.
Amostras S (m2/g) ρ (g/cm3) D (μm)
LSM 15 4,27 ± 0,05 6,59 0,21
LSM 50 3,32 ± 0,02 6,08 0,30
434 Na análise de picnometria por gás hélio, as amostras LSM 15 e LSM 50 apresentaram os seguintes resultados de densidade real, conforme a Tabela 4. Nesta análise verificou-se que quanto maior a dopagem de estrôncio, menor é o valor da densidade.
Tabela 4: Densidade real das amostras LSM 15 e LSM 50.
Amostras Densidade Real (g/cm3)
LSM 15 6,24 ± 0,01
LSM 50 6,02 ± 0,01
Por difratometria de raios X (DRX) verificou-se a formação da estrutura cristalina característica para cada amostra. A Figura 5 apresenta os difratogramas dos pós de LSM 15 e LSM 50.
Figura 5: Difratogramas obtidos por DRX dos pós LSM 15 (a) e LSM 50 (b).
Os difratogramas de raios X mostram uma possível formação da estrutura cristalina hexagonal com parâmetros de rede a = 5,5156 ± 0,0015 Å e c = 13,3211 ± 0,0003 Å para LSM 15 e tetragonal com seus parâmetros de rede a = 5,4883 ± 0,0070 Å e c = 7,7393 ± 0,0002 Å para LSM 50 (CHIBA, 2005). Estes cálculos de parâmetros de rede foram possíveis, devido aos programas Crystallographica Search Match e Celref, e as microfichas JCPDS encontradas de suas respectivas estruturas cristalinas e grupos espaciais. Segundo ROMARK, WIIK, STOLEN et al.(2002) [16], essas transformações de estruturas cristalinas ocorreram para as amostras La0,8Sr0,2MnO3,06 e La0,4Sr0,6MnO3.
Para estas amostras LSM 15 e LSM 50, identificou-se também a possível presença de uma pequena quantidade de La2O3 e La(OH)3 [5], respectivamente, proveniente da não total polimerização com os íons
La3+. Os resultados das estruturas cristalinas estão de acordo com os dados apresentados por GAUDON, LABERTY-ROBERT, ANSART et al. (2002) [7], que também verificaram a presença de La2O3 nos
resultados de DRX.
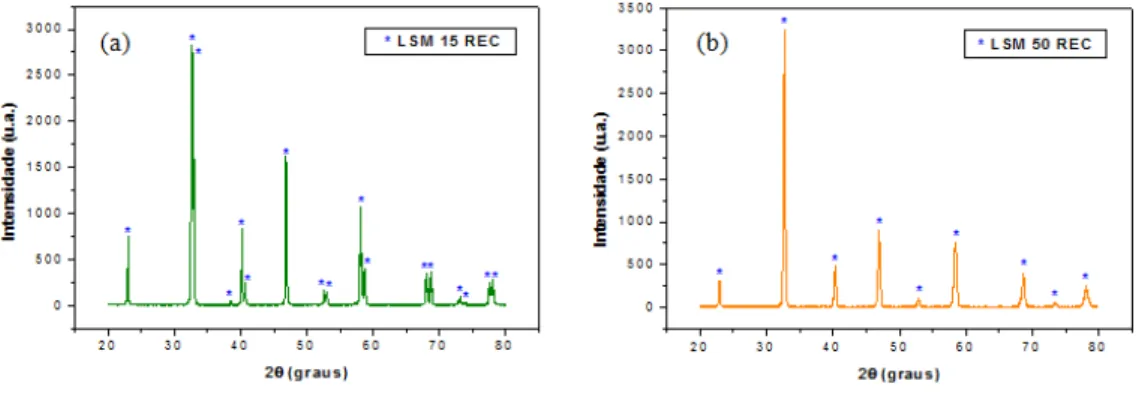
Em face destes resultados, fez-se um tratamento com relação aos compostos de La2O3 e La(OH)3 nas
amostras LSM15 e LSM 50. Realizou-se uma dissolução nítrica [19] a 65 % de concentração de HNO3,
lavagem com água destilada, posterior secagem e calcinação a 800 °C / 1 h. A Figura 6 mostra os difratogramas de raios X das amostras denominadas LSM 15 REC e LSM 50 REC e observou-se que não há presença dos compostos La(OH)3 e La2O3, resultando somente os compostos de LSM.
435 Os compostos tratados, LSM 15 REC e LSM 50 REC, apresentam estruturas cristalinas hexagonal e tetragonal, e parâmetros de rede calculada a = b = 5,5096 ± 0,0021 Å e c = 13,3218 ± 0,0002 Å, e a = b = 5,4673 ± 0,0064 Å e c = 7,7373 ± 0,0004 Å, respectivamente.
As composições químicas dos compostos tratados foram verificadas após a dissolução em ácido nítrico por FRX (Tabela 5). Para as amostras LSM 15 e LSM 50, as composições apresentadas antes e depois do tratamento não mostram uma diferença significativa.
Tabela 5: Composição química dos compostos tratados.
Amostras Compostos Compostos tratados
La0,85Sr0,15MnO3
La0,81Sr0,19MnO3
(LSM 15)
La0,80Sr0,20MnO3
(LSM 15 REC) La0,50Sr0,50MnO3
La0,45Sr0,55MnO3
(LSM 50)
La0,44Sr0,56MnO3
(LSM 50 REC)
Conforme os resultados apresentados na Tabela 5, a diminuição na concentração de lantânio é devida à dissolução nítrica, eliminando a fase secundária de La2O3 ou de La(OH)3, ocasionando a mudança
no valor de concentração molar na composição, embora a diferença entre as concentrações seja pequena. Nos compostos obtidos após a síntese, os valores de concentrações molares do lantânio são relativos ao composto formado e a fase secundária.
Desta forma, o tratamento com HNO3, mostrou-se eficiente para as duas amostras, eliminando as
fases secundárias presentes e ainda obter uma composição química com mínima perda dos elementos constituintes.
Na análise de microscopia eletrônica de varredura (MEV) é observada a morfologia das partículas dos pós LSM 15 e LSM 50 obtidos após calcinação a 1100 °C / 24 h. A Figura 7 apresenta as micrografias dos pós LSM 15, LSM 15 REC, LSM 50 e LSM 50 REC.
436 Nas micrografias pode-se observar que os pós se encontram na forma de aglomerados e os tamanhos das partículas são inferiores a 1 m. Para amostras LSM 15 e LSM 15 REC, os tamanhos das partículas estão com formas mais homogêneas, que para as amostras LSM 50 e LSM 50 REC.
4 CONCLUSÕES
Pela técnica de síntese dos citratos é possível a obtenção de pós de LSM 15 e LSM 50 com composições aproximadas com os valores de concentrações estequiométricas.
As condições de calcinação adotadas (1100 °C por 24 horas) para as amostras de LSM 15 e LSM 50 foram adequadas para remoção do carbono residual.
Os resultados obtidos na análise granulométrica por espalhamento de feixe de laser comprovam que os tamanhos de partículas/aglomerados são inferiores a 1 m.
Por DRX, identificou-se a presença de La2O3 e La(OH)3, assim como os compostos LSM 15 e LSM
50, e os compostos tratados LSM 15 REC e LSM 50 REC. Observou-se nos difratogramas de raios X, a formação da estrutura cristalina hexagonal para LSM 15 eLSM 15 REC, e tetragonal para LSM 50 e LSM 50 REC.
Os resultados obtidos por dissolução nítrica foram satisfatórios para eliminação das fases secundárias, La2O3 e La(OH)3, comprovadas por DRX e FRX.
As micrografias observadas por MEV e os valores de densidades mostram que a amostra LSM 15 são pós mais reativos se comparado ao LSM 50.
As micrografias dos pós mostram que o tamanho de partículas é inferior a 1 m e a forma de aglomerados para amostras LSM 15 e LSM 15 REC é mais homogênea se comparada às amostras LSM 50 e LSM 50 REC.
As características dos pós obtidos para as amostras LSM são contribuições para o estudo do material catódico para fabricação de células unitárias nas SOFCs.
5 AGRADECIMENTOS
Os autores agradecem ao CNPq pelo apoio financeiro, aos amigos e colegas, Celso V. de Morais, Eliana N. S. Muccillo, Ivana C. Consentino, Nelson B. de Lima, Nildemar A. M. Ferreira, Rene R. Oliveira e Yone V. França (CCTM-IPEN); José O. V. Bustillos, Thais C. Prado e Vera L. R. Salvador (CQMA-IPEN); e Hamilton P. S. Corrêa (IQ-UNESP) pelo auxílio e colaboração contidas neste trabalho.
6 BIBLIOGRAFIA
[1] ARUNA, S.T., MUTHURAMAN, M., KASHINARH, P.C., “Combustion synthesis and properties of strontium substituted lanthanum manganites La1-xSrxMnO3 (0 x 0,3)”, Journal of Materials
Chemistry, v. 7, n. 12, pp. 2499-2503, 1997.
[2] BADWAL, S.P.S., “Stability of solid oxide fuel cell components”, Solid State Ionics, v. 143, pp. 39-46, 2001.
[3] BAYTHOUN, M.S.G., SALE, F.R., “Production of strontium-substituted lanthanum manganite perovskite powder by the amorphous citrate process”, Journal of Materials Science, v. 17, pp. 2757-2769, 1982.
[4] CGEE - Centro de Gestão e Estudos Estratégicos, “Programa Brasileiro de Células a Combustível”, Ministério da Ciência e Tecnologia, 2002.
[5] CHIBA, R., Obtenção e caracterização de manganito de lantânio dopado com estrôncio para aplicação em células a combustível de óxido sólido, Dissertação de M.Sc., IPEN - Instituto de Pesquisas Energéticas e Nucleares / USP - Universidade de São Paulo, São Paulo, São Paulo, SP, Brasil, 2005. [6] FULLER, T.F., “Is a fuel cell in your future?”, The Electrochemical Society Interface, v. 6, n. 3, pp.
26-32, 1997.
[7] GAUDON, M., LABERTY-ROBERT, C., ANSART, F., STEVENS, P., ROUSSET, A., “Preparation and characterization of La1-xSrxMnO3+ (0 x 0,6) powder by sol-gel processing”, Solid State
437 [8] IOROI, T., HARA, T., UCHIMOTO, Y., OGUMI, Z., TAKEHARA, Z., “Preparation of perovskite-type La1-xSrxMnO3 films by vapor-phase processes and their electrochemical properties”, Journal of the
Electrochemical Society, v. 145, n. 6, pp. 1999-2004, 1998.
[9] JORGENSEN, M.J., “Lanthanum manganate based cathodes for solid oxide fuel cell”, Materials Research Department, Riso National Laboratory, Riso-R-1242, 2001.
[10] KORDESCH, K., SIMADER, G., Fuel cells and their applications, Weinheim, New York, Basel, Cambridge, Tokyo, VCH, 1996.
[11] LESSING, P.A., “Mixed-cation oxide powders via polymeric precursors”, Ceramic Bulletin, v. 68, n. 5, pp. 1002-1007, 1989.
[12] LINARDI, M., ARICÓ, E.M, WENDT, H., “Células a combustível de baixa potência para aplicações estacionárias”, Química Nova, v. 25, n. 3, pp. 470-476, 2002.
[13] MINH, N.Q., “Ceramic fuel cells”, Journal of the American Ceramic Society, v. 76, n. 3, pp. 563-588, 1993.
[14] MINH, N.Q., “Solid oxide fuel cell technology - features and applications”, Solid State Ionics, v. 174, pp. 271-277, 2004.
[15] RISO ENERGY REPORT 1, “New and emerging technologies - options for the future”, Riso National Laboratory, Riso-R-1351, 2002.
[16] ROMARK, L., WIIK, K., STOLEN, S., Grande, T., “Oxygen stoichiometry and structural properties of La1-XAXMnO3±δ(A = Ca or Sr and 0 ≤ X ≤ 1)”, Journal of Materials Chemistry, v. 12, pp.
1058-1067, 2002.
[17] TANASESCU, S., TOTIR, N.D., MARCHIDAN, D.I., TURCANU, A., “The influence of compositional variables on the thermodynamic properties of lanthanum strontium ferrite manganites and lanthanum strontium manganites”, Materials Research Bulletin, v. 32, n. 7, pp. 915-923, 1997.
[18] TIFFÉE, E.I., WEBER, A., HERBSTRITT, D., “Materials and technologies for SOFC - components”, Journal of the European Ceramic Society, v. 21, pp. 1805-1811, 2001.
[19] WALLER, D., LANE, J.A., KILNER, J.A., STEELE, B.C.H., “The effect of thermal treatment on the resistance of LSCF electrodes on gadolinia doped ceria electrolytes”, Solid State Ionics, v. 86-88, pp. 767-772, 1996.
[20] YAMAMOTO, O., “Solid oxide fuel cells: fundamental aspects and prospects”, Electrochimica Acta, v. 45, pp. 2423-2435, 2000.