FACULDADE DE CEILÂNDIA
PÓS-GRADUAÇÃO EM CIÊNCIAS E TECNOLOGIAS EM SAÚDE
MARCUS AURELIO DA COSTA TAVARES SABINO
INVESTIGAÇÃO DO METABOLISMO REDOX EM UM MODELO ANIMAL TOLERANTE A SITUAÇÕES
POTENCIALMENTE DANOSAS À SAÚDE
ORIENTADOR: DR. ALEXIS F. WELKER CO-ORIENTADOR: DR. MARCELO HERMES-LIMA
ii
MARCUS AURELIO DA COSTA TAVARES SABINO
INVESTIGAÇÃO DO METABOLISMO REDOX EM UM MODELO ANIMAL TOLERANTE A SITUAÇÕES
POTENCIALMENTE DANOSAS À SAÚDE
Dissertação apresentada ao Programa de Pós-Graduação em Ciências e Tecnologias em Saúde da Universidade de Brasília para a obtenção do título de Mestre.
Orientador: Dr. Alexis Fonseca Welker. Co-Orientador: Dr. Marcelo Hermes-Lima.
iii
iv
INVESTIGAÇÃO DO METABOLISMO REDOX EM UM MODELO ANIMAL TOLERANTE A SITUAÇÕES
POTENCIALMENTE DANOSAS À SAÚDE
MARCUS AURELIO DA COSTA TAVARES SABINO
Dissertação defendida no Programa de Pós-graduação “Stricto Sensu” em
Ciências e Tecnologias em Saúde da Universidade de Brasília, como parte das exigências para a obtenção do título de Mestre. Número de páginas: 74.
Banca examinadora constituída pelos seguintes membros:
________________________________________________ Prof. Dr. Alexis Fonseca Welker
Universidade de Brasília
Programa de Pós-Graduação em Ciências e Tecnologias em Saúde
________________________________________________ Profa. Dr. Vicente de Paulo Martins
Universidade de Brasília
Programa de Pós-Graduação em Ciências e Tecnologias em Saúde
________________________________________________ Prof. Dr. Eduardo Antônio Ferreira
Universidade de Brasília
________________________________________________ Profa. Dra. Tatiana Ramos Lavich
v
AGRADECIMENTOS
Agradeço imensamente a meu pai que sempre apoiou meus estudos, minha dedicação e vontade de querer aprender e realizar meus sonhos, infelizmente ele não teve esta oportunidade, não estaria aqui senão fosse por seu imenso e arduoso trabalho, pela sua paciência e preocupação após permanecer dias fora de casa fazendo meu trabalho.
Agradeço aos meus parentes pelo grande apreço dado a minha vida, em especial minhas duas mães.
Agradeço à Cida Aguiar, minha namorada, pela imensa paciência e preocupação das horas em que eu chegava a minha casa tarde.
Agradeço aos inúmeros colegas e amigos que fiz e passaram no laboratório de radicais livres, no qual tive a oportunidade de conhecer.
Agradeço ao biólogo Roberto Andrade Junior pelo treinamento no grupo dos ANIMAIS.
Agradeço à farmacêutica e Mestra Juliana Bicálio pelo treinamento inicial que tive no laboratório, além do bom convívio.
Agradeço à Dra. Luana Dalvi pelo excelente convívio no laboratório por anos. Agradeço ao ex IC do laboratório, Igor Santos, por ajudar em uma das coletas e por ajudar e acompanhar de perto os experimentos.
Agradeço a Hylane e Lara pelo bom convívio no laboratório.
Agradeço ao aluno de doutorado na época e hoje orientador e professor Dr. Alexis Welker pelos incentivos, aprendizagens metodologicas e oportunidades de fazer iniciação científica e mestrado na UnB.
Agradeço ao técnico do laboratório Francisco Orivan “Chiquinho” pelas
muitas ajudas incontáveis no laboratório, além das prosas do corredor, saudáveis ao bom convívio social.
Agradeço ao grande amigo Daniel Carneiro Moreira, que virou um grande gênio da bancada e biologia experimental, por suas ideias, críticas, sugestões, e ceticismo experimental, pela ajuda e ideias na coleta do dia I, pela ajuda nas parafernalhas eletrônicas que horas funcionam, horas não funcionam, e com paciência e astúcia conseguia sanar na medida do possível os experimentos devido a sua larga experiência em informática.
Agradeço a professora Dra. Carolina Arruda Freire e o seu aluno de mestrado Leonardo Rios pela colaboração, ajuda na coleta, identificação da espécie estudada, e hospedagem/tour em Curitiba.
Agradeço ao professor Dr. Marcelo Hermes-Lima pelo convite de ter entrado precocemente no seu laboratório, pelas inúmeras dicas, discussões, pelo incentivo de
fazer ciência de alto nível “fronteira”, pela oportunidade de encabeçar este projeto, de
tomar a frente dele, pela oportunidade de contribuir na confecção de artigo científico, por representar o laboratório internacionalmente com os estudos desta dissertação e conhecer pessoas diferentes no mundo científico.
Agradeço a CAPES pelo incentivo de fazer este trabalho com bolsa, e aos funcionários da secretaria da pós-graduação da FCE pelo bom atendimento que recebi.
“Se eu vi mais longe, foi por estar ao ombro de gigantes”.
vi ÍNDICE
AGRADECIMENTOS ... v
ÍNDICE ... vi
LISTA DE TABELAS ... ix
LISTA DE ABREVIAÇÕES ... x
LISTA DE FIGURAS ... xi
RESUMO ... xiii
ABSTRACT ... xiv
INTRODUÇÃO GERAL ... 15
OBJETIVOS ... 21
CAPÍTULO 1 – MANUSCRITO 1: METABOLISMO DA GLUTATIONA NO MEXILHÃO MYTILASTER SOLISIANUS (MYTILIDAE) EM CICLOS NATURAIS DE MARÉS ... 22
1.INTRODUÇÃO ... 22
2.OBJETIVO ... 23
3.MATERIAL E MÉTODOS ... 23
3.1. COLETA DOS ANIMAIS...23
3.2.1. NÍVEIS DE EQUIVALENTES DE GLUTATIONA (EQ-GSH) ...28
3.2.2. PROCESSAMENTO DAS AMOSTRAS...29
3.2.3. PREPARO DE SOLUÇÃO PADRÃO DE GSH...30
3.2.4. CURVA-PADRÃO E MEDIÇÃO ...31
4.ESTATÍSTICA ... 31
5.RESULTADOS ... 31
5.1. REGISTRO DA TEMPERATURA AMBIENTE ...32
5.2. CURVA DE DISTRIBUIÇÃO (COMPRIMENTO E PESO)...32
5.3. PARÂMETROS DE GLUTATIONA (EQ-GSH, GSH, GSSG E RAZÃO GSSG/EQ-GSH)...33
5.4. ESTUDOS DE CORRELAÇÃO...39
6. DISCUSSÃO ... 45
vii
8. REFERÊNCIAS BIBLIOGRÁFICAS ... 53
CAPÍTULO 2 – MANUSCRITO 2: HOW WIDESPREAD IS PREPARATION FOR OXIDATIVE STRESS IN THE ANIMAL KINGDOM? ... 61
3. DISCUSSÃO GERAL E CONCLUSÕES ... 62
ANEXO A – Pedra na qual os animais foram coletados nas três coletas, foto específica da coleta I ... 73
viii LISTA DE ANEXOS
ANEXO A – Pedra na qual os animais foram coletados nas três coletas, foto específica da coleta I. ... 73
ix LISTA DE TABELAS
x LISTA DE ABREVIAÇÕES
BAX BCL2-associated X protein BCL2 B cell linfoma 2
DTNB 5,5’-ditiobis-2-ácido nitrobenzóico Eq-GSH Equivalents de glutationa
EROs Espécies reativas de oxigênio FOX Forkhead box
G6PDH Glicose-6-fosfato desidrogenase GSH Glutationa
GSSG Glutationa dissulfeto
Se-GPx Glutationa peroxidase dependende de selênio GPx Glutationa peroxidase
GR Glutationa redutase GST Glutationa transferase HSP Proteínas de choque térmico H2O2 Peróxido de hidrogênio HIF Fator induzido por hipóxia LDH Lactato desidrogenase Nrf2 Nuclear fator eritroide 2 Prx Peroxiredoxina
POS Preparo para o estresse oxidativo
O2 Oxigênio
˙OH Radical hidroxil
O2- Radical ânion superóxido OMS Organização Mundial de Saúde SOD Superóxido dismutase
SOD1 Superóxido dismutase dependente de cobre e zinco TCA Ácido tricloroacético
TNB 5-tio-2-ácido nitrobenzóico XO Xantina oxidase
XDH Xantina desidrogenase 2-VP 2-vinilpiridina
xi LISTA DE FIGURAS
Figura 1. Tábua das marés (u.a. unidade arbitraria) para as três coletas mostrando momentos em que a maré alta se encontra no seu pico em seus respectivos dias, e os animais se encontram imersos, e momentos de maré baixa e os animais emersos, nos dias 1 e 2 de novembro de 2014 (à esquerda e ao centro da figura), e para o dia 09 de
maio (à direita). Fonte: Tábua das Marés, Marinha do Brasil
<http://www.mar.mil.br/dhn/chm/box-previsao-mare/tabuas/>...25 Figura 2. A. Coleta de mexilhões durante a exposição aérea. B. Seta apontando para o bisso...26
Figura 3. Grupos experimentais das três coletas. Os grupos destacados foram escolhidos para a realização das análises de GSH nos mexilhões...29 Figura 4. Reação entre DTNB e 2 moléculas de GSH, produzindo TNB (detectado em 412 nm) e GS-TNB. Glutationa redutase (GR) reduz GS-TNB na presença de NADPH, e GSH é produzida novamente e retorna a participar da reação com DTNB, enquanto que GSSG presente na amostra também é biotransformada produzindo duas moléculas de GSH. Figura modificada de Rahman et al., (2006), e Caito e Aschner (2015)...30 Figura 5. Registro da temperatura da água e ar ao longo das três coletas...33 Figura 6. Dados de distribuição (%) do comprimento (cm) e peso dos mexilhões (mg). N=146 animais. A. Comprimento dos animais (cm). B. Peso dos animais (mg)...34 Figura 7. Regressão linear entre comprimento (cm) e peso (mg) nos mexilhões. N=146 animais...34
xii
Figura 10. Níveis de GSSG nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental. Dados dos níveis de GSSG da coleta I à esquerda, coleta II no centro, coleta III à direita...36
Figura 11. Níveis de GSSG/Eq-GSH nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental. Dados da razão GSSG/Eq-GSH da coleta I à esquerda, coleta II no centro, coleta III à direita...37
Figura 12. Correlação entre os níveis de GSH e Eq-GSH em todos os mexilhões analisados. N=146 animais...40 Figura 13. Correlação entre os níveis de GSSG e Eq-GSH em todos os mexilhões analisados. N=146 animais...41 Figura 14. Correlação entre os níveis de GSH e a razão GSSG/Eq-GSH em todos os mexilhões analisados. N=146 animais...41 Figura 15. Correlação entre os níveis de GSSG e a razão GSSG/Eq-GSH em todos os mexilhões analisados. N=146 animais...42 Figura 16. Correlação entre os níveis de Eq-GSH e comprimento em todos os
mexilhões analisados. N=146
xiii RESUMO
Nos animais sensíveis à privação de O2, é observada a injúria tecidual durante a hipóxia e o reoxigenação, tendo como causa principal o estresse oxidativo gerado por radicais livres derivados do oxigênio. Uma das estratégias encontradas por uma ampla variedade de animais à escassez de oxigênio é responder a este insulto com aumento das defesas antioxidantes, e assim evitar o dano oxidativo causado pelos radicais livres, fenômeno nomeado de preparo para o estresse oxidativo (POS). Nossa pergunta é saber se o fenômeno bioquímico do POS acontece na natureza, em especial, no ambiente entre marés, no qual mudanças cíclicas de retirada e oferta de oxigênio acontecem durante a baixa e alta das marés. Nestas condições de baixa e alta da maré em uma praia de Penha (Santa Catarina, Brasil), foi estudado o metabolismo redox envolvendo glutationa (GSH), em análise de corpo inteiro nos mexilhões da espécie Mytilaster solisianus, em três diferentes coletas (chamadas de I, II e III). Os animais mostraram suportar o esperado desequilíbrio redox durante as situações de exposição aérea (de até quatro horas na coleta I e II, e até 9 horas na coleta III) e reimersão no campo, pois os parâmetros antioxidantes endógenos relacionados ao metabolismo de GSH estiveram inalterados durante o ciclo das marés (i.e. Eq-GSH, GSH, GSSG e GSSG/Eq-GSH). Todavia na coleta III, houve uma queda dos níveis totais de Eq-GSH após duas horas de exposição aérea em relação ao grupo de animais pré-imersos. Na coleta III houve uma forte variação da temperatura do ar ao longo da exposição aérea (de 19 para 28° C), apesar disso, o indicador de desequilibrio redox não mudou (razão GSSG/Eq-GSH), mostrando que estes animais têm alto grau de adaptabilidade neste ambiente, no qual os fatores abióticos estão em constante mudança.
xiv ABSTRACT
In animals sensible to oxygen privation is seen injury in their tissues during hypoxia and reoxygenation, and the main cause is the oxidative stress generated by oxygen-derived free radicals. One of the strategies found by a widespread variety of animals to survive oxygen lack is respond with increase of antioxidant defenses, and thus avoiding the oxidative damage caused by free radicals, a phenomenon named preparation for oxidative stress (POS). Our question address if biochemical phenomenon of POS happens in nature, in special, in the intertidal environment, where changes cyclical of lack and supply oxygen happens during low and high tide. In these conditions of low and high tide in beach of Penha (Santa Catarina, Brazil), was studied redox metabolism of glutathione (GSH), in body whole analysis in the mussel specie Mytilaster solisianus in three differents expeditions (named of I, II e III). The animals shown endure to the expected redox imbalance during aerial exposure (until four hours in expedition I e II, and until 9 hours in expedition III) and reimmersion in field, because the endogenous antioxidant parameters related to the metabolism of the glutathione remained unchanged during tidal cycle (i.e GSH-eq, GSH, GSSG and GSSG/GSH-eq ratio). However in expedition III, there was a drop in glutathione pool (GSH-eq) after two hours of aerial exposure when compared to group of animals pre-emersion. In expedition III there was a strength variation in air temperature (19 to 28° C) during aerial exposure, despite this, the index of redox imbalance remained unchanged (GSSG/GSH-eq) in expedition III, showing that mussels have high level of adaptability in this environment, in which abiotic factors are in continuous changes.
INTRODUÇÃO GERAL
No decorrer dos anos 80 e 90 do século XX iniciaram-se os estudos moleculares que associavam a geração em excesso de radicais livres derivados do oxigênio molecular (O2) como o responsável pela injúria da isquemia (privação sanguínea) e reperfusão (reintrodução sanguínea) em tecidos de camundongos. A incubação tecidual com antioxidantes enzimáticos como superóxido dismutase (SOD) e catalase aumentava a viabilidade celular destes (Zewier et al., 1987; Zewier et al., 1988). Ao submeter camundongos transgênicos que super-expressam SOD1 (isoforma dependente de cobre e zinco) à isquemia e reperfusão no miocárdio, a concentração de radicais livres é mantida no nível do controle, gerando menos necrose tecidual quando comparado com o tecido que não super-expressa SOD1 (Wang et al., 1998). Ainda neste contexto, tinham-se evidências experimentais de que os radicais livres aumentavam de concentração durante a isquemia, por outro lado a reperfusão hipóxica gerava menos radicais de oxigênio do que a reperfusão normóxica, ilustrando a relação (paradoxal) entre a variação da disponibilidade do O2 (molécula fundamental para a vida aeróbica) e injúria (Zewier et al., 1987; Bolli et al., 1989).
Na época, acreditava-se que determinados sistemas enzimáticos, como xantina oxidase (XO) (formada através da proteólise durante os processos de extração e purificação ou a partir da oxidação de resíduos sulfidrilas de cisteína de xantina desidrogenase (XDH)) era considerada como fonte de radicais livres de oxigênio durante o estresse oxidativo pós-isquêmico, produzindo radical anion superóxido (O2 -) e o mais reativo radical livre hidroxil (˙OH) (este tem sua produção favorecida em
XDH (Xia e Zweier, 1995; Lee et al., 2014). Em paralelo a estes estudos, em camundongos, mostrou-se que os metabólitos xantina, hipoxantina e succinato são os que mais se acumulam quando diferentes órgãos são submetidos à isquemia (i.e. cérebro, coração, fígado e rim), através de estudo por metabolômica por meio de espectrometria de massas (Chouchani et al., 2014).
O succinato foi postulado como o responsável pelos níveis aumentados de EROs gerados pela mitocôndria na fase isquêmica, com maiores níveis gerados durante a reperfusão, e alto grau de área infartada, mas o bloqueio farmacológico da rota bioquímica de produção de succinato (i.e. succinato desidrogenase) previamente à isquemia, diminuía a produção de EROs na fase isquêmica e também na reperfusão, e os tecidos apresentavam menor área infartada, porém pouca atenção foi dada aos metabólitos xantina e hipoxantina (Chouchani et al., 2014). Mais evidências mostram que a inibição de succinato desidrogenase (complexo II da mitocôndria) por malonato reduz o tamanho da área infartada do miocárdio dos camundongos, com menor produção de EROs, menor liberação de lactato desidrogenase tecidual (LDH), um indicador de morte celular, pois com a ocorrência de dano celular, tem-se o extravasamento do seu conteúdo, isto promove a liberação de moléculas intracelulares para o sangue, como LDH, e como esta pode ser detectada pelos seus níveis de atividade, quanto maior sua atividade, maiores os seus níveis (Valls-Lacalle et al., 2016).
oxidados geram aldeídos como o malonaldeído, 4-hidroxinonenal (4-HNE) (produtos finais de peroxidação lipídica), e um dos indicadores de oxidação de proteínas nas quais apresentam grupos carbonil (tidas como proteínas carboniladas), ambos os marcadores de estresse oxidativo aumentam durante o evento da isquemia e reperfusão em tecidos de camundongos (Ayene et al., 1992; Eaton et al., 1999). Porém os níveis destes parâmetros de estrese oxidativo se mantém inalterados em espécies que toleram a reduzida disponibilidade de O2 e sua posterior reoxigenação (Willmore e Storey, 1997; Welker et al., 2012).
Logo, tecidos de mamíferos quando submetidos à privação de O2 sofrem fortes lesões oxidativas mediadas por EROs, sendo que em humanos, segundo a Organização Mundial de Saúde (OMS) em 2012, a estimativa do número de mortes por doenças isquêmicas foi de 14,1 milhões em todo o mundo (OMS, 2016). Porém há exemplos de animais que passam por privação de O2 e o estresse da reoxigenação sem danos aparentes (Hermes-Lima e Zenteno-Savín, 2002; Welker et al., 2012). Uma das formas que estes animais tem como resposta adaptativa frente à falta de oxigênio é a redução dos processos que consomem ATP, chamada de depressão metabólica, envolvendo a redução da atividade da bomba de sódio e potássio ATPase, redução global da síntese proteica, reduzindo as taxas teciduais de consumo de O2, ativação de rotas anaeróbicas produtoras de ATP, através da produção de lactato por lactato desidrogenase (Hochachka et al., 1996, Hochachka e Lutz, 2001). Adendo à depressão metabólica, animais de vida aeróbia, que têm como história natural de vida a passagem por mudanças drásticas na disponibilidade de O2 respondem a este insulto por meio da supra-regulação de antioxidantes endógenos, como forma de defesa ao estresse oxidativo (Hermes-Lima et al., 1998; Hermes-Lima e Zenteno-Savín, 2002). Parece que os antioxidantes têm sua importância frente à falta de O2, pois no estado de depressão metabólica, no qual ocorre à redução global da síntese de proteínas, as enzimas antioxidantes continuam com atividade mantida ou aumentada, assim como os níveis proteicos.
com maiores níveis de síntese de metabólitos, incluindo glutationa (GSH), ascorbato e metalotioneina, bem como a resposta de genes (para enzimas antioxidantes) e fatores de transcrição envolvidos na resposta antioxidante (p.ex. fator induzido por hipóxia (HIF), nuclear fator eritroide 2 (Nrf2), forkhead box (FOX), ambos regulam genes antioxidantes entre outros sistemas envolvidos na adaptabilidade celular (Welker et al., 2013; Hermes-Lima et al., 2015; Moreira et al., 2016). Logo, os antioxidantes parecem ter uma importância adaptativa frente à privação de O2 na defesa contra o excesso da geração de EROs. Mas será que esta resposta adaptativa faz parte de qualquer espécie animal que tem como história natural de vida passagens por alteração da disponibilidade de oxigênio como a hipóxia ou anóxia? Esta resposta, avaliada em condições controladas de laboratório (ao submeter animais de respiração aquática à exposição aérea) foi observada em 100% dos casos de animais cuja história natural de vida se adaptou a viver (ou sobreviver) na zona entre marés (ambiente altamente hostil) (Moreira et al., 2016). Apesar de não serem muitos os estudos sobre a resposta antioxidante na exposição aérea, estes estudos foram compilados por uma meta análise (ver capítulo 2 desta dissertação), mostrando que todos os animais apresentavam pelo menos uma enzima ou metabólito com seus níveis de atividade ou concentração, ou gene aumentados nesta condição (Moreira et al., 2016).
No ambiente entre marés, animais sesseis como mexilhões têm que lidar com ciclos de emersão aérea e submersão aquática. A descida da maré expõe os animais ao ar, privando-os de oxigênio da água, e posteriormente com a subida da maré, os animais são reimersos. Estes eventos cíclicos (intermitentes) de retirada e oferta de oxigênio podem acontecer por duas vezes em um período de 24 horas, podendo ser considerado um ritmo circadiano ou circatidal (Tessmar-Raible et al., 2011), e um
altamente hostil? Ainda durante a exposição aérea, metabólitos e produtos nitrogenados que seriam excretados durante a fase de reimersão, se acumulam no seu interior (Bayne et al., 1976).
Boa parte dos estudos neste contexto submete os animais apenas a um ou outro fator abiótico em separado, em condições artificiais de laboratório. Na zona entre marés, vários fatores abióticos podem atuar em conjunto, o que torna a visão ecológica e bioquímica altamente complexa, o que pode tornar os achados encontrados em laboratório um pouco distante do realismo fisiológico encontrado na natureza (Tomanek e Somero, 1999; Connor e Gracey, 2011; Spicer, 2014). A hipótese deste trabalho é que frente à exposição aérea, os mexilhões teriam seus antioxidantes supra-regulados, como parte do seu sucesso de adaptabilidade ambiental, devido ao esperado desequilíbrio redox promovido pelos agressores ambientais, como observado em estudos frente à privação de oxigênio (Welker et al., 2013; Hermes-Lima, 2015), estresse térmico (Hofmann e Somero, 1999), já que o aumento da temperatura ambiental em diferentes espécies de ectotérmicos marinhos promove aumento da produção de EROs, gerando estresse oxidativo (Abele et al. 2002; Lesser, 2006), assim como a hipóxia e o estresse da reoxigenação (Welker et al., 2016). Este mecanismo de aumento das defesas antioxidantes foi nomeado de
‘preparo para o estresse oxidativo’(Hermes-Lima e Storey, 1998), pois na época os autores imaginavam que a resposta antecipada pelos antioxidantes quando submetidos à privação de O2 seria para os níveis aumentados de EROs na reoxigenação (Hermes-Lima e Storey, 1998), mas esta ideia foi revista, e os autores sugerem que na hipóxia ocorre aumento de EROs e os animais respondem a este aumento através das defesas antioxidantes (Hermes-Lima et al., 2015).
Porém ainda não foi completamente elucidado se nos animais tolerantes a falta de O2 ocorre aumento de EROs quando submetidos a mudanças da indisponibilidade de O2 (hipóxia, anóxia), e evidências sugerem que não em tartarugas da espécie
Trachemys scripta submetidas à anóxia por diferentes períodos, entre uma e quatro horas (Milton et al., 2007). Na espécie de platelminto Macrostomum lignano
por 48 horas também não houve aumento da produção de superóxido (Rivera-Ingraham et al., 2013b), e no bivalve Ártica islandica tanto na hipóxia (2 horas) quanto na reoxigenação ocorre baixa dos níveis de superóxido (Strahl et al., 2011). Mas ainda é uma questão em aberto já que algumas das sondas utilizadas por Rivera-Ingraham (2013a) e Strahl et al., (2011) não serem específicas para EROs apenas (Kalyanaraman et al., 2012), apesar dos tecidos animais dos platelmintos submetidos à anóxia e incubados com SOD exógena terem o sinal da produção de superóxido diminuído em relação aos animais em normóxia, ou até mesmo diminuído em relação ao grupo de animais que também teve diminuído o sinal para o superóxido em resposta à anóxia (Rivera-Ingraham et al., 2013a).
Não obstante, foi observado que mudanças de expressão de genes antioxidantes em resposta à exposição aérea no ambiente entre marés foram supra-regulados, na espécie de mexilhão Mytillus Californianus, genes para glutationa S transferase (GST) (envolvida no metabolismo de xenobióticos), GPx e peroxiredoxina (Prx), peroxidase que utiliza tioredoxina como co-substrato) (Gracey et al., 2008). Mas a relação de altos níveis de expressão de genes, ou proteínas não necessariamente resulta em ganho de atividade funcional enzimática (Czaha et al., 1994), pois a nível de resposta imediata ao estresse oxidativo, envolvendo o controle fisiológico dos níveis de EROs ocorre por meio da atividade enzimática antioxidante (Weydert e Cullen, 2010), ou das moléculas antioxidantes que neutralizam e mantém EROs em níveis fisiológicos (Wu et al., 2004).
redutase (GR), na presença de NADPH (Lushchak, 2011). Em mamíferos a forma reduzida pode atingir entre 1–8 mM de concentração, funcionando como um tampão redox (Griffith, 1999). É altamente compartimentalizada no núcleo e mitocôndria, sendo importante para o homeostase redox destas organelas quando submetidas a estresse oxidativo (Marí et al., 2009; Hatem et al., 2014). Participa também na regulação funcional de proteínas por modificação pós-traducional (S-glutationilação) (Mailloux e Willmore, 2014), transporte de aminoácidos, regulação do correto dobramento de proteínas no retículo endoplasmático pelo fornecimento de enxofre pela forma dissulfeto (Chakravarthi et al., 2006). E em relação à anóxia artificial, por seis dias, no gastrópode marinho de região entre marés Littorina littorea, houve aumento nos níveis de GSH de 2,8 vezes (Pannunzio e Storey, 1998). Será que esta resposta à privação de O2 envolvendo GSH também ocorre em Mytilaster solisianus
em condições naturais do campo?
OBJETIVOS
Avaliar mudanças no sistema antioxidante e no metabolismo de radicais livres em mexilhões Mytilaster solisianus expostos à exposição aérea no seu ambiente natural de região entre marés. Tal investigação deu origem ao manuscrito apresentado no capítulo 1 desta dissertação.
CAPÍTULO 1 – MANUSCRITO 1: METABOLISMO DA GLUTATIONA NO MEXILHÃO MYTILASTER SOLISIANUS (MYTILIDAE) EM CICLOS NATURAIS DE MARÉS
1. INTRODUÇÃO
Parte dos resultados das coletas I e II apresentados neste capítulo foram reportados no congresso realizado no México em Novembro de 2015, na “Second International conference on oxidative stress in aquatic ecosistems”. Neste capítulo, também foram adicionados resultados de outra coleta realizada em maio de 2015, e foi apresentada no congresso regional da Federação de Sociedades de Biologia Experimental (FeSBE) em maio de 2016 em Natal (Pará) pelo Dr. Orlando, no qual ajudou na coleta de número III.
2. OBJETIVO
Quantificar os níveis de GSH em mexilhões Mytilaster solisianus em resposta à exposição aérea no seu ambiente natural de região entre marés.
3. MATERIAL E MÉTODO
3.1. COLETA DOS ANIMAIS
Os mexilhões foram coletados no litoral de Penha, praia do trapiche, Santa Catarina. Foram realizadas três coletas, a primeira expedição nos dias 1 e 2 de novembro de 2014, nomeadas de coletas I e II, e a coleta III no dia 9 de maio de 2015. Na coleta I, os animais foram coletados de 6:30 até 21:10. Na coleta II, os animais
foram coletados de 6:30 até 21:25. Na coleta III, os animais foram coletados de 7h00
e 18h30. Foram registradas durante o período de coleta as temperaturas da água e ar
com termômetro de mão. A espécie estudada Mytilaster solisianus possui licença
ambiental com finalidade científica pelo ICMBio e SISBIO (número 20030-9). Por se tratar de uma espécie de invertebrado, não foi necessário comitê de ética. A espécie foi identificada por mim e pelo especialista em moluscos Dr. Luiz Ricardo Lopes de Simone (Universidade de São Paulo).
A escolha dos dias de coleta dos animais foi baseada na tábua das marés, no
site da Marinha Brasileira (
à realização da coleta, tentando evitar períodos de chuva. A seguir, tábua das marés (Fig. 1) para a primeira, segunda e terceira coleta, especificando momentos de maré alta e baixa, e foi observado que na rocha no qual os animais foram coletados eles ficaram emersos a partir da maré 0.5:
Figura 1. Tábua das marés (u.a. unidade arbitraria) para as três coletas: coleta I no dia 1 de novembro de 2014 à esquerda; coleta II no dia 2 de novembro de 2014 ao centro da figura; e coleta III no dia 09 de maio à direita. São mostrados os horários/momentos em que a maré alta se encontra no seu pico, e momentos em que a maré se encontra mais baixa. Fonte: Tábua das Marés, Marinha do Brasil <http://www.mar.mil.br/dhn/chm/box-previsao-mare/tabuas/>.
Os animais eram retirados da rocha (45 animais) com pinça ou com as próprias mãos, levados até a praia em uma bandeja plástica com água (no caso de animais coletados imersos) ou seca (no caso de animais coletados emersos), limpos em papel, colocados em microtubos de 2 mL (três animais por tubo) e em seguida congelados em gelo seco. Após todos os animais serem colocados em gelo seco (-80° C), estes eram guardados em nitrogênio líquido (-195,79° C), sendo que o tempo entre a retirada dos animais da pedra e a guarda destes no nitrogênio líquido era de até 10 minutos. Este procedimento também é adotado por outros pesquisadores (Gracey et
al., 2008; Dowd et al., 2013). O nitrogênio líquido ficava em um local sombreado não muito distante, para evitar sua rápida evaporação. A coleta era feita por mim e mais duas pessoas (Daniel Carneiro Moreira e Leonardo Rios).
A coleta 3 ocorrida em maio seguiu o mesmo princípio, porém, 90 animais foran pegos durante o regime da maré e quatro pessoas realizaram a coleta (Igor Santos, Leonardo Rios, Orlando Vieira, e eu). No anexo A, há o registro de fotos durante o momento em que os animais se encontram reimersos e a rocha na qual os mesmos foram coletados.
No momento da retirada dos animais, era observado se estes possuíam bisso, estrutura que deixa os animais fixos à rocha, como forma de avaliar a viabilidade dos animais. Os animais que eram retirados facilmente da rocha eram desprezados por estarem mortos (o que era constatado com sua abertura). A seguir, imagem com os animais na bandeija e na figura ao lado, seta apontando para o biço:
Figura 2. A. Coleta de mexilhões durante a exposição aérea. B. Seta apontando para o bisso.
Além disto, grupos de animais pegos aleatoriamente eram abertos manualmente e observados, como outra forma de avaliar se eles estavam vivos. Nos animais vivos, foi observada a presença de água dentro destes, seja nos animais imersos ou durante a emersão. Durante a exposição aérea, observou-se que os animais ficam com sua concha fechada, e durante o período de reimersão, eles tinham sua concha levemente aberta. Também foi constatado que, mesmo após muitas horas de exposição aérea, havia a presença de água no interior dos mexilhões.
A
Bisso
o
Chegamos à praia às 5 horas da manhã. Às 5h:30min, começamos a contar no relógio o tempo que os animais estavam expostos ao ar na maré baixa com absoluta certeza. Ao chegar à praia, os animais já estavam passando por uma maré baixa noturna (que terminou ao final da manhã) e alguns já estavam emersos. Portanto, os tempos de reimersão e exposição aérea para os animais foram baseados a partir da retirada dos primeiros animais.
Às 06:30 (uma hora, pelo menos, de exposição aérea), foram coletados 45 animais, e após mais uma hora, a mesma quantidade. Após este último ponto de coleta, a maré começou a banhar os animais, período inicial do retorno à água. Entretanto, o retorno da maré não é brusco, e sim intermitente, ou seja, ela retorna aos poucos, de modo que foi necessário estabelecer uma regra: enquanto a água não molhasse os animais com certo grau de frequência, de minuto em minuto, os animais ainda não eram considerados completamente reimersos. A partir daí, o tempo de início da reimersão era contado (tempo zero) e a hora da reimersão registrada. O momento de considerar a exposição aérea também foi estabelecido, levando em conta o tempo no qual os animais pararam de ser definitivamente banhados pela água.
Nas coletas I e II, os tempos de retirada dos animais foram similares. Os tempos experimentais foram: pelo menos uma e duas horas de exposição aérea; uma, duas, três, cinco e 7 horas de reimersão; 30 minutos, 2, 3 e 4 horas de exposição aérea. Após 4 horas de exposição aérea, começou a chover e decidiu-se não coletar mais animais no tempo de reimersão, pois havia risco da força da água sobre os experimentadores no campo, com a ocorrência de raios perto da localidade.
(específico de cada espécie) induzem estado de hipóxia em invertebrados ectotérmicos (Anestis et al., 2007). Deste modo, foi escolhida uma maré diurna, onde os fatores abióticos pudessem potencializar um forte estresse fisiológico nos animais.
Assim, neste cenário ideal de intenso estresse fisiológico, mediado por múltiplos agentes estressores do ambiente, buscou-se um período de maré na fase de lua cheia, com uma mais duradoura. A coleta dos animais se deu na mesma pedra da praia da coleta I e II, local em que os primeiros animais foram coletados. Apesar de a tábua das marés ser apenas uma previsão (não necessariamente iria acontecer do jeito que foi predito), a coleta foi bem sucedida. A expectativa inicial era de que os animais ficassem 8 horas expostos ao ar, e ficaram expostos por 9 horas.
As mesmas regras de retirada dos animais estabelecidas na coleta I e II foram utilizadas na coleta III. Chegamos à praia por volta dàs 05:30. Às seis horas da manhã, começamos a cronometrar o tempo de permanência dos animais na água. O tempo de coleta dos animais foi: pelo menos uma e duas horas em água; duas, quatro, seis, 7,5, e 9 horas de exposição aérea; o tempo de reimersão começou no momento em que os animais começaram a ficar constantemente imersos por 5 minutos, uma e duas horas de reimersão.
Para fins de análises bioquímicas, foram escolhidos alguns pontos específicos durante o ciclo das marés. Nos parâmetros de GSH na coleta I e II, analisaram-se animais com pelo menos 2 horas de exposição ao ar; uma, três e 7 horas de reimersão; e 30 minutos e quatro horas de exposição aérea. Na coleta III, foram analisados animais imersos por pelo menos duas horas; duas, quatro e 9 horas de exposição aérea; e o tempo de 5 minutos, uma e duas horas de reimersão. Para cada experimento, sempre havia pelo menos um animal de cada grupo experimental, escolhido aleatoriamente. Os animais eram previamente pesados antes das análises, e tinham o seu tamanho (i.e. largura) registrado por paquímetro de mão.
3.2. ANÁLISES BIOQUÍMICAS
Todas as análises foram feitas utilizando o leitor de Microplaca EspectraMax (Molecular Devides, Multi-Mode Microplate Readers).
Figura 3. Grupos experimentais das três coletas. Os grupos destacados foram escolhidos para a realização das análises de GSH em homogenato de corpo inteiro nos mexilhões.
3.2.1. NÍVEIS DE EQUIVALENTES DE GLUTATIONA (EQ-GSH)
A concentração de glutationa total (Eq-GSH) ou equivalentes de GSH foi determinada através da reação entre os grupos sulfidrila de duas moléculas de GSH
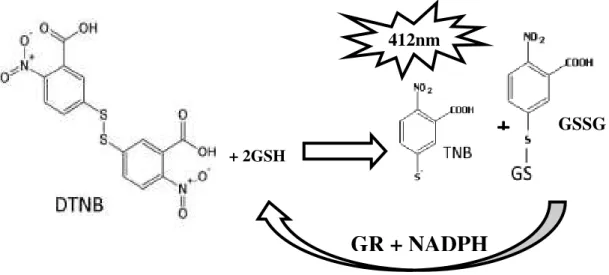
com uma molécula 5,5’-ditiobis-2-ácido nitrobenzóico (DTNB) (reagente de Ellmans), produzindo 5-tio-2-ácido nitrobenzóico (TNB) e GS-TNB, TNB tem pico máximo de absorção em 412nm (Rahman et al., 2006). O método se baseia no descrito por Akerboom e Sies (1981) e os passos dos procedimentos metodológicos para a medição dos níveis totais de glutationa e GSSG foram feitos de acordo com Welker (2009). O método envolve um sistema enzimático, pois o produto GS-TNB é reduzido pela presença de GR e NADPH, a GSSG presente na amostra animal também é reduzida formando duas moléculas de GSH, isto proporciona a
Coleta I e II
Reimersão
Exposição
aérea
>1h >2h 1h 2h 3h 5h 7h 0,5h 1h 2h 4h
Exposição
aérea
>1h >2h 2h 4h 6h 7,5h 9h 5 min 1h 2h
Exposição aérea
Reimersão
Reimersão
especificidade do método para a medição dos níveis totais de GSH. Deste modo, Eq-GSH é a soma entre Eq-GSH e GSSG (Eq-Eq-GSH=Eq-GSH+2GSSG) (Griffith, 1980). Para a medição somente de GSSG, a GSH presente na amostra sofria derivatização, ou seja, era impedida de participar da reação por meio da sua reação com 2-vinilpiridina (2-VP) (Griffith, 1980). Assim, analisavam-se tanto Eq-GSH quanto GSSG através das taxas de reação (abs/min) em 412 nm, sendo proporcional a concentração destas moléculas (Griffith, 1980).
Abaixo, figura demonstrativa da reação:
Figura 4. Reação entre DTNB e 2 moléculas de GSH, produzindo TNB (detectado em 412 nm) e GS-TNB. Glutationa redutase (GR) reduz GS-TNB na presença de NADPH, e GSH é produzida novamente e retorna a participar da reação com DTNB, enquanto que GSSG presente na amostra também é biotransformada produzindo duas moléculas de GSH. Figura modificada de Rahman et al., (2006), e Caito e Aschner (2015).
3.2.2. PROCESSAMENTO DAS AMOSTRAS
As amostras de tecidos congeladas e previamente pesadas (dias antes das análises) tinham sua largura medida com paquímetro de mão no dia dos experimentos. Rapidamente, a amostra animal era quebrada em nitrogênio líquido em um almofariz de porcelana para posterior homogeneização, utilizando um
+ 2GSH
+
GR + NADPH
412nm nm
homogeneizador de 3 mL (tubo e pistilo de vidro), mantido sempre em baixa temperatura (no gelo), numa diluição de 1:5 (peso/volume), considerando o corpo inteiro dos animais. A quebra dos animais em nitrogênio líquido facilitava a obtenção do extrato bruto, devido à presença da concha. No homogeneizador, eram adicionados ácido tricloroacético (TCA) e a amostra, de forma que a concentração de TCA final atingisse 10% (p/v). O meio acidificado evita que a GSH seja oxidada, e inativa as enzimas que a degradam. A concentração de 10% para o TCA foi escolhida por promover completa precipitação das proteínas e adequada estabilidade de GSH (Welker et al., 2009). O tempo de preparo dos homogeneizados era registrado para cada amostra animal, sendo de até 5 minutos. Feito o extrato bruto, este era transferido para microtubos de 1,5 mL, que eram centrifugados por 6 minutos a 10.000xg, sob baixa temperatura (4º C). Seu sobrenadante era usado para a determinação da concentração de Eq-GSH e GSSG.
3.2.3. PREPARO DE SOLUÇÃO PADRÃO DE GSH
era então diluída para as concentrações desejadas (próximas das encontradas nas amostras) usando-se solução de TCA neutralizada da mesma forma que nas amostras (TCA 2,38%; tampão fosfato 0,357 M; etanol 4,76%). Também eram separados tubos para a medição dos níveis de GSSG, substituindo o etanol por 2-vinilpiridina (2-VP), as amostras eram incubadas por 1 hora no escuro, esta é a etapa que ocorre a derivatização de GSH. Além disto, a amostra dos mexilhões e a solução padrão eram centrifugadas novamente a 10.000xg por 4 minutos (4°C), pois no momento da adição do tampão no sobrenadante ácido, havia a formação de um precipitado branco, não se sabe o que era, mas houve a necessidade desta nova centrifugação.
3.2.4. CURVA-PADRÃO E MEDIÇÃO
O volume final nos poços era de 200 L, e as concentrações do meio reacional eram: tampão fosfato 100 mM (pH 7,0), EDTA 1 mM, TCA 0,238%, GSH entre 0 e 1,5 M, NADPH 0,1 mM, DTNB 2 mM e GR 0,05 U/mL. A curva de medição dos níveis de GSSG também era feita com GSH, e a concentração de GSH estava entre 0 e 0,2 M, enquanto que a concentração final de GR era de 0,3 U/mL (Welker, 2009). Nos poços, os mesmos eram misturados na seguinte sequência de reagentes: tampão fosfato com EDTA, solução de TCA neutralizada (ou solução niveladora), solução padrão de GSH ou amostra neutralizada (volumes entre 3 e 12 L), NADPH e DTNB. A reação se iniciava com GR, e as taxas (abs/min) em 412 nm eram registradas. Ao se fazer a curva-padrão, as amostras eram feitas logo em seguida.
4. ESTATÍSTICA
experimental variou entre seis e nove animais para cada grupo experimental analisado.
5. RESULTADOS
5.1. REGISTRO DA TEMPERATURA AMBIENTE
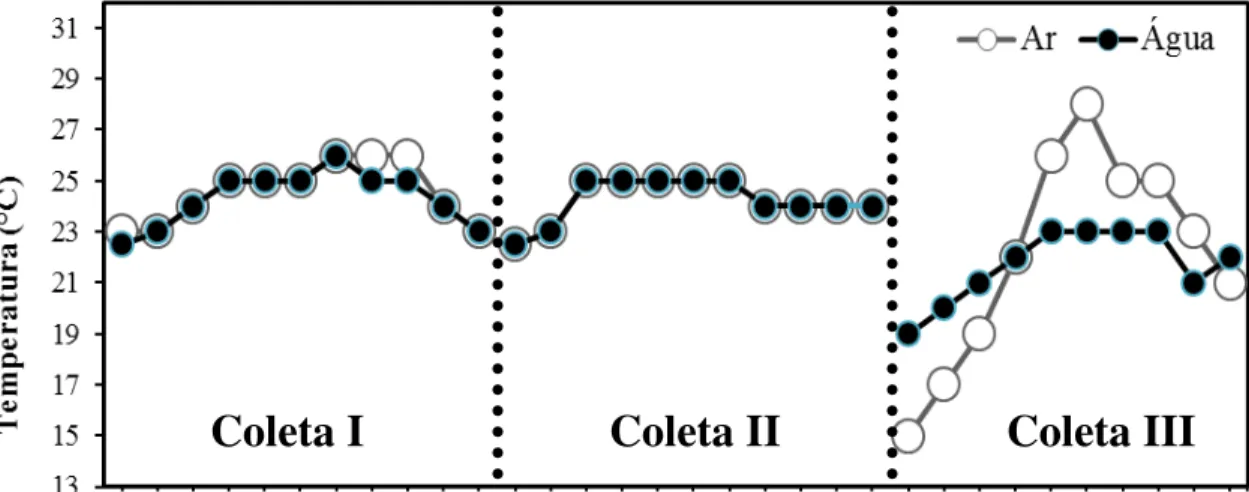
Durante a coleta dos animais, observou-se que a temperatura da água e ar na coleta I e II variaram entre 22,5 a 26° C, na coleta 3 a variação da temperatura da água variou entre 19 e 23° C, enquanto que a temperatura do ar variou entre 15 e 28° C, ver figura a seguir:
Figura 5. Registro da temperatura da água e ar ao longo das três coletas.
Especificamente para a coleta de número III, fez-se um gráfico mostrando a relação do momento inicial de baixa da maré até o seu retorno no final da tarde (ver figura no anexo).
5.2. CURVA DE DISTRIBUIÇÃO (COMPRIMENTO E PESO)
Antes de iniciar as análises, os animais tinham o seu peso registrado, e durante os experimentos, o seu tamanho também era medido. Assim, fez-se um perfil de curva de distribuição destas variáveis. Em um total de 146 animais, a média do comprimento dos animais foi de 0,71 cm, com desvio padrão de 0,23 cm, e amplitude de 17,55. Para o peso, a média foi de 235 mg, com desvio-padrão de 93,22 mg, e amplitude de 20,68, ver figura abaixo:
C o m p rim en to (cm ) F r e q u ê n c ia r e la ti v a ( % )
0 .0 0 .5 1 .0 1 .5
0 5 1 0 1 5 2 0 2 5 A
P e s o (m g )
F r e q u ê n c ia r e la t iv a ( % )
0 2 0 0 4 0 0 6 0 0 8 0 0
0 1 0 2 0 3 0
B
Figura 6. Dados de distribuição (%) da largura (cm) e peso dos mexilhões (mg). N=146 animais. A Comprimento dos animais (cm). B Peso dos animais (mg).
A seguir, realizou-se uma análise de regressão linear, relacionando as variáveis comprimento e peso. Houve correlação positiva entre tamanho e peso (P<0,001). Em muitos casos, os animais possuem o mesmo tamanho, porém, com pesos diferentes, mas a tendência é o aumento do peso com o tamanho, figura abaixo:
C o m p r im e n t o ( c m )
P es o ( m g )
0 .2 0 .4 0 .6 0 .8 1 .0 1 .2 1 .4
0 2 0 0 4 0 0 6 0 0 8 0 0
R2= 0 ,6 2 7 3 Y = 4 0 0 ,9 X -3 3 ,1 1 P < 0 ,0 0 1
Figura 7. Regressão linear entre comprimento (cm) e peso (mg) nos mexilhões. N=146 animais.
Na coleta I e II, os níveis de Eq-GSH nos animais foram mantidos inalterados ao longo do ciclo das marés (P=0,0664 para a coleta I e P=0,4832 para a coleta II). Na coleta III, houve uma queda nos níveis de Eq-GSH (42%) após duas horas de exposição aérea em relação ao grupo de animais reimersos por mais de duas horas (P=0,050), ver a seguir:
T e m p o d e e x p o s iç ã o (m in o u h o r a s )
E q -G S H (n m o l/ g d e t e c id o ú m id o )
> 2 h 1
h 3 h 7 h
0 ,5 h
4 h > 2 h 1 h 3 h 7 h 0 ,5
h 4 h
> 2 h 2 h 4 h 7 ,5 h 9 h5 min 1 h 2 h
0 1 0 0 2 0 0 3 0 0 4 0 0 5 0 0
R e im e rs ã o
*
E x p o s iç ã o a é re a
Figura 8. Níveis totais de glutationa (Eq-GSH) nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados dos níveis Eq-GSH da coleta I à esquerda, coleta II no centro, coleta III à direita. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental. * Diferença significativa (P=0,050).
Não houve diferença nos níveis de GSH na coleta I, II e III (P>0,05), ver figura:
G S H (n m o l/ g d e t e c id o ú m id o )
> 2
h 1h 3h 7h
0,5
h 4h
> 2
h 1h 3h 7h
0,5
h 4h
> 2
h 2h 4h
7,5
h 9h
5m
in 1h 2h
0 1 0 0 2 0 0 3 0 0 4 0 0
R e im e r s ã o
T e m p o d e e x p o s iç ã o ( m in o u h o r a s )
E x p o s iç ã o a é r e a
Figura 9. Níveis de glutationa (GSH) nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados dos níveis de GSH da coleta I à esquerda, coleta II no centro, e coleta III à direita. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental.
Não houve diferenças entre os grupos nos níveis de GSSG na coleta I, II e III (P>0,05), ver figura:
T e m p o d e e x p o s iç ã o (m in o u h o r a s )
G S S G (n m o l/ g d e t e c id o ú m id o )
> 2h 1h 3h 7h 0,5h 4h > 2h 1h 3h 7h 0,5h 4h > 2h 2h 4h 7,5h 9h5min 1h 2h
0 2 0 4 0 6 0 8 0 1 0 0
R e im e rs ã o
E x p o s iç ã o a é re a
Figura 10. Níveis de GSSG nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados dos níveis de GSSG da coleta I à esquerda, coleta
Coleta I
Coleta II
Coleta III
II no centro, coleta III à direita. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental.
Não houve diferenças entre os grupos na razão GSSG/Eq-GSH nas coletas I, II e III (P>0,05), ver figura:
T e m p o d e e x p o s iç ã o (m in o u h o r a s )
R
a
z
ã
o
G
S
S
G
/E
q
-G
S
H
> 2 h 1 h 3 h 7 h 0 ,5 h 4 h > 2 h 1 h 3 h 7 h 0 ,5 h 4 h> 2 h 2 h 4 h 7 ,5 h 9 h5 min 1 h 2 h
0 .0 0 .1 0 .2 0 .3 0 .4
R e im e rs ã o
E x p o s iç ã o a é re a
Figura 11. Níveis de GSSG/Eq-GSH nos mexilhões medidos nas três coletas durante a reimersão e exposição aérea. Dados representados com média e erro padrão da média. N=(6-9) animais por grupo experimental. Dados da razão GSSG/Eq-GSH da coleta I à esquerda, coleta II no centro, coleta III à direita.
Os parâmetros de GSH (níveis médios) dos mexilhões reimersos foram comparados com outros invertebrados marinhos, com o molusco terrestre (Helix aspersa) e outras espécies que são estudadas em relação à privação de O2 (tabela 1).
Estes valores médios foram tomados a partir dos animais controle sem ‘nenhum’ tipo
de situação imposta, na mesma unidade de concentração (nmol/grama de tecido úmido). Quando os resultados eram padronizados por miligrama de proteína, eu procurei o valor dos níveis de proteína medidos (quando disponível) e passei para a mesma unidade comum entre os animais, como no caso de Doyote et al., (1997). Em outros estudos, isto não foi possível, pois os autores não informavam os níveis de proteína (Hartwig et al., 2009) ou o resultado era dado em nmol por grama de tecido seco (Power e Sheehan, 1996). Em determinadas espécies não foi possível encontrar todos os parâmetros, pois nem todos medem GSSG, e às vezes há valores de
determinados parâmetros em trabalhos diferentes para a mesma espécie. Por exemplo, no mexilhão Mytillus edulis o dado dos níveis de Eq-GSH na tabela são de Canesi e Viarengo (1997), e GSH por Power e Sheehan (1996), a seguir tabela 1:
Tabela1.Comparação dos parâmetros de Eq-GSH, GSH, GSSG (nmol/g tecido) e razão GSSG/Eq-GSH em invertebrados.
Família e Espécie Tecido Eq-GSH GSH GSSG
Razão
GSSG/Eq-GSH
Referência
Mytilidae, mexilhão
Mytilaster solisianus Corpo inteiro 169 - 356
138 -
293 28 - 62 0,16-0,21 Trabalho atual
Mytilidae, mexilhão
Mytilus californianus Hepatopâncreas 1000 - - -
Mitchelmorea et al., 2003
Mytilidae, mexilhão
Mytilus edulis
Hepatopâncreas 608
90 - 450 nmol/g de peso seco - - Eq-GSH (Canesi e Viarengo) (1997) GSH (Power e Sheehan (1996)
Brânquias 192 100 -
350 nmol/g de peso seco - - Mytilidae, mexilhão Mytilus galloprivincialis
Hepatopâncreas 579 -1276 - - - Regoli e
Principato, 1995
Brânquias 161 - 290 - - -
Mytilidae, mexilhão Perna perna
Hepatopâncreas 1300 1291 8,92 0,006 Dafre et al., 2004
Brânquias 680 665 15 0,039
Franco et al., 2006
Arcticidae, marisco
Arctica islandica
Manto 304-754 214 -
402 49 - 179 0,17-0,43 Abele et al.,
2008
Brânquias 1027-1798 420-730 303-534 0,71-0,73
Unionidea, mexilhão
Unio tumidus
Hepatopâncreas 3040 1920 1056 0,34 Doyote et al.,
1997
Brânquias 3200 2480 992 0,31
Mytilidae, mexilhão
Geukensia demissa Hepatopâncreas 750-1700 - - -
Khan e Ringwood, 2016 Littorinidae, caramujo
marinho Littorina littoria
Hepatopâncreas 320 187 91 0,28 Pannunzio e
Storey, 1998
Músculo do pé 214 206 27 0,12
Caramujo marinho
Nacella pollaris Hepatopâncreas - 100 - -
Ansaldo et al., 2007 Ostreidae, ostra
Crassostrea gigeas Brânquias 600-1000 - - -
Trevisan et al., 2012 Ostreidae, ostra
Crassostrea virginica Hepatopâncreas
1000 -
2600 - - - Ringwood, 2016 Khan e
Helicidae, caramujo terrestre
Helix aspersa
Hepatopâncreas 1620 1400 160 0,098
Welker et al.,
2016
Músculo do pé 740 660 70 0,094
Rhabditidae Caenorhabditis elegans Corpo inteiro 15 nmol/mg proteína 13 nmol/mg proteína 2 nmol/mg
proteina 0,13
Hartwig et al., 2009
Na tabela, alguns animais apresentam faixas nos parâmetros de GSH porque os níveis era diferentes em diferentes momentos no tempo (incluindo época). Por exemplo, na espécie Mytilaster solisianus que eu estudei, os níveis de Eq-GSH no corpo inteiro na fase de reimersão varia entre 169-356 nmol/g de tecido úmido em diferentes épocas. No trabalho de Abele et al., (2008), o mexilhão Arctica islandica
no tecido branquial (órgão responsável pelas trocas gasosas) tem níveis de Eq-GSH que variam entre 1027-1798 nmol/g de tecido úmido, pois os animais foram coletados de locais diferentes. O gastrópode marinho Littorina littorea possui em torno de 320 nmol/g de tecido de Eq-GSH no hepatopâncreas (órgão com função central no metabolismo energético, e no metabolismo de xenobióticos) (Pannunzio e Storey, 1998), o mexilhão Mytillus edulis possui no mesmo órgão 608 nmol/g de tecido de Eq-GSH, as brânquias possuem menos Eq-GSH, com 192 nmol/ g de tecido (Canesi e Viarengo, 1997). No gastrópode terrestre Helix aspersa tem no hepatopâncreas em torno de 1620 nmol/g de tecido de Eq-GSH (Welker et al., 2016), ver tabela 1.
Interessantemente, assim como os níveis de Eq-GSH, os níveis de GSSG variam muito entre os moluscos, entre 28-62 nmol/g de tecido no corpo inteiro de
Mytilaster solisianus, sendo que, no mexilhão Unio tumidus, o valor encontrado para GSSG no hepatopâncreas foi de 1056 nmol/g de tecido úmido (Doyote et al., 1997), e entre 303-534 nmol/g de tecido no tecido branquial de Arctica islandica, o que nesta espécie, a idade é um fator que influência os níveis de GSSG (Abele et al., 2008). Isto pode influenciar a razão GGSG/Eq-GSH (e importante marcador de estresse oxidativo, Marí et al., 2009), sendo que alguns animais (Arctica islandica) possuem inacreditáveis 70% de GSSG (Abele et al., 2008). Este valor de porcentagem foi obtido através da razão GSSG/Eq-GSH, e multiplicado por 100, mas a partir do que se sabe, o molusco Arctica islandica é tido no mundo animal como a segunda espécie mais longeva (Philip e Abele, 2008). No gastrópode marinho Littorina littoria, há 28 e 12% de GSSG no hepatopâncreas e brânquias, respectivamente (Pannunzio e Storey, 1998).
tem em torno de 3,62% de GSSG, enquanto que o rim tem 3,55% (a partir do mesmo método de análise do trabalho presente). O invertebrado nematódeo Caenorhabditis
elegans, por exemplo, possui 13% de GSSG, em análise de animais de corpo inteiro (Hartwig et al., 2009) (ver tabela 1). Deste modo, os níveis de GSH e GSSG variam entre espécies e órgãos analisados.
5.4. ESTUDOS DE CORRELAÇÃO
Como cada animal teve o seu peso e tamanho registrados antes das análises ou previamente a elas (tamanho), pôde-se fazer o perfil de correlação dos parâmetros de GSH medidos para cada amostra animal, incluindo também peso (mg) e comprimento (cm).
Houve correlação entre os níveis de GSH e Eq-GSH, ver figura:
G S H ( n m o l/g t e c id o ú m id o )
E
q
-G
S
H
(n
m
o
l/
g
t
e
c
id
o
ú
m
id
o
)
0 1 0 0 2 0 0 3 0 0 4 0 0 5 0 0 6 0 0
0 1 0 0 2 0 0 3 0 0 4 0 0 5 0 0 6 0 0 7 0 0
R2= 0 ,9 1 3 9 Y = 0 .8 8 7 4 X -1 3 ,2 8 P < 0 ,0 0 0 1
Figura 12. Correlação entre os níveis de GSH e Eq-GSH em todos os mexilhões analisados. N=146 animais.
G S S G ( n m o l/g d e t e c id o ú m id o ) E q -G S H (n m o l/ g d e t e c id o ú m id o )
0 2 5 5 0 7 5 1 0 0 1 2 5 1 5 0
0 2 0 0 4 0 0 6 0 0 8 0 0
R2= 0 ,1 4 1 7 Y = 1 4 1 6 X + 1 7 4 ,9 P < 0 ,0 0 0 1
Figura 13. Correlação entre os níveis de GSSG e Eq-GSH em todos os mexilhões analisados. N=146 animais.
Houve correlação entre os níveis de GSH e a razão GSSG/Eq-GSH, ver figura:
G S H ( n m o l/g t e c id o ú m id o )
R a z ã o (G S S G /E q -G S H )
0 2 0 0 4 0 0 6 0 0 8 0 0
0 .0 0 .1 0 .2 0 .3 0 .4 0 .5 0 .6
R2= 0 ,2 6 7 5
Y = -0 ,0 0 0 3 9 5 0 + 0 ,2 9 7 5 P < 0 ,0 0 0 1
Figura 14. Correlação entre os níveis de GSH e a razão GSSG/Eq-GSH em todos os mexilhões analisados. N=146 animais.
G S S G ( n m o l/g d e t e c id o ú m id o ) R a z ã o (G S S G /E q -G S H )
0 5 0 1 0 0 1 5 0
0 .0 0 .1 0 .2 0 .3 0 .4 0 .5 0 .6
R2= 0 ,5 0 6 7
Y = 0 ,0 0 2 8 5 9 + 0 ,0 6 8 8 8 8 P < 0 ,0 0 0 1
Figura 15. Correlação entre os níveis de GSSG e a razão GSSG/Eq-GSH em todos os mexilhões analisados. N=146 animais.
Houve correlação entre tamanho e os níveis de Eq-GSH, ver figura:
C o m p r i m e n t o ( c m )
E q-G SH (n m ol /g t ec id o úm id o)
0 . 2 5 0 . 5 0 0 . 7 5 1 . 0 0 1 . 2 5 1 . 5 0
0 2 0 0 4 0 0 6 0 0 8 0 0
R2= 0 ,0 6 5 2 6 Y = - 1 0 9 ,7 X + 3 1 3 P = 0 ,0 1 9
Figura 16. Correlação entre os níveis de Eq-GSH e comprimento em todos os mexilhões analisados. N=146 animais.
C o m p r i m e n t o ( c m ) G S H (n m o l/ g t e c id o ú m id o )
0 .2 5 0 .5 0 0 .7 5 1 .0 0 1 .2 5 1 .5 0
0 2 0 0 4 0 0 6 0 0
R2= 0 ,0 5 4 5 9
Y = - 9 3 ,1 1 X + 2 6 1 ,3 P = 0 ,0 0 4 5
Figura 17. Correlação entre os níveis de GSH e comprimento em todos os mexilhões analisados. N=146 animais.
Não houve correlação entre tamanho e os níveis de GSSG, ver figura:
C o m p r i m e n t o ( c m )
G S S G (n m o l/ g t e c id o ú m id o )
0 .2 5 0 .5 0 0 .7 5 1 .0 0 1 .2 5 1 .5 0
0 5 0 1 0 0 1 5 0
R2= 0 ,0 2 2 7 8 Y = -1 7 ,2 3 + 5 2 ,7 8 P = 0 ,0 6 9
Não houve correlação entre tamanho e a razão GSSG/Eq-GSH, ver figura:
C o m p r i m e n t o ( c m )
R az ão (G S S G /E q -G S H )
0 . 2 0 . 4 0 . 6 0 . 8 1 . 0 1 . 2 1 . 4 1 . 6
0 . 0 0 . 2 0 . 4 0 . 6
R2= 0 ,0 0 3 9 1 9
Y = 0 ,0 2 8 7 0 X + 0 ,1 6 1 8 P = 0 ,4 5 2 8
Figura 19. Correlação entre a razão GSSG/Eq-GSH e comprimento em todos os mexilhões analisados. N=146 animais.
Houve correlação entre peso e os níveis de Eq-GSH, ver figura:
P e s o ( m g )
E
q-G
SH
(n
m
ol
/g
te
ci
do
ú
m
id
o)
1 5 0 3 0 0 4 5 0 6 0 0
0 2 0 0 4 0 0 6 0 0 8 0 0
R2= 0 ,0 7 5 0 9
Y = - 0 ,2 3 2 4 X + 2 9 3 ,1 P = 0 ,0 0 0 8
Figura 20. Correlação entre os níveis de Eq-GSH e peso em todos os mexilhões analisados. N=146 animais.
P e s o ( m g )
G
SH
(n
m
ol
/g
te
ci
do
ú
m
id
o)
0 2 0 0 4 0 0 6 0 0
0 2 0 0 4 0 0 6 0 0
R2= 0 ,0 7 4 7 4
Y = - 0 ,2 1 5 2 X + 2 4 9 ,2 P = 0 ,0 0 0 8
Figura 21. Correlação entre os níveis de GSH e peso em todos os mexilhões analisados. N=146 animais.
Não houve correlação entre peso e os níveis de GSSG, ver figura:
P e s o ( m g )
G
SS
G
(n
m
ol
/g
te
ci
do
ú
m
id
o)
1 5 0 3 0 0 4 5 0 6 0 0
0 5 0 1 0 0 1 5 0
R2= 0 ,0 0 8 1
Y = - 0 ,0 2 0 4 0 X + 4 5 ,3 8 P = 0 ,2 7 7 5
Figura 22. Correlação entre os níveis de GSSG e peso em todos os mexilhões analisados. N=146 animais.
P e s o ( m g )
R
az
ão
(G
S
S
G
/E
q
-G
S
H
)
2 0 0 4 0 0 6 0 0 8 0 0
0 . 0 0 . 2 0 . 4 0 . 6
R2= 0 ,0 1 4 8 8
Y = 0 ,0 0 0 1 1 0 5 X + 0 ,1 5 3 9 P = 0 ,1 4 2 5
Figura 23. Correlação entre a razão GSSG/Eq-GSH e peso em todos os mexilhões analisados. N=146 animais.
6. DISCUSSÃO
Neste trabalho, foram monitorados os parâmetros de GSH durante ciclos naturais de marés em mexilhões da espécie Mytilastersolisianus, com uma robusta e representativa população de 146 espécimes de animais. Na mesma rocha de coleta, fez-se um perfil de possíveis mudanças relacionadas ao status redox em análise de corpo inteiro envolvendo GSH, em um ambiente no qual os fatores abióticos mudam e podem flutuar periodicamente durante a descida e subida das marés, com menor ou maior tempo de exposição aérea, com a ocorrência ou não de mudanças de temperatura ambiente. E mesmo assim, nestas condições de extremo fisiológico, os mexilhões mostraram manter a homeostase redox, devido à ausência do aumento dos indicadores de estresse oxidativo e desequilibtio redox, analisados por GSSG e razão GSSG/Eq-GSH. Esta resistência foi mais eloquente na coleta de número III, na qual os animais experimentaram uma alta temperatura ambiente de 28° C. As respostas fisiológicas de mexilhões à exposição aérea se encontram na seção de discussão geral e conclusões.
corrente é que quanto maiores forem os mexilhões e outros moluscos, mais velhos são os animais (Anwar et al., 1990; Abele et al., 2008). Alguns trabalhos mostram que os níveis Eq-GSH diminuem com o aumento da idade no mexilhão Mytilus edulis, assim como as enzimas envolvidas no seu metabolismo, como glutamil-cisteína ligase (etapa limitante para a biossíntese de GSH) e GST, com ocorrência de baixos níveis de atividade enzimática, nos dois tecidos analisados, brânquias e hepatopâncreas (Canesi e Viarengo, 1997). Porém, estes autores observaram que GR, que renova GSH a partir de GSSG e NADPH, tem seus níveis de atividade aumentados nas brânquias (tecido com níveis maiores de GSH do que o hepatopâncreas nesta espécie), compensando a baixa da síntese de GSH (Canesi e Viarengo, 1997). A queda dos níveis de GSH com o decorrer da idade também é observada em Arctica islandica
(Abele et al., 2008).
Há poucos trabalhos que estudaram a resposta antioxidante de animais na exposição aérea com espécies de invertebrados e todos feitos em laboratório, com raras exceções. Teixeira et al., (2013) submeteram a espécie de coral Veretillum cynomorium à exposição aérea e, em análise de corpo inteiro, observaram aumento de atividade de catalase (310%) após duas horas de exposição aérea, em relação ao grupo de animais recém expostos ao ar (grupo zero). Houve também aumento dos níveis de atividade de GST, quanto comparado com o grupo zero. As atividades das enzimas catalase e GST retornam ao nível do grupo zero após três horas de reimersão, e sem mudanças para os níveis de atividade de SOD nestas condições (Teixeira et al., 2013). Infelizmente, fica a dúvida se estes aumentos são reais, pois os parâmetros não foram padronizados por miligrama de proteínas e os animais podem ter perdido água durante a exposição aérea. Medições por miligrama de proteínas evita este efeito de nível de hidratação de tecidos, sendo este tipo de padronização comum entre vários trabalhos (Freire et al., 2011a; Welker et al., 2016). As enzimas podem estar mais concentradas por estarem em um meio com menor teor de água.