Resistência a Fármacos Antifúngicos
por
Candida e Abordagem Terapêutica
Candida Antifungal Resistance and Therapeutic Approach
Francisca Vieira1, Teresa do Nascimento1,21. Instituto Superior de Ciências da Saúde Egas Moniz (ISCSEM), Caparica, Portugal 2. Centro de investigação interdisciplinar Egas Moniz (CiiEM), Caparica, Portugal Autor correspondente:
Francisca Vieira, franciscademellovieira@gmail.com
Instituto Superior de Ciências da Saúde Egas Moniz, Campus Universitário - Quinta da Granja - Monte de Caparica 2829-511 Caparica, Portugal
Recebido: 02/05/2017 Aceite: 04/07/2017
Resumo
As espécies do género Candida caracterizam-se pelo seu carácter oportunista, podendo desencadear diversas
infecções nomeadamente em hospedeiros imunocomprometidos. A emergência de infecções por espécies não-albicans, associadas a elevadas taxas de morbilidade e mortalidade, deve-se em grande parte aos
meca-nismos de resistência, intrínsecos ou adquiridos, que estas espécies possuem aos antifúngicos convencional-mente utilizados, sendo fundamental a sua compreensão para o desenvolvimento de abordagens terapêuti-cas eficazes.
O diagnóstico e terapêutica das candidoses constituem um verdadeiro desafio, devendo instituir-se trata-mento o mais rapidamente possível. No entanto, se por um lado a utilização empírica de agentes antifún-gicos se correlaciona com o incremento da resistência de Candida aos mesmos, os testes de susceptibilidade
aos antifúngicos funcionam como auxiliares para uma terapêutica direccionada, estando-lhe inerente uma diminuição no desenvolvimento de espécies resistentes.
Palavras-chave: Antifúngicos/uso terapêutico; Candida; Farmacorresistência Fúngica; Infecções Fúngicas
Invasivas
Abstract
Species from genus Candida are characterized by their opportunistic nature and can trigger several infec-tions, especially in immunocompromised hosts. The emergence of non-albicans Candida species, associated with high morbidity and mortality rates, is largely associated with the mechanisms of resistance, intrinsic or acquired, to the conventionally antifungal agents used. Their understanding is fundamental for the de-velopment of effective therapeutic approaches.
The diagnosis and treatment of these infections poses to be a real challenge and treatment should be imple-mented as soon as possible. However, on one hand the empirical use of antifungal agents correlates with increased resistance of non-albicans Candida species, on the other hand the antifungal susceptibility testing acts as an auxiliary for targeted therapy, and it is implicit a reduction in the development of resistant spe-cies.
Keywords: Antifungal Agents/therapeutic use; Candida; Drug Resistance, Fungal; Invasive Fungal
Infec-tions
Introdução
Os fungos do género Candida, para além de desenca-dearem candidoses superficiais (cutâneas e mucocu-tâneas), poderão também alcançar a corrente san-guínea (candidemia) e/ou atingir tecidos profundos (candidose invasiva). A candidose sistémica poderá ocorrer por inoculação directa num local estéril ou por disseminação hematogénica.1
Apesar de a Candida albicans (C. albicans) ser considera-da a espécie mais patogénica do género e com maiores taxas de isolamento, segundo dados epidemiológicos assiste-se à emergência de espécies de Candida não--albicans, sendo Candida glabrata (C. glabrata), Candida parapsilosis (C. parapsilosis), Candida tropicalis (C. tropi-calis) e Candida krusei (C. krusei) as espécies mais pre-valentes.2-4
Actualmente, o tratamento das infecções fúngicas in-vasivas representa um grande desafio na prática clíni-ca, pelo que a instituição atempada de uma terapêu-tica apropriada contribui para um bom prognóstico destas infecções.5 Porém, a complexidade do diag-nóstico conduz muitas vezes a atrasos na implemen-tação da terapêutica, e a agravar a situação anterior, surgem as resistências de Candida aos antifúngicos (AF) pelo seu uso inadequado, factor este responsá-vel pela emergência deste género e nomeadamente das espécies de Candida não-albicans (CNA).6
A limitação de agentes antifúngicos existentes tor-na fundamental a execução de um correcto diagnósti-co, onde os testes de susceptibilidade aos antifúngicos (TSAF) auxiliam na instituição de uma terapêutica efec-tiva, evitando-se a emergência de espécies resistentes.6,7
Antifúngicos
Para o tratamento de candidoses superficiais, pode-rão ser utilizados AF tópicos ou sistémicos.8 Já no tratamento de candidose invasiva (CI) , são adminis-trados fármacos sistémicos que estão agrupados em classes distintas, conforme o seu alvo celular (Fig. 1) e mecanismo de acção para inibir ou cessar o cresci-mento fúngico.9,10
Os azóis – fluconazol (FCZ), voriconazol (VCZ), itraconazol, posaconazol e o mais recente triazol, o isavuconazol – actuam inibindo a actividade da en-zima lanosterol 14-α-desmetilase responsável pela biossíntese de ergosterol, levando à acumulação de um esterol tóxico (14-α-metil-3,6-diol) e à perda da integridade da membrana. Por outro lado, os polie-nos – anfotericina B (AmB)– ligam-se ao ergoste-rol e interferem com os poros transmembranares, o que vai aumentar a permeabilidade da membrana
provocando a morte celular fúngica por perda dos seus componentes. Já as equinocandinas – caspofun-gina, micafungina e anidulafungina – inibem de forma não-competitiva a enzima 1,3-β-D-glucanosintetase, o que inibe a síntese de 1,3-β-D-glucano e afecta a in-tegridade da parede celular fúngica.2,11,12
Resistências aos AF
O aumento do número de infecções fúngicas, bem como da utilização de fármacos AF e crescente re-sistência aos mesmos, levaram à necessidade de execução de testes de susceptibilidade aos antifún-gicos (TSAF), reproduzíveis e standard, baseados em guidelines de laboratórios de referência, cujo intuito se prende com a observação da capacidade de cres-cimento de um fungo na presença de um AF em par-ticular, de forma a estimar o seu comportamento in vivo. Neste contexto, é avaliada a concentração mí-nima inibitória (CMI), ou seja, a concentração míni-ma de AF capaz de inibir o crescimento fúngico.6,13
Actualmente, ainda que semelhantes, existem duas directrizes para testar a susceptibilidade aos AF: Clinical and Laboratory Standards Institute (CLSI) e European Committee on Antimicrobial Susceptibi-lity Testing (EUCAST).14
Estes testes são essenciais para a aplicação de uma terapêutica segura e eficaz, já que permitem estudar os padrões de resistência aos AF.6,7 Nos casos de
can-didemia, a execução de TSAF é recomendada, nomea-damente aos azóis, em todos os isolados, e às equi-nocandinas nos casos de terapêutica prévia com esta classe ou infecção por C. glabrata ou C. parapsilosis.14
Existem diversos mecanismos responsáveis pela re-sistência das espécies de CNA aos antifúngicos con-vencionalmente utilizados (Tabela 1).3,15,16
Resistência aos azóis
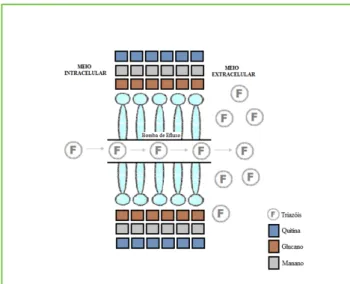
Um dos mecanismos de resistência aos azóis assen-ta na capacidade de activação de bombas de efluxo que promovem a exocitose do fármaco, o que dimi-nui a sua concentração na enzima-alvo (lanosterol 14-α-desmetilase) (Fig.1).15,17
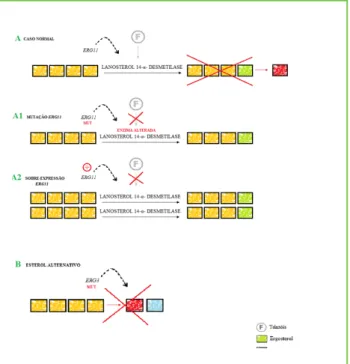
A alteração da enzima-alvo ou sobre expressão do gene que a codifica – ERG11 – constitui um outro me-canismo que confere resistência aos azóis (Fig. 2).15,17
A alteração qualitativa da enzima ocorre por muta-ções pontuais no gene ERG11, o que evita a sua ligação aos derivados triazólicos, por redução da sensibilida-de (Fig. 2).15,18
Um outro mecanismo de resistência reside na ca-pacidade de Candida produzir vias alternativas para
Tabela 1. Mecanismos de resistência das espécies de CNA aos AF. Mecanismo de resistência Diminuição da concentração intracelular de fármaco
Causa Efeito Ocorrência em Candida spp.
Cd Ct Cgla Cp Ck
Azóis
Expressão de genes que codificam transportadores ABC
Expressão de genes que codificam transportadores MFS Efluxo de fármaco + – + + + + – – + ND Alterações no local de ligação do fármaco à enzima
Mutações no gene ERG11 Diminuição da afinidade da enzima-alvo para os azóis + + – + + Produção aumentada da enzima-alvo Sobre-expressão do gene ERG11 Aumento da síntese de ergosterol + + + + + Polienos (Amb) Alterações na permeabilidade da membrana Mutações em genes implicados na biossíntese de ergosterol
Modificações nos lípidos de membrana
ND – – ND –
Equinocandinas
Mutações nos genes
FKS que codificam
as subunidades da enzima alvo
Mutações nos genes FKS1 e/ou FKS2
Diminuição da afinidade das equinocandinas para a enzima-alvo
FKS1 FKS1 FKS1 FKS1 FKS1
Crescimento paradoxal Capacidade de produção de outros componentes
Crescimento acima da CMI + + ND + +
Figura 1 – Mecanismo de resistência de Candida aos azóis
por activação de bombas de efluxo, que promovem a exocitose do fármaco.
Cd, C. dubliniensis; Ct, C. tropicalis; Cgla, C. glabrata; Cp, C. parapsilosis; Ck, C. krusei; –, mecanismo não observado (mas descrito); +, mecanismo observado; ND, mecanismo não descrito. Adaptado de Kolaczkowska A, et al; Sanguinetti M, et al; Gonçalves SS, et al.3,15,16
FKS2
31
sdfcompensar a perda de ergosterol induzida pelos azóis.15 Constatou-se que mutações no gene ERG3
levam a uma acumulação de 14-α-metilfecosterol, ao invés de 14-α-metil-3,6-diol (produto tóxico) (Fig. 2).15,17 Esta mutação bloqueia a acumulação do
es-terol tóxico, que de outra forma se produz quando a enzima é exposta aos triazóis.15,19
Os diferentes mecanismos de resistência aos azóis poderão coexistir simultaneamente, desenvolvendo--se nestes casos elevados níveis de resistência.3
Resistência às equinocandinas
Os mecanismos de resistência às equinocandinas baseiam-se na ocorrência de mutações pontuais adquiridas nos genes FKS que codificam a enzima 1,3-β-D-glucanosintetase, em regiões denominadas “hot-spot” (HS), o que leva a uma diminuição da sua sensibilidade, associado a valores elevados de CMI
Figura 2 – Mecanismo de resistência de Candida aos
azóis. A – Situação normal: inibição da síntese de ergoste-rol, levando à produção de um esterol tóxico que conduz à perda da integridade da membrana; A1 – Alteração qua-litativa da enzima, modificando-se a afinidade do fármaco para a mesma, o que permite a síntese de ergosterol; A2 – Alteração quantitativa da enzima, promovendo-se um aumento da síntese de ergosterol. B – Mutações no gene
ERG3 inibem a síntese do esterol tóxico, levando à síntese
de um esterol alternativo capaz de integrar a membrana celular, colmatando a perda da sua integridade induzida pelos triazóis.
Figura 3 – Mecanismo de resistência de Candida às
equi-nocandinas por mutações no gene FKS1, diminuindo a
afi-nidade do fármaco para a enzima.
Figura 4 – Mecanismo de resistência de Candida às
equi-nocandinas por capacidade de activação de vias que per-mitem a síntese de outros componentes da parede celular na ausência de síntese de glucano.
32
e consequente falha terapêutica.20,21 Poderão existir
também casos de mutações intrínsecas, em que a for-ma alterada da enzifor-ma não tem tanta afinidade para o fármaco (Fig. 3).18 Actualmente, são raros os casos
de resistência a esta classe, porém em C. glabrata são referenciados cada vez mais casos de resistência se-cundária às equinocandinas.5
A indução de uma resposta adaptativa ao stress consti-tui um outro mecanismo de resistência, isto é, em fun-ção da inibifun-ção da síntese de glucano, a parede celular tem a capacidade de produzir outros componentes (por exemplo, quitina) (Fig. 4).15,17 Esta resposta leva a um
aumento da concentração de quitina na parede celular e efeito de crescimento paradoxal in vitro, ou seja, a capa-cidade de crescimento acima da CMI.22
Resistência aos polienos
Nesta classe destaca-se a AmB, sendo pouco frequen-tes as resistências a este fármaco entre as espécies de CNA.3 A resistência adquirida está relacionada com
mutações que ocorrem no gene ERG3, cujas enzimas que codifica participam na síntese de ergosterol. Estas mu-tações afectam a biossíntese deste componente, poden-do ocorrer modificações nos lípipoden-dos de membrana e um decréscimo na quantidade sintetizada.21,23
Outros estudos reportam que as mutações genéticas, para além de afectarem o gene ERG3, poderão afectar outros genes envolvidos na síntese do ergosterol – ERG2, ERG5, ERG6 ou ERG11, levando à diminuição da sua quantidade ou à síntese de outros esteróis, alterações estas responsáveis pela redução da afinidade do fármaco para o seu alvo celular.16
Estudos evidenciam que a exposição à AmB leva à produção de espécies reactivas ao oxigénio, responsáveis pela morte celular. Neste sentido, Candida apresenta um outro mecanismo de
Figura 5 – Factores predisponentes para resistência aos AF.
Os agentes AF utilizados variam consoante se tratem de infecções superficiais ou sistémicas. As candidoses superficiais são em muitos casos auto-limitadas em in-divíduos saudáveis.2,11 Nas candidoses mucocutâneas, de
uma maneira geral, os cremes locais, soluções, suspensões ou pastilhas apresentam-se como terapêutica inicial.25
Na Tabela 2 é feita referência ao tratamento das candido-ses superficiais mais comuns.
Nas candidoses invasivas poderão ser adoptadas dife-rentes estratégias terapêuticas: profiláctica, preemptiva, empírica e documentada. A terapêutica profiláctica en-globa os casos de ausência de infecção, em que os sinais/ sintomas são inexistentes. Na terapêutica preemptiva o doente apresenta factores de risco e marcadores seroló-gicos de infecção, pelo que se defende a instituição de te-rapêutica dado o elevado risco de candidose. A terapêu-tica empírica é iniciada com base em evidências clínicas apesar da inexistência de confirmação microbiológica, em doentes que apresentam sinais e sintomas de infec-ção. Já a terapêutica documentada é direccionada, uma vez que o agente patogénico se encontra microbiologica-mente confirmado e é sustentada por evidências clí-nicas.26-28
Tabela 2. Tratamento das candidoses superficiais segundo as recomendações da IDSA.
Infecção
Candidose Vulvovaginal
Terapêutica recomendada IDSA
- Casos não complicados: antifúngicos tópi-cos ou fluconazol via oral
- Infecções agudas graves: fluconazol Candidose
orofaríngea
- Infecções ligeiras: clotrimazol ou micona-zol; Alternativa: nistatina
- Infecções graves: fluconazol Candidose
esofágica
- Fluconazol oral
- Impossibilidade de via oral: fluconazol intravenoso ou equinocandina e terapêutica de escalação para fluconazol oral
Existem diversas razões que levam a crer que a tera-pêutica profiláctica com azóis poderá ser vantajosa em doentes de alto risco, nomeadamente a inespeci-ficidade dos sinais/sintomas de infecção, dificuldade de obtenção de um diagnóstico preciso e consequen-tes atrasos na instituição da terapêutica e taxas de morbilidade e mortalidade associadas.29 A
terapêuti-ca profiláctiterapêuti-ca é referida como benéfiterapêuti-ca na prevenção de candidose invasiva em doentes neutropénicos com patologias hemato-oncológicas, após transplantes de medula óssea, receptores de órgãos sólidos e doentes de alto risco submetidos a cirurgia em Unidade de Cuidados Intensivos (UCI) para prevenção de infec-ções intra-abdominais.27,30,31
No entanto, em doentes na UCI ainda são questio-náveis as vantagens de uma terapêutica profiláctica e quais os doentes que dela beneficiariam.14,32 A dúvida
reside no facto dos dados serem inconclusivos quanto à sua eficácia, devido aos múltiplos desenhos de es-tudo e heterogeneidade da população estudada, exis-tindo limitações inerentes: impossibilidade de definir um doente de alto risco em UCI, AF utilizado, dose e formulação, e doenças subjacentes.32,33
Para uma UCI que evidencie taxas de candidose inva-siva elevadas, superiores a 5% dos doentes, a terapêu-tica profilácterapêu-tica poderá ser considerada em popula-ções seleccionadas de doentes com elevado risco para candidose invasiva.14 Porém, a utilização rotineira de
AF em profilaxia não é recomendada.34 A utilização
generalizada e inadequada do FCZ como agente pro-filáctico conduz ao desenvolvimento de resistências e incremento de candidoses por estirpes resistentes a este AF, o que se traduz igualmente na emergência das espécies não-albicans.32,33,35
Adaptado de Pappas PG, et al.14
33
resistência à AmB que consiste num aumento da pro-dução de catalases, respondendo desta forma ao stress oxidativo induzido pelo fármaco.24
Terapêutica
A resistência de Candida aos AF é multifactorial (Fig. 5), pelo que diversos factores deverão ser conside-rados aquando da escolha da terapêutica.2 Importa
também considerar a espécie de Candida e a exposição prévia a terapêuticas com azóis ou equinocandinas.14
Actualmente, não existem evi-dências que sustentem a utili-zação das terapêuticas preemp-tiva e empírica na UCI, pelo que é necessária maior investi-gação de modo a apurar os seus benefícios.26 De acordo com a Infectious Diseases Society of America (IDSA), nos doentes em estado crítico e com suspei-ta de candidose invasiva, deve-rá ser realizada uma avaliação dos marcadores de infecção ou dados obtidos de meios de cul-tura de locais não estéreis, de-vendo ser iniciada terapêutica empírica com equinocandinas em casos onde existem factores de risco e febre de origem des-conhecida, bem como sinais de choque séptico.14,26
Em doentes sem exposição pré-via ao FCZ, este poderá ser uma opção desde que a espécie em causa seja susceptível ao fárma-co.14 Porém, há quem defenda
que uma terapêutica empírica com FCZ em doentes com septi-cémia na UCI revela-se desvan-tajosa dada a possibilidade de desenvolvimento de resistências e falha terapêutica em infecções por espécies de CNA.36
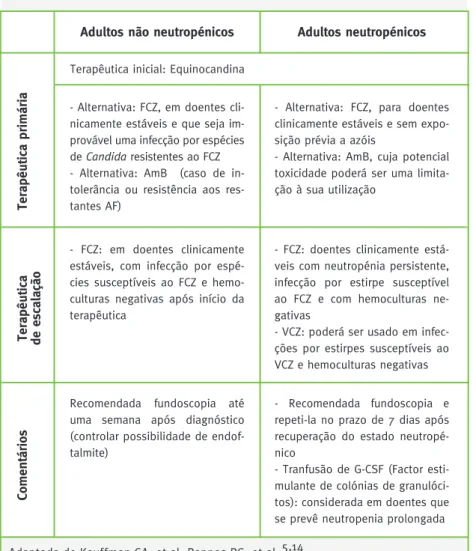
Tabela 3. Recomendações da IDSA para o tratamento de candidemia e candidose invasiva em adultos.
Adultos não neutropénicos
Terapêutica inicial: Equinocandina
Adultos neutropénicos
- Alternativa: FCZ, em doentes cli-nicamente estáveis e que seja im-provável uma infecção por espécies de Candida resistentes ao FCZ - Alternativa: AmB (caso de in-tolerância ou resistência aos res-tantes AF)
- Alternativa: FCZ, para doentes clinicamente estáveis e sem expo-sição prévia a azóis
- Alternativa: AmB, cuja potencial toxicidade poderá ser uma limita-ção à sua utilizalimita-ção
- FCZ: em doentes clinicamente estáveis, com infecção por espé-cies susceptíveis ao FCZ e hemo-culturas negativas após início da terapêutica
- FCZ: doentes clinicamente está-veis com neutropénia persistente, infecção por estirpe susceptível ao FCZ e com hemoculturas ne-gativas
- VCZ: poderá ser usado em infec-ções por estirpes susceptíveis ao VCZ e hemoculturas negativas
Recomendada fundoscopia até uma semana após diagnóstico (controlar possibilidade de endof-talmite)
- Recomendada fundoscopia e repeti-la no prazo de 7 dias após recuperação do estado neutropé-nico
- Tranfusão de G-CSF (Factor esti-mulante de colónias de granulóci-tos): considerada em doentes que se prevê neutropenia prolongada
Os fármacos de primeira linha numa terapêutica do-cumentada são escolhidos com base no perfil de sus-ceptibilidade da espécie responsável pela infecção.28
Nos doentes neutropénicos, o sucesso terapêutico é fortemente influenciado pela subida de neutrófilos, uma vez que a sua função é preponderante na defesa do hospedeiro.14 De acordo com a IDSA e a European
So-ciety for Clinical Microbiology and Infectious Diseases (ESCMID), é dado ênfase ao papel das equinocandinas como fármacos de eleição dado o desenvolvimento de resistências ao fluconazol.14,27 Na Tabela 3 estão
repre-sentadas as directrizes da IDSA para o tratamento de candidemia e candidose invasiva. Como referido ante-riormente, em todos os casos é essencial ter-se em consi-deração o local de infecção.
A duração do tratamento deverá ser de 14 dias após primeira hemocultura negativa e resolução dos sinais e sintomas.14 Caso seja possível e o doente se encontre
cli-nicamente estável e infectado por uma espécie suscep-tível, o switch de terapêutica intravenosa (IV) para oral deverá ser considerado após 10 dias de tratamento.27
Conclusão
Com a realização do presente artigo, que reúne informa-ção actualizada, foi possível concluir que a emergência de infecções por Candida está associada a elevadas taxas de morbilidade e mortalidade, merecendo deste modo espe-cial atenção o seu diagnóstico e terapêutica. São diversos os factores que estão na origem da elevada prevalência de candidose, tais como a existência de resistências aos AF, intrínsecas ou adquiridas, que dependem tanto da espécie de Candida, como do fármaco e do hospedeiro. Também a limitação no número de fármacos existen-tes bem como a sua acção predominantemente fun-gistática são factores que poderão contribuir para o desenvolvimento de resistências.
Terapêutica primária
Terapêutica de escalação
Comentários
Adaptada de Kauffman CA, et al; Pappas PG, et al.5,14
Os microbiologistas deparam-se com a complexidade de realização de um correcto diagnóstico, sendo este fundamental para que a terapêutica seja instituída o mais precocemente possível. Tal como no diagnósti-co, está inerente à terapêutica uma grande complexi-dade. De uma maneira geral, a escolha inicial recai so-bre uma equinocandina e a terapêutica de escalação sobre um azol. No entanto, é sempre imprescindível ter em consideração o local de infecção, a espécie de CNA que está na sua origem e o seu padrão de sus-ceptibilidade aos AF. Apesar da terapêutica precoce estar associada a um provável melhor prognóstico, com esta emergem novos padrões de resistência. Por outro lado, a terapêutica documentada é direcciona-da, instituindo-se de acordo com o microrganismo identificado, onde os TSAF auxiliam na escolha te-rapêutica, estando por isso implícita uma diminuição da emergência de novos perfis de resistência.
Em suma, com o aumento das espécies resistentes aos fármacos convencionalmente utilizados e aumento da população imunocomprometida, bem como as elevadas taxas de mortalidade associadas, advém a necessidade de desenvolvimento de abordagens terapêuticas efectivas.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse.
Suporte financeiro
O presente trabalho não foi suportado por nenhum subsídio ou bolsa.
Nota
Por decisão pessoal, os autores não escrevem segundo o novo Acordo Ortográfico.
Referências
1. Clancy CJ, Nguyen MH. Finding the “Missing 50%” of invasive candidiasis: how nonculture diagnostics will improve unders-tanding of disease spectrum and transform patient care. Clin In-fect Dis. 2013;56:1284-92.
2. Deorukhkar SC, Saini S. Non albicans Candida species : A review of epidemiology, pathogenicity and antifungal resistance. Prava-ra Med Rev. 2015;7:7-15.
3.Kolaczkowska A, Kolaczkowski M. Drug resistance mechanisms and their regulation in non-albicans Candida species. J Antimicrob Chemother. 2016;71:1-13.
4. Papon N, Courdavault V, Clastre M, Bennett RJ. Emerging and emerged pathogenic Candida species: beyond the Candida albicans paradigm. PLoS Pathog. 2013;9:e1003550.
5. Kauffman CA. Treatment of candidemia and invasive
candidiasis in adults. UpToDate. 2016. [Accessed September 8, 2016]. Available from: https://www.uptodate.com/ contents/treatment-of-candidemia-and-invasive-candidiasis-in -ad ults?so urce =se arch_re sult& se arch=tratame n to candida&selectedTitle=1~150.
6. Alcazar-Fuoli L, Mellado E. Current status of antifungal resistance and its impact on clinical practice. Br J Haematol. 2014;166:471-84. 7. Giolo MP, Svidzinski TI. Fisiopatogenia, epidemiologia e diagnóstico laboratorial da candidemia. J Bras Patol Med Lab. 2010;46:225-34.
8. Peixoto JV, Rocha MG, Nascimento RT, Moreira VV, Kashiwabara TG. Candidíase: uma revisão de literatura. Bras J Surg Clin Res. 2014;8:75-82.
9. Patil S, Rao RS, Majumdar B, Anil S. Clinical appearance of oral Candida infection and therapeutic strategies. Front Microbiol. 2015;6:1-10.
10. Sardi JC, Scorzoni L, Bernardi T, Fusco-Almeida AM,
Mendes Giannini MJ. Candida species: current epidemiology,
pathogenicity, biofilm formation, natural antifungal products and new therapeutic options. J Med Microbiol. 2013;62):10-24. 11. Spampinato C, Leonardi D. Candida infections, causes, targets, and resistance mechanisms: traditional and alternative antifungal agents. Biomed Res Int. 2013;2013:1-13.
12. Grover N. Echinocandins: A ray of hope in antifungal drug therapy. Indian J Pharmacol. 2010;42:9.
13. Pfaller MA. Antifungal susceptibility testing. UpToDate. 2016. [Accessed July 6, 2016]. Available from: https:// www.uptodate.com/contents/antifungal-susceptibility-testing?source=search_result&search=antifungal susceptibility testing&selectedTitle=1~150.
14. Pappas PG, Kauffman CA, Andes DR, Clancy CJ, Marr KA, Ostrosky-Zeichner L, et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2015;62:1-50. 15. Sanguinetti M, Posteraro B, Lass-Flörl C. Antifungal drug resistance among Candida species: mechanisms and clinical impact. Mycoses. 2015;58(Suppl. 2):2-13.
16. Gonçalves SS, Souza AC, Chowdhary A, Meis JF, Colombo AL. Epidemiology and molecular mechanisms of antifungal resistance in Candida and Aspergillus. Mycoses. 2016;59:198-219. 17. Cowen LE, Steinbach WJ. Stress, drugs, and evolution: the role of cellular signaling in fungal drug resistance. Eukaryot Cell. 2008;7:747-64.
18. Silva S, Negri M, Henriques M, Oliveira R, Williams DW, Azeredo J. Candida glabrata, Candida parapsilosis and Candida tropicalis: biology, epidemiology, pathogenicity and antifungal resistance. FEMS Microbiol Rev. 2012;36:288-305.
19. Kelly S, Lamb D, Kelly D, Manning NJ, Loeffler J, Hebart H, et al. Resistance to fluconazole and cross-resistance to amphotericin B in Candida albicans from AIDS patients caused by defective sterol Δ 5,6 -desaturation. FEBS Lett. 1997;400:80-82.
20. Beyda ND, Lewis RE, Garey KW. Echinocandin resistance
in Candida species: mechanisms of reduced susceptibility and therapeutic approaches. Ann Pharmacother. 2012;46:1086-96. 21. Cuenca-Estrella M. Antifúngicos en el tratamiento de las infecciones sistémicas: importancia del mecanismo de acción, espectro de actividad y resistencias. Rev Española Quimioter. 2010;23:169-176.
22. Walker LA, Gow NA, Munro CA. Fungal echinocandin resistance. Fungal Genet Biol. 2010;47:117-26.
23. Morio F, Pagniez F, Lacroix C, Miegeville M, Le Pape P. Amino acid substitutions in the Candida albicans sterol 5,6-desaturase (Erg3p) confer azole resistance: characterization of two novel mutants with impaired virulence. J Antimicrob Chemother. 2012;67:2131-8.
24. Pemán J, Cantón E, Espinel-Ingroff A. Antifungal drug resistance mechanisms. Expert Rev Anti Infect Ther. 2009;7:453-60.
25. Kauffman CA. Candidiasis. In: Goldman L, Ausiello D, editors. Cecil Medicine. 23rd ed. Philadelphia: Saunders Elsevier; 2008. p.2350-3.
26. Guery BP, Arendrup MC, Auzinger G, Azoulay E, Borges Sá M, Johnson EM, et al. Management of invasive candidiasis and candidemia in adult non-neutropenic intensive care unit patients: Part I. Epidemiology and diagnosis. Intensive Care Med. 2009;35:55-62.
27. Cornely OA, Bassetti M, Calandra T, Garbino J, Kullberg BJ, Lortholary O, et al. ESCMID guideline for the diagnosis and management of Candida diseases 2012: non-neutropenic adult patients. Clin Microbiol Infect. 2012;18(Suppl. 7):19-37.
28. Mendes J. Abordagem diagnóstica e terapêutica da candidíase invasiva em doentes adultos não-neutropénicos internados em unidades de cuidados intensivos. Rev Port Doenças Infecc. 2012;8:76–84.
29. Garnacho-Montero J, Díaz-Martín A, De Piappón MR-P, García-Cabrera E. Infección fúngica invasiva en los pacientes ingresados en las áreas de críticos. Enferm Infecc Microbiol Clin. 2012;30:338–43.
30. Pappas PG, Kauffman CA, Andes D, Benjamin Jr. DK, Calandra TF, Edwards Jr. JE, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;48:503–35. 31. Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem. Clin Microbiol Rev. 2007;20:133–63.
32. Paramythiotou E, Frantzeskaki F, Flevari A, Armaganidis A, Dimopoulos G. Invasive fungal infections in the ICU: how to approach, how to treat. Molecules. 2014 ;19:1085–119.
33. Párola AG. Estudo epidemiológico de candidíase invasiva na unidade de cuidados intensivos do Hospital Egas Moniz - Centro Hospitalar Lisboa Ocidental[tese] Lisboa: Universidade de Lisboa; 2011. [consultada 8 Jul 2016] Disponível em http:// repositorio.ul.pt/bitstream/10451/4188/1/620654_Tese.pdf
34. Kauffman CA. Overview of Candida infections. UpToDate. 2016 [Accessed June 5, 2016]. Available from: https://www.uptodate. com/contents/overview-of-candida-infections?source=search_ result&search=candida cutaneas e mucocutaneas&selectedTitl e=4~150#H3.
35. Oren I, Paul M. Up to date epidemiology, diagnosis and management of invasive fungal infections. Clin Microbiol Infect. 2014;20(Supplement 6):1–4. 36. Golan Y. Empiric anti-Candida therapy for patients with sepsis in the ICU: how little is too little? Crit Care. 2009;13:180.