UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA CURSO DE PÓS–GRADUAÇÃO EM QUÍMICA
LEÔNCIO MESQUITA DE SOUSA
ESTUDO QUÍMICO E AVALIAÇÃO BIOLÓGICA DE
Phanera glabra (Jacq.) Vaz & Bauhinia ungulata L.
(FABACEAE)
ESTUDO QUÍMICO E AVALIAÇÃO BIOLÓGICA DE Phanera glabra (Jacq.) Vaz & Bauhinia ungulata L.
(FABACEAE)
Tese apresentada à Coordenação do Programa de Pós-Graduação em Química do Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Química. Área de Concentração: Química Orgânica
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
S697e Sousa, Leôncio Mesquita de.
Estudo químico e avaliação biológica de Phanera glabra (Jacq.) Vaz & Bauhinia ungulata L. (FABACEAE) / Leôncio Mesquita de Sousa. – 2016.
263 f.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Programa de Pós-Graduação em Química, Fortaleza, 2016.
Orientação: Profa. Dra. Gilvandete Maria Pinheiro Santiago.
1. Phanera glabra. 2. Bauhinia ungulata. 3. Óleo essencial. 4. Flavonoides. 5. Bibenzis. I. Título.
ESTUDO QUÍMICO E AVALIAÇÃO BIOLÓGICA DE
Phanera glabra (Jacq.) Vaz & Bauhinia ungulata L.
(FABACEAE)
A DEUS pelo dom da vida e pela concretização desse sonho.
Aos meus pais Manuel Lino de Sousa e Maria Mesquita de Sousa por todos os ensinamentos e sacrifícios que fizeram para que eu me tornasse a pessoa que sou e aos meus irmãos Luzira Sandra, Zelândia e Leondino Cesar que sempre me apoiaram e me estimularam.
À minha sobrinha Luana Marques por ter me proporcionado muitos momentos de alegria e descontração. Sua ajuda foi extremamente importante para que eu pudesse chegar até aqui.
À minha namorada e amiga Ravena Pamella pela companhia, amor e compreensão.
Aos colegas e amigos do PRECE, em particular, o professor Manoel Andrade Neto, pelo exemplo e apoio, um dois maiores incentivadores desde a minha preparação para o vestibular.
A todos os professores da UFC, em destaque, a professora Ângela, Belmino e Telma Leda, pela força e inspiração no magistério, bem como, a professora Selma, uma das incentivadoras no meu curso de pós-graduação.
Aos professores Edilberto e Raimundo Braz-Filho, os quais tive a honra de conhecê-los, e também pela ajuda nas elucidações estruturais.
Aos colegas e amigos de laboratório Roberto Wagner, Michele Asley, Aislândia, Erivaldo, Jarbas e Horlando Carlota pela colaboração para que a dura rotina no laboratório se tornasse divertida e prazerosa.
Aos funcionários Célia e Orlando pela acessibilidade.
À Professora Gilvandete Maria Pinheiro Santiago, um agradecimento todo especial: cheio de carinho e admiração. Sua orientação foi indispensável para a concretização deste trabalho, bem como, a minha formação profissional.
O presente trabalho relata o estudo químico e biológico das espécies Phanera glabra (Jacq.) Vaz e Bauhinia ungulata L. A composição química do óleo essencial das folhas de B. ungulata, obtido por hidrodestilação, foi determinada e quantificada por cromatografia gasosa acoplada à espectrometria de massas (CG-EM) e detector de ionização por chama (CG-DIC), sendo, portanto, identificado 85,90% dos seus constituintes: Óxido de cariofileno (22,99%), (E)-cariofileno (14,53%) e α-copaeno (7,17%) foram os constituintes majoritários. O óleo essencial teve sua atividade larvicida avaliada sobre Aedes aegypti, sendo obtido um valor de CL50 igual a 75,12
µg/mL. A atividade citotóxica do OEBU foi realizada sobre quatro linhagens tumorais humanas HL-60, MCF-7, NCI-H292 e HEP-2, através do método do MTT. O estudo dos componentes não voláteis foi iniciado com a preparação dos extratos hexânico e etanólico dos caules de P. glabra. O fracionamento cromatográfico destes extratos permitiu o isolamento de lupenona (PG–1), mistura de sitosterol e estigmasterol (PG–2), 4’-hidroxi-7-metoxiflavana (PG–3), 3’,7-dimetoxi-4’-hidroxiflavana (PG–4) e 5,5'-dihidroxi-2',3,7-trimetoxiflavona (PG–5). Taraxerol (BU–1), ácido betulínico (BU– 2), taraxerona (BU–3), glutinol (BU–4), mistura de sitosterol e estigmasterol (BU–5), pacharina (BU–6), naringenina (BU–7), eriodictiol (BU–8), liquiritigenina (BU–9), guibourtinidol (BU–10) e fisetinidol (BU–11) foram isolados a partir dos extratos dos caules de B. ungulata; enquanto do extrato etanólico das raízes de B. ungulata
foram isolados 3,5-dimetoxi-4-metil-2’-hidroxibibenzil (BU–12), substância inédita na literatura, e 3,5-dimetoxi-2’-hidroxibibenzil (BU–13) cujos dados de RMN 13C são
descritos pela primeira vez neste trabalho. As estruturas dos compostos foram elucidadas através de técnicas espectroscópicas tais como IV, EM, RMN 1D e 2D, e por comparação com dados descritos na literatura. O bibenzil 3,5-dimetoxi-4-metil-2’-hidroxibibenzilmostrou atividade citotóxica significativa contra as linhagens celulares humanas HL-60 e HEP-2 com valores de IC50 de 4,3 e 6,5 µg/mL, respectivamente.
This paper describes the chemical and biological study of species Phanera glabra
(Jacq.) Vaz and Bauhinia ungulata L. The chemical composition of essential oil from leaves of B. ungulata, obtained by hydrodistillation, was analysed by gas chromatography-mass spectroscopy (GC-MS) and gas chromatography-flame ionization detector. Twenty-two constituents were identified representing 85.90% of the total composition: Caryophyllene oxide (22.99%), (E)-caryophyllene (14.53%) and α-copaene (7.17%) were the major constituents. Larval bioassay against Aedes aegypti of B. ungulata essential oil showed LC50 value of 75.12 ± 2.82 µg/mL. The
cytotoxic effect against four human tumor cell lines HL-60, MCF-7, NCI-H292 and HEP-2 was evaluated, showing IC50 values of 10.57; 22.25; 23.11 and 26.56 µg/ mL,
respectively. The study of the non-volatile constituents was initiated with the preparation of the hexane and ethanol extracts from stems of P. glabra. The chromatographic fractionation of these extracts allowed the isolation of lupenone (PG–1), the mixture of sitosterol and stigmasterol (PG–2), 4'-hydroxy-7-methoxyflavone (PG–3), 3',7-dimethoxy-4'-hydroxyflavone (PG–4) and 5,5'-dihydroxy-2',3,7-trimethoxyflavone (PG–5). Taraxerol (BU–1), betulinic acid (BU–2), taraxerone (BU–3), glutinol (BU–4), the mixture of sitosterol and stigmasterol (BU–5), pacharin (BU–6), naringenin (BU–7) and eriodictyol (BU–8), liquiritigenin (BU–9), guibourtinidol (BU–10) and fisetinidol (BU–11) were obtained from the extracts from stems of B. ungulata; while 3,5-dimethoxy-4-methyl-2’-hydroxybibenzyl (BU–12) and 3,5-dimethoxy-2’-hydroxybibenzyl (BU–13) were isolated from the ethanol extract of the roots. The structures of the compounds were elucidated by spectroscopic methods as IR, MS, 1D and 2D NMR, and by comparison with previously reported data in the literature. It's worth noting that BU–12 is unprecedented in the literature and the 13C NMR data of BU–13 are reported for the first time in this work. The cytotoxicity of BU–12 has been evaluated against four human cancer cell lines, showing IC50 values of 4.3 and 6.5 µg/mL against pro-myelocytic leukemia (HL-60)
CENAUREMN Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear
BB Broad Band
RMN 1H Ressonância Magnética Nuclear de Hidrogênio RMN 13C Ressonância Magnética Nuclear de Carbono-13 DEPT Distortionlesss Enhancement by Polarization Transfer
HSQC Heteronuclear Single Quantum Coherence
HMBC Heteronuclear Multiple Bond Connectivity
COSY Correlation Spectroscopy
IV Infravermelho
EM-ASR Espectro de massas de alta resolução
EM Espectrometria de Massas
m/z Razão massa/carga
CG-DIC Cromatografia gasosa com detector de ionização de chama CG-EM Cromatografia gasosa acoplada à espectrometria de massas
IK Índice de Kovatz
J Constante de acoplamento
s Simpleto
sl Simpleto largo
d Dupleto
dd Duplo dupleto
t Tripleto
m Multipleto
MHz Mega hertz
MTT 3-(4,5-dimetil-2-tiazol)-2,5-difenil-2-H-brometo de tetrazolio CI50 Concentração Inibitória de 50%
L Comprimento
V Volt
ppm Partes por milhão
CCD Cromatografia em camada delgada
EERPG Extrato etanólico das raízes de Phanera glabra
EHCCBU Extrato hexânico das cascas dos caules de Bauhinia ungulata EECCBU Extrato etanólico das cascas dos caules de Bauhinia ungulata
EELCBU Extrato etanólico do lenho dos caules de Bauhinia ungulata
EHRBU Extrato hexânico das raízes de Bauhinia ungulata
EERBU Extrato etanólico das raízes de Bauhinia ungulata
FA Fração alcaloídica
FNA Fração não alcaloídica
LISTA DE SÍMBOLOS
Φ Diâmetro
α Alfa
β Beta
Figura 01 – Folhas e caules de Phanera glabra (Jacq.) Vaz... 36
Figura 02 – Folhas e caules de Bauhinia ungulata L... 38
Figura 03 – Cromatograma de OEBU obtido por CG/EM... 59
Figura 04 – Cromatograma de OEBU obtido por CG/DIC... 59
Figura 05 – Espectro de massas do α-pineno... 62
Figura 06 – Espectro de massas do α-cubebeno... 62
Figura 07 – Espectro de massas do ciclosativeno... 62
Figura 08 – Espectro de massas do α-copaeno... 62
Figura 09 – Espectro de massas do β-bourboneno... 63
Figura 10 – Espectro de massas do β-elemeno... 63
Figura 11 – Espectro de massas do (E)-cariofileno... 63
Figura 12 – Espectro de massas do β-copaeno... 63
Figura 13 – Espectro de massas do α-guaieno... 64
Figura 14 – Espectro de massas do 6,9-guaiadieno... 64
Figura 15 – Espectro de massas do α-humuleno... 64
Figura 16 – Espectro de massas da allo-aromadendreno... 64
Figura 17 – Espectro de massas do β-selineno... 65
Figura 18 – Espectro de massas do α-muuroleno... 65
Figura 19 – Espectro de massas do γ-cadineno... 65
Figura 20 – Espectro de massas do α-calacoreno... 65
Figura 21 – Espectro de massas do espatulenol... 66
Figura 22 – Espectro de massas do óxido de cariofileno... 66
Figura 23 – Espectro de massas do epóxido de humuleno II... 66
Figura 24 – Espectro de massas do junenol... 66
Figura 25 – Espectro de massas do cubenol... 67
Figura 26 – Espectro de massas do α-cadinol... 67
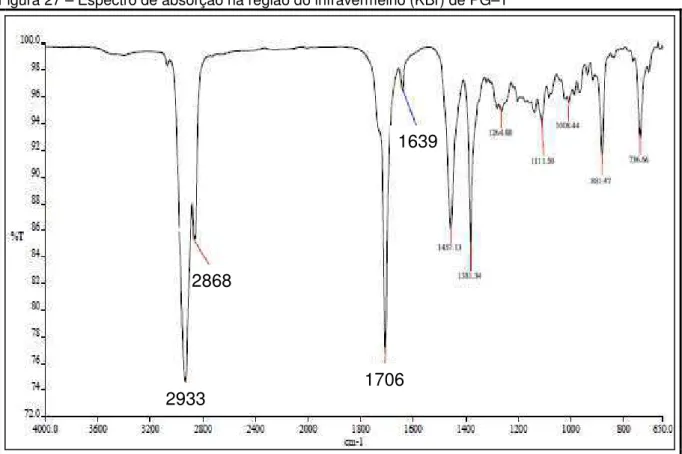
Figura 27 – Espectro de absorção na região do infravermelho (KBr) de PG–1.... 71
Figura 28 – Espectro de RMN 1H (500 MHz, CDCl3) de PG–1... 71
Figura 29 – Espectro de RMN 13C–BB (125 MHz, CDCl3) de PG–1... 72
Figura 30 – Espectro de RMN 13C–DEPT 135o de PG–1... 72
Figura 34 – Espectro de RMN 1H (500 MHz, CDCl3) de BU–1... 77
Figura 35 – Espectro de RMN 13C–BB (125 MHz, CDCl3) de BU–1... 78
Figura 36 – Espectro de RMN 13C–DEPT 135o de BU–1... 78
Figura 37 – Espectro de massas (i.e. 70 eV) de BU–1... 79
Figura 38 – Estrutura do taraxerol... 75
Figura 39 – Espectro de absorção na região do infravermelho (KBr) de BU–2... 83
Figura 40 – Espectro de RMN 1H (500 MHz, C5D5N) de BU–2... 83
Figura 41 – Espectro de RMN 13C–BB (125 MHz, C5D5N) de BU–2... 84
Figura 42 – Espectro de RMN 13C–DEPT 135o de BU–2... 84
Figura 43 – Espectro de massas (i.e. 70 eV) de BU–2... 85
Figura 44 – Estrutura do ácido betulínico... 81
Figura 45 – Espectro de absorção na região do infravermelho (KBr) de BU–3... 89
Figura 46 – Espectro de RMN 1H (300 MHz, CDCl3) de BU–3... 89
Figura 47 – Espectro de RMN 13C–BB (75 MHz, CDCl3) de BU–3... 90
Figura 48 – Espectro de RMN 13C-DEPT 135o de BU–3... 90
Figura 49 – Espectro de massas (i.e. 70 eV) de BU–3... 91
Figura 50 – Estrutura da taraxerona... 87
Figura 51 – Espectro de absorção na região do infravermelho (KBr) de BU–4... 95
Figura 52 – Espectro de RMN 1H (300 MHz, CDCl 3) de BU–4... 95
Figura 53 – Espectro de RMN 13C–BB (75 MHz, CDCl 3) de BU–4... 96
Figura 54 – Espectro de RMN 13C–DEPT 135o de BU–4... 96
Figura 55 – Espectro de massas (i.e. 70 eV) de BU–4... 97
Figura 56 – Estrutura do glutinol... 93
Figura 57 – Espectro de RMN 1H (300 MHz, CDCl3) de PG–2... 101
Figura 58 – Espectro de RMN 13C–BB (75 MHz, CDCl3) de PG–2... 101
Figura 59 – Espectro de RMN 13C–DEPT 135o de PG–2... 102
Figura 60 – Estruturas do sitosterol e estigmasterol de PG... 99
Figura 61 – Espectro de RMN 1H (300 MHz, CDCl3) de BU–5... 104
Figura 67 – Espectro de RMN 13C–DEPT 135o de BU–6... 110
Figura 68 – Espectro de massas (i.e. 70 eV) de BU–6... 111
Figura 69 – Esqueleto básico de derivado dibenzo[b,f]oxepínico... 106
Figura 70 – Espectro bidimensional de correlação heteronuclear 1H x 13C– HSQC de BU–6...111
Figura 71 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–6... 112
Figura 72 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–6... 112
Figura 73 – Estrutura da pacharina... 107
Figura 74 – Espectro de absorção na região do infravermelho (KBr) de PG–3.... 118
Figura 75 – Espectro de RMN 1H (300 MHz, CDCl3) de PG–3... 118
Figura 76 – Espectro de RMN 13C–BB (75 MHz, CDCl3) de PG–3... 119
Figura 77 – Espectro de RMN 13C–DEPT 135o de PG–3... 119
Figura 78 – Espectro de massas de alta resolução de PG–3... 120
Figura 79 – Estrutura do núcleo flavana... 114
Figura 80 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de PG–3... 120
Figura 81 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de PG–3... 121
Figura 82 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de PG–3...121
Figura 83 – Estrutura de (2S)-4’-hidroxi-7-metoxiflavana... 116
Figura 84 – Espectro de absorção na região do infravermelho (KBr) de PG–4.... 126
Figura 85 – Espectro de RMN 1H (300 MHz, CDCl3) de PG–4... 126
Figura 86 – Espectro de RMN 13C–BB (75 MHz, CDCl3 de PG–4... 127
Figura 87 – Espectro de RMN 13C–DEPT 135o de PG–4... 127
Figura 88 – Espectro de massas de alta resolução de PG–4... 128
COSY de PG–4...129
Figura 92 – Estrutura do (2S)-3’,7-dimetoxi-4-hidroxiflavana... 124
Figura 93 – Espectro de absorção na região do infravermelho (KBr) de PG–5.... 134
Figura 94 – Espectro de RMN 1H (500 MHz, CDCl3) de PG–5... 134
Figura 95 – Espectro de RMN 13C–BB (125 MHz, CDCl3) de PG–5... 135
Figura 96 – Espectro de RMN 13C–DEPT 135o de PG–5... 135
Figura 97 – Espectro de massas de alta resolução de PG–5... 136
Figura 98 – Estrutura do núcleo flavona... 131
Figura 99 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de PG–5... 136
Figura 100 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de PG–5... 137
Figura 101 – Espectro bidimensional de correlação homonuclear 1H x 1H – NOESY de PG–5... 137
Figura 102 – Estrutura do 3',5-diidroxi-3,4',7-trimetoxiflavona... 133
Figura 103 – Espectro de absorção na região do infravermelho (KBr) de BU–7... 143
Figura 104 – Espectro de RMN 1H (300 MHz, CD3OD) de BU–7... 143
Figura 105 – Espectro de RMN 13C–BB (75 MHz, CD 3OD) de BU–7... 144
Figura 106 – Espectro de RMN 13C–DEPT 135o de BU–7... 144
Figura 107 – Espectro de massas de alta resolução de BU–7... 145
Figura 108 – Estrutura do núcleo flavanona... 139
Figura 109 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de BU–7...145
Figura 110 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–7... 146
Figura 111 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–7... 146
Figura 112 – Estrutura da (2S)-naringenina... 141
Figura 118 – Estrutura da (2S)-eriodictiol... 149
Figura 119 – Espectro de absorção na região do infravermelho (KBr) de BU–9... 158
Figura 120 – Espectro de RMN 1H (300 MHz, CD3OD) de BU–9... 158
Figura 121 – Espectro de RMN 13C–BB (75 MHz, CD3OD) de BU–9... 159
Figura 122 – Espectro de RMN 13C–DEPT 135o de BU–9... 159
Figura 123 – Espectro de massas de alta resolução de BU–9... 160
Figura 124 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de BU–9...160
Figura 125 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–9... 161
Figura 126 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–9... 161
Figura 127 – Estrutura da (2S)-liquiritigenina... 157
Figura 128 – Espectro de absorção na região do infravermelho (KBr) de BU–10... 167
Figura 129 – Espectro de RMN 1H (500 MHz, CD 3OD) de BU–10... 167
Figura 130 – Espectro de RMN 13C–BB (125 MHz, CD 3OD) de BU–10... 168
Figura 131 – Espectro de RMN 13C–DEPT 135o de BU–10... 168
Figura 132 – Espectro de massas de alta resolução de BU–10... 169
Figura 133 – Estrutura do núcleo flavana-3-ol... 163
Figura 134 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de BU–10...169
Figura 135 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–10... 170
Figura 136 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–10... 170
Figura 137 – Estrutura (2R, 3S)-4’,7-dihidroxiflavan-3-ol (Guibourtinidol)... 165
Figura 138 – Espectro de absorção na região do infravermelho (KBr) de BU–11... 176
Figura 139 – Espectro de RMN 1H (300 MHz, CD3OD) de BU–11... 176
Figura 140 – Espectro de RMN 13C–BB (75 MHz, CD3OD) de BU–11... 177
Figura 141 – Espectro de RMN 13C–DEPT 135o de BU–11... 177
Figura 144 – Espectro bidimensional de correlação heteronuclear 1H x 13C –
HMBC de BU–11... 179
Figura 145 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–11... 179
Figura 146 – Estrutura do (-)-fisetinidol...174
Figura 147 – Espectro de absorção na região do infravermelho (KBr) de BU–12... 185
Figura 148 – Espectro de RMN 1H (300 MHz, CDCl3) de BU–12... 185
Figura 149 – Espectro de RMN 13C–BB (75 MHz, CDCl3) de BU–12... 186
Figura 150 – Espectro de RMN 13C–DEPT 135o de BU–12... 186
Figura 151 – Espectro de massas de alta resolução de BU–12... 187
Figura 152 – Esqueleto básico de bibenzis... 181
Figura 153 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de BU–12...187
Figura 154 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–12... 188
Figura 155 – Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de BU–12... 188
Figura 156 – Estrutura do 3,5-dimetoxi-4-metil-2’-hidroxibibenzil... 183
Figura 157 – Espectro de absorção na região do infravermelho (KBr) de BU–13... 193
Figura 158 – Espectro de RMN 1H (300 MHz, CD 3OD) de BU–13... 193
Figura 159 – Espectro de RMN 13C–BB (125 MHz, CD 3OD) de BU–13... 194
Figura 160 – Espectro de RMN 13C–DEPT 135o de BU–13... 194
Figura 161 – Espectro de massas (i.e. 70 eV) de BU–13... 195
Figura 162 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de BU–13...195
Figura 163 – Espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC de BU–13... 196
Figura 164 – Estrutura do 2’-hidroxi-3,5-dimetoxibibenzil... 191
LISTA DE TABELAS
Tabela 01 – Estruturas dos flavonoides isolados de espécies do gênero
Bauhinia... 43 Tabela 02 – Flavonoides isolados de espécies do gênero
Bauhinia... 57 Tabela 03 – Constituintes químicos do óleo essencial das folhas de Bauhinia
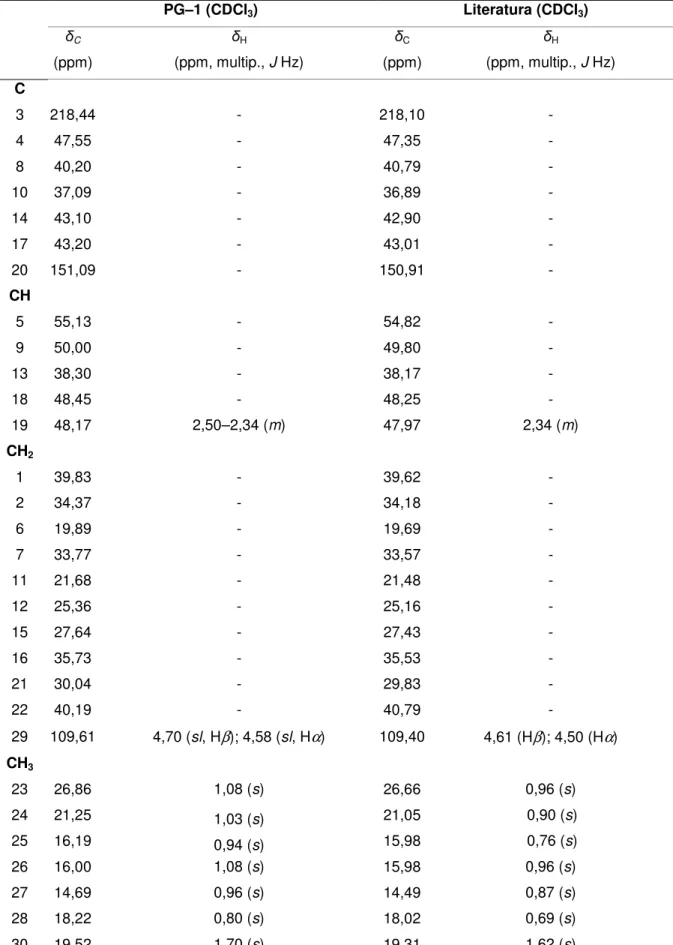
ungulata... 61 Tabela 04 – Dados espectroscópicos de PG–1 comparados com os dados
descritos na literatura (CULHAOGLU et al., 2015) para lup-20(29)-en-3-ona... 70 Tabela 05 – Dados espectroscópicos de BU–1 comparados com os dados
descritos na literatura (HERNÁNDEZ-CHÁVEZ et al., 2012) para 13α-metil-27-norolean-14-en-3β-ol... 76 Tabela 06 – Dados espectroscópicos de BU–2 comparados com os dados
descritos na literatura (PENG et al., 1998) para lup-20(29)-en-28-oico... 82 Tabela 07 – Dados espectroscópicos de BU–3 comparados com os dados
descritos na literatura (SARAIVA; PINTO, 2006) para 13α -metil-27-norolean-14-en-3β-ona... 88 Tabela 08 – Dados espectroscópicos de BU–4 comparados com os dados
descritos na literatura (ABDEL-SATTAR; ABOU-HUSSEIN; PETEREIT, 2015) para glutin-5-en-3α-ol... 94 Tabela 09 – Dados espectroscópicos de PG–2 comparados com os dados
descritos na literatura (SILVA et al., 2012) para a mistura*/** de sitosterol* e estigmasterol**... 100 Tabela 10 – Dados espectroscópicos de BU–6 comparados com os dados
metoxiflavana... 117 Tabela 12 – Dados espectroscópicos de PG–4 comparados com os dados
descritos na literatura (ACHENBACH; STOCKER; CONSTENLA, 1988) para (2S)-3’,7-dimetoxi-4’-hidroxiflavana... 125 Tabela 13 – Dados espectroscópicos de PG–5 comparados com os dados
descritos na literatura (PARK et al., 2006) para (3',5,-diidroxi-3,4',7-trimetoxiflavona)... 133 Tabela 14 – Dados espectroscópicos de BU–7 comparados com os dados
descritos na literatura (ZEKRY et al., 2015) para a (2S )-4’,5,7-triidroxiflavanona (Naringenina)... 142 Tabela 15 – Dados espectroscópicos de BU–8 comparados com os dados
descritos na literatura (NOBAKHT et al., 2014) para (2S)- 3’,4’,5,7-tetrahidroxiflavanona (Eriodictiol)... 150 Tabela 16 – Dados espectroscópicos de BU–9 comparados com os dados
descritos na literatura (KHAMSAN et al., 2012) para a (2S )-4’,7-dihidroxiflavanona (Liquiritigenina)... 157 Tabela 17 – Dados espectroscópicos de BU–10 comparados com os dados
descritos na literatura (NEL et al., 1999) para o (2R,3S)-2,3-trans -4',7-dihidroxiflavana-3-ol... 166 Tabela 18 – Dados espectroscópicos de BU–11 comparados com os dados
descritos na literatura (IMAI et al., 2008) para (-)−fisetinidol... 175 Tabela 19 – Dados espectroscópicos de BU–12
(3,5-dimetoxi-4-metil-2’-hidroxibibenzil)... 184 Tabela 20 – Dados espectroscópicos de BU–13 comparados com os dados
descritos na literatura (TAKASUGI et al., 1987) para 3,5-dimetoxi-2’-hidroxibibenzil... 192 Tabela 21 – Valores de CI50 e intervalos de confiança 95% do OEBU e BU–12.. 198
Tabela 25 – Dados referentes ao tratamento cromatográfico da fração (16–35) do EHCPG ... 212 Tabela 26 – Dados referentes ao tratamento cromatográfico da fração (18–22)
do EHCPG... 213 Tabela 27 – Frações resultantes do fracionamento cromatográfico do
EECPG... 215 Tabela 28 – Dados referentes ao fracionamento cromatográfico da fração (12–
19) do EECPG... 216 Tabela 29 – Dados referentes ao fracionamento cromatográfico da fração (103–
137) do EECPG... 216 Tabela 30 – Dados referentes ao tratamento cromatográfico da fração (85–160)
do EECPG... 217 Tabela 31 – Dados referentes ao tratamento cromatográfico da fração (10–11)
do EECPG... 218 Tabela 32 – Dados referentes ao fracionamento cromatográfico da fração (138–
152) do EECPG... 219 Tabela 33 – Dados referentes ao tratamento cromatográfico da fração (277–
280) do EECPG... 219 Tabela 34 – Frações resultantes do fracionamento cromatográfico do
EHCCBU... 222 Tabela 35 – Dados referentes ao fracionamento cromatográfico da fração (1–4)
do EHCCBU... 223 Tabela 36 – Dados referentes ao tratamento cromatográfico da fração (5–20)
do EECCBU... 224 Tabela 37 – Dados referentes ao tratamento cromatográfico da fração (21–32)
do EHCCBU... 225 Tabela 38 – Dados referentes ao tratamento cromatográfico da fração (21–32)
do EHCCBU... 225 Tabela 39 – Frações resultantes do fracionamento cromatográfico do
do EECCBU... 228 Tabela 42 – Dados referentes ao fracionamento cromatográfico da fração (11–
14) do EECCBU... 229 Tabela 43 – Dados referentes ao fracionamento cromatográfico da fração (61–
135) do EECCBU... 230 Tabela 44 – Dados referentes ao fracionamento cromatográfico da fração (45–
79) do EECCBU... 230 Tabela 45 – Dados referentes ao tratamento cromatográfico da fração (66–117)
do EECCBU... 231 Tabela 46 – Dados referentes ao tratamento cromatográfico da fração (109–
117) do EECCBU... 232 Tabela 47 – Dados referentes ao fracionamento cromatográfico da
FNAEELCBU... 236 Tabela 48 – Dados referentes ao tratamento cromatográfico da fração (40–49)
da FNAEELCBU... 236 Tabela 49 – Dados referentes ao tratamento cromatográfico da fração (50–137)
da FNAEELCBU... 237 Tabela 50 – Dados referentes ao tratamento cromatográfico da fração (145–
205) da FNAEELCBU... 238 Tabela 51 – Dados referentes ao fracionamento cromatográfico da
FNAEERBU... 242 Tabela 52 – Dados referentes ao fracionamento cromatográfico da fração (1–
11) da FNAEERBU... 243 Tabela 53 – Dados referentes ao tratamento cromatográfico da fração (131–
141) da FNAEERBU... 243 Tabela 54 – Dados referentes ao tratamento cromatográfico da fração (141–
Fluxograma 01 – Método de extração dos óleos essenciais de B. ungulata... 207 Fluxograma 02 – Obtenção dos extratos hexânico e etanólico dos caules de
Phanera glabra... 209 Fluxograma 03 – Fracionamento cromatográfico do extrato hexânico dos caules
de Phanera glabra e isolamento de PG–1 e PG–2... 214 Fluxograma 04 – Fracionamento cromatográfico do extrato etanólico dos caules
de Phanera glabra eisolamento de PG–3, PG–4 e P–5... 220 Fluxograma 05 – Obtenção dos extratos hexânico e etanólico das cascas e do
lenho dos cales de Bauhinia ungulata... 221 Fluxograma 06 – Fracionamento cromatográfico do extrato hexânico das
cascas dos caules de Bauhinia ungulata e isolamento de BU–1, BU–2, BU–3, BU–4 e BU–5... 226 Fluxograma 07 – Fracionamento cromatográfico do extrato etanólico das
cascas dos caules de Bauhinia ungulata e isolamento de BU–6, BU–7 e BU–8... 233 Fluxograma 08 – Obtenção das frações alcaloídica (FA) e não alcaloídica
(FNA) do extrato etanólico do lenho dos caules de Bauhinia ungulata... 235 Fluxograma 09 – Fracionamento cromatográfico da fração não alcaloídica
(FNA) do extrato etanólico do lenho dos caules de Bauhinia ungulata e isolamento de BU–9, BU–10 e BU–11... 239 Fluxograma 10 – Obtenção dos extratos hexânico e etanólico das raízes de
Bauhinia ungulata... 240 Fluxograma 11 – Obtenção das frações alcaloídica (FA) e não alcaloídica
(FNA) do extrato etanólico das raízes de Bauhinia ungulata... 241 Fluxograma 12 – Fracionamento cromatográfico da fração não alcaloídica
1 INTRODUÇÃO... 28 1.1 DOENÇAS TRANSMITIDAS PELO Aedes aegypti... 30
1.2 ATIVIDADE LARVICIDA SOBRE Aedes aegypti... 31
1.3 ATIVIDADE CITOTÓXICA... 32 2 CONSIDERAÇÕES BOTÂNICAS... 34 2.1 A FAMÍLIA FABACEAE... 34 2.1.1 A subfamília Caesalpiniodeae... 34
2.1.1.1 O gênero Phanera... 35
2.1.1.1.1 A espécie Phanera glabra (Jacq.) Vaz... 35
2.1.1.2 O gênero Bauhinia... 37
2.1.1.2.1 A espécie Bauhinia ungulata L...... 37 3 OJETIVOS... 40 3.1 OBJETIVO GERAL... 40 3.2 OBJETIVOS ESPECÍFICOS... 40 4 LEVANTAMENTO BIBLIOGRÁFICO... 42
4.1 LEVANTAMENTO BIBLIOGRÁFICO SOBRE OS
FLAVONOIDES ISOLADOS DE ESPÉCIES DO GÊNERO
BAUHINIA... 42
5 RESULTADOS E DISCUSSÃO... 59
5.1 IDENTIFICAÇÃO DOS CONSTITUINTES QUÍMICOS DO ÓLEO
ESSENCIAL DAS FOLHAS DE BAUHINIA UNGULATA... 59
5.2 DETERMINAÇÃO ESTRUTURAL DOS CONSTITUINTES
QUÍMICOS NÃO VOLÁTEIS ISOLADOS DOS EXTRATOS DE
P. GLABRA (PG) E B. UNGULATA (BU)... 68
5.2.1 Determinação estrutural dos triterpenos... 68
5.2.1.1 Determinação estrutural de PG–1... 68 5.2.1.2 Determinação estrutural de BU–1... 74 5.2.1.3 Determinação estrutural de BU–2... 80
5.2.3 Determinação estrutural do derivadooxepínico... 105
5.2.3.1 Determinação estrutural de BU–6... 105
5.2.4 Determinação estrutural dos flavonoides... 113
5.2.4.1 Determinação estrutural de PG–3... 113 5.2.4.2 Determinação estrutural de PG–4... 122 5.2.4.3 Determinação estrutural de PG–5... 130 5.2.4.4 Determinação estrutural de BU–7... 138 5.2.4.5 Determinação estrutural de BU–8... 147 5.2.4.6 Determinação estrutural de BU–9... 154 5.2.4.7 Determinação estrutural de BU–10... 162 5.2.4.8 Determinação estrutural de BU–11... 171
5.2.5 Determinação estrutural dos bibenzis... 180
5.2.5.1 Determinação estrutural de BU–12... 180 5.2.5.2 Determinação estrutural de BU–13... 189
5.3 ENSAIOS DE ATIVIDADES BIOLÓGICAS... 197 5.3.1 Avaliação da atividade citotóxica in vitro do OEBU e BU–12
frente a linhagens de células cancerígenas... 197 5.3.2 Avaliação da atividade larvicida do OEBU sobre do Aedes
aegypti... 199
6 PARTE EXPERIMENTAL... 202 6.1 MATERIAL VEGETAL... 202 6.2 MÉTODOS ANALÍTICOS... 202 6.2.1 Métodos cromatográficos... 202 6.2.2 Métodos físicos de análise orgânica... 203
6.2.2.1 Espectroscopia de absorção na região do infravermelho... 203 6.2.2.2 Espectroscopia de ressonância magnética nuclear (RMN)... 203 6.2.2.3 Espectrometria de massas... 204 6.2.2.4 Cromatografia gasosa acoplada à espectrometria de massas
B. UNGULATA... 206
6.3.1 Obtenção do óleo essencial das folhas de P. glabra e B. ungulata... 206
6.4 ATIVIDADES BIOLÓGICAS... 208 6.4.1 Avaliação da atividade citotóxica do OEBU e de BU-12 sobre
linhagens celulares tumorais... 208 6.4.2 Avaliação da atividade larvicida do OEBU sobre Aedes
aegypti... 208
6.5 ESTUDO DOS CONSTITUINTES FIXOS DE P. GLABRA E B. UNGULATA... 209
6.5.1 Obtenção dos extratos hexânico e etanólico dos caules de P. glabra... 209 6.5.1.1 Fracionamento cromatográfico do EHCPG... 210
6.5.1.1.1 Fracionamento cromatográfico da fração (1–17) do EHCPG... 210
6.5.1.1.1.1 Fracionamento cromatográfico da fração (9–24) do EHCPG... 211
6.5.1.1.1.1.1 Tratamento cromatográfico da fração (16–35) do EHCPG e
isolamento de PG–1... 212
4.3.1.1.2 Tratamento cromatográfico da fração (18–22) do EHCPG e
isolamento de PG–2... 212
6.5.1.2 Fracionamento cromatográfico do EECPG... 215
6.5.1.2.1 Fracionamento cromatográfico da fração (12–19) do
EECPG... 215
6.5.1.2.1.1 Fracionamento cromatográfico da fração (103–137) do
EECPG... 216
6.5.1.2.2.1.1 Tratamento cromatográfico da fração (85–160) do EECPG e isolamento de PG–3... 217
6.5.1.2.2 Tratamento cromatográfico da fração (10–11) do EECPG e
isolamento de PG–4... 217
lenho dos caules de B. ungulata... 221 6.5.2.1 Fracionamento cromatográfico do EHCCBU e isolamento de
BU–1 e BU–2... 222
6.5.2.1.1 Fracionamento cromatográfico da fração (1–4) do EHCCBU... 223
6.5.2.1.1.1 Tratamento cromatográfico da fração (5–20) do EHCCBU e
isolamento de BU–3... 223
6.5.2.1.1.2 Fracionamento cromatográfico da fração (21–32) do EHCCBU e
isolamento de BU–4... 224
6.5.2.1.2 Tratamento cromatográfico da fração (8–16) do EHCCBU e
isolamento de BU–5... 226
6.5.2.2 Fracionamento cromatográfico do EELCBU... 227
6.5.2.2.1 Fracionamento cromatográfico da fração (5–10) do EECCBU... 227
6.5.2.2.1.1 Tratamento cromatográfico da fração (80–120) do EECCBU e
isolamento de BU–6... 228
6.5.2.2.2 Fracionamento cromatográfico da fração (11–14) do EECCBU... 229
6.5.2.2.2.1 Fracionamento cromatográfico da fração (61–135) do EECCBU... 229
6.5.2.2.2.1.1 Fracionamento cromatográfico da fração (45–79) do EECCBU... 230
6.5.2.2.2.1.1.1 Tratamento cromatográfico da fração (66–117) do EECCBU e isolamento de BU–7... 231
6.5.2.2.2.1.2 Tratamento cromatográfico da fração (109–117) do EECCBU e isolamento de BU–8... 231
6.5.2.3 Obtenção das frações alcaloídica (FA) e não alcaloídica (FNA) do EELCBU... 234
6.5.2.3.1 Fracionamento cromatográfico da FNAEELCBU... 235
6.5.2.3.1.1 Tratamento cromatográfico da fração (40–49) da FNAEELCBU e
isolamento de BU–9... 236
6.5.2.3.1.2 Tratamento cromatográfico da fração (50–137) da FNAEELCBU
e isolamento de BU–10... 237
6.5.2.3.1.3 Tratamento cromatográfico da fração (145–205) da FNAEELCBU
(FNA) do EERBU... 240
6.5.3.1.1 Fracionamento cromatográfico da FNAEERBU... 241
6.5.3.1.1.1 Fracionamento cromatográfico da fração (1–11) da FNAEERBU.. 242
6.5.3.1.1.1.1 Tratamento cromatográfico da fração (131–141) da FNAEERBU
e isolamento de BU–12... 243
6.5.3.1.1.1.2 Tratamento cromatográfico da fração (142–158) da FNAEERBU
1 INTRODUÇÃO
A utilização de plantas na prevenção e no tratamento de doenças é considerada uma das mais antigas formas de prática medicinal da humanidade (OTTOBELLI et al., 2011). O uso destas, de maneira empírica, proporcionou sucessos e fracassos, sendo que, muitas vezes, umas curavam, outras matavam ou produziam efeitos colaterais severos (TOMAZZONI; NEGRELLE; CENTA, 2006).
No decorrer do tempo, as interrelações estabelecidas entre o ser humano e as plantas em diferentes ambientes inspiraram o surgimento da etnobotânica, uma ciência especializada no resgate das relações entre povos e plantas (FREITAS et al., 2012); enquanto, a investigação científica do uso popular de plantas com fins terapêuticos consistem em confirmar sua eficácia farmacológica e a ausência de toxicidade (BALBINO; DIAS, 2010).
Planta medicinal constitui todo e qualquer vegetal que possui, em um ou mais órgãos, substâncias que podem ser utilizadas com fins terapêuticos ou que sejam precursores de fármacos semissintéticos (VEIGA JUNIOR; PINTO; MACIEL, 2005). Estas podem ser transformadas em fitoterápicos, através do estudo de validação e o desenvolvimento deste processo conta com estudos botânicos, químicos e farmacológicos (PEREIRA; CARDOSO, 2012). Vale salientar que fitoterápico é o produto obtido de matéria-prima ativa vegetal, exceto substâncias isoladas, com finalidade profilática, curativa ou paliativa, incluindo medicamento fitoterápico e produto tradicional fitoterápico (BRASIL, 2014).
Os estudos químicos são realizados pela Química de Produtos Naturais, e consistem no processo de extração, fracionamento, isolamento e purificação dos constituintes ativos. Nas pesquisas com plantas medicinais utilizam-se os métodos cromatográficos e espectrométricos, bem como a introdução de bioensaios simples compatíveis com isolamentos biomonitorados (PUPO; GALLO; VIEIRA, 2007).
importância econômica nas indústrias farmacêutica, alimentícia e cosmética (TAIZ; ZEIGER, 2009; FURLAN, 1998).
No Brasil, propriedades biológicas de grande interesse medicinal têm sido reveladas em estudos com espécies vegetais pertencentes à família Fabaceae, as quais são adaptadas ao clima tropical (ANTUNES et al., 2001). Adicionalmente, a grande biodiversidade de espécies aumenta as chances de isolamento e identificação de metabólitos bioativos, os quais podem ser empregados como modelos para a síntese de grande número de fármacos.
Diversas espécies do gênero Bauhinia são utilizadas na medicina popular no tratamento de diversas enfermidades como diabetes, infecções, dor e inflamação. Estudos revelam para as plantas desse gênero diversas atividades tais como antitumoral, antipirética, antioxidante e antimalárica (CECHINEL FILHO, 2009). As propriedades biológicas de fitopreparações bem como de metabólitos secundários isolados de diferentes espécies de Bauhinia foram investigadas em numerosos experimentos in vivo e in vitro. Os resultados atestam que as suas propriedades terapêuticas são devidas à presença de várias classes de metabólitos secundários existentes na composição química de tais espécies, e mostram que estas atividades são atribuídas, principalmente, aos flavonoides (DA SILVA; CECHINEL FILHO, 2002; MALI; MAHAJAN; MEHTA, 2007).
A literatura relata o uso de Bauhinia ungulata L. por índios Tapebas no Ceará no tratamento da diabetes (MORAIS et al., 2005) e da diarréia (BIESKI et al., 2012). Outro trabalho investigou o potencial de inibição do extrato em hexano de suas flores sobre a enzima acetilcolinesterase no tratamento da doença de Alzheimer (SANTOS et al., 2011). No entanto, existem apenas dois estudos químicos com suas folhas, nos quais constam o isolamento de 12 flavonoides, 2 alcaloides e 1 inositol (MAIA NETO et al., 2008; PAULA, 2014).
também relataram a capacidade antioxidante do referido extrato (DOS SANTOS et al., 2011).
Tendo em vista que muitas plantas são por natureza tóxica para mosquitos, este trabalho propõe-se determinar a atividade larvicida do óleo essencial das folhas de B. ungulata sobre as larvas do A. aegypti.
1.2 DOENÇAS TRANSMITIDAS PELO Aedes aegypti
O Aedes aegypti transmite as arboviroses responsáveis pela dengue, Chikungunya, vírus Zika, febre amarela e malária (MARCONDES; XIMENES, 2016), doenças que introduzem obstáculos socioeconômicos aos países em desenvolvimento, particularmente das regiões tropicais (VIMALADEVI et al., 2012).
No Brasil, esse mosquito tem encontrado as condições ambientais favoráveis ao seu desenvolvimento e proliferação, devido à falta de saneamento básico na maioria das suas regiões (MINISTÉRIO DA SAÚDE, 2016). Vale salientar que o aumento da oferta de criadouros de larvas no processo de urbanização vem ocasionando explosões populacionais do Aedes aegypti, com consequente aumento dos casos de doenças transmitidas por este mosquito.
Recentemente, evidências apontam a associação do vírus Zika a doenças como microencefalia infantil e a síndrome de Guillain-Barré (CAMPOS; BANDEIRA; SARDI, 2015; WHO, 2016a; CAO-LORMEAU et al., 2016; CUGOLA et al., 2016). Este vírus, transmitido às pessoas através da picada de um mosquito infectado do gênero Aedes, principalmente o Aedes aegypti, é um arbovírus pertencente ao gênero Flavivirus (Família Flaviviridae). Este vírus chegou no Brasil e em outros países da América do Sul e da América Central em 2013 (FARIA et al., 2016). Vale salientar que mais de treze países nas Américas notificaram infecções esporádicas pelo vírus Zika, o que indica uma rápida expansão geográfica do vírus (WHO, 2016a).
A forma grave da doença, também conhecida como dengue hemorrágica, foi reconhecida pela primeira vez na década de 1950 durante as epidemias de dengue nas Filipinas e Tailândia. Hoje, a dengue grave afeta a maioria dos países asiáticos e latino-americanos e tornou-se uma das principais causas de hospitalização e morte entre crianças e adultos nestas regiões. Observando-se, portanto, que a incidência de dengue tem crescido dramaticamente em todo o mundo nas últimas décadas (WHO, 2016c).
1.3 ATIVIDADE LARVICIDA SOBRE Aedes aegypti
Atualmente, observa-se uma grande dificuldade em erradicar o Aedes aegypti em curto prazo, e, portanto, uma das maneiras de controlar as doenças transmitidas por este mosquito, consiste do controle do vetor. Para isso, existem vários métodos de controle, entretanto, um dos ideais, é o tratamento sistemático dos locais de reprodução através de larvicidas.
Na eliminação das larvas de A. aegypti são utilizados inseticidas sintéticos, tais como organofosforados, organoclorados, carbamatos e piretróides (WALIWITIYA; KENNEDY; LOWENBERGER, 2009). No entanto, problemas observados no uso de inseticidas e/ou larvicidas sintéticos consistem na falta de seletividade e na toxicidade em relação a outros organismos e ao meio ambiente. Como conseqüência do uso continuado desses inseticidas surgiram populações resistentes de A. aegypti (MELO-SANTOS et al., 2010; POLSON et al., 2011; SMITH; KASAI; SCOTT, 2016), implicando no aumento da dosagem destes, causando maiores danos ao meio ambiente, além de gerar outras doenças e prejuízos econômicos (MENDONÇA et al., 2005).
GOVINDARAJAN; RAJESWARY; BENELLI, 2016; OLIVEIRA et al., 2016), bem como constituintes químicos isolados de óleos essenciais (DIAS; MORAIS, 2014; DA SILVA et al., 2016a) e de extratos (GÓIS et al., 2013; BEZERRA-SILVA et al., 2015; KIM; LEE, 2016; DA SILVA et al., 2016b) no combate às larvas de A. aegypti.
Vale destacar que uma revisão publicada na literatura (DIAS; MORAIS, 2014) relata que mais de 60% de 361 óleos essenciais avaliados sobre larvas de
Aedes aegypti foram considerados ativos (CL50 < 100 µg/mL) e que os óleos
essenciais mais eficazes exibiram concentrações comparáveis com a dose recomendada para a utilização de temefos®, um composto organofosforado utilizado no controle do Aedes aegypti.
Diante da busca de métodos alternativos que visam diminuir impactos ambientais, os processos chamados de verde vêm surgindo como alternativa para diversos segmentos na comunidade científica. Dessa forma, nosso grupo de pesquisa tem demonstrado a eficácia de produtos naturais sobre larvas de Aedes aegypti de óleos essenciais, de compostos isolados de extratos (GOIS et al., 2011; GÓIS et al., 2013; MALCHER et al., 2014; DE SOUSA et al., 2016), com a perspectiva de incorporar recursos alternativos para o controle do A. aegypti.
1.3 ATIVIDADE CITOTÓXICA
O câncer é um problema de saúde pública, especialmente entre os países em desenvolvimento, onde é esperado que, nas próximas décadas, o impacto do câncer na população corresponda a 80% dos mais de 20 milhões de casos novos estimados para 2025 (INCA, 2016).
2 CONSIDERAÇÕES BOTÂNICAS
2.1 A FAMÍLIA FABACEAE
A família fabaceae constitui o terceiro maior grupo das angiospermas, com aproximadamente 751 gêneros e 19.500 espécies. É dividida em três subfamílias: Caesalpinoideae, Faboideae e Mimosideae e apresenta distribuição cosmopolita, podendo ser encontrada em praticamente todos os ambientes terrestres, com exceção das regiões polares (LPWG, 2013).
No Brasil é considerada a maior família botânica, com 2.100 espécies e 188 gêneros, dos quais 31 são endêmicos, estando representada em todos os biomas brasileiros (LIMA et al., 2010). Nos ecossistemas brasileiros, as espécies dessa família são representativas em diversidade e densidade, além de terem grande importância econômica e ecológica.
2.1.1 A subfamília Caesalpinoideae
A subfamília Caesalpinoideae compreende 171 gêneros e 2.250 espécies, de ocorrência, principalmente, nas regiões tropicais e subtropicais da América do Sul, África e Sudeste Asiático. As espécies desta subfamília ocorrem como árvores, algumas extremamente grandes, bem como lianas e arbustos. Dentre as subfamílias da família Fabaceae, a Caesalpinoideae é a menos estudada e entendida, sendo considerada a mais primitiva (LPWG, 2013).
Um grande número de espécies florestais nativas faz parte dessa subfamília. Muitas delas são utilizadas como ornamentais e na arborização urbana; outras são utilizadas na medicina popular; na recuperação de áreas degradadas; muitas possuem madeira de elevada importância econômica; espécies que propiciam relações ecológicas inquestionáveis nos mais diversos ecossistemas (BIONDO; MIOTTO; WITTMANN, 2005).
2.1.1.1 O gênero Phanera
Phanera Lour. é um gênero formado por 80 a 90 espécies distribuídas no Novo Mundo, sul da Ásia e Malásia (MACKINDER; CLARK, 2014). As espécies deste gênero consistem de lianas de ramos com gavinhas, possuindo, geralmente, folhas lobadas com nervação palmatinérvea (VAZ; BORTOLUZZI; SILVA, 2010). No Brasil, em especial, este gênero ocorre em biomas tão diversos, tais como florestas tropicais, com alto teor de umidade, assim como, em áreas de seca como a caatinga. Vale salientar que a similaridade nas características morfológicas das espécies deste gênero com as das espécies do gênero Bauhinia têm sido objeto de exaustivas reclassificações taxonômicas (VAZ, 2010).
2.1.1.1.1 A espécie Phanera glabra (Jacq.) Vaz
Phanera glabra (Jacq.) Vaz, classificada anteriormente como Bauhinia glabra, é uma espécie de trepadeira lenhosa nativa da bacia do rio Parnaíba, conhecida popularmente como “cipó-de-escada”, devido às curvas alternadas de seus caules simularem os degraus de escada (BATISTA et al., 1999). Seus ramos entrelaçam-se em outras árvores, usando-as como suporte, podendo, desta forma, atingir vários metros de comprimento.
Figura 01 – Folhas e caules de Phanera glabra (Jacq.) Vaz
2.1.1.2 O gênero Bauhinia
As plantas pertencentes ao gênero Bauhinia são encontradas nas áreas tropicais do planeta, compreendendo aproximadamente 300 a 350 espécies (FARAG
et al., 2015). Consistem de árvores e arbustos de ramos sem gavinhas que possuem em geral folhas lobadas com nervação palmatinérvea (VAZ; BORTOLUZZI; SILVA, 2010). Devido ao formato de suas folhas, muitas espécies deste gênero são conhecidas popularmente como “pata-de-vaca” ou “unha-de-vaca” (ACHENBACH; STOCKER; CONSTELA, 1988).
2.1.1.2.1 A espécie Bauhinia ungulata L.
Bauhinia ungulata L. apresenta-se como subarbusto, arbusto ou arvoreta que pode variar entre 2 a 4 metros de altura (DUTRA et al., 2009), sendo conhecida popularmente como “pata-de-vaca” e também por “mororó” (MORAIS et al., 2005). Apresenta grande espectro de distribuição, ocorrendo na faixa neotropical, desde o México até a Amazônia periférica e corredor seco até 23° de latitude Sul (MAIA NETO, 2006). Essa é uma das espécies nativas do Brasil, encontrada em todas as regiões com domínios fitogeográficos principalmente na Amazônia, Mata Atlântica e Cerrado (VAZ, 2014).
Figura 02 – Folhas e caules de Bauhinia ungulata L.
3 OBJETIVOS
3.1 OBJETIVO GERAL
Contribuir para o conhecimento químico e biológico das espécies Phanera glabra
e Bauhinia ungulata.
3.2 OBJETIVOS ESPECÍFICOS
Extrair o óleo essencial das folhas de Bauhinia ungulata;
Identificar e quantificar os constituintes químicos do óleo essencial; Preparar os extratos hexânico e etanólico dos caules de Phanera glabra;
Preparar os extratos hexânico e etanólico dos caules e das raízes de Bauhinia ungulata;
Isolar e purificar, através de técnicas cromatográficas, os constituintes químicos dos extratos preparados de Phanera glabra e de Bauhinia ungulata;
Determinar a estrutura dos compostos isolados através de técnicas espectroscópicas e espectrométricas tais como IV, EM, RMN 1H e 13C;
Avaliar a atividade citotóxica do óleo essencial sobre as linhagens tumorais humanas HL-60 (leucemia pró-mielocítica), HEP-2 (adenocarcinoma cervical), NCI-H292 (carcinoma de pulmão) e MCF-7 (adenocarcinoma de mama), utilizando-se o teste do MTT;
4 LEVANTAMENTO BIBLIOGRÁFICO
4.1 LEVANTAMENTO BIBLIOGRÁFICO SOBRE OS FLAVONOIDES ISOLADOS DE ESPÉCIES DO GÊNERO BAUHINIA
Levantamento bibliográfico realizado no Scifinder Scholar®, abrangendo
os artigos publicados do período de 2009 até fevereiro de 2016, revelou registros de estudos químicos de 15 espécies do gênero Bauhinia. Embora muitos compostos, incluindo alcaloides, lactonas, terpenoides, esteroides, taninos, quinonas, etc, tenham sido isolados e identificados nestas espécies, no entanto, os flavonoides são os mais frequentemente isolados (DOS SANTOS; RIEDER, 2013).
Vale ressaltar que apesar de um grande número de metabólitos secundários já ter sido isolado e identificado em espécies deste gênero e que pouco se conhece sobre a atividade farmacológica e/ou biológica da maioria das substâncias isoladas (CECHINEL FILHO, 2009), alguns estudos disponíveis na literatura relatam que algumas propriedades dessas espécies são atribuídas aos flavonoides, dentre elas pode-se destacar as atividades antioxidante e hipoglicemiante (DOS SANTOS et al., 2014).
Desta forma, visando adquirir um banco de dados atualizado que possa ser utilizado em futuras determinações estruturais de outros flavonoides, foi destacada apenas esta classe de compostos neste levantamento bibliográfico. Observando-se, portanto, que as espécies deste gênero são caracterizadas pela presença de flavonoides livres e glicosilados (Tab. 01, p. 43).
Nesse levantamento bibliográfico, foi possível observar que alguns flavonoides livres e/ou glicosilados são bastante comuns entre as espécies de
Bauhinia estudadas. Dentre os flavonoides livres foram constatados o isolamento da quercetina (3) em doze espécies e do canferol (5) em seis espécies. Adicionalmente, entre os flavonoides glicosilados a rutina (12) foi isolada em sete espécies de
Bauhinia.
similar não foram encontrados na literatura nenhum relato sobre estudo químico de espécies pertencentes ao gênero Phanera.
Tabela 01 – Estruturas dos flavonoides isolados de espécies do gênero Bauhinia
O OH OH OH OH HO 1 O OH R2 R1 OH HO O
2 R1 = OH; R2 = OCH3
3 R1 = OH; R2 = OH
4 R1 = H; R2 = OH
5 R1 = OH; R2 = H
6 R1 = H; R2 = OCH3
O OH OH HO O OH O O HO OH OH 7 O OH OH HO O OH O OH O
H3C OH
OH OH 8 O OH OH HO O OH OCH3 9 O OCH3 OCH3
H3CO
O
OCH3
OCH3
O
OCH3
H3CO
O
OCH3
H3CO
O O 11 O OH HO O OH O OH O O OH OH OH O HO H3C
OH OH 12 O OH HO O O OH O O OH OH OH O HO H3C
O OH HO O OH O O
H3C
OH OH OH 17 O OH HO OH OH OH 18 O OH HO OH O OH 19 O OH HO O O O
H3C
OH OH OH 20 O OH O O O O OH OH OH OH O O OH OH HO
H3C
O OH CH3 HO HO 21 O OH O O O O
H3C
O OH O O O O
H3C
OH OH OH OH O OH CH3 HO HO OH 23 O OH HO O O O OH O OH OH OH O O HO OH HO O OH OH OH 24 O OH HO O O OH R O
O CH3
HO OH
O H3C
HO
OH
OH
25 R = OH 26 R = H
O OH HO O O OH OH O OH OH HO 27 O OCH3
H3CO
O
OCH3 OCH3
H3CO
OCH3
O
OCH3
H3CO
O H3CO
O O OH HO O OH OH O HO OH OH OH 36 O O OH HO O OH OH O
H3C
O O OH HO O OH O OH OH OH OCH3 O O HO OH OH H3C
42 O O OH HO O OH O OH CH3 HO 43 O O OH HO O OH O O O OH OH OH OH OH HO
H3C
O OH HO OH OCH3 O 48 O OH HO OH O 49 O OH O OH O O O O OH OH HO HO OH R OH O O H3C
HO
OH
OH HO
50 R = OH 51 R = H 52 R = OCH3
O OH O OH O O O O OH OH HO HO OH OH OH O O HO OH OH HO HO 53 O OH 54 O OH O OH OH H3CO
O
OCH3
O OH H3CO
H3CO
OH 56 O O OH HO 57 O O OH O O OH OH HO HO 58 O O OH HO OH OH O O OH O OH OH O HO HO OH 59 O O OH HO OH OH O O OH O OH OH O HO HO OH 60 O O OH HO OH OCH3 OCH3 R1
61 R1 = H
62 R1 = OCH3
O
O
OCH3
OCH3 H3CO
65 O O OH OH HO OCH3 66 O O OH OH HO CH3
H3C
67
O
O
H3C
OH HO OH OCH3 68 O O HO CH3
H3C
OH O O OH OH OH OH
H3C
O O HO OH OCH3 OH CH3
H3C
71 O O HO OH OH OH OH 72 OH OH OH O O O OH
H3CO
OH O O H H 73 OH OH OH O CH3 O O R2 HO OH O R1
74 R1 = OCH3; R2 = OH
75 R1 = R2 = OH
O O
OH OH
H3CO
O O OH HO O O OH O OH OCH3 O HO O OH O OH OH OH H3C
OH 78 O O HO OH OCH3 79 O O HO OH OH OH O OH OH HO HO 80 O O HO OH OH OH OH O OH OH HO HO 81 O O OH HO O OH OH O OH OH OH H3C
O OH
O OCH3
O OH HO OH HO 84 O O OH HO OH OH O O OH OH OH
H3C
85
O
O
CH3 OCH3
H3CO
OCH3 OCH3 OCH3 86 O OH HO OH O 87 O O OH HO O OH OH OH O O O HO O HO HO OH CH3 O OH OH OH H3C
O OH
HO
R2 R1
90 R1 = R2 = OH
91 R1 = R2 = H
92 R1 = H; R2 = OCH3
O
R1
H3CO
93 R1 = OH
94 R1 = OCH3
O
H3CO OH
OH OH
95
O
H3CO OH
OCH3
96
O O
OCH3 OH
OH
HO
HO
97
O HO
OCH3
O
O
OH OH
HO
HO
Tabela 02 – Flavonoides isolados de espécies do gênero Bauhinia
ESPÉCIES FLAVONOIDES REFERÊNCIAS
B. aurea 88; 89 (SHANG et al., 2012)
57; 58; 59; 60 (SHANG et al., 2009)
B. brachycarpa 10; 11; 27; 28; 29 (ZHANG et al., 2012)
B. championii
10; 11 (ZHAO et al., 2014)
8; 85; 86; 87 (XU et al., 2013) 3; 5; 8 (XU et al., 2012) 3; 28; 46; 64 (XU et al., 2009a)
B. forficata
12; 13 (FARIAS; MENDEZ, 2014)
21; 22; 23 (SAYAGO et al., 2013) 12; 13; 25; 26 (SALGUEIRO et al., 2013) 3; 7; 12; 13; 17; 23; 31; 36; 37;
38; 39; 40; 41; 42; 43; 44; 45 (FERRERES et al., 2012)
B. glauca
1; 2; 3; 4; 5; 6; 7; 8; 9; 10 (TANG et al., 2014) 30; 83; 84 (BAIMING et al., 2012a) 4; 32; 33; 34; 35 (BAIMING et al., 2012b)
84 (ZHAO et al., 2011)
83; 90; 91; 92; 93; 94; 95 (WU et al., 2009a) 66; 67; 68; 96; 97; 98 (WU et al., 2009b)
B. malabarica 3; 69; 70; 71 (PARK et al., 2014)
B. microstachya 17; 24 (MANSUR et al., 2012)
B. monandra 3; 12; 31 (ALADE et al.,2012)
B. racemosa 78; 79; 80; 81 (YADAVA; CHAKRAVART, 2014)
18; 46; 47 (SASHIDHARA et al., 2012)
B. retusa
72; 73; 74; 75; 76; 77 (SAYED; HASSAN; ATEYA, 2015)
54 (SEMWAL; SHARMA, 2011)
23; 39; 50; 51; 52; 53 (YADAV; VERMA, 2010)
B. rufescens 3; 5; 12; 36; 37 (COMPAORE et al., 2012)
B. strychnifolia 19; 20 (YUENYONGSAWAD et al.,2013)
3; 20; 82 (BUNLUEPUECH et al., 2013)
B. tomantosa 3; 12; 48; 49 (JAIN et al., 2011)
B. tomentosa
Linn (FBBT) 32; 33; 34; 35 (RADHA; VASANTHA; PITCHUMANI, 2016)
B. variegata
3; 5 (JASH; ROY; GORAI, 2014)
3 (GUPTA et al., 2013)
5; 14; 15; 16; 17; 18; 83 (LIAO; LI, 2013) 21; 22; 23 (SAYAGO et al., 2013)
3 (KUMARI; KUMAR; YADAV, 2012)
5; 12 (MODH et al., 2011)
55; 56 (BODAKHE et al., , 2010)
5 RESULTADOS E DISCUSSÃO
5.1. IDENTIFICAÇÃO DOS CONSTITUINTES QUÍMICOS DO ÓLEO ESSENCIAL
DAS FOLHAS DE BAUHINIA UNGULATA
O estudo da composição química do óleo essencial das folhas de
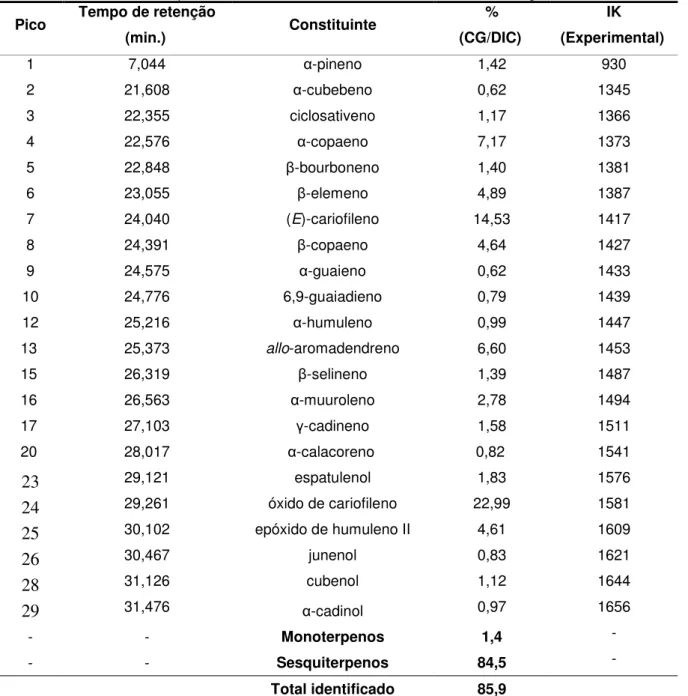
Bauhinia ungulata (OEBU) foi realizado por cromatografia gasosa acoplada à espectrometria de massas (CG/EM) na análise qualitativa e por cromatografia gasosa acoplada a detector de ionização por chama (CG/DIC) na análise quantitativa. Os cromatogramas obtidos por ambas as técnicas são mostrados nas Figuras 03 e 04, respectivamente.
Figura 03 – Cromatograma de OEBU obtido por CG/EM
5.0 10.0 15.0 20.0 25.0 30.0 35.0 40.0 45.0 50.0
0.25 0.50 0.75 1.00 1.25 1.50 1.75 2.00 2.25 2.50 2.75 (x1,000,000) TIC 1 2 3 4 5 6 7 8 9 10 11 12 13 14
15161718
19 20 21 22 23 24 25
262728
29
30 31
Figura 04 – Cromatograma de OEBU obtido por CG/DIC
5.0 10.0 15.0 20.0 25.0 30.0 35.0 40.0 45.0 50.0 min
Os constituintes químicos do óleo essencial de Bauhinia ungulata (OEBU) foram identificados através da comparação de seus respectivos espectros de massas com espectros registrados na literatura (ADAMS, 2007), com espectros do banco de dados (NIST 21, NIST 107 e Willey 8) do equipamento e, também, pela comparação dos índices de retenção com aqueles da literatura. Os índices de retenção de Kovats (IK) foram determinados utilizando uma série homologa de n -alcanos (C8-C18) injetados nas mesmas condições cromatográficas da amostra,
utilizando a equação de Van den Dool e Kratz (VAN DEN DOOL; KRATZ, 1963). Essa análise possibilitou a identificação de 22 constituintes nesse óleo essencial, representando 85,9% da composição total. Óxido de cariofileno (22,99%), (E )-cariofileno (14,53%) e α-copaeno (7,17%) foram os constituintes químicos predominantes neste óleo essencial. Os sesquiterpenos (84,5%) são os constituintes predominantes na composição química desse óleo (Tab. 03, p. 61).
A predominância de sesquiterpenos no OEBU está de acordo com dados descritos na literatura sobre a composição dos óleos essenciais das folhas de B. aculeata, B. brevipes, B. longifolia, B. pentandra, B. rufa, B. variegata, B. forficata, B.
ungulata e B. acuruana (DUARTE-ALMEIDA; NEGRI; SALATINO, 2004;
SARTORELLI; CORREA, 2007; GRAMOSA et al., 2009; GOIS et al., 2011). Parecendo, portanto, que a ocorrência de sesquiterpenos como constituintes predominantes nos óleos de folhas de espécies de Bauhinia é uma característica química deste gênero.
Tabela 03 – Constituintes químicos do óleo essencial das folhas de Bauhinia ungulata
Pico Tempo de retenção
(min.) Constituinte
% (CG/DIC)
IK (Experimental)
1 7,044 α-pineno 1,42 930
2 21,608 α-cubebeno 0,62 1345
3 22,355 ciclosativeno 1,17 1366
4 22,576 α-copaeno 7,17 1373
5 22,848 β-bourboneno 1,40 1381
6 23,055 β-elemeno 4,89 1387
7 24,040 (E)-cariofileno 14,53 1417
8 24,391 β-copaeno 4,64 1427
9 24,575 α-guaieno 0,62 1433
10 24,776 6,9-guaiadieno 0,79 1439
12 25,216 α-humuleno 0,99 1447
13 25,373 allo-aromadendreno 6,60 1453
15 26,319 β-selineno 1,39 1487
16 26,563 α-muuroleno 2,78 1494
17 27,103 γ-cadineno 1,58 1511
20 28,017 α-calacoreno 0,82 1541
23 29,121 espatulenol 1,83 1576
24 29,261 óxido de cariofileno 22,99 1581
25 30,102 epóxido de humuleno II 4,61 1609
26 30,467 junenol 0,83 1621
28 31,126 cubenol 1,12 1644
29 31,476 α-cadinol 0,97 1656
- - Monoterpenos 1,4 -
- - Sesquiterpenos 84,5 -
Total identificado 85,9
Figura 05 – Espectro de massas do α-pineno
50 100 150 200 250 300 350 400 450 500 550 0.0 25.0 50.0 75.0 100.0 % 40 93 44 121 558 191
Figura 06 – Espectro de massas do α-cubebeno
50.0 75.0 100.0 125.0 150.0
0.0 25.0 50.0 75.0 100.0 % 40 105 119 161 91 81 55 79 67 51 134 155 128
Figura 07 – Espectro de massas do ciclosativeno
50 100 150 200 250 300 350 400
0.0 25.0 50.0 75.0 100.0 % 40 105 77 161 55 119 204 136 410 302
Figura 08 – Espectro de massas do α-copaeno
Figura 09 – Espectro de massas do β-bourboneno
50.0 75.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 0.0 25.0 50.0 75.0 100.0 % 81 123 41 91 53 161 105 67
133 146 189 250
Figura 10 – Espectro de massas do β-elemeno
50 100 150 200 250 300 350 400 450 0.0 25.0 50.0 75.0 100.0 % 41 67 81 107 121 147 189
175 267 455
Figura 11 – Espectro de massas do (E)-cariofileno
50.0 75.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 0.0 25.0 50.0 75.0 100.0 % 41 69 93 79
55 105 133
119 148 161
189
175 204 250
Figura 12 – Espectro de massas do β-copaeno
Figura 13 – Espectro de massas do α-guaieno
50.0 75.0 100.0 125.0 150.0 175.0 200.0 0.0 25.0 50.0 75.0 100.0 % 40 44
65 81 91
55 105 120 132 148 161
205
Figura 14 – Espectro de massas do 6,9-guaiadieno
50.0 75.0 100.0 125.0 150.0 175.0 200.0 225.0 250.0 275.0 0.0 25.0 50.0 75.0 100.0 % 40 105 91 67
55 79 119 161
147
133 189 204 281
Figura 15 – Espectro de massas do α-humuleno
50.0 75.0 100.0 125.0 150.0 175.0 200.0 0.0 25.0 50.0 75.0 100.0 % 93 41 80 79
53 67 121
107 147
105 44
136 161 178 189 204
Figura 16 – Espectro de massas da allo-aromadendreno
50.0 75.0 100.0 % 41 91 55 67 79
105
H H