Universidade de Trás-os-Montes e Alto Douro
Dissertação de Mestrado Integrado em Medicina Veterinária
Análise da imunoexpressão de marcadores de
multiresistência a fármacos em oncologia
Pedro Luis Teles de Carvalho
Orientadora: Professora Felisbina Luísa Pereira Guedes Queiroga Co-orientador: Professor Bruno Cogliatti
i
Universidade de Trás-os-Montes e Alto Douro
Dissertação de Mestrado Integrado em Medicina Veterinária
Análise da imunoexpressão de marcadores de
multiresistência a fármacos em oncologia
Pedro Luis Teles de Carvalho
Orientadora: Professora Felisbina Luisa Queiroga Co-orientador: Professor Bruno Cogliatti
ii
Declaração
Nome: Pedro Luis Teles de Carvalho
C.C: 13640424
Telemóvel: (+351) 934601209
Correio eletrónico: pedrotelesdecarvalho@gmail.com
Designação do mestrado: Mestrado Integrado em Medicina Veterinária
Título da dissertação de mestrado em medicina veterinária: Análise da
imunoexpressão de marcadores de Multiresistência a Fármacos em oncologia
Orientador: Professora Doutora Felisbina Luisa Queiroga
Ano de conclusão: 2017
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e da orientação do meu supervisor. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
iii
Agradecimentos
Vejo neste particular pedaço de papel uma oportunidade de deixar uma marca genuína e uma oportunidade de reconhecer pequenas personalidades que fizeram a diferença num trajeto de vida de um jovem que, com os seus 18 anos, chegou a uma fria e nobre cidade por “trás de uns montes”, uma humilde cidade que dá pelo nome de Vila Real.
Vila Real mudou muita coisa na minha vida e, como tal, a ela dedico não o principal, mas sim o meu primeiro agradecimento, pois aqui descobri grande parte de mim e o que realmente desejo, e encontrei muitos daqueles que fizeram parte dessa transformação.
Não poderei, obviamente, deixar de referir as duas pessoas que mais contribuíram para tudo o que sou. Duas pessoas a quem sempre estarei profundamente agradecido por me terem mostrado como o importante não são conquistar coisas, títulos ou reconhecimentos, mas sim descobrir o que importa para nós ou, dito de outra forma, descobrir o que somos e do que precisamos verdadeiramente. Por isso, aos meus pais quero agradecer pelo seu contributo na realização deste trabalho e também pela pessoa que sou, por me ensinarem a seguir aquilo em que acredito.
Depois, há ainda aquelas três pessoas particularmente importantes, que creio nem necessitar de nomear para saberem da sua importância. Elas são parte do que eu sou, e creio que provavelmente sempre o serão, isto porque talvez eu precise de um pouco de cada um deles na minha vida. A todos eles um genuíno e humilde obrigado xD.
Não poderei obviamente deixar de agradecer ao Professor Bruno Cogliatti e à Veronica Govoni por toda a ajuda que disponibilizaram na realização desta dissertação, pois que, com toda a certeza, sem o seu apoio nada disto seria possível.
Por último, um especial obrigado à Professora Felisbina Queiroga pelo apoio essencial na realização desta disseratação, tendo-me ajudado a descortinar um pouco do mundo da investigação e a experienciar o quão fascinante pode ser todo o trabalho que ainda há por fazer pela ciência: Nem tudo é feito de grandes descobertas, pois, por vezes, uma pequena molécula pode fazer a diferença na vida de muitos animais e pessoas.
iv
Resumo
Ainda muito pouca informação existe no que diz respeito aos processos de resistência à quimioterapia em medicina veterinária, e principalmente em gatas, sendo que os tumores mamários estão entre os tumores mais comuns e mais imprevisíveis ao tratamento e poderão fornecer-nos dados oncológicos de grande importância, principalmente no que diz respeito aos processos de resistência à quimioterapia e aos fatores de prognóstico, devido à sua heterogeneidade dentro do processo de carcinogénese. Como tal, o objetivo deste estudo foi precisamente analisar as características clinocopatológicas e imunoexpressão de proteínas frequentemente associadas a processos de multiresistência à quimioterapia e para isso recorremos à imunohistoquímica de forma a quantificar a expressão das proteínas glicoproteína P, LRP (em inglês Lung Resistance Protein), Metalotioneína e BCRP (em inglês breast cancer resistance protein) em 24 amostras de tumores mamários de gata.
Os resultados deste estudo revelaram que a maioria das gatas (76,7%) eram Europeus comuns, e as restantes 23,3% pertenciam à raça siamesa. A média de idades em que foi diagnosticado o tumor de mama foi aos 11 anos, com uma média de 1,33 tumores por animal. Em todos os tumores analisados foi detetada expressão de pelo menos um dos marcadores (100%), e em 33,3 % dos tumores foi detetada expressão dos 4 marcadores analisados simultaneamente. Foram encontradas relações estatisticamente significativas entre a expressão da glicoproteína P e o tipo histológico (p=0,019), onde detetámos que os carcinomas sólidos e criviformes estão geralmente associados a maiores scores de expressão desta proteína. Encontrámos também associação entre a expressão da LRP e o índice mitótico (p <0,001) e entre a expressão da BCRP e a presença de ulceração (p=0,026), contudo não foi encontrada relação com o grau de malignidade ou estadiamento tumoral em qualquer um dos marcadores. Em síntese, com base nos nossos resultados podemos supor que a expressão destes marcadores não será uma boa ferramenta de avaliação prognóstica do animal nos tumores mamários felinos, contudo, a sua elevada prevalência nos tumores mamários analisados leva-nos a pensar que estes poderão estar de certa forma envolvidos em fenómeleva-nos de resistência a fármacos, fenómenos provavelmente responsáveis pela grande imprevisibilidade de resposta destes tumores à quimioterapia.
v
Abstract
Veterinary and human medicine still have many questions to answer in the scope of one of the main problems in chemotherapy: Multidrug resistance. The relevance of mammary carcinomas in feline medicine relies on the fact that they are not only one of the most common tumours but also unpredictable to treatment and can therefore be a perfect comparative model for the study of this kind of problems.
Hence, the aim of this study was the analysis of the histopathological and immunohistochemical characterization of feline mammary tumours. Twenty four mammary gland tumours were enrolled in the present study with clinicopathological and immunohistochemical assessments using four different proteíns (glycoprotein P, LRP, BCRP and Metallothionein). Then we proceeded with statistical analyses in order to evaluate possible associations between the clinicopathological variables and proteins expression to understand their role as prognostic factors.
The majority of neoplasias were found in European shorthair cats with an average age of 11 years.
In all the analysed tumours we found protein expression from at least one protein, and we also found a high percentage of tumours with inequivocal expression from each protein enrolled in this work. Following statistical analyses of results with regard to immunohistochemistry there were statistically significant differences between Glycoprotein P, LRP and BCRP expression and some clinicopathological factors. However we could´t find an association between these protein expressions and useful prognostic factors.
In short, we assume that these protein expressions are not related with the prognosis in gland mammary feline tumours, however, their high prevalence makes us think that these proteins could somehow be enrolled in the multiresistance phenotype responsible for the unpredictability response of these tumours to chemotherapy.
vi
Índice Geral
Agradecimentos ……….………….iii Resumo………...……….…….…iv Abstract……….. v Ìndice de Figuras………..….viii Índice de Quadros………...……... ix Índice de gráficos……….……xi Siglas e Abreviaturas………..………xiiCapítulo I - Revisão Bibliográfica ... 1
1. Resistência a Fármacos... 1
2. A Problemática da Multiresistência nos Tumores de mama de gata ... 2
3. Proteínas de Multiresistência a Fármacos ... 5
3.1 Glicoproteína P ... 6
3.2 BCRP - Breast cancer resistance protein ... 7
3.3 LRP – Lung resistance Protein ... 10
3.4 Metalotioneína ... 11
Capítulo II - Objetivos ... 14
Capítulo III - Material e Métodos ... 15
1. Material……… ... 15
2. Análise das variáveis clínico-patológicas ... 15
3. Análise histopatológica ... 15
3.1 Grau histológico ... 16
3.2 Estadiamento ... 17
4. Análise imuno-histoquímica ... 18
4.1 Procedimento ... 18
4.2 Métodos de quantificação da imunoreacção ... 19
5. Análise Estatística ... 22
Capítulo IV – Resultados ... 23
6. Análise descritiva da amostra em estudo ... 23
vii
6.2 Características Histológicas ... 25
7. Avaliação Imuno-histoquímica ... 27
8. Associações estatísticas entre marcadores moleculares e as ... - 31 -
características clínico-patológicas em estudo ... - 31 -
8.1 Glicoproteína P ... - 31 - 8.2 LRP ... - 34 - 8.3 Metalotioneína ... - 37 - 8.4 BCRP ... - 40 - Capítulo V - Discussão ... - 43 - Capítulo VI - Conclusão ... - 58 -
viii
Índice de Figuras
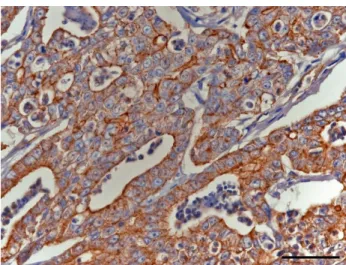
Figura 1) Imunorreactividade para a Glicoproteína P avaliado num carcinoma cribriforme
(Estalão=50μm)……….…….……29
Figura 2) Imunorreactividade para a LRP avaliado num carcinoma sólido (Estalão=50μm)………..29 Figura 3) Imunorreactividade para a Metalotioneína avaliado num carcinoma in situ
(Estalão=50μm)...29
Figura 4) Imunorreactividade para a BCRP avaliado num carcinoma em tumor benigno
ix
Índice de Quadros
Quadro 1) Avaliação do grau histológico de malignidade segundo Elston e Ellis (1991).……….17
Quadro 2) Estadio TNM……….…………..……….17
Quadro 3) Caracterização dos anticorpos primários utilizados………....………19
Quadro 4) Score semiquantitativo da imunoreacção para a Glicoproteína P………..………….20
Quadro 5) Score semiquantitativo da imunoreacção para a LRP……….……….………21
Quadro 6) Score semiquantitativo da imunoreacção para a Metalotioneína………..………..21
Quadro 7) Score semiquantitativo da imunoreacção para a BCRP……….………….22
Quadro 8) Análise descritiva das variáveis clínicas (frequências relativas e absolutas).…..……….24
Quadro 9) Classificação histológica das neoplasias mamárias analisadas………..….25
Quadro 10) Análise descritiva dos parâmetros histopatológicos…….……….…….……..………..26
Quadro 11) Análise descritiva dos Scores de imunoreatividade da Glicoproteína P, LRP, Metalotioneína e BCRP………27
Quadro 12) Descrição da imunoexpressão da Glicoproteína P, LRP, BCRP e Mealotioneína nas 24 amostras………...………....………..28
Quadro 13) Associação entre % de células marcadas e Intensidade da marcação para a glicoproteína P……….…………...31
Quadro 14) Associação entre a expressão da glicoproteína P e os parâmetros clinico- patológicos………..………...32
Quadro 15) Associação entre a expressão da glicoproteína P e os parâmetros histológicos………33
Quadro 16) Associação entre % de células marcadas e Intensidade da marcação para a LRP ……34
Quadro 17) Associação entre a imunomarcação para LRP e os parâmetros clinico-patológicos …35 Quadro 18) Associação entre a imunomarcação para LRP e os parâmetros histológicos…………36
Quadro 19) Associação entre % de células marcadas e Intensidade da marcação para a Metalotioneina ...37
Quadro 20) Associação entre a imunomarcação para a Metalotioneina e os parâmetros clinico-patológicos………..……….…38
x
Quadro 22) Associação entre % de células marcadas e Intensidade da marcação para a BCRP….40
Quadro 23) Associação entre a imunomarcação para a BCRP e os parâmetros clínico-
patológicos………...41
xi
Índice de Gráficos
Gráfico 1) Frequência absoluta Estadio TNM………..……….………25 Gráfico 2) Grau histológico de malignidade………….……….……….………..25 Gráfico 3) Expressões simultâneas dos marcadores glicoproteína P, LRP, MT e BCRP em %, na
totalidade das amostras……….……….30
Gráfico 4) Percentagem de tumores com marcação baixa vs moderada ou alta dos marcadores
xii
Siglas e Abreviaturas
%cels- Percentagem de células marcadas µm - Micrometro
ABC – ATP Binding Cassette
ABCG1 – ATP Binding Cassette grupo G1 ADN- Ácido dexoribonucleico
ATP – Adenosine Triphosphate ANOVA – Análise de variância
BCRP – Breast cancer resistance Protein
DAB – Tetra-hidrocloreto de 3,3’-diaminobenzidina LRP – Lung Resistance Protein
MDR – Multi drug resistance (multiresistência a fármacos) MDR1 – Gene Multidrug resistance 1
MT - Metalotioneína
M1 – Presença de metástases à distância M0 – Ausência de metástases à distância n- Número de amostras
N0 – Ausência de metástases nos gânglios linfáticos regionais N1 – Presença de metástases nos gânglios linfáticos regionais OMS – Organização Mundial de Saúde
OVH - Ovariohisterectomia p – Significância estatística
SPSS – Statistical Pachage for the Social Sciences T – Tumor size (Tamanho do tumor)
1
Capítulo I - Revisão Bibliográfica
1. Resistência a Fármacos
O fenómeno de resistência aos fármacos tem-se tornado um dos principais obstáculos ao sucesso da quimioterapia antineoplásica, sendo que as células tumorais que são insensíveis aos fármacos anti tumorais apresentam, geralmente, multiresistência aos fármacos (em inglês multidrug resistance - MDR). Na oncologia humana, as taxas de resposta à quimioterapia antineoplásica de primeira linha no cancro da mama metastático variam entre 50 a 70%, enquanto que a taxa de resposta à quimioterapia subsequente diminui significativamente devido a estes mesmos fenómenos de multiresistência (Faneyte et al. 2002).
A resposta dos pacientes à quimioterapia antineoplásica varia bastante de indivíduo para indivíduo de acordo com um complexo sistema de mecanismos genéticos, moleculares, biológicos e bioquimicos, que poderão causar resistências a diferentes grupos de fármacos como as antraciclinas ou os alcaloides da vinca (Borst 1997). Estes mecanismos poderão atuar de forma isolada ou combinados sobre um fármaco específico, ou levar ao desenvolvimento de resistência não específica a diversos fármacos (Schneider et al. 1999).
A quimioterapia aplicada à oncologia é baseada, em grande parte, em conceitos aplicados à quimioterapia antimicrobiana e, tal como acontece com os antibióticos, à medida que se desenvolvem fármacos cada vez mais eficazes no combate ao cancro, é provável que também os mecanismos de resistência das células tumorais se desenvolvam para sua própria protecção e sobrevivência (Schneider et al. 1999).
A designação MDR (do inglês multidrug resistance ou multiresistência a fármacos em português) refere-se a uma condição de sobrexpressão de determinados genes que codificam proteínas membranares ou citosólicas, o que se traduz num fenómeno de resistência simultânea a fármacos cujas estruturas e mecanismos de acção poderão, inclusivé, ser completamente diferentes (Baguley 2010).
A resistência intrínseca, ou adquirida, aos fármacos, representa atualmente o maior problema para a quimioterapia antineoplásica, limitando substancialmente a eficácia da mesma. Compreender os mecanismos de resistência torna-se assim fulcral para conseguir novas estratégias terapêuticas que ultrapassem esta dificuldade (Gottesman e Pastan 1993). No entanto, a compreensão destes mecanismos representa um processo altamente complexo uma vez que muitos dos fatores envolvidos estão relacionados com as próprias características
2
do tumor e dos fármacos. Apesar da dificuldade, de forma genérica, poderemos sintetizá-los da seguinte forma (Baguley 2010):
Existem os mecanismos de MDR que impedem os fármacos de alcançar as células alvo, outros que apenas impedem que estes atinjam as concentrações intracelulares necessárias. Existem ainda os relacionados com a supressão dos mecanismos de apoptose, e os relacionados com resistências às respostas imunes do hospedeiro e imunosupressão. Há ainda a considerar o papel da heterogenicidade tumoral, pois as células tumorais contêm muitas mutações e alterações epigenéticas que levam a defeitos tanto na sua capacidade de se diferenciar como no seu controlo de proliferação, existindo inúmeras formas diferentes destes mecanismos de MDR se expressarem (Baguley 2010).
2. A Problemática da Multiresistência nos Tumores de mama de
gata
A glândula mamária dos gatos é o 3º órgão mais afetado por neoplasias, após o linfoma e neoplasias de pele (Dorn et al. 1968, Hayes et al, 1981). A incidência de neoplasias mamárias nos gatos é metade do observado em mulheres e cadelas, contudo, em contraste com o que acontece com estes pelo menos 85% dos tumores mamários da gata são malignos (H. Hayes et al 1981; Bostock 1986, Skorupski et al., 2005).
Misdorp e colaboradores, em 2002, referem que as neoplasias resultam de um conjunto de fatores genéticos, hormonais, alimentares e virais. No entanto, as causas daneoplasias mamárias em gatas ainda estão sobre investigação, uma vez que estamos perante um processo extremamente complexo e multifatorial. Tanto a invasão como o próprio crescimento tumoral dependem essencialmente de fatores genéticos, mas também de fatores adicionais do micro ambiente do estroma (Spieker et al. 1995).
Nos tumores mamários da mulher já foram bastante estudadas as alterações genéticas envolvidas. Alguns oncogenes codificam fatores de crescimento e a amplificação ou sobrexpressão destes mesmos genes conduzem a um descontrolado crescimento celular (Misdorp 2002). Foram também já identificadas nos gatos, alterações nos controlos moleculares de proliferação e sobrevivência celular, no que respeita ao processo de angiogénese e de resposta ao dano de ADN, e pensa-se que estejam envolvidos na patogénese dos tumores mamários em gatas (Murakami et al. 2000; Nasir et al. 2000).
3
A chave para conseguir uma abordagem apropriada ao cancro é ter um diagnóstico preciso, para que se possa realizar um estadiamento tumoral correto e o melhor tratamento possa ser recomendado (Hughes e Dobson 2012). A maioria dos patologistas veterinários segue atualmente a classificação histológica dos tumores mamários da gata, proposta pela Organização Mundial de Saúde (Misdorp et al.,1999). A classificação morfológica pode ainda ser complementada pela classificação tumoral baseada no score de formação tubular, pleomorfismo nuclear e contagem mitótica, e esta é usada genericamente como um método semiquantitativo em gatos e humanos, que permite classificar entre três tipos de tumores: Carcinomas bem diferenciados, moderadamente diferenciados e mal diferenciados (Scarff-Bloom-Richardson system; Elston e Ellis 1991).
Quanto à terapêutica, a cirurgia é atualmente o procedimento mais utilizado nos tumores mamários da gata, podendo ser usado isolado ou combinado com quimioterapia ou radioterapia (Rutterman et al, 2001). Contudo, devido à natureza invasiva destes tumores e tendência para metastizar rapidamente, o sucesso da cirurgia é frequentemente incerto (Misdorp 2002).
Quanto à avaliação prognóstica dos tumores de mama na gata, este tema permanece controverso, principalmente, porque apesar do considerável número de estudos realizados, não se têm obtido melhorias significativas, principalmente no que diz respeito ao tempo de sobrevida. Isto está relacionado com o facto de que quando se faz a cirurgia, em geral, já haver invasão do estroma e/ou metastização (Withrow e Vail 2013).
Os tumores de mama da gata são muito agressivos, com alguns dados a indicarem que, após a realização de cirurgia conservativa, 2/3 dos gatos virão a sofrer de recorrência local (A. Hayes 1977; Eg et al. 1984; Brown et al, 1985). Em média a literatura descreve um intervalo entre o diagnóstico e a morte do animal de 10 a 12 meses (Hayes 1977, Hayes et al 1981; Weijer e Hart 1983; Eg et al. 1984 , Millanta et al. 2002), o que é manifestamente uma baixa sobrevida total após cirurgia.
O estado dos linfonodos regionais constitui o fator de prognóstico independente mais importante na mulher (Kumar et al. 2014). Em veterinária, também já se usa este fator, juntamente com o tamanho tumoral e a presença de metástases à distância, para o estadiamento das neoplasias mamárias e para conseguir um indicador de prognóstico fiável (Owen et al 1980, Lara et al. 2003, Novosad et al. 2006).
Também se poderá obter informação prognóstica importante pelo tipo de abordagem terapêutica, expressão de marcadores de proliferação e estado dos recetores hormonais
4
(Castagnaro et al.,1998; Millanta et al.,2002; Preziosi et al.,2002; Dias et al, 2004). O índice mitótico é um indicador de prognóstico independente nas neoplasias mamárias das gatas e parece estar relacionado com a diminuição do tempo de sobrevida em gatas em que foi realizada cirurgia para remoção do carcinoma mamário (Preziosi et al., 2002; Castagnaro et al. 1998).
Já foi também demonstrado que o grau histológico poderá ser utilizado como fator de avaliação do comportamento biológico dos tumores mamários na gata (Seixas et al. 2011). Outros fatores fenotípicos que poderão ter algum valor prognóstico são a morfometria nuclear/celular (Hughes e Dobson 2012), expressão VEGF e sobrexpressão de HER2/neu (Millanta et al. 2002, Millanta et al. 2005).
Os tumores mamários são tumores frequentes tanto na mulher como na cadela e na gata, todos eles com diversas características em comum. O carcinoma mamário da gata tem sido reconhecido, desde 1980, como um importante modelo de estudo comparativo para o cancro da mama da mulher, uma vez que estes partilham características epidemiológicas, morfológicas e prognósticas importantes (Misdorp e Weijer 1980, Maniscalco et al. 2012, Zappulli et al.,2012).
Os tumores de mama na gata têm-se revelado como uma das neoplasias com uma resposta clínica mais imprevisível. Relativamente ao fenómeno de MDR, os estudos disponíveis são escassos e a informação muitas vezes controversa, desconhecendo-se o impacto destes processos na eficiência da resposta terapêutica, (Dincer et al. 2001, Lee et al, 2004, Koltai e Vajdovich 2014).
Supõe-se que diversos mecanismos estarão envolvidos na resistência à quimioterapia do cancro da mama, tanto em medicina humana como em medicina veterinária. O envolvimento dos genes da glicoproteína P e LRP já foi identificado (Kanzaki et al. 2001) e já foi descrito também o gene BCRP (Austin Doyle e Ross 2003). O mecanismo de multiresistência a fármacos associado à glicoproteína P é o mais estudado e compreendido a nível molecular (Ga e Bi 1995). Todavia, o significado clínico da sobrexpressão genética destes mesmos genes no cancro de mama contínua ainda incerto. Para conseguirmos estabelecer o significado real destes genes/ transportadores poderá ser necessário observar os efeitos clínicos de inibidores específicos de cada transportador, individualmente (Kanzaki et al. 2001).
5
3. Proteínas de Multiresistência a Fármacos
No que respeita aos fenómenos de resistência a fármacos causados por proteínas transportadoras, é importante entender os 2 mecanismos primários de acumulação dos fármacos nas células tumorais (Ambudkar et al. 2003):
- Fármacos hidrofílicos, solúveis em água, como a cisplatina atravessam a membrana com a ajuda de transportadores ou canais hidrofílicos, sendo que mutações individuais nestes transportadores levam a uma resistência a um único agente terapêutico (Ambudkar et al. 2003);
- Fármacos hidrofóbicos, entram na célula por difusão passiva através da membrana plasmática, logo são necessários sistemas de transporte dependentes de energia (família ABC, em inglês ATP binding cassette) para expulsar estes fármacos da célula (Higgins 1995).
Apesar de serem múltiplos os mecanismos envolvidos no desenvolvimento de MDR, o mecanismo clássico de resistência a fármacos é o aumento do efluxo dos fármacos da célula tumoral através de transportadores dependentes de ATP, que constituem uma superfamília de transportadores (genes ABC) (Higgins 1995). Os membros desta família funcionam como transportadores membranares ativos, dependentes de ATP, que transportam moléculas através da membrana plasmática contra o gradiente de concentração (Chang 2003). Já foram identificados 48 membros da família de transporte ABC, sendo que a maioria está localizada na membrana celular. Esta família foi dividida em 7 classes diferentes (A-G) e 4 destas classes (A, B, C e G) já demonstraram causar resistência a fármacos em células em cultura (Gottesman et al, 2002). A glicoproteina P e a BCRP são dois dos membros, até agora identificados, da família de proteínas transportadoras ABC dos mamíferos, que comprovadamente causam multiresistência a fármacos (Childs e Ling 1994, Austin Doyle e Ross 2003).
Estudos com linhas celulares tumorais identificaram estas proteínas de transporte que funcionam como bombas celulares de efluxo dos fármacos, contudo já foram também identificados outros mecanismos como, por exemplo, o sequestro de substrato para vesículas celulares que são mais tarde eliminadas por exocitose, como por exemplo a LRP (Baguley 2010). Existem ainda proteínas como a metalotioneína que também têm recebido bastante atenção, mas das quais ainda não estão bem compreendidos os mecanismos de funcionamento (Hainaut e Mann 2001).
6
3.1 Glicoproteína P
A Glicoproteína P é uma proteína de grandes dimensões, com mais de 1200 aminoácidos, e pensa-se que seja constituída por múltiplos segmentos transmembranares e dois domínios altamente conservados de ligação a ATP (Childs e Ling 1994). De acordo com a topologia prevista da glicoproteína P, os terminais C e N serão similares, contendo cada um deles seis segmentos transmembranares e um domínio de ligação ao ATP (Cole et al., 1992). É muito difícil prever com segurança se um transportador ABC em particular será capaz de produzir um fenótipo MDR (Ling, 1997).
Tem sido estudado extensivamente, numa perspectiva bioquímica, o mecanismo de acção da glicoproteína P (Shapiro e Ling, 1995). Uma vez que as células MDR que sobrexpressam a glicoproteína P são resistentes a um amplo espetro de fármacos, especulou-se que a mesma actuaria através de mecanismos indiretos como, por exemplo, alterando o pH intracelular ou modificando o potencial da membrana. Utilizando glicoproteína P purificada demonstrou-se que esta só por si é suficiente para transportar diferentes fármacos e que a energia para os transportes deriva do magnésio do ATP e de uma ATPase intrínseca da glicoproteína P. Demonstrou-se, igualmente, que o gradiante de pH não é necessário para o transporte do fármaco (Shapiro e Ling, 1995). Estes achados suportam o modelo de ação da glicoproteína P que interatua diretamente com um largo espetro de compostos hidrofóbicos da dupla camada lipídica e transporta-os diretamente para o exterior da célula, utilizando ATP e ATPase intrínseca para obter energia. Alguns estudos genéticos corroboram esta mesma teoria, demonstrando que mutações pontuais, localizadas em certos segmentos transmenbranares, afetam a especificidade da glicoproteína P em relação aos fármacos (Sheps e Ling, 1996).
Concluindo, o papel da glicoproteína P neste mecanismo de multiresistência a fármacos será impedir que os agentes quimioterápicos, como a vincristina, doxorubicina, actinomicina D e mitoxantrona, atingam a concentração intracelular mínima necessária, para que a quimioterapia tenha sucesso (Koltai e Vajdovich 2014). Estudos em mulheres concluíram que aproximadamente 33,3% dos adenomas mamários e 63,2% dos carcinomas mamários expressam a glicoproteína P (Sanfilippo et al. 1991, Ginn, 1996). Tanto em medicina humana como em oncologia veterinária já se demonstrou que a alta expressão desta proteína é um fator de prognóstico negativo em muitos tipos de tumores. No caso particular da oncologia humana, já se sabe há algum tempo que existe uma correlação entre níveis altos de glicoproteína e o fenótipo MDR, no caso dos tumores mamários (Sanfilippo et al. 1991).
7
Em tumores de mama na mulher, a expressão da glicoproteína P já foi associada a tumores com comportamentos biológicos mais agressivos (Linn et al. 1995). Existem diversos estudos sobre a expressão desta proteína no cão em tecidos normais e neoplásicos da glândula mamária (Petterino et al. 2006, Levi et al. 2016), no entanto, no caso da espécie felina ainda há pouca informação disponível: existe um estudo com carcinomas pulmonares (Hifumi et al. 2010) e um outro com linfomas felinos. Pela escassez de dados disponíveis, torna-se necessário continuar a investigar a expressão desta proteína nos tumores de mama da gata (Brenn et al. 2008).
3.2 BCRP - Breast cancer resistance protein
A proteína BCRP foi associada ao fenótipo MDR no cancro da mama da mulher, num trabalho de Austin Doyle e Ross em 2003 e foi assim designada pois a descoberta da mesma derivou de uma linha celular de cancro mamário resistente à quimioterapia. A expressão de BCRP foi correlacionada por Austin e Ross, em 2003, com uma marcada diminuição da acumulação no interior das células tumorais, principalmente de mitoxantrona, mas também de daunorubicina, topotecan, prazosine e rodamina 123, o que não se verificou com os substratos da glicoproteína P. Já foi demonstrado que a atividade da ATPase desta proteína transportadora é estimulada pelo transporte destes mesmos substratos, referidos anteriormente, o que nos indica que ensaios com base nesta mesma ATPase poderiam ser muito úteis para a deteção de interações entre diversos fármacos e a BCRP (Özvegy et al. 2001).
Através de análise Northern blot investigou-se a expressão de BCRP em diversos tecidos de humanos, sendo que foram detetados os níveis mais altos de expressão de BCRP em tecidos placentários, com níveis cerca de 100x mais elevados que na glândula mamária, cérebro, próstata, intestino delgado, testículos, ovário, cólon e fígado. Não foi detetada a presença desta proteína no coração, pulmão, músculo-esquelético, rim, pâncreas, baço e timo (Doyle et al. 1998). Em outro estudo imunohistoquímico, de Faneyte e colaboradores, em 2002, identificou-se que o epitélio mamário normal da mulher, assim como os vasos sanguíneos, expressam variavelmente BCRP.
Supõe-se que a BCRP desempenhe um papel importante na barreira hematoencefálica (tal como a glicoproteína P), e na defesa do feto, através do efluxo de fármacos e componentes nocivos (Jonker et al. 2000; Eisenblätter e Galla 2002).
8
Nos estudos imunohistoquímicos iniciais, em medicina humana, realizados em tumores sólidos da glândula mamária e utilizando anticorpos monoclonais, foram detetados baixos níveis de expressão de BCRP (Austin Doyle e Ross 2003). Todavia, em investigações subsequentes em que se utilizou um segundo anticorpo monoclonal, demonstrou-se que 40% dos tumores sólidos testados eram imunoreativos para o BCRP. Foram testados 150 tumores não tratados, de 21 tipos diferentes, sendo que em 92 casos se detetou uma reação de moderada a forte, em 27 casos foi fraca, e não se detetou expressão nos restantes 31. Os mesmos autores também estudaram a presença desta proteína em cancro da mama e a mesma foi detetada em 55% dos tumores analisados (Diestra et al. 2002). Não se detetou reatividade do BCRP em cancros de bexiga, ovários e carcinoma de células pequenas, mas foi detetada em cancros do cólon, esófago, endométrio, pulmão e melanoma, com marcação tanto do citoplasma como da membrana plasmática (Diestra et al. 2002). O efluxo de topotecan na linhagem celular de cancros de pulmão foi já correlacionado com os níveis expressos de mRNA de BCRP (Austin Doyled e Ross 2003).
Ironicamente, nos casos clínicos de cancro da mama na mulher, os níveis de expressão da BCRP baseados em técnicas de PCR são baixos (Kanzaki et al. 2001). Estudos imunohistoquímicos confirmam uma expressão de BCRP indetetável em tumores de mama, em oncologia humana, mesmo em biopsias de tumores reincidentes, após quimioterapia baseada em doxorubicina (Faneyte et al. 2002). Segundo Faneyte et al, em 2002, será improvável que o BCRP contribua para o fenótipo de MDR no caso do cancro de mama.
Em canídeos, num estudo, realizado por Nowak et al em 2009, com 54 cães diagnosticados com adenocarcinomas e adenomas mamários, a BCRP foi detetada em 85% dos adenocarcinomas e 28% dos adenomas, sendo que as amostras de tumores com graus de malignidade mais altos demonstraram um aumento da expressão de BCRP. Este estudo suporta a teoria de que a proteína BCRP desempenhará um papel na biologia celular tumoral no caso dos cães.
O papel do BCRP na resistência à quimioteria antineoplásica tem sido investigado com recurso a técnicas imunológicas e moleculares como a imunohistoquímica e northern blot e pensa-se que esta poderá desempenhar um papel importante nas recidivas tumorais, principalmente nas neoplasias hematológicas, em que já foi realizada quimioterapia, simultaneamente com inibidores de glicoproteína P (Austin Doyle e Ross 2003). A terapia genética baseada em riboenzimas poderá vir a ser clinicamente aplicável para prevenir ou reverter este mecanismo de resistência a fármacos (Kolk et al. 2002). A utilização de novas
9
técnicas, com anticorpos inibidores específicos da função do BCRP e de modelos animais, deverá permitir um desenvolvimento e compreensão mais aprofundada do papel fisiológico e patológico deste interessante transportador (Austin Doyle e Ross 2003).
Estudos imunohistoquímicos com anticorpos mono ou policlonais confirmam que os transportadores BCRP se localizam predominantemente na membrana plasmática (Rocchi et al. 2000), sendo que a localização específica deste transportador diferencia-o da maioria dos outros transportadores que se localizam em membranas intracelulares como, por exemplo, a mitocôndria ou retículo endoplasmático (Austin Doyle e Ross 2003). Este é mais um dos membros da família de transportadores ABC, mas é importante ter em conta que esta família possui mais de 100 membros identificados até ao momento, desde o reino procariota ao eucariota. No reino eucariota já foi reportada uma grande variedade de especifidade a diferentes substratos: iões, metais, aminoácidos, péptidos, hormonas esteróides, fosfolípidos e fármacos. Também foi identificada a expressão dos genes dos transportadores ABC em diversos tipos celulares e tecidos, no entanto, as suas funções não são geralmente conhecidas (Childs e Ling 1994).
Seria interessante identificar o número de transportadores ABC do genoma humano, sendo que, extrapolando do que acontece nas bactérias, poderemos supor que o genoma humano, no mínimo, possuirá várias centenas de transportadores ABC. Se isto for verdade, significa que as células tumorais terão o potencial de se defender com um grande número de transportadores promotores de resistência aos agentes terapêuticos (Childs e Ling 1994).
Os mecanismos de resistência a determinados fármacos têm sido historicamente identificados através de modelos experimentais como, por exemplo, linhas celulares. No entanto, é importante ter em conta que as células tumorais possuem um alto grau de heterogeneidade e instabilidade genética, pelo que muitos dos mecanismos de resistência poderão não ser observados nos modelos experimentais (Hedley et al., 1997).
É importante ter a consciência de que as células tumorais têm um potencial tremendo de resistência aos quimioterápicos. Contudo, é possível que o reportório de mecanismos de resistência que uma célula tumoral possui não seja ilimitado e, como tal, torna-se essencial entender quão clinicamente relevantes estes transportadores serão, quais as suas funções, mecanismos e como revertê-los. Deveremos verificar, sistematicamente, cada cancro, individualmente, em busca dos possíveis mecanismos de resistência envolvidos e assim fazer recomendações que melhorem a eficácia da quimioterapia, por exemplo, através de agentes reversores apropriados (Ling, 1997). Neste sentido, torna-se também necessário esclarecer o
10
papel desta proteína no desenvolvimento de fenótipos MDR dos tumores de mama da gata, onde a sua expressão não foi descrita até ao presente momento.
3.3 LRP – Lung resistance Protein
A LRP (do inglês Lung resistance protein) não possui homologias com a família ABC, no entanto, a sua sequência de aminoácidos foi identificada, concluindo-se que esta será a maior proteína do grupo das proteínas Vault. As proteínas Vault são complexos ribonucleoproteicos altamente conservados durante o processo evolutivo e que possuem este nome devido à sua forma ovóide. Estas proteínas localizam-se nos poros das membranas nucleares e vesículas citoplasmáticas e estão implicadas no transporte entre o citoplasma e o núcleo (Rome et al, 1991).
Estudos com microscopia fluorescente suportam que a LRP terá uma função similar às restantes proteínas Vault, sendo responsáveis por uma rápida distribuição de antraciclinas desde o núcleo para as vesículas citoplasmáticas, em linhagens celulares com sobrexpressão desta proteína (Schuurhuis et al. 1991). O gene que codifica a LRP foi clonado e localizado no cromossoma 16p11.2, (List et al. 1996). Entre 61 linhagens de tumores humanos não seleccionados, em que foi analisada a expressão das proteínas LRP e glicoproteína P, parece que a LRP seria a mais indicada para testes de resistência a fármacos in vitro, devido ao seu fiável valor preditivo (Izquierdo et al. 1996).
Na leucemia aguda humana, a LRP já foi associada a variáveis prognósticas adversas, como idade avançada e elevada expressão de glicoproteína P, mas não foram encontradas correlações com anomalias cromossómicas específicas. (List et al. 1996). Está ainda descrito que a sobrexpressão de LRP em pacientes com cancro ovárico provocava uma menor taxa de resposta à quimioterapia baseada em cisplatina, demonstrando assim que o valor prognóstico desta proteína se extende a outros tipos tumorais (Lzquierdo et al. 1995). Estudos realizados em medicina humana já demonstraram que alta expressão de LRP promove a capacidade invasiva das células cancerígenas no cancro da mama e, como tal, o seu silenciamento (knock out) poderá diminuir a capacidade migratória das células cancerígenas (Appert-Collin et al. 2016).
Em medicina veterinária, os estudos que abordam a imunoexpressão da LPR são escassos. Hifumi et al. em 2010, realizou um estudo em carcinomas pulmonares na espécie canina e felina e concluiu que poderá existir uma forte multiresistência a fármacos devido à
11
presença inequívoca de LRP e glicoproteína P. No entanto, que seja do nosso conhecimento, a expressão de LPR não foi ainda investigada nos tumores de mama da gata.
3.4 Metalotioneína
O papel da metalotioneína na carcinogénese, e a sua potencial aplicação no diagnóstico e prognóstico das neoplasias, tem recebido muita atenção (Dincer et al. 2001). As metalotioneinas são proteínas de baixo peso molecular entre 6 e 7 kDa, sendo que 30% são resíduos de cisteína e aminoácidos não aromáticos. As metalotioneinas são constituídas por sequências conservadas de resíduos de cisteína justapostas com aminoácidos básicos, como lisina e arginina, e estes formam estruturas com especial afinidade para metais de transição (Robbins et al. 1991; Jin et al., 2012). Nos humanos, as metalotioneínas são codificadas por uma família de genes: 10 isoformas funcionais de metalotioneínas, que se localizam no cromossoma 11q13 (West et al. 1990).
Devido às suas propriedades de ligação a metais, postulou-se que a metalotioneína deverá estar envolvida no controlo da homeostase e regulação de oligoelementos. No caso dos mamíferos, a metalotioneína-zinco parece ser o complexo predominante, no entanto, ainda não se compreende bem como funcionam os mecanismos de transferências de metais entre proteínas (Tapiero e Tew 2003). Pensa-se que as metalotioneinas possam também servir como um tampão oxidoredutor (Maret e Vallee 1998), daí se supor que a sobrexpressão de metalotioneinas possa servir como forma de proteger o ADN celular, de radicais livres e da peroxidação lipídica (Cai et al, 2000).
Sabe-se que a metalotioneina influencia o crescimento tumoral, uma vez que estimula a proliferação e diminui a apoptose, que são processos fundamentais na carcinogénese (Cherian et al. 1993; Schwarz et al. 1995). Em alguns carcinomas já se demonstrou associação entre a diminuição do processo de apoptose e a expressão da metalotioneina, no entanto, esta relação não foi ainda demonstrada no cancro da mama (Jin et al. 2002).
Não se conhece ainda com precisão os mecanismos de funcionamento da metalotionina, no entanto, supõe-se que esta interaja com outras proteínas envolvidas nos processos de proliferação e apoptose celular (Cui et al. 2003). Também parece existir uma ligação funcional entre a metalotioneina e o gene supressor de tumores p53, principalmente, em situações de depleção de zinco, que levam a uma alteração do fenótipo do gene p53 (Hainaut e Mann 2001).
12
Nos tumores de mama da mulher, a expressão imunohistoquimica da metalotioneina tem sido consistentemente associada a um aumento do grau de malignidade tumoral (Fresno et al., 1993, R et al. 1999, Jin et al. 2002). No entanto, a maioria dos estudos não encontrou uma associação estatisticamente significativa entre a expressão de Metalotioneína e o tamanho tumoral ou a presença de metástases nos linfonodos ao diagnóstico (Jin et al. 2002; Ioachim et al. 2003). Foi descrita a associação de níveis mais altos da expressão de metalotioneina com diminuição dos tempos de sobrevida livre de doença e de sobrevida total (Fresno et al., 1993). Contudo, em estudos de sobrevida com análise multivariada, os autores referem que a expressão da metalotioneina não providencia informação prognóstica adicional, quando considerados todos os outros fatores de prognóstico no seu conjunto (Haerslev et al, 1995).
A metalotioneina já foi extensamente estudada como possível mediador de resistência à quimioterapia antineoplásica em medicina humana (Cree et al., 2002). Por exemplo, já foi teorizado que a resistência à cisplatina, mediada pela metalotioneina, se deve em parte à transferência da porção platina, desde a cisplatina para a metalotioneina, levando assim à inativação deste quimioterápico (Andrews et al 1987) . No entanto, pensa-se que este efeito protetor dependa também do regime instituído, pois em outros estudos não se verificou esta resistência (Jin et al., 1997). Estudos mais recentes sugerem que a metalotioneína também poderá reduzir os níveis de apoptose, induzidos pelo etoposide, em linhas celulares de cancro de fígado e pulmões, embora este mecanismo ainda não seja totalmente compreendido (Shimoda et al. 2003).
Pouco ainda se sabe sobre o efeito da expressão de metalotioneinas na sensibilidade aos agentes quimioterápicos em linhas celulares de cancro da mama. Uma vez que o processo de resistência aos fármacos representa um fenómeno multifatorial, torna-se extremamente difícil conseguir evidências sobre o efeito direto da metalotioneína neste processo (Cherian et al, 2003). Muito falta ainda ser estudado sobre a função e mecanismo de funcionamento desta proteína na carcinogénese e no processo de resistência aos quimioterápicos, sendo que este conhecimento nos poderá vir a ser útil na busca de novas técnicas terapêuticas, bem como numa maior precisão prognóstica (Jin et al., 1997).
Nos tumores de mama da gata, já foi detetada a expressão de metalotioneina em 31% dos tumores de mama malignos (Dincer et al, 2001). Os resultados obtidos neste estudo foram semelhantes aos já encontrados em medicina humana (Schmid et al. 1993) e suportam a ideia de um possível envolvimento desta proteína na promoção da progressão tumoral nos tumores
13
mamários felinos. No entanto, dado que só existe um estudo publicado até ao momento, por Dincer e colaboradores em 2001, que compara a expressão desta proteína em tumores mamárias na cadela e na gata, torna-se necessário continuar a investigar a expressão desta proteína nestas neoplasias.
14
Capítulo II - Objetivos
Com este trabalho pretendemos:
Caracterizar a expressão das proteínas de multiresistência a fármacos (Glicoproteína P, LRP, Metalotioneína e BCRP) nos tumores de mama da gata.
Investigar as associações entre a expressão imunohistoquimica destas proteínas com parâmetros clínicos e histológicos e interpretar os resultados de tal associação.
15
Capítulo III - Material e Métodos
1. Material
Para este estudo retrospetivo foram incluídos 30 tumores mamários de gata, cujas amostras foram recolhidas de animais que se deslocaram ao hospital público de São Paulo, para realizar mastectomias para exérese da massa tumoral entre o ano de 2013 e 2015.
O material foi recebido no laboratório de patologia comparada da Universidade de São Paulo, já fixado em formol a 10%, com tempo de fixação variável, incluído em parafina e processado segundo o procedimento de rotina para microscopia ótica. Dos blocos de parafina seleccionados foram efetuados vários cortes para estudos histopatológicos e técnicas de imunohistoquímica.
2. Análise das variáveis clínico-patológicas
Foram recolhidos dados clínicos relativos ao animal, nomeadamente a raça, o sexo, a idade, o estado reprodutivo (inteira vs ovariectomizada), o uso de contraceptivos, o número de lesões mamárias, a sua localização, tamanho, ulceração e, quando possível, início do processo lesional. O tamanho das lesões apresentadas neste estudo refere-se ao seu diâmetro maior. Para o tratamento estatístico esta variável foi categorizada em 3 grupos (inferior a 2 cm; de 2 a 3 cm e superior a 3 cm) de acordo a classificação TNM para as neoplasias mamárias felinas (Owen, 1980, Lana et al, 2013).
O tratamento de eleição em todos os animais incluídos neste estudo foi a cirurgia, que foi categorizada em cirurgia unilateral, regional e bilateral (radical).
Quanto ao seguimento clínico, após o procedimento cirúrgico, foi possível aceder aos registos do hospital público, conseguindo-se assim obter informações sobre o estado geral dos animais, ocorrência de recidivas e/ou metástases.
3. Análise histopatológica
Em todas as preparações histológicas realizou-se uma observação sistemática, que permitiu a classificação histológica dos tumores, em conformidade com os critérios da OMS para tumores mamários caninos e felinos (Misdorp et al. 1999), sendo que as lesões foram classificadas com base nas características histológicas predominantes. Todo o procedimento de análise histopatológica foi realizado pelo Prof. Dr. Bruno Cogliati.
16
3.1 Grau histológico
Os tumores foram graduados pelo Sistema de Nottingham (Elston e Ellis, 1991) e os critérios incluíram formação tubular, pleomorfismo nuclear e contagem mitótica (Quadro 1). As estruturas tubulares foram definidas como aquelas que apresentaram lúmen claro e visível. O score 1 foi atribuído aos tumores que apresentaram mais de 75% da área carcinomatosa formada por túbulos; score 2 entre 10% - 75% e score 3 entre 0 - 10% da área do tumor. Para análise de pleomorfismo nuclear, foi observado o tamanho e a forma dos núcleos das células, sendo utilizadas como parâmetro de normalidade as células epiteliais normais adjacentes ao tumor: Score 1 foi atribuído para núcleos pequenos e regulares e cromatina uniforme. Quando os núcleos se apresentaram com tamanho aumentado e com variabilidade foi dado score 2. A presença de células com acentuado pleomorfismo, com grande variação no tamanho e forma do núcleo, apresentando ainda núcleos bizarros e vesiculosos, com múltiplos nucléolos caracterizaram o score 3. As figuras mitóticas foram contadas em 10 campos de grande ampliação (40x) (Elston e Ellis, 1991). O score foi atribuído de acordo com o número de mitoses detetadas: Score 1 (0-8 mitoses); Score 2 (9-16 mitoses) e Score 3 (acima de 17 mitoses).
Para a obtenção do grau histológico combinado do tumor, o score para cada fator foi somado, resultando num valor total que varia de 3 a 9. O grau foi alocado pela seguinte divisão arbitrária dos pontos totais: grau I (bem diferenciado) - 3, 4 ou 5 pontos; grau II (moderadamente diferenciado) - 6 ou 7 pontos, e grau III (mal diferenciado) - 8 ou 9 pontos.
17
Quadro 1 Avaliação do grau histológico de malignidade segundo Elston e Ellis (1991) Formação tubular Pleomorfismo nuclear Índice Mitótico 1. Boa formação tubular
(75% do tumor)
1. Tamanho nuclear semelhante à
célula normal 1. 0 - 8 Contagens
2. Moderada formação
tubular (10 a 75%)
2. Moderado aumento de tamanho
e variabilidade 2. 9- 17 Contagens
3. Baixa formação
tubular ( <10%) 3. Marcada variação 3. Mais que 17
Total do Score 3 - 5 6 - 7 8 – 9 Grau de Malignidade I – Bem diferenciado II – Moderadamente diferenciado III – Mal diferenciado
3.2 Estadiamento
Para o estadiamento dos carcinomas usámos o sistema TNM da OMS modificado para ser aplicado nos carcinomas felinos (Owen et al, 1980, Lana et al, 2013; Rutteman et al., 2001) que se baseia nos seguintes critérios: (1) Tamanho do tumor primário (T); (2) envolvimento dos gânglios linfáticos regionais (N) confirmado por citologia ou histologia e (3) ocorrência de metástases à distância (M) (Quadro 3). O T corresponde ao diâmetro maior do nódulo mamário, sendo T1 tumores com dimensões inferiores a 2 cm, T2 entre 2 e 3 cm e T3, com dimensão superior a 3 cm. Relativamente ao estado ganglionar N0 corresponde a ausência de metástases ganglionares e N1 à sua presença. O M0 corresponde a ausência de metástases à distância e M1 à sua ocorrência.
Quadro 2. Estadio TNM (Owen et al, 1980)
Estadio TNM T N M
I 1 0 0
II 2 0 0
III 1,2 ou 3 1 0
18
4. Análise imuno-histoquímica
4.1 ProcedimentoDe acordo com a disponibilidade de material biológico, entre a totalidade dos 30 animais foram selecionados 24 tumores para a realização da imunohistoquímica com os anticorpos para Glicoproteína P, LRP, BCRP e Metalotioneína (Quadro 3). Para o procedimento imunohistoquímico é importante referir que previamente foram necessários estudos preliminares para apuramento da técnica e padronização do anticorpo, para cada marcador individualmente, a fim de otimizar os resultados.
Foram realizados cortes histológicos de 5 µm de espessura nos blocos dos animais selecionados, os quais foram desparafinados, hidratados e submetidos ao desmascaramento antigénico em panela de pressão elétrica durante 20 minutos, utilizando solução tampão (pH 6,0 ou pH 9,0) de acordo com o Quadro 3. Posteriormente, as lâminas foram submetidas ao bloqueio da peroxidase endógena em solução de H2O2 6% por 30 minutos, protegido da luz e de seguida lavagem em água corrente e destilada com posterior colocação destas lâminas em tampão de lavagem TBS. Procedeu-se então ao bloqueio de proteína com Protein Block (reagente Kit Spring – Cod SPD – 125), por 10 minutos, com uma temperatura de 20 a 25ºC. As lâminas foram incubadas com os anticorpos primários diluídos, nos títulos adequados, em diluente de anticorpo (Spring Cod – ADS 125) por um período de 60 minutos, a 20-25ºC em estufa (Quadro 3). Por fim, as lâminas foram lavadas com tampão de lavagem e foi iniciado o sistema de visualização. O primeiro reagente foi o Polimero Reveal HRP (Spring – Cód SPD 125), uma gota do reagente, por 10 minutos, em temperatura de 20 a 25ºC. O segundo reagente HRP Conjugate HRP (Spring – Cód SPD 125), aplicado por 15 minutos em temperatura de 20 a 25ºC. De seguida, foi aplicado o substrato cromógeno DAB Liquido (reagente Kit Spring-Cód SPD 125), por 5 minutos, em temperatura ambiente. Após incubação do DAB, foi retirado o excesso do cromógeno no papel filtro e lavado em água corrente seguido de água destilada. As lâminas foram contra coradas com Hematoxilina de Harris por 25 segundos, em seguida foram lavadas em água corrente e destilada e realizados 2 banhos rápidos em água amoniacal 0,5%. Depois disso, foram realizadas lavagens em água corrente e água destilada e as lâminas foram submetidas à bateria de desidratação. Para montagem, foram utilizadas lamelas e Permount como meio de montagem. Os controlos negativos foram realizados pela omissão dos anticorpos primários e substituídos por PBS.
19
Quadro 3) Caracterização dos anticorpos primários utilizados
Marcador Marca Clone Tampão de desmascaramento Condições de desmascaramento Diluições de anticorpo LRP Santa Cruz 1014 EDTA (pH9,0) Panela de pressão elétrica, 125ºC, 20min 1:500
Glicoproteína P Enzo C494 Citrato (pH 6,0) Panela de pressão
elétrica, 125ºC, 20min 1:100 Metalotioneína (MT-1 e MT-2) Dako E9 EDTA (pH 9,0) Panela de pressão elétrica, 125ºC, 20min 1:100 BCRP-1 Santa Cruz BXP-21 Citrato (pH 6,0) Panela de pressão elétrica, 125ºC, 20min 1:200
4.2 Métodos de quantificação da imunoreacção
Todas as lâminas de imunohistoquímica foram classificadas por 3 observadores numa prova cega, em que os mesmos não conheciam previamente o seguimento clínico dos animais. Foi utilizado um microscópio óptico (10 lente x 40objetiva) e foram aleatoriamente escolhidos 10 campos de alta resolução para avaliar a intensidade de expressão dos 4 biomarcadores. Foi realizada uma observação exaustiva das preparações na sua totalidade e, em cada preparação, foi determinada, em termos percentuais, a fracção de células marcadas (%cels), e a intensidade da marcação (IM). As amostras foram classificadas de acordo com os seguintes parâmetros:
No caso da glicoproteína P e da metalotioneína, quando menos de 20% das células, em 10 campos de alta resolução, mostraram marcação membranar ou citoplasmática, considerou-se uma reacção fraca, de acordo com o descrito previamente por Petterino et al. em 2006, em estudos com cancros mamários em humanos.
A expressão do BCRP e do LRP foi considerada fraca quando menos de 10% das células tumorais foram marcadas, de acordo com o descrito por outros autores (Diestra et al. 2002, Rudas et al. 2003).
Quanto à intensidade da marcação, esta foi avaliada igualmente em todos os marcadores por comparação com o endotélio (usado como controlo interno positivo). As células que não demonstraram reação foram consideradas negativas, sendo que aquelas que demonstraram uma reação muito fraca comparada com o endotélio foram consideradas de intensidade fraca, as com intensidade de marcação semelhante ao endotélio foram
20
classificadas com intensidades moderadas, e as que se destacavam relativamente ao endotélio com intensidade alta.
Recorreu-se a um score semi-quantitativo de imunoreatividade (Score) que mede tanto a intensidade da reação como a percentagem de células marcadas. A percentagem de células marcadas (%cels) foi agrupada em intervalos distintos para cada marcador (Quadro 4, 5, 6 e 7), de acordo com o referido na bibliografia. Quanto à intensidade da marcação (IM), utilizou-se um score previamente descrito por Remmele e Stegner 1987, no qual o grau 1 corresponde a uma marcação fraca, o 2 a uma marcação moderada e o 3 a uma marcação intensa. O produto destas duas categorias (%cels x IM) permite-nos então distinguir entre 3 scores de expressão, sendo que os intervalos variam de acordo com o encontrado na bibliografia para cada marcador.
Para efetuar a análise estatística, as amostras foram agrupadas em três categorias de imunoexpressão: Baixa (que inclui os de expressão negativa), Moderada e Alta.
4.2.1Glicoproteína P (Kim et al. 2012)
Quadro 4) Score semiquantitativo da imunoreacção para a Glicoproteína P
IM- intensidade de marcação
% céls – percentagem de células marcadas
O produto da intensidade da marcação com a percentagem de células marcadas origina os seguintes scores para a glicoproteína P:
Score 1 (< 3) – Expressão Baixa
Score 2 (3 ou 4) – Expressão Moderada Score 3 (6 a 9) – Expressão Alta
Intensidade da reacção IM Percentagem de células positivas % céls
Sem marcação 0 <20% 1
Fraca 1 20–50% 2
Moderada 2 >50% 3
21
4.2.2LRP (Rudas et al. 2003)
Quadro 5) Score semiquantitativo da imunoreacção para a LRP
IM- intensidade de marcação
% céls – percentagem de células marcadas
O produto da intensidade da marcação com a percentagem de células marcadas origina os seguintes scores para a LRP:
Score 1 (< 3) – Expressão Baixa
Score 2 (3 ou 4) – Expressão Moderada Score 3 (6 a 12) – Expressão Alta
4.2.3Metalotioneína (Erginsoy et al. 2006)
Quadro 6) Score semiquantitativo da imunoreacção para a metalotioneína
IM- intensidade de marcação
% céls – percentagem de células marcadas
O produto da intensidade da marcação com a percentagem de células marcadas origina os seguintes scores para a metalotioneína:
Score 1 (< 3) – Expressão Baixa
Score 2 (3 ou 4) – Expressão Moderada Score 3 (6 a 12) – Expressão Alta
Intensidade da reacção IM Percentagem de células positivas %cels
Sem marcação 0 < ou = 10% 1
Fraca 1 11 a 30% 2
Moderada 2 31 a 69% 3
Intensa 3 >ou = 70% 4
Intensidade da reacção IM Percentagem de células positivas %cels
Sem marcação 0 <25% 1
Fraca 1 26 a 50% 2
Moderada 2 51 a 75% 3
22
4.2.4 BCRP (Nowak, Madej, and Dziegiel 2009)
Quadro 7) Score semiquantitativo da imunoreacção para a BCRP
IM- intensidade de marcação
% céls – percentagem de células marcadas
O produto da intensidade da marcação com a percentagem de células marcadas origina
os seguintes scores:
Score 1 (< 3) – Expressão Baixa
Score 2 (3 ou 4) – Expressão Moderada Score 3 (6 a 12) – Expressão Alta
5. Análise Estatística
A análise estatística dos dados foi realizada recorrendo ao sistema SPSS (Statistical Package for the Social Sciences, Chicago, IL, EUA). Os resultados foram expressos em frequências absolutas e relativas e, para as variáveis quantitativas foi efetuada a estatística descritiva com o cálculo da média, desvio padrão, erro padrão, máximo e mínimo. A relação entre as variáveis categóricas foi realizada recorrendo ao teste de Fisher, uma vez que não foi possível utilizar o teste do qui quadrado, pois o número de observações esperadas foi inferior a 5 em mais de 20% das células. O nível de significância usado para todos os testes foi α= 5%, ou seja, um valor de p <0,05 foi considerado estatisticamente significativo.
Intensidade da reacção IM Percentagem de células positivas %cels
Sem marcação 0 < ou = 10% 1
Fraca 1 11–50% 2
Moderada 2 51 e 79% 3
23
Capítulo IV – Resultados
6. Análise descritiva da amostra em estudo
6.1 Características clinicopatológicasEntre os 30 animais incluídos no estudo, 23 não tinham raça definida (n=23; 76,7%), e 7 eram da raça siames (n=7; 23,3%). Todos os animais eram do sexo feminino (n=30; 100%), sendo que quanto ao estado reprodutivo dos quais conseguimos esta informação, a maioria tinham realizado OVH, pelo menos, 2 anos antes do diagnóstico (n=20, 87%), e 3 estavam inteiras no momento da mastectomia (n=3; 13%), sendo que em uma destas foi realizada a OVH no momento da mastectomia. A prévia administração de contracetivos foi confirmada pelos proprietários em 8 dos animais (n=8; 27,6%).
A idade média no momento do diagnóstico foi de 11,71 + 2,94 anos (intervalo entre 6 -18 anos), sendo que nos animais de raça siamesa a idade média ao diagnóstico foi de 12,57 + 3,9 anos. Quanto aos animais que realizaram OVH, a idade média foi de 11,9 + 3,3 anos (mediana=13 anos; intervalo entre 6-18anos de idade) e, quanto aos 3 animais inteiros no momento do diagnóstico, a idade média foi de 11,33 + 1,5 anos (mediana 11 anos; intervalo entre 5 e 13 anos de idade).
Quanto à localização, entre os 18 tumores dos quais obtivemos informação, a localização mais frequente foram as glândulas inguinais e abdominais (n=14; 77,8%), sendo que apenas 4 tumores se localizaram nas glândulas abdominas anteriores e axilares (n=4; 22,2%). Em relação ao tamanho, foi observado um diâmetro médio de 3,85 + 2,7 cm, sendo que 20,7% dos tumores (n=6) possuiam diâmetro inferior a 2 cm e 55,2% possuiam diâmetro superior a 3 cm (n=16). Entre os 30 tumores analisados, 9 apresentavam mais que uma massa tumoral no momento do diagnóstico (n=9; 30%), com uma média de 1,3 massas por animal (intervalo entre 1 e 3). Em 9 (60%) dos 15 animais dos quais obtivemos informações sobre o estado dos linfonodos, foram detetadas metástases nodais. Foram detetadas metástases pulmonares em 9 animais (n=9; 34,5%) e em 1 animal foi detetada uma metástase cutânea (3,6%). Quanto ao estadiamento TNM (Gráfico 1), a maioria dos animais eram estadio III (n=13, 43,3%).
A mastectomia foi realizada em todos os animais (n=30; 100%), sendo que a técnica cirúrgica mais utilizada foi a mastectomia regional (n=13; 50%); em 8 animais optou-se pela
24
mastectomia bilateral total (30,8%), em 5 animais (19,2%) pela mastectomia unilateral total, e em 4 animais não se obteve detalhes sobre a extensão cirúrgica.
Quanto à ulceração cutânea, esta foi detetada em 14 das massas mamárias (n=14, 66,7%), sendo que apenas obtivemos esta informação em 20 dos animais. Quanto à aderência, 5 das massas (20%) estavam aderiadas à pele e 9 (36%) à pele e musculatura (sem informação em 5 das massas mamárias). No quadro 8, encontram-se descritas as frequências relativas e absolutas das variáveis atrás mencionadas.
Quadro 8) Análise descritiva das variáveis clínicas (frequências relativas e absolutas)
Variáveis N % Variáveis N %
Raça (n=30)
Sem raça defenida Siamês 23 7 76,7 23,3 Ulceração (n=21) Sim Não 7 14 33,3 66,7 Estado reprodutivo(n=23) Castrada Inteira 20 3 87 13 Tamanho (n=29) <2cm 2-3cm >3cm 6 7 16 20,7 24,1 55,2 Anticoncepcional (n=29) Não Sim 21 8 72,4 27,6 Tipo de cirurgia (n=26) Mastectomia Unilateral Mastectomia Regional Mastectomia Bilateral (radical)
5 13 8 19,2 50 20,8 Localização (n=18)
1ºe 2º par de glândulas 3º e 4º par de glândulas 4 14 22,2 77,8 Aderência (n=25) Não Pele Pele e musculatura 11 5 9 44 36 20 Estadiamento TNM (n=30) I II III IV 6 9 13 2 20 30 43,3 6,7
25
6.2 Características Histológicas
Entre os 30 tumores analisados todos foram classificados como carcinomas (100%). Os subtipos histológicos mais frequentes foram o carcinoma tubulopapilar (n=11; 36,7%), o carcinoma sólido (n=7; 23,3%) e o carcinoma cribriforme (n=6; 20%) (Quadro 9). O grau de malignidade foi avaliado nos 30 carcinomas (Gráfico 2), sendo que a maioria das massas neoplásicas eram de Grau II (n=14) e I (n=10), correspondendo a 80 % dos casos. Apenas 6 tumores foram classificados com grau de malignidade III (20% dos casos) (Quadro 10).
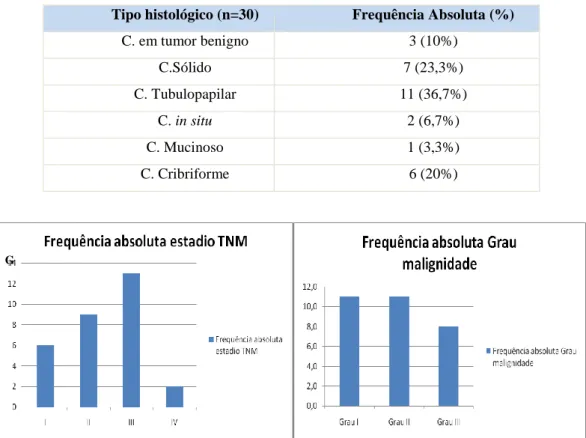
Quadro 9) Classificação histológica das neoplasias mamárias analisadas
G
Gráfico 1 Frequência absoluta Estadio TNM
Tipo histológico (n=30) Frequência Absoluta (%)
C. em tumor benigno 3 (10%) C.Sólido 7 (23,3%) C. Tubulopapilar 11 (36,7%) C. in situ 2 (6,7%) C. Mucinoso 1 (3,3%) C. Cribriforme 6 (20%)
26
Quadro 10) Análise descritiva dos parâmetros histopatológicos
Variáveis N % Variáveis N % Formação tubular (n=30) 1 2 3 5 12 13 16,7 40 43,3 Envolvimento ganglionar (n=15) N0 N1 6 9 40 60 Pleomorfismo nuclear (n=30) 1 2 3 4 16 10 13,3 53,3 33,3 Metástases à distância (n=28) Mo M1 18 10 64,3 35,7 Índice Mitótico (n=30) 1 2 3 13 10 7 43,3 33,3 23,3 Grau Histológico (n=30) I II III 10 14 6 6 33,3 46,7 20