CENTRO DE CIÊNCIAS DA SAÚDE FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PÓS-GRADUAÇÃO EM FARMACOLOGIA
ANA JÉRSIA ARAÚJO
ESTUDO DAS PROPRIEDADES CITOTÓXICA DA NOR-β-LAPACHONA E SEU DERIVADO NITROFENILAMINO EM CÉLULAS HL-60
ESTUDO DAS PROPRIEDADES CITOTÓXICAS DA NOR-β-LAPACHONA E SEU DERIVADO NITROFENILAMINO EM CÉLULAS HL-60
Dissertação submetida à Coordenação do Programa de Pós-Graduação em Farmacologia, do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Mestre em Farmacologia.
Orientadora: Dra. Raquel Carvalho Montenegro Co-orientadora: Profª Dra Letícia Veras Costa Lotufo
A687e Araújo, Ana Jérsia
Estudo das propriedades citotóxicas da Nor-β -Lapachona e seu derivado nitrofenilamino em células HL-60 / Ana Jérsia Araújo. – Fortaleza, 2009.
95 f. : il.
Orientadora: Profa. Dra. Raquel Carvalho Montenegro Dissertação (Mestrado) - Universidade Federal do Ceará. Faculdade de Medicina. Programa de Pós-Graduação em Farmacologia, Fortaleza-Ceará, 2009
1. Leucemia Promielocítica Aguda 2. Naftoquinonas 3. Testes de Toxicidade 4. Apoptose I. Montenegro, Raquel Carvalho (orient.) II. Título.
ESTUDO DAS PROPRIEDADES CITOTÓXICAS DA NOR-β-LAPACHONA E SEU DERIVADO NITROFENILAMINO EM CÉLULAS HL-60
Dissertação submetida à coordenação do programa de Pós-graduação em Farmacologia como parte dos requisitos necessários para a obtenção do título de mestre em Farmacologia outorgado pela Universidade Federal do Ceará.
BANCA EXAMINADORA
__________________________________________________ Dra. Raquel Carvalho Montenegro (Orientadora)
Universidade Federal do Ceará
__________________________________________________ Profa. Dra. Letícia Veras Costa Lotufo (Co-orientadora)
Universidade Federal do Ceará
__________________________________________________ Profa. Dra. Ana Paula Negreiros Nunes Alves
Universidade Federal do Ceará
__________________________________________________ Profa. Dra. Geanne Matos de Andrade
Agradeço primeiramente a Deus, por estar presente em todos os momentos da minha vida, dando-me força nos momentos difíceis, pelos muitos momentos de alegria proporcionados e pelas vitórias conquistadas;
À Dra. Raquel Carvalho Montenegro, pela orientação neste trabalho, por todas as oportunidades ofertadas em todo este período e pelos ensinamentos que contribuíram muito para a minha formação;
À Dra. Letícia Veras Costa Lotufo pela competência e simplicidade, pelos bons conselhos, incentivo e orientação e pelos inesquecíveis momentos de descontração;
À Dra. Cláudia Pessoa, pelo incentivo em implantar novas técnicas no laboratório e pela busca por novos recursos para o mesmo;
Ao Dr. Manoel Odorico de Moraes, pelo incentivo e contribuição à pesquisa
no Laboratório de Oncologia Experimental e pelo seu bom-humor;
À Dra. Ana Paula Negreiros Nunes Alves, por sempre nos receber de braços
abertos em seu laboratório e pelos excelentes momentos de descontração;
Ao Delano, namorado dedicado e companheiro, pela ajuda nesse e em todos
os trabalhos desenvolvidos na minha vida acadêmica, pela tranqüilidade, apoio e
acima de tudo, pelo amor que sente por mim (completamente correspondido);
À minha mãe, pela torcida e por estar sempre orando por mim. Pelo apoio em
todas as minhas decisões, incentivo aos estudos e dedicação;
Aos meus “projetos” de sogro e sogra, pelo espaço sempre reservado para os
estudos, pelo carinho, torcida e apoio em todos os momentos;
Aos amigos do Laboratório de Oncologia Experimental: Adriana Carvalho,
Bruno Cavalcanti, Bruno, Carla Sombra, Cecília Carvalho, Deisy, Elthon Gois,
Germano, Hemerson Iury, Igor, Kézia Lacerda, Kristiana Mousinho, Patrícia Marçal,
Paula Abreu, Rafael, Vanessa, Venúcia, Washington Bastos, Zé Roberto e a todos
que de forma direta ou indireta me ajudaram e que proporcionaram um convívio
agradável dentro e fora do LOE. Em especial, agradeço a Evelyne Alves e Arinice
Às professoras que aceitaram participar dessa banca: Dra. Geanne Matos de
Andrade, Dra. Ana Paula Negreiros Nunes Alves, Dra. Letícia Veras Costa Lotufo e
Dra. Raquel Carvalho Montenegro.
Aos professores, frutos do LOE, Márcio Roberto, Gardênia Militão, Daniel
Bezerra, Marne Vasconcellos e Paulo Michel.
As secretárias Adelânia Marinho e Sheyla por sempre estarem dispostas a
ajudar, pelo apoio e torcida para que tudo de melhor nos aconteça. Obrigada pela
dedicação e pelos bons conselhos;
Aos técnicos: Paulo, D. Fátima e em especial Erivanda França, Silvana
França e a Rogéria Montenegro pela constante ajuda dentro do laboratório e pelas
conversas agradáveis;
Aos funcionários do Departamento de Fisiologia e Farmacologia: Chiquinho,
Alana, Carlos, Iris, Márcia e em especial a Aura Rhanes pela paciência e ajuda
em todos os momentos;
Este trabalho foi realizado graças ao auxílio das seguintes instituições: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES Banco do Nordeste do Brasil - BNB
Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq Financiadora de Estudos e Projetos - FINEP
O esqueleto quinona foi identificado como um importante grupo farmacofórico para atividade citotóxica de vários compostos utilizados na clínica, constituindo ainda uma das maiores classes de agentes anticâncer. A β-lapachona é uma das quinonas mais estudadas nos últimos anos. Suas aplicações mais importantes estão relacionadas às ações contra várias células tumorais. Seu derivado, nor-β-lapachona (composto 1), tem atividade anticâncer similar. Assim, o objetivo desse trabalho foi avaliar o mecanismo de ação envolvido na citotoxicidade do composto 1 e de seu derivado nitrofenilamino (composto 2) em células leucêmicas HL-60. Inicialmente foi investigado o efeito desses compostos na viabilidade de células HL-60 após 24 horas de incubação, mostrando CI50 de 2,92 e 0,48 M para os compostos 1 e 2, respectivamente. Acerca da seletividade celular, o composto 1 mostrou forte seletividade para células tumorais, enquanto que o seu derivado foi apenas parcialmente seletivo. Estudos feitos em células HL-60 indicaram que o composto 2 induz morte celular por apoptose como mostrado pelas mudanças morfológicas, fragmentação do DNA, despolarização da membrana mitocondrial e externalização da fosfatidilserina. Ambos compostos aumentaram a geração de espécies reativas de oxigênio (EROs). Nossos resultados sugerem que a introdução do radical nitrofenilamino na posição 3 do anel furano aumenta a citotoxicidade da nor-β -lapachona em células HL-60. Esses achados apontam para o potencial dessas quinonas sintéticas como modelo para a produção de novos compostos com propriedades anticâncer.
The quinone moiety has been identified as an important pharmacophoric group for cytotoxic activity of several compounds clinically used, constituting just one of the major classes of anticancer agents. β-lapachone is one of the most studied quinones in the last years. Its most important applications are related to its action against several cancer cells. Its derivative, nor-β-lapachone (compound 1), has similar anticancer activity. Thus, the aim of this work was to evaluate the mechanism of action involved in nor-β-lapachone and its nitrophenylamino derivative (compound 2) cytotoxicity in a leukemia cells model of HL-60 cell line. Initially it was investigated the effect of both the compounds on HL-60 cells viability after 24 hours of incubation, showing IC50 values of 2.92 and 0.48 M to compounds 1 and 2, respectively. Considering the selectivity, compound 1 showed strong selectivity to cancer cells, while its derivative was only partially selective. Studies performed in HL-60 cells, after 24 hours, indicated that compound 2 induces cell death by apoptosis as showed by morphological changes, DNA fragmentation, mitochondrial membrane depolarization and phosphatidylserine externalization. Both tested compounds increased generation of reactive oxygen species (ROS). Our results suggest that a nitrophenylamino radical introduction at position 3 of the furane ring enhances the cytotoxicity of nor-β -lapachone in HL-60 cell line. These findings highlight the potential of these synthetic quinones as prototypes molecules to produce new compounds with anticancer properties.
1 - Esquema das fases do ciclo celular... 16
2 - Esquema das fases da mitose... 18
3 - Esquema dos pontos de checagem do ciclo ... 19
4 - Características morfológicas dos principais tipos de morte celular... 22
5 - Esquema da via intrínsica da apoptose... 26
6 - Esquema da via extrínsica da apoptose... 27
7 - Estruturas do paclitaxel e seu análogo docetaxel... 30
8 - Estruturas da vimblastina e vindesina... 30
9 - Estruturas da camptotecina e seus derivados irinotecano e topotecano... 31
10 - Estruturas de quinonas utilizadas na terapia anticâncer... 32
11 - Estruturas dos principais grupos de quinonas (benzo-, nafto- e antraquinona)... 33
12 - Estruturas do lapachol e da β-lapachona... 34
13 - Ciclo redox das quinonas: redução de quinonas a semiquinonas e hidroquinonas... 36
14 - Estruturas da nor-β-lapachona (composto 1) e seu derivado nitrofenilamino (composto 2)... 39
15 - Efeito dos compostos 1 e 2 na viabilidade de células leucêmicas HL-60 determinado por exclusão de azul de tripan após 24 horas de incubação... 53
16 - Análises morfológicas de células HL-60 por coloração de May-Grünwald-Giemsa após 24 horas de incubação como os compostos 1 e 2... 55
19 - Efeito dos compostos 1 e 2 sobre a integridade de membrana de células leucêmicas HL-60, analisado por citometria de fluxo utilizando iodeto de propídeo, após 24 horas de incubação... 58 20 - Efeito dos compostos 1 e 2 sobre a fragmentação de DNA de células
leucêmicas de HL-60, analisado por citometria de fluxo utilizando
iodeto de propídeo, após 24 horas de
incubação... 59 21 - Efeito dos compostos 1 e 2 sobre a distribuição do ciclo celular em
células leucêmicas (HL-60) determinado por citometria de fluxo utilizando iodeto de propídeo, após 24 horas de incubação... 60 22 - Efeito dos compostos 1 e 2 sobre o potencial transmembrânico em
células leucêmicas (HL-60) determinado por citometria de fluxo utilizando rodamina 123, após 24 horas de incubação... 61 23 - Efeito dos compostos 1 e 2 sobre a externalização da fosfatidilserina
em células leucêmicas (HL-60) determinado por citometria de fluxo utilizando Anexina V-PE e 7-AAD, após 24 horas de incubação... 62 24 - Efeito dos compostos 1 e 2 sobre a geração de EROs em células
1 - Efeito dos compostos 1 e 2 na citotoxicidade de células leucêmicas (HL-60) e normais (CMSP) após 24 horas de incubação... 52 2 - Efeito dos compostos 1 e 2 sobre a incorporação do BrdU em células
APAF-1 Fator apoptótico ativado por protease
ANOVA Análise de variância
7AAD 7 amino-actinomicina
BrdU Bromodeoxiuridina
CMSP Células Mononucleares de Sangue Periférico
DAB Diaminobenzidina
DCF Diclorofluoresceina
DISC Complexo de sinalização indutor de morte
DMSO Dimetilsulfóxido
E.P.M. Erro Padrão da Média
EROs Espécies reativas de Oxigênio FADD Domínio de morte associado ao Fas
H2-DCF-DA Diacetato de 2’,7’-diclorodihidrofluoresceina IAP Inibidores de apoptose
ICAD Inibidor de DNase ativada por caspase LA/BE Laranja de Acridina/ Brometo de Etídio LMC Leucemia mielóide crônica
MTT 3-(4,5-dimetil-2-tiazol)-2,5-difenil-brometo de tetrazolium NAC N-acetil-L-cisteína
NQO1 NAD(P)H: quinona oxirredutase
PARP Poli (ADP-ribose) polimerase
PBS Phosphate Buffer Solution (Tampão Fosfato)
PE Ficoertitrina
PI Iodeto de propídeo
PMA Forbol-12-miristato-13-acetato
PS Fosfatidilserina
RPMI Roswell Parrk Memorial Institute Medium TNF Fator de necrose tumoral
TNFR Receptores do fator de necrose tumoral
U Unidade
UV Ultra-Violeta
1.1 Câncer... 16
1.2 Morte celular... 21
1.3 Produtos naturais e a importância da síntese química... 28
1.4 Quinonas... 32
2 OBJETIVOS... 38
2.1 Geral... 38
2.2 Específicos... 38
3 MATERIAIS E MÉTODOS... 39
3.1 Materiais utilizados... 39
3.2 Metodologias experimentais... 39
3.2.1 Síntese das quinonas... 39
3.2.2 Estudo da atividade citotóxica... 39
3.2.2.1 Avaliação da atividade citotóxica – Teste do MTT... 40
3.2.2.2 Avaliação da atividade citotóxica em células normais in vitro – Alamar Blue... 41
3.2.3 Estudo do mecanismo de ação em células HL-60... 42
3.2.3.1 Avaliação da atividade antiproliferativa em células leucêmicas HL-60 através da exclusão por azul de tripan... 42
3.2.3.2 Avaliação da atividade antiproliferativa através da incorporação do BrdU... 43
3.2.3.3 Análise morfológica-Coloração por May-Grünwald-Giemsa... 44
3.2.3.4 Coloração diferencial por Brometo de Etídio/Laranja de Acridina... 45
3.3 Citometria de fluxo... 46
3.3.1 Determinação da integridade de membrana celular... 46
3.3.5 Geração de Espécies Reativas de Oxigênio (EROs)
intracelulares... 49
4 RESULTADOS... 51
4.1 Citotoxicidade dos compostos 1 e 2 em células HL-60... 51
4.2 Mecanismo de ação dos compostos 1 e 2... 52
4.3 Análise das mudanças morfológicas... 54
4.4 Análise da citometria de fluxo... 57
5 DISCUSSÃO... 64
6 CONCLUSÃO... 72
REFERÊNCIAS... 73
1 INTRODUÇÃO
1.1 Câncer
A integridade contínua de todo organismo depende da habilidade de seus componentes celulares de manter a fidelidade do material genético durante a divisão celular. A principal tarefa do ciclo celular é, portanto, permitir e garantir a replicação do DNA livre de erros, a segregação cromossômica e a citocinese (FISCHER et al., 2004).
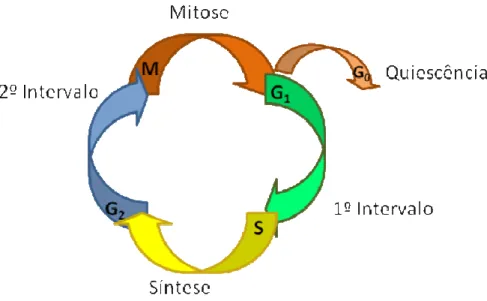
O ciclo celular é uma seqüência intrínseca de eventos que permite o crescimento e a replicação das células. É o mecanismo que governa o destino das células, interpreta os sinais de crescimento recebidos e decide se a célula deve continuar sua proliferação (FOSTER, 2008). O ciclo celular é subdividido em quatro subfases: G1, S, G2 e M (VERMEULEN et al., 2003) (Figura 1).
Figura 1: Esquema das fases do ciclo celular
As células que estiverem aptas a se replicar movem-se da fase G0 (fase de repouso) para a fase G1 do ciclo, entrando então na fase de síntese de DNA (fase S). A fase S é seguida pela fase G2, onde as células se preparam para entrar na mitose e se dividir (HARTWELL; KASTAN, 1994).
A fase G1 (primeiro intervalo) do ciclo celular precede o início da síntese de DNA (fase S). É nesta fase que proteínas e RNA são sintetizados e que ocorre a estimulação do crescimento celular ou a parada temporária (fase G0) da mesma. A decisão crítica é tomada em uma fase de transição que é chamada de ponto de restrição ou ponto R. Tendo passado o ponto de restrição no final da fase G1, a célula entrará na fase S, onde a síntese de DNA ocorre (KING et al., 1996; LOURO
et al., 2002).
Na fase de síntese (fase S), todo o DNA deve ser fidedignamente replicado. Após essa fase, uma célula pode estar pronta para entrar diretamente na fase M (mitose), no entanto, a maioria das células retarda a entrada nessa fase para um segundo intervalo (fase G2), onde o ciclo celular é interrompido para que os sistemas de reparo do DNA possam conferir e corrigir erros, excisar adutos e substituir bases erradas antes do prosseguimento do ciclo (LOURO et al., 2002; WEINBERG, 2008). Assim, os processos de reorganização geral na síntese celular ocorrem durante a fase G2, incluindo a regulação do dano não reparado do DNA (FOSTER, 2008).
Figura 2: Fases da mitose
Fonte: Adaptada de Jackson et al. (2007)
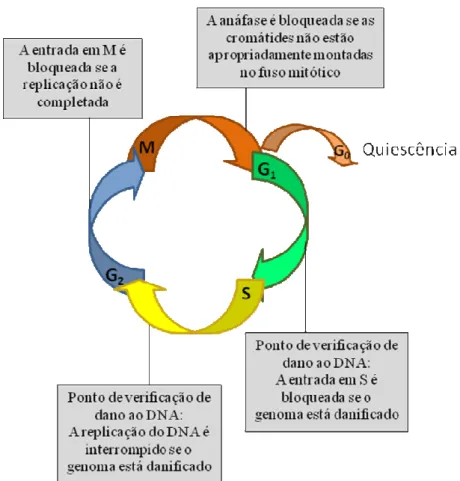
Figura 3: Esquema dos pontos de checagem do ciclo celular
A ativação de um ponto de checagem possibilitará o reparo das lesões detectadas. Caso o reparo não seja possível, o ciclo celular será interrompido ou a célula será induzida a morte (FISCHER et al., 2004).
que contribuem para o surgimento das características malignas do tumor, como auto-suficiência na sinalização de fatores de crescimento, insensibilidade aos inibidores de crescimento, evasão da morte celular programada (apoptose), potencial replicativo ilimitado, angiogênese e invasão tecidual e metástase (HANAHAN; WEINBERG, 2000; LOURO et al., 2002; FOSTER, 2008). Portanto, as células cancerosas diferem das células normais, pelo fato de continuarem a crescer e se dividir, não obedecendo ao controle biológico natural do organismo (HANAHAN; WEINBERG, 2000).
Mesmo após importantes avanços no entendimento das neoplasias, o câncer apresenta-se como a segunda causa de morte por doenças no mundo, sendo diagnosticados cerca de 10 milhões de novos casos a cada ano (SCHOTTENFELD; BEEBE-DIMMER, 2005). Nos Estados Unidos avalia-se que metade dos homens e um terço das mulheres irão desenvolver cânceres durante suas vidas (AMERICAN CANCER SOCIETY, 2007). No Brasil, as estimativas para o ano de 2009 apontam que ocorrerão cerca de 466.730 novos casos de câncer (BRASIL, 2009).
Atualmente, as terapias anticâncer mais usadas, após a cirurgia, são a quimioterapia, a radiação ionizante, a imunoterapia e a terapia gênica (KUMAR et
al., 2004). A quimioterapia consiste em um tratamento a base de fármacos que
interferem no processo de crescimento e divisão celular de células cancerígenas (SOUZA et al., 2007). O objetivo primário da quimioterapia é destruir as células neoplásicas, preservando as células normais (FULDA; DEBATIN, 2004).
Nos últimos anos, muitos pesquisadores têm focado seus estudos para compreender as alterações moleculares e genéticas responsáveis pela malignidade dos tumores. Dentre as terapias mais modernas, destaca-se a terapia-alvo. Esta tem como objetivo agir em alvos presentes somente em células tumorais, alvos estes com o papel na carcinogênese e na sobrevida dessas células (ROSA et al., 2008).
Dentre as drogas-alvo em uso clínico podemos citar o mesilato de imatinib (Glivec®), um inibidor de tirosina quinase (Bcr-Abl) que se destacou no tratamento de leucemia mielóide crônica (LMC) (DRUKER et al., 2001), e ao Trastuzumab (Herceptin®), um anticorpo monoclonal humanizado utilizado em pacientes com câncer de mama HER2 positivo (SLAMON; PEGRAM, 2001; SLAMON et al., 2001; PICCART-GEBHART et al., 2005; JOENSUU et al., 2006). Dessa maneira, o uso de quimioterápicos no tratamento antineoplásico tem como finalidade induzir a morte das células tumorais (FULDA; DEBATIN, 2004) sem, no entanto atingir as células normais, ou que, se houver algum efeito tóxico, que este seja reduzido nas células normais.
1.2 Morte celular
O equilíbrio entre a proliferação e a morte celular regula e controla o número de células no organismo. A cascata de eventos, bioquímicos e fisiológicos, que leva a mudanças na síntese de macromoléculas, na homeostase celular, na regulação do volume celular, e finalmente na perda da viabilidade celular está intimamente relacionada às mudanças morfológicas características de cada tipo de morte celular (TINARI et al., 2008).
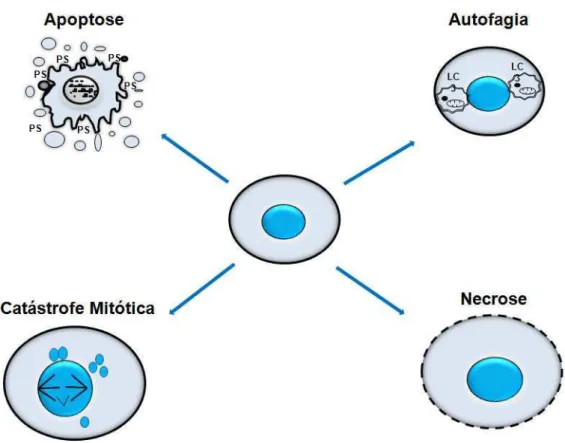
Figura 4: Características morfológicas dos principais tipos de morte celular. PS: fosfatidilserina; LC3: proteína citoplasmática que é considerada um marcador da macroautofagia.
Fonte: Bruin e Medema (2008)
A morte celular programada é uma forma geneticamente controlada de suicídio celular que é crucial para o desenvolvimento e homeostase de organismos multicelulares (KIM et al., 2006). São descritos três tipos de morte celular programada (BURSCH et al., 2000; KIM, 2005):
Tipo I: é a morte celular por apoptose, que inclui mudanças morfológicas tais como compactação celular, prolongamentos da membrana plasmática, chamados de “blebbing”, e extensiva condensação da cromatina e fragmentação internucleossomal de DNA.
Tipo II: é a morte celular por autofagia. Esta é caracterizada pela formação de vacúolos autofágicos no citoplasma de células que estão em processo de morte.
A expressão “catástrofe mitótica” tem sido utilizada para definir um processo que pode levar a morte celular. Ainda não há uma definição totalmente aceita para esse termo, no entanto alguns pesquisadores definiram catástrofe mitótica, em termos morfológicos, como um tipo de morte celular resultante de mitose aberrante, que geralmente culmina na formação de células grandes micronucleadas e cromatina descondensada (SWANSON et al., 1995; IANZINI; MACKEY, 1997; RONINSON et al., 2001).
A apoptose é caracterizada por ser uma via de morte essencial para a homeostase do organismo, sendo responsável pelo controle da população celular em tecidos específicos, nos órgãos e estruturas em formação (LOURO et al., 2002). O processo de morte na apoptose ocorre de maneira altamente controlada, permitindo a fagocitose dos componentes das células danificadas, evitando assim uma resposta imune e subseqüente processo inflamatório (VAN CRUCHTEN; VAN DEN BROECK, 2002).
O processo apoptótico é caracterizado por mudanças morfológicas típicas e bem definidas, além da formação de corpos apoptóticos que contém material nuclear e citoplasmático que são subseqüentemente fagocitados por macrófagos, não havendo assim extravasamento de material pró-inflamatório (KERR et al., 1972) (Figura 4). Dentre as mudanças bioquímicas características da apoptose estão a clivagem proteolítica por caspase (RICCI; ZONG, 2006), externalização da fosfatidilserina (PS) (FADOK et al., 1992; DENECKER et al., 2001), mudanças na permeabilidade da membrana mitocondrial com perda do potencial de membrana (KROEMER; REED, 2000; RICCI; ZONG, 2006), liberação de proteínas presentes no espaço intermembranar da mitocôndria (VAN LOO et al., 2002), dentre outras.
Há duas vias distintas de sinalização molecular que levam à morte celular por apoptose, a via intrínseca ou mitocondrial e a via extrínseca ou via do receptor de morte (NAGATA, 1997; CORY; ADAMS, 2002; DANIAL; KORSMEYER, 2004; GRIVICICH et al., 2007).
ativação de oncogenes (HENGARTNER, 2000; RICCI; ZONG, 2006; BRUIN; MEDEMA, 2008) levam à permeabilização da membrana mitocondrial externa.
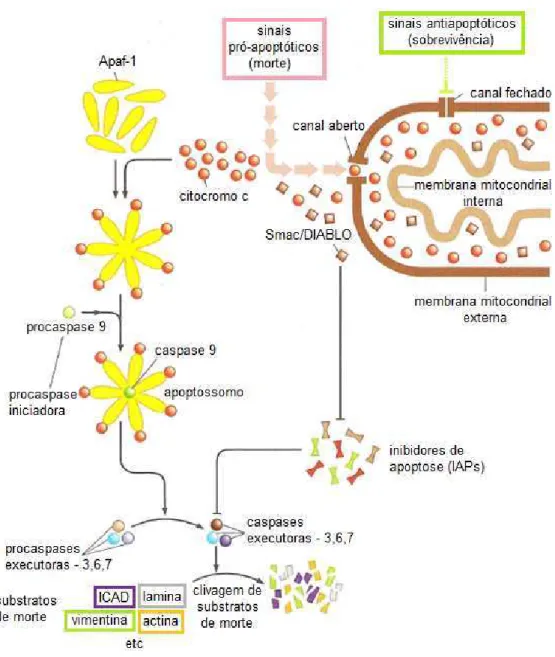
Além da função de produzir energia na forma de ATP, a mitocôndria atua em um papel crítico na regulação da morte celular por apoptose. A permeabilização da membrana mitocondrial induz a formação de poros por onde são liberadas pequenas moléculas do seu espaço intermembranar (PARONE et al., 2002; KIM et al., 2006). Essas moléculas são proteínas apoptogênicas que incluem citocromo c (LIU et al., 1996), Smac/DIABLO (DU et al., 2000), AIF (Fatores de indução de apoptose) (SUSIN et al., 1999) e endonuceases (LI et al., 2001), resultando em apoptose caspase dependente e caspase independente (DONOVAN; COTTER, 2004).
Um dos reguladores mais importantes da abertura desses poros são membros da família de proteínas Bcl-2 anti- e pró-apoptóticas, tais como Bcl-2/BclXL e Bax/Bak, respectivamente. Estas proteínas atuam na membrana externa da mitocôndria e são responsáveis pelo controle do fluxo de proteínas apoptogênicas através de canais especializados. Esses canais regulam a saída do citocromo c bem como de outras proteínas que são liberadas da mitocôndria para o citosol (ROSSÉ
et al., 1998; WEINBERG, 2008). O citocromo c fica aprisionado no espaço
intermembranar da mitocôndria, onde atua na transferência de elétrons como parte da fosforilação oxidativa (HIRSCH et al., 1997; WEINBERG, 2008).
Durante o processo de apoptose, as moléculas de citocromo c são liberadas para o citosol (HIRSCH et al., 1997) onde se associa a proteína Apaf-1 (fator apoptótico ativado por protease), ATP e a procaspase 9 para formar um complexo denominado apoptossomo (LI et al., 1997; BUDIHARDJO et al., 1999; ACEHAN et
al., 2002). Diferente das outras caspases, a procaspase 9 não é ativada por uma
que leva as conhecidas mudanças morfológicas da apoptose ocorrendo a morte celular (Figura 5) (LI et al., 1997; REED, 1997; WEINBERG, 2008).
Figura 5: Esquema da via intrínseca da apoptose. Fonte: Weinberg (2008)
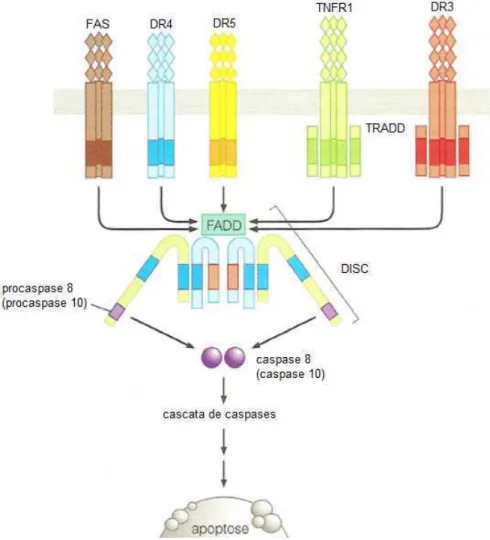
A via extrínseca é induzida por receptores de morte que estão localizados na superfície da célula (VAN CRUCHTEN; VAN DEN BROECK, 2002). Tais receptores de morte pertencem a família dos receptores do fator de necrose tumoral (TNFR) que incluem Fas, TNFR1, DR3, DR4 e DR5 (Figura 7) (LOCKSLEY et al., 2001) e estão envolvidos na transdução de sinais que resultam na morte celular (ZIMMERMANN et al., 2001).
vez ativados pela ligação de seus ligantes, os domínios de morte desses receptores ligam-se e ativam uma proteína associada denominada FADD (domínio de morte associado à Fas) no citoplasma (CHINNAIYAN et al., 1995; CHINNAIYAN et al., 1996). O complexo resultante é chamado DISC (complexo de sinalização indutor de morte) que atua na conversão das procaspases iniciadoras (8 e/ou 10) em suas respectivas caspases ativas através de clivagem autoproteolítica (Figura 6) (DONEPUDI et al., 2003; WEINBERG, 2008). Após ativação das procaspases 8 e /ou 10 em suas caspases ativas, estas últimas convergem na cascata apoptótica intrínseca clivando e ativando as caspases executoras (3, 6 e 7) culminando assim com morte celular por apoptose (BUDIHARDJO et al., 1999; WEINBERG, 2008).
Figura 6: Esquema da via extrínseca da apoptose Fonte: Weinberg (2008)
recentes sugerem que a necrose também pode ocorrer através de uma morte celular programada (BURSCH et al., 2000; KIM, 2005). Esse processo constitui uma forma de morte celular passiva e independente de energia (PROSKURYAKOV et al., 2003). Os marcos desse tipo de morte envolve alterações dramáticas na mitocôndria, incluindo despolarização mitocondrial, depleção de ATP, geração de EROs (espécies reativas de oxigênio), perda da homeostase de cálcio, além de causar vacuolização citoplasmática, perda de integridade da membrana, inchaço da célula seguido de lise completa, sem formações de vesículas, e desintegração das organelas. O rompimento brusco da membrana plasmática causa extravasamento de mediadores inflamatórios como citocinas e pirógenos desencadeando o processo inflamatório (LOURO et al., 2002; RODRIGUES et al., 2006; ZONG; THOMPSON, 2006). A necrose não é observada durante o processo normal de eliminação celular, que ocorre durante o desenvolvimento e a homeostase de tecidos normais (SCHWARTZ; OSBORNE, 1993). A necrose ocorre tipicamente em grupos de células adjacentes expostas as mesmas condições não fisiológicas, levando a uma amplificação da lesão ao tecido afetado (DUVALL; WYLLIE, 1986).
Zong e Thompson (2006) sugeriram que algumas formas de necrose não são processos passivos, mas uma via bastante regulada, semelhante a apoptose. Esse tipo de necrose estaria presente nas doenças neurodegenerativas, doenças inflamatórias, infecções e câncer, bem como em outros processos. Dentre as características morfológicas da necrose programada estão a despolarização mitocondrial, ativação de proteases (não-caspase), perda da homeostase de cálcio, depleção de ATP e geração de espécies reativas de oxigênio (EROs).
1.3 Produtos naturais e a importância da síntese química
espécies de plantas que tinham sido usadas no tratamento de cânceres (HARTWELL, 1982).
A importância da diversidade química dos produtos naturais e seus derivados para a descoberta de novos fármacos têm despertado interesse da indústria farmacêutica. Em 2005, a Sociedade Americana de Química destacou uma lista de 46 fármacos que tiveram um enorme impacto na saúde, onde, dentre estas 80% são compostos sintéticos, que vão desde a aspirina (ácido acetil salicílico), com estrutura química simples, sendo o analgésico mais utilizado no mundo, ao taxol (paclitaxel) com estrutura química complexa, usado no tratamento de neoplasias, entre outros (DAEMMRICH; BOWDEN, 2005).
Figura 7: Estrutura do paclitaxel e seu análogo docetaxel
De fato, o melhor impacto de compostos isolados de plantas como protótipo para novas drogas é percebido na área do tratamento de neoplasias (NEWMAN et
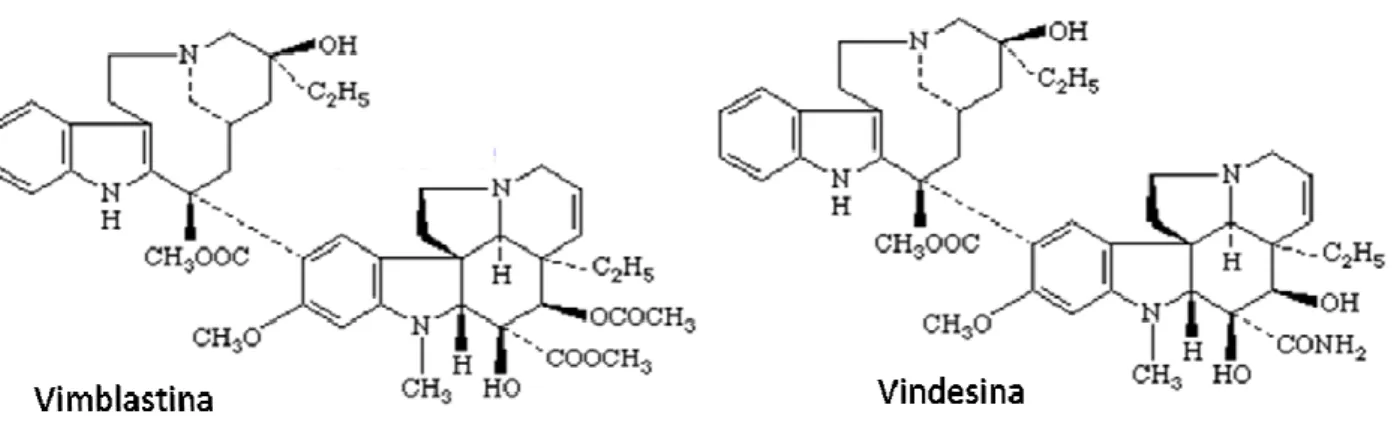
al., 2003). Neste aspecto, pode-se citar além do paclitaxel, a vimblastina e vincristina
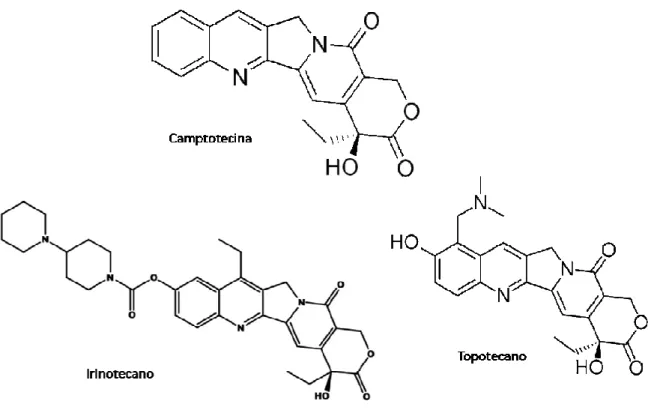
(Catharanhtus roseus G. Don) com o análogo vinorelbina e vindesina (Figura 8) (JOHNSON et al., 1996), Camptotecina (Camptotheca acuminata Decne) com os análogos irinotecano e topotecano (Figura 9), entre outros, todos usados no tratamento de diferentes tipos de câncer (SCHWARTSMANN et al., 2002). O sucesso terapêutico dessas substâncias estimula a procura de novos agentes quimioterápicos derivados de produtos naturais mais ativos e com menos efeitos colaterais. Assim, há uma maior probabilidade de se encontrar uma droga promissora no âmbito terapêutico e/ou preventivo do câncer.
Figura 9: Estruturas da camptotecina e dos derivados irinotecano e topotecano
Figura 10: Estruturas quinonas utilizadas na terapia anticâncer
1.4 Quinonas
As quinonas representam uma importante classe de compostos de ocorrência natural ou produto de síntese com uma grande variedade de funções (THOMSON, 1987; ASCHE, 2005). O esqueleto quinona foi identificado como um importante grupo farmacofórico para a atividade citotóxica de vários compostos utilizados na clínica (DRISCOLL et al., 1974; LIU et al., 2004), constituindo ainda uma das maiores classes de agentes anti-tumorais (ASCHE, 2005).
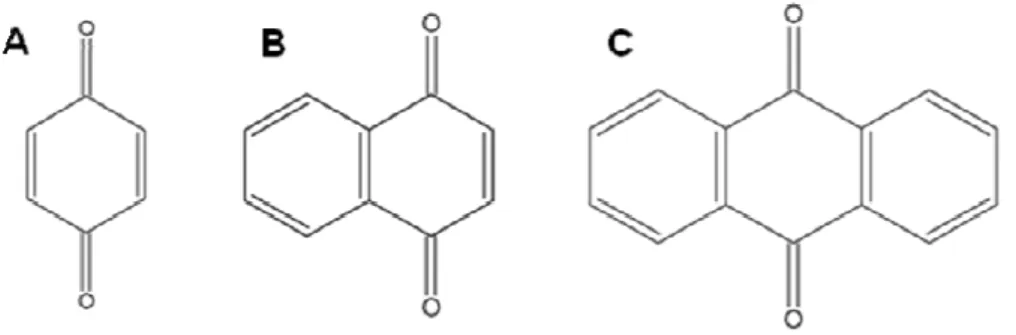
naftoquinonas - um anel naftalênico; antraquinonas - um anel antracênico (Figura 11) (SIMÕES et al., 2002).
Figura 11: Estruturas dos principais grupos de quinonas: benzoquinona (A), naftoquinona (B) e antraquinona (C)
As quinonas representam uma ampla e variada família de metabólitos de distribuição natural. Em estudos farmacológicos, as quinonas mostram variadas atividades destacando-se, dentre outras, as propriedades microbicidas, anti-inflamatórias e antitumorais (MONKS et al., 1992).
Drogas que possuem um grupamento quinona tais como antraquinonas e mitoxantronas apresentam uma excelente atividade anti-neoplásica na clínica oncológica, sendo bastante aceito que a citotoxicidade de quinonas esteja relacionada à geração de espécies reativas de oxigênio, além da inibição da enzima topoisomerase-II, levando a quebra da molécula de DNA (MATES; SÁNCHEZ-JIMÉNEZ, 2000). No entanto, a contribuição exata da subestrutura quinona para seu efeito antitumoral permanece incerta (ASCHE, 2005).
O lapachol e seus derivados estão associadas com numerosas atividades biológicas como bactericida, fungicida, anti-malária, tripanossomicida e antitumoral (GUIRAUD et al., 1994; de ANDRADE-NETO et al., 2004; RAVELO et al., 2004; FERREIRA et al., 2006).
atividades antibacteriana, antifúngica, tripanossomicida, anti-retroviral e antiinflamatória (LOPES et al., 1978; SCHUERCH; WEHRLI, 1978; GOIJMAN; STOPPANI, 1985; GUIRAUD et al., 1994; MANNA et al., 1999). Além disso, a β -lapachona é um potente agente anticâncer, sendo efetivo contra uma variedade de células tumorais humanas (SCHAFFNER-SABBA, 1984; PLANCHON et al., 1995; 2001; LI et al., 1999a, PINK et al., 2000a, 2000b), inibindo até mesmo tumores resistentes a terapias convencionais (LI et al., 1995; PLANCHON et al., 1995; OUGH
et al., 2005).
Figura 12: Estruturas do lapachol e da β-lapachona.
O mecanismo exato do efeito citotóxico desse composto permanece desconhecido, no entanto, alguns estudos mostraram que a β-lapachona causa parada em fases específicas do ciclo celular podendo levar à apoptose (LI et al., 1993; PLANCHON et al., 1995; LI et al., 1995; LI et al., 1999b) ou à necrose (LI et
al., 1999b) dependendo da célula alvo, tempo e da dose testada (WELLER et al.,
1997). O processo de morte induzido por esta quinona é independente de dano direto ao DNA (PARDEE et al., 2002).
poli (ADP-ribose) polimerase (PARP) e caspase 3 e aumentar a atividade proteolítica da procaspase 9 (GUPTA et al., 2002).
A geração de EROs intracelular é um processo inevitável e muitas vezes fisiologicamente importantes (SKULACHEV, 1996). As EROs podem ser produzidas durante a respiração celular na mitocôndria e por sistemas enzimáticos distintos, incluindo aquelas dos peroxissomos e a oxidação espontânea de lipídeos (KAMATA; HIRATA, 1999; WEINBERG, 2008). Dentre as EROs liberadas da mitocôndria estão o íon superóxido (O2 •–), o oxigênio singlet, o peróxido de hidrogênio (H2O2) e radicais hidroxilas (•OH) (WEINBERG, 2008).
As EROs possuem papéis bastante controversos. Em situações de não estresse elas atuam promovendo a proliferação celular, no entanto, na presença de estresse, parecem ativar e modular a morte celular via apoptose e/ou necrose. Segundo Jabs (1999), os níveis de EROs são aumentados em células expostas a situações de estresse, incluindo o tratamento com drogas anticâncer que irão promover a ativação de proteínas pró-apoptóticas, induzindo a morte celular (BENHAR et al., 2001; DAVIS et al., 2001; TOBIUME et al., 2001). As Eros também podem atuar diretamente na maquinaria apoptótica por acelerar a despolarização mitocondrial e disfunção durante a fase efetora da apoptose (JABS, 1999). Assim, a mitocôndria é a maior fonte de EROs durante o curso da apoptose (CAI; JONES, 1999).
A enzima NAD(P)H: quinona oxirredutase (NQO1), uma flavoproteína encontrada na maioria das células eucarióticas, é também chave para a ação da β -lapachona (PINK et al., 2000b). A NQO1 catalisa uma redução de dois elétrons de quinonas, como β-lapachona ou menadiona, usando ou NADH ou NADPH como doador de elétrons. As quinonas são diretamente reduzidas a hidroquinonas pelo NQO1, evitando o seu estado intermediário (instável e altamente reativo) de semiquinona (Figura 13). As semiquinonas são excelentes geradores de radicais livres, iniciando o ciclo redox que resulta na geração de superóxidos (PINK et al., 2000a, 2000b). A redução da β-lapachona pela NQO1 aumenta sua ação citotóxica, incluindo inibição do crescimento e apoptose. Essa enzima é superexpressa em tumores de mama, cólon, pulmão e próstata (MALKINSON et al., 1992; MARIN et al., 1997; OUGH et al., 2005) o que torna o grupo quinona assim como seus derivados, potentes agentes terapêuticos para esses tipos de tumores (ASHWELL et al., 2006). Entretanto, esse mecanismo não parece ser exclusivo visto que também é observado a indução de apoptose pela β-lapachona em células deficientes em NQO1, como células HL-60 e MDA-MB-468 (PINK et al., 2000b). Com isso, tem sido sugerido que a atividade antitumoral da β-lapachona está relacionada a diferentes mecanismos de ação dependendo do tipo de célula estudada.
Substâncias que promovam o estresse oxidativo produzindo EROs diretamente nas células, inibindo o aparato antioxidativo (KONG; LILLEHEI, 1998), causando desequilíbrio no estado redox intracelular ou atuando como catalisadores na toxicidade das EROs (FRY; JACOB, 2006) são bons candidatos para o tratamento do câncer (HILLARD et al., 2008).
É sabido que a grande maioria dos quimioterápicos usados na prática clínica, não possui especificidade para as células tumorais, levando a toxicidade também para as células normais. As células com alta taxa de proliferação como as das mucosas e cabelo, são uma das células mais prejudicadas, desencadeando efeitos colaterais como mucosite e alopecia. Assim, a indústria farmacêutica procura cada vez mais fármacos que sejam mais eficazes e mais seletivos. A β-lapachona, diferente de muitas drogas utilizadas na quimioterapia convencional, induz apoptose em células transformadas, mas não em células com taxa de proliferação normal (CHAU et al., 1998; LI et al., 2003). No entanto, apesar da grande seletividade desse composto para células tumorais, estudos mostraram que a dose máxima tolerada, quando administrada via oral diariamente por um mês, é de 200mg/kg em ratos e 100mg/kg em cachorros. Em doses mais elevadas, a β-lapachona causa ulceração gástrica e perda de eritrócitos, mas sem sinais de supressão da medula óssea (LI et
al., 1995).
Nesse âmbito, a remodelagem de compostos a partir da β-lapachona pode aumentar a eficácia dessa classe de compostos e diminuir os seus efeitos adversos. A nor-β-lapachona (composto 1) é um derivado da β-lapachona que mostrou citotoxicidade em algumas linhagens de carcinoma humano, com CI50 variando de 2 a 2,5 µM (KONGKATHIP et al., 2003). Já o seu derivado nitrofenilamino (composto 2) foi anteriormente descrito como um composto com forte atividade citotóxica contra várias linhagens de células tumorais, após 72 h de incubação, apresentando CI50 abaixo de 1µg/mL (da SILVA Jr et al., 2007).
2 OBJETIVOS
2.1 Objetivo Geral
O objetivo desse trabalho foi avaliar as propriedades citotóxicas e possíveis mecanismo de ação da 2,2-dimetil-3-(3-nitrofenilamino)-2,3-di-hidronafto [1,2-b] furan-4,5-diona (composto 2) e de seu protótipo, nor-β-lapachona (composto 1) em células leucêmicas humanas (HL-60), visando avaliar o mecanismo de ação.
2.2 Objetivos Específicos
Determinar o potencial citotóxico in vitro dos compostos 1 e 2 em linhagem leucêmica humana (HL-60) após 24 horas de exposição;
Determinar a seletividade dos compostos 1 e 2 utilizando células mononucleares de sangue periférico de voluntários saudáveis;
3 MATERIAIS E MÉTODOS
3.1 Materiais utilizados
Os equipamentos, soluções, reagentes e fármacos utilizados estão listados no anexo A.
3.2 Metodologia Experimental
3.2.1 Síntese das quinonas
O derivado nitrofenilamino da nor-β-lapachona (composto 2) foi sintetizado (da SILVA Jr et al., 2007) e cedido pelo Prof. Dr. Vítor Francisco Ferreira da Universidade Federal Fluminense e seu aluno Eufrânio Nunes da Silva Júnior, em colaboração com a Profa. Dra Marília Oliveira Fonseca Goulart da Universidade Federal de Alagoas. As amostras foram mantidas a - 20ºC em soluções estoque de DMSO a 1mg/mL.
Figure 14: Estruturas dos compostos estudados: (1): 2,3-dihidro-2,2-dimetilnafto [1,2-b] furan- 4,5-diona (nor-β-lapachona) e (2): 2,2-dimetil-3-(3-nitrofenilamino)-2,3-di-hidronafto [1,2-b] furan-4,5-diona.
3.2.2 Estudo da atividade citotóxica
Cultivo da Linhagem tumoral
Células leucêmicas (HL-60) foram cultivadas em frascos plásticos para cultura (Corning, 75 cm2, volume de 250 mL para células em suspensão); utilizando o meio de cultura RPMI 1640 suplementado com 10% de soro fetal bovino e 1% de antibióticos (penicilina/estreptomicina). As células foram incubadas em estufa a 37°C
com atmosfera de 5% de CO2, seguido da observação do crescimento celular com ajuda de microscópio de inversão a cada 24 horas (BUTLER; DAWSON, 1992). 3.2.2.1 Avaliação da atividade antiproliferativa em linhagens de células tumorais in
vitro - Teste do MTT
Princípio do Teste
O ensaio consiste em uma análise colorimétrica baseada na conversão do sal 3-(4,5-dimetil-2-tiazol)-2,5-difenil-2-H-brometo de tetrazólio (MTT) para formazan, pela atividade da enzima succinil-desidrogenase presente na mitocôndria da célula viável (MOSMANN, 1983), permitindo, dessa maneira, quantificar a porcentagem de células vivas.
Procedimento Experimental
As células foram distribuídas em multiplacas de 96 cavidades numa densidade de 3 x 105 células/mL. As substâncias testes (0,009 – 5 g/mL) foram incubadas durante 21 horas juntamente com a suspensão de células. Após o período de incubação, as placas foram centrifugadas (1500 rpm/15 min), e o sobrenadante foi descartado. Cada cavidade recebeu 150 µL da solução de MTT (10% em meio RPMI 1640) e foi reincubada durante 3 horas, em estufa a 37°C e a 5% CO2. Após esse período, as placas foram novamente centrifugadas (3000 rpm/10 min), o sobrenadante foi desprezado, e o precipitado foi ressuspendido em 150µL de DMSO para a quantificação do sal reduzido nas células vivas. As absorbâncias foram lidas com o auxílio do espectrofotômetro de placa, no comprimento de onda de 595 nm.
Análise dos Dados
3.2.2.2 Avaliação da atividade antiproliferativa em células mononucleares de sangue humano periférico (CMSP) – Ensaio do Alamar Blue
Princípio do Teste
Com o objetivo de estudar a seletividade dos compostos em estudo na proliferação de células normais, o ensaio do alamar blue foi realizado com célula mononucleares de sangue periférico (CMSP), que inclui linfócitos e monócitos. O alamar blue, recentemente identificado como resazurina (O'BRIEN et al., 2000), é um indicador fluorescente/colorimétrico, onde em sua forma oxidada apresenta uma coloração azul (não fluorescente/célula não viável) e em sua forma reduzida uma coloração rósea (fluorescente/célula viável). Assim como o MTT, o alamar blue reduz-se em células vivas, e assim pode ser quantificado e utilizado para avaliar a viabilidade celular (AHMED et al., 1994).
Procedimento Experimental
Análise dos Dados
A proliferação celular foi calculada utilizando a seguinte fórmula: % proliferação = ALW – (AHW x R0) x 100. Onde, ALW e AHW são as absorbâncias no menor e maior comprimento de onda, respectivamente. O R0 foi calculado utilizando a seguinte fórmula: R0=AOLW/AOHW. Onde, AOLW e AOHW são as absorbâncias do meio adicionado ao alamar blue subtraído das absorbâncias do meio isolado nos comprimentos de onda menor e maior, respectivamente. A absorbância foi medida usando um leitor de multiplacas (DTX 880 Multimode Detector, Beckman Coulter, Inc. Fullerton, Califórnia, EUA). O efeito da droga foi quantificado como a porcentagem da absorbância controle a 570 nm e a 595 nm. Os compostos foram testados em diluição seriada, em duplicata ou triplicata, e suas CI50 (concentração inibitória média capaz de provocar 50% do efeito máximo) e respectivos intervalos de confiança de 95% (IC 95%) foram determinados a partir de regressão não-linear utilizando o programa Prism versão 5.0 (GraphPad Software).
3.2.3 Estudo do Mecanismo de Ação em células leucêmicas (HL-60)
Células da linhagem HL-60, na concentração de 3 x 105 células/mL, foram incubadas por 24 horas e examinadas ao microscópio óptico de inversão. As concentrações das drogas utilizadas foram estimadas a partir do valor da CI50 do composto 2 encontrada no método do MTT para esta mesma linhagem celular após incubação por 24 horas. Assim as concentrações escolhidas foram de 1,0 e 2,0 µM para a nor-β-lapachona (composto 1) e 0,5; 1,0; 2,0 µM para o composto 2. Os grupos do controle negativo receberam a mesma quantidade de DMSO. A doxorrubicina (0,5 µM) foi utilizada como controle positivo (VERAS et al, 2004). 3.2.3.1 Teste de citotoxicidade in vitro – Viabilidade celular por Exclusão do azul de tripan
Princípio do Teste
para fora, sendo possível dessa maneira, observar uma coloração azulada nas células metabolicamente inativas (PERES; CURI, 2005).
Procedimento Experimental
A uma alíquota de 90 L da suspensão de células foi adicionado 10 L do corante azul de tripan (0,4%). As células viáveis e as não viáveis foram diferenciadas e contadas em câmara de Newbauer, contando-se as células de dois quadrantes diagonalmente opostos. A Doxorrubicina (0,5 M) foi usada como controle positivo (VERAS et al., 2004).
Análise dos Dados
Os dados foram analisados a partir da média e do erro padrão da média de 3 experimentos. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida do teste de Dunnet, com nível de significância de 5% (p<0,05).
3.2.3.2 Ensaio antiproliferativo - Incorporação do BrdU
Princípio do Teste
A bromodeoxiuridina (BrdU) é uma base nitrogenada análoga a timina. Assim, quando as células estão sintetizando seu DNA, o BrdU é incorporado no lugar da timina. A detecção do BrdU incorporado nas células é feita por técnicas imunohistoquímicas (PERA et al., 1977).
Procedimento Experimental
primário por 120 minutos em estufa bacteriológica em câmara úmida. As células foram incubadas com anticorpo secundário biotinado por 20 minutos e, em seguida, com a solução de estreptavidina-fluoresceína por mais 20 minutos. Foi adicionado o cromógeno diaminobenzidina (DAB) por aproximadamente 1minuto e em seguida, removido com água destilada. A contracoloração foi realizada com hematoxilina de Harrys a 0,1% (PERA et al., 1977).
Análise dos Dados
Duzentas células foram contadas, diferenciando-as entre núcleo marrom (incorporaram o BrdU) e não-marrom (não incorporam o BrdU). Os dados foram expressos como da média ± E.P.M. de experimentos independentes (n = 2). A proporção de células marcadas em marrom e não-marcadas entre os diferentes grupos foi comparada pelo teste ANOVA com nível de significância de 5 % (p < 0,05) usando o programa GraphPad (Intuitive Software for Science, San Diego, CA).
3.2.3.3 Análise morfológica - Coloração por May-Grünwald-Giemsa
Princípio do Teste
A coloração utilizada nesse experimento se baseia em interações eletrostáticas entre os corantes e moléculas-alvo. Essa coloração possui azul de metileno (corante básico), eosina (corante ácido), entre outros componentes básicos que permite distinguir o citoplasma e o núcleo, sendo possível analisar a célula quanto a sua integridade nuclear, bem como alterações no citoplasma. Essa técnica é bastante indicada para estudo do padrão de morte celular (apoptose/necrose).
Procedimento Experimental
Análise dos Dados
As lâminas contendo as células coradas foram levadas ao microscópio para avaliação das suas características morfológicas e comparadas ao controle (não-tratadas). O registro das alterações celulares foi feito por fotografia em microscopia óptica.
3.2.3.4 Análise morfológica – Coloração diferencial por Laranja de Acridina / Brometo de Etídio
Princípio do Teste
O método de contagem diferencial laranja de acridina /brometo de etídio permite diferenciar células viáveis daquelas em processo de morte por apoptose ou necrose através da contagem diferencial por fluorescência com base em alterações morfológicas nucleares e citoplasmáticas (MCGAHON et al., 1995). Este método baseia-se na revelação das células (controle e tratadas) com a coloração por brometo de etídio (BE) e laranja de acridina (LA) no núcleo. A LA intercala-se ao DNA, conferindo aparência verde ao núcleo celular, sendo capaz de atravessar membranas intactas. O brometo de etídio é incorporado majoritariamente por células não viáveis (com instabilidade de membrana), intercalando-se ao DNA corando-o de laranja; ligando-se fracamente ao RNA, que se mostrará com uma coloração vermelha. As células viáveis com membrana intacta apresentam núcleo uniformemente corado de verde pela LA. O BE marca muito fracamente e às vezes não marca, pois não atravessa a membrana íntegra. As células em apoptose inicial (membrana ainda intacta) apresentam manchas verdes brilhantes no núcleo (condensação da cromatina) e não são marcadas por BE. Podem ser observadas as alterações da membrana em decorrência da formação de corpúsculos apoptóticos. As células em necrose (lesão na membrana) apresentaram um padrão de coloração uniforme, laranja-avermelhada e não há formação de corpos apoptóticos (CURY-BOAVENTURA et al., 2003).
Procedimento Experimental
sobrenadante foi descartado e as células foram ressuspendidas em 20 L de solução de PBS. Em seguida, 1 L da solução de LA/BE foi adicionado a cada tubo e uma alíquota dessas células foi transferida para uma lâmina e montado com lamínula para, em seguida, ser contada considerando cada evento celular de interesse (GENG et al., 2003).
Análise dos Dados
Foram contadas 300 (trezentas) células, em duplicata, cada amostra para quantificação percentual de cada evento celular (viáveis, necróticas e apoptóticas). As lâminas foram montadas e fotografadas para registro visual dos efeitos. Para verificação de ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida por teste de Dunnett (p<0,05).
3.3 Citometria de Fluxo
A citometria de fluxo é uma técnica utilizada para se determinar diferentes características das partículas biológicas. Os citômetros analisam as células ou partículas em meio líquido que passam através de uma fonte de luz. O desvio da luz, que está relacionado diretamente com a estrutura e morfologia das células, e a fluorescência são determinados para cada partícula que passa pela fonte de excitação. Após a aquisição do desvio da luz e fluorescência de cada partícula, a informação resultante pode ser analisada utilizando-se um computador com programa específico acoplado ao citômetro (SHAPIRO, 1995).
Para todos os compostos testados, cinco mil eventos foram avaliados por experimento e os debris celulares foram omitidos da análise. A fluorescência de células de HL-60 foram então determinadas por citômetro de fluxo Guava EasyCyte Mine usando o software Guava Express Plus após 24 horas de incubação. Cinco mil eventos foram analisados para cada replicata em três experimentos independentes. 3.3.1 Determinação da integridade da membrana celular - viabilidade celular
O teste baseia-se na capacidade do iodeto de propídeo penetrar nas células cuja membrana esteja rompida e após a ligação ao DNA emitir alta fluorescência quando é excitado pelo laser. As células com membrana íntegra emitem baixa fluorescência (SHAPIRO, 1995).
Procedimento Experimental
Uma alíquota de 100µL de suspensão de células tratadas e não tratadas foi incubada com 100µL de uma solução de PI a 50µg/mL (diluído em tampão fosfato). Após 5 minutos as amostras foram analisadas por citometria de fluxo. Foram obtidas informações sobre morfologia celular (espalhamento frontal e lateral da luz, o que corresponde ao tamanho e granulosidade relativa entre as células, respectivamente) e integridade de membrana utilizando-se o filtro para o espectro do vermelho (DARZYNKIEWICZ et al., 1992).
3.3.2 Análise do ciclo celular e da fragmentação do DNA por citometria de fluxo
Princípio do Teste
Esse teste baseia-se na capacidade do iodeto de propídeo ligar-se ao DNA. Inicialmente a membrana plasmática das células foram lisadas por um detergente, permitindo que o iodeto de propídeo (PI) ligue-se ao DNA de todas as células. Células com o DNA íntegro emitirão alta fluorescência, já núcleos com condensação da cromatina e DNA fragmentado incorporam menos PI e por isso emitem menor fluorescência, sugestivo de apoptose. Além disso, o PI consegue intercalar proporcionalmente a quantidade de DNA da célula, podendo então mensurar as fases do ciclo celular, através da quantidade de DNA presente em cada fase do ciclo celular.
Procedimento Experimental
3.3.3 Determinação do potencial transmembrânico da mitocôndria por citometria de fluxo
Princípio do Teste
Esse teste baseia-se na capacidade da mitocôndria seqüestrar um corante fluorescente, rodamina 123. Quando esta organela apresenta potencial transmembrânico inalterado, as células que seqüestraram a rodamina emitem alta fluorescência quando atingidas pelo laser. Alterações no potencial mitocondrial transmembrânico levam ao efluxo da rodamina de dentro da mitocôndria, gerando eventos que emitirão menor fluorescência comparado com as células que possuem mitocôndrias normais.
Procedimento Experimental
Uma alíquota de 100µL de suspensão de células tratadas e não tratadas foi incubada com 200µL de uma solução de solução de rodamina 1 g/mL. Após 15 minutos de incubação no escuro, as amostras foram centrifugadas a 2000rpm/5min. O sobrenadante foi então descartado e 100 µL de PBS foi adicionado em cada amostra. Após um período de 30 minutos incubadas no escuro, as amostras foram analisadas no citômetro de fluxo (CURY-BOAVENTURA et al., 2004).
Análise dos dados
Os dados foram analisados a partir da média e do erro padrão da média de 3 experimentos independentes. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida por Teste de Dunnet, com nível de significância de 5% (p < 0,05).
3.3.4 Determinação da Externalização da Fosfatidilserina – Anexina V
Princípio do Teste
PS ainda continua como um processo não totalmente conhecido, mas sabe-se que a externalização da fosfatidilserina funciona como um sinal da célula para que os macrófagos as fagocitem, antes da perda da integridade da membrana celular (VERMES et al., 1995).
Procedimento Experimental
A externalização da fosfatidilserina foi analisada por citometria de fluxo após coloração da fosfatidilserina com a anexina V (VERMES et al., 1995). Foi utilizado o kit Guava Nexin para determinar apoptose inicial e tardia. Células foram lavadas duas vezes com PBS gelado e ressuspendidas em 135 L de PBS com 5 L de 7-amino-actinomicina (7AAD) e 10 L de anexina V conjugada com ficoeritrina (PE). As células foram gentilmente agitadas e incubadas por 20 minutos em temperatura ambiente (20–25°C) no escuro. Posteriormente, as células foram analisadas por citometria de fluxo (EasyCyte/Guava Technologies). Anexina V é uma proteína ligada a um fosfolipídio que tem alta afinidade por PS. 7AAD, é um corante hidrofílico impermeável em células intactas, e é utilizado como um indicador da integridade da membrana celular. A fluorescência da anexina V conjugada com a ficoeritrina foi mensurada por fluorescência amarela-583nm e o 7AAD na fluorescência vermelha a 680nm. A percentagem de células viáveis e de células apoptóticas inicial e tardia foi calculada.
Análise dos Dados
Os dados foram analisados a partir da média e do erro padrão da média de 2 experimentos realizados em triplicata. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida por Teste de Dunnett, com nível de significância de 5% (p < 0,05).
3.3.5 Determinação da geração de espécies reativas de oxigênio intracelulares
Princípio do Teste
produto altamente fluorescente denominado de diclorofluoresceína (DCF) na presença de espécies reativas de oxigênio intracelulares (LEBEL et al., 1992).
Procedimento Experimental
No final do tratamento de 1 e 3 horas com as amostras teste, as células foram incubadas a 20 µM de H2-DCF-DA e mantidas a 37°C por 30 minutos no escuro. Após terminar o período total de incubação as células foram centrifugadas por duas vezes, lavadas e ressuspendidas em tampão PBS e analisadas imediatamente utilizando citometria de fluxo com comprimento de onda de excitação e emissão de 490 e 530 nm, respectivamente. PMA (Forbol-12-miristato-13-acetato) foi utilizado como controle positivo.
Análise dos dados
4 RESULTADOS
4.1 Atividade citotóxica da nor-β-lapachona (composto 1) e seu derivado nitrofenilamino (composto 2) pelo ensaio do MTT e ensaio de seletividade pelo método do Alamar blue
Inicialmente, foi determinado o efeito citotóxico dos compostos 1 e 2 sobre o crescimento de células leucêmicas (HL-60) e em células mononucleares de sangue periférico de voluntários saudáveis. Os valores de CI50, determinados após 24 horas de exposição com as substâncias estão representados na tabela 1.
Como apresentado na tabela 1, ambos os compostos testados exibiram forte efeito inibitório na proliferação das células HL-60 após 24 horas de incubação. Baseado nos dados obtidos de dois experimentos independentes realizados em duplicata, os valores de CI50 dos compostos 1 e 2 foram de 2,92 µM e 0,48 µM, respectivamente (Tabela 1). Esses dados mostram que a adição do radical nitrofenilamino na posição três do anel furano da nor-β-lapachona aumentou o efeito citotóxico sobre células HL-60.
Tabela 1: Efeito da nor-β-lapachona (composto 1) e do seu derivado nitrofenilamino (composto 2) na citotoxicidade de células leucêmicas (HL-60) e normais (CMSP) após 24 horas de incubação, respectivamente.
MTT (HL-60)
Alamar blue (CMSP) Compostos
CI50 µµµµg/mL (µµµµM) CI50 µµµµg/mL (µµµµM)
Composto 1 0,84 (2,92)
(0,73 - 0,97) > 5 (17,38)
Composto 2 0,17 (0,48)
(0,15 - 0,20)
1,07 (3,02) (0,88 – 1,31)
Doxorrubicina 0,3 (0,5)
(0,2 - 0,4) > 5 (8,3)
Nota: Os resultados são apresentados em valores de CI50 com um intervalo de confiança de 95%
obtido por regressão não-linear a partir de três experimentos independentes, feitos em duplicata.
4.2 Mecanismo de ação envolvido na citotoxicidade dos compostos 1 e 2
A fim de investigar os possíveis mecanismos envolvidos na citotoxicidade dos compostos 1 e 2, células HL-60 foram utilizadas como modelo. As concentrações testadas foram baseadas nos valores de CI50 do composto 2 após 24 horas de incubação. A doxorrubicina, na concentração de 0,5 µM, foi utilizada como controle positivo.
4.2.1 Viabilidade celular pelo método de exclusão por azul de tripan
0 20 40 60 80
Composto 1 Composto 2
*
*
*
*
*
(µµµµM)
Células viáveis Células não viáveis
Controle Dox 1,0 2,0 0,5 1,0 2,0
N ú m e ro d e c é lu la s (x 1 0 4 c é ls /m L )
Figura 15: Efeito da nor-β-lapachona (composto 1) e do seu derivado nitrofenilamino (composto 2) na viabilidade de células leucêmicas HL-60 determinado por exclusão de azul de tripan depois de 24 horas de incubação. O controle negativo (Controle) foi tratado apenas com o veículo utilizado para a diluição da substância (DMSO). A doxorrubicina (0,5 µM) foi utilizada como controle positivo (Dox). Os dados correspondem a média ± E.P.M. de experimentos independentes (n = 3). *p < 0,05 comparado ao controle por ANOVA, seguida de Dunnett.
4.2.2 Inibição da proliferação celular através da incorporação de BrdU
Tabela 2: Efeito da nor-β-lapachona (composto 1) e do seu derivado nitrofenilamino (composto 2) sobre a incorporação do BrdU expresso em porcentagem do número de células, avaliada através da incorporação do 5-bromo-2´-deoxyuridina (BrdU) em células leucêmicas HL-60 após 24 horas de incubação. O controle negativo (C) foi tratado apenas com o veículo utilizado para a diluição da substância (DMSO). Doxorrubicina (0,5µM) foi usado como controle positivo.
Compostos Concentração (µM) BrdU positivo (%) T/C
Controle - 56,71 -
Doxorrubicina 0,5 38,17* 0,67
Composto 1 2,0 53,50 0,94
0,5 57,00 1,0
1,0 49,00 0,86
Composto 2
2,0 39,75* 0,7
Nota: Os dados correspondem à média ± E.P.M. de experimentos independentes (n = 2). * p < 0,05, ANOVA, seguida de Dunnett.
4.3 Análise das mudanças morfológica
4.3.1 Coloração diferencial por May-Grünwald-Giemsa
(0,5µM), utilizada como controle positivo, induziu redução do volume celular, condensação da cromatina e fragmentação nuclear em células de HL-60, todas as características condizentes com apoptose (Figura 16 B).
Figura 16: Análise morfológica de células da linhagem HL-60 (leucemia) após 24 horas de incubação, coradas por May-Grünwald-Giemsa e visualizadas por microscopia óptica. (A): controle negativo tratado apenas com o veículo utilizado para diluir as substâncias. (C) e (D): células tratadas com nor-β-lapachona (composto 1) nas concentrações de 1,0µM e 2,0µM, respectivamente. (E), (F) e (G): células tratadas com o derivado nitrofenilamino (composto 2) nas concentrações 0,5 µM, 1,0µM e 2,0µM, respectivamente. (B): controle positivo tratado com doxorrubicina (0,5µM). Células em apoptose indicadas pelas setas pretas e célula em necrose indicada pela seta vermelha.
4.3.2 Coloração diferencial por Laranja de Acridina / Brometo de Etídio
de acridina e brometo de etídio (LA/BE) por microscopia de fluorescência. O percentual de células viáveis, apoptóticas e necróticas foi então calculado. Células viáveis, com coloração verde uniforme e morfologia normal, foram observadas em células HL-60 do grupo controle negativo, atingindo mais de 85% das células contadas. O tratamento das células com o composto 1, em ambas as concentrações testadas, não causou alterações significativas no padrão morfológico de células HL-60 quando comparadas ao controle negativo. No entanto, na concentração intermediária do composto 2 (1,0 µM) foi observado um aumento de 19,1% na porcentagem de células em processo de apoptose (Figura 17). Já na maior concentração (2,0 µM) o composto 2 causou uma redução da porcentagem de células viáveis para 61,33% (p < 0,05). Essa redução foi acompanhada por um aumento de 36,17% de células com características de apoptose e apenas um discreto aumento de 2,5% de células em necrose. Já a doxorrubicina, utilizada como controle positivo, causou 82,17% de apoptose, diminuindo drasticamente o percentual de células viáveis (Figura 17).
4.4 Análises da citometria de fluxo
4.4.1 Integridade de membrana celular e concentração de células determinada por citometria de fluxo
A integridade da membrana celular e a concentração de células foram determinadas por citometria de fluxo após 24 horas de incubação com as amostras teste. O corante iodeto de propídio foi utilizado para corar o núcleo de células com dano na membrana celular.
Como observado na figura 18, ambos os compostos causaram diminuição na concentração de células de maneira dose-dependente.
Figura 18: Efeito da nor-β-lapachona (composto 1) e do seu derivado nitrofenilamino (composto 2) sobre a densidade de células leucêmicas HL-60, analisado por citometria de fluxo utilizando iodeto de propídeo, após 24 horas de incubação. O controle negativo (Controle) foi tratado com o veículo utilizado para diluir as substâncias testadas. Doxorrubicina (0,5µM) foi utilizada como controle positivo (Dox). Os dados correspondem à média ± E.P.M. de três experimentos independentes. Cinco mil eventos foram contados em cada experimento. *, p < 0,05 comparado com o controle negativo por ANOVA seguido pelo teste de Dunnett.