UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
THALITA MONTORIL FERREIRA
RESPOSTAS FISIOLÓGICAS E BIOQUÍMICAS DE PLANTAS DE SORGO
FORRAGEIRO SUBMETIDAS AO ESTRESSE SALINO
THALITA MONTORIL FERREIRA
RESPOSTAS FISIOLÓGICAS E BIOQUÍMICAS DE PLANTAS DE SORGO FORRAGEIRO SUBMETIDAS AO ESTRESSE SALINO
Dissertação apresentada à coordenação do curso de Pós-graduação em Bioquímica, como requisito básico para obtenção do grau de Mestre em Bioquímica.
Área de concentração: Bioquímica Vegetal Orientador: Prof. Enéas Gomes Filho
Ao meu Pai:
Valmi Neto (in memoriam), verdadeiramente o maior mestre que tive.
À minha Mãe:
Loide Montoril, que sempre acreditou em mim e, apesar das
“Talvez não tenha conseguido fazer o melhor, mas lutei para que o melhor fosse feito. Não sou o que deveria ser, mas, graças a Deus, não sou o que era antes.”
AGRADECIMENTOS
A Deus, por tudo o que tem feito na minha vida, por ter me sustentado nesta caminhada e renovar minhas forças a cada dia.
Ao Professor Dr. Enéas Gomes Filho, pela confiança, amizade, apoio e orientação durante toda a minha vida acadêmica. Obrigada pelos valiosos conselhos e pelo tempo dedicado a mim.
Aos professores Dr. Joaquim Enéas Filho e Dr. José Tarquinio Prisco, da Universidade federal do Ceará, pela contribuição na minha formação acadêmica.
Ao meu amigo e namorado Carlos Eduardo Braga de Abreu, que mesmo atarefado, sempre teve um tempinho para me dar uma força. Por ter me ajudado a caminhar nos momentos mais difíceis da minha vida, e por todo amor e carinho a mim dispensados. Simplesmente, não sei o que seria de mim sem você.
Aos amigos do Laboratório de Fisiologia Vegetal I e II: Alexcyane Feijão, Cibelle Gadelha, Daniel Farias, Elaine Angelim, Elton Marques, Franklin Aragão, Gyedre Araújo, Hugo Leite, Ian Valença, Michella de Albuquerque, Thiago Augusto, Nara Lídia, Paulo André, Rafael Miranda, Jones Vidal, Vitor Freitas, Valdinéia Soares e Viviane Pinho pela amizade e por todos os momentos maravilhosos de convivência que pude vivenciar com vocês.
Aos colegas: Celso Marinones, Antônio Xavier, pela contribuição na realização deste trabalho, e por tê-lo tornado mais agradável.
A minha amiga Marcela Cristina Rabelo, por sempre estar disposta a me ouvir, por toda força, e por todos os momentos de conversa e distração em meio a tanto trabalho.
A todos os laboratórios da Bioquímica, que de alguma forma me ajudaram na realização deste trabalho. Agradeço, especialmente, à Jacilane Ximenes, e à Mirella Leite, pela valiosa ajuda no início dos meus experimentos com a ribonuclease.
À minha família, minha mãe, Loide, e minhas irmãs Quelyta e Quézia, pela força, apoio e segurança para superar todas as dificuldades da vida. Esta vitória também é de vocês.
Ao professor Dr. Edir e ao Dr. Edângelo, da Embrapa Agroindústria Tropical, pela colaboração na realização das análises das poliaminas.
Ao Instituto Nacional de Ciência e Tecnologia em Salinidade (INCTSal/CNPq).
RESUMO
FERREIRA, T. M. Respostas fisiológicas e bioquímicas de plantas de sorgo forrageiro
submetidas ao estresse salino. Fortaleza: UFC. 116f. (Dissertação).
As plantas estão freqüentemente expostas a estresses ambientais, os quais causam desequilíbrios no metabolismo fisiológico e bioquímico. Este trabalho teve por objetivo estudar as alterações fisiológicas e bioquímicas de plantas de sorgo forrageiro [Sorghum bicolor (L.) Moench], genótipo CSF 18, em função do tempo de exposição ao estresse salino. As sementes foram semeadas em vermiculita umedecida com água destilada, em casa de vegetação e, após sete dias, as plântulas foram transferidas para bandejas com solução nutritiva de Hoagland diluída 1:2. Após sete dias, foi estabelecido o tratamento de estresse salino (NaCl a 75 mM), sendo um grupo de plantas mantido em solução nutritiva na ausência de sal (controle). As coletas foram realizadas aos 0, 5, 10 e 15 dias após o início do estresse. Avaliou-se o crescimento, as trocas gasosas, os teores e a fluorescência da clorofila, os teores de solutos orgânicos (prolina, N-aminossolúveis, carboidratos solúveis, proteínas solúveis e poliaminas livres) e inorgânicos (Na+, Cl- e K+), bem como a atividade da ribonuclease (RNase). Também foram determinadas as atividades das enzimas catalase (CAT), dismutase do superóxido (SOD), peroxidase do ascorbato (APX) e peroxidase do guaicol (GPX), bem como os teores de H2O2, glutationa e ascorbato em folhas e raízes. O estresse salino reduziu o
crescimento das plantas, sendo observadas reduções na área foliar, e nas matérias fresca e seca da parte aérea e das raízes. Isto foi relacionado com a redução na taxa de fotossíntese líquida, mesmo com a taxa de transpiração e a condutância estomática não sendo afetadas. A salinidade aumentou os teores de Na+ e Cl- nos tecidos das plantas, porém, diminuiu os de K+. Os teores de solutos orgânicos em folhas e raízes aumentaram, principalmente aos cinco e dez dias de estresse. As poliaminas putrescina e espermidina foram encontradas em níveis muito baixos tanto em folhas como raízes, enquanto a espermina não foi detectada em qualquer dos tecidos analisados. Embora a putrescina tenha aumentado em condições de estresse salino, pouco deve ter contribuído para o ajustamento osmótico, contudo, foi sugerida sua participação na proteção oxidativa. A salinidade aumentou a atividade das enzimas SOD, APX e GPX e o estado redox do ascorbato, especialmente nas folhas, sendo isto relacionado com a manutenção dos níveis de H2O2 e com o aumento da proteção contra os danos
oxidativos. A CAT mostrou-se a principal enzima removedora de H2O2 nas folhas, enquanto
nas raízes esse papel foi desempenhado pela GPX. A atividade da RNase, em folhas, colmos e raízes de sorgo aumentou em condições de estresse, porém seu papel na proteção contra os efeitos deletérios da salinidade ainda não está totalmente esclarecido. Em geral, os dados mostram que o sistema antioxidativo (enzimático e não-enzimático) pode desempenhar papel fundamental na aclimatação das plantas de sorgo ao estresse salino e que os efeitos deletérios da salinidade no crescimento das plantas, devem-se, provavelmente, à inibição da fase bioquímica da fotossíntese, causada pelo acúmulo de íons tóxicos, Na+ e Cl-, reduzindo a relação K+/Na+ a níveis prejudiciais ao metabolismo.
Palavras-chave: Antioxidantes, estresse oxidativo, enzimas antioxidativas, salinidade,
ABSTRACT
FERREIRA, T. M. Biochemical and physiological responses of sorghum plants submitted
to salt stress. Fortaleza: UFC. 116f. (Dissertation).
The plants are frequently exposed to environmental stresses, which cause imbalances in physiological and biochemical metabolism. This work aimed to study the physiological and biochemical changes of plant forage sorghum (Sorghum bicolor) genotype CSF18, depending on the time of salt stress. The seeds were sown in vermiculite moistened with distilled water, in a greenhouse conditions, and after seven days, the seedlings were transferred to trays with Hoagland solution diluted 1:2. After seven days, treatment was established stress saline (75 mM NaCl), one group of plants kept in nutrient solution in the absence of salt (control). Samples were collected at 0, 5, 10 and 15 days after the initiation of stress. We evaluated the growth, gas exchange, contents and chlorophyll fluorescence, the concentration of organic solutes (proline, N-amino solutes, soluble carbohydrates, soluble proteins and polyamines free) and inorganic (Na+, Cl- and K+), as well as the activity of ribonuclease (RNase). We also determined the activities of catalase (CAT), superoxide dismutase (SOD), ascorbate peroxidase (APX) and guaicol peroxidase (GPX), as well as the levels of H2O2, ascorbate and
glutathione in leaves and roots. Salinity reduced plant growth, being observed reductions in leaf area, and fresh and dry weights of shoots and roots. This was related to a reduction in net photosynthesis rate, even with the transpiration rate and stomatal conductance is not affected. The salinity increased contents of Na+ and Cl- in plant tissues, but the K+ decreased. The levels of organic solutes in leaves and roots increased, particularly at five and ten days of stress. The polyamines putrescine and spermidine were found at very low levels in both leaves and roots, while spermine was not detected in any analyzed portion of the plant. Although putrescine increased in salt stress, some must have contributed to the osmotic adjustment, however, their participation in oxidative protection was suggested. The salinity increased the activity of SOD, APX and GPX and the redox state of ascorbate, especially in the leaves, and this is related to the maintenance of H2O2 levels and increased protection against oxidative
damage. The CAT showed the main enzyme remover H2O2 in the leaves while the roots that
role was played by GPX. The RNase activity in leaves, stems and roots of sorghum increased in stress conditions, but their role in protection against the deleterious effects of salinity is not yet fully understood. In general, the data show that the antioxidative system (enzymatic and non-enzymatic) can play a key role in the acclimation of sorghum plants to salt stress, and that the reduction of plant growth was probably due to inhibition of biochemical phase of photosynthesis, caused by accumulation of toxic ions, Na+ and Cl-, reducing the relation K+/Na+ at levels harmful to the metabolism.
LISTA DE FIGURAS
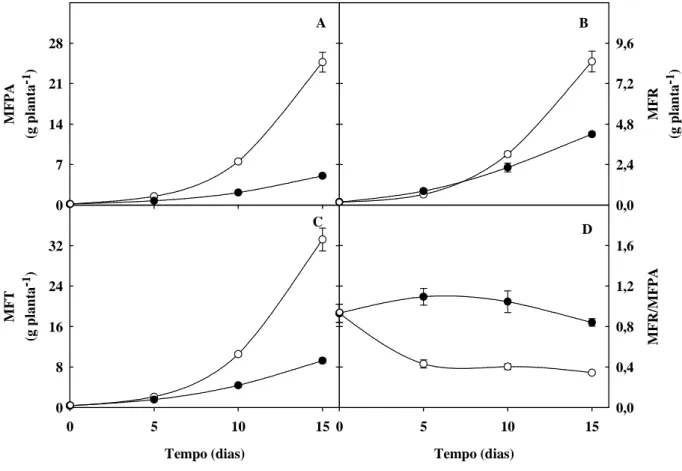
Figura 1. Matérias frescas da parte aérea (MFPA), das raízes (MFR) e total (MFT) e relação
MFR/MFPA de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ...
48
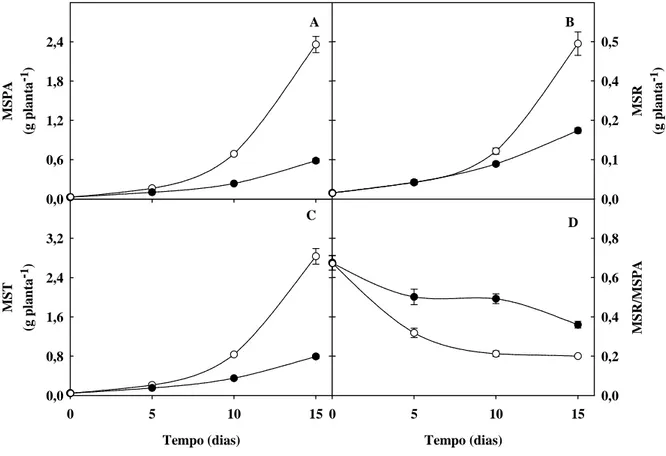
Figura 2. Matérias secas da parte aérea (MSPA), das raízes (MSR) e total (MST) e relação
MSR/MSPA de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 49
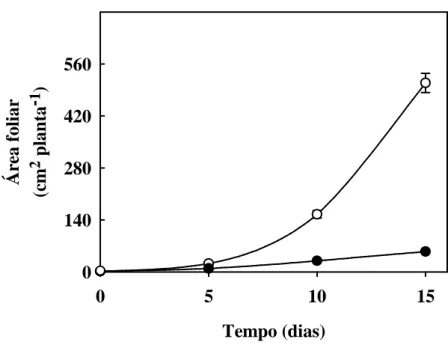
Figura 3. Área foliar de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução
nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino) em função do tempo de estresse ... 51
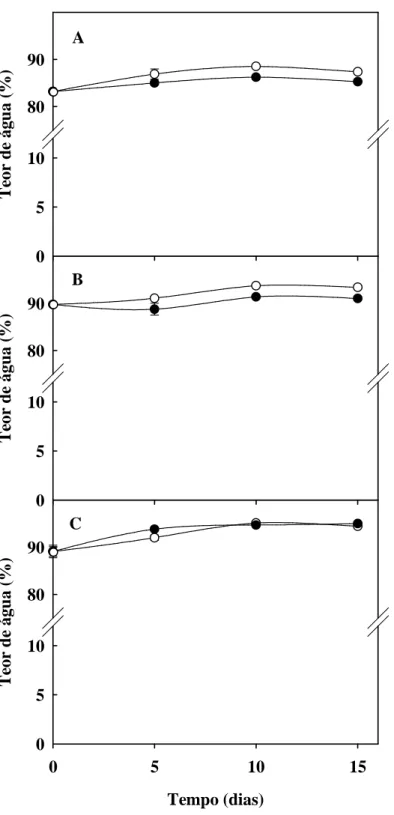
Figura 4. Teor de água em folhas, colmos + bainha e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 52
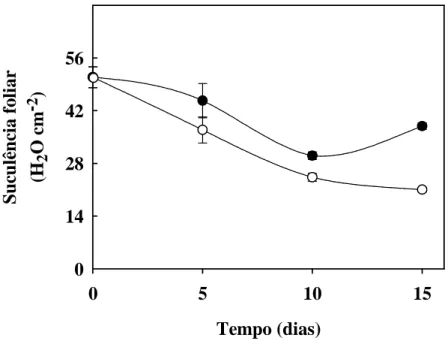
Figura 5. Suculência de folhas de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em
solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 54
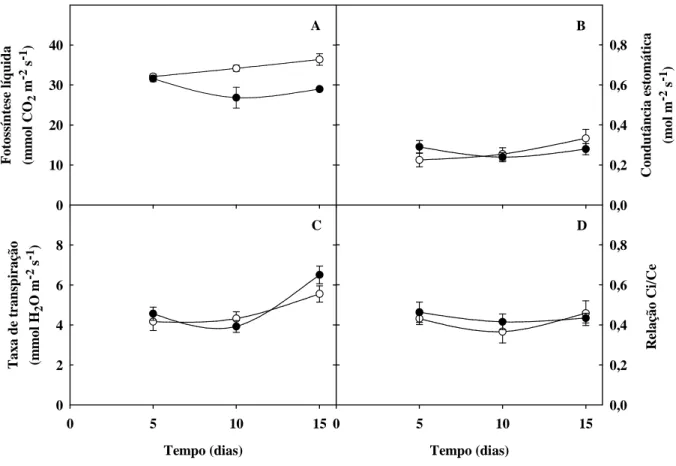
Figura 6. Fotossíntese líquida, condutância estomática, transpiração e relação entre a concentração
de CO2 interna e externa de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução
nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 55
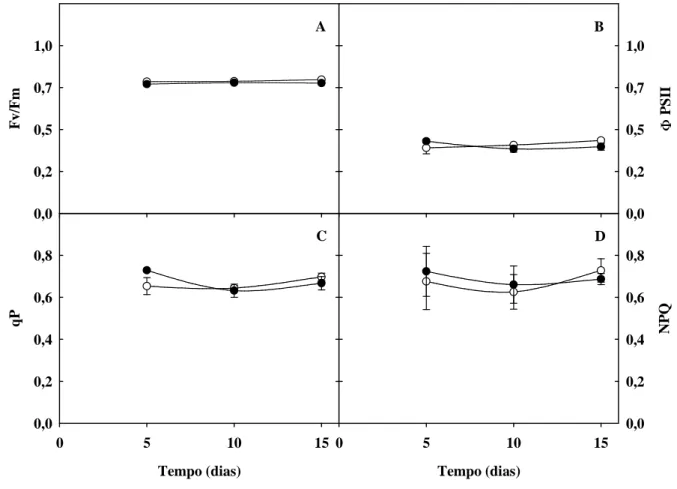
Figura 7. Rendimento máximo do fotossistema II, rendimento quântico efetivo do fotossistema II,
dissipação fotoquímica (quenching fotoquímico) e dissipação não fotoquímica (quenching não-fotoquímico) de plantas de sorgo forrageiro (genótipo CSF 18), crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 58
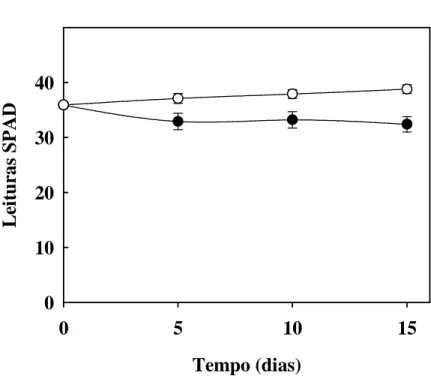
Figura 8. Teores relativos de clorofila em folhas de plantas de sorgo forrageiro (genótipo CSF 18)
crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 60
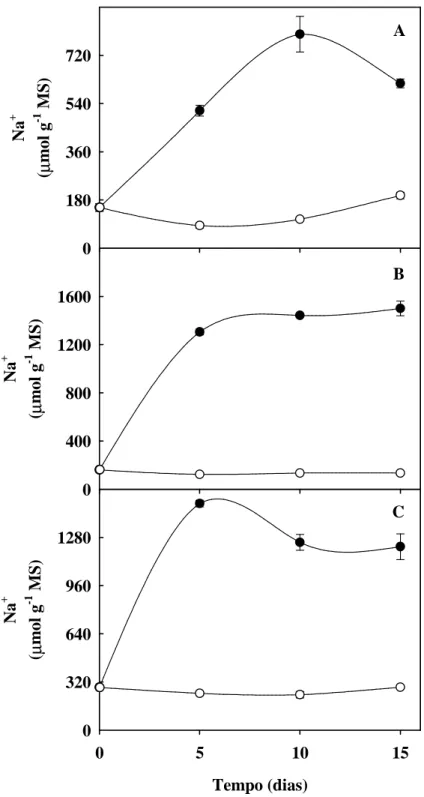
Figura 9. Teores de sódio de folhas, colmos + bainha e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 62
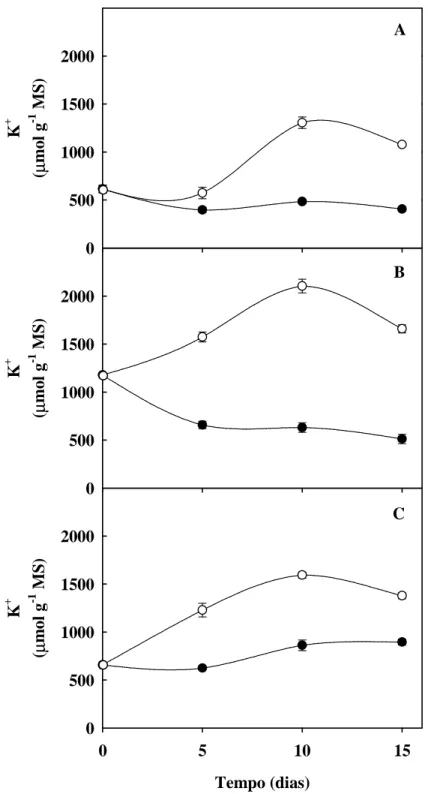
Figura 10. Teores de potássio de folhas, colmos + bainha e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 63
Figura 11. Teores de cloreto de folhas, colmos + bainha e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 65
Figura 12. Relação potássio/sódio (K+/Na+) em folhas, colmos + bainha e raízes de plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 67
Figura 13. Teores de prolina e de carboidratos solúveis em folhas e raízes de plantas de sorgo
Figura 14. Teores de N-aminossolúveis e de proteínas solúveis em folhas e raízes de plantas de
sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 71
Figura 15. Teores de putrescina e espermidina em folhas e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 74
Figura 16. Atividade da dismutase do superóxido em folhas e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 76
Figura 17. Atividade da peroxidase do ascorbato e da peroxidase do guaiacol em folhas e raízes de
plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 78
Figura 18. Atividade da catalase em folhas de plantas de sorgo forrageiro (genótipo CSF 18)
crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 81
Figura 19. Teores de ascorbato reduzido, total e estado redox do ascorbato em folhas de plantas de
sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 83
Figura 20. Teores de glutationa reduzida, total e estado redox da glutationa em folhas e raízes de
plantas de sorgo forrageiro (genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 85
Figura 21. Teores de peróxido de hidrogênio em folhas e raízes de plantas de sorgo forrageiro
(genótipo CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle) ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 88
Figura 22. Teores de malondialdeído em folhas e raízes de plantas de sorgo forrageiro (genótipo
CSF 18) crescidas em solução nutritiva de Hoagland 1:2 (controle), ou solução nutritiva contendo NaCl a 75 mM (estresse salino), em função do tempo de estresse ... 89
Figura 23. Atividade da ribonuclease em folhas, colmos + bainha e em raízes de plantas de sorgo
SUMÁRIO
Pág.
Resumo ... 6
Abstract ... 7
Lista de figuras ... 8
1. INTRODUÇÃO ... 12
2. REVISÃO DE LITERATURA ... 14
2.1. O sorgo ... 14
2.2. Aspectos fisiológicos e bioquímicos do estresse salino ... 15
2.3. Fotossíntese e fluorescência da clorofila em plantas sob estresse salino ... 17
2.4. Mecanismos de tolerância das plantas à salinidade... 20
2.4.1. Ajustamento osmótico ... 21
2.4.2. Exclusão de sais: homeostase iônica ... 23
2.4.3. Defesa antioxidativa: mecanismos enzimáticos e não enzimáticos ... 25
2.5. Ribonucleases ... 30
3. OBJETIVOS ... 31
3.1. Geral ... 31
3.2. Específicos ... 31
4. MATERIAL E MÉTODOS ... 33
4.1. Material vegetal e condições de cultivo ... 33
4.2. Coleta das plantas e medidas de crescimento ... 34
4.3. Teor de água e suculência foliar ... 34
4.4. Parâmetros fotossintéticos, fluorescência e teor de clorofila ... 34
4.5. Determinação de teores de solutos inorgânicos ... 35
4.6. Determinação dos teores de solutos orgânicos ... 36
4.6.1. Obtenção dos extratos ... 36
4.6.2. Carboidratos solúveis ... 36
4.6.3. Prolina livre ... 37
4.6.4. N-aminossolúveis ... 37
4.6.6. Determinação de poliaminas livres ... 38
4.7. Determinação de H2O2 ... 40
4.8. Determinação de antioxidantes não enzimáticos ... 41
4.8.1. Determinação de glutationa ... 41
4.8.2. Determinação de ascorbato ... 41
4.9. Atividade das enzimas do sistema anioxidativo ... 42
4.9.1. Catalase ... 43
4.9.2. Peroxidase do ascorbato ... 43
4.9.3. Peroxidase do Guaiacol ... 44
4.9.4. Dismutase do superóxido ... 44
4.10. Determinação da peroxidação de lipídios ... 45
4.11. Atividade da ribonuclease ... 45
4.12. Delineamento experimental ... 46
5. RESULTADOS E DISCUSSÃO ... 47
5.1. Crescimento das plantas de sorgo ... 47
5.2. Teor de água e suculência das folhas ... 50
5.3. Trocas gasosas ... 53
5.4. Fluorescência da clorofila ... 57
5.5. Teor de clorofila ... 59
5.6. Teores de sódio, potássio, cloreto e relação K+/Na+ ... 61
5.7. Teores de solutos orgânicos ... 68
5.7.1. Prolina livre ... 68
5.7.2. Carboidratos solúveis ... 68
5.7.3. N-aminossolúveis ... 70
5.7.4. Proteínas solúveis ... 72
5.7.5. Poliaminas livres ... 73
5.8. Atividade das enzimas do estresse oxidativo ... 75
5.9. Mudanças no conteúdo e no estado redox do ascorbato e da glutationa ... 82
5.10. Teores de peróxido de hidrogênio ... 87
5.11. Peroxidação de lipídios ... 87
5.12. Atividade ribonucleásica ... 90
6. CONCLUSÕES ... 93
1. INTRODUÇÃO
As plantas frequentemente se encontram sob situações de estresses, ou seja, sob condições externas que afetam desfavoravelmente seu crescimento, desenvolvimento e/ou produtividade (YU; WANG; WANG, 2012). Dentre os estresses abióticos que mais limitam a produção agrícola em grandes áreas do mundo, destaca-se a salinidade (FAO, 2005). Em áreas salinas ou irrigadas com águas salinas, a maioria das culturas exibe reduções significativas na produção. Isto é devido à redução do potencial osmótico da solução do solo, dos desequilíbrios nutricionais ou uma combinação desses fatores (ASHRAF; HARRIS, 2005).
O grau com que a salinidade afeta o crescimento depende de fatores intrínsecos à planta (espécie, cultivar e estádio de desenvolvimento), fatores relacionados ao estresse (tipo de sal, concentração salina, tempo e frequência de exposição aos sais e modo de aplicação ou exposição aos sais) e fatores ambientais (luz, temperatura e umidade relativa do ar), bem como da interação entre eles (BRAY et al., 2000; GREENWAY; MUNNS, 1980; LACERDA et al., 2003a; MUNNS; TERMAAT, 1986; PRAXEDES et al., 2011; TRINDADE et al.,
2006). Enquanto algumas espécies apresentam elevada tolerância à salinidade (halófitas), outras são altamente susceptíveis (glicófitas). Convém salientar que a maioria das espécies cultivadas tem seu crescimento inibido ou retardado, mesmo em baixas concentrações de sais (AZEVEDO-NETO et al., 2004; FREITAS et al., 2011; GONDIM et al., 2012).
2008). Tais respostas incluem: a retenção e/ou aquisição de água; a manutenção da fotossíntese e da homeostase iônica; a prevenção e reparo de danos; e o restabelecimento do crescimento. Além dessas respostas, para contornar esse problema, as plantas se utilizam de ajustes fisiológicos tais como: compartimentalização de íons tóxicos no vacúolo, ajustes osmóticos e produção de osmólitos compatíveis e, em especial, o aumento de produtos gênicos para a reestruturação da homeostase celular (VERSULES et al., 2006). Contudo, estas respostas são bastante complexas e de difícil entendimento por resultar de modificações na expressão de vários tipos genes (DUAN et al., 2012; HASEGAWA et al., 2000). Além disso, o fato de muitos dos genes induzidos não serem específicos para um determinado tipo de estresse tem dificultado ainda mais o estudo e a compreensão dos mecanismos de tolerância.
2. REVISÃO DE LITERATURA
2.1. O sorgo
O sorgo (Sorghum bicolor) é uma planta C4, herbácea anual, de origem africana, com
altas taxas fotossintéticas, pertencente à família Poaceae. Os colmos são eretos, dispostos em forma de touceira e suculentos, com folhas medindo de 25 a 50 mm de largura e de 50 a 100 cm de comprimento. A inflorescência é do tipo espiga terminal, com ramificações curtas. É uma planta de clima temperado e tropical, com ciclo vegetativo curto e que se adapta bem a solos arenosos e medianamente arenosos (VILELA, 2008).
O sorgo é uma importante cultura forrageira, especialmente para o semiárido, devido a sua tolerância à seca e ao calor, sendo a quinta maior cultura de grãos no mundo, seguindo-se logo depois do milho, trigo, arroz e cevada (FAO, 2011). Ele pode substituir parcialmente o milho nas rações para aves e suínos e, totalmente para ruminantes, com a vantagem de menor custo de produção e valor de comercialização de 80% do preço do milho. Além disso, a cultura tem demonstrado bom desempenho como alternativa para uso no sistema de integração lavoura/pecuária e para produção de biomassa, proporcionando maior proteção do solo contra a erosão, maior quantidade de matéria orgânica disponível e melhor capacidade de retenção de água nos solos, além de propiciar condições para o uso no plantio direto (MAGALHÃES; DURÃES; RODRIGUES, 2010). A cultura do sorgo, no Brasil, apresentou crescimento significativo a partir da década de 70. O aumento da demanda por fontes de água doce e do uso de terras marginais, bem como as tendências climáticas globais, sugerem que culturas de sequeiro, como o sorgo, sejam de importância fundamental para alimentar populações do mundo em expansão (PATERSON, 2008).
2.2. Aspectos fisiológicos e bioquímicos do estresse salino
O solo é o principal meio para nutrição mineral das plantas terrestres e é a partir dele que elas absorvem a água e os nutrientes minerais na forma de íons inorgânicos. O acúmulo excessivo de sais no solo é um problema grave para a agricultura, pois muitas áreas plantadas no mundo tornam-se improdutivas devido aos efeitos prejudiciais que os sais exercem sobre o crescimento e o desenvolvimento das plantas (TAIZ; ZEIGER, 2009).
Os efeitos do estresse salino sobre o crescimento das plantas podem ser de natureza iônica ou hídrica (GREENWAY; MUNNS, 1980; MUNNS, 2002). Os efeitos iônicos resultam da elevada absorção de íons, especialmente, Na+ e Cl-, que em altas concentrações, alteram a homeostase iônica, perturbando as funções fisiológicas e bioquímicas da célula (ZHU, 2001). Os efeitos hídricos, decorrentes da diminuição do potencial osmótico do ambiente radicular, acarretam a diminuição da disponibilidade de água para a planta.
Os problemas osmóticos afetam processos fisiológicos da planta como as taxas de transpiração e o próprio crescimento, uma vez que a expansão celular é diminuída. A hipótese que melhor parece adequar-se às observações é que a salinidade excessiva reduz o crescimento da planta por causar aumento do dispêndio de energia para absorver água do solo e produzir metabólitos e componentes celulares para sobreviver em condições de estresse salino (MUNNS, 1993). Esta energia é desviada dos processos que conduzem o crescimento e à produção.
características comuns que determinam que o Na+ seja um competidor do K+ pelas proteínas de transporte que controlam sua absorção, sendo as concentrações elevadas de Na+ no meio externo e o potencial negativo de membrana, fatores adicionais que favorecem o influxo de Na+ para o citosol. O acúmulo excessivo de íons tóxicos, como o sódio, afeta a atividade de algumas enzimas citosólicas que requerem o potássio como cofator, tanto em glicófitas quanto em halófitas (ZHU, 2002).
Em adição aos aspectos iônicos e osmóticos, a produção de espécies reativas de oxigênio (ROS, do inglês reactive oxygen species) é uma das principais alterações metabólicas que ocorrem em plantas submetidas à salinidade. Essas espécies são geradas, principalmente, a partir da redução monovalente do O2 durante o fluxo de elétrons em
compartimentos subcelulares, tais como cloroplastos, mitocôndrias e peroxissomos (APEL; HIRT, 2004). As ROS são altamente reativas e podem prejudicar o metabolismo celular normal, causando danos oxidativos às proteínas, ácidos nucléicos e lipídios de membrana (MITTLER, 2002; MØLLER; JESSEN; HANSSON, 2007).
De forma geral, durante o estresse salino, vários processos fisiológicos, bioquímicos e moleculares são alterados, incluindo: taxa de fotossíntese líquida, condutância estomática, transpiração, respiração, produção de biomassa, expansão e divisão celular, metabolismo dos lipídios, equilíbrio celular redox, síntese de proteínas, biossíntese de solutos orgânicos, transporte de nutrientes, ativação de vias de sinalização, expressão gênica e de fatores de transcrição, etc. (CHARTZOULAKIS; KLAPAKI, 2000; PARIDA; DAS, 2005; PRAXEDES et al., 2011; SAIRAM; TYAGI, 2004; ZHU, 2001).
capazes de enfrentar o excesso de sais presentes na solução do solo, no entanto, representam apenas 1% da flora mundial (FLOWERS; COLMER, 2008). As glicófitas, por sua vez, apresentam menor tolerância à salinidade e seus crescimentos são inibidos em cerca de 25% em concentrações de NaCl abaixo de 100 mM.
2.3. Fotossíntese e fluorescência da clorofila em plantas sob estresse salino
A fotossíntese constitui a base da produção de uma cultura. Estima-se que 90% da matéria seca total de um vegetal resultem diretamente do processo fotossintético (JIAO; JI; LI, 2003). Durante o estresse salino, as mudanças nas relações hídricas associadas com o acúmulo de íons no interior dos tecidos fotossintéticos têm implicações consideráveis para a atividade fotossintética das plantas. Vários estudos mostram que a redução no crescimento das plantas pode ser acompanhada por decréscimo na taxa de fotossíntese (AZEVEDO NETO et al., 2004; CHARTZOULAKIS et al., 2002; ROMERO-ARANDA; SORIA; CUARTERO,
2001).
O decréscimo da taxa fotossintética com o aumento da salinidade pode ser devido tanto ao fechamento estomático (que minimiza a perda de água nessas condições) como a limitações não estomáticas (AZEVEDO-NETO et al., 2011; BRUGNOLI; BJÖRKMAN, 1992; DREW; HOLE; PICCHIONI, 1990). Inicialmente, quando a concentração de sal na folha é moderada, observa-se um aumento da resistência à difusão do CO2 através do mesofilo
até o sítio de redução nos cloroplastos, afetando desfavoravelmente os processos bioquímicos envolvidos na fotossíntese (PARIDA; DAS; MITTRA, 2004). Em cultivares de oliveira (Olea europea L.), a baixa concentração de CO2 nos cloroplastos resultante da baixa condutância
tóxicos no mesofilo inibe a fotossíntese por meio de mecanismos não-estomáticos, como mudanças no conteúdo de pigmentos e redução na atividade de enzimas fotossintéticas (PARIDA; DAS; MITTRA, 2003). Bañuls e Primo-Millo (1992) consideram que a inibição na taxa de assimilação de CO2, em plantas do gênero Citrus submetidas à salinidade, é
conseqüência do acúmulo de cloreto nas folhas. Garg e Singla (2004) observaram reduções no conteúdo de clorofila e na atividade da Rubisco em cultivares de grão-de-bico submetidos à salinidade. É relativamente comum em estresses mais severos a ocorrência de necrose dos tecidos foliares e aceleração da senescência de folhas maduras, o que reduz a área destinada à fotossíntese. A limitação da fotossíntese também pode ser atribuída a uma inibição por feedback exercida pelas altas concentrações de açúcar no mesofilo das células foliares
frequentemente observadas em plantas sob estresse salino (RABHI et al., 2010).
Parte da energia luminosa absorvida pelos pigmentos cloroplastídicos, especialmente a clorofila a, durante a fotossíntese é emitida como fluorescência (GLYNN; FRASER; GILLIAN, 2003). As mudanças na composição e função do aparato fotossintético das plantas em resposta à salinidade têm sido descritas na literatura recente (BROETTO; DUARTE; LÜTTGE, 2007, MATEOS-NARANJO et al., 2010). Demonstrações de que a fluorescência das clorofilas a pode ser usada para estimar, rapidamente e de forma não invasiva, a eficiência do transporte de elétrons através do fotossistema II (PSII), e de que a eficiência de operação deste fotossistema está correlacionada à assimilação de CO2, tem levado à utilização de
PSII, estimada através da razão entre a fluorescência variável e a máxima (Fv/Fm), expressam o rendimento quântico dos processos fotoquímicos no PSII, quando todos os centros de reação estão abertos, dando uma idéia da eficiência relativa da captura de energia luminosa (BAKER; ROSENQVIST, 2004; PEREIRA; FERNANDES; BELTRÃO, 1998). Essa relação tem sido utilizada para detectar perturbações no sistema fotossintético causadas pelo estresse salino, visto que sua diminuição indica um declínio na eficiência fotoquímica do PSII e um distúrbio ou dano no aparato fotossintético (GLYNN; FRASER; GILLIAN, 2003; PERCIVAL; FRASER, 2001). A eficiência quântica efetiva do PSII (Φ PSII) indica a fração de energia absorvida pela clorofila associada a esse fotossistema que foi utilizada em atividade fotoquímica e, como tal, informa a quantidade de elétrons transportados, sendo um indicativo da fotossíntese (LICHTENTHALER; BUSCHMANN; KNAPP, 2005). O principal fator determinante desta eficiência é a habilidade com que os elétrons são removidos da quinona receptora do PSII, o que está diretamente relacionado com a taxa de consumo de ATP e NADPH, produtos do transporte fotossintético de elétrons (BAKER; ROSENQVST, 2004).
(BAKER; ROSENQVST, 2004). Krause e Weis (1991) relatam que qP representa a fração de centros de reação abertos do PSII em relação à fração total deste fotossistema. O decaimento da fluorescência máxima da clorofila também ocorre por processos não-fotoquímicos, sendo que o NPQ indica a dissipação do excesso de energia radiante na forma de calor (radiação infravermelha) nos complexos antena do PSII. Esse processo está intimamente relacionado com a fotoproteção através da dissipação térmica de energia e tem sido correlacionado com a formação de zeaxantina (AZEVEDO-NETO et al., 2011).
Em geral, as medidas da fluorescência da clorofila a têm se mostrado uma ferramenta muito informativa para o estudo dos efeitos de diferentes estresses ambientais sobre a fotossíntese (KALAJI et al., 2011). Estes parâmetros têm sido utilizados inclusive na seleção de plantas com tolerância à salinidade (AZEVEDO-NETO et al., 2011; GLYNN; FRASER; GILLIAN, 2003). A avaliação desses parâmetros durante todo o ciclo de desenvolvimento das plantas possibilita informações mais precisas, já que eles apresentam variações nos diferentes estádios de desenvolvimento (BACARIN; MOSQUIN, 2002). Portanto, medidas simultâneas de fluorescência da clorofila a e de trocas gasosas das plantas permitem um melhor entendimento dos efeitos da salinidade sobre o aparato fotossintético durante o crescimento e desenvolvimento vegetal.
2.4. Mecanismos de tolerância das plantas à salinidade
retranslocação de Na+ e Cl- no floema, garantindo a ausência de translocação para tecidos da parte aérea em crescimento; e) excreção de sais através de glândulas ou pêlos vesiculares, presentes apenas em halófitas (MUNNS, 2002; TESTER; DAVENPORT, 2003). Portanto, de acordo com esses autores, a tolerância das glicófitas depende dos três primeiros mecanismos, sendo que eles ocorrem em diferentes graus, em função da espécie e/ou cultivar.
2.4.1. Ajustamento osmótico
De acordo com Prisco e Gomes-Filho (2010), o ajustamento osmótico se faz à custa da absorção e acúmulo de íons (principalmente os tóxicos) no vacúolo e de íons não tóxicos e solutos orgânicos no citosol, compatíveis com a manutenção da atividade metabólica das células. Como resultado desse processo, o potencial osmótico celular e, como consequência o hídrico, são reduzidos com a finalidade de manter a absorção de água e o turgor celular (KRASENSKY; JONAK, 2012).
Os solutos orgânicos acumulados em resposta ao abaixamento do potencial osmótico do meio garantem um fluxo contínuo de água. Além do mais, tem sido sugerida a participação desses solutos como osmoprotetores de macromoléculas como proteínas e lipídeos, assim como de membranas, substituindo a água na superfície das mesmas e, portanto, favorecendo sua estabilização (SERRAJ; SINCLAIR, 2002; SMIRNOFF, 1998). Os principais solutos que se acumulam em condições de estresse são os carboidratos (trealose, frutose e sacarose), polióis (glicerol, pinitol, sorbitol, manitol e ornitol), aminoácidos livres, iminoácidos (prolina, hidroxiprolina), betaínas (glicina, glicina betaina), além de poliaminas (putrescina, espermidina e espermina) (ALCÁZAR et al., 2006; FREITAS et al., 2011; HASEGAWA et al., 2000; LACERDA et al., 2003b; PRAXEDES et al., 2011).
tolerância ao estresse salino (CHEN; MURATA, 2002; SAKAMOTO; MURATA, 2000). No entanto, a relação entre o acúmulo de solutos orgânicos e a tolerância ao estresse osmótico é ainda bastante controversa e uma grande quantidade de estudos mostram resultados contraditórios que comprometem a hipótese do ajustamento osmótico. O acúmulo de prolina é um exemplo. Em condições de estresse, o desequilíbrio entre a captura da luz e a utilização do NADPH na fixação do carbono pode diminuir a disponibilidade de NADP+ nos cloroplastos e causar fotoinibição. Dessa forma, a síntese de prolina, que é dependente de NADPH, poderia atuar como uma válvula protetora por meio da qual a regeneração do NADP+ proporcionaria o efeito protetor observado (HARE; CRESS, 1997). Em adição, acredita-se que a prolina participe dos processos de remoção de radicais livres e estabilização de proteínas e/ou membranas, podendo também servir como reserva de carbono e nitrogênio (ASHRAF; FOOLAD, 2007).
As poliaminas, por sua vez, são aminas alifáticas de baixo peso molecular que estão envolvidas nos processos de crescimento e desenvolvimento das plantas (CROZIER et al., 2000). Em pH fisiológico, essas aminas apresentam-se carregadas positivamente e, dessa maneira, são capazes de interagir com proteínas, ácidos nucléicos, fosfolipídios e constituintes de parede celular, ativando ou estabilizando essas moléculas (BARON; STASOLLA, 2008). Em plantas, os níveis intracelulares de poliaminas são extremamente regulados por processos metabólicos e catabólicos, bem como por reações de conjugação (ALCÁZAR et al., 2010).
para a estabilização de proteínas do tonoplasto e para a prevenção da desnaturação protéica, protegendo dessa maneira a atividade de enzimas sob condições de estresse (LIU et al., 2007). Sob condições de estresses abióticos, como seca, frio, calor, metais pesados e salinidade, há acúmulo acentuado dos teores de poliaminas, paticularmente Put, Spm e Spd, em diferentes espécies de plantas (ALCÁZAR et al., 2006; GROPPA; BENAVIDES, 2008), entretanto, a significância desse aumento permanece não elucidada, já que não existe consenso se os teores aumentados de poliaminas são conseqüência das injúrias ocasionadas pelo estresse ou apenas resposta de proteção contra ele (ALCÁZAR et al., 2010). Também não há consenso se esses metabólitos se acumulam sob condições de estresse abióticos, como a salinidade (ERDEI et al., 1996).
O ajustamento osmótico por meio do acúmulo de solutos orgânicos, entretanto, tem um custo energético alto que pode afetar negativamente a produtividade da planta e o uso eficiente da água (TURNER; JONES, 1980). O acúmulo de carboidratos solúveis desvia a energia disponível dos processos ativos do crescimento para o ajustamento osmótico (MUNNS; TERMAAT, 1986; TATTINI; MONTAGNI; TRAVERSI, 2002). Além disso, aumentos na concentração de carboidratos podem afetar negativamente a taxa de fotossíntese líquida por um mecanismo de feedback (RABHI et al., 2010).
2.4.2. Exclusão de sais: homeostase iônica
macronutriente essencial para o crescimento e desenvolvimento, porém, sua adição ao meio em pequenas doses, pode promover o crescimento das plantas quando o suprimento de K+ é limitado (MÄSSER; GIERTH; SCHROEDER, 2002). Embora o Na+ possa substituir o K+ nas suas funções osmóticas dentro do vacúolo, um excesso de Na+ é indesejável, pois prejudica os sistemas enzimáticos do citosol. Dessa forma, a capacidade das plantas de manterem altas relações K+/Na+ no citosol tem sido sugerida como um dos elementos-chave para tolerar o estresse salino e é muitas vezes utilizada como critério para selecionar materiais sensíveis e tolerantes à salinidade (AKTAS; ABAK; CAKMAK, 2006; ASHRAF; HARRIS, 2004).
A manutenção da relação K+/Na+ no citosol depende dos processos que controlam a absorção, a translocação e a compartimentalização do íon Na+ nos vacúolos (MAATHUIS; AMTMANN, 1999). Infelizmente, na maioria das glicófitas esses processos não ocorrem como nas halófitas, e as plantas parecem acumular parte dos íons tóxicos no citosol. Com relação a este último fator, uma atenção maior tem sido dada ao estudo dos efeitos do estresse salino sobre a nutrição potássica das plantas. Isto se deve, principalmente, às similaridades físico-químicas entre os íons Na+ e K+ (MAATHUIS; AMTMANN, 1999; MÄSSER; GIERTH; SCHROEDER, 2002). De fato, inúmeras evidências apontam para a participação de transportadores de alta e de baixa afinidade por K+ no transporte de Na+ para dentro da célula, quando este se encontra em altas concentrações no solo (BLUMWALD, 2000; MAATHUIS; AMTMANN, 1999).
por um transportador vacuolar Na+/H+ do tipo antiporte (APSE; BLUMWALD, 2002). O acúmulo de grandes quantidades de Na+ e Cl- no vacúolo, evita seus efeitos deletérios em outras partes do citoplasma e favorece a entrada de água para dentro da célula mesmo em um ambiente de baixo potencial osmótico e hídrico (BLUMWALD, 2000; ZHU, 2003). A comparação dos níveis de expressão da H+-ATPase de uma glicófita (Nicotiana tabacum) e de uma halófita (Atriplex nummularia), mostraram que a tolerância ao sal estava positivamente correlacionada com os níveis de transcritos (NIU et al., 1993).
2.4.3. Defesa antioxidativa: mecanismos enzimáticos e não enzimáticos
Estresses ambientais que limitam a fotossíntese podem aumentar o dano celular induzido pelo oxigênio, devido ao aumento na produção de espécies reativas de oxigênio (ROS), gerando o chamado estresse oxidativo (MITTLER et al., 2004). Uma das principais razões para isto é que o estresse salino limita as trocas gasosas e, dessa forma, o suprimento de CO2 para as folhas. A limitada fixação do CO2 causa, então, um decréscimo na velocidade
do ciclo de Calvin e, conseqüentemente, na disponibilidade de NADP+ para captar os elétrons provenientes do fotossistema I. Tal situação favorece a redução monovalente do oxigênio molecular nesse fotossistema, gerando o radical superóxido (reação de Mehler) a partir do qual são originadas as outras ROS nas células (AZEVEDO NETO; GOMES-FILHO; PRISCO, 2008; DEMIRAL; TÜRKAN, 2005; EDREVA, 2005).
As principais ROS acumuladas em condições de estresse são o radical superóxido (•O2
-), o peróxido de hidrogênio (H2O2) e o radical hidroxil (•OH). As ROS são altamente
oxidase do NADPH, a qual transfere elétrons do NADPH citosólico para o O2 (BÉRCZI;
MØLLER, 2000). Uma vez produzido, o •O2
é rapidamente dismutado em H2O2 e O2.
Embora o cloroplasto seja a fonte primária de H2O2 nas plantas, durante o processo de
fotorrespiração nos peroxissomos a ação da enzima oxidase do glicolato representa uma outra fonte de produção de H2O2 (SIEDOW; DAY, 2000). O H2O2 produzido na célula pode ser
convertido, na presença de íons Fe2+, em radicais (•OH) através da reação de Fenton, um componente do ciclo de Haber-Weiss (McKERSIE; LESHEM, 1994). O oxigênio singleto, por sua vez, é formado principalmente nos processos fotoquímicos no cloroplasto (EDREVA, 2005).
Para mitigar os danos oxidativos causados pelas ROS, as plantas possuem um complexo sistema de defesa, que envolve antioxidantes não enzimáticos de baixa massa molecular (hidrofílicos, como o acido ascórbico e a glutationa, ou lipofílicos, como o α-tocoferol e os carotenoides) e enzimas antioxidativas, tais como, dismutase do superóxido (SOD), catalase (CAT), peroxidase do ascorbato (APX), peroxidase do guaiacol (GPX), redutase da glutationa (GR), redutase do monodesidroascorbato (MDHAR) e redutase do desidroascorbato (DHAR) (MITTLER, 2002). Estudos têm demonstrado que a redução nos danos oxidativos e o aumento da tolerância a estresses ambientais, incluindo o estresse salino, estão correlacionados a sistemas antioxidativos mais eficientes (FAROUK, 2011; GILL; TUTEJA, 2010).
A SOD é considerada como a primeira linha de defesa das plantas contra as ROS (ALSCHER; ERTURK; HEATH, 2002). Esta enzima é responsável pela dismutação do •O2
-
em O2 e H2O2 e é encontrada em basicamente todos os compartimentos celulares. Baseado no
peroxissomos; 3) a Cu/Zn-SOD, nos cloroplastos e citosol (ALSCHER; ERTURK; HEATH, 2002).
A CAT, que se encontra sob diferentes isoformas, é uma enzima tetramérica contendo grupo heme e que catalisa a dismutação do H2O2 a O2 e H2O, impedindo os efeitos
potencialmente danosos provocados pelas mudanças na homeostase do peróxido de hidrogênio (BREUSEGEM et al., 2001). A CAT exerce importante papel fisiológico na eliminação do H2O2 produzido na fotorrespiração e na oxidação dos ácidos graxos nos
peroxissomos (DEL RIO et al., 2002; GONDIM et al., 2012).
A APX, da mesma forma que a CAT, também se encontra na forma de diferentes isoformas. Essa enzima utiliza o ascorbato como doador específico de elétrons para reduzir o H2O2 a água com a geração concomitante de monodesidroascorbato (MDHA). O ascorbato é,
então, regenerado através do ciclo ascorbato-glutationa utilizando equivalentes redutores do NAD(P)H (SHIGEOKA et al., 2002). A APX é encontrada em, pelo menos, quatro compartimentos celulares (estroma, membrana do tilacóide, membrana dos microcorpos e citosol) e está associada com a eliminação do H2O2 gerado a partir do •O2
-
pela ação da SOD (ALSHER; ERTURK; HEATH et al., 2002; SHIGEOKA et al., 2002). Além da APX, um outro grupo de peroxidases encontrado em plantas é o das isoenzimas que utilizam o guaiacol (GPX) como doador de elétrons. A GPX é encontrada no citosol, vacúolo, parede celular e espaços intracelulares, e realiza importante papel na fisiologia das células vegetais (ASADA, 1992).
Uma importante evidência do papel do estresse oxidativo na indução da resposta ao estresse salino foi relatada por Uchida et al. (2002). Esses autores pré-trataram plântulas de arroz com concentrações crescentes de H2O2 (0 a 1000 µM) antes da aplicação do NaCl e
uma aclimatação prévia ao estresse (tolerância cruzada), enquanto que em concentrações elevadas, essa molécula passa a ter um efeito tóxico ao crescimento das plantas (UCHIDA et al., 2002). Tanaka et al. (1999) relataram que as plantas de arroz transgênicas expressando
altos níveis de Mn-SOD de levedura nos cloroplastos tornaram-se mais resistentes ao estresse salino. Além disso, um mutante pst1 (photoautotrophic salt tolerance1) de Arabidospis thaliana, que exibe tolerância a 200 mM de NaCl, apresentou uma maior capacidade para
eliminar as ROS (TSUGANE et al., 1999). Esses resultados sugerem uma forte correlação entre o sistema antioxidante e a tolerância ao estresse salino.
Outro mecanismo de proteção oxidativa são os antioxidantes não enzimáticos, representados pelo ácido ascórbico (ASA), glutationa (GSH), tocoferóis e carotenóides (BONIFACIO et al., 2011; WANG; QUINN, 2000). O ASA, a forma reduzida do ascorbato, tem um importante papel na proteção das plantas contra as ROS que são formadas nos processos fotossintéticos e respiratório (GUO et al., 2005). O ASA é considerado o mais importante substrato para a remoção do H2O2, convertendo-o em água e oxigênio molecular
dentro da célula vegetal. A enzima APX utiliza duas moléculas de ascorbato como doadoras de elétrons para cada molécula de H2O2, produzindo duas moléculas do ácido
O estado redox do ascorbato, representado pela fração do ascorbato reduzido presente no pool total de ascorbato celular (ASA/ASA+DHA), representa a fração do ASA efetivamente capaz de atuar na proteção oxidativa (CONKLIN; BARTH, 2004). Como é uma das primeiras linhas de defesa oxidativa, a manutenção do estado redox do ascorbato durante a exposição a vários tipos de estresse pode conferir maior resistência aos danos oxidativos causados pelo estresse (BONIFACIO et al., 2011; CONKLIN; BARTH, 2004; KWON et al., 2003; SANMARTIN et al., 2003; SHEN; YEH, 2010).
2.5. Ribonucleases
A ribonuclease (RNase) é uma enzima que desempenha importante papel no metabolismo, tendo em vista que o nível de RNA, um dos componentes do processo de síntese protéica, pode ser alterado pela mesma (GOMES-FILHO et al., 1994). Esta enzima apresenta variações em sua atividade que podem se manifestar em funções de diversos estímulos endógenos ou exógenos, tais como, injúrias físicas (SACHER; MORGAN; DE LAROSA, 1975), patógenos e processos infecciosos (CHAKRAVORTY; SHAW; SCRUBB, 1974), seca, frio e salinidade (GOMES-FILHO et al., 2008).
3. OBJETIVOS
3.1. Geral
Estudar as respostas fisiológicas e bioquímicas de plantas de sorgo forrageiro submetidas ao estresse salino, com a finalidade de contribuir para o entendimento dos mecanismos envolvidos na inibição do crescimento e da produção do sorgo sob condições de salinidade.
3.2. Específicos
Utilizando plantas de sorgo forrageiro, sob condições controle e de estresse salino, pretende-se analisar possíveis alterações:
a) Nas medidas de crescimento (área foliar e matérias fresca e seca da parte aérea e raízes das plantas);
b) No estado hídrico das plantas, medindo a suculência foliar e os teores de água em folhas, colmos + bainha e raízes;
c) Nas trocas gasosas (fotossíntese líquida, transpiração, condutância estomática e concentração interna de CO2) e nos teores de clorofila;
d) Nos parâmetros de fluorescência: qP (quenching fotoquímico), NPQ (quenching não-fotoquímico) e Φ PSII (eficiência fotoquímica efetiva do PSII);
f) Na atividade das enzimas antioxidativas: catalase, dismutase do superóxido, peroxidase do ascorbato, peroxidase do guaiacol, e nos teores dos antioxidantes não-enzimáticos, glutationa e ascorbato em folhas e raízes;
g) Na peroxidação dos lipídios de membrana, determinando os teores de malondialdeído, em folhas e raízes;
4. MATERIAL E MÉTODOS
4.1. Material vegetal e condições de cultivo
No presente trabalho, sementes de sorgo forrageiro [Sorghum bicolor (L.) Moench], genótipo CSF 18, provenientes do Instituto Agronômico de Pernambuco (IPA), Recife-PE, foram tratadas superficialmente com NaOCl a 1% (v/v), por 5 min, antes de serem semeadas em copos plásticos contendo vermiculita umedecida com água destilada. Decorridos sete dias da semeadura, as plântulas mais uniformes foram transferidas para bacias plásticas (10 plantas por bacia), contendo 10 L de solução nutritiva de Hoagland (diluída 1:2), pH 5,5. Após sete dias de aclimatação nas bandejas, as plântulas foram divididas em dois grupos e os tratamentos foram iniciados. A um grupo foi adicionado NaCl na dose de 75 mM. O outro grupo de plântulas permaneceu em solução nutritiva 1:2 na ausência de NaCl (controle). Os níveis das soluções nos vasos foram mantidos diariamente pela adição de água destilada e, a cada cinco dias, as soluções nutritivas foram trocadas por uma nova com a finalidade de evitar deficiências nutricionais.
O experimento foi realizado em casa de vegetação, pertencente ao Departamento de Bioquímica e Biologia Molecular da Universidade Federal do Ceará, durante os meses de fevereiro e março de 2012. Durante o experimento, a intensidade de fluxo de fótons fotossintéticos, ao meio-dia, foi de 1.500 µmol m-2
4.2. Coleta das plantas e medidas de crescimento
As coletas do material vegetal foram realizadas aos 0, 5, 10 e 15 dias do início dos tratamentos. Durante a coleta, as plantas foram divididas em folhas, colmos + bainha e raízes, sendo, em seguida, determinada a matéria fresca (MF) do material. A área foliar (AF) foi determinada com um medidor de área LI-3100 (Area Meter, LI-Cor., Inc., Lincoln, Nebraska, USA). O material vegetal foi congelado em nitrogênio (N2) líquido e armazenado a -25 ºC até
posterior utilização nas análises bioquímicas. Para a obtenção das matérias secas (MS), as folhas, colmos + bainha e raízes foram postos em estufa a 60 °C para secagem durante três dias, quando atingiram peso constante. Com essas medidas, e com base nos valores das matérias frescas (MF) foram estimadas as matérias secas da parte aérea (MSPA), das raízes (MSR), total (MST) e a relação MSR/MSPA.
4.3. Teor de água e suculência foliar
Os teores de água (TA) foram determinados em folhas, colmos + bainha e raízes, empregando-se a fórmula: TA = [(MF-MS)/MF] x 100, conforme Barrs (1968), sendo expressos em percentagens.
A suculência foliar (SF) foi determinada segundo Benincasa (1988), empregando-se a fórmula: SF= (MFfolha – MSfolha) (AF)-1, sendo expressa em mg H2O cm-2.
4.4. Parâmetros fotossintéticos, fluorescência e teor de clorofila
Os parâmetros de trocas gasosas (fotossíntese líquida, transpiração, condutância estomática e concentração interna de CO2) e de fluorescência da clorofila foram determinados
intensidade luminosa utilizada nas medições de trocas gasosas foi de 1.000 µmol m-2 s-1, enquanto que para as medidas de fluorescência da clorofila utilizou-se uma intensidade de 3.000 µmol m-2 s-1. Com as folhas na presença de luz, foram determinados os parâmetros de fluorescência do estado adaptado à luz: qP (quenching fotoquímico), NPQ (quenching não-fotoquímico) e Φ PSII (eficiência fotoquímica efetiva do PSII). As leituras de fluorescência variável (Fv) e máxima (Fm) foram determinadas em folhas adaptadas ao escuro por 30 min e utilizadas para o cálculo da eficiência fotoquímica potencial do PSII, expressa pela relação Fv/Fm.
Nos mesmos dias, entre 15:00 e 16:00 h, foram realizadas as determinações dos teores relativos de clorofila total, na primeira folha completamente expandida, utilizando-se de um medidor portátil (SPAD-502, Minolta Co., Ltd., Osaka, Japan). Para essa análise foram realizadas três medições por folha, e destas foi obtida uma média.
4.5. Determinação dos teores de solutos inorgânicos
Os teores dos íons sódio, potássio e cloreto foram determinados em tecidos de folhas, colmos + bainha e raízes. Para a preparação dos extratos utilizou-se o método descrito por Cataldo et al. (1975), com a homogeneização de 100 mg do material vegetal seco em estufa, finamente triturado, com 10 mL de água desionizada por 1 h em banho-maria a 40 °C. Os tubos foram agitados vigorosamente a cada 15 min e, em seguida, o homogenato foi centrifugado a 3.000 x g por 10 min. O sobrenadante obtido foi então filtrado em papel de filtro e armazenado a -25 °C. Os teores de sódio e potássio foram determinados por fotometria de chama, segundo Malavolta, Vitti e Oliveira (1989). Para a determinação dos teores de cloreto, a 3,0 mL do extrato, convenientemente diluído, foram adicionados 0,5 mL do reagente formado pela mistura de Hg(SCN)2 a 13,2 mM, em metanol e Fe(NO3)3.9H2O a
permaneceram em repouso por 15 min, sendo os teores de cloreto estimados através de leituras de absorbância em 460 nm, utilizando-se o NaCl como padrão (GAINES; PARKER; GASCHO, 1984).
Nas análises dos íons sódio e potássio foi realizada uma única leitura do extrato, convenientemente diluído, no fotômetro de chama, enquanto que, para a determinação de cloreto, cada extrato (repetição) foi dosado em duplicata. Os teores de solutos inorgânicos foram expressos em µmol g-1
MS.
4.6. Determinação dos teores de solutos orgânicos
4.6.1. Obtenção dos extratos
Os extratos brutos foram obtidos a partir da homogeneização de 1 g do tecido fresco de folhas e raízes com 10 mL de tampão fosfato de potássio a 100 mM, pH 7,0, contendo EDTA a 0,1 mM e ascorbato a 1 mM. O homogenato resultante foi filtrado em tecido de musselina e centrifugado a 20.000 x g durante 15 min. Todas as operações descritas anteriormente foram conduzidas à temperatura de aproximadamente 4 °C. Esses extratos também foram utilizados nas determinações das atividades das enzimas do sistema antioxidativo (item 4.8).
4.6.2. Carboidratos solúveis
curva padrão de D(+) glicose anidra. Cada extrato (repetição) foi dosado em duplicata, sendo os resultados expressos em µmol g-1
MF.
4.6.3. Prolina livre
Os teores de prolina livre foram determinados de acordo com Bates, Waldren e Teare (1973). Em uma alíquota de 1,0 mL do extrato, convenientemente diluído, foram adicionados 1,0 mL do reagente da ninhidrina ácida e 1,0 mL de ácido acético glacial. Para um total de 50 amostras, o reagente da ninhidrina ácida foi preparado dissolvendo-se 1,25 g de ninhidrina em 30 mL de ácido acético e 20 mL de ácido fosfórico a 6 M. Os tubos de ensaio foram hermeticamente fechados e, após a homogeneização da mistura de reação, foram colocados em banho-maria a 100 °C por 1 h. A reação foi interrompida colocando-se os tubos de ensaio em banho de gelo. Após o resfriamento, foram adicionados 2,0 mL de tolueno ao meio de reação. Após agitação vigorosa da solução, a fase superior menos densa (cromóforo + tolueno) foi aspirada com o auxílio de uma pipeta Pasteur e submetida à leitura de absorbância em 520 nm, sendo o tolueno utilizado como branco. Os teores de prolina livre foram estimados com base em uma curva padrão ajustada a partir de concentrações crescentes de prolina. Cada extrato (repetição) foi dosado em duplicata, sendo os resultados expressos em µmol g-1
MF.
4.6.4. N-aminossolúveis
100 °C durante 20 min. A reação foi interrompida abruptamente colocando-se os tubos em banho de gelo e, após resfriamento, foram adicionados 0,65 mL de etanol a 60%. Os teores de N-aminossolúveis foram estimados através de leituras de absorbância em 570 nm, com base em uma curva padrão ajustada a partir de concentrações crescentes de glicina. Cada extrato (repetição) foi dosado em duplicata, sendo os resultados expressos em µmol g-1
MF.
4.6.5. Proteínas solúveis
Os teores de proteínas solúveis foram determinados pelo método de ligação ao corante “Coomassie Blue” descrito por Bradford (1976). Para um volume final de 1,0 L, o reagente foi preparado dissolvendo-se 153,84 mg de Coomassie Brilliant Blue G-250 (Sigma Chemical, St. Louis, MO, USA) em 50 mL de etanol a 95%, seguindo-se da adição de 100 mL de ácido fosfórico a 85%. O volume final foi completado pela adição de água destilada. A 0,1 mL da amostra foi adicionado 1,0 mL do reagente de Coomassie. A mistura foi deixada em repouso por 15 min e, em seguida, submetida a leituras de absorbância em 595 nm, utilizando-se como branco a mistura de 0,1 mL de água destilada e 1,0 mL do reagente de coomassie. As concentrações de proteína solúveis foram estimadas com base numa curva padrão ajustada a partir de concentrações crescentes de albumina sérica bovina (Sigma Chemical Co., Saint Louis, MO, USA). Os resultados foram expressos em mg g-1 MF, sendo cada extrato (repetição) dosado em duplicata.
4.6.6. Determinação de poliaminas livres
completa homogeneização, as amostras foram incubadas em banho de gelo por 1 h e posteriormente centrifugadas a 12.000 x g por 30 min, a 4 oC. O precipitado foi ressuspendido com 2,0 mL de PCA a 5% e submetido a nova centrifugação. Esse procedimento foi repetido por mais três vezes. Os quatro sobrenadantes coletados (extrato) foram utilizados para determinação das poliaminas livres.
As poliaminas livres presentes nos extratos foram, em seguida, derivatizadas, segundo metodologia descrita por Duan, Guo e Kang (2008). Para isso, 200 µL de cada extrato foram
misturados com 2,0 mL de NaOH a 2 N e 15 µL de cloreto de benzoíla. As amostras foram então agitadas vigorosamente por 10 s e incubadas por 30 min a 37 oC. Em seguida, foram adicionados às amostras 4,0 mL de uma solução saturada de NaCl, com a finalidade de parar a reação. As poliaminas derivatizadas foram extraídas com 2,0 mL de éter dietílico. Após isso, retirou-se 1,0 mL da fase orgânica, que foi em seguida evaporada sob fluxo de nitrogênio gasoso, sendo o material remanescente ressuspendido em 100 µL de metanol.
de 370 oC; voltagens de 3500 V para PI e 3500 V para NI; e a voltagem de campo do spray de 600 V foram utilizados.
A identificação dos compostos foi baseada nos espectros de massas dos íons moleculares, os quais foram comparados com os padrões de putrescina (Put), espermidina (Spd) e espermina (Spm). Os picos correspondentes às poliaminas foram detectados e comparados com curvas padrões construídas a partir de diferentes concentrações (Xu et al., 2011). Os resultados foram expressos em µmol g-1
MF.
4.7. Determinação de H2O2
Os extratos para a determinação dos teores de peróxido de hidrogênio foram obtidos a partir da homogeneização do material fresco (0,5 g) com 5,0 mL de ácido tricloroacético (TCA) a 5%, seguido de centrifugação a 12.000 x g por 15 min a 4º C. O sobrenadante resultante (extrato) foi utilizado tanto para as determinações de peróxido de hidrogênio quanto para as determinações de ascorbato e glutationa e malondialdeído (MDA).
A determinação de H2O2 foi feita de acordo com método desenvolvido por Sergiev,
Alexieva e Karanov (1997). Para isso, alíquotas de 0,2 mL do extrato foram adicionados a 0,2 mL de tampão fosfato de potássio a 10 mM (pH 7,0) e 0,4 mL de KI a 1 M. A mistura foi deixada no escuro por 1 h e, em seguida, foram realizadas leituras de absorbância a 390 nm. Os teores de peróxido de hidrogênio foram estimados a partir de uma curva padrão, utilizando-se H2O2 a concentrações conhecidas, sendo os resultados expressos em µmol g-1
4.8. Determinações de antioxidantes não enzimáticos
4.8.1. Determinação de glutationa
Os conteúdos de glutationa total [glutationa reduzida (GSH) + glutationa oxidada (GSSG)] e de GSH foram determinados conforme Griffth (1980), com algumas modificações. Para a determinação de GSH, alíquotas de 0,2 mL do extrato foram adicionadas ao meio de reação contendo 2,6 mL de tampão fosfato de sódio a 150 mM (pH 7,4) e 0,2 mL de tampão fosfato de sódio a 100 mM (pH 6,8), contendo 5-5’-ditio-bis-2-ácido-nitrobenzóico (DTNB) 6 mM. A mistura, após agitação, foi deixada em banho-maria a 30 °C por 10 min, sendo a reação parada pela imersão dos tubos de ensaio em banho de gelo.
O conteúdo de GSH + GSSG foi determinado após a redução da GSSG pela ação da enzima redutase da glutationa (GR). O meio de reação consistiu da adição de 0,2 ml do extrato ao meio de reação composto por 1,6 mL de tampão fosfato de sódio a 150 mM (pH 7,4), contendo 1 U de redutase da glutationa (GR) por mL; 1,0 mL de NADPH a 150 µM, em tampão fosfato de sódio a 150 mM; e 0,2 ml de tampão fosfato de sódio a 100 mM (pH 6,8), contendo DTNB 6 mM. A mistura de ração foi mantida em banho-maria a 30 ºC por 10 min, sendo seguida de banho de gelo para cessar a reação.
Para ambas as reações descritas acima, as determinações de GSH e glutationa total foram feitas através de leituras de absorbância em 412 nm, sendo os conteúdos estimados com base em uma curva padrão feita com concentrações conhecidas de GSH. Os resultados foram expressos em µmol g-1
MF. O estado redox para a glutationa foi obtido pela fórmula: (GSH) (GSH+GSSG)-1 x 100, sendo o resultado expresso em percentagem.
4.8.2. Determinação de ascorbato
com algumas modificações. Para determinação do ASA, a mistura de reação constou de uma alíquota de 0,1 mL do extrato em um meio contendo: 0,3 mL de tampão fosfato de potássio a 200 mM (pH 7,4); 0,1 mL de água destilada; 0,5 ml de TCA a 10%; 0,4 mL de H3PO4 a 42%;
0,4 ml de bipiridil a 4%; e 0,2 mL de FeCl3 a 3%. A mistura foi agitada e mantida em
banho-maria a 42 °C, por 40 min, seguida de banho de gelo para interromper a reação.
O ascorbato total foi determinado após a redução do DHA pelo ditiotreitol (DTT). Para isso, a mistura de reação constou da adição de 0,1 mL de extrato a um meio contendo: 0,1 mL de DTT a 10 mM (em tampão fosfato de potássio a 200 mM, pH 7,4) e 0,2 mL de tampão fosfato de potássio a 200 mM, pH 7,4, sendo a mistura agitada e mantida em banho-maria a 42 °C por 15 min. Em seguida, adicionaram-se 0,1 mL de N-etilmaleiamida a 0,5% e aguardou-se o tempo de 2 min para então acrescentar os demais reagentes: 0,5 mL de TCA a 10%; 0,4 mL de H3PO4 a 42%; 0,4 mL de bipiridil a 4%, em etanol a 70%; e 0,2 mL de FeCl3
a 3%. A mistura foi agitada e mantida em banho-maria a 42 °C, por 40 min, seguida de banho de gelo para interromper a reação.
Para ambas as reações acima descritas, as determinações de ASA e de ascorbato total foram estimadas pelas leituras de absorbância em 525 nm, com base em uma curva padrão construída com concentrações conhecidas de L-ascorbato (ASA). Os resultados foram expressos em µmol g-1
MF e o estado redox para o ascorbato foi obtido pela fórmula: (ASA) (ASA + DHA)-1 x 100, sendo o resultado expresso em percentagem.
4.9. Atividade das enzimas do sistema antioxidativo
4.9.1. Catalase
A atividade da CAT foi determinada segundo Beers e Sizer (1952), com algumas modificações. O meio de reação consistiu de uma mistura contendo 50 µL de extrato, tampão fosfato de potássio a 100 mM (pH 7,0), contendo EDTA a 0,1 µM, e H2O2 a 20 mM, em um
volume final de 1,5 mL. Os tubos contendo o meio de reação foram deixados em banho-maria a 30 °C até o momento das leituras espectofotométricas. O consumo de H2O2 foi monitorado
através do decréscimo da absorbância a 240 nm durante 5 min. A diferença na absorbância (∆A240) foi dividida pelo coeficiente de extinção molar do H2O2 (36 M-1 cm-1) e os resultados
foram expressos em µmol H2O2 g-1 MF.
4.9.2. Peroxidase do ascorbato
A atividade da APX foi avaliada pelo método de Nakano e Asada (1981), sendo a oxidação do ascorbato medida pelo decréscimo da absorbância a 290 nm. O ensaio consistiu da adição de 50 µ L do extrato enzimático a um meio de reação contendo 1,35 mL de tampão fosfato de potássio 0,05 M com EDTA 0,05 mM (pH 6,0); 50 µ L de H2O2 a 3 mM e 50 µ L de
ácido ascórbico a 15 mM. Os tubos contendo o meio de reação foram deixados em banho-maria a 30 °C até o momento das leituras espectrofotométricas. O volume final de reação foi de 1,5 mL. A oxidação do ascorbato foi monitorada pela leitura de absorbância a 290 nm no momento da adição do H2O2, numa concentração final de 1 mM, juntamente com o extrato e
ascorbato numa concentração final de 0,5 mM. A diferença de absorbância (ΔA290) foi
dividida pelo coeficiente de extinção molar do ascorbato (2,8 mM-1 cm-1) e a atividade enzimática foi expressa em µmol H2O2 g-1 MF, considerando que 2 moles do ascorbato são
4.9.3. Peroxidase do guaiacol
A atividade da GPX foi determinada como descrito por Urbanek, Kuzniak-Gebarowska e Herka (1991). O meio da reação consistiu em uma mistura contendo 50 µ L do extrato enzimático, 950 µ L de tampão fosfato de potássio a 0,1 M (pH 7,0), contendo EDTA a 0,1 µM, 0,5 mL de guaiacol a 5 mM e 0,5 ml de H2O2 a 15 mM, perfazendo um volume total
de 2,0 mL. Os tubos contendo o meio de reação foram deixados em banho-maria a 30 °C até o momento das leituras espectofotométricas. A oxidação do guaiacol (formação do tetraguaiacol) foi monitorada pela leitura da absorbância a 470 nm, através do incremento da absorbância, devido à formação do tetraguaiacol, no momento da adição do H2O2 e 1 min
após. A diferença na absorbância (ΔA470) foi dividida pelo coeficiente de extinção molar do
tetraguaiacol (26,6 mM-1 cm-1) e a atividade enzimática expressa em µmol H2O2 g-1 MF,
considerando que quatro moles de H2O2 são necessários para produzir 1 mol de tetraguaiacol.
4.9.4. Dismutase do superóxido