UNIVERSIDADE FEDERAL DO PARÁ INSTITUTO DE CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
AVALIAÇÃO DO POTENCIAL BIOTECNOLÓGICO DE COMPOSTOS ISOLADOS DE Swietenia macrophylla NO TRATAMENTO DE CÂNCER
LEILANE DE HOLANDA BARRETO
UNIVERSIDADE FEDERAL DO PARÁ INSTITUTO DE CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
AVALIAÇÃO DO POTENCIAL BIOTECNOLÓGICO DE COMPOSTOS ISOLADOS DE Swietenia macrophylla NO TRATAMENTO DE CÂNCER
LEILANE DE HOLANDA BARRETO
Tese apresentada ao Programa de Pós-Graduação em Biotecnologia da Universidade Federal do Pará, como parte dos requisitos para obtenção do título de Doutor em Biotecnologia.
Orientadora:
Profª. Drª. Raquel Carvalho Montenegro
LEILANE DE HOLANDA BARRETO
AVALIAÇÃO DO POTENCIAL BIOTECNOLÓGICO DE COMPOSTOS ISOLADOS DE Swietenia macrophylla NO TRATAMENTO DE CÂNCER
Tese apresentada ao Programa de Pós-Graduação em Biotecnologia da Universidade federal do Pará, como parte dos requisitos para obtenção do título de Doutor em Biotecnologia.
Orientadora:
Profª. Drª. Raquel Carvalho Montenegro
Belém, 30 de novembro de 2015
BANCA EXAMINADORA
____________________________________________ Orientadora: Profª. Dra. Raquel Carvalho Montenegro
____________________________________________ Profª. Dra. Luciana Pereira Xavier
____________________________________________ Prof. Dr. Moysés dos Santos Miranda
____________________________________________ Prof. Dr. Milton Nascimento da Silva
DEDICATÓRIA
Para Honra e Glória do Senhor Jesus Cristo.
E às duas pessoas mais importantes da minha vida:
AGRADECIMENTOS
Obrigada Senhor, por Teu imenso amor, por me guiar e me proteger por toda a minha vida. Agradeço-Te por teres permitido que eu contemplasse alguns detalhes da Tua maravilhosa criação. Para sempre serei agradecida!
À minha família, por estar sempre ao meu lado, me incentivando e me apoiando, sendo pacientes e amigos. Por tudo o que vocês representam em minha vida: AMOR INCONDICIONAL!!!
Ao meu amor, melhor amigo, companheiro de todas as horas, Jorge Felipe. Obrigada pelos momentos de paciência, compreensão, atenção, brincadeiras, pelo abraço apertado nos momentos de dificuldade, e principalmente pelo seu imenso carinho e amor. Te amo!
À minha orientadora Raquel Carvalho Montenegro, pela confiança, paciência e amizade. Agradeço a oportunidade de aprender e conviver com você!
Aos meus amigos e companheiros Danielle Feio, Laine Pinto, Bruno Soares e Ingryd Ramos, pelo carinho, paciência, companhia e grande ajuda na realização desse trabalho. Obrigada por estarem ao meu lado em todos os momentos!
Ao professor “tio” Rommel Burbano, pela valiosa ajuda no desenvolvimento desse trabalho.
Ao professor Milton Silva, pela confiança para dar continuidade a esse trabalho.
Aos colegas do Laboratório de Citogenética Humana, pela força e companheirismo ao longo dessa caminhada.
À coordenação do Programa de Pós-graduação em Biotecnologia. À CAPES e ao CNPq, pelo suporte financeiro.
À Universidade Federal do Pará.
EPÍGRAFE
“Pois será como a árvore plantada junto a ribeiros de águas, a qual dá o seu fruto no seu tempo; as suas folhas não cairão, e tudo quanto fizer prosperará.”
RESUMO
Swietenia macrophylla (mogno) é uma espécie de planta amplamente conhecida pelo seu potencial terapêutico. Os principais constituintes de extratos isolados de partes dessa planta são estruturas conhecidas como limonoides. Os limonoides também apresentam várias atividades biológicas, dentre elas, ação antitumoral. O objetivo desse trabalho foi avaliar o potencial antitumoral do extrato e de limonoide obtido de folhas de S. macrophylla em linhagens tumorais. A avaliação da citotoxicidade frente a 5 linhagens tumorais e uma normal, revelou que o extrato teve ação citotóxica em linhagens de câncer coloretal (HCT-116 e HT-29), já os limonoides foram citotóxicos para câncer colorretal (HCT-116) e melanoma (SKMEL-19). Diante desses resultados, foram selecionados o limonoide L3 e a linhagem HCT-116 para avaliação do mecanismo de ação, assim como a linhagem HT-29, que possui o gene TP53 mutado para comparação do possível mecanismo de ação do composto, haja vista que foi menos sensível a L3. Além disso, L3 se mostrou mais seletiva para células tumorais. Nenhum dos compostos causou hemólise em eritrócitos de camundongos. Para avaliação da ação antiproliferativa de L3, foi realizado o ensaio clonogênico, onde nas duas linhagens houve significativa redução de colônias, no entanto essa redução foi mais expressiva em HCT-116. O composto L3 também causou morte por apoptose de maneira dose-dependente nas linhagens, onde o número de células em processo de apoptose foi maior na HCT-116. Para avaliação de dano ao DNA, foi realizado o ensaio do cometa, o qual demonstrou que L3 causa dano no DNA das duas linhagens, com índice de dano maior na HCT-116. A avaliação da distribuição de células pelo ciclo celular após tratamento com L3 mostrou que houve bloqueio do ciclo na fase G2/M, principalmente na HCT-116 (45% das células). A partir desses dados, foi realizado um estudo de genes implicados nessa fase do ciclo, a partir da análise de suas expressões por PCR-RT. O gene ATM, o qual é ativado mediante a danos no DNA, ativa o CHK-2 que por sua vez fosforila p53. p53 pode ativar a transcrição de p21, o qual desencadeia parado ciclo celular, ou ativar vias de morte celular. Neste trabalho, foi verificado aumento da expressão dos genes ATM, CHK-2, TP53, ARF de maneira dose dependente nas duas linhagens, sendo essa expressão foi maior em células da linhagem HCT-116. A expressão de p21 foi aumentada em HCT-116, ao passo que em HT-29 diminuiu, isso se deve ao fato que HT-29 possuir o gene TP53 mutante, logo sua proteína não funciona corretamente. Quanto a via da apoptose, foi avaliado o gene da caspase-3 e o gene antiapoptótico BCL-2. Houve aumento na expressão de caspase-3, principalmente em HCT-116, e diminuição de BCL-2. Esses resultados sugerem que L3 possa estar causando danos ao DNA das células, desencadeando uma via de sinalização celular dependente de p53. Para avaliação da toxicidade do extrato de S. macrophylla, foi realizado o teste de toxicologia aguda em camundongos, onde o extrato não causou nenhuma alteração nos parâmetros fisiológicos dos animais. Assim como, o teste de claustogenicidade (micronúcleo) também mostrou que o extrato não é mutagênico em células da medula óssea de camundongos.
ABSTRACT
Swietenia macrophylla (mahogany) is a species of plant widely known for its therapeutic potential. The main constituents isolated extracts of this plant are structures known as limonoids. The limonoids also have several biological activities, among them, antitumor activity. The aim of this study was to evaluate the antitumor potential of the extract and limonoid obtained from leaves of S. macrophylla in cancer cell lines. Cytotoxicity to 5 cancer cell lines and normal revealed that the extract had cytotoxic effect in colorectal cancer cell lines (HCT-116 and HT-29), as the limonoids were cytotoxic for colorectal cancer (HCT-116) and melanoma (SKMEL-19). Given these results, we selected the limonoid L3 and HCT-116 cell line to evaluate the mechanism of action, as well as the HT-29 lineage, which has the TP53 gene mutated for comparison as possible of the compound mechanism of action, once it was less sensitive to L3. Moreover, L3 showed more selective for tumor cells. None of the compounds caused hemolysis of erythrocytes in mice. To evaluate the antiproliferative action of L3, the clonogenic assay was performed, where the two lines there was a significant reduction of colonies, however this reduction was more significant in HCT-116. The L3 compound also has caused death by apoptosis in a dose-dependent manner in the lines, where the number of cells in apoptosis was higher in HCT-116. To evaluate DNA damage, it was held the comet assay, which showed that L3 cause damage to the DNA of the two cancer cell lines, with greater damage index in HCT-116. The assessment of cell cycle distribution of cells after treatment with L3 showed that there was blocking the cycle at the G2 / M phase, mainly in HCT-116 (45% of the cells). From these data, it conducted a study of genes involved in this phase of the cycle, from analysis of their expression by RT-PCR. The ATM gene, which is activated by DNA damage activates the CHK-2 which in turn phosphorylates p53 protein. p53 protein can activate the transcription of p21 gene, which triggers cell cycle stopped, or activate cell death pathways. In this study, we found increased expression of genes ATM, CHK-2, TP53, ARF in a dose dependent in both cacer cell lines, and this expression was higher in HCT-116 cell line. The expression of p21 was increased in HCT-116, while in HT-29 decreased, this is due to the fact that HT-29 possess the mutant TP53 gene, then your protein does not work properly. As the path of apoptosis was evaluated caspase-3 gene and the anti-apoptotic gene BCL-2. There was increase in the expression of caspase-3 mainly in HCT-116 and decrease of BCL-2. These results suggest that L3 may be causing damage to the DNA of cells, triggering a cellular signaling pathway dependent on p53. To evaluate the toxicity of S. macrophylla extract, it was held the acute toxicology testing in mice, where the extract did not cause any changes in the physiological parameters of animals. As the claustogenicidade test (micronucleus) also showed that the extract is not mutagenic in the mouse bone marrow cells.
LISTA DE TABELAS
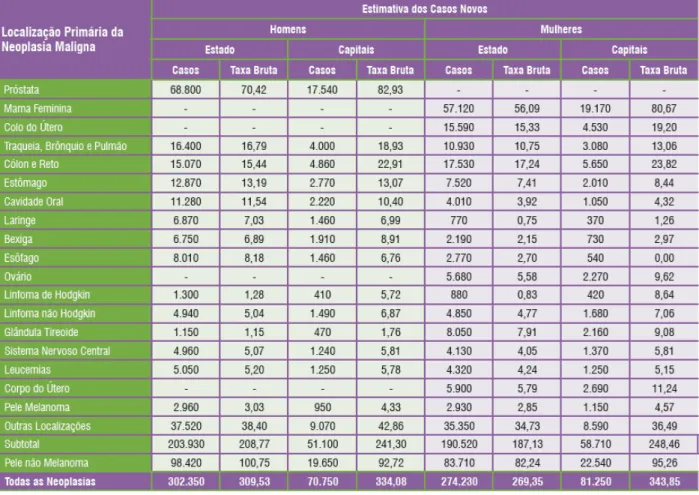
Tabela 1: Distribuição proporcional dos dez tipos de cânceres mais incidentes por sexo, estimados para 2014, exceto pele não melanoma.
Tabela 2: Estimativas para o ano de 2014/2015 das taxas brutas de incidência por 100 mil habitantes e do número de casos novos por câncer, segundo sexo e localização primária.
Tabela 3: Estadiamento do câncer colorretal baseado no sistema TNM definido pelo AJCC.
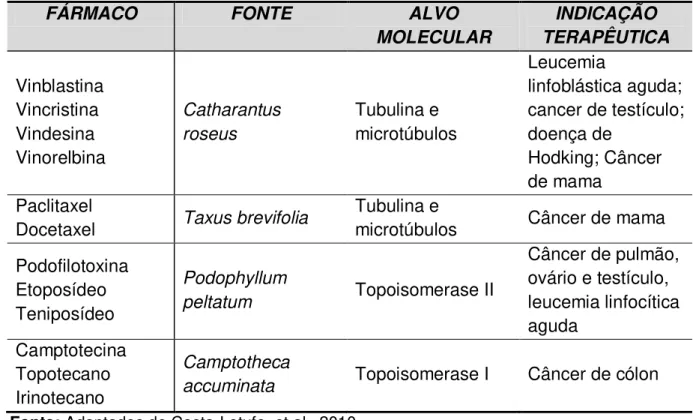
Tabela 4: Produtos naturais ou fármacos derivados de plantas utilizados na terapia do câncer.
Tabela 5: Linhagens celulares utilizadas neste estudo.
Tabela 6: Valores da concentração da CI50 (concentração inibitória média do
crescimento celular em μM), com a realização do teste do MTT, após 72h de incubação, para cinco linhagens tumorais (HCT-116, HT-29, ACP-03, SKMEL19, MDAMB231) e linhagem normal de fibroblasto pulmonar humano (MRC5).
Tabela 7: Efeito de L3 sobre a distribuição das fases do ciclo celular em células HCT-116 tratadas por 48 e 72h, avaliado por citometria de fluxo.
LISTA DE FIGURAS
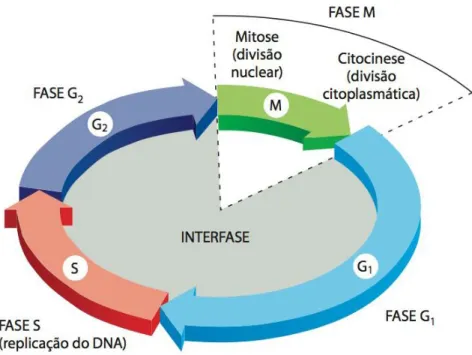
Figura 1: As quatro fases do ciclo celular: G1, S, G2 e M, culminando na divisão citoplasmática, citocinese.
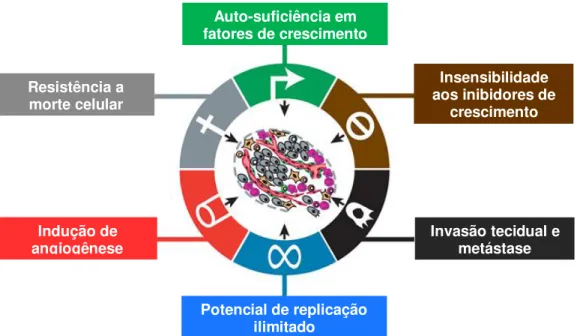
Figura 2: Características adquiridas por células tumorais.
Figura 3: Classificação visual dos danos, representados em uma escala de 0-4, sugeridos por Collins et al (1997). Imagens de cometas (a partir de linfócitos), coradas com Brometo de Etídio.
Figura 4: Estrutura química do limonoide L3, isolado de folhas de Swietenia macrophylla (Meliaceae).
Figura 5: Efeito de L3 sobre as linhagens HCT-116 (A) e HT-29 (B) no ensaio clonogênico, após 8 dias de incubação.
Figura 6: Análise do padrão de morte celular ocasionada pelo limonoide L3 nas linhagens de câncer colorretal HCT-116 e HT-29, através da coloração diferencial de brometo de etídio/laranja de acridina.
Figura 7: Níveis de expressão do gene ATM nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 8: Níveis de expressão do gene CHK-2 nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 9: Níveis de expressão do gene TP53 nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 10: Níveis de expressão do gene ARF nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 11: Níveis de expressão do gene p21 nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 12: Níveis de expressão do gene da caspase-3 nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 13: Níveis de expressão do gene BCL-2 nas linhagens HCT-116 e HT-29, após 48 e 72h de tratamento com L3.
Figura 14: Índice de dano causado pelo tratamento com L3 nas linhagens de câncer colorretal HCT-116 e HT-29.
LISTA DE SIGLAS E SÍMBOLOS
µg Micrograma
µL Microlitro
µM Micromolar
°C graus celsius
AJCC American Joint Comittee on Cancer ANVISA Agência Nacional de Vigilância Sanitária ARF ADP-ribosylation factor
ATCC American Type Culture Collection ATM Ataxia-telangiectasia mutated ATR Ataxia telangiectasia Rad3 related BAX Bcl-2 associated X protein
BE/LA Brometo de etídeo / Laranja de Acridina BCL-2 B-cell lymphoma 2
Brca1 Breast cancer 1, early onset CDK Cinase dependente de ciclina CE50 Concentração efetiva mediana CHK-2 Checkpoint kinase 2
CI50 Concentração inibitória média CKI Cinases inibidoras de CDK
CO2 Gás carbônico
CTL Controle negativo DMSO Dimetilsulfóxido
DNA Ácido desoxirribonucleico
DOX Doxorrubicina
EDTA Ácido etilenodiaminotetracético ENC Eritrócitos normocromáticos EPC Eritrócitos policromáticos
FASR Fas Receptor
G Gap
HCT-116 Carcinoma colorretal
HPLC Cromatografia Líquida de Alta Eficiência HT-29 Adenocarcinoma colorretal
IEC Instituto Evandro Chagas
IGF-BP3 Insulin-like growth factor binding protein 3 INCA Instituto Nacional do Câncer
INPI Instituto Nacional da Propriedade Industrial IP Iodeto de propídeo
Km² Quilômetro quadrado
L Limonoide
LABCROL Laboratório de Cromatografia Líquida MDA-MB-231 Adenocarcinoma mamário
Mdm2 Mouse double minute 2
mg Miligrama
mL Mililitro
mM Milimolar
mRNA RNA mensageiro
MTT Sal de tetrazolium
MRC-5 Fibroblasto pulmonar normal
nm Nanômetro
OECD Organisation for Economic Co-operation and Development OMS Organização Mundial da Saúde
PBS Phosphate buffered saline PCNA Proliferating cell nuclear antigen RNA Ácido ribonucleico
rpm Rotações por minuto
RPMI 1640 Roswell Park Memorial Institute - meio de cultura
S Síntese
SBF Soro bovino fetal SKMEL 19 Melanoma
SMEAF Fração etilacetato de Swietenia macrophylla SM-EE Extrato etanólico de Swietenia macrophylla
TMN Tumour-node-metastasis
UFPA Universidade Federal do Pará
SUMÁRIO
1 INTRODUÇÃO 16
1.1 CÂNCER 16
1.2 CÂNCER COLORRETAL 20
1.3 PRODUTOS NATURAIS E TRATAMENTO DE CÂNCER 23
1.4 LIMONÓIDES ISOLADOS DE Swietenia macrophylla 25
2 OBJETIVOS 29
2.1. OBJETIVO GERAL 29
2.2. OBJETIVOS ESPECÍFICOS 29
3 MATERIAL E MÉTODOS 30
3.1 EXTRATO ETANÓLICO E LIMONÓIDES DE Swietenia macriphylla 30
3.2 CULTIVO DAS LINHAGENS CELULARES 30
3.3 DETERMINAÇÃO DA ATIVIDADE HEMOLÍTICA EM ERITRÓCITOS
DE CAMUNDONGOS (Mus musculus, Swiss) 31
3.4 AVALIAÇÃO DA ATIVIDADE ANTIPROLIFERATIVA EM LINHAGENS DE CÉLULAS TUMORAIS E NORMAIS IN VITRO: MÉTODO
COLORIMÉTRICO DO MTT
32
3.5 ENSAIO CLONOGÊNICO 34
3.6 ANÁLISE DO PADRÃO DE MORTE CELULAR
(APOPTOSE/NECROSE) ATRAVÉS DA COLORAÇÃO DIFERENCIAL DE BROMETO DE ETÍDIO/LARANJA DE ACRIDINA.
35
3.7 ANÁLISE DO CICLO CELULAR E FRAGMENTAÇÃO DO DNA POR
CITOMETRIA DE FLUXO 36
3.8 ANÁLISE DA EXPRESSÃO DE mRNA por PCR EM TEMPO REAL
QUANTITATIVA (PCR-RT) 37
3.9 AVALIAÇÃO DA GENOTOXICIDADE IN VITRO: TESTE DO COMETA 39
3.10 TOXICOLOGIA AGUDA (OECD,423, 2001) 42
3.11 TESTE DO MICRONÚCLEO IN VIVO (OECD, 497, 1997) 44
4 RESULTADOS 46
4.1 DETERMINAÇÃO DA ATIVIDADE HEMOLÍTICA EM ERITRÓCITOS
DE CAMUNDONGOS (Mus musculus, Swiss) 46
DE CÉLULAS TUMORAIS E NORMAIS IN VITRO: MÉTODO COLORIMÉTRICO DO MTT
4.3 ENSAIO CLONOGÊNICO 48
4.4 ANÁLISE DO PADRÃO DE MORTE CELULAR
(APOPTOSE/NECROSE) ATRAVÉS DA COLORAÇÃO DIFERENCIAL DE BROMETO DE ETÍDIO/LARANJA DE ACRIDINA
49
4.5 ANÁLISE DO CICLO CELULAR E FRAGMENTAÇÃO DO DNA POR
CITOMETRIA DE FLUXO 50
4.6 ANÁLISE DA EXPRESSÃO DE mRNA por PCR EM TEMPO REAL
QUANTITATIVA (PCR-RT) 52
4.7 AVALIAÇÃO DA GENOTOXICIDADE IN VITRO: TESTE DO COMETA 60
4.8 TOXICOLOGIA AGUDA (OECD,423, 2001) 60
4.9 TESTE DO MICRONÚCLEO IN VIVO (OECD, 497, 1997) 61
5 DISCUSSÃO 63
6 CONCLUSÃO 74
1 INTRODUÇÃO
1.1 CÂNCER
O estudo das bases moleculares do desenvolvimento de tumores (tumorigênese) forneceu suporte para o conceito de que o câncer é uma doença genética causada pelo acúmulo progressivo de alterações moleculares. Este processo confere à célula a propriedade de evasão dos mecanismos de controle homeostático, garantindo a sua própria sobrevivência e proliferação clonal (HANAHAN, WEINBERG, 2000; HANAHAN, WEINBERG, 2011).
A proliferação anormal de células é um traço comum no câncer humano, e em geral, é resultado da desregulação do ciclo celular associada à instabilidade genômica e cromossômica (CERVEIRA et al., 2012). As células tumorais apresentam perda no controle da proliferação celular (ponto de restrição) e, muitas vezes, tornam-se independentes de sinais mitogênicos para a sua progressão através das diferentes fases do ciclo celular (LOURO et al., 2002; CERVEIRA et al., 2012).
Figura 1: As quatro fases do ciclo celular: G1, S, G2 e M, culminando na divisão citoplasmática, citocinese. Fonte: Adaptado de Alberts, B., et al. Biologia Molecular da Célula. 2010.
Figura 2: Características adquiridas por células tumorais. Fonte: Adaptado de Hanahan e Weinberg, 2011.
O gene TP53, chamado de guardião do genoma, é um gene regulador de uma extensa rede que controla a integridade do genoma frente a danos celulares, como alterações cromossômicas, depleção de metabólitos, choque térmico, hipóxia, oncoproteínas virais e ativação de oncogenes celulares (MENENDEZ et al., 2007; MAXIMOV, MAXIMOV, 2008; ELIAS et al., 2014). Tais danos ocorrem durante o desenvolvimento do câncer e resultam em mudanças biológicas, como o equilíbrio entre a apoptose e a sobrevivência celular (MENENDEZ et al., 2007; PETITJEAN et al., 2007; CERVEIRA et al., 2012).
A proteína p53 está diretamente relacionada ao bloqueio do ciclo celular, no caso de dano ao DNA. Esta proteína sinaliza o bloqueio do ciclo celular no ponto de checagem na fase G1/S (Gap – intervalo / Synthesis - síntese). O ponto de checagem corresponde a um mecanismo para impedir a formação de células anômalas. A p53 possui vários mecanismos para efetuar o reparo ou induzir a apoptose, e diferentes fatores induzem essa proteína a gerar resposta celular mais adequada (WU et al., 2006; MAXIMOV, MAXIMOV, 2008; ELIAS et al., 2014).
Várias vias de sinalização, no ciclo celular, são dependentes da ação da p53. A sequência específica do fator de transcrição dessa proteína coordena a expressão de grande número de genes alvo que participam em diferentes respostas celulares a condições de estresse (MENENDEZ et al., 2009).
Auto-suficiência em fatores de crescimento
Insensibilidade aos inibidores de
crescimento
Invasão tecidual e metástase
Potencial de replicação ilimitado
Através da ativação da p21, proteína reguladora da transmissão da fase G1 para S no ciclo celular, p53 controla a fosforilação do complexo molecular ativo ciclina-CDK (cinase dependente de ciclina), interrompendo o ciclo celular (SOLOMON et al., 2011). Pela conjugação da p21 à proteína PCNA (proliferating cell nuclear antigen), p53 promove o reparo ao DNA. Este também ocorre pelo estímulo direto à proteína codificada pelo gene XPC (Xeroderma pigmentosum-complementation 8 group C), que está envolvido com o reparo por excisão de nucleotídeos (SOLOMON et al., 2011).
p53, também, induz a apoptose ao regular a expressão de mediadores anti ou pró-apoptóticos, envolvidos em atividades celulares, como os membros da família de proteínas Bcl-2: NOXA (gene pro-apoptótico), PUMA (p53 upregulated modulator of apoptosis), BAX (Bcl-2 associated X protein), proteína FASR (Fas Receptor) e a proteína IGF-BP3 (Insulin-like growth factor binding protein 3) (SOLOMON et al., 2011).
Apesar dos importantes avanços no entendimento das neoplasias, sobretudo nos últimos 25 anos, o câncer apresenta-se como grande problema de saúde pública tanto nos países desenvolvidos, nos quais ele é a segunda principal causa de morte, como nos países em desenvolvimento, onde ele é a principal causa de morte (JEMAL et al., 2011; INSTITUTO NACIONAL DO CÂNCER, 2014). A Organização Mundial da Saúde (OMS) estimou que, no ano 2030, pode-se esperar 21,4 milhões de casos incidentes de câncer, 13,2 milhões de mortes por câncer em consequência do crescimento e do envelhecimento da população, bem como da redução na mortalidade infantil e nas mortes por doenças infecciosas em países em desenvolvimento (INCA, 2014).
No Brasil, as estimativas para o ano de 2014/2015 apontam que ocorrerão cerca de 576 mil novos casos de câncer (INCA, 2014). Os tipos mais incidentes serão os cânceres de pele não melanoma, próstata, pulmão, colorretal e estômago para o sexo masculino; e os cânceres de pele não melanoma, mama, colo do útero, colorretal e glândula tireoide para o sexo feminino (Tabela 1). Tirando os cânceres de pele não melanoma, de mama na mulher e próstata no homem, o câncer colorretal será o mais prevalente (INCA, 2014).
Tabela 1: Distribuição proporcional dos dez tipos de cânceres mais incidentes por sexo, estimados para 2014, exceto pele não melanoma*.
Fonte: Estimativa 2014: Incidência de Câncer no Brasil. INCA, 2014.
1.2 CÂNCER COLORRETAL
O câncer colorretal está entre os tumores malignos mais comuns. É o terceiro câncer mais frequente no mundo, sendo o quarto tipo de neoplasia mais frequente em nosso país (INCA, 2014). O câncer colorretal configura-se como o terceiro tipo de câncer mais comum entre os homens, com uma estimativa de 746 mil novos casos no mundo para o ano de 2012. Já para o sexo feminino, essa neoplasia é a segunda, com 614 mil casos novos no mundo. Cerca de 60% dos casos ocorrem em regiões mais desenvolvidas (INCA, 2014).
Tabela 2: Estimativas para o ano de 2014/2015 das taxas brutas de incidência por 100 mil habitantes e do número de casos novos por câncer, segundo sexo e localização primária*.
Fonte: Estimativas 2014: Incidência de Câncer no Brasil. INCA, 2014.
Essa neoplasia é considerada de bom prognóstico se a doença for diagnosticada em estágios iniciais (SAGAERT, 2014). A sobrevida média global em cinco anos se encontra em torno de 55% nos países desenvolvidos e 40% para países em desenvolvimento. Os fatores de risco para o desenvolvimento de câncer de cólon podem ser ambientais e genéticos (INCA, 2014).
que tanto a incidência como a mortalidade aumenta com a idade (INCA, 2014; BRENNER et al., 2014).
Em geral, os sinais e sintomas surgem em estádios avançados da doença e são dependentes da localização e tamanho do tumor. São sintomas possíveis: alterações do trânsito intestinal, perdas hemáticas, dor abdominal e sintomas gerais como emagrecimento, anorexia e astenia (SCHWARTZ et al., 2004; LESLIE et al., 2002). Após o estabelecimento do diagnóstico, é importante determinar a extensão da doença quer localmente quer à distância (LESLIE et al., 2002). Apesar de existirem vários sistemas, o Tumour-Node-Metastasis (TNM), definido pelo American Joint Comittee on Cancer (AJCC), é o mais utilizado para o estadiamento do câncer colorretal (SCHWARTZ et al., 2004; WOLPIN; MAYER, 2008; WOLPIN et al., 2007). T representa a profundidade da penetração do tumor, N define o atingimento de gânglios linfáticos e M a presença de metástases à distância (Tabela 3) (WOLPIN, MAYER, 2008).
Tabela 3: Estadiamento do câncer colorretal baseado no sistema TNM definido pelo AJCC.
Tumor Primário (T)
TX: Tumor primário não pode ser avaliado T0: Sem evidência de tumor primário
Tis: Carcinoma in situ: tumor intraepitelial da lâmina própria T1: Tumor invade a submucosa
T2: Tumor invade a musculatura própria
T3: Tumor que invade além da muscular própria, alcançando a subserosa ou os tecidos peri-cólicos ou peri-retais, não peritonizados
T4: Tumor que invade diretamente outros órgãos ou estruturas e/ou que perfura o peritônio visceral
Linfonodos (N)
Nx: Os linfonodos regionais não podem ser avaliados N0: Ausência de metástase em linfonodos regionais N1: Metástase em um a três linfonodos regionais N2: Metástase em quatro ou mais linfonodos regionais Metástase (M)
Mx: A presença de metástase à distância não ode ser avaliada M0: Ausência de metástase à distância
M1: Metástase à distância
Fonte: Adaptado de TNM: classificação de tumores malignos. Ministério da Saúde. Instituto Nacional do Câncer (2004).
1.3 PRODUTOS NATURAIS E TRATAMENTO DE CÂNCER
O tratamento da maioria dos cânceres consiste na combinação de diferentes abordagens terapêuticas e não apenas de uma. A quimioterapia, aliada à cirurgia e à radioterapia, constituem as principais modalidades terapêuticas utilizadas no tratamento de pacientes com diferentes tipos de câncer (KUMMAR et al., 2004).
mielossupressão, toxicidades neurológica, cardíaca, pulmonar e renal. Todos estes efeitos secundários reduzem a qualidade de vida e desencoraja o paciente a obdecer os protocolos de tratamento, o que resulta em progressão da doença e complicações associadas (MANS et al., 2000; ALONSO-CASTRO et al., 2011).
Mesmo com todos os avanços na compreensão da biologia do câncer e do grande volume de moléculas novas em fase clínica para seu tratamento, o número de drogas que são aprovadas pelas agências reguladoras ainda é baixo (MUNÕZ, 2009; CAPONIGRO, SELLERS, 2011; SWINNEY, ANTHONY, 2011). Além disso, em muitos casos, o sucesso terapêutico não é alcançado por causa de falhas nos esquemas terapêuticos, altos índices de recidivas, redução da sobrevida dos pacientes e dos efeitos adversos, o que leva a uma contínua busca por novos fármacos (SALGALLER, LODGER, 1998; SWANTON et al., 2007; BORST, 2012).
Nesse contexto, os produtos naturais, principalmente as plantas, se apresentam como fonte de novas drogas para o tratamento do câncer. Produtos naturais frequentemente possuem atividades biológicas altamente seletivas e específicas (CRAGG et al., 2009).
As plantas têm uma longa história de utilização no tratamento do câncer. Hartwell (1982) na sua revisão de plantas utilizadas contra o câncer, lista mais de 3000 espécies utilizadas no tratamento do câncer. Mais recentemente, Newman e Cragg (2012) relataram que de 206 drogas aprovadas para uso clínico, 131 são de origem natural ou inspiradas em produtos naturais. A descoberta de agentes usados na clínica pode ser atribuída, direta ou indiretamente, a uma história relevante de utilização da planta na medicina popular.
Tabela 4: Produtos naturais ou fármacos derivados de plantas utilizados na terapia do câncer.
Fonte: Adaptados de Costa-Lotufo, et al., 2010.
1.4 LIMONÓIDES ISOLADOS DE Swietenia macrophylla
A floresta amazônica compreende mais de 5 milhões de Km2, onde
60% desta encontra-se na região Norte do Brasil. A diversidade de espécies de plantas na Amazônia é uma das maiores do mundo, sendo relatado que em um hectare pode conter 280 espécies de árvores (VALENCIA et al., 1994; OLIVEIRA, MORI, 1999; CALDERON et al., 2009). Mais de 400 mil espécies de plantas de interesse econômico e social têm sido registradas na região. Essa vasta diversidade de espécies de plantas e o grande potencial terapêutico destas têm atraído a atenção da comunidade científica. Das 80.000 espécies de plantas mais altas dentro da Amazônia, menos de 2%, foram testados quanto à atividade farmacológica (GOTTLIEB, KAPLAN, 1990; EISNER, 1992).
Alguns trabalhos relatam o potencial terapêutico contra o câncer de algumas espécies de plantas de ocorrência na Amazônia, como Pfaffia paniculata (Amaranthaceae) (OLIVEIRA et al., 1980; MATSUZAKI et al., 2006; NAGAMINI et al., 2009), Himatanthus articulatus (Apocynaceae) (MOUSINHO et al., 2011;
FÁRMACO FONTE ALVO
MOLECULAR INDICAÇÃO TERAPÊUTICA Vinblastina Vincristina Vindesina Vinorelbina Catharantus roseus Tubulina e microtúbulos Leucemia linfoblástica aguda; cancer de testículo; doença de
Hodking; Câncer de mama
Paclitaxel
Docetaxel Taxus brevifolia
Tubulina e
microtúbulos Câncer de mama
Podofilotoxina Etoposídeo Teniposídeo
Podophyllum
peltatum Topoisomerase II
Câncer de pulmão, ovário e testículo, leucemia linfocítica aguda Camptotecina Topotecano Irinotecano Camptotheca
REBOUÇAS et al., 2011), e o gênero Croton (Euphorbiaceae) (SANDOVAL et al., 2002; ALONSO-CASTRO et al., 2012; MONTOPOLI et al., 2012).
Outra espécie de planta de ocorrência na floresta amazônica também se apresenta como fonte de substâncias com potencial terapêutico, a Swietenia macrophylla (Família Meliaceae). O gênero Swietenia compreende três espécimes: S. macrophylla, S. mahogany e S. humillis e, um híbrido de S. macrophylla e S. mahogani - S. aubrevilleana (MOOTOO, 1999), sendo que S. macrophylla tem predominância absoluta nas áreas de ocorrência.
Swietenia macrophylla (Meliaceae), também conhecida como Mogno de folha larga, é uma árvore de madeira tropical que pode crescer até 40-60 metros de altura. A árvore é nativa das regiões tropicais das Américas, incluindo o sul do México, América Central e Bolívia (TAN et al., 2009). Na Amazônia, encontra-se distribuída numa faixa que passa pelos estados do Acre, Rondônia, Amazonas, Pará, Mato Grosso e Maranhão. Sua população é superior ao conjunto das populações de todos os outros países onde ocorre, o que equivale a 74% da população mundial (FIGUEROA, 1994; VERÍSSIMO et al., 1995; GROGAN et al., 2002).
Várias atividades biológicas apresentadas pelos extratos e constituintes das sementes de S. Macrophylla já foram descritas, principalmente atividade anti-inflamatória, anti-mutagênica e anti-tumoral (GUEVERA et al., 1996; GOH, ABDUL KADIR, 2011), anti-malárico (SOEDIRO et al., 1990; MUNÕZ et al., 2000; MURNIGSIH et al., 2005), inseticida (NAKATANI, 2004), antiparasitário (ENDRIGA et al., 2005), antimicrobiano (DEWANJEE et al., 2007), anti-diarréico (MAITI et al., 2007), anti-nocieptiva (DAS et al., 2009), hipoglicemiante (MAITI et al., 2009; DEWANJEE et al., 2009), acaricida (EL ZALABANI et al., 2012) o que torna esta família bastante interessante quimicamente.
Poucos trabalhos têm sido desenvolvidos com llimonóides isolados de diferentes famílias de plantas, sendo demonstrado apenas as atividades larvicida (LIU et al., 2012) e citotóxica (KIKUSHI et al., 2011; NAGOOR et al., 2011). Nimbolida, um limonóide isolado de Azadirachta indica, exibiu atividade antiproliferativa em linhagens de células tumorais de mama, pulmão, neuroblastoma, osteossarcoma e melanoma (GUPTA et al., 2010a; GUPTA et al., 2010b; HARISH KUMAR et al., 2009). Outro estudo demonstrou que a eritrocarpina E, limonoide isolado de Chisocheton erythrocarpus, apresentou atividade citotóxica contra células de carcinoma escamoso oral, carcinoma cervical, hepatocarcinoma e adenocarcinoma de mama humana (NAGOOR et al., 2011).
O uso de medicamentos baseados em plantas ainda hoje é bastante utilizado por diferentes populações (MOERMAN, 1986; JOHNSON, 1999). A OMS estima que aproximadamente 65% da população mundial utiliza plantas e seus derivados para cuidados primários em saúde, sendo importante nos sistemas de saúde, principalmente em países em desenvolvimento (NEWMANN, CRAGG, 2012). A análise do índice de novos fármacos aprovados para uso teurapêutico entre os anos 2000 e 2010 demonstrou que cerca de 50% destes são de origem natural (NEWMANN, CRAGG, 2012).
Estima-se que mais de 50% dos medicamentos prescritos nos Estados Unidos contenham princípios ativos de origem natural, sendo que pelo menos 25% contem substâncias ativas isoladas de plantas, ou são formas modificadas de compostos isoladas de plantas (BALUNAS, KINGHORN, 2005). Fitoterápicos são responsáveis por 25% do receituário médico em países desenvolvidos e cerca de 80% em países em desenvolvimento (SIMÕES et al., 2007).
No entanto, grande parte das plantas ainda não tem estudos químicos, analíticos e farmacológicos. Muitas espécies são usadas de forma empírica, sem comprovação cientifica quanto à eficácia e segurança. Em todo o mundo, apenas 17% das plantas foram estudadas de alguma maneira quanto ao seu emprego medicinal e, na maioria dos casos, sem grande aprofundamento nos aspectos fitoquímicos e farmacológicos. Esses dados demonstram o enorme potencial das plantas para a descoberta de novos fitoterápicos e fitomedicamentos (NODARI, GUERRA, 1999; HOSTETTMANNet al., 2003; NEWMANN, CRAGG, 2012).
fitoquímico, farmacológico, biotecnológico, de tal forma que esta integração possa propiciar uma ampliação nas possibilidades de busca de novas moléculas ativas.
Diante deste cenário, Swietenia macrophylla se apresenta como uma espécie de planta com grande potencial biotecnológico para pesquisa de novas moléculas ativas para uso terapêutico. Essa espécie de planta é largamente explorada pela indústria madeireira no Estado do Pará. Logo, se faz importante o desenvolvimento do estudo com extrato e com limonóides isolados das suas folhas quanto à sua atividade antitumoral, haja vista que as folhas do mogno são consideradas “lixo” da indústria madeireira.
2 OBJETIVOS
2.1. OBJETIVO GERAL
Avaliar o potencial antitumoral de extrato e limonóide isolados de Switenia macrophylla em linhagens tumorais.
2.2. OBJETIVOS ESPECÍFICOS
Avaliar a atividade hemolítica do limonóide em estudo em eritrócitos de camundongos;
Avaliar a citotoxicidade do limonóide em estudo em linhagens tumorais e normal humanas;
Avaliar o potencial anticlonogênico do limonóide em estudo em linhagens tumorais HCT-116 e HT-29;
Avaliar o padrão de morte celular em células HCT-116, HT-29 e MRC5, causado pelo limonóide em estudo;
Analisar o ciclo celular das linhagens tumorais HCT-116 e HT-29, após tratamento com o limonóide em estudo;
Estudar a via de sinalização do TP53 e seu envolvimento na citotoxicidade do composto selecionado na indução de morte celular;
Avaliar o potencial genotóxico do limonóide em estudo em linhagens tumorais de câncer colorretal;
Avaliar a toxicologia aguda causada pelo extrato etanólico em camundongos albino suíço (Mus musculus);
3 MATERIAL E MÉTODOS
3.1 EXTRATO ETANÓLICO E LIMONÓIDES DE Swietenia macriphylla
O extrato etanólico (SM-EE) e os limonóides (L0, L2, L3, L4, L7) isolados de folhas de Swietenia macrophylla foram cedidos pelo professor Dr. Milton Silva, responsável pelo Laboratório de Cromatografia Líquida da Universidade Federal do Pará (LABCROL-UFPA). O extrato foi obtido por maceração e os limonóides foram isolados por Cromatografia Líquida de Alta Eficiência (HPLC).
O extrato etanólico (SM-EE) e os limonóides (L0, L2, L3, L4, L7) foram diluídos em Dimetilsulfóxido (DMSO) para compor soluções estoque a 10mg/mL e 10mM, respectivamente, as quais foram mantidas em refrigerador a -20°C.
3.2 CULTIVO DAS LINHAGENS CELULARES
As linhagens utilizadas neste trabalho foram: melanoma (SKMEL-19), adenocarcinoma mamário (MDA-MB-231), adenocarcinoma gástrico primário (ACP-03), carcinoma corretal (HCT-116), adenocarcinoma colorretal (HT-29) e fibroblasto pulmonar normal (MRC-5), todas de origem humana (Tabela 5).
As células foram cultivadas em garrafas para cultura de células em meio RPMI, suplementados com 10% de soro bovino fetal (SBF) e 1% de antibióticos (penicilina/estreptomicina 5000U/5000µg/mL), mantidas em estufa com atmosfera de 5% de CO2 a 37ºC. Diariamente, o crescimento celular foi
Tabela 5: Linhagens celulares utilizadas neste estudo.
LINHAGEM TIPO HISTOLÓGICO ORIGEM
SKMEL19 Melanoma maligno Humana
MDA-MB-231 Adenocarcinoma
Mamário Humana
ACP-03 Gástrico Primário Adenocarcinoma Humana
HCT-116 Carcinoma Colorretal Humana
HT-29 Adenocarcinoma Colorretal Humana
MRC-5 Fibroblasto Pulmonar
Normal Humana
Fonte: ATCC - www.atcc.org
3.3 DETERMINAÇÃO DA ATIVIDADE HEMOLÍTICA EM ERITRÓCITOS DE CAMUNDONGOS (Mus musculus, Swiss)
Princípio do teste
Esta metodologia permitiu avaliar o potencial dos compostos em estudo em causar danos na membrana celular, seja pela formação de poros ou pela ruptura total, através da presença de hemoglobina em solução. Quando o composto testado causa hemólise em até 1hora de incubação, o mecanismo de ação citotóxico é considerado inespecífico por causar dano direto à membrana plasmática.
Procedimento experimental
O sangue foi coletado em camundongos (Mus musculus, Swiss) pela via orbital e diluído em 30 volumes de solução salina (8,5 g de NaCl (0,85%), 1,11 g de CaCl2 10mM, q.s.p. H2O 1000mL de solução). Os eritrócitos foram lavados 2
10% (veículo de diluição da substância teste). Na terceira fileira em diante, foram adicionadas 100 µL da solução salina e 100 µL das substâncias teste em triplicata, na concentração de 5 mg/mL (dose máxima: 200 µg/mL), exceto a última fileira, que recebeu 80 µL de solução salina e 20 µL de Triton X-100 1%.
Em seguida, 100 µL da SE 2% foi adicionada, seguida de incubação por 1 hora sob agitação e posterior centrifugação a 1500 rpm por 10 minutos. Em seguida, transferiu-se o sobrenadante para outra placa e realizou-se a leitura em espectrofotômetro (SYNERGY/HT microplate reader) no comprimento de onda de 450 nm. Triton X-100 (0,5%) e DMSO foram utilizados como controle positivo e negativo respectivamente.
Análise dos dados
O experimento foi analisado segundo suas médias e desvios padrão. A concentração média capaz de provocar 50% do efeito máximo (CE50) e seu
respectivo intervalo de confiança (IC 95%) para cada amostra foi obtido a partir da regressão não - linear no programa GraphPad Prism versão 5.0.
Este trabalho foi submetido e aprovado pelo Comitê de Ética em Pesquisa com animais da Universidade Federal do Pará (parecer de aprovação – Anexo B).
3.4 AVALIAÇÃO DA ATIVIDADE ANTIPROLIFERATIVA EM LINHAGENS DE CÉLULAS TUMORAIS E NORMAIS IN VITRO: MÉTODO COLORIMÉTRICO DO MTT
Princípio do teste
púrpura. Essa técnica tem a capacidade de analisar a viabilidade e o estado metabólico da célula, sendo assim, bastante útil para a citotoxicidade (BERRIDGE et al., 1993).
Procedimento experimental
As células foram cultivadas em placas de 96 poços com 3000 células/poço (100 μL/poço) e mantidas na estufa com atmosfera de 5% de CO2 a
37ºC. Os limonóides estavam em solução estoque a 10mM, diluídos em DMSO. A partir desta solução, foram realizadas diluições seriadas em triplicata para obtenção da concentração final de 20μM (0,312-20 μM) para os limonóides e foram adicionadas na placa de 96 poços (100 μL/poço). A doxorrubicina foi utilizada como controle positivo e o DMSO como controle negativo. Após um período de incubação de 72h, o sobrenadante das células foi aspirado, adicionado 100 μL de solução de MTT (0,5 mg/mL diluído em meio RPMI 1640) e a placa foi reincubada em estufa a 37° C com atmosfera úmida e 5% de CO2, por 3h. Em seguida, o sobrenadante foi
removido e a placa foi mantida em temperatura ambiente protegida da luz por 24 horas. Então, foi adicionado 100μL/poço de DMSO e agitado por 10 minutos até a completa dissolução dos cristais de formazana. As placas foram lidas no espectrofotômetro (SYNERGY/HT microplate reader) no comprimento de onda de 570 nm.
Análise dos dados
A análise foi realizada através do percentual de inibição x log da concentração, determinadas suas CI50 e seus respectivos intervalos de confiança (IC
3.5 ENSAIO CLONOGÊNICO
Princípio do teste
É um ensaio baseado na capacidade de uma única célula crescer e se tornar uma colônia (FRANKEN et al., 2006). Além disso, neste ensaio também é possível distinguir os efeitos de proliferação celular incluindo o tamanho da colônia como um parâmetro adicional.
Procedimento experimental
As células da linhagem HCT 116 e HT-29 foram plaqueadas na densidade de 500 células/2mL em placas de 6 poços e mantidas em estufa a 37ºC com 5% de CO2. Após 24 horas, as células foram tratadas nas concentrações 0,05;
0,1; 0,5; 1,0 µM de L3.Doxorrubicina a 0,1 µM e DMSO 0,01% foram utilizados como controle positivo e negativo, respectivamente. O crescimento das colônias foi observado durante oito dias, período no qual a placa permaneceu sob condições de cultivo ideais. Após esse período, as células foram fixadas com metanol e em seguida coradas com cristal violeta (0,2%), lavadas com água destilada.
Análise dos dados
3.6 ANÁLISE DO PADRÃO DE MORTE CELULAR (APOPTOSE/NECROSE) ATRAVÉS DA COLORAÇÃO DIFERENCIAL DE BROMETO DE ETÍDIO/LARANJA DE ACRIDINA.
Princípio do teste
O método de coloração pelo brometo de etídio/laranja de acridina (BE/LA) permitiu diferenciar células viáveis daquelas em processo de morte por apoptose ou necrose. Este método baseia-se na revelação diferencial das células por fluorescência. A LA é capaz de atravessar membranas intactas e intercala-se ao DNA celular conferindo aparência verde ao núcleo. Enquanto, o BE, por sua vez, só consegue intercalar ao DNA e marcar o núcleo em vermelho se a membrana celular estiver danificada. Dessa maneira, as células viáveis que tem membrana íntegra apresentam núcleo uniformemente corado de verde pela LA.
As células em apoptose (membrana ainda íntegra) apresentam manchas verdes brilhantes que caracterizam morte celular por apoptose (condensação da cromatina e fragmentação nuclear) e são marcada por BE apenas na apoptose tardia ou secundária, em que ocorre o afrouxamento da membrana permitindo que o corante atravesse a célula (MCGAHON et al., 1995). Na apoptose, observam-se ainda alterações na membrana celular em decorrência da formação de corpos apoptóticos (BASKIC et al., 2006). O BE é incorporado majoritariamente por células necróticas (membrana danificada) e apresentam, portanto, núcleo corado em vermelho (BASKIC et al., 2006).
Procedimento experimental
As células foram cultivadas em placas de 12 poços a uma densidade de 40000 células/poço e foram mantidas por 24 horas na estufa com atmosfera de 5% de CO2 a 37º C. Após esse período, foi realizado o tratamento com L3 nas
descartado e as células foram ressuspendidas em 20 µL de PBS 1X. Em seguida, foi adicionado 1 µL da solução de BE:LA ao tubo e uma alíquota dessas células foi transferida para lâmina. A lâmina foi montada com lamínula para contagem em microscópio de fluorescência (OLYMPUS BX41).
Análise dos dados
Foram contadas 300 células, em triplicata, para quantificar o percentual de eventos celulares (viáveis, apoptóticas e necróticas). Os dados foram analisados a partir da média e do erro padrão de três experimentos independentes. Para verificar a ocorrência de diferença significativa entre os grupos, os dados foram comparados por análise de variância (ANOVA: one way), seguida por Teste de Turkey, com nível de significância de 95% (p<0,05).
3.7 ANÁLISE DO CICLO CELULAR E FRAGMENTAÇÃO DO DNA POR CITOMETRIA DE FLUXO
Princípio do teste
Procedimento experimental
As células HCT-116 e HT-29 foram plaqueadas em placas de 12 poços a uma densidade de 40000 células/poço e foram mantidas por 24 horas na estufa com atmosfera de 5% de CO2 a 37ºC. Após esse período, foi realizado o tratamento com L3 nas concentrações 0,5 µM; 1,0 µM; 2,0µM e 5,0 µM em triplicata por 48 e 72 horas. A doxorrubicina na concentração 0,5 µM foi utilizada como controle positivo de citotoxicidade, e DMSO 0,01% como controle negativo. Após a incubação, as células foram lavadas e tripsinizadas para obtenção das células aderidas, transferidas para um tubo de 15 mL e centrifugadas por 5 minutos a 1000 rpm. O sobrenadante foi descartado e as células foram ressuspendidas em aproximadamente 300 µL de solução contendo iodeto de propídeo (10µg/mL). Após 30 minutos de incubação, a temperatura ambiente e protegidas da luz, as células foram levadas ao citômetro de fluxo (BD FACSCALIBUR) para avaliação do conteúdo de DNA.
3.8 ANÁLISE DA EXPRESSÃO DE mRNA por PCR EM TEMPO REAL QUANTITATIVA (PCR-RT)
Princípio do teste
A PCR-RT baseia-se na detecção na fluorescência detectada por uma molécula fluorescente que aumenta enquanto a reação ocorre. Isso acontece devido ao cúmulo dos produtos da PCR em cada ciclo de amplificação. A fluorescência detectada é gerada pelo emprego de marcadores fluorescente com modos de ação específicos (WONG; MEDRANO, 2005).
Procedimento experimental
de citotoxicidade, e DMSO 0,01% como controle negativo. Após a incubação, as células foram lavadas e tripsinizadas para obtenção das células aderidas, transferidas para um tubo de 15 mL e centrifugadas por 5 minutos a 1000 rpm e ressupendidas em reagente Allprotect Tissue Reagent (1g/100mL), diluído em DMSO (QIAGEN, ALEMANHA).
Após, foi realizada a extração do RNA das amostras coletadas utilizando o kit AllPrep DNA/RNA/Protein (QIAGEN, ALEMANHA) de acordo com as instruções do fabricante. A concentração e a qualidade do RNA foram determinadas utilizando espectrofotômetro Nano-drop (KISKER, ALEMANHA) e 1% de gel de agarose, respectivamente. As amostras foram armazenadas em refrigerador a -80°C até o momento de uso.
Transcrição Reversa
A partir de 25g de RNA extraído foi sintetizado o cDNA de acordo as instruções do fabricante com o kit High Capacity cDNA Reverse Transcriptase (Life Technologies), usando o termociclador GeneAmp PCR System 9700 (Applied Biosystems®).
PCR em tempo real quantitativa (qPCR)
Foi avaliada a expressão dos genes selecionados: ATM, CHK-2, TP53, ARF, p21, Caspase-3, BCL-2 e para o controle endógeno da reação foi utilizado o gene constitutivo -actina. Tais genes estão disponíveis comercialmente como
TaqMan® Gene expression assays (Life Technologies, EUA), o qual possui sondas e iniciadores específicos para cada gene.
A PCR em tempo real quantitativa (qPCR) foi realizada para cada um dos genes, no aparelho ABI 7500 Real-Time PCR (Life Technologies, USA). Para cada amostra e genes testados foram usadas as seguintes concentrações: 3L de cDNA, 1L de cada iniciador/sonda, 12,5L de TaqMan® Gene Expression Master Mix (Life Technologies, EUA) e 8,5L de H2O ultra-pura. odas as reaç es de qPC
Information for Publication of Quantitative Real-Time PCR Experiments- MIQE Guidelines (BUSTIN et al., 2009).
O cálculo do nível de expressão de cada um dos genes testados foi realizado através do Método CT comparativo ou Método 2 - CT, dessa forma, o nível
de expressão do gene de interesse é relatado em relação ao do gene de referência para cada amostra (SCHMITTGEN, LIVAK, 2008).
Análise dos dados
Para a análise estatística foi utilizado o teste de Correlação Linear de Pearson (R2), onde foram correlacionadas as concentrações de L3 e a variação de expressão gênica para cada um dos genes testados. Os dados foram analisados pelo software GraphPad Prism 5.0.
3.9 AVALIAÇÃO DA GENOTOXICIDADE IN VITRO: TESTE DO COMETA
Princípio do teste
Desenvolvido por Singh et al. (1988) e, posteriormente, modificado por Anderson et al. (1994) é uma importante ferramenta utilizada nos estudos de biomonitoramento populacional. É um teste muito sensível para a detecção de vários tipos de danos causados no DNA (quebra de fitas dupla ou simples, danos oxidativos e ligações cruzadas) induzidos por compostos genotóxicos (FAUST et al., 2004).
A condição alcalina do teste e a migração dos danos no DNA estão associadas. Foi comprovado que essa condição é um fator importante para evidenciar o potencial genotóxico de uma determinada substância química em uma única célula. A eletroforese alcalina mostra, além do aumento da migração do DNA, a presença de sítios alcalino-lábeis, os quais são rapidamente convertidos em quebras de filamento (TICE, 2000).
Procedimento experimental
Para realização do cometa, foram preparadas previamente lâminas cobertas por solução de agarose de ponto de fusão normal a 1,5%. Posteriormente, foram mantidas em temperatura ambiente até a solidificação da agarose de um dia para o outro. Esta camada foi utilizada para promover a adesão da segunda camada de agarose de baixo ponto de fusão.
As células HCT-116 e HT-29 foram semeadas em placas de 6 poços a uma densidade de 250000 células/poço e mantidas por 24 horas na estufa com atmosfera de 5% de CO2 a 37ºC. Após 21 horas de tratamento, foi realizado o
luminosisdade por 20 minutos, usando 34 V e uma corrente de 300 mA. Após a corrida eletroforética, as lâminas foram retiradas e mergulhadas rapidamente em H2O destilada gelada (4ºC) para a remoção da solução de eletroforese, o procedimento foi repetido utilizando-se H2O destilada gelada, no entanto as lâminas foram mergulhadas por 5 minutos para serem neutralizadas. As lâminas foram fixadas mergulhando-as em etanol absoluto por três minutos. As células foram contadas em microscópio de fluorescência (OLYMPUS BX41) com 50 µL de Brometo de etídio (20µg/ mL).
Análise dos dados
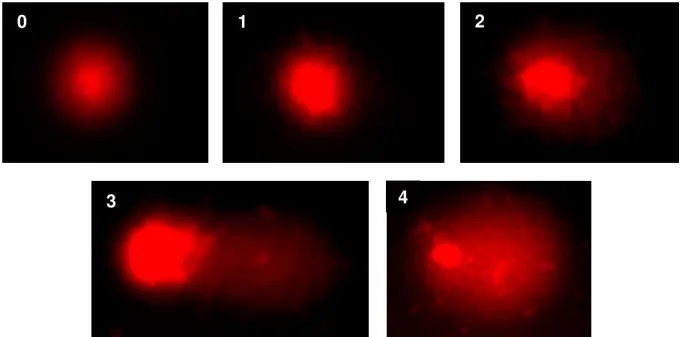
A análise foi realizada de acordo como padrão de escores previamente determinados pelo tamanho e intensidade da cauda do cometa. (BURLINSON et al., 2007). Foram contadas 100 cometas/lâmina e classificados, de acordo com a percentagem de DNA na cauda do cometa, indicando o grau de quebra do DNA, de acordo com a Figura 3. Onde, 0 = sem danos (<5%), 1 = baixo nível de danos (5-20%), 2 = médio nível de danos (20-40%), 3 = alto nível de danos e 4 = dano total (>95%). A doxorrucina a 0,5 µM foi usada como controle positivo de citotoxicidade e 0,01% de DMSO como controle negativo.
Após a contagem das células e atribuição de escores nas duas lâminas de cada amostra foi estabelecido um índice de dano (ID) e obtido uma média final para cada amostra. O cálculo do índice de dano foi feito através da soma dos produtos do escore como número de danos respectivo a nada nível, com mostra a seguinte fórmula:
ID= (0 x n) + (1 x n) + (2 x n) + (3 x n) + (4 x n)
Aonde, ID é o índice de dano, n é a quantidade de danos obtida por escore.
Figura 3: Classificação visual dos danos, representados em uma escala de 0-4, sugeridos por Collins e col. (1997). Imagens de cometas (a partir de linfócitos), coradas com Brometo de Etídio Fonte: SOARES, 2012
3.10 TOXICOLOGIA AGUDA (OECD,423, 2001)
Princípio do teste
Os estudos de toxicidade aguda são aqueles utilizados para avaliar a toxicidade produzida por uma substância quando esta é administrada em uma ou mais doses durante um período não superior a 24 horas, seguido de observação dos animais por 14 dias após a administração (AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA, 2010).
Procedimento experimental
Para este estudo, foram utilizados seis camundongos albinos (Mus musculus) fêmeas da linhagem swiss, os quais foram obtidos do biotério central do Instituto Evandro Chagas (IEC). Os animais foram mantidos em biotério, a temperatura da sala de manutenção foi de 22 ± 3°C e um ciclo de luz 12h claro/12h escuro. Foram acondicionados em caixas de polipropileno forradas com palha de arroz em pequenos grupos em estantes ventiladas, alimentados com ração peletizada, água ad libitum e observados diariamente.
0 1 2
Os animais foram divididos em dois grupos com três animais cada. O primeiro grupo foi tratado com uma dose única de 1000mg/Kg do extrato etanólico SM-EE, diluído em solução salina; o segundo grupo foi o grupo controle negativo, recebendo somente solução salina. Esses animais foram tratados pela via oral, por gavagem. Logo após administração, esses animais foram observados por duas horas para avaliação de possíveis alterações comportamentais, e posteriormente por 14 dias. Foram avaliados os seguintes parâmetros: mortalidade; sinais clínicos (incluindo parâmetros comportamentais); variações no peso corporal e no consumo de ração e água; latência, duração e reversibilidade da toxicidade.
Após os 14 dias de avaliação, esses animais foram sacrificados em câmara de CO2. Foi feita a coleta de sangue para avaliação de patologia clínica.
Foram feitas as análises hematológica, Bioquímica e histopatológica.
Determinação do perfil hematológico
A análise hematológica foi feita utilizando-se o contador de células automático para uso veterinário Cell Dyn Ruby® (Abbott Diagnostics) para determinação dos seguintes parâmetros hematológicos: Bastonetes, Segmentados, Linfócitos, Monócitos, Eosinófilos, Basófilos, Plasmócitos, Linfócitos atípicos, Leucoblastos, Pro-mielócitos, Mielócitos, Metamielócitos e Eritroblastos.
Determinação do perfil bioquímico
O perfil bioquímico dos camundongos foi acompanhado durante todo o período experimental, através da análise de Alanina Aminotransferase (ALT), Aspartato de aminotransferase (AST), Uréia, Creatinina, Fosfatase alcalina, Bilirrubina Total e Direta. Os procedimentos foram realizados através do Sistema de química seca ARCHITECT 5000® (Abbot Diagnostics), seguindo a metodologia preconizada pelos fabricantes dos kits para cada parâmetro analisado.
Análise da anatomia patológica e morfológica
pH 7,2, desidratados em álcool (70% - 80% - 90% - 100%), diafanizados em xilol e incluídos em parafina no Laboratório de Histopatologia do CENP.
Realizou-se também a coloração diferencial por hematoxilina e eosina (H/E), para permitir a diferenciação do citoplasma e do núcleo, fornecendo assim subsídios de análise morfológica para sugerir o mecanismo de ação do composto em estudo.
Análise dos dados
Os dados foram expressos e analisados a partir da média e do erro padrão 6 animais. Para verificação da ocorrência de diferenças significativas entre os diferentes grupos, os dados foram comparados por análise de variância (ANOVA) seguida por Teste de Turkey, sendo que as diferenças serão consideradas estatisticamente significantes para p < 0,05, utilizando o software GraphPad Prism versão 5.0.
3.11 TESTE DO MICRONÚCLEO IN VIVO (OECD, 497, 1997)
Princípio do teste
O teste do micronúcleo é o ensaio, in vivo, mais amplamente utilizado para a detecção de agentes clastogênicos (que quebram cromossomos) e aneugênicos (que induzem aneuploidia ou segregação cromossômica anormal), internacionalmente aceito como parte da bateria de testes recomendada para a avaliação do potencial mutagênico e para o registro de novos produtos químicos que entram anualmente no mercado mundial (KIRSCH-VOLDERS et al., 2011).
Procedimento experimental
citotóxicos causados na medula óssea, bem como a avaliação do potencial mutagênico induzido pelo extrato.
Os camundongos foram divididos em três grupos com cinco animais cada: 1) controle negativo, o qual recebeu apenas o veículo de diluição da substância teste; 2) controle positivo, o qual foi tratado com Ciclofosfamida, 200mg/kg (OECD, 474, 1997); 3) tratado, o qual recebeu o extrato SM-EE (extrato etanólico de S. macrophylla) na concentração de 1000mg/kg. Os animais foram pesados, com variação mínima de peso, não excedendo a 20%, e identificados individualmente.
O extrato foi administrado pela via oral, por gavagem, um animal por vez. Após 24h de tratamento, os animais foram sacrificados em câmara de CO2.
Para a retirada da medula óssea, as pernas do animal foram limpas com álcool 70% e o osso fêmur (das duas pernas) foi retirado, com auxilio de pinça e tesoura de dissecação. O material retirado da medula óssea passou por centrifugação a 1000rpm por 5 minutos e posteriormente uma porção deste material foi colocado em lâminas de microscópio para realização do esfregaço (duas para cada animal); essas lâminas secaram a temperatura ambiente overnight.
Depois de secas as lâminas foram coradas com o corante Leishman a 2%. Tais lâminas foram analisadas em microscópio óptico para avaliação do número de eritrócitos monocromáticos e policromáticos na medula óssea, avaliação dos efeitos citotóxicos causados a medula óssea, bem como a avaliação do potencial mutagênico (ocorrência de micronúcleos) induzido pelo extrato.
Análise dos dados
4 RESULTADOS
4.1 DETERMINAÇÃO DA ATIVIDADE HEMOLÍTICA EM ERITRÓCITOS DE CAMUNDONGOS (Mus musculus, Swiss)
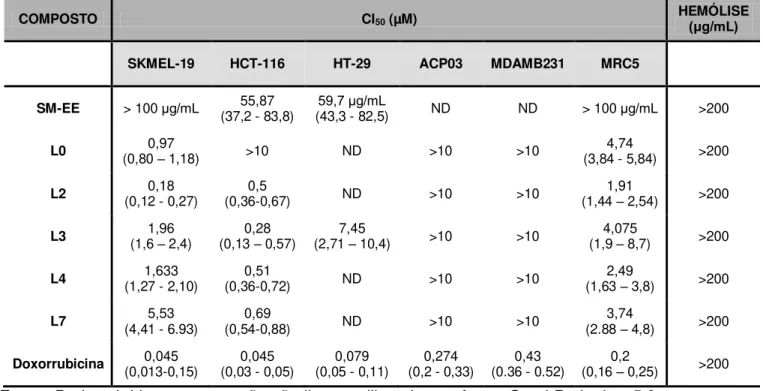
O estudo realizado para a determinação de atividade hemolítica em células de camundongos indicou que nenhum dos compostos provocou lise na membrana plasmática das células na maior concentração testada, apresentando CE50>200μg/mL ( abela 6).
4.2 AVALIAÇÃO DA ATIVIDADE ANTIPROLIFERATIVA EM LINHAGENS DE CÉLULAS TUMORAIS E NORMAIS IN VITRO: MÉTODO COLORIMÉTRICO DO MTT
A atividade citotóxica do extrato etanólico de S. macrophylla (SM-EE) e dos limonóides foi avaliada pelo método do MTT, os resultados estão representados na tabela 6. O SM-EE apresentou CI50 variando entre 55,87 até > 100 µg/mL nas
linhagens testadas. Os limonóides mostraram atividade citotóxica diversa, com CI50
variando entre 0,18 - 7,45 µM.
A análise da ação citotóxica revelou que o extrato SM-EE causou citotoxicidade nas duas linhagens de câncer colorretal, HCT-116 e HT-29, apresentando CI50 55,87 e 59,7 µg/mL, respectivamente. Os limonóides testados apresentaram citotoxicidade em duas linhagens tumorais, SKMEL-19 e HCT-116, onde os valores de CI50 variaram de 0,28 - 5,53 µM. O mesmo foi observado para
linhagem de células normais (MRC-5), apresentando valores de CI50 1,91 – 4,74 µM.
O liminóide L2 mostrou melhor resultado em células de melanoma (SKMEL-19), apresentando CI50 de 0,18 µM e CI50 de 1,91µM em células normais
(MRC-5).
Já o limonóide L3 apresentou excelente atividade citotóxica, após 72h de tratamento, em células da linhagem HCT-116 (colorretal), com valor de CI50 0,28
A doxorrubicina, usada como controle positivo, apresentou elevada citotoxicidade em todas as linhagens testadas, com valores de CI50 menores que
0,5µM.
Tabela 6: Valores da concentração da CI50 (concentração inibitória média do crescimento
celular em μM), com a realização do teste do M , após 72h de incubação, para cinco linhagens tumorais (HCT-116, HT-29, ACP-03, SKMEL19, MDAMB231) e linhagem normal de fibroblasto pulmonar humano (MRC5). A doxorrubicina foi utilizada como controle positivo. ND: não determinado. Intervalo de confiança de 95% (p<0,05).
COMPOSTO CI50 (µM) HEMÓLISE (μg/mL)
SKMEL-19 HCT-116 HT-29 ACP03 MDAMB231 MRC5
SM-EE > 100μg/mL (37,2 - 83,8) 55,87 (43,3 - 82,5) 59,7 μg/mL ND ND > 100μg/mL >200
L0 (0,80 0,97 – 1,18) >10 ND >10 >10 (3,84 - 5,84) 4,74 >200
L2 (0,12 - 0,27) 0,18 (0,36-0,67) 0,5 ND >10 >10 (1,44 1,91 – 2,54) >200
L3 (1,6 1,96 – 2,4) (0,13 0,28 – 0,57) (2,71 7,45 – 10,4) >10 >10 (1,9 4,075 – 8,7) >200
L4 (1,27 - 2,10) 1,633 (0,36-0,72) 0,51 ND >10 >10 (1,63 2,49 – 3,8) >200
L7 (4,41 - 6.93) 5,53 (0,54-0,88) 0,69 ND >10 >10 (2.88 3,74 – 4,8) >200
Doxorrubicina (0,013-0,15) 0,045 (0,03 - 0,05) 0,045 (0,05 - 0,11) 0,079 (0,2 - 0,33) 0,274 (0.36 - 0.52) 0,43 (0,16 0,2 – 0,25) >200
Fonte: Dados obtidos por regressão não-linear, utilizando o software GraphPad prism 5.0.
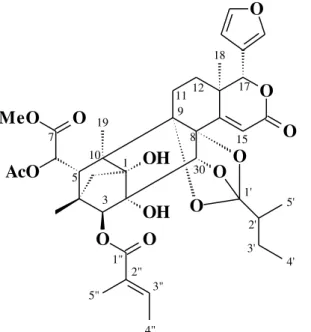
A partir dos dados do teste de citotoxicidade, escolheu-se para dar continuidade a este trabalho a linhagem HCT-116, por apresentar maior sensibilidade aos compostos testados. Foi ainda selecionado o composto L3 (Figura 4), devido seu excelente efeito citotóxico frente à linhagem selecionada, apresentando CI50 aproximadamente 14 vezes menor do que o valor da CI50 em
células normais.
A partir desses dados, foram escolhidas as concentrações 0,5, 1, 2 e 5µM para continuar os testes subsequentes.
Figura 4: Estrutura química do limonoide L3, isolado de folhas de Swietenia macrophylla (Meliaceae). Fonte: DA SILVA et al., 2008
4.3 ENSAIO CLONOGÊNICO
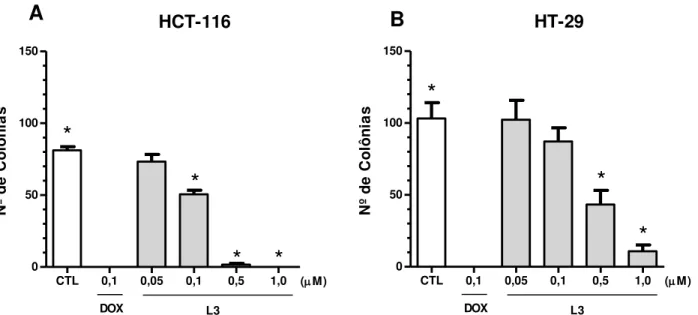
Os resultados obtidos no ensaio clonogênico estão representados na Figura 5. Observou-se redução significativa (p<0,05) do número de colônias após oito dias de tratamento com L3 nas concentrações 0,1; 0,5 e 1,0µM, comparando-se ao controle negativo na linhagem HCT-116 (Figura 5-A), enquanto que na linhagem HT-29 somente houve redução significativa no número de colônias nas concentrações 0,5 e 1,0µM (p<0,05) (Figura 5-B). O tratamento com doxorrubicina (0,1µM) também causou redução significativa (p<0,05).
Figura 5: Efeito de L3 sobre as linhagens HCT-116 (A) e HT-29 (B) no ensaio clonogênico, após 7 dias de incubação. As barras representam a média e o desvio padrão de três experimentos independentes. * p<0,05 foi considerado estatisticamente significativo, quando comparado controle negativo (CTL) por análise de variância (ANOVA one way), seguido do pós teste de Tukey.
4.4 ANÁLISE DO PADRÃO DE MORTE CELULAR (APOPTOSE/NECROSE) ATRAVÉS DA COLORAÇÃO DIFERENCIAL DE BROMETO DE ETÍDIO/LARANJA DE ACRIDINA
A morfologia das células das linhagens HCT-116 e HT-29 foi investigada utilizando a coloração laranja de acridina e brometo de etídio para microscopia de fluorescência. Células uniformemente verdes com morfologia normal foram observadas no grupo controle atingindo mais de 85% das células contadas. Após 72h de tratamento com L3, observou-se significativo aumento crescente de células em apoptose nas concentrações 0,5, 1, 2 e 5µM comparado ao controle negativo nas duas linhagens (p < 0,01) (Figura 6-A e B). Ao compararmos o efeito de L3 entre as duas linhagens, percebeu-se que HCT-116 se mostra mais sensível, apresentando maior número de células em apoptose, exceto na maior concentração testada (5µM) onde não há diferença. Não houve diferença significativa no padrão de morte celular por necrose em nenhuma das concentrações testadas
CTL 0,1 0,05 0,1 0,5 1,0 0 50 100 150 (M) DOX L3 HCT-116