UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE MEDICINA CLÍNICA
PÓS-GRADUAÇÃO EM CIÊNCIAS MÉDICAS
EMERSON DE OLIVEIRA FERREIRA
ERIODICTIOL PROTEGE CAMUNDONGOS SUBMETIDOS À ISQUEMIA CEREBRAL FOCAL PERMANENTE, DO DANO NEURONAL, DÉFICIT DE MEMÓRIA E
RESPOSTA INFLAMATÓRIA
EMERSON DE OLIVEIRA FERREIRA
ERIODICTIOL PROTEGE CAMUNDONGOS SUBMETIDOS À ISQUEMIA CEREBRAL FOCAL PERMANENTE, DO DANO NEURONAL, DÉFICIT DE MEMÓRIA E
RESPOSTA INFLAMATÓRIA
Dissertação submetida à Coordenação do Curso de Pós-Graduação em Ciências Médicas da Faculdade de Medicina da Universidade Federal do Ceará, como requisito para obtenção do título de Mestre em Ciências Médicas.
Orientador: Profª. Drª. Geanne Matos de Andrade
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
F439e Ferreira, Emerson de Oliveira.
Eriodictiol protege camundongos submetidos à isquemia cerebral focal permanente, do dano neuronal, déficit de memória e resposta inflamatória / Emerson de Oliveira Ferreira. – 2015.
92 f. : il. color.
Dissertação (Mestrado) – Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Medicina Clínica, Programa de Pós-Graduação em Ciências Médicas, Mestrado em Ciências Médicas, Fortaleza, 2015.
Área de Concentração: Medicina Clínica.
Orientação: Profa. Dra. Geanne Matos de Andrade.
1. Inflamação. 2. Isquemia Encefálica. 3. Memória. I. Título.
Aos meus pais,
AGRADECIMENTOS
Jesus Cristo, tu tens me cumulado de graça. Eu reconheço e repito, é graça! A ti a minha eterna gratidão.
Meus pais, Erialdo e Joselia, meus exemplos de luta e determinação. O sim de vocês a Deus e um ao outro, me trouxe a vida. Obrigado pelo lar, pela a educação e por acreditarem nos meus planos. Pai, amo você! Mãe, amo você!
Vó Zélia, eu não esqueço o seu amor tão devotado a mim! Amo você! Meus irmãos, Erialdo e Larice, estamos juntos! Amo vocês!
Minha família e amigos, eu tenho apreço incondicional por cada um. Gratidão!
Minha estimada orientadora, Profª. Geanne, eu agradeço pelo seu “sim”, pela sua confiança investida em mim. A senhora é especial!
Mara, Neila, Arnaldo e Ana Paula, obrigado pela a força e companheirismo. Marta, obrigado por cada ensinamento. Você é exemplo de sabedoria e humildade. Pode ter certeza que aprendi muito com você.
Os demais colegas de laboratório, eu reconheço que de forma direta ou indireta, todos contribuíram para essa minha conquista. A vocês, os meus sinceros agradecimentos.
“Não a nós, Senhor, não a nós, mas ao vosso nome dai glória, por amor de vossa misericórdia e fidelidade.”
RESUMO
FERREIRA, E. O. ERIODICTIOL PROTEGE CAMUNDONGOS SUBMETIDOS À ISQUEMIA CEREBRAL FOCAL PERMANENTE, DO DANO NEURONAL, DÉFICIT DE MEMÓRIA E RESPOSTA INFLAMATÓRIA. EXAME DE QUALIFICAÇÃO, PÓSGRADUAÇÃO EM CIÊNCIAS MÉDICAS, UNIVERSIDADE FEDERAL DO CEARÁ.
O Acidente Vascular Encefálico (AVE) é definido como um quadro clínico de déficit neurológico que pode perdurar ou exceder as primeiras vinte e quatro horas do evento. A Organização Mundial de Saúde (OMS) revela que entre os anos de 2000 e 2011, o AVE apresentou-se como a segunda principal causa de óbitos em todo o mundo. Segundo o Ministério da Saúde, o AVE é a principal causa de morte no Brasil. É causado pela diminuição da perfusão sanguínea com depleção de oxigênio e glicose ao cérebro, causando redução dos níveis de ATP e predispondo a eventos como: excitotoxicidade glutamatérgica, influxo exacerbado de Ca++, estresse oxidativo, inflamação e apoptose, resultando em morte neuronal. O eriodictiol (γ‟,4‟,5,7-tetrahidroxiflavanona) é um flavonóide encontrado na erva chinesa (Dracocephalum rupestre). Possui atividades anti-inflamatória, antioxidante e antiapoptótica já reportadas. O objetivo deste trabalho foi estudar os efeitos do eriodictiol sobre o dano neuronal, déficits de memória e resposta infamatória de camundongos submetidos à isquemia cerebral focal por oclusão permanente da artéria cerebral média (pMCAO). Os animais foram tratados oralmente com eriodictiol (1, 2 e 4 mg / kg) ou veículo (5% Tween 80 em salina 0,9%) 30 min antes, 2 horas depois da pMCAO e diariamente durante 4 dias. A pMCAO promoveu dano cerebral nos animais isquemiados, sendo esse comprovado, por meio da detecção do aumento significativo nas percentagens das áreas de infarto, pelos déficits sensório-motores observados e pela perda da viabilidade neuronal. O eriodictiol reduziu a área de infarto cerebral nas doses de 1, 2 e 4 mg/kg e preveniu os animais isquemiados dos déficits neurológicos 24h após pMCAO. Também, preveniu esses animais da perda da viabilidade neuronal na dose de 4 mg/kg 96h após pMCAO. Os animais submetidos à pMCAO apresentaram uma significativa redução no número de rearings no teste de campo aberto e déficits de memória de trabalho (Y-maze) e memória aversiva (esquiva-passiva) 72 e 96h após indução isquêmica. O tratamento com o eriodictiol nas doses de 2 e 4 mg/kg normalizou o número de rearings, nas doses de 1, 2 e 4 mg/kg preveniu os déficits na memória de trabalho e na dose de 4 mg/kg preveniu os déficits na memória aversiva. A pMCAO induziu o aumento da atividade de MPO no córtex temporal, induziu a imunoreatividade para TNF-α, iNOS e GFAP no córtex temporal e corpo estriado nos animais isquemiados. O eriodictiol na dose de 4 mg/kg preveniu o aumento da atividade de MPO e o aumento da imunoreatividade para TNF-α, iNOS e GFAP. Os resultados do presente estudo mostram que o eriodictiol possui atividade neuroprotetora em animais submetidos à pMCAO e que essa ação está relacionada, ao menos em parte, a sua propriedade anti-inflamatória.
ABSTRACT
FERREIRA, E.O. ERIODICTYOL PROTECTS AGAINST NEURONAL DAMAGE, MEMORY DEFICIT AND INFLAMMATORY RESPONSE IN PERMANENT FOCAL CEREBRAL ISCHEMIA INJURY IN MICE. QUALIFICATION EXAMINATION, POSTGRADUATE IN MEDICAL SCIENCES, FEDERAL UNIVERSITY OF CEARÁ.
Stroke is defined as a clinical neurological deficit that may last or exceed the first twenty-four hours of the event. The World Health Organization (WHO) reveals that between 2000 and 2011, the Stroke was presented as the second leading cause of death worldwide. According to the Ministry of Health, stroke is the leading cause of death in Brazil. It is caused by decreased blood perfusion depleted of oxygen and glucose to the brain, causing ATP reduction levels and predisposing to events such as glutamatergic excitotoxicity, exacerbated influx of Ca++, oxidative stress, inflammation and apoptosis, resulting in neuronal death. The eriodictyol (3 ', 4', 5,7-tetrahydroxyflavanone) is a flavonoid found in the Chinese herb (Dracocephalum rupestre) having anti-inflammatory, antioxidant and anti-apoptotic effects previously reported. The objective of this study was to analyze the effects of eriodictyol on neuronal damage, memory deficits and inflammatory-response of mice subjected to focal cerebral ischemia by permanent meddle cerebral artery occlusion (pMCAO). The animals were treated orally with eriodictyol (1, 2 and 4 mg / kg) or vehicle (5% Tween 80 in saline 0,9%) 30 minutes before, 2 hours after the pMCAO and daily for 4 days. The promoted pMCAOischemic brain damage in animals, this being confirmed by means of detection of a significant increase in the percentage of infarcted areas, the observed sensorimotor deficits and loss of neuronal viability. The eriodictyol reduced the area of cerebral infarction in doses of 1, 2 and 4 mg / kg and prevented the animal-ischemic neurological deficits 24h post-pMCAO. Also, prevented these animals of loss neuronal viability at dose of 4 mg/kg 96h after pMCAO. The animals submitted to pMCAO showed a significant reduction in the number of rearings (open field test) and working (Y-maze) and aversive memory (passive avoidance test) deficits 72 and 96h after pMCAO. Treatment with eriodictyol the doses of 2 and 4 mg / kg normalized rearings number at the doses of 1, 2 and 4 mg/kg prevented the working memory deficits, and a dose of 4 mg/kg prevented the memory aversive deficits. The pMCAO induced increase in MPO activity in the temporal cortex, induced TNF-α, iNOS and GFAP immunoreactivity in the temporal cortex and striatum in-ischemic animals. The eriodictyol at a dose of 4 mg/kg prevented the increase in MPO activity and increased of TNF-α, iNOS and GFAP immunoreactivity. The results of this study show that eriodictyol has neuroprotective activity in animals subjected to pMCAO and that this action is related at least in part to its antiinflammatory property.
LISTA DE FIGURAS
Figura 01. Imagem representativa da área do core isquêmico e penumbra
Figura 02. Vias de sinalizações envolvidas na cascata isquêmica, adaptado de HOSSMANN, 2009.
Figura 03. Diagrama sistemático da sinapse glutamatérgica em condições normais e em condições isquêmicas (Adaptado de ALLEN et al., 2004).
Figura 04. Diagrama representando a resposta inflamatória aguda após isquemia cerebral focal, (Adaptado de BROUNS e DEYNN, 2009).
Figura 05. Diagrama sistemático da gênese de mediadores inflamatórios envolvidos na lesão secundária pós-isquemia cerebral (Adaptado de BROUGHTON et al., 2013).
Figura 06. Representação esquemática do Polígono de Willis (Fonte: WIKIMIDIA COMMONS, 2008).
Figura 07. Estrutura molecular do eriodictiol.
Figura 08. Delineamento experimental.
Figura 09. Cirurgia de indução isquêmica focal pelo método da Oclusão permanente da Artéria Cerebral Média (Fonte: Laboratório de Neurociências e Comportamento - LNC). Figura 10. Arena de campo aberto (Fonte: LNC).
Figura 11. Labirinto em Y (Fonte: LNC).
Figura 12. Aparelho de esquiva passiva (Insight LTDA).
Figura 13. Efeito do eriodictiol sobre o número de total de escores obtidos na avaliação neurológica de camundongos submetidos à pMCAO.
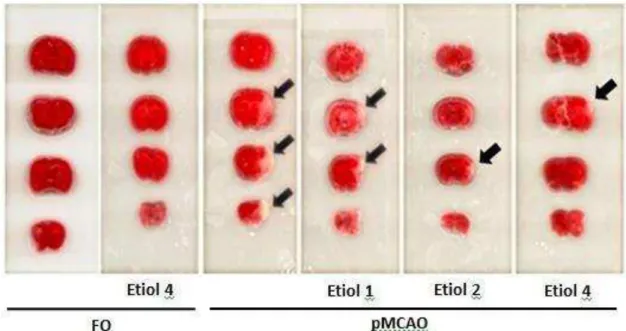
Figura 14. Fatias cerebrais de camundongos submetidos à pMCAO, coradas com TTC, representando o dano cerebral isquêmico.
Figura 16. Fotomicrografia representando o efeito do eriodictiol sobre a viabilidade celular evidenciada pela coloração de cresil-violeta no córtex temporal e corpo estriado de camundongos submetidos à pMCAO.
Figura 17. Efeito do eriodictiol sobre a viabilidade celular evidenciada pela coloração de cresil-violeta no córtex temporal de camundongos submetidos à pMCAO.
Figura 18. Efeito do eriodictiol sobre a viabilidade celular evidenciada pela coloração de cresil-violeta no corpo estriado de camundongos submetidos à pMCAO.
Figura 19. Efeito do eriodictiol sobre o número de cruzamentos (crossings) e levantamentos (rearings) de camundongos submetidos à pMCAO avaliados no teste de campo aberto.
Figura 20. Efeito do eriodictiol sobre a memória de trabalho de camundongos submetidos a pMCAO avaliados no labirinto em Y.
Figura 21. Efeito do eriodictiol sobre a memória aversiva de camundongos submetidos à pMCAO.
Figura 22. Efeito do eriodictiol sobre os níveis da atividade de MPO no córtex temporal e corpo estriado de camundongos submetidos à pMCAO.
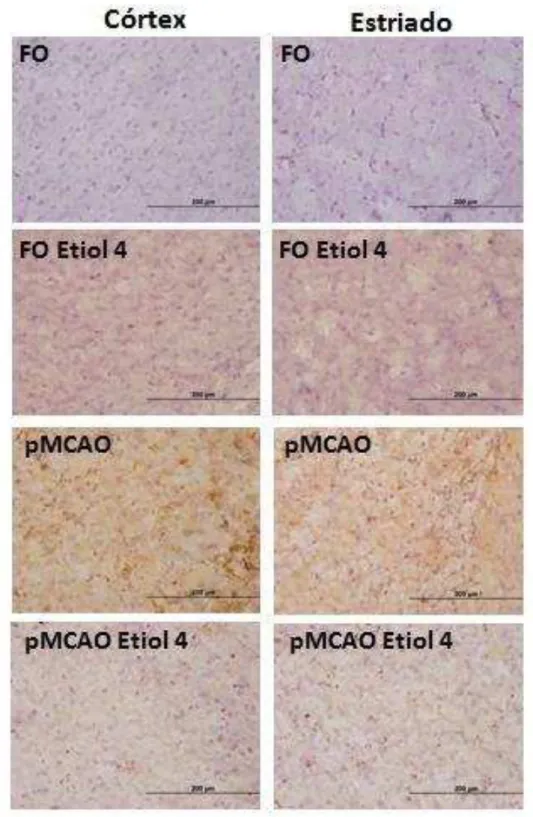
Figura 23. Fotomicrografia da imunoreatividade de TNF-α no córtex temporal e corpo estriado de camundongos submetidos à pMCAO e tratados com eriodictiol.
Figura 24. Efeito do eriodictiol sobre a imunoreatividade de TNF-α no córtex temporal e corpo estriado de camundongos submetidos à pMCAO.
Figura 25. Fotomicrografia da imunoreatividade de iNOS no córtex temporal e corpo estriado de camundongos submetidos à pMCAO e tratados com eriodictiol.
Figura 26. Efeito do eriodictiol sobre a imunoreatividade de iNOS no córtex temporal e corpo estriado de camundongos submetidos à pMCAO.
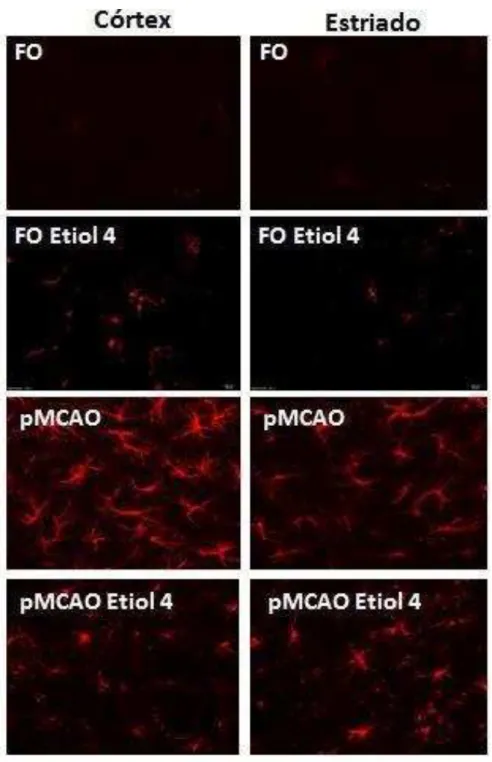
Figura 27. Fotomicrografia da astrogliose evidenciada pela imunoreatividade de GFAP no córtex temporal e corpo estriado de camundongos submetidos à pMCAO e tratados com eriodictiol.
LISTA DE ABREVIATURAS E SIGLAS µL Microlitros
µM Micromolar
AMPA Ácido amino-3-hidroxi-5-metil-isoxasole-propiônico
ATP Trifosfato de Adenosina
AVE Acidente Vascular Encefálico
cm Centímetros
CE Córtex Entorrinal
COX Clicooxigenase
CypD Cyclophilina D
DNA Ácido Dexorribonucléico
EPM Erro Padrão Médio
FO Falso-operado
FSC Fluxo sanguíneo cerebral
h Hora
HTAB Brometo de cetil trimetil amônio
IL Interleucina
ICAM-1 Molécula de adesão intracelular-1
i.p. Intraperitoneal
iNOS Óxido nítrico sintase induzida
KCl Cloreto de potássio
kg Kilograma
LTP Potenciação de longa duração
MCP-1 Proteína quimiotática de monócito-1
mA Miliampere
MIP-1α Proteína inflamatória de macrófagos-1α mg Miligramas
mL Mililitros
mM Milimolar
NaCl Cloreto de sódio
Nm Nanômetro
NMDA N-Metil-D-Aspartato
nNOS Óxido nítrico sintase neuronal
NO Óxido nítrico
pMCAO Oclusão permanente da artéria cerebral média
PKC Proteína Quinase C
RIPK Receptor-Interação de Proteina Kinase
RN Necrose Regulada
RNAm Ácido Ribonucléico mensageiro
ROS Espécies Reativas de Oxigênio
RPM Rotações por minuto
s Segundos
SNC Sistema Nervoso Central
TNF-α Fator de necrose tumoral-α TTC Cloreto de 2,3,5-Trifeniltetrazol
v.o Via oral
LISTA DE TABELAS
Tabela 01 – Grupos de tratamento.
Tabela 02 – Escala utilizada para a avaliação neurológica (Adaptado de GARCIA et al., 1995).
SUMÁRIO
1. INTRODUÇÃO...16
1.1 Acidente Vascular Encefálico...16
1.1.1 Definiçãoe Classificação...16
1.1.2 Epidemiologia e Principais Fatores de Risco...17
1.1.3 Diagnóstico e Tratamento do AVE...18
1.2 Aspectos Fisiopatológicos do AVE Isquêmico...18
1.2.1 Natureza do Problema...18
1.2.2 Cascata Isquêmica...19
1.2.3 Fase Isquêmica...20
1.2.3.1. Falência Energética...20
1.2.3.2. Aumento do Cálcio (Ca++) Intracelular...21
1.2.3.3. Excitotoxicidade Glutamatérgica...22
1.2.3.4. Inflamação e Isquemia Cerebral...24
1.2.4 Fase de Reperfusão...28
1.2.4.1. Estresse Oxidativo e Nitrosativo...28
1.2.5 Morte Celular na Isquemia Cerebral...29
1.3 Isquemia cerebral focal: modelos experimentais in vivo...30
1.4 Isquemia e déficits cognitivos...32
1.5 Flavonóides e Neuroproteção...34
1.6 Eriodictiol...35
2. JUSTIFICATIVA E RELEVÂNCIA... 37
3. OBJETIVOS...38
3.1 Objetivo Geral...38
3.2 Objetivos Específicos...38
4. MATERIAL E MÉTODOS...39
4.1 Animais...39
4.2 Drogas...39
4.3 Protocolo experimental...39
4.4 Isquemia cerebral focal por oclusão permanente da artéria cerebral média (pMCAO)...41
4.5 Avaliação Neurológica...41
4.6 Avaliação do Dano Cerebral...43
4.4.1 Avaliação da Área de Infarto Cerebral Isquêmico com Cloreto de 2,3,5-Trifeniltetrazol (TTC)...43
4.4.2 Avaliação da viabilidade celular (cresil-violeta)...43
4.7 Avaliação da Atividade Locomotora - Teste do Campo Aberto...44
4.8. Avaliação Sobre a Memória...45
4.8.1 Avaliação da Memória de Trabalho - Teste do Labirinto em Y...45
4.8.2Avaliação da Memória Aversiva - Teste da Esquiva Passiva...46
4.9. Avaliação da Inflamação...47
4.9.1. Ensaio para Mieloperoxidase (MPO)...47
4.9.2. Avaliação da imunoreatividade para TNF-α e iNOS...48
4.4.3 Avaliação da astrogliose através da imunoreatividade de GFAP...48
4.10 Análise estatística...50
5.1 Efeito do eriodictiol sobre a avaliação neurológica de camundongos submetidos à pMCAO...51 5.2 Efeito do eriodictiol sobre o dano cerebral isquêmico de camundongos submetidos à pMCAO...52 5.3 Efeito do eriodictiol (4 mg/kg) sobre a viabilidade celular evidenciada pela coloração de cresil violeta no córtex temporal e corpo estriado de camundongos submetidos à pMCAO...53 5.4 Efeito do eriodictiol sobre a atividade locomotora de camundongos submetidos
à pMCAO...56 5.5 Efeito do eriodictiol sobre a memória de trabalho de camundongos submetidos à
pMCAO...57 5.6 Efeito do eriodictiol sobre a memória aversiva de camundongos submetidos à
pMCAO...58 5.7 Efeito do eriodictiol (4 mg/kg) sobre a atividade da enzima mieloperoxidase (MPO) no
córtex temporal e corpo estriado de camundongos submetidos à pMCAO...59 5.8 Efeito do eriodictiol (4 mg/kg) sobre a imunoreatividade de TNF-α e iNOS no córtex temporal e corpo estriado de camundongos submetidos
à pMCAO...60 5.9 Efeito do eriodictiol (4 mg/kg) sobre a astrogliose pela imunoreatividade de GFAP no córtex temporal e corpo estriado de camundongos submetidos
à pMCAO...64 6. DISCUSSÃO...67 7. CONCLUSÃO...76 REFERÊNCIAS BIBLIOGRÁFICAS
1. INTRODUÇÃO
1.1. Acidente Vascular Encefálico
1.1.1. Definição e Classificação
O Acidente Vascular Encefálico (AVE) é definido como um quadro clínico de déficit neurológico que pode perdurar ou exceder as primeiras vinte e quatro horas do evento. É causado pela diminuição da perfusão sanguínea com depleção de oxigênio e glicose ao cérebro. (BROUGHTON et al., 2009; HOFFMANN et al., 2010). A instabilidade da perfusão sanguínea pode se apresentar de forma transitória ou permanente. Suas causas clássicas originam-se de tromboembolismo ou processos hemorrágicos (OMS, 2006).
O AVE pode ser classificado em duas categorias: isquêmico e hemorrágico. O isquêmico acontece pela interrupção de um vaso sanguíneo ascendente ao encéfalo. Este apresenta uma maior prevalência, com um percentual de 85% a 90% de todos os casos (CHEN et al., 2014). O hemorrágico resulta do rompimento do vaso sanguíneo e extravasamento do sangue para o parênquima cerebral ou para o espaço subaracnóideo (GILGUN-SHERKI et al., 2002).
O processo isquêmico pode ser transitório ou permanente. Na isquemia transitória, há um retorno do aporte sanguíneo para a área lesionada após a oclusão do vaso, o que não acontece na isquemia permanente. Além disso, o dano isquêmico pode suceder num âmbito global, focal ou multifocal. Na global, todo o encéfalo é prejudicado pela diminuição significativa da perfusão sanguínea. Diferentemente, nos casos de isquemias focais e multifocais, esse prejuízo acomete uma, duas ou até mesmo, um número mais elevado de regiões encefálicas (PAGNUSSAT, 2005). O AVE acarreta sinais e sintomas debilitantes ao acometido e a irreversibilidade do quadro clínico persistente pode levar a sua morte, sem outra causa aparente que a de origem vascular (OMS, 2006).
Figura 01. Imagem representativa da área do core isquêmico e penumbra A região do core em humanos que sofreram AVE isquêmico é facilmente visualizada por métodos de imagem, pois a área sofre rapidamente um “infarto”. O fluxo sanguíneo nessa região se reduz a 15% do normal. Quando o insulto isquêmico é persistente, tanto o core quanto a penumbra se tornam áreas de infarto (LIPTON, 1999). Na penumbra, a perfusão sanguínea é diminuída pra 20 a 40% do normal. No entanto, nessa região contém neurônios eletricamente silenciosos (que não respondem ao estímulo elétrico), com seus gradientes iônicos preservados. Estes neurônios podem ter suas membranas despolarizadas, caso o fluxo sanguíneo não seja restaurado. A lesão na penumbra é reversível, e é essa a região alvo das inúmeras pesquisas (LIPTON, 1999; HOSSMANN, 2009).
1.1.2 Epidemiologia e Principais Fatores de Risco
A Organização Mundial de Saúde (OMS, 2013) revela que entre os anos de 2000 e 2011, o AVE apresentou-se como a segunda principal causa de óbitos em todo o mundo. Precisamente, 12,9% no total. Segundo o Ministério da Saúde, o AVE é a principal causa de morte no Brasil e os dados são crescentes. Em 2000, 84.130 mortes foram notificadas. Em 2010, esse número acendeu para 99.726. Se não forem adotadas medidas preventivas, os óbitos em todo o mundo por AVE continuarão progressivos. Estima-se 6,5 milhões em 2015 e 7,8 milhões em 2030 (SCHIMIDT, 2014). Os principais fatores de risco para o AVE são dislipidemia, hipertensão arterial, diabetes mellitus, sedentarismo, obesidade e tabagismo (ZHENG, 2014).
1.1.3 Diagnóstico e Tratamento do AVE
O diagnóstico do AVE fundamenta-se em avaliação neurológica, isto é, a observação da presença de sinais clínicos característicos, como déficits motores, alterações na marcha e na fala. Entretanto, a tomografia computadorizada (TC) do crânio é o exame primordial para o desfecho do diagnóstico. A agilidade no atendimento a partir do tempo de entrada do acometido ao hospital e a realização da TC permite um prognóstico diferencial na reabilitação do paciente. Antitrombóticos, anticoagulantes e antiplaquetários são os principais medicamentos de ataque (PERSSON et al., 2014).
Uma terapia bastante aplicada tem como base a administração do fator do ativador do plasminogênio tecidual recombinante (rtPA) que atua como trombolítico (NESBIT et al., 2004). No entanto, o rtPA tem uma janela terapêutica estreita e sua eficácia está relacionada com sua utilização nas primeiras 4,5 horas (DEL ZOPPO et al., 2009). A utilização do rtPA após as 4 horas e meia do início do ataque isquêmico, pode distorcer o efeito terapêutico esperado, sensibilizando o aumento de risco hemorrágico ao paciente. Consequentemente, somente 2 a 8% dos acometidos por AVE são beneficiados por este tratamento (KLEINDORFER et al., 2008). Outra alternativa para a terapia de reperfusão é a extração mecânica do coágulo endovascular (NESBIT et al., 2004).
1.2 Aspectos Fisiopatológicos do AVE Isquêmico
1.2.1 Natureza do Problema
A isquemia gerada por embolismo apresenta uma prevalência de 30% dos casos. Geralmente ocorre por distúrbios cardio-vasculares, as clássicas são: miocardiopatias, valvulopatias e aneurisma ventricular. Porém, numa prevalência menor, a embolia pode se manifestar também por fraturas ósseas que desenvolvem embolia gordurosa. Complicações pós-cirúrgicas de pulmões podem gerar êmbolos que, porventura, percorrem os vasos e se prendem nos estreitamentos arteriais (ROWLAND e MERRI, 2002). A hipoperfusão sistêmica é outra problemática que também predispõe a um evento isquêmico. O fluxo sanguíneo fica diminuído de forma global no cérebro. Isso é causado por hipovelemia ou falência cardíaca (COLLI et al., 1998).
1.2.2 Cascata Isquêmica
As lesões no tecido cerebral devido ao AVE isquêmico acontece em duas fases, classificadas em fase isquêmica e fase de reperfusão (MIGUEL et al., 2012), envolvendo várias vias de sinalizações, como: falência na produção de ATP, acidose (excessiva produção de lactato pela via anaeróbica), excitotoxicidade glutamatérgica, despolariação peri-infártica, inflamação, apoptose e estresse oxidativo pelo o aumento de espécies reativas de oxigênio e pela diminuição de antioxidantes naturais (Figura 02) (GUO et al., 2011; MAJID, 2014).
Figura 02. Vias de sinalizações envolvidas na cascata isquêmica (Adaptado de HOSSMANN,
2009).
1.2.3. Fase Isquêmica
1.2.3.1. Falência Energética
reservas de glicose, abastecem por cerca de 90 minutos as regiões isquemiadas do cérebro. No entanto, esse metabolismo passa de oxidativo para glicolítico (glicólise anaeróbica), produzindo acidose secundária pela formação de lactato, o que exacerba a lesão hipóxica na célula (de VEBER, 1999). Ainda, o metabolismo anaeróbico não sustenta a alta demanda bioenergética que o cérebro necessita. A produção de ATP é bem inferior comparada à via aeróbica (MACHADO, 2002).
A diminuição da produção de ATP altera o gradiente iônico das células, causando falência da bomba sódio-potássio (Na+/K+). Acontece acúmulo de sódio (Na+) intracelular e evasão de potássio (K+)para o espaço extracelular. O Na+ carreia moléculas de água (H2O) e o seu influxo descontrolado promove edema (degeneração hidrotrópica) das células e de suas organelas, assim como recorrentes despolarizações anóxicas (KANEKAR et al., 2012). A ineficiência da bomba Na+/K+ promove o aumento na produção do radical superóxido (O2-) e outros radicais, como o peroxido de oxigênio (H2O2) e hidroxila (OH-) pelo metabolismo da xantina. Ao mesmo tempo, as sinapses glutamatérigicas liberam glutamato, promovendo excitotoxicidade por glutamato, com aumento do Ca++ intracelular. A integridade da barreirahemato-encefálica é perdida. Vários mediadores inflamatórios são produzidos, dando curso à inflamação (MIGUEL et al., 2012; ALLEN e BAYRAKTUTAN, 2009).
1.2.3.2. Aumento do Cálcio (Ca+ +) Intracelular
O cálcio (Ca++) livre no citosol é encontrado em concentrações muito inferiores comparadas aos níveis extracelulares (1/10.000). No interior da célula, a maior parte do Ca++ está seqüestrado nas mitocôndrias e retículo endoplasmático (COTRAN et al., 2000; WHITE et al., 2000). A depleção de ATP após um processo isquêmico causa a falência da bomba de Ca++ ATPase, promovendo o aumento exacerbado da concentração de Ca++ citosólico através do seu influxo a partir da membrana plasmática, mitocôndrias e retículo endoplasmático (DOYLE et al., 2008). Cotran et al. (2000) e Murphy et al. (2002) mostraram que o Ca++ citosólico aumenta significativamente para aproximadamente 3mM depois de 15 minutos de isquemia global induzida em modelo animal.
concentração de Ca++ total na região de core da lesão mostrou-se superior a concentração observada na área de penumbra, aumentando cerca de 1,0 mM/h do início do insulto até 24 horas depois deste (KIM et al., 1998). As recorrentes despolarizações devida a falência da bomba de Na+/K+ promove a abertura dos canais de Ca++ voltagem-dependente e leva a acúmulo ainda maior desses íons para o interior da célula, contribuindo ainda mais para morte neuronal. Por essa razão, os bloqueadores de canal de cálcio são visto como pontos estratégicos para a neuroproteção. Dentre os subtipos de canais de cálcio (P, Q e L), o tipo L é que se apresenta mais participante no dano celular (LUKIC-PANIN, 2007). Antagonistas do canal do tipo L reduziram a área de infarto em lesões focais transitórias (CAMPBELL et al., 1997) e permanentes (BIELENBERG et al., 1990; JACEWICZ et al., 1990).
1.2.3.3. Excitotoxicidade Glutamatérgica
No final dos anos 50, Curtis e colaboradores observaram pela primeira vez a ação excitatória do ácido glutâmico sobre o cérebro de mamíferos (BENNETT e BALCAR,1999). Entretanto, somente no final da década de 70, o L-glutamato foi reconhecido como o principal neurotransmissor excitatório do sistema nervoso central (SNC), sendo observado na maioria das sinapses (MELDRUM, 2000). A concentração de glutamato na fenda sináptica se encontra na faixa micromolar (em torno de 1-β μM). Já no citoplasma das células neuronais, essa concentração chega a 10 mM (NEDERGAARD et al., 2002). O glutamato é liberado por dois mecanismos: (1) exocitose das vesículas sinápticas por processo dependente de Ca++ e (2) via independente de Ca++. Nesta, não há participação das vesículas sinápticas. Acontece um fenômeno chamado: reversão da captação. Essa reversão pode acontecer, dentre outros fatores, devido a um aumento de K+ extracelular (DANBOLT, 2001).
receptores, fenômeno esse, conhecido como excitotoxicidade glutamatérgica (Figura 03) (ALLEN et al., 2004).
Em condições normais, depois de sintetizado, o glutamato é lançado para a fenda sináptica, podendo se ligar a receptores do tipo NMDA e AMPA. O glutamato é removido da fenda sináptica por transportadores de membrana nos neurônios pré (EAAT2), pós-sinápticos EAAC1 (EAAT3) e pelas células da glia, GLAST (EAAT1) e GLT1 (EAAT2). Na isquemia, as perturbações nos gradientes de concentração de Na+ e K+, vão levar ao evento conhecido como transporte reverso, levando ao aumento da concentração de glutamato no espaço extracelular (ALLEN et al., 2004).
Figura 03. Diagrama sistemático da sinapse glutamatérgica em condições normais e em condições isquêmicas (Adaptado de ALLEN et al., 2004)
O glutamato no meio extracelular irá se ligar aos seus receptores ionotrópicos, NMDA (N-metil-D-aspartato). Esses receptores são canais iônicos operados por ligantes e medeiam o influxo de CA++, que possui um sítio de ligação dentro do canal iônico, exposto a ligação do magnésio que realiza sobre ele um bloqueio voltagem dependente (GINSBERG, 1995; HOSSMAN, 2009).
aumentando em até 18 vezes a permeabilidade desses receptores ao Ca++ (LIU et al., 2006). A hiperativação de ambos os receptores NMDA e AMPA/cainato no processo de excitotoxicidade pelo glutamato, leva a um aumento do influxo de Ca++ e Na+ na célula. Favorece a ativação da transcrição gênica e vias de sinalização que induzem a morte celular (ROMERA et al., 2004).
1.2.3.4 Inflamação e Isquemia Cerebral
A inflamação pós-AVE é um mecanismo secundário de lesão à cascata isquêmica (KIM et al., 2014; CHAMORRO e HALLENBENCK, 2006). Essa resposta inflamatória é estimulada pela a ativação de enzimas cálcio-dependente e por espécies reativas de oxigênio (ROS), que induzem a produção de mediadores inflamatórios. Estes, por sua vez, promovem a ativação das células da glia, o que gera uma maior produção de citocinas, com conseqüente expressão de moléculas de adesão nos endotélios da vasculatura cerebral (BENAKIS et al., 2014; SHICHITA et al., 2012; MACREZ et al., 2011; BECKER, 1998).
Os mediadores inflamatórios produzidos primariamente ativam as células da glia (micróglia e astrócitos), principalmente (Figura 04) (HOSSMANN, 2009). As células da micróglia são macrófagos especializados, atuam como células apresentadoras de antígenos, removem restos célulares e secretam citocinas. Isso as torna participantes de um sistema imune organizado e residente do sistema nervoso central (SNC) (MORIOKA et al., 1993). Os astrócitos são as células gliais que garantem a integridade da comunicação entre as células neurais, impedindo a propagação desordenada das sinapses. Os seus prolongamentos contem a proteína ácida fibrilar glial (GFAP de Glial Fibrillary Acidic Protein) (HOL e PEKNY, 2015).
Figura 04. Diagrama representando a resposta inflamatória aguda após isquemia cerebral focal (Adaptado de BROUNS e DEYNN, 2009).
Tanto as células da micróglia, quanto os astrócitos secretam mediadores próinflamatórios, tais como matriz metaloproteinase, quimiocinas, citocinas e óxido nítrico induzível (iNOS) (CHE et al., 2001). A partir de então, esses mediadores, estimulam a expressão de mais moléculas de adesão endotelial, num prazo de 4 a 6 horas após a isquemia (DANTON e DIETRICH, 2003).
(CD11c, LFA-1 e Mac-1) que estimulam a adesão celular ao endotélio e modificação conformacional de leucócitos facilitando da diapedese, (HARING et al., 1996) e (3) as imunoglobulinas (CAM‟s), como as ICAM-1 e -2 e VCAM-1. Elas facilitam as interações dos leucócitos com o endotélio e promovem a diapedese (EHRENSPERGER et al., 2005).
As células participantes do processo inflamatório na isquemia incluem neutrófilos, macrófagos/micróglia, células dendriticas e linfócitos B e T (KLEINSCHNITZ et al., 2012; BRAIT et al., 2010). Os neutrófilos são os primeiros leucócitos a migrarem para o sítio isquêmico (WANG et al., 2013). A atividade da enzima mieloperoxidade (MPO) se encontra significativamente elevada na inflamação pós-isquemia. A MPO é uma enzima presente nos grânulos dos neutrófilos. Por essa razão, a elevação da sua atividade tem sido estabelecida como parâmetro indicativo de infiltração leucocitária em processos isquêmicos (SHI et al., 2014). Moléculas com propriedades antiinflamatórias reduziram significativamente a atividade de MPO em animais isquemiados (WANG et al., 2015; LIU et al., 2014).
Geralmente, a ativação dessas células inflamatórias leva a translocação nuclear do fatornuclear kappaB (NF-kB), que por sua vez, induz a expressão de vários mediadores próinflamatórios (LAN et al., 2013; TU et al., 2010). Linfócitos T CD4+ e T CD8+ produzem citocinas como, interferon- (IFN- ), interleucina-6 (IL-6), interleucina-17 (IL-17), e Fator de Necrose Tumoral (TNF-α) (GELDERBLOM et al., 2012; BRAIT et al., 2010). Em adição, a ativação de macrófagos infiltrados e a atuação da micróglia residente, estimula o aumento da sinalização inflamatória, levando a produção de mais interleucinas (IL-1, IL-6, IL-18, TNF-α) com concomitante lançamento de mais radicais livres. O resultado dessa cascata é a morte de células neuronais (neurônios) e de células não neuronais (astrócitos) (BROUGHTON et al., 2013) (Figura 05).
Figura 05. Diagrama sistemático da gênese de mediadores inflamatórios envolvidos na lesão secundária pós-isquemia cerebral (Adaptado de BROUGHTON et al., 2013).
TNF-α e iNOS são mediadores inflamatórios que tem um papel relevante no mecanismo inflamatório do dano cerebral (BLANCO et al., 2004). A expressão desta citocina e desta enzima, respectivamente, foi reportada em estudos envolvendo isquemia cerebral em animais e intervenções terapêuticas com antiinflamatórios foram capazes de suprimir estas significativas expressões (GAIRE et al., 2015; XU et al, 2014; YU et al., 2013). Ainda, simultaneamente na cascata inflamatória isquêmica e com um up regulation de várias enzimas, por exemplo, a fosfolipase A2 é ativada a partir da elevação dos níveis de cálcio intracelular.
AVE (GAIRE et al., 2015; WANG et al., 2015; LIU et al., 2014; XU et al, 2014; YU et al., 2013).
1.2.4 Fase de Reperfusão
1.2.4.1 Estresse Oxidativo e Nitrosativo
A fase de reperfusão é caracterizada pelo restabelecimento do fluxo sanguíneo nas áreas isquemiadas. Esse evento causa lesões adicionais, conhecidas como lesões por reperfusão. O sangue que volta a irrigar os sítios isquêmicos carreia uma grande demanda de O2, sujeitando as células a um repentino e intenso metabolismo aeróbico. Ocorre então um desequilíbrio entre a produção e a neutralização de ROS. Fisiologicamente, quando o O2 chega à mitocôndria, sofre redução, recebendo quatro elétrons. Com a participação da enzima citocromo oxidase são formados ROS, como, superóxido (O2-), peróxido de hidrogênio (H2O2), hidroxila (OH-) e hidroperoxila (HO2-) (CAMPOS e YOSHIDA, 2004). Para que aja um balanço homeostático, esses ROS são removidos por agentes antioxidantes endógenos. Na reperfusão, o excesso de ROS se sobrepõe à capacidade desse processo de remoção, causando um fenômeno conhecido como estresse oxidativo (ZLATKOVIC et al., 2014; PRADEEP et al, 2012; ALLEN e BAYRAKTUTAN, 2009).
O influxo exacerbado do Ca++, participante simultâneo da cascata isquêmica, promove a ativação da calpaína, uma protease que quebra uma ponte peptídica da enzima xantina desidrogenase (XD). Essa ação, leva à produção da enzima xantina oxidase (OX). O O2 juntamente com OX, converte a hipoxantina em xantina. Na reperfusão, o excesso de O2, causa hiperprodução de xantina. Esta é oxidada em ácido úrico, formando como subproduto, mais O2-, H2O2 e OH-(SILVA Jr. et al., 2002). O NO também está presente nas lesões de isquemia-reperfusão pós-AVE. O NO reage com O2-, originando um radical livre altamente reativo, o peroxinitrito (ONOO-) (KUNZ et al., 2010; CAMPOS e YOSHIDA, 2004). O estresse causado por radicais livres do óxido nítrico (NO) é chamado de estresse nitrosativo (ALLEN e BAYRAKTUTAN, 2009).
diabetes, entre outras (TAYLOR et al., 2013). Na isquemia cerebral, o estresse oxidativo desempenha um papel crucial na sua fisiopatologia pela grande susceptibilidade do cérebro ao estresse, devido a alta taxa de metabolismo de O2, grande quantidades de ácidos graxos insaturados, altas reservas de ferro e sistema antioxidante ineficiente (PRADEEP et al, 2012; ALLEN e BAYRAKTUTAN, 2009; TARDINI e YOSHIDA, 2003).
Para combater os radicais livres o organismo produz uma série de enzimas antioxidantes. Por exemplo, a glutationa peroxidase (GSHPX) que converte H2O2 em H2O; a superóxido dismutase (SOD), que está presente no citosol, na mitocôndria e no meio extracelular, produz H2O2 através de uma reação de dismutação a partir do O2–; e a catalase, que tem como principal função eliminar peróxido formado no peroxissoma, diminuindo o risco da formação de radical hidroxil. Além dos antioxidantes endógenos, o corpo pode se beneficiar de antioxidantes provindos da dieta, como a vitamina C e E (CHAN, 1996).
1.2.5. Morte Celular na Isquemia Cerebral
Quando os eventos fisiopatológicos tornam-se irreversíveis na lesão isquêmica, as células atingidas são induzidas à morte. Coexistem dois tipos de morte celular após a isquemia: necrose e apoptose (DEVARAJAN, 2006). A necrose é caracterizada pela presença de edema citoplasmático, desintegração de organelas, conseguinte perda da integridade da membrana celular e liberação de conteúdos celulares para o meio extracelular, através de uma forma passiva de energia, “independente de mecanismos de regulação” que comumente estão presentes na apoptose (JOUAN-LANHOUET et al., 2014; ZIEGLER e GROSCURTH, 2004).
No entanto, esse conceito está sendo mudado. Recentemente, foi evidenciado que existem diferentes tipos de necrose envolvendo regulação intracelular, classificadas como necroptoses ou RN (do inglês Regulated Necrosis). As vias de sinalização envolvidas nas necroptoses podem interagir com receptores do tipo CypD (Cyclophilin D) (VANDEN et al., 2014) e receptores do tipo RIPK 1 e 3 (Receptor-Interacting Protein Kinase) (GALLUZZI et al., 2012). Esses receptores podem ser ativados pelos produtos da cascata isquêmica como ROS e as suas sinalizações resultam na desintegração celular (VANDENABEELE et al., 2010).
sinalização, que podem ser classificadas como vias intrínsecas (nas mitocondrias) e extrínsecas. Existem receptores de membrana celular que quando ativados, sinalizam a ação de proteases, denominadas caspases (NAGATA e GOLSTEIN, 1995). O mecanismo central para a apoptose é a ativação das caspases, constituído de caspases iniciadoras e caspases efetoras. Ambas as vias (intrínsecas e extrínsecas) induzem a ativação das caspases. A partir de sinais específicos e indutivos de morte celular, as caspases iniciadoras (8 e 9) ativam as caspases efectoras (3, 6, e 7) (LI et al., 2013).
As alterações celulares peculiares da apoptose, incluem, fragmentação do DNA, condensação da cromatina e desarranjo dos microtúbulos. Esses processos induzem a fragmentação celular, formando o que se conhece por “corpos apoptóticos”. Essas estruturas são envoltas por membrana celular, contendo no seu interior, citoplasma e massas negras de cromatina. Os corpos apoptóticos são removidos do parênquima por fagocitose. No entato, não estimulam resposta inflamatória. A necrose, por sua vez, estimula a produção de mediadores inflamatórios e conseqüente quimiotaxia (HARRIAUT-MARLANGUE et al., 1996).
1.3 Isquemia cerebral focal: modelos experimentais in vivo.
Figura 06. Representação esquemática do Polígono de Willis (WIKIMIDIA COMMONS, 2008).
A artéria cerebral mais comumente acometida por AVC é a artéria cerebral média (ACM), que irriga a região lateral do hemisfério e estruturas subcorticais. A oclusão da ACM resulta em redução do fluxo sanguíneo cerebral tanto no núcleo estriado quanto no córtex, mas o grau de distribuição do fluxo depende da duração e do sítio de oclusão ao longo da ACM, assim como da quantidade de fluxo sanguíneo colateral na região de oclusão (TRAYSTMAN, 2003).
De acordo com a classificação experimental de isquemia cerebral através da distribuição da região de infarto, se conhece dois tipos de modelo de isquemia: a global e a focal. A isquemia global ocorre quando há falência circulatória e a isquemia focal ocorre quando o fluxo sanguíneo cerebral é limitado em uma região específica, geralmente resultado da oclusão de uma artéria cerebral. Existe ainda o modelo multifocal, onde várias pequenas regiões são atingidas (LIPTON, 1999). A isquemia cerebral focal tem sido produzida por uma variedade de métodos, e as variações na indução do infarto são atribuídas à diversidade de espécies e às técnicas empregadas (TAKAMATSU, 2002).
contralateral à isquemia (OTERO, 2009). Além disso, podem ocorrer déficits de memória e aprendizagem (FERNANDES, et al., 2014).
1.4 Isquemia e déficits cognitivos
A memória é um processo cognitivo de armazenamento de informações. O SNC adquire informações constantemente através do aprendizado e demais acontecimentos da vida, no qual o organismo e seus sentindos são expostos. Entretanto, apenas uma pequena parte dessas informações é retida de forma duradoura. Existe um processo de seleção para a armazenação da informação na memória e a sua duração é determinada pelo impacto emocional, grau de atenção e importância dessa informação no processo de sua aquisição. A memória é estudada num processo constituído de fases, respeitando a uma sequencia de eventos que corresponde à aquisição, consolidação e evocação da informação (IZQUIERDO, 2002).
A aquisição é a primeira fase do processamento da memória. É onde toda a informação é adiquirida através dos sistemas sensoriais. Após a aquisição, se dá o processo de consolidação, a informação é consolidada “armazenada”. A última fase do processo de memória é a evocação, onde toda a informação armazenada pode ser acessada “evocada”, constituindo o ato de lembrar (ABEL e LATTAL, 2001).
A memória é divida em dois tipos, memória declarativa e não-declarativa. A memória declarativa é uma memória explícita. É uma memória usada para recordação de fatos e eventos, como, datas importantes, fatos históricos marcantes, nomes de pessoas e lugares. A memória declarativa é ainda dividida em episódica e semântica. A episódica está relaconada com o tempo. A semântica envolve o significado de palavras. A memória declarativa é armazenada no diencéfalo e no lobo temporal. A memória não-declarativa é uma memória implícita ou de procedimento. Está relacionada com a memória para o desenvolvimento de habilidades, como o ato de escrever, de mastigar, de amarrar o cadarço, de dirigir e ainda a habilidade de identificar um estímulo como um resultado de uma exposição prévia (LENT, 2005). As regiões envolvidas nesse tipo de memória incluem amígdala, o cerebelo e os núcleos da base (SQUIRE e KANDEL, 2003; IZQUIERDO, 2002).
planejar uma ação futura (SQUIRE e ZOLA-MORGAN, 1996). A memória de curta duração pode ser perdida ou convertida em longa duração (GOLDMAN-RAKIC, 1992). As áreas cerebrais responsáveis pela memória de trabalho são o córtex pré-frontal, córtex orbitofrontal e suas conexões com o córtex temporal e parietal, hipocampo e amígdala (IZQUIERDO et al., 1998).
Danos ao tecido cerebral resultante de isquemia cerebral podem levar a problemas de cognição, como déficits de memória (AVIRAM et al., 2000). Alguns trabalhos têm demonstrado défictis na aquisição e retenção da memória após a oclusão da artéria cerebral média em animais, utilizando o teste de esquiva passiva e Y-maze (SARKAKI et al., 2015; CARMO et al., 2014; FERNANDES et al., 2014).
A esquiva passiva é um teste comportamental utilizado para mensurar a memória de curta e longa duração. É um teste que analisa respostas de alerta e ansiedade associada a um estímulo aversivo em modelos animais. As principais regiões envolvidas nessa tarefa incluem a amígdala, o hipocampo e septo medial (IZQUIERDO et al., 1992, 1993a). A avaliação de alternações espontâneas no Y-maze possibilita ao pesquisador analisar a memória de trabalho em roedores. O Y-maze é um labirinto formado de três braços, dispondo aos animais nele observados a explorarem novos ambientes. Geralmente, os animais preferem explorar um novo braço do labirinto em vez de retornar a um que foi anteriormente visitado. As áreas cerebrais envolvidas nessa tarefa incluem, córtex occipital, parietal e frontal direitos (SQUIRE e ZOLA-MORGAN, 1996).
A morte celular no córtex, corpo estriado e hipocampo podem levar a severos défictis de memória (GU et al., 2010). Um estudo de Hong et al. (2000), mostrou que animais isquemiados apresentaram graves déficits de memória de curta e longa duração e estes déficits estavam parcialmente relacionados com a morte de células piramidais do córtex e do estriado. Segundo LEE et al. (2003) a morte celular após AVE pode acontecer precocemente ou de forma tardia. Acontece uma “morte precoce” por necrose no core isquêmico e uma “morte tardia” de células susceptíveis de outras regiões vizinhas. O hipocampo é outra estrutura relacionada com a aprendizagem e a memória. Estudos mostraram que animais submetidos AVE experimental apresentam morte celular no hipocampo. Assim, os déficits de memória ocasionados por lesões no hipocampo, podem também estar relacionados primariamente a danos corticais e estriatais, visto que, os déficitis cognitivos causados pela isquemia cerebral podem ser por lesão extra ou intra hipocampal (BACHEVALIER e MEUNIER, 1996).
1.5. Flavonóides e Neuroproteção
Os flavonóides são compostos polifenólicos, encontrados em frutas, sementes, legumes, ervas, mel, dentre outros alimentos da dieta consumidos cotidianamente (KOES e QUATTROCCHIO, 1994). Os flavonóides possuem propriedades antinflamatórias, antioxidantes, antiapoptótica, vasodilatadoras, antialérgicas, antiplaquetária, antitumorais e antimicrobianas (RATTY e DAS, 1998). Vários estudos têm demonstrado a capacidade dos flavonóides em melhorar a cognição e prevenir danos neuronais causados por isquemia cerebral induzida em modelos animais (FU et al., 2014; MIAO et al., 2014; DONG et al., 2013).
Os flavonóides são dividos em classes: flavonas, flavanonas, flavonóis, auronas, isoflavonas, flavanas, antocianidinas, leucoantocianidinas, chalconas, neoflavonóides, proantocianidinas (Bravo, 1998). Particularmente, a classe das flavanonas se destaca por serem compostos encontrados em altas concentrações nos cítricos e em algumas ervas. As flavanonas são representadas pelos compostos: eriodictiol, naringenina, naringina e hesperidina.
Vários estudos reportaram a capacidade das flavanonas em inibir o processo inflamatório (WU et al., 2015), o estresse oxidativo (KOCYIGIT, et al., 2015) e a apoptose (MUTHAIAH, et al., 2013), bem como as ações benéficas sobre déficits cognitivos, por exemplo, a naringenina preveniu animiais de déficitis de memória ocasionados por modelo de Alzheimer induzido (MA et al., 2013). Por essa razão, é relevante dar continuidade a investigação dos efeitos neuroprotetores de outras flavanonas, como por exemplo, o eriodictiol, que demonstrou proteger animais do dano cerebral isquêmico. No entanto, não existem na literatura estudos que relatem seus efeitos sobre déficits de memória.
1.6. Eriodictiol
O eriodictiol (γ‟,4‟,5,7-tetrahidroxiflavanona) (Etiol) (ROSSATO, et al., 2011), é um flavonóide da classe das flavanonas (HAVSTEEN, 1983). É um metabólito secundário que pode ser encontrado em frutas cítricas, como o limão e em algumas ervas, como na erva chinesa (Dracocephalum rupestre) (LOU et al., 2012), na erva santa (Eriodictyon californicum) (JAKOB et al., 2005) e na erva-de-mula (Vernonia tweedieana) (ROSSATO, 2010). O Etiol mostrou efeito antinociceptivo eficaz a partir da dose de 4,5 mg/kg por via oral em ratos (Figura 7) (ROSSATO, 2010).
Figura 07. Estrutura molecular do eriodictiol
Vários estudos foram realizados com intuito de conhecer a farmacocinética do eriodictiol. Quando absorvido no intestino, é convertido em sua forma aglicona e metabolizado por metilação, originando outros flavonoides, a hesperetina e o hemoeriodictiol (Miyake et al., 2000).
O eriodictiol possui propriedades terapêuticas reportadas, incluindo propriedade antiinflamatória, antialérgica, antimicrobiana, antitumoral (LEE, 2011) e antioxidante (HU et al.,2012;. LOU et al., 2012). Eriodictiol reduziu significativamente o infarto cerebral e déficits neurológicos em ratos submetidos à isquemia cerebral focal transitória (Jing et al., 2013). Ainda, reprimiu a neurotoxicidade induzida pelo H2O2 em cultura de células de feocromocitoma em ratos (PC12) (LOU et al., 2012).
(OURO et al., 2012). O eriodictiol-7-O-glucosideo mostrou estabilizar a degradação de Nrf2, resultando no seu acúmulo. Estudos recentes têm sugerido que a Nrf2 confere proteção contra a toxicidade induzida pela cisplatina numa linhagem de HRMC (Human Renal Mesangial Cell) (HU et al., 2012).
O tratamento com eriodictiol suprimiu significativamente a morte celular induzida por luz ultravioleta (UV) em queratinócitos humanos (células NHEK, do inglês Normal Human Epidermal Keratinocyte), através da redução da apoptose e da clivagem de poli (ADP-ribose) polimerase e inibiu concomitantemente a ativação da caspase-3 e a produção de ROS (LEE, et al., 2011). O eriodictiol também mostrou efeito direto sobre o sistema vascular. Foi evidenciado seu efeito vasodilatador sobre anéis de aórtica torácica de ratos. O eriodictiol diminuiu significativamente as contrações endoteliais induzidas por noradrenalina (NA) e cloreto de potássio (KCl). Esse efeito vasodilatador mostrou estar parcialmente relacionada com a inibição do influxo de Ca++ ou com outra proteína enzimática subsequente a ativação de PKC (Protein Kinase C) envolvida com a ativação de proteínas contráteis como a MLCK (Myosin Light Chain Kinase) (ROJAS et al., 1999).
Lee, (2011) mostrou a capacidade anti-inflamatória do eriodictiol através da redução de óxido nítrico (NO) e citocinas pro-inflamatórias produzidas a partir de LPS de células RAW 264.7. Ainda, demonstrou que o eriodictiol foi capaz de suprimir a atividade fagocítica dos macrófagos. O bloqueio do NF-kB mostrou ser o mecanismo molecular envolvido nessa ação antinflamatória. Em outro trabalho, Lee et al. (2013) mostrou que o eriodictiol inibiu a produção de citocinas pró-inflamatórias estimuladas por LPS via bloqueio de TLR4/CD14 seguido de p38 MAPK, ERK1/2, JNK, e regulação da COX-2. Estes achados sugerem que o eriodicitiol pode ser útil na inibição da produção de mediadores inflamatórios, quimiotaxia, infiltrado leucocitário e ativação glial presentes no processo inflamatório do AVE. No entanto, os efeitos do eriodictiol sobre a neuroinflamação (in vivo) e sobre os déficits de memória após a oclusão permanente da artéria cerebral média (pMCAO) encontram-se desconhecidos.
2. JUSTIFICATIVA E RELEVÂNCIA
O Acidente vascular encefálico é a terceira principal causa de morte humana. O dano inflamatório desempenha um papel importante na patogênese da isquemia cerebral e constitue um alvo para a prevenção e tratamento (ZHAO et al., 2014). Terapias anti-inflamatórias têm mostrado serem eficazes na redução do dano isquêmico e déficits de memória ocasionados por modelos de AVE experimental (HUANG et al., 2014).
As medidas preventivas no combate aos riscos de AVE, como, o controle da pressão arterial, combate ao tabagismo e controle dos níveis de colesterol e da diabetes, são focos da promoção à saúde realizada pelo o governo, no entanto, o Brasil ainda possui altas taxas de mortalidade devido ao AVE (GARRITANO et al, 2012).
Assim se faz necessária a busca por substâncias que possam atuar na neuroproteção de pacientes de risco. Apesar de muitos estudos buscarem drogas neuroprotetoras para a isquemia cerebral (AHMED, et al., 2000; HALEY, 1998), poucos se mostraram realmente efetivos (TAZAKI, et al., 1988). O presente estudo visa investigar se o eriodictiol, por suas ações anti-inflamatórias e antioxidantes possa vir a ser uma estratégia terapêutica no tratamento do AVE.
3. OBJETIVOS
3.1. Objetivo Geral
Estudar os efeitos do eriodictiol sobre o dano neuronal, memória e resposta inflamatória de camundongos submetidos à isquemia cerebral focal permanente.
3.2. Objetivos Específicos
Estudar os efeitos do eriodictiol em camundongos submetidos à isquemia cerebral focal permanente, analisando os seguintes aspectos:
Disfunção mitocondrial (TTC);
Alterações sensório-motoras e déficits de memória;
Viabilidade neuronal através da coloração de cresil-violeta no córtex temporal e estriado dos animais isquemiados.
Neuroinflamação através de determinação da atividade de MPO e imunohistoquímica para mediadores inflamatórios (TNF-α e iNOS) e ativação astrocitária (GFAP) no córtex temporal e estriado de animais isquemiados;
4. MATERIAL E MÉTODOS
4.1 Animais
Foram utilizados camundongos albinos adultos Swiss, machos, pesando entre 25 e 30g, provenientes do Biotério Central do Campus do Pici da Universidade Federal do Ceará (UFC) e transferidos para o Biotério do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina - UFC. Os animais foram mantidos em gaiolas plásticas apropriadas, forradas com raspas de madeira, com ciclo de claro/escuro de 12h/12h e alimentados com ração padrão e água à vontade. No que se refere aos cuidados com os animais, este estudo seguiu os princípios éticos da experimentação animal, estabelecidos pelo Colégio Brasileiro de Experimentação Animal (COBEA). O estudo foi submetido à Comissão de Ética em Pesquisa Animal (CEPA) da UFC sob o número de registro 90/2013.
4.2 Drogas
Eriodictiol 10mg (Sigma-Aldrich, EUA); Cloridrato de xilazina 2% (Kensol® Laboratórios König S.A, Argentina); Cloridrato de ketamina 5% (Vetanarcol®, Laboratórios König S.A, Argentina). Todos os reagentes utilizados eram de grau analítico.
4.3 Protocolo experimental
Foram utilizados 128 animais divididos entre os grupos falso-operados tratados com veículo ou eriodictiol (Etiol) na dose de 4 mg/kg, isquemiados (pMCAO) tratados com veículo e isquemiados (pMCAO) tratados com Etiol nas doses de 1, 2, e 4 mg/kg por via oral (v. o.) (Tabela 01). A dose maior de Etiol (4 mg/kg) escolhida para esse estudo foi baseada nos resultados de Rossato, (2010) que demonstrou que o tratamento com Etiol a partir da dose de 4,5 mg/kg foi capaz de reduzir significativamente a nocicepção induzida por capsaicina. O Etiol foi solubilizado (5% Tween 80 em salina 0,9%). Os animais foram tratados com Etiol 30 minutos antes da indução isquêmica por eletrocoagulação da artéria cerebral média e 1 hora depois. Nos dias que se seguiram a cirurgia, as doses de 1, 2 e 4 mg/kg foram administradas 1 vez ao dia.
nessas estruturas cerebrais para avaliar a atividade enzimática de MPO (n=6/grupo). Protocolo 3: 72 horas após a cirurgia foram realizados os testes de campo aberto, labirinto em Y e esquiva passiva (memória recente) e 96 horas após o teste da esquiva passiva (memória tardia) (n=8/grupo). Ao final do protocolo 3 os animais foram perfundidos com paraformolaldeído 4% e seus cérebros, dissecados e fixados com formol tamponado por 24 horas. Logo após, os cérebros foram armazenados em sacarose até serem cortados no criostato. Após a realização dos cortes, as fatias foram armazenadas em geladeira “free floating” em PBS e foram utilizadas para as técnicas de imunohistoquímica (TNF-α, iNOS e GFAP) e para as técnica de histologia (Cresil-violeta). (Figura 8).
Tabela 01. Grupos de tratamento.
Grupo Tratamento
FO Animais falso-operados e tratados com veículo (5% Tween 80 salina 0,9%) v.o.
FO + Etiol 4 Animais falso operados e tratados com Etiol na dose de 4 mg/kg v.o.
pMCAO Animais submetidos à pMCAO tratados com veículo v.o.
pMCAO+Etiol 1 Animais submetidos à pMCAO tratados com 1 mg/kg de Etiol v.o.
pMCAO+Etiol 2 Animais submetidos à pMCAO tratados com 2 mg/kg de Etiol v.o.
pMCAO+Etiol 4 Animais submetidos à pMCAO tratados com 4 mg/kg de Etiol v.o.
4.4 Isquemia cerebral focal por oclusão permanente da artéria cerebral média (Tamura
et al., 1981).
Os animais foram anestesiados com xilazina (10mg/kg) e ketamina (90mg/kg), administradas por via intraperitoneal (i.p) para o procedimento cirúrgico. A temperatura foi mantida entre 36 e 37º C com o auxílio de uma lâmpada. Inicialmente foi realizada uma incisão na linha entre o olho esquerdo e a orelha, o músculo temporal foi rebatido e realizada uma craniectomia com uma broca de 1 (mm), seguido da exposição e cauterização da artéria cerebral média. Em seguida a incisão foi suturada com fio de seda agulhado 4.0, e os animais foram colocados em gaiolas para recuperação da cirurgia com livre acesso a água e comida. Os animais falso-operados (FO) foram submetidos aos procedimentos descritos para isquemia, exceto a cauterização da artéria cerebral média (Figura 09).
Figura 09 - Cirurgia de indução isquêmica focal pelo método da Oclusão permanente da Artéria Cerebral Média (pMCAO): momento da aproximação do bisturi elétrico para coagulação da artéria cerebral média. Fonte: Laboratório de Neurociências e Comportamento - LNC.
4.5 Avaliação Neurológica (Garcia et al., 1995).
Para a avaliação sensório-motora foi realizada a avaliação neurológica 24 h após a indução isquêmica. Os achados neurológicos foram pontuados utilizando uma escala previamente descrita por Garcia et al. (1995) (Tabela 02).
Testes Escores
0 1 2 3
Atividade Espontânea
Animal sem movimento
Animal não se ergue e raramente se
movimenta
Animal se movimenta, mas não se aproxima de três lados da caixa
Animal se movimenta e se aproxima de três
lados da caixa Simetria do movimento das quatro patas Contra Lateral: sem movimento
Contra Lateral: raros movimentos
Contra Lateral: movimentos lentos
Ambos os lados: movem simetricamente Estiramento das patas dianteiras Contra Lateral: sem movimento
Contra Lateral: raros movimentos
Contra Lateral: movimentos lentos
Ambos os lados: movem simetricamente
Escalada/ Prensão
... Animal falhou em escalar e exibiu
movimentos circulares
Contra Lateral com dificuldade de subir e
agarrar a grade
Animal escalou normalmente e agarra a
grade
Propiocepção Corpórea
... Contra Lateral: sem resposta
Contra Lateral < Ipsilateral
Resposta Simétrica
Resposta ao toque da Vibrissa
... Contra Lateral: sem resposta
Contra Lateral < Ipsilateral
Resposta Simétrica
Os parâmetros avaliados foram: a atividade espontânea, que analisa a habilidade do animal de se aproximar das paredes de uma arena circular de polipropileno (30cm de diâmetro), explorando o ambiente; a simetria do movimento das quatro patas, que analisa se o animal ao ser segurado pela cauda e suspenso no ar possui simetria dos quatro membors; o estiramento das patas dianteiras, que avalia se o animal caminha sobre as patas dianteiras na borda de uma mesa; a escalada, que analisa a capacidade do animal de subir e agarrar firmemente uma grade de ferro ou de fazer movimentos circulares; a propriocepção corpórea na qual o animal é tocado com uma pinça em ambos os lados do corpo e sua reação é observada, que avalia a resposta sensorial; e a resposta ao toque da vibrissa, no qual a pinça toca as vibrissas em ambos os lados do animal-analisa a resposta sensorial.
4.6 Avaliação do Dano Cerebral
4.6.1. Avaliação da Área de Infarto Cerebral Isquêmico - Cloreto de 2,3,5-Trifeniltetrazol
(TTC) (BEDERSON, et al., 1986).
O TTC é um sal que ganha um próton da succinato desidrogenase na membrana interna mitocondrial. Neste processo, ele é reduzido para uma forma insolúvel, o formazam, fornecendo uma coloração avermelhada ao tecido composto por células viáveis. As células da região de infarto não possuem mitocôndrias viáveis, desta forma, o processo de redução não acontece, a coloração avermelhada não é gerada, permitindo a área de infarto ser caracteristicamente detectada por uma região pálida.
Vinte e quatro horas após a indução isquêmica os animais foram eutanasiados e seus cérebros foram removidos. Conservados em salina gelada até o momento dos cortes, os cérebros foram fatiados na espessura de 2 mm e imersos em solução de 2% de TTC à 37°C por 30 minutos. Em seguida, as fatias foram digitalizadas. As imagens foram analisadas a partir das áreas de infarto e das áreas totais das fatias, empregando-se cálculos das respectivas porcentagens. As extensões das áreas foram mensuradas utilizando o software Osíris TM (University of Geneva, Switzerland).
4.6.2 Avaliação da Viabilidade Celular
Neste estudo, a viabilidade celular foi analisada pela coloração de cresil-violeta. A coloração de cresil-violeta é utilizada para evidenciar os corpúsculos de Nissl presentes no citoplasma de neurônios viáveis (SCORZA et al., 2005). Cinco dias após à pMCAO, os animais (n=4/grupo), foram anestesiados com xilazina (10mg/kg) e ketamina (90mg/kg) por via intraperitoneal e perfundidos transcardialmente com salina, seguido por paraformaldeído a 4% em PBS. Os cérebros foram removidos e fixados com paraformaldeído a 4% durante 24 h e armazenados em sacarose a 30% (4ºC), até a realização dos cortes. Os cortes coronais do córtex e estriado foram feitos em um criostato (Leica CM3050 S, Heidelberg, Alemanha) a 21 ºC, e armazenados free floating em PBS (4ºC) numa série de “um em seis” de 50 μm (γ00 μm de intervalo).
100%). Em seguida, foram mergulhadas em xilol e montadas com entellan (Merck, Alemanha). As lâminas foram visualizadas em um microscópio (Nikon Elipse E200) com aumento de 40x. Foram selecionadas três fatias de cada animal, aleatoriamente, ao longo da área da lesão e a quantificação das células foi realizada utilizando o software ImageJ (NIH, Bethesda , MD, EUA) com um gride de 100.
As células foram consideradas cresil positivas quando apresentaram coloração violeta no citoplasma das células, bem como, aspectos morfológicos normais (células de forma redonda ou oval com núcleos centralizados). As células foram consideradas cresil negativas quando apresentaram ausência da coloração violeta associada a alterações morfológicas, caracterizados por núcleos celulares encolhidos, acompanhados por núcleos picnóticos. Os resultados foram expressos como percentual de células cresil positivas e negativas.
4.7Avaliação da Atividade Locomotora - Teste do Campo Aberto (Broadhurst, 1957).
Figura 10 – Arena do Campo Aberto (Fonte: LNC)
4.8. Avaliação Sobre a Memória
4.8.1. Avaliação da Memória de Trabalho - Teste do Labirinto em Y (Sarter et al., 1988). A memória operacional ou de trabalho foi avaliada através do teste do labirinto em Y. Nesse teste o animal é colocado em um labirinto em forma de Y com os três braços iguais (Sarter et al., 1988). Os animais apresentam forte tendência de alternar a entrada nos diferentes ambientes. O labirinto em Y é composto por 3 braços de madeira com 16 cm de altura, 5 cm de largura e 40 cm de comprimento (Figura 11).
Figura 11 - Labirinto em Y (Fonte: LNC)
repetição. O resultado foi expresso em porcentagem e obtido através da seguinte fórmula matemática:
O sucesso do teste é indicado pela alta taxa de alternância nos grupos controle, indicando que os animais podem se lembrar em qual braço eles entraram por último (Stone et al., 1991). Entre cada sessão, o labirinto foi higienizado com uma solução de álcool a 20% e secado com toalhas de papel.
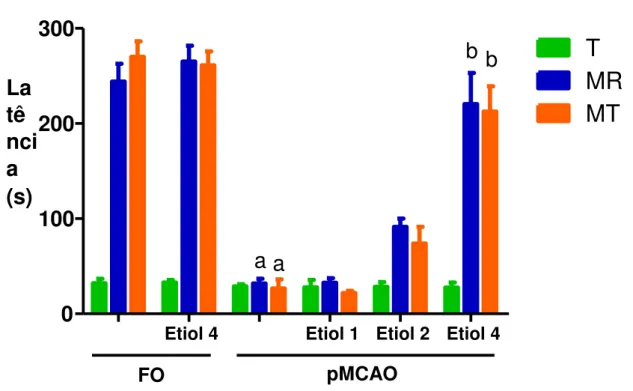
4.8.2. Avaliação da Memória Aversiva – Teste da Esquiva Passiva (Gold, 1986).
O teste de esquiva passiva envolve a tendência natural do animal de explorar além da plataforma e envolve o aprendizado de evitar o choque, um componente aversivo que constitui uma resposta condicionada.
O aparelho consiste de uma caixa de acrílico (48 x 22 x 22), com o piso constituído por uma plataforma e uma grade eletrificada (Figura 12). O animal foi colocado na plataforma e deixado para ambientação no aparelho durante um 1 minuto, e depois retirado. Após 30 segundos, o animal foi colocado novamente na plataforma. O animal ao descer da plataforma recebeu um choque de 0,5 mA, durante 1 segundo, com o tempo de latência para entrar sendo registrado, até um máximo de 5 minutos (treino). Retirou-se o animal e após 15 minutos este foi colocado novamente na plataforma e registrou-se a latência de descida (avaliação da memória recente). A retenção do aprendizado (avaliação da memória tardia) foi testada após 24 h, quando o animal foi colocado na plataforma e o tempo de latência para a descida da plataforma foi registrada, nessa etapa o animal não recebeu o choque.