Universidade Federal do Ceará
Centro de Ciências Agrárias
Departamento de Tecnologia de Alimentos
Curso de Pós-Graduação em Ciência e Tecnologia de Alimentos
Isabel Moreira da Silva
SUCO DE CAJU CONTENDO OLIGOSSACARÍDEOS PREBIÓTICOS
UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE TECNOLOGIA DE ALIMENTOS
CURSO DE PÓS- GRADUAÇÃO EM CIÊNCIA E TECNOLOGIA DE
ALIMENTOS
ISABEL MOREIRA DA SILVA
SUCO DE CAJU CONTENDO OLIGOSSACARÍDEOS PREBIÓTICOS
ISABEL MOREIRA DA SILVA
SUCO DE CAJU CONTENDO OLIGOSSACARÍDEOS PREBIÓTICOS
Dissertação submetida à Coordenação do Curso de Pós-graduação em Ciência e Tecnologia de Alimentos, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Ciência e Tecnologia de Alimentos.
Orientadora: Profa. Dra. Sueli Rodrigues
S578s Silva, Isabel Moreira da
Suco de caju contendo oligossacarídeos prebióticos / Isabel Moreira da Silva. -- Fortaleza, 2010.
61 f. ; il. color. enc.
Orientadora: Profa. Dra. Sueli Rodrigues
Área de concentração: Ciência e Tecnologia de Alimentos
Dissertação (Mestrado) - Universidade Federal do Ceará, Centro de Ciências Agrárias, Depto. de Tecnologia de Alimentos, Fortaleza, 2010.
Dissertação submetida à Coordenação do Curso de Pós-graduação em Ciência e Tecnologia de Alimentos, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Ciência e Tecnologia de Alimentos.
A citação de qualquer trecho desta Dissertação é permitida, desde que seja feita de conformidade com as normas da ética científica.
Isabel Moreira da Silva
Dissertação aprovada em 29 de Junho de 2010.
BANCA EXAMINADORA
Profa. Dra. Sueli Rodrigues (Orientadora) Universidade Federal do Ceará - UFC
Prof. Dr. José Maria Correia da Costa
Universidade Federal do Ceará - UFC
Profa. Dra. Andrea Lopes de Oliveira Ferreira
AGRADECIMENTOS
Agradeço a Deus por estar sempre presente, me protegendo e abençoando, em todos os momentos de minha vida.
Aos meus pais, Núbia e Odemilton, pelo amor, companheirismo, e pelo apoio nos momentos mais difíceis.
Ao Wagner, pelo amor, compreensão e dedicação constante.
Ao meu irmão, Israel, pelo companheirismo e incentivo.
Ao meu afilhado, Miquéias, pela ajuda e compreensão.
Às minhas tias, Elizabete, Helena, Neide, Odinilda e Oliene, pelo carinho, valiosos ensinamentos e incentivo.
Ao Sr. João Leite e D. Rosa pela apoio e grande ajuda.
À todos os meus familiares, que torcem pelo meu sucesso e que muito contribuíram para essa realização.
À minha orientadora professora Dra. Sueli Rodrigues, pelo apoio, dedicação, confiança, e ensinamentos de grande valor a quem tenho como exemplo de profissional
Aos professores Dr. José Maria Correia da Costa e Dra. Andrea Lopes de Oliveira Ferreira que gentilmente aceitaram o convite de participar desta banca de defesa de dissertação, contribuindo assim, para o enriquecimento deste trabalho.
Aos atuais e antigos membros do Laboratório de Biotecnologia: Alexandre, Ana Laura, Claudinha, Cris, Imilena, jamile, Jéssica, Jonas, Luiz Carlos, Mayra, Mariana, Simone, Soraya, Tiago, Tati Maciel, Tati Nunes e Tati Vidal pela amizade e momentos de descontração.
À Cristiane Rabelo, minha eterna gratidão pela amizade, paciência, ensinamentos e valiosa colaboração na realização dos experimentos.
Aos colegas da turma de mestrado: Suelane, Ana Valquiria, Simone, Alais, Giovana, Cristiane, Priscila, Rafaela, Carlos Eliardo, Geirla, Edna, Ana Cristina.
A todos os professores do Departamento de Tecnologia de Alimentos, pelos ensinamentos, colaboração e amizade durante o curso de Mestrado e graduação.
Ao secretário do curso de Mestrado, Paulo Mendes, por sua dedicação e ajuda no decorrer do curso.
Ao CNPq, pela concessão da bolsa de estudo durante todo o curso e pelo apoio financeiro.
À Embrapa Agroindústria Tropical pelo fornecimento do suco de caju utilizado neste experimento
“Em tempo de paz convém ao homem serenidade e humildade; mas quando estoura a guerra deve agir como um tigre!”
RESUMO
Os alimentos funcionais constituem hoje prioridade em pesquisas devido a crescente busca dos consumidores por alimentos que além da função básica de nutrir possam trazer outros benefícios. Dessa forma, estudos para o desenvolvimento de prebióticos tornam-se interessantes. A enzima dextrana-sacarase quando em meio contendo sacarose e um aceptor como substrato produz oligossacarídeos prebióticos. O suco de caju funciona como fonte de aceptores, uma vez que é rico em glicose e frutose. A produção da enzima dextrana-sacarase
pode ser realizada via processo fermentativo através da inoculação da bactéria Leuconostoc
mesenteroides NRRL B512F ao meio de cultura contendo sacarose. Dessa forma o objetivo desse trabalho foi a produção de oligossacarídeos prebióticos via processo enzimático com adição da enzima dextrana–sacarase ao suco de caju clarificado. Com base nos resultados obtidos, pode-se concluir que o suco de caju clarificado pode ser empregado como uma alternativa de substrato de baixo custo para a síntese de oligossacarídeos prebióticos, por via enzimática utilizando a enzima dextrana-sacarase. O rendimento em dextrana foi favorecido pela combinação de baixas concentrações de sacarose e açúcares redutores. A formação de oligossacarídeos foi favorecida pelo aumento da concentração dos açúcares redutores e pela combinação de elevadas concentrações de sacarose e açúcares redutores. Neste trabalho a maior concentração de oligossacarídeos obtida foi de 104,73 g/L utilizando-se 75 g/L de sacarose em combinação com 75 g/L de açucares redutores e por fim a análise qualitativa mostrou que em concentrações de 25 g/l e 75 g/l de sacarose e açúcar redutor, respectivamente foi possível obter oligossacarídeos de grau de polimerização até 12.
PALAVRAS-CHAVE: Dextrana-sacarase, Leuconostoc mesenteroides B512, pedúnculo de
ABSTRACT
Functional foods are now a research priority due to growing demand for foods that, besides the basic function of nurture, can bring benefits. Thus, studies for the development of prebiotics become interesting. The enzyme dextransucrase in a medium containing sucrose and an acceptor as substract synthesizes prebiotics oligosaccharides. The cashew apple juice works as a source of acceptors, since it is rich in glucose and fructose. The production of dextransucrase enzyme can be accomplished by fermentative process by inoculating the
bacterium Leuconostoc mesenteroides NRRL B512F into a culture medium containing
sucrose.Thus the aim of this work was the production of prebiotic oligosaccharides by enzymatic process with addition of the dextransucrase enzyme to the clarified cashew apple juice. Based on the results we can conclude that the clarified cashew apple juice can be used as low cost alternative substrate for the synthesis of prebiotic oligosaccharides through enzyme synthesis using the dextransucrase enzyme. Dextran yeld was favored by the combination of low concentrations of sucrose and reducing sugars. The formation of oligosaccharides was favored by increasing the concentration of reducing sugars and by the combination of high concentrations of sucrose and reducing sugars, where the largest concentration of oligosaccharides obtained was 104.73 g/L using 75g/L sucrose in combination with 75g/L of reducing sugars and finally the qualitative analysis shows that at concentrations of 25 g/L and 75g/L sucrose and reducing sugar, respectively, is possible to obtain oligosaccharides of degree of polymerization up to 12.
LISTA DE TABELAS
Tabela Página
1 Oligossacarídeos prebióticos comercialmente disponíveis. . . 20
2 Meio padrão otimizado. . . 31
3 Planejamento experimental para a síntese enzimática dos
oligossacarídeos prebióticos no suco de caju . . . 35
4 Planejamento experimental e resultado obtido em dextrana no
suco de caju . . . 42 5 Efeitos estimados do rendimento em dextrana. . . 43
6 Análise de variância para o rendimento em dextrana no suco de
caju. . . 44
7 Planejamento experimental e resultados obtidos de concentração
de oligossacarídeos prebióticos e rendimentos em oligossacarídeos. . . .
45
8 Efeitos estimados de concentração de oligossacarídeos. . . 46
9 Análise de variância para concentração de oligossacarídeos no
LISTA DE FIGURAS
Figura Página
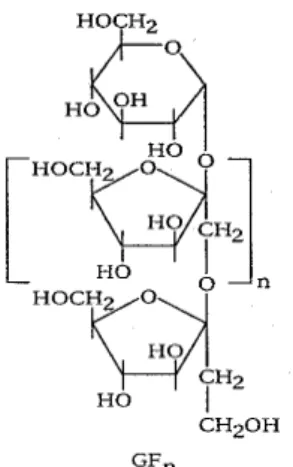
1 Estrutura química dos principais frutooligossacarídeos. . . 22
2 Fórmula estrutural da inulina. . . 23
3 Rendimento em dextrana em função da concentração de sacarose
e açúcares redutores. . . 44
4 Oligossacarídeos prebióticos obtidos em função da concentração
de sacarose e açúcares redutores. . . 47
5 Oligossacarídeos detectados através de cromatografia de camada
SUMÁRIO
1 INTRODUÇÃO. . . 15
2 REVISÃO DA LITERATURA. . . . 18
2.1 Alimentos funcionais. . . . . . . 18
2.2 Oligossacarídeos prebióticos . . . . 19
2.3 Tipos de oligossacarídeos prebióticos. . . . 20
2.3.1 Frutooligossacarídeo (FOS) . . . 21
2.3.2 Inulina. . . 23
2.4 Propriedades funcionais e aplicações tecnológicas. . . 24
2.5 Dextrana-sacarase.. . . . 26
2.6 Mecanismo de síntese de oligossacarídeos prebióticos. . . 26
2.7 Leuconostoc mesenteroides B-512F. . . 27
2.8 Caju . . . . 28
2.9 Suco de caju. . . 28
2.10 Aspectos da produção e economia. . . . 29
2.11 Utilização do suco de caju como substrato em processos biotecnólogicos. . . . . . 30
3 MATERIAL E MÉTODOS . . . 31
3.1 Obtenção do microrganismo . . . 31
3.2 Ativação do Leuconostoc mesenteroides B512 F liofilizado . . . 31
3.3 Ativação do microrganismo congelado. . . 32
3.4 Produção da enzima dextrana-sacarase. . . 32
3.5 Purificação parcial da enzima. . . . 33
3.6 Obtenção do suco de caju. . . . 33
3.7 Caracterização físico-química do suco de caju clarificado. . . . 34
3.8 Síntese enzimática dos oligossacarídeos prebióticos. . . 34
3.9 Métodos Analíticos . . . 36
3.9.1 pH . . . 36
3.9.2 Determinação de açúcares redutores . . . 36
3.9.3 Determinação do crescimento microbiano. . . 37
3.9.4 Determinação da Dextrana .. . . 37
3.9.5 Determinação da atividade enzimática . .. . . 38
3.9.6 Detecção de oligossacarídeos através de cromatografia de camada delgada (CCD). . . . . 39
3.9.7 Determinação de açucares residuais através de cromatografia líquida de alta eficiência. . . 40
3.9.8 Análise dos dados. . . 41
4. RESULTADOS E DISCUSSÃO . . . . 42
4.1 Caracterização do suco de caju. . . 42
4.2 Síntese enzimática de oligossacarídeos prebióticos . . . 42
5. CONCLUSÕES . . . 50
6. REFERÊNCIAS BIBLIOGRÁFICAS. . . 51
1. INTRODUÇÃO
Os alimentos funcionais constituem hoje a prioridade de pesquisa na área de nutrição e tecnologia de alimentos. Levando-se em conta o interesse do consumidor em alimentos mais saudáveis, os alimentos funcionais além de nutrir devem modelar o sistema fisiológico do organismo (BORTOLOZO E QUADROS, 2007). Com relação à interferência dos alimentos funcionais na flora intestinal, estes podem ser divididos em três grupos: probióticos, simbióticos e prebióticos (GIBSON, 1999; HUTCHENSO, 1987).
Os Probióticos são definidos como microrganismos viáveis que afetam beneficamente
a saúde do hospedeiro por promoverem balanço da microbiota intestinal, sendo Lactobacillus
e Bifidobacterium as espécies mais utilizadas como probióticos (FULLER, 1989).
O termo prebiótico é definido como um ingrediente alimentar não digerível pela maioria dos microrganismos do intestino, e que afeta beneficamente o hospedeiro, pelo estímulo seletivo do crescimento e/ou atividade de apenas um ou de um número limitado de bactérias no cólon (GIBSON & ROBERFROID, 1995). Alguns carboidratos têm sido denominados prebióticos por não serem metabolizados no estômago e no intestino delgado, sendo capazes de chegar ao intestino grosso (CHUNG e DAY, 2004). Um produto denominado simbiótico é aquele em que há a combinação de um probiótico e um prebiótico.
Uma das formas de obtenção de oligossacarídeos prebióticos é por via enzimática utilizando a enzima dextrana- sacarase. Essa enzima catalisa a formação de dextrana quando em meio contendo sacarose como único substrato. Entretanto, quando em meio contendo um aceptor (maltose, frutose, glicose, etc) como substrato predominante e sacarose como segundo substrato, a enzima produz oligossacarídeos prebióticos (RODRIGUES et al., 2005; RABELO et al., 2006). Esta reação secundária é denominada reação do aceptor.
A reação do aceptor consiste em adições de unidades de glicose provenientes da sacarose ligadas ao aceptor (glicose, frutose, maltose, etc). À medida que unidades de glicose são incorporadas na cadeia vão sendo formadas séries homólogas. Para esta reação são conhecidas séries homológas contendo até 10 unidades de glicose, sendo incorporadas a este carboidrato através da síntese enzimática (ligação glicosídica -1,6). Estes oligossacarídeos, embora apresentem aplicações técnicas relevantes, são considerados de difícil síntese (HEINKE et al., 1999; RABELO et al., 2006, RODRIGUES et al., 2006).
A produção da enzima que catalisa a síntese desse oligossacarídeos pode ser realizada
via processo fermentativo através da inoculação da bactéria Leuconostoc mesenteroides NRRL
B512F ao meio de cultura contendo sacarose. O suco de caju funciona como fonte de aceptores, uma vez que é rico em glicose e frutose. Além disso, a utilização de substratos regionais como o suco de caju visa o aproveitamento de matérias-primas regionais agrícolas. O caju é composto por 10% de amêndoa e 90% de pedúnculo. Dessas duas partes, o pedúnculo apresenta o menor aproveitamento (LIMA, 2008). O produto de maior expressão econômica é a amêndoa, sendo tipicamente um produto de exportação, enquanto os produtos obtidos a partir do processamento do pedúnculo destinam-se basicamente ao mercado interno (CHAGAS 2007; RABELO 2008). Além disso, a utilização de suco de caju, como substrato na síntese enzimática de oligossacarídeos prebióticos, torna-se interessante por tratar-se de uma matéria-prima de baixo custo para uso como substrato em processos fermentativos, uma vez que não requer nenhum tratamento prévio como hidrólise ou tratamento enzimático,
2 REVISÃO DA LITERATURA
2.1 Alimentos funcionais
Nos seus primórdios, a ciência de alimentos preocupava-se somente em desenvolver alimentos para a sobrevivência humana, em seguida, esse conceito foi subtituído pelo conceito de produzi-lo com qualidade. Mais recentemente, a idéia passou a ser usá-los como veículos de promoção de bem-estar e saúde, ao mesmo tempo reduzindo o risco de doenças (MATSUBARA, 2001). Daí a importãncia de desenvolver novos estudos envolvendo alimentos funcionais.
Alimento funcional é qualquer alimento, natural ou preparado, que contenha uma ou mais substâncias, classificadas como nutrientes ou não nutrientes, que seja capaz de atuar no metabolismo e na fisiologia humana, promovendo efeitos benéficos para a saúde, podendo retardar o estabelecimento de doenças crônico-degenerativas e melhorar a qualidade e a expectativa de vida das pessoas (SGARBIERI e PACHECO, 1999).
A definição legal de alimento funcional é todo alimento ou ingrediente que, além das funções nutricionais básicas, quando consumido como parte da dieta usual, produz efeitos metabólitos e/ou fisiológico e/ou efeitos benéficos à saúde, devendo ser seguro para consumo sem supervisão médica (BRASIL, 1999 a).
A regulamentação sobre alimentos funcionais no Brasil é feita pela Agência Nacional de Vigilância Sanitária (ANVISA), que publicou em 30 de abril de 1999 três resoluções relacionadas ao tema. A resolução n° 17 aprova as diretrizes básicas para a avaliação de risco e segurança dos alimentos; a resolução n° 18 aprova as diretrizes básicas para análise e comprovação de propriedades funcionais e/ou de saúde alegadas em rotulagem de alimentos e a resolução n° 19 aprova procedimentos para registro de alimentos com alegação de propriedades funcionais e ou saúde em sua rotulagem (BRASIL, 1999 b; BRASIL, 1999 c; BRASIL,1999 d; VERGARA, 2007).
fitostanóis, ácidos graxos (ômega 3 e ômega 6), prebióticos e probióticos (BELLO, 1995; TORRES, 2001).
Um alimento funcional é similar em aparência a um alimento convencional, no entanto, foi modificado com ingredientes que fornecem efeitos adicionais à saúde. Na busca por novos alimentos funcionais, os prebióticos têm sido estudados como ingredientes em vários alimentos, entre eles bebidas lácteas funcionais ou simbióticas (SILVA e STAMFORD, 2000).
2.2 Oligossacarídeos prebióticos
Entre os prebióticos são conhecidos alguns carboidratos, peptídeos, proteínas e lipídeos. Entretanto, os carboidratos denominados de oligossacarídeos – cadeias curtas de polissacarídeos – são os que mais se enquadram na definição e nas características dos prebióticos. “Os mananoligossacarídeos (MOS) e os frutoligossacarídeos (FOS) são os dois
grupos mais utilizados, para algumas espécies deLactobacillus e Bifidobacterium” (HIDAKA
et al., 1986).
São considerados prebióticos os oligossacarídeos resistentes, ou seja, carboidratos complexos de configuração molecular que os tornam resistentes à ação hidrolítica da enzima salivar e intestinal, atingindo o cólon intactos, com efeitos sobre a microbiota colônica, uma vez que ao chegarem ao intestino grosso são metabolizados pelas bifidobactérias e lactobacilos ali presentes, estimulando o seu crescimento (BORGES, 2002; FAGUNDES e COSTA, 2003; CHUNG e DAY, 2004). Os oligossacarídeos são utilizados como novos ingredientes funcionais dos alimentos apresentando grande potencial para melhorar a qualidade de muitos alimentos (MAKINO, 2004).
Os prebióticos não somente proporcionam aumento potencial do número de bactérias benéficas no intestino grosso de humanos, predominantemente os lactobacilos e as bifidobactérias, mas também aumentam sua atividade metabólica através do fornecimento de substrato fermentável (BIELECKA et al., 2002).
2.3 Tipos de oligossacarídeos prebióticos
Oligossacarídeos de vários tipos são encontrados como componentes naturais de frutas, vegetais, leite e mel. Muitos destes compostos têm propriedades bifidogênicas. Os
oligossacarídeos produzidos são maltooligossacarídeos, xilooligossacarídeos,
gentiooligossacarídeos, soja-oligossacarídeos, palatinose, lactosacarose, glicosil sacarose e ciclodextrina (MAKINO, 2004). A Tabela 1 apresenta os oligossacarídeos com efeitos bifidogênicos que são produzidos comercialmente.
Tabela 1 - Oligossacarídeos prebióticos comercialmente disponíveis (MUSSATTO e MANCILHA, 2007)
Composto Estrutura Molecular a
Ciclodextrinas (Glu)n
Frutooligossacarídeos (Fru)n–Glu
Galactooligossacarídeos (Ga)n–Glu
Gentiooligossacarídeos (Glu)n
Glicosilsacarose (Glu)n–Fru
Isomaltooligossacarídeos (Glu)n
Isomaltulose (ou paliatinose) (Glu–Fru)n
Lactusacarose Ga–Glu–Fru
Lactulose Ga–Fru
Maltooligossacarídeos (Glu)n
Rafinose Ga–Glu–Fru
Oligossacarídeos de soja (Ga)n–Glu–Fru
Xilooligossacarídeos (Xil)n
A maioria dos oligossacarídeos prebióticos estudados atualmente são produtos comerciais obtidos por hidrólise parcial, ácida ou enzimática, de polissacarídeos ou por reações de transglicosilação (SILVA e NÖRNBERG, 2003).
Os oligossacarídeos prebióticos são encontrados naturalmente em vegetais como alcachofra, raiz de chicória, cebola, alho, banana, aspargo, trigo, centeio e cevada. No entanto, as concentrações presentes são baixas, exigindo consumo extremamente elevado para obtenção dos efeitos fisiológicos desejados (PIMENTEL, et al., 2005).
Dentre os oligossacarídeos utilizados comercialmente, destacam-se os frutooligossacarÌdeos (FOS), que são importantes principalmente por suas propriedades funcionais, mais do que pela sua doçura (PASSOS e PARK, 2006). As diferenças químicas entre estes oligossacarídeos são o comprimento da cadeia, a composição de monossacarídeos, o grau de ramificação e a pureza (MUSSATTO e MANCILHA, 2007).
Os prebióticos abrangem as frutanas, que incluem a inulina natural, inulina hidrolisada enzimaticamente ou oligofrutose e frutooligossacarídeos sintéticos, além de
galactoligossacarídeos, lactulose, isomaltoligossacarídeo, xiloligossacarídeos,
gentioligossacarídeos (GIBSON e FULLER , 2000).
2.3.1 Frutooligossacarídeo (FOS)
Entre os oligossacarídeos de ocorrência natural, os frutooligossacarídeos (FOS) são os principais compostos reconhecidos e utilizados em alimentos aos quais atribuem-se propriedades prebióticas (NITSCHKE, 2002). Dependendo do comprimento da cadeia, definida pelo número de unidades de monossacarídeos e também chamada grau de polimerização (DP), os FOS podem ser chamados de oligofrutoses (DP < 10, DP média = 4,8) ou inulina (DP entre 2 - 60, média = 12) (GIBSON & ROBERFROID, 1995; NINESS, 1999).
cebola, alho e banana. São chamados açúcares não convencionais e têm tido impacto na indústria do açúcar devido às suas excelentes características funcionais em alimentos, além de seus aspectos fisiológicos e físicos (PASSOS e PARK, 2003).
Os frutooligossacarídeos são os principais oligossacarídeos da classe dos bifidogênicos, açúcares formados de 1 a 3 moléculas de frutose ligadas a uma molécula de sacarose na posição β(1-2) e as estruturas químicas estão apresentadas na Figura 1. Apresentam propriedades físicas e fisiológicas que os tornam compostos de grande potencial de aplicação em alimentos para nutrição humana e animal. São açúcares não digeridos pelo organismo humano, passam através do intestino delgado sem serem absorvidos e vão direto para o intestino grosso, onde são seletivamente utilizados pelas bifidobactérias na microflora intestinal (MITSOUKA, 1990).
Figura 1 - Estrutura química dos principais frutooligossacarídeos (A)1- Kestose, (B) Nistose e (C) Frutofuranosil.
Fonte: PASSOS e PARK (2003).
2.3.2 Inulina
A inulina (Figura 2) é uma fibra solúvel, considerada um ingrediente prebiótico. Comumente extraída da raiz da chicória, oferece uma gama de benefícios nutricionais e tecnológicos. Pode trazer benefícios para o sistema digestivo, pois a ingestão de ingredientes prebióticos melhora o equilíbrio da nossa microflora intestinal, aumentando significativamente a quantidade de bifidobactérias benéficas, inibindo os patógenos. O resultado disso é que o sistema digestivo trabalha melhor, aumentando a absorção dos nutrientes dos alimentos ingeridos.
As diferenças no tamanho das cadeias da inulina e das oligofrutoses são também responsáveis pelas diferenças entre suas propriedades. Devido às cadeias mais longas, a inulina é menos solúvel que as oligofrutoses e possui capacidade de formar micro cristais quando misturada com água e leite. Estes micro cristais interagem para formar uma mistura cremosa e macia, promovendo a sensação de presença de gordura. (BORTOLOZO e QUADROS, 2007).
Figura 2- Fórmula estrutural da inulina Fonte: Roberfroid, 1993
significativo incremento dos benefícios das bifidobactérias. A flora bifidus estimula o sistema imunológico, a absorção de minerais, e inibe o crescimento de bactérias nocivas ao organismo (ROBERFROID, VAN LOO & GIBSON, 1998).
A inulina é adicionada em barras de cereais, biscoitos, bolos e cereais matinais para aumentar o teor de fibra dietética e na formulação de alimentos prebióticos como bebidas lácticas funcionais ou simbióticas no caso de iogurtes (NITSCHKE, 2002).
Além das frutas e hortaliças, muitos cereais também contêm inulina. Entre eles estão o trigo, a cevada, o centeio, com concentrações variando entre 1-4% (NILSSON e DAHLQUIST, 1986). A inulina é extraída da raiz da chicória ou produzida a partir da sacarose através da reação enzimática com a frutose catalisada pela enzima frutosetransferase.
2.4 Propriedades funcionais e aplicações tecnológicas
A funcionalidade dos alimentos prebióticos está relacionada a uma atuação direta com: aumento do tempo de esvaziamento do estômago; modulação no trânsito do trato gastrointestinal (GOT); diminuição de colesterol via adsorção de ácidos biliares e por meio de atuação indireta, modulando a fermentação microbiana pelo estímulo de bactérias bífidas responsáveis por aumento de SCFA (ácidos graxos de cadeia curta), diminuição de pH e diminuição na absorção da amônia (FERREIRA, 2000).
A fermentação dos prebióticos no intestino leva à produção de ácidos graxos de cadeia curta – AGCC (acetato, propianato e butirato) que são totalmente absorvidos pelo trato intestinal. Os AGCC têm um efeito sistêmico no metabolismo da glicose e dos lipídeos causando diminuição da glicemia posprandial e reduzindo a concentração de triglicerídeos e colesterol sanguíneos (PIMENTEL, FRANCKI e GOELIICKE, 2005), e conseqüentemente uma redução do risco de arteriosclerose (KAUR e GUPTA, 2002).
controlando a secagem excessiva e a baixa atividade de água o que favorece o controle microbiológico (RABELO, 2008).
Testes mostraram que o aumento da ingestão de ingredientes prebióticos em apenas 5 g por dia pode melhorar o equilíbrio de nossa microflora intestinal, aumentando significativamente a quantidade de bifidobactérias benéficas, inibindo os patógenos. O resultado é que o nosso sistema digestivo trabalha melhor, e pode absorver os nutrientes do alimentos de forma mais adequada. (BONDT, 2003).
Estudos “in vitro” têm indicado que a inulina e as oligofrutoses apresentam as características de prebiótico desenvolvendo fermentação específica e melhorando a microbiota intestinal (HIDAKA et al.,1986, WANG e GIBSON, 1993). Isso também tem sido confirmado em ensaios com voluntários humanos, que apresentaram efeitos bifidogênicos para inulina e oligofrutoses “in vivo” (GIBSON, 1999; BUDDINGTON et al., 1996).
O equilíbrio produzido na microbiota gastrointestinal pelo consumo de frutooligossacarídeos estimula outros benefícios no metabolismo humano, como a redução da pressão sanguínea em pessoas hipertensas, redução da absorção de carboidratos e lipídeos, normalizando a pressão sanguínea e lipídeos séricos e melhoria do metabolismo de diabéticos. Ainda pode-se observar um aumento da digestão e metabolismo da lactose, aumento de reciclagem de compostos como o estrógeno, aumento da síntese de vitaminas (principalmente do grupo B), aumento da produção de compostos imuno estimulantes, que possuem atividade antitumoral, diminuição da produção de toxinas e compostos carcinogênicos e auxílio da restauração da flora intestinal normal durante terapia com antibióticos (YAMASHITA et al.,1984, SPIEGEL et al., 1994).
As frutanas não são cariogênicas, uma vez que não são utilizadas como substrato de
oligofrutose também é utilizada para conferir consistência a produtos lácteos, maciez a produtos de panificação, diminuir o ponto de congelamento de sobremesas congeladas, conferir crocância a biscoitos com baixo teor de gordura e, além disso, também atua como ligante em barras de cereais (SAAD, 2006).
Devido as suas características físico-químicas e bioquímicas, os oligossacarídeos têm encontrado aplicação na indústria de alimentos, em produtos utilizados para alimentação humana (bebidas, adoçantes, leite em pó infantil) e animal (ração), assim como aplicação em cosméticos, produtos farmacêuticos e produtos para diabéticos (PLAYNE e CRITTENDEN, 1996).
2.5 Dextrana-sacarase
A enzima dextrana-sacarase (1,6-α-D-glucan-6-α-glucanosil transferase, EC. 2.4.1.5) é
geralmente obtida à partir do microrganismo Leuconostoc mesenteroides NRRL B512F via
processo fermentativo. Trata-se de uma enzima indutiva, cujo único indutor conhecido é a sacarose, a qual é utilizada como fonte de carbono (RODRIGUES, 2003).
A frutose é um produto natural liberado quando a enzima polimeriza a glicose obtida da sacarose em dextrana. A mesma enzima é também responsável pela síntese de oligossacarídeos prebióticos a partir da reação com o aceptor (MONSAN e PAUL, 1995; MONCHOIS, WILLEMONT e MONSAN, 1999). A produção de dextrana-sacarase é afetada por vários fatores, como temperatura, pH, aeração e concentração do substrato (CORTEZI, MONTI e CONTIERO, 2005).
2.6 Mecanismos de síntese de oligossacarídeos prebióticos
formando oligossacarídeos de interesse técnico. Esta reação secundária é denominada reação do aceptor.
No mecanismo aceptor da dextrana-sacarase, a sacarose é usada como substrato, onde o grupo glicosil é transferido por transglicosilação e o aceptor e a frutose são formados como produtos. A dextrana é formada em maior ou menor quantidade dependendo do aceptor e das condições da reação (DEMUTH et al., 2002). Conforme reações a seguir:
Sacarose + aceptor dextrana-sacarase oligossacarídeos prebióticos + frutose
Sacarose dextrana-sacarase Dextrana + frutose
O ajuste da proporção aceptor/sacarose permite a supressão da síntese de dextrana e a maximização da produção de oligossacarídeos (RODRIGUES at al., 2004; RABELO et al., 2006). Quando glicose ou frutose são utilizadas como aceptores há formação de gluco-oligossacarídeos e leucrose, respectivamente, que estimulam o crescimento de bifidobactérias e lactobacilos inibindo o crescimento de microrganismos daninhos (VERGARA, 2007).
Os oligossacarídeos formados pela reação do aceptor não são fermentáveis pela flora oral humana. Além disso, há estudos indicando que estes oligossacarídeos estimulam o
desenvolvimento de bidifidobactérias e lactobacillus no intestino humano (MACHIDA et al.,
1986). As quais são benéficas ao trato digestivo sem estimular o desenvolvimento de microrganismos indesejáveis (RODRIGUES, 2003). Estes oligossacarídeos, embora apresentem aplicações técnicas relevantes, são considerados de difícil síntese (HEINKE et.
al., 1999; RABELO et al., 2006, RODRIGUES et al., 2006).
2.7 Leuconostoc mesenteroides B-512F
(Mg+2 e Mn+2), vitaminas, em especial do complexo B e aminoácidos para seu ótimo crescimento (GAO et al., 2006). O crescimento celular é realizado em meio tamponado, sendo 7 o pH ótimo para esta etapa. Já o pH ótimo para a produção enzimática se encontra na faixa de 6,0 a 6,9, enquanto que o pH ótimo para a reação enzimática é de 5,2 (RODRIGUES, 2003; VERGARA, 2007).
2.8 Caju
O cajueiro é uma planta rústica, originária do Brasil, sendo típica de regiões de clima tropical. Na Amazônia tropical, as árvores apresentam porte bastante elevado; nos Estados do Nordeste brasileiro, a principal espécie de ocorrência é o Anacadium occidentale L., cujas árvores apresentam pequeno e médio porte, sendo a única espécie do gênero que é cultivada com finalidade comercial, enquanto que as demais espécies são exploradas apenas por extrativismo (SANCHO, 2006;).
O caju compõe-se da castanha – o verdadeiro fruto – e de um pedúnculo hipertrofiado. A castanha, verdadeiro fruto do cajueiro, é um aquênio reniforme (3 g a 32 g), com tegumento liso, coriáceo, cinzento ou verde acinzentado; o mesocarpo é espesso, alveolado, cheio de um líquido viscoso, vermelho, acre, cáustico e inflamável, comumente chamado LCC (líquido da casca da castanha). A ela está associado grande valor comercial tanto no Brasil como no exterior, constitui-se no principal produto de utilização do cajueiro (MENEZES e ALVES, 1995).
É a castanha de caju que apresenta grande valor comercial tanto no Brasil como no exterior, desta forma, o pseudofruto ou pedúnculo acaba por ser subutilizado. Este, que apresenta cerca de 10 vezes o peso da castanha, representa uma quantidade enorme de matéria prima perdida anualmente, valores que chegam a quase um milhão de toneladas anuais no Estado do Ceará, que detém 54,4 % de quase um milhão de hectares plantados no país com esse tipo de lavoura (SANCHO, 2006).
2.9 Suco de caju
clarificado é definido como a bebida não fermentada e não diluída, obtida da parte comestível do pedúnculo do caju (Anacardium occidentalis, L.). O suco deve apresentar características de odor e sabor próprios da fruta e a coloração variando da cor branca à amarelada. (BRASIL, 2000).
O suco de caju clarificado é rico em glicose e frutose e, dessa forma, funciona como fonte de aceptores (frutose e glicose) para a síntese de oligossacarídeos prebióticos
(HONORATO et al.,2006). Segundo Honorato e Rodrigues (2010) a enzima
dextrana-sacarase apresentou estabilidade por um período mais prolongado no suco de caju do que no meio sintético, além de apresentar uma atividade relativa mais elevada.
2.10 Aspectos da produção e economia
Em virtude da crescente demanda, esforços para a diminuição do custo de processos produtivos tem sido alvo recente de estudos. A utilização de substratos de origem agropecuária tais como: amido, melaço de cana, xarope de abacaxi e suco de uva tem sido estudada como uma forma de redução de custos e, portanto, aumento da competitividade no mercado mundial. Neste contexto, o uso de matérias-primas agrícolas regionais como substrato de baixo custo para o desenvolvimento de processos fermentativos é uma alternativa interessante. O caju possui pedúnculo que é desperdiçado, pois o maior valor dessa cultura está associado à amêndoa da castanha. O processamento do pedúnculo possui segmentos em vários setores industriais, como bebidas, doces, farinhas, condimentos e ração animal. O produto de maior expressão econômica é a amêndoa, sendo tipicamente um produto de exportação, enquanto os produtos obtidos a partir do processamento do pedúnculo destinam-se basicamente ao mercado interno (LEITE, 1994; FONTES, 2009).
toneladas provenientes do Ceará representando 73,4% das exportações de castanha de caju (SINDICAJU, 2009).
É a castanha de caju que representa grande valor comercial tanto no Brasil como no exterior, desta forma, o pseudofruto ou pedúnculo acaba por ser subutilizado. Este, que apresenta cerca de 10 vezes o peso da castanha, representa uma quantidade enorme de matéria prima perdida anualmente. Valores esses, que chegam a quase um milhão de toneladas anuais no estado do Ceará (SANCHO, 2006). Estima-se que o aproveitamento do pedúnculo para industrialização seja inferior a 12% da produção (LIMA, 2008). Dentre os fatores de influência estão a alta perecibilidade do pedúnculo do caju, associada ao curto período da safra e a inexistência de métodos econômicos de preservação da matéria-prima (COSTA, 1999).
2.11 Utilização do suco de caju como substrato em processos biotecnológicos
Devido a alta disponibilidade de pedúnculos de caju, diversos estudos tem sido voltado ao seu aproveitamento como substrato em processos biotecnológicos. A produção de ácido lático em suco de caju utilizando uma bactéria lática homofermentativa foi estudada por
Silveira (2009). Rabelo et al. (2009) estudaram a produção da enzima dextrana-sacarase e a
síntese de oligossacarídeos utilizando a enzima bruta produzida em suco de caju e utilizando a enzima produzida pelo Leuconostoc citreum B-742. Vergara et al. (2010) estudaram a produção de oligossacaríedos via processo fermentativo em suco de caju. O suco de caju foi ainda utilizado como substrato para diversas outras aplicações, tais como produção de
bioetanol (ROCHA et al., 2009), enzimas (CHAGAS et al., 2007; RODRIGUES et al., 2007),
biosurfactante (ROCHA et al., 2007; GIRO et al., 2009) e outros produtos de alto valor agregado tal como manitol (FONTES et al., 2009, HONORATO et al. 2007).
3. MATERIAIS E MÉTODOS
3.1 Obtenção do microrganismo
Foi utilizada uma cultura estoque do microrganismo Leuconostoc mesenteroides
B512F mantida congelada no Laboratório de Biotecnologia do Departamento de Tecnologia de Alimentos (LABIOTEC/DETAL/UFC). Esta linhagem foi obtida liofilizada junto ao banco
de microrganismos do Departamento Estadual de Agricultura dos EUA (United States
Departament of Agricultural, Peoria, Illinois, NRRL Culture Collection).
3.2 Ativação do Leuconostoc mesenteroides B-512F liofilizado
O crescimento da cepa liofilizada foi realizado com o meio padrão otimizado por GUIMARÃES et al. (1999), o qual é descrito na Tabela 2.
Tabela 2 - Meio padrão otimizado
Reagente Concentração (g/L)
Sacarose 50,0
Extrato de levedura 20,0
Fosfato de potássio dibásico 20,0
Sulfato de magnésio 0,20
Sulfato de manganês 0,01
Sulfato ferroso 0,01
Cloreto de cálcio 0,02
Cloreto de sódio 0,01
pH 6,5 121°C/15min
Fonte: GUIMARÃES et al. (1999).
fermentação, ocorreu a precipitação no meio (QUEIROZ, 1987). O pH foi ajustado para 6,5 com ácido fosfórico concentrado e o meio foi dividido em Erlenmeyers contendo alíquotas de 100 mL, cada um, os quais foram esterilizados.
O microrganismo liofilizado foi então inoculado no meio, contendo fosfato, e
cultivado em shaker rotatório TECNAL, modelo TE-420 a 30°C com agitação de 150 rpm.
Este procedimento foi repicado por três vezes até a formação de uma boa quantidade de biomassa (RODRIGUES, LONA e FRANCO, 2003). Após o crescimento, o microrganismo foi congelado em tubos contendo 8,0 mL cada em freezer (– 20°C) em solução de glicerol 50 % (v/v) para ser usado como inóculo da fermentação.
3.3 Ativação do microrganismo congelado
O Leuconostoc mesenteroides B-512F foi ativado, inoculando-se num tubo de cultura estoque (congelada a –20°C) em 100 mL do meio sintético padrão otimizado por
GUIMARÃES et al. (1999) o qual continha somente sacarose como fonte de carbono (indutor
da produção da enzima). A ativação foi conduzida em agitador orbital TECNAL, modelo TE-420 a 30°C com agitação de 150 rpm por 6 horas.
3.4 Produção da enzima dextrana-sacarase
O Leuconostoc mesenteroides B-512F, foi ativado conforme descrito no item 3.3. A ativação foi conduzida em agitador orbital TECNAL, modelo TE-420 a 30°C com agitação de 150 rpm por 6 horas. Este procedimento foi repicado por duas vezes até a formação de uma boa quantidade de biomassa e encerrado quando o pH atingiu o valor de 5,5 para evitar a perda de viabilidade do microrganismo.
monitorados em intervalos de tempo regulares. Após este período, a alimentação foi interrompida. A fermentação foi interrompida quando o pH atingiu o valor de 5,2 (pH ótimo de atividade e estabilidade da enzima) e em seguida, o caldo fermentado foi centrifugado para remoção de células (11600g por 10 minutos em 4°C) em centrífuga de marca Sigma®, modelo 6k-15. Dessa forma, foi obtida a enzima bruta.
3.5 Purificação parcial da enzima
A purificação parcial da enzima foi realizada através da precipitação da enzima com a adição de polietileno glicol (PEG 1500). Foi adicionada lentamente ao fermentado livre de células o mesmo volume de uma solução de polietileno glicol (PEG) a 50 % (v/v). A mistura foi centrifugada a 11600g por 10 minutos a 4°C e o precipitado (fase rica em dextrana-sacarase) foi resuspenso em tampão acetato de sódio 20 mM contendo 0,05 g/L de CaCl2 com pH ajustado para 5,2 (pH ótimo de atividade enzimática) e a enzima obtida foi estocada e congelada em freezer à –20° C.
Esta técnica é denominada purificação parcial, pois juntamente com a enzima há precipitação de dextrana, pois segundo Lopretti et al. (1999), ocorre uma partição entre a dextrana produzida, sendo parte precipitada junto com a enzima e a parte remanescente no caldo bruto da fermentação. Entretanto, a presença de dextrana é benéfica, pois auxilia na estabilização da enzima.
3.6 Obtenção do suco de caju
O suco de caju clarificado in natura é altamente perecível e foi estocado congelado (-20°C) para evitar deterioração, uma vez que não foram utilizados aditivos por se tratar de uma matéria prima para uso em processos fermentativos.
3.7 Caracterização físico-química do suco de caju clarificado
O suco de caju foi físico-quimicamente caracterizado quanto ao pH (potenciometria direta), açúcares redutores pelo método DNS (MILLER, 1959) a metodologia das análises serão descritas nos itens 3.9.1 e 3.9.2, respectivamente.
3.8 Síntese enzimática dos oligossacarídeos prebióticos
As sínteses foram realizadas com a enzima parcialmente purificada. As concentrações de substratos (glicose, frutose e sacarose) para a síntese dos oligossacarídeos foram avaliadas através de um planejamento fatorial, 22 central compósito com três pontos centrais (RODRIGUES e IEMMA, 2005), onde foram realizados 11 ensaios (Tabela 3 ) tendo como variáveis as concentrações de sacarose e açúcares redutores (glicose e frutose), segundo RABELO et al. (2007). As concentrações de açúcares redutores utilizados no planejamento experimental foram obtidas a partir da diluição do suco de caju clarificado que apresentou um teor de 87,7g/L de açúcares redutores. Foram obtidos como resposta os açúcares redutores totais consumidos (glicose e frutose), a dextrana, os oligossacarídeos prebióticos, os rendimentos em dextrana e oligossacarídeos.
Tabela 3 - Planejamento experimental para a síntese enzimática dos oligossacarídeos prebióticos no suco de caju
Ensaio Sacarose (g/L) Açúcares redutores totais (g/L)
1 25,00 25,00
2 25,00 75,00
3 75,00 25,00
4 75,00 75,00
5 14,64 50,00
6 85,35 50,00
7 50,00 14,65
8 50,00 85,35
9 50,00 50,00
10 50,00 50,00
11 50,00 50,00
Os resultados de açúcares redutores e de dextrana, no final do ensaio, foram determinados experimentalmente conforme metodologia descrita no item 3.9. Os açúcares redutores totais consumidos (frutose e glicose), oligossacarídeos prebióticos e os rendimentos em dextrana e em oligossacarídeos foram calculados através de balanço de massa conforme as equações 1 a 8:
Fi (g/L) = ART + SAC 2
(1)
FCONS (g/L) = Fi- FRT (2)
Gi (g/L) = ART + SAC 2
(3)
GCONS (g/L) = (ART + Gi) – GRT 2
(4)
OLIGO (g/L) = FCONS + GCONS (5) AT(g/L) = SAC + ART (6) YOLIGO (%) = OLIGO (g/L) x 100 AT (g/L)
(7)
YDXT (%) = DXT(g/L) x 100
AT (g/L)
Onde,
Fi frutose no início do ensaio (g/L)
SAC quantidade de sacarose no início do ensaio (g/L)
ART FCONS FRT Gi
açúcares redutores totais (g/L) frutose consumida no ensaio (g/L)
frutose residual total no final do ensaio (g/L) glicose no início do ensaio (g/L)
GCONS glicose consumida no ensaio (g/L)
GRT glicose residual total no final do ensaio (g/L)
OLIGO Oligossacarídeos (g/L)
AT açúcares totais (g/L)
YOLIGO rendimento em oligossacarídeos
YDXT rendimento em dextrana
DXT dextrana
3.9 Métodos Analíticos
3.9.1 pH
O pH foi determinado através de leitura direta, em potenciômetro de marca Marconi®, modelo PA200, calibrado a cada utilização com soluções tampão de pH 4,0 e pH 7,0 conforme a AOAC (1992).
3.9.2 Determinação de açúcares redutores
Os açúcares redutores foram determinados de acordo com o método de MILLER (1959), o qual consiste na reação da amostra com o reagente DNS (ácido dinitrosalicílico) a 100°C durante 5 minutos, sendo este um método colorimétrico onde a concentração dos açúcares redutores após a reação com DNS é proporcional a absorbância no espectro visível a 540 nm.
2,0 g/L). Esta curva de calibração é uma reta passando pela origem dos eixos, cuja equação é determinada através de regressão linear.
A determinação da curva de calibração foi feita adicionando-se 125 µL de cada solução padrão em um tubo de ensaio contendo 125 µL da solução de DNS. A mistura foi aquecida à 100°C por 5 minutos e resfriada posteriormente em banho de gelo. Após atingir a temperatura ambiente, a mistura foi diluída com 2250 µL de água destilada e a leitura da absorbância no comprimento de onda de 540 nm foi realizada em espectrofotômetro Spectrum®, modelo SP2000UV. Para os ensaios, foi realizado o mesmo procedimento utilizado para a construção da curva padrão.
3.9.3 Determinação do crescimento microbiano
Segundo Rodrigues (2003), o crescimento microbiano está associado à produção da enzima, onde no final do crescimento exponencial atinge-se a máxima atividade enzimática. Após esse período tanto o pH como a atividade decrescem rapidamente. Dessa forma, fazer o monitoramento do crescimento microbiano durante a produção da enzima torna-se necessário.
A determinação do crescimento microbiano foi realizada através de leitura da absorbância a 590 nm em espectrofotômetro Spectrum®, modelo SP200UV. O procedimento consistiu em diluir uma alíquota da suspensão contendo as células em água destilada e realização da leitura da absorbância contra um branco com água. A massa seca celular foi calculada através de uma curva de calibração construída com a determinação do peso seco das
células seguido de diluição (RODRIGUES et al., 2003).
3.9.4 Determinação da Dextrana
3.9.5 Determinação da atividade enzimática
A atividade enzimática no caldo fermentado e na enzima parcialmente purificada foi determinada através da quantificação da frutose liberada em meio reacional contendo sacarose como substrato (HEINKE et al., 1999).
A atividade enzimática foi determinada em termos de unidade de dextrana-sacarase (UDS/mL). Entretanto não é necessário que a cinética seja determinada no período de 1 hora, pois ainda se está na faixa linear do gráfico de velocidade.
Realizou-se o cálculo da atividade enzimática utilizando a seguinte equação:
(Atividade UDS / mL) = 1 β1 60 d (9) 1 0,52 Onde:
1 coeficiente angular da curva de calibração de DNS (mg/ABS.ml) β1 coeficiente angular da reta da curva cinética (ABS/min)
60 conversão do tempo de minutos para hora d diluição da amostra
O coeficiente angular da curva foi calculado da seguinte forma:
β = ABS10 – ABS0 (10) 10
ABS10 valor médio das leituras de absorbância no tempo 10 minutos ABS0 valor médio das leituras de absorbância no tempo zero
Para a determinação da atividade da enzima obtida no meio sintético, realizou-se o seguinte procedimento:
2. Uma alíquota de 450 µL desta solução de atividade foi adicionada a dois tubos de ensaio e, em seguida, uma alíquota de 50 µL do caldo fermentado centrifugado foi adicionada a cada tubo de ensaio;
3. Os tubos foram incubados a 30°C em banho termostatizado por 10 minutos onde, Foram adicionados 500 µL do reagente de DNS a cada um dos tubos nos tempos 0 e 10 minutos, respectivamente.
4. Os tubos foram então aquecidos por 5 minutos a 100°C e resfriados à temperatura ambiente em banho de gelo.
5. A cada um dos tubos foram adicionados 9,0 mL de H2O destilada.
6. Os tubos foram homogeneizados e a leitura foi realizada a 540 nm contra o branco da solução de atividade.
3.9.6 Detecção de oligossacarídeos através de cromatografia de camada delgada (CCD)
Os oligossacarídeos prebióticos foram detectados através de cromatografia de camada delgada (CCD), em placas de sílica gel da marca Whatman, sendo utilizadas placas tipo K6 (sílica gel 60 A). Foi utilizada a técnica de múltiplas ascensões, que permite uma melhor separação dos produtos de interesse, e placas de dimensões de 20 x 20 cm permitindo a corrida de aproximadamente 15 amostras simultâneas. Para a separação dos oligossacarídeos foi utilizado o sistema acetonitrila/acetato de etila/1-propanol/água (85:20:50:90), sendo realizadas duas ascensões (RODRIGUES, 2003).
Após diluição adequada, as amostras foram aplicadas na borda inferior da placa à uma distância de 1,5 cm da borda. Foram aplicados 10 µL de cada uma das amostras e mais os padrões de sacarose, frutose e glicose para identificação das respectivas manchas. Para aplicação das amostras, foram utilizadas micropipetas. As placas foram colocadas na câmara de desenvolvimento saturada com a fase móvel. Ao término de cada ascensão a placa foi seca com secador de cabelos para remoção completa da fase móvel.
secagem natural em capela (à temperatura ambiente e sem uso do secador de cabelos), as placas foram colocadas em uma estufa a 120°C por 10 minutos para revelação das bandas.
3.9.7 Determinação de açúcares residuais, através de cromatografia Líquida de Alta Eficiência (HPLC)
A cromatografia é uma técnica extremamente versátil, utilizada para a separação dos componentes de uma mistura, que consiste na distribuição dos componentes da mistura entre uma fase estacionária e uma fase móvel. A separação é resultante das diferenças de velocidade entre os componentes arrastados pela fase móvel devido às diferentes interações destes componentes, com a fase estacionária (SANCHO, 2006).
Equipamento
Utilizou-se um cromatógrafo líquido da marca Varian, composto por duas bombas de
alta pressão Pro Star 210, um detector de índice de refração (IR) Pro Star 355 Varian, detector UV-Vis Pro Star de duplo canal modelo 342, um injetor Rheodyne com alça de
amostragem de 20 μL, gerenciado pelo software Star Chromatography WS versão 6.0 e forno
para termostatização da coluna.
Os açucares residuais foram analisados utilizando uma coluna para separação de
açúcares Aminex® HPX-87C (300 mm x 7,8 mm), a 85 ºC, usando água Milli-Q como fase
móvel.
Fase móvel
No desenvolvimento analítico, foram utilizados como fase móvel, água purificada pelo
sistema Milli-Q (MILLIPORE) e H2SO4 0,01M. Ambos, filtrados a vácuo, em membrana de
Curva de calibração
Para a elaboração da curva de calibração, foram utilizadas soluções padrão compostas por misturas de padrões puros de glicose, frutose e sacarose, em concentrações conhecidas (faixa de 0,1 a 10 g/L). As soluções foram preparadas com água deionizada, e posteriormente filtradas em membrana de acetato de celulose (Whatman), com 13 mm de diâmetro e poros de
0,45 μm, e acondicionadas em frascos eppendorfs.
Preparação das amostras
Em virtude da composição do suco de caju, fez-se necessário, submetê-las a um processo de extração em fase sólida, usando cartucho C18 (Bond Elut C18,), a fim de promover a retirada das substâncias coloridas que, poderiam interferir na determinação do analito de interesse. A extração foi realizada a uma velocidade média de fluxo correspondente a uma gota a cada três segundos. (SANCHO, 2006).
Posteriormente, as amostras foram filtradas em membrana de acetato de celulose (Whatman) com 13 mm de diâmetro e poros de 0,45 μm, acoplada a uma seringa Hamilton, e
acondicionadas em frascos eppendorfs.
Método de análise
Na metodologia utilizada para elaboração da curva de calibração e análise das amostras empregou-se uma vazão de fase móvel de 0,6 mL/ min, com a temperatura do detector em 35ºC. A identificação e quantificação dos açúcares residuais foi realizada por comparação entre os tempos de retenção obtidos com padrões previamente injetados.
3.9.8 Análise dos dados
4.0 Resultados e Discussão
4.1 Caracterização do suco de caju
O suco de caju clarificado apresentou um teor de 87,7g/L de açúcares redutores totais, mostrando que este pode ser utilizado como fonte de aceptores (glicose e frutose) para a síntese de oligossacarídeos prebióticos.
Em seu estudo Vergara (2007) encontrou teor semelhante de 90,45 g/L de açúcares redutores totais. Contudo, Rabelo (2008) encontrou valores de 65,60 g/L de açúcares redutores totais, o que demonstra que o teor de açucares pode variar bastante de uma safra a outra.
4.2 Síntese enzimática de oligossacarídeos prebióticos.
A síntese enzimática dos oligossacarídeos prebióticos foi realizada com a enzima parcialmente purificada no suco de caju durante o período de 24 horas tempo suficiente para que toda sacarose fosse consumida na síntese (o que foi confirmado por HPLC). A Tabela 4 apresenta as condições experimentais do ensaio e os resultados com relação a dextrana produzida e o rendimento em dextrana obtido a partir da síntese de oligossacarídeos prebióticos utilizando a enzima dextrana-sacarase e o suco de caju e sacarose como substrato.
Essa dextrana foi determinada analiticamente (DUBOISet al., 1956).
Tabela 4 - Planejamento experimental e resultados obtidos de dextrana e rendimento em dextrana no suco de caju
Ensaio Sacarose (g/L) redutores Açúcares
totais (g/L) Dextrana (g/L) YDXT(%)
1 25,00 25,00 7,21±0,312 14,42
2 25,00 75,00 8,17±0,290 8,17
3 75,00 25,00 7,44±0,118 7,44
4 75,00 75,00 4,85±0,108 3,23
5 14,64 50,00 6,71±0,183 10,38
6 85,35 50,00 9,63±0,065 7,11
7 50,00 14,65 10,64±0,000 16,46
8 50,00 85,35 11,21±0,011 8,28
9 50,00 50,00 13,60±0,108 13,60
10 50,00 50,00 13,58±0,065 13,58
A tabela 4 mostra que o menor rendimento em dextrana 3,23% foi obtido a partir de concentrações de 75 g/L de sacarose e 75 g/L de açúcar redutor. O rendimento máximo em dextrana foi de 16,46% utilizando-se uma combinação de 50 g/L de sacarose e 14,65 g/L de açúcares redutores. Esses resultados são bastante favoráveis, pois baixos rendimentos em dextrana favorecem a formação dos oligossacarídeos prebióticos. Como a dextrana não é um produto de interesse neste trabalho, é indicado que sejam empregadas condições que desfavoreçam sua síntese.
O modelo de regressão para a concentração em dextrana não foi estatisticamente significativo no intervalo de confiança de 95%, portanto as Tabelas referentes aos efeitos das variáveis e à análise de variância (ANOVA) são apresentadas no ANEXO 1.
A Tabela 5 apresenta os efeitos das variáveis independentes (sacarose e açúcares redutores) no rendimento em dextrana.
Tabela 5 - Efeitos estimados de rendimento em dextrana YDXT
Fator Efeito S.E.
Média 13,54* 1,06*
Sac(L) -4,14* 1,03*
Sac (Q) -5,92* 1,55*
A R(L) -5,51* 1,30*
A R (Q) -2,29 1,55
Sac x A R 1,02 1,84
* Significativo em um intervalo de 95% de confiança. SAC : Sacarose, AR: Açúcar redutor
De acordo com a Tabela 5, observa-se que no intervalo de confiança de 95% o efeito linear da sacarose e dos açúcares redutores e sacarose quadrática apresentaram-se significativos sobre o rendimento em dextrana.
O modelo de regressão obtido para o rendimento em dextrana é expresso pela equação 11. (11) S.AR x AR x AR , S x
S 5 103 2 003 2 103 2 1 103 35 , 0 80 , 8 (g/L) Dextrana em
A análise de variância (ANOVA) para o modelo de regressão obtido para o rendimento em dextrana é apresentado na Tabela 6.
Tabela 6 - Análise de variância para o rendimento em dextrana no suco de caju.
Fonte de variação Soma
Quadrática
Graus de Liberdade
Média
Quadrática Valor de F
Regressão 145,81 5 29,16 8,65
Residual 16,86 5 3,37
Total 162,67 10
Coeficiente de
determinação 0,89
F Tabelado (95%) F5,5= 5,05
De acordo com as Tabela 6 que apresenta a ANOVA para os modelos de regressão ajustados, os valores de F calculado (8,65) para o modelo de rendimento em dextrana, foi
maior que o valor de F5,5 Tabelado (5,05) no intervalo de 95% de confiança, assim o modelo
pode ser considerado estatisticamente significativo, de acordo com o teste F.
Os resultados de rendimentos em dextrana apresentados na Tabela 4 foram analisados através do gráfico de superfície de resposta com o auxílio do software Statistica 7.0 (Statsoft). A Figura 3 apresenta a superfície de resposta obtida para o rendimento em dextrana (Eq.11 ).
A Figura 3 mostra que em altas concentrações os açúcares redutores não apresentam influência no rendimento em dextrana e que o mesmo é favorecido na combinação de baixas concentrações de sacarose e açúcares redutores, isso se deve ao fato da enzima dextrana-sacarase na presença de aceptores e com um ajuste da proporção aceptor/sacarose favorecer a formação de oligossacarídeo em detrimento da síntese de dextrana.
A Tabela 7 apresenta as condições experimentais do ensaio e os resultados com relação a concentração de oligossacarídeos prebióticos no suco de caju e o rendimento em oligossacarídeos obtidos a partir da síntese de oligossacarídeos prebióticos utilizando a enzima dextrana sacarase e o suco de caju como substrato.
Tabela 7 - Planejamento experimental e resultados obtidos de concentração de oligossacarídeos prebióticos e rendimentos em oligossacarídeos
Ensaio Sacarose
(g/L) Açúcares redutores totais (g/L) Olig (g/L) YOLIG(%)
1 25,00 25,00 27,04 54,08
2 25,00 75,00 53,49 53,49
3 75,00 25,00 71,20 71,2
4 75,00 75,00 104,73 69,82
5 14,64 50,00 38,55 59,64
6 85,35 50,00 62,94 46,50
7 50,00 14,65 41,65 64,42
8 50,00 85,35 77,96 57,60
9 50,00 50,00 63,84 63,84
10 50,00 50,00 59,24 59,24
11 50,00 50,00 65,18 65,18
A tabela 7 mostra que em concentrações de 25 g/L de sacarose e 25 g/L de açúcar redutor foi obtido uma baixa concentração de oligossacarídeos prebióticos. A maior concentração de oligossacarídeos (104,73 g/L) foi obtida utilizando-se 75 g/L de sacarose em combinação com 75 g/L de açucares redutores, sendo que nestas mesmas concentrações de sacarose e açucares redutores foi observado o menor rendimento em dextrana (Tabela 4) mostrando que através da reação do aceptor, a glicose proveniente da sacarose é desviada da cadeia de dextrana e passa a ser incorporada no aceptor formando oligossacarídeos prebióticos em detrimento da formação de dextrana.
A Tabela 8 apresenta os efeitos das variáveis independentes (sacarose e açúcares redutores) na concentração de oligossacarídeos.
Tabela 8 - Efeitos estimados de concentração de oligossacarídeos Oligossacarídeos
Fator Efeito S.E.
Média 62,75* 6,58*
Sac(L) 32,47* 8,05*
Sac (Q) -7,58 9,59
A R(L) 27,83 8,05
A R (Q) 1,47 9,59
Sac x A R 3,54 11,39
* Significativo em um intervalo de 95% de confiança. SAC : Sacarose, AR: Açúcar redutor
De acordo com a Tabela 8, observa-se que no intervalo de confiança de 95% o efeito linear da sacarose apresentou-se significativo sobre os oligossacarídeos.
O modelo de regressão obtido para concentração em oligossacarídeos é expressos pela equação 12:
3 2
3 2
3 0,30 1 10 2 10
10 6 11 ,1 69 , 2 ) /
(g L S x S AR x AR x
rídeos
Oligossaca (12)
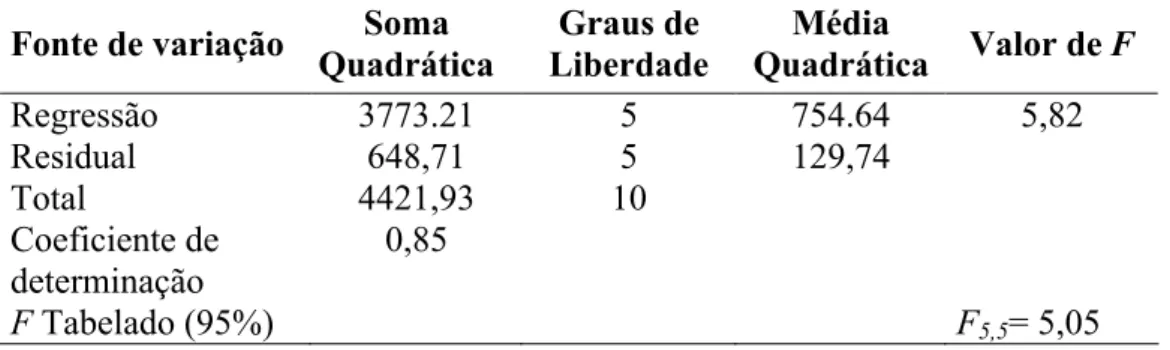
A análise de variância (ANOVA) para o modelo de regressão obtido para a concentração em oligossacarídeos é apresentado na Tabela 9.
Tabela 9 - Análise de variância para concentração de oligossacarídeos no suco de caju.
Fonte de variação QuadráticaSoma LiberdadeGraus de Quadrática Valor de Média F
Regressão 3773.21 5 754.64 5,82
Residual 648,71 5 129,74
Total 4421,93 10
Coeficiente de
determinação 0,85
De acordo com a Tabela 9 que apresenta a ANOVA para os modelos de regressão ajustados, os valores de F calculado (5,82) foi maior que o valor de F5,5 Tabelado (5,05) no intervalo de 95% de confiança, assim os modelos pode ser considerado estatisticamente significativo, de acordo com o teste F.
O resultado de oligossacarídeos prebióticos apresentado na Tabela 7 foi analisado através de gráficos de superfície de resposta que é apresentado na Figura 4 (Eq. 12).
Figura 4 - Oligossacarídeos prebióticos obtidos em função da concentração de sacarose e açúcares redutores.
A análise de superfície de resposta para os oligossacarídeos prebióticos mostra que o efeito da sacarose e do açúcar redutor, isoladamente, não têm influência sobre os oligossacarídeos prebióticos. Entretanto, a combinação de elevadas concentrações de sacarose e açúcares redutores favorece a formação de oligossacarídeos, pois a enzima dextrana-sacarase quando em meio contendo um aceptor (glicose ou frutose) e a sacarose como substratos, produz oligossacarídeos prebióticos.
Figura 5 – Oligossacarídeos prebióticos em suco de caju detectados através de cromatografia de camada delgada.
De acordo com a Figura 5, verifica-se que houve formação de oligossacarídeos prebióticos com graus de polimerização de 5 a 12. Estudos anteriores têm mostrado que o grau de polimerização (entre 2 e 10) dos oligossacarídeos tem sido considerado fator chave para o estabelecimento de efeitos de saúde (RABELO, 2008).
No ensaio 2 (25,0 g/L de sacarose e 75,0 g/L de açúcares redutores), verificou-se uma maior variedade de oligossacarídeos formados, com indicação de formação de oligossacarídeos com grau de polimerização 12 (GP12). Além disso, foi obtido um rendimento em oligossacarídeos acima de 50% (Tabela 7). Uma melhor eficiência dos oligossacarídeos está associada ao comprimento de sua cadeia, visto que oligossacarídeos prebióticos de cadeia curta são parcialmente absolvidos no intestino delgado, os de cadeia
GP2 GP3
GP4
GP6
GP10 GP9
GP11 GP7 GP5
GP8
longa são absolvidos em grau muito menor e vão permanecer por mais tempo no colón (LEE, et al., 2008)
No ensaio 4 foi observado elevadas concentrações de oligossacarídeo prebióticos e uma boa variedade de oligossacarídeos formados com indicação de formação de oligossacarídeos com grau de polimerização 7 (GP7), segundo Rabelo (2008) Oligossacarídeos com grau de polimerização entre 2 e 10 são extremamente importantes para várias aplicações nutricionais e farmacêuticas.
O uso da enzima parcialmente purificada permite o alongamento da cadeia dos oligossacarídeos. Rabelo et al. (2009) e Vergara (2009) observaram oligossacarídeos com grau de polimerização 7 em suco de caju.
5 CONCLUSÕES
O suco de caju clarificado pode ser empregado como uma alternativa de substrato de baixo custo para a síntese de oligossacarídeos prebióticos, por via enzimática utilizando a enzima dextrana-sacarase.
O rendimento em dextrana é favorecido na combinação de baixas concentrações de sacarose e açúcares redutores. O rendimento máximo em dextrana obtido foi de 16,46% Utilizando-se uma combinação de 50 g/L de sacarose e 14,65 g/L de açúcares redutores.
A formação de oligossacarídeos é favorecida pelo aumento da concentração dos açúcares redutores e pela combinação de elevadas concentrações de sacarose e açúcares redutores. Nas concentrações de 75 g/L de sacarose em combinação com 75 g/L de açucares redutores observou-se a maior concentração de oligossacarídeos que foi de 104,73 g/L e o menor rendimento em dextrana que foi de 3,23%.
6 REFERÊNCIAS BIBLIOGRÁFICAS
ABREU, F. A. P. Cajuína. In: VENTURINI FILHO, W. G. Tecnologia de bebidas:
matéria-prima, processamento, BPF/APPCC, legislação, mercado. São Paulo: Editora Edgard Blücher, cap. 8. p 169 - 184, 2006.
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTRY. Official methods of
analysis of the Association of official Analytical Chemistry: Vitamins and other nutrients. Washington: AOAC. Chapter 45, p. 4,1992.
BELLO, J. Os alimentos funcionais e nutracêuticos: nova gama de produtos na indústria
alimentícia. São Paulo, 1995.
BIELECKA, M.; BIEDRZYCKA, E. ;MAJKOWSKA, A.; JUSKIEWICZ, J.; WRÓBLEWSKA, M. Effect of non-digestible oligosaccharides on gut microecosytem in rats. Food Reserch International, v. 35, p. 139-144, 2002.
BONDT, V. Novas tendências para bebidas funcionais. Brasil Alimentos, n.18 . 2003.
BORGES, V. C. Alimentos funcionais: prebióticos, probióticos, fitoquímicos e
simbióticos. In: WAITZBERG, D. L. Nutrição oral, enteral e parenteral na prática clínica. 3. ed., v. 2. São Paulo: Atheneu, 2002. p. 1495 - 1509.
BORNET, F. R. Undigestible sugars in food products. Am. J. Clin. Nutr., Paris. v. 59, n. 37, p.63-69, 1994.
BORTOLOZO, E. Q.; QUADROS, M. E. R. Aplicação de inulina e sucralose em iogurte. Revista Brasileira de Tecnologia Agroindustrial, v. 1, p.37 - 47. 2007.
BRASIL. Portaria ANVISA n° 398, de 30 de abril de 1999. Regulamento técnico que estabelece as diretrizes básica para análise e comprovação de propriedades funcionais e/ou de saúde alegadas em rotulagem de alimentos. Diário Oficial da União. Brasilia, DF, 03 maio 1999a.
BRASIL. Resulução RDC ANVISA n° 17, de 30 de abril de 1999. Regulamento técnico